黄瓜(Cucumis sativus Linn.)作为日常生活中最常见的果蔬之一,自身水分含量达98%,含有丰富的维生素、胡萝卜素等营养成分[1]。在常温下贮藏,黄瓜的营养物质快速流失,黄瓜容易衰老并发生腐败;而适合的贮藏温度虽然能够减缓衰老[2],防止营养物质的损失,但黄瓜在低温贮藏下会发生细胞膜的破坏,进而发生冷害[3]。黄瓜果实冷害的发生受到诸多因素的共同影响[4],冷害对果实品质影响很大,在表面形成黑斑,随着贮藏时间的延长,果实耐贮性逐渐下降,冷害面积逐渐增大,冷害程度加深,严重影响商品价值。故对黄瓜果实进行冷藏的同时,还需采取一定的措施来减轻冷害的发生。热处理能延长水果货架期,抑制生理病害,还能提高果蔬的抗冷性,减轻冷害,并且在食用方面有一定的安全性[5]。SHAO等[6]用45 ℃热空气处理枇杷果实3 h,显著降低了枇杷的冷害发生率。李秀杰等[7]发现8 ℃热水处理 10 min 的‘鲁星’油桃可以减轻果肉褐变和腐烂,保持油桃风味。乔勇进等[8]通过对黄瓜进行37 ℃热空气处理24 h,维持了细胞膜的完整性,减轻了低温伤害,延缓了冷害的发生。IBRAHIM等[9]发现55 ℃热水处理可提高黄瓜果实CAT、APX和POD的活性,降低果实的冷害发生率。热处理同样也能提高柑橘[10]、西葫芦[11]、青椒[12]的抗冷性。黄瓜果实与果梗连接处含有一定量的苦味素也叫葫芦素C,有抗肿瘤的功能[13],具有一定的研究价值。目前,国内外学者在热处理技术减轻果蔬冷害方面进行了大量的研究,但都限于对黄瓜果实单一部位的影响,而对果实不同部位的冷害和活性氧代谢的研究较少见报道。
本研究以黄瓜为试验材料,根据前期的二次正交旋转组合设计试验选出的4 ℃贮藏温度下最佳热处理条件(39.4 ℃热水中热激24.4 min),测定黄瓜果实活性氧清除酶的活性以及膜脂含量对低温胁迫的变化,研究了短时热处理对低温逆境下黄瓜不同部位的冷害研究,为进一步研究热处理对贮藏保鲜与耐冷性的关系,并应用于黄瓜的贮藏保鲜提供理论依据。
试验选取的黄瓜果实品种为“申青”黄瓜,选取黄瓜果实长度在(26±1)cm,表面无明显机械损伤的果实,在室温放置4 h后,使温度达到均一化。随机分成2组,分别为热处理组(HWT)和对照组(CK),每组120根。将前期的二次正交旋转组合设计试验选出的4 ℃贮藏温度下最佳热处理条件(39.4 ℃热水中热激24.4 min)设置为热处理组(HWT),对照组(CK)为未进行热处理的黄瓜果实,处理后立即贮藏于温度预先设定为4 ℃的冷库内,湿度控制在(75±5)%,处理完成后每3根装入1个厚度为0.07 mm聚乙烯薄膜塑料袋中。在3、6、9、12、15 d分别进行冷害指数、硬度、丙二醛(MDA)含量、电解质渗透率(electrolyte leakage, EL)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、超氧化物歧化酶(SOD)、过氧化物酶(POD)、多酚氧化酶(PPO)、可溶性蛋白、H2O2含量和超氧阴离子自由基![]() 指标的测定,每组重复3次测定,分别对黄瓜果实热处理组(HWT)和对照组(CK)的头部(花萼端)、中部、尾部(果梗端)进行指标的测定。
指标的测定,每组重复3次测定,分别对黄瓜果实热处理组(HWT)和对照组(CK)的头部(花萼端)、中部、尾部(果梗端)进行指标的测定。
NaOH、抗坏血酸、H2O2、硫代巴比妥酸、乙二胺四乙酸二钠、甲硫氨酸、核黄素、三氯乙酸、无水乙醇、磷酸氢钠、冰醋酸,国药集团化学试剂有限公司;MDA测试盒、H2O2测试盒、超氧阴离子自由基测试盒、超氧化物歧化酶测试盒,南京建成生物工程研究所。
BPS-100CA 型恒温恒湿培养箱,上海一恒科学仪器有限公司;HSWX-600BS 型电热恒温水温箱,上海圣科仪器设备有限公司;H-2050R-1型高速冷冻离心机,长沙湘仪离心机有限公司;THZ-82A 型恒温振荡箱,江苏省金坛市环宇科学仪器厂;GY-4型数显果实硬度计,浙江托普云农科技股份有限公司;BJ2100D型数字孔式电子天平;DDS-307 型电导率仪,上海笛柏实验设备有限公司;紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.3.1 冷害指数的测定
分别随机取15根黄瓜,观察冷害状况,判断冷害等级[14]。冷害指数共分为5个等级,即0级,无冷害;1级,冷害面积小于25%;2级,冷害面积为25%~50%,轻度冷害;3级,冷害面积为50%~75%,中度冷害;4级,冷害面积为75%~100%,严重冷害。按照公式(1)计算冷害指数,重复3次。
(1)
1.3.2 硬度的测定
硬度测定参考曹建康等[14]的方法,在黄瓜果实头部(花萼端)、赤道部位、尾部(果梗端)取1 cm厚果肉,将硬度计垂直打入黄瓜果实果肉处测定。
1.3.3 EL、MDA含量的测定
EL的测定参考曹建康等[14]的方法进行修改。黄瓜切成薄片,用打孔器取圆片,加20 mL去离子水,振荡后过滤,再加入离子水,测定初始电导率(R0)。真空干燥后放入振荡箱振荡,测定样品溶液电导率(R)。煮沸取出后冷却,测定溶液的电导率(R′)。按照公式(2)计算电解质外渗百分率(Y):
(2)
MDA含量采用MDA测试盒测定。
1.3.4 PPO活性的测定
参考曹建康等[14]的方法。PPO催化后形成产物在420 nm处有最大光吸收峰,可利用比色法测定。
1.3.5 可溶性蛋白含量的测定
采用紫外吸收法[14]测定。在280 nm处其吸光度值蛋白质出现吸收高峰,其吸光度值与蛋白质含量成正比。
1.3.6 CAT、POD、APX、SOD的活性测定
CAT、APX活性测定参考CHEN等[15]的方法;CAT以每克果肉1 min内OD240值变化0.01为1个酶活单位;APX以每克果肉1 min内OD290值变化0.01为1个酶活单位;POD含量参考曹建康等[14]的方法,采用愈创木酚法进行测定;超氧化物歧化酶含量的测定采用SOD测试盒测定。
1.3.7 H2O2含量和超氧阴离子自由基的测定
H2O2含量的测定采用 H2O2测试盒测定;超氧阴离子自由基![]() 测定采用超氧阴离子自由基测试盒测定。
测定采用超氧阴离子自由基测试盒测定。
所有试验数据进行3次重复,SPSS软件进行单因素方差分析,Duncan法进行多重比较,数据采用Excel 2010软件处理。
冷害指数是能直观地判断冷害发生程度的指标[16]。如图1所示,黄瓜在4 ℃贮藏条件下,CK组和HWT组的冷害指数随贮藏时间的延长逐渐增加。在贮藏初期,黄瓜果实冷害症状不明显,3 d后,HWT组和CK组黄瓜的头部和中部均发生冷害,靠近头部最严重,而尾部的冷害则推迟到第6天出现,之后冷害指数急剧上升,到第12天时CK组的头部和中部的冷害指数达到0.6以上,HWT组的头部和中部的冷害指数均低于对照组,HWT组尾部的冷害指数最低,仅为0.32,贮藏结束时CK组以及HWT组头部、中部和尾部的冷害指数分别达到了0.84、0.85、0.62、0.79、0.80和0.55。黄瓜果实头部、中部到尾部冷害指数逐渐上升,且存在显著差异(P<0.05)。由此可见,黄瓜不同部位抑制冷害的效果不同,实验结果表明整个低温贮藏期,热处理可以减轻贮藏过程中冷害的发生时间,且HWT组的头部和中部的冷害要高于HWT组的尾部。王静等[17]研究发现哈密瓜果实经过55 ℃热水处理3 min,推迟了冷害的发生时间,使细胞膜破坏程度减轻,与本试验结果一致。
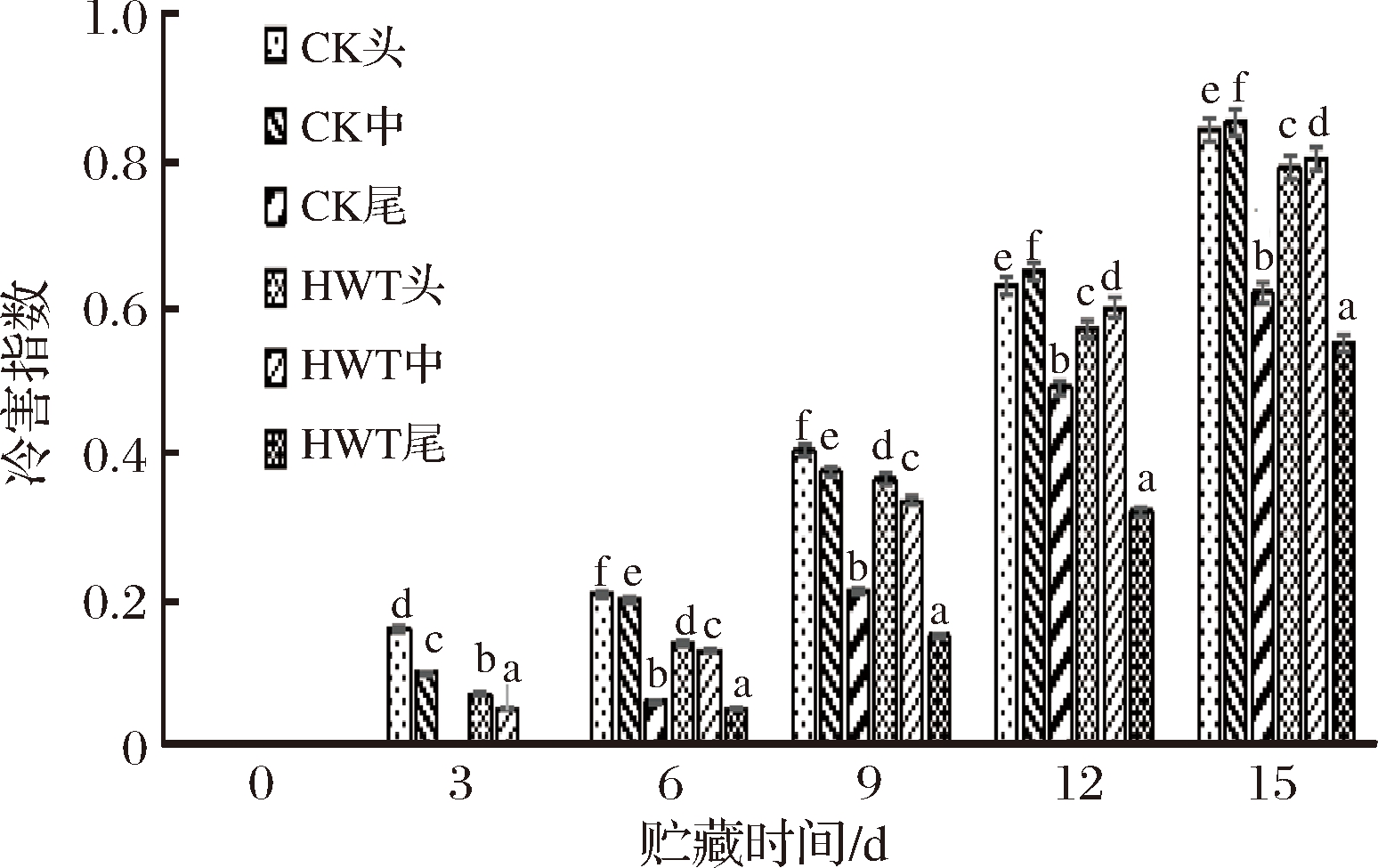
图1 短时热处理对黄瓜果实不同部位冷害指数的影响
Fig.1 The influence of short time heat treatment on chilling damage index of different parts of cucumber fruit
黄瓜果实硬度是衡量其贮藏寿命的重要指标之一。如图2所示,CK组和HWT组的硬度均呈现下降的趋势,且随着贮藏时间的延长,其降幅存在一定的差异。黄瓜果实贮藏3 d时,HWT组头部、中部和尾部的黄瓜果实硬度分别比CK组的头部、中部和尾部高1.56%、2.21%和2.34%。贮藏9 d后,HWT组的头部、中部、尾部的硬度较0 d分别低12.34%、11.32%、9.96%,对照组的头部、中部和尾部较0 d低15.79%、14.55%、10.54%。贮藏后期,随着冷害的加重,CK组黄瓜果实中部的硬度降幅逐渐升高,说明冷害程度加速硬度的下降,下降的原因可能是冷害的加深,导致细胞软化程度加深。从图2可以看出,热处理能较好地维持果实较高的硬度,且不同部位的黄瓜果实硬度存在显著差异(P<0.05),随着贮藏时间的延长,头部和中部的下降幅度增大。HWT组黄瓜果实的头部、中部和尾部的硬度分别高于CK组头部、中部、尾部的硬度,说明不同部位的黄瓜果实在低温逆境下抑制硬度下降程度不同,而尾部的硬度比头部和中部高,说明黄瓜果实尾部能更好地抑制软化程度的加深。
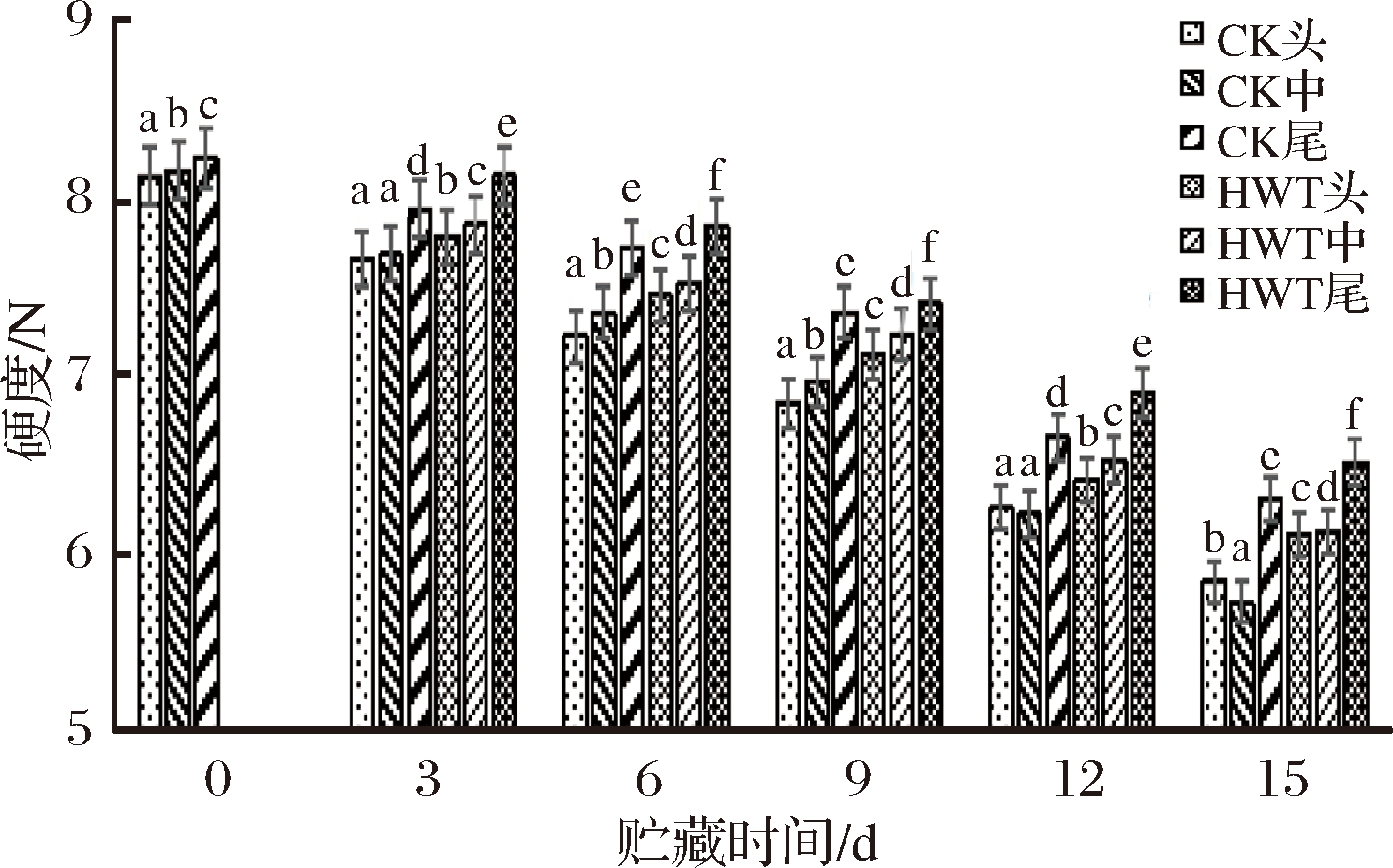
图2 短时热处理对黄瓜果实不同部位硬度的影响
Fig.2 The influence of short time heat treatment on hardness of different parts of cucumber fruit
黄瓜果实在低温贮藏后细胞膜发生破坏,导致果实冷害的发生[18]。邵婷婷等[19]利用50 ℃强制对流热空气处理20 min能够推迟青椒果实冷害发生的时间,能有效减轻低温胁迫下活性氧的伤害,延缓了青椒果实冷害的发生。如图3所示,CK组和HWT组的电解质外渗率(EL)均呈现增加的趋势,且随着贮藏时间的增加而增加。在4 ℃下贮藏9 d后,HWT组的头部、中部、尾部的电解质外渗率分别为59.6%、56.2%、53.26%,较CK组的头部、中部和尾部低6.88%、7.62%、6.51%。说明热处理可以使黄瓜果实在低温逆境下产生抗性,进而保护细胞的膜脂状态,而尾部的电解质外渗率值比头部和中部低,说明黄瓜果实尾部的抗冷性更强。

图3 短时热处理对黄瓜果实不同部位电解质外渗率(EL)的影响
Fig.3 The influence of short time heat treatment on the electrolyte leakage rate in different parts of cucumber fruit
丙二醛含量的变化跟电解质外渗率一样均表征细胞膜的破坏情况,细胞膜上的磷脂分子被氧化,生成过氧化产物丙二醛称之为膜脂过氧化现象,丙二醛的累积会破坏细胞膜的完整性[20]。ENDO等[21]通过青梅果实在45 ℃水中浸泡5 min,抑制了丙二醛和过氧化氢的升高,延缓了抗坏血酸含量和总抗氧化能力水平的下降,显著降低果实对CI的敏感性。如图4所示,在第3天,MDA含量有下降的趋势,尾部下降较为明显;6 d后,各组的黄瓜MDA含量增加迅速;贮藏前9 d,CK组尾部的MDA含量低于HWT组的中部和头部,与贮藏前期冷害程度较低有关;至贮藏末期,对照组的头部MDA含量的增长率最高,HWT组的尾部增长率最小;在贮藏结束时,其数值由贮藏初期的3.45 nmol/g升至7.36 nmol/g,显著小于其他处理组(P<0.05),说明热处理能够减轻细胞膜的破坏,从而减轻冷害,而热处理组尾部的细胞膜破坏程度最低。

图4 短时热处理对黄瓜果实不同部位丙二醛含量的影响
Fig.4 The influence of short time heat treatment on MDA content in different parts of cucumber fruit
可溶性蛋白作为果实组织中的营养物质,也是重要的渗透调节物质,对生物膜和细胞起到保护作用[22]。从图5可以看出,贮藏过程中,黄瓜果实可溶性蛋白含量呈现出先急剧上升后缓慢下降的趋势。贮藏前3 d,可溶性蛋白含量明显上升,可能与冷敏果实受到低温胁迫机体自身合成一些小分子蛋白有关,接着可溶性蛋白质含量逐渐下降,可能是与低温引起的蛋白质合成酶系统遭到破坏有关[23]。贮藏3 d后,可溶性蛋白含量逐渐下降,各组之间差异显著(P<0.05)。HWT组尾部的可溶性蛋白含量由3 d时的0.70 mg/g下降至15 d时的0.49 mg/g,下降了42.86%。HWT组尾部的可溶性蛋白含量一直高于其他处理组,这可能是因为果蔬在遭受低温逆境胁迫时,能合成小分子物质,以增强其抗逆性。
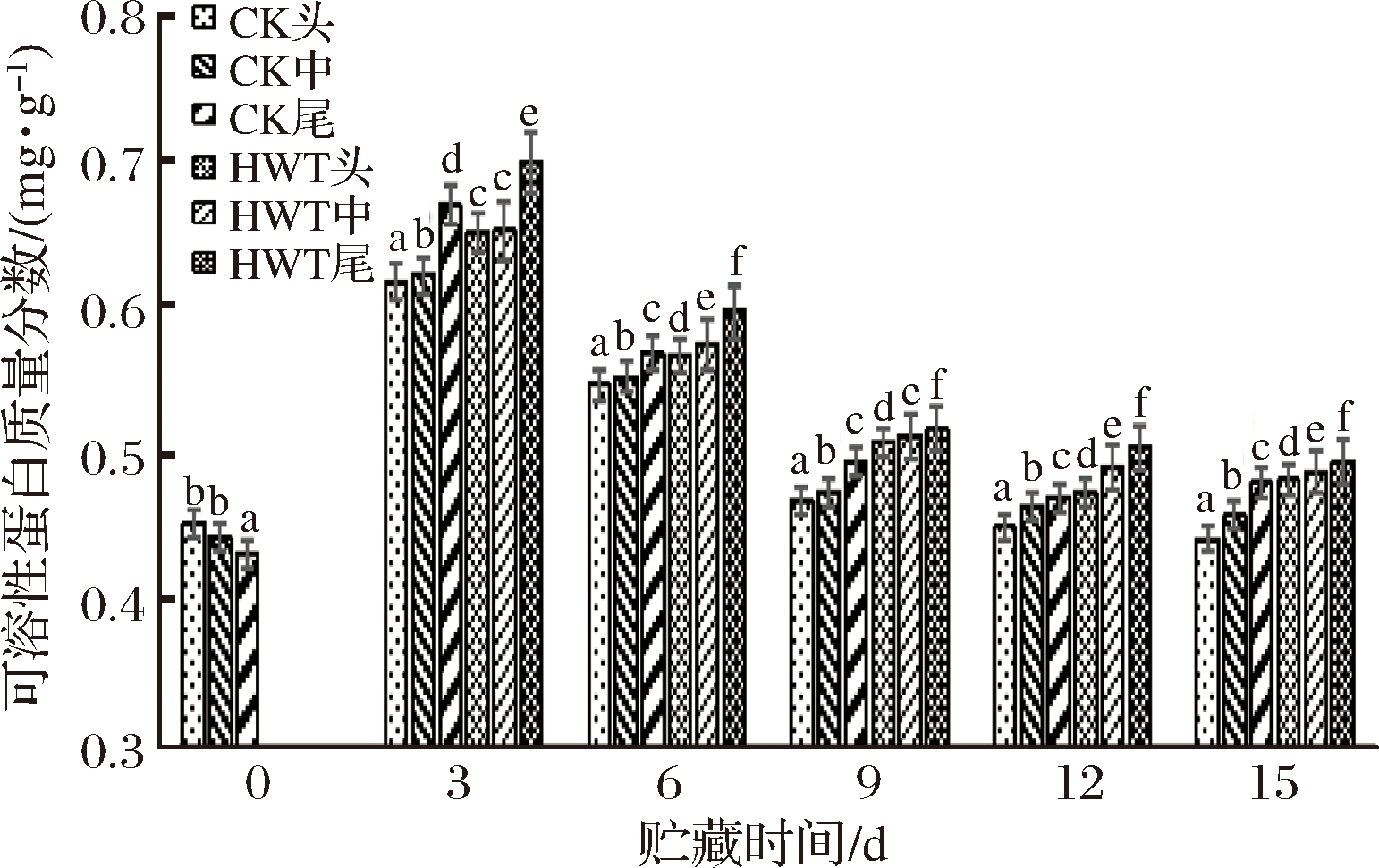
图5 短时热处理对黄瓜果实不同部位可溶性蛋白含量的影响
Fig.5 The influence of short time heat treatment on soluble protein content in different parts of cucumber fruit
在果蔬贮藏过程中,多酚氧化酶参与一系列由酶促活动而引起的化学变化,多酚氧化酶使酚类物质氧化,引起果实组织褐变[24]。如图6所示,贮藏过程中,PPO活力呈现上升的趋势。贮藏初期PPO的活力上升,但各组之间数值差别不大,至6 d时,多酚氧化酶活力变化出现差异,黄瓜果实的尾部增长率最高达到8.03 U/g;至9 d时,多酚氧化酶活力再次上升,CK组尾部达到13.71 U/g,上升速度快、幅度大,随着贮藏时间的延长,多酚氧化酶活力持续上升;15 d时CK组尾部比HWT组尾部高2.1(U/g)。在贮藏过程中,HWT组头部的PPO活力相对最低,而CK组尾部的PPO活力在各组中相对最高.贮藏9 d后,HWT组尾部的PPO活力高于CK组的头部和中部,与果实组织的成熟度有关,黄瓜果实尾部的成熟度大于头部和中部。
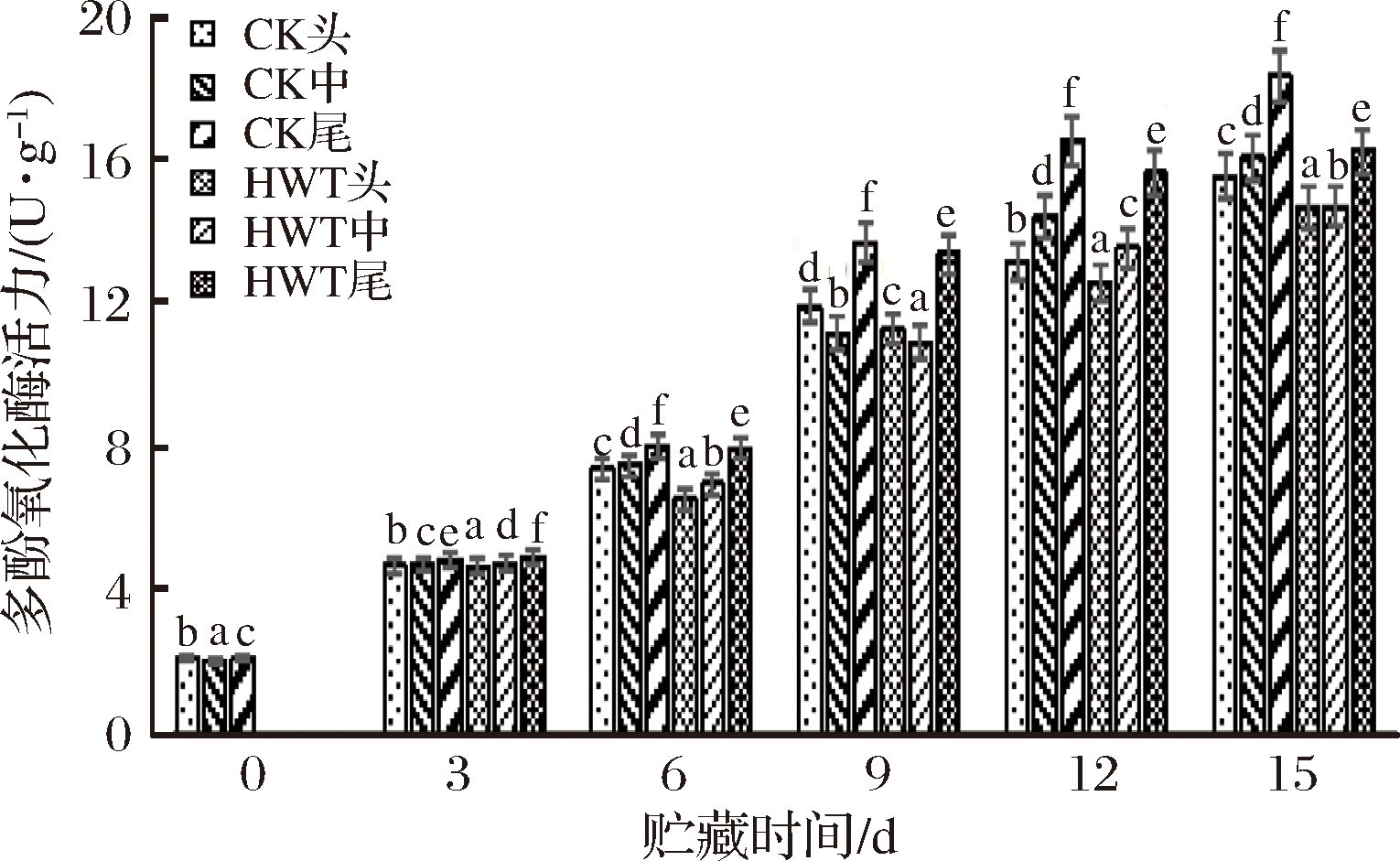
图6 短时热处理对黄瓜果实不同部位多酚氧化酶(PPO)活力的影响
Fig.6 The influence of short time heat treatment on PPO activity in different parts of cucumber fruit
在反应过程中,CAT能催化H2O2形成H2O[25],能够有效地清除自由基,从而维持膜的稳定性,减轻机体不良反应,如图7所示。
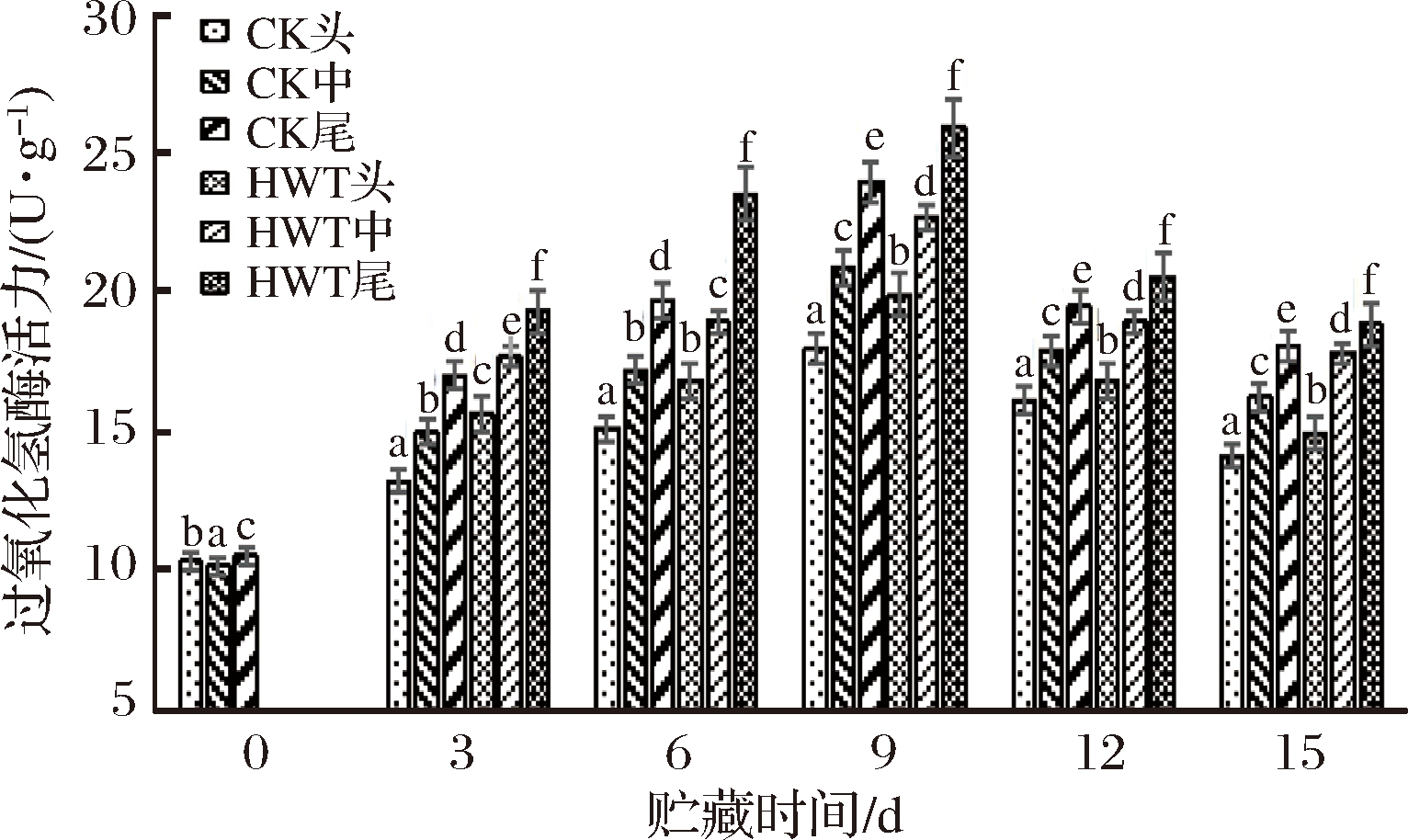
图7 短时热处理对黄瓜果实不同部位过氧化氢酶(CAT)活力的影响
Fig.7 The influence of short time heat treatment on CAT activity in different parts of cucumber fruit
CAT酶活力呈现出先增大后减小的趋势,贮藏第9天时各处理组的CAT活力均达到峰值,随后逐渐降低。HWT组的头部和中部的CAT活力大于CK组的头部和中部;CK组的头、中、尾部较0 d的高1.74倍、2.05倍和2.27倍,HWT组的头、中、尾部较0 d的高1.92倍、2.22倍和2.46倍,表明果实中CAT活力在热处理时被诱导升高,经过热处理后黄瓜果实的活性氧较低,清除部分活性氧,细胞受伤害程度减小,从而抑制了冷害的发生,而且HWT组和CK组尾部的CAT活力都较高,说明尾部的CAT活力对于催化植物体内的H2O2分解为水和氧分子,从而减少H2O2对果蔬组织可能造成的氧化伤害的作用更显著。
POD 能够反映植物生长发育的特性,同时也是植物体内抗氧化酶系统的重要组成部分,是清除H2O2 的主要酶,其催化过氧化氢、氧化酚类物质产生醌类化合物,可以减轻H2O2对细胞的损伤,维持细胞膜结构的完整性[26]。由图8可知,POD酶活力呈上升的趋势,第6天热处理组的头、中、尾部的POD含量分别为8.9、11.6 和14.2 U/g,HWT组的头、中、尾部POD酶活力分别高于CK组的头、中、尾部POD活力。贮藏后期黄瓜果实尾部POD酶活力逐渐上升,POD活力与果实抗冷性成正相关关系。POD酶活力随贮藏时间的延长而增加,各组间POD酶活力存在显著差异(P<0.05)。HWT组头部的POD酶活力由0 d时的7.4 U/g增长到15 d时的14.3 U/g,HWT组POD酶活力高于对照组,差异显著(P<0.05);第6天后尾部的增长趋势明显高于其他组,且HWT组黄瓜果实尾部的POD酶活力高于CK组尾部,说明果实尾部的POD在热处理后能更好地清除![]() 和H2O2,从而减少果实冷害。
和H2O2,从而减少果实冷害。
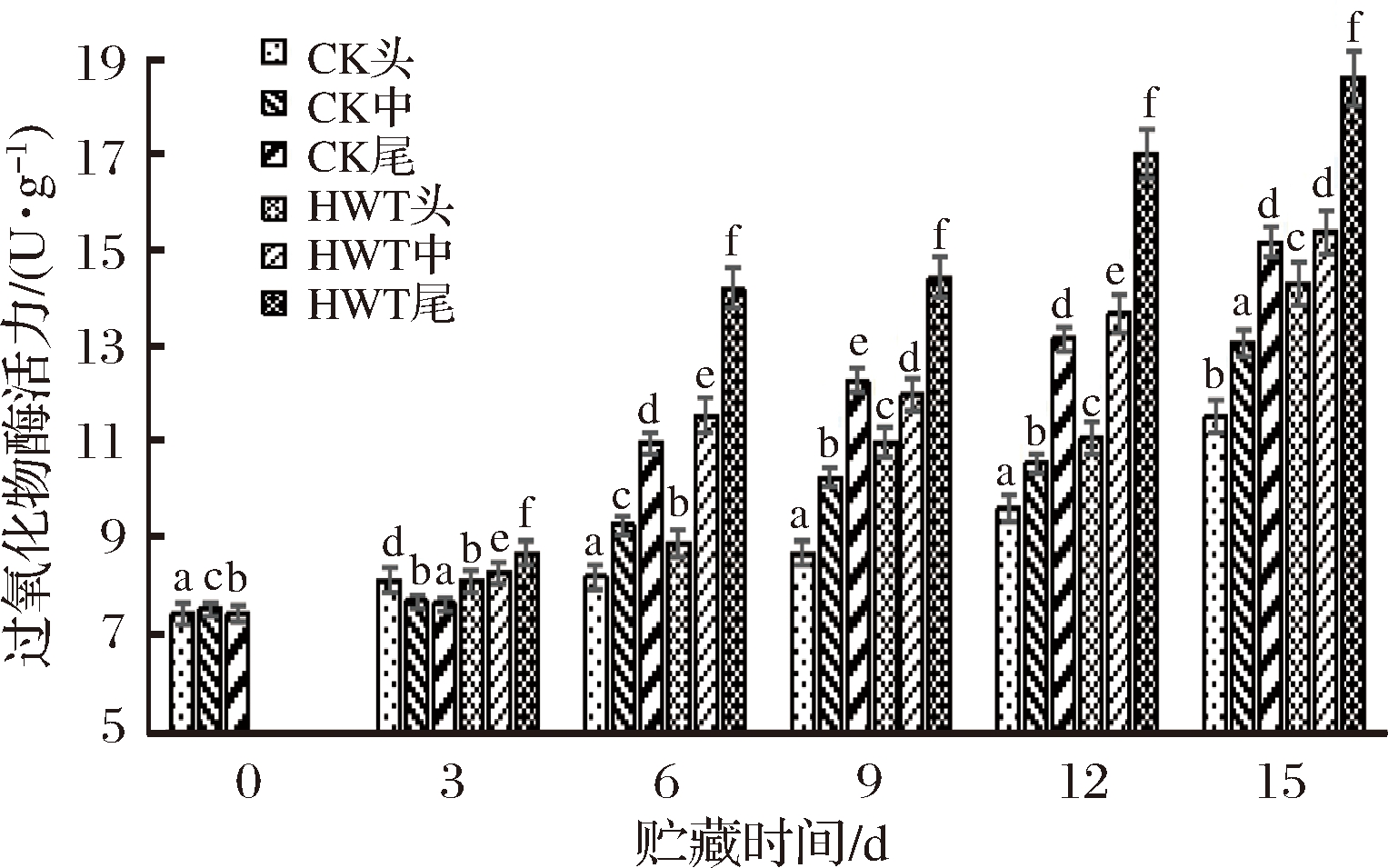
图8 短时热处理对黄瓜果实不同部位过氧化物酶(POD)活力的影响
Fig.8 The influence of short-time heat treatment on POD content in different parts of cucumber fruit
抗坏血酸过氧化物酶(APX)能催化抗坏血酸与H2O2发生反应,清除果实内H2O2,进而提高果蔬的抗氧化能力[27]。如图9所示,随贮藏时间的延长,各处理组的APX活力均呈现先上升后下降的趋势;HWT组的APX活力在贮藏第6天达到最大值,头、中、尾部的值分别为111.13、112.88、123.25 U/g,比0 d高3.72、3.76、和4.9倍,随后迅速下降。CK组APX活力在贮藏第9天达到最大值,头、中、尾部的值为87.88、88.38、91.13 U/g。上述结果表明,热处理可以保持细胞较高的活性氧清除酶活力,从而减少活性氧的积累,且HWT组尾部的活性氧清除酶活力最高。
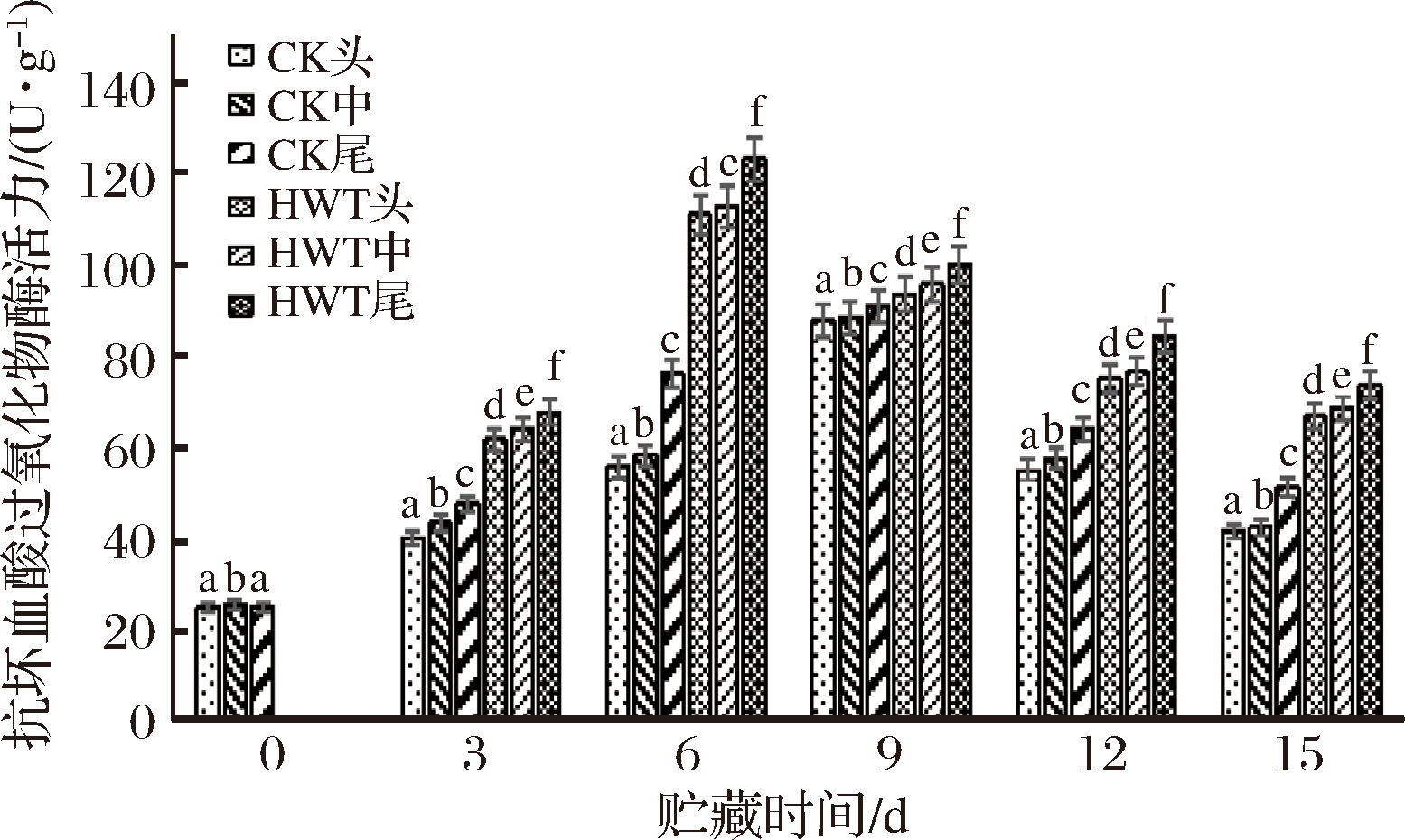
图9 短时热处理对黄瓜果实不同部位抗坏血酸过氧化物酶(APX)活力的影响
Fig.9 The influence of short-time heat treatment on APX activity in different parts of cucumber fruit
超氧化物歧化酶(SOD)可催化超氧阴离子自由基歧化生成H2O2和O2,前者分解为无毒的H2O和O2,也能够保护细胞膜的完整性[28]。如图10所示,随贮藏时间的延长,各处理组的SOD活力均呈现先上升后下降的趋势,HWT组的增长趋势明显。在贮藏第3天,SOD活力增长差别较小,HWT组的头部、中部小于CK组的尾部,是由于贮藏前期冷害不明显,尾部的抗冷性更强;各组SOD活力在贮藏第6天达到峰值,HWT组头、中、尾部的值分别比CK组高36.37%、34.05%、30.76%。上述结果表明,热处理可以有效提高果实的SOD酶活力,增强了清除自由基的能力;HWT组的尾部增长率高,说明尾部的自我保护能力更高。

图10 短时热处理对黄瓜果实不同部位超氧化物歧化酶(SOD)活力的影响
Fig.10 The influence of short time heat treatment on SOD activity in different parts of cucumber fruit
在植物体中,SOD是植物防御体系中的第一道防线,低温会导致抗氧化酶系(SOD、CAT、APX)活力下降,破坏生物膜的结构和功能。朱赛赛等[29]研究45 ℃热空气处理20 min使西葫芦![]() 含量、H2O2含量降低,抗氧化酶(CAT、SOD、POD)活力提高,MDA含量、电解质渗透率减小,果实的冷害指数也降低。周文娟等[30]采用50℃热水处理桃果实1 min能够有效提高抗氧化代谢相关酶控制桃果实的发病率,提高桃果实的抗氧化代谢能力,进而提高果实抗病性。对番茄[31]、牛角椒[32]、橄榄果实[33]等的研究也有相同的结果。
含量、H2O2含量降低,抗氧化酶(CAT、SOD、POD)活力提高,MDA含量、电解质渗透率减小,果实的冷害指数也降低。周文娟等[30]采用50℃热水处理桃果实1 min能够有效提高抗氧化代谢相关酶控制桃果实的发病率,提高桃果实的抗氧化代谢能力,进而提高果实抗病性。对番茄[31]、牛角椒[32]、橄榄果实[33]等的研究也有相同的结果。
H2O2是植物体内一种活性氧自由基,当活性氧清除系统代谢不平衡时,H2O2将会大量累积导致细胞膜结构受到破坏。由图11可知,在贮藏期间(黄瓜H2O2含量总体呈上升的趋势),可对黄瓜果实细胞组织造成损伤。在贮藏初期,各组H2O2含量的头部和中部无显著性差异。在贮藏后期,CK组的H2O2含量显著大于HWT组,第12天,CK组头部、中部和尾部的H2O2含量分别比HWT组的头部、中部和尾部高出26.7%、35.6%及38.1%。贮藏15 d,果实CK组头部、中部、尾部的H2O2含量比0 d高4.8、4.7和4.6倍;HWT组头部、中部和尾部的黄瓜果实的H2O2含量比0 d高3.9、3.8和3.7倍,表明热处理在贮藏期能明显抑制黄瓜果实体内H2O2含量上升,尾部的抑制效果更明显。

图11 短时热处理对黄瓜果实不同部位H2O2含量的影响
Fig.11 The influence of short time heat treatment on H2O2 content in different parts of cucumber fruit
超氧阴离子自由基![]() 能造成并加速果实内部的氧化伤害,在低温胁迫下,
能造成并加速果实内部的氧化伤害,在低温胁迫下,![]() 不断累积,导致细胞膜透性增大,对生物膜的攻击性极强,使细胞的完整性遭到破坏,如图12所示。
不断累积,导致细胞膜透性增大,对生物膜的攻击性极强,使细胞的完整性遭到破坏,如图12所示。
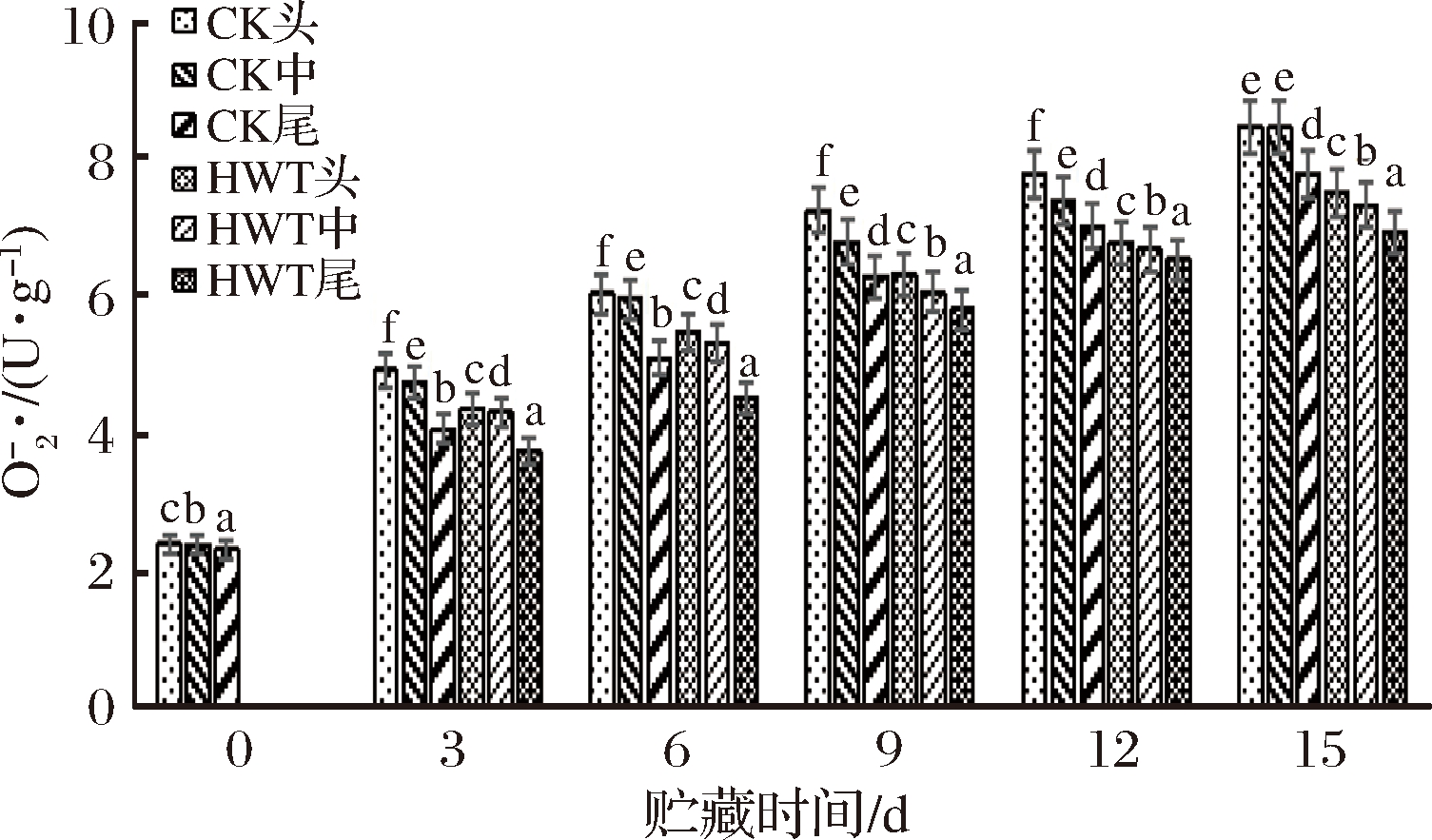
图12 短时热处理对黄瓜果实不同部位![]() 的影响
的影响
Fig.12 The influence of short time heat treatment on ![]() in different parts of cucumber fruit
in different parts of cucumber fruit
随着贮藏时间的延长,CK与HWT组的![]() 含量呈增加趋势,在贮藏期间CK的头部和中部始终大于HWT组的头部和中部,CK的尾部始终小于HWT组尾部。贮藏前6 d,CK组黄瓜果实尾部大于HWT组的头部和中部,在9 d后CK组大于HWT组,与第9天后冷害逐渐严重有关,CK与HWT组均呈显著性差异(P<0.05),贮藏至15 d,CK组头部和尾部的
含量呈增加趋势,在贮藏期间CK的头部和中部始终大于HWT组的头部和中部,CK的尾部始终小于HWT组尾部。贮藏前6 d,CK组黄瓜果实尾部大于HWT组的头部和中部,在9 d后CK组大于HWT组,与第9天后冷害逐渐严重有关,CK与HWT组均呈显著性差异(P<0.05),贮藏至15 d,CK组头部和尾部的![]() 含量分别比HWT组的头部和尾部高出9.9%及9.3%,果实CK组头部、中部、尾部的
含量分别比HWT组的头部和尾部高出9.9%及9.3%,果实CK组头部、中部、尾部的![]() 生成速率比0 d高63.6%、63.5%和61.5%。HWT组头部、中部和尾部的黄瓜果实的
生成速率比0 d高63.6%、63.5%和61.5%。HWT组头部、中部和尾部的黄瓜果实的![]() 生成速率比0 d高59.6%、58.6%和57.4%,热处理组黄瓜
生成速率比0 d高59.6%、58.6%和57.4%,热处理组黄瓜![]() 生成速率显著(P<0.05)低于对照的各组。说明热处理可明显抑制黄瓜果实
生成速率显著(P<0.05)低于对照的各组。说明热处理可明显抑制黄瓜果实![]() 含量的增加,且热处理组尾部的
含量的增加,且热处理组尾部的![]() 生成速率比头部和中部低,说明黄瓜果实尾部在贮藏中更能抑制
生成速率比头部和中部低,说明黄瓜果实尾部在贮藏中更能抑制![]() 生成速率的上升,减少
生成速率的上升,减少![]() 的积累。
的积累。
热水处理能抑制黄瓜果实丙二醛含量以及电解质外渗率的升高,能提高APX、CAT、POD活力,提高黄瓜果实的抗氧化能力和活性氧清除能力。赵宇瑛等[34]为了研究黄瓜果实采后的耐冷性,在2 ℃下贮藏9 d后,分别测定头部(花萼端)、中部、尾部(果梗端)3个部位的指标,黄瓜果实从尾部到头部的耐低温能力逐渐降低。本试验热处理组的头、中、尾部与对照组相比,冷害指数、电导率、MDA含量要低于对照组,热处理组的头、中、尾部硬度分别高于对照组的头、中、尾部,POD、CAT活力要高于对照组,这说明黄瓜果实不同部位热处理均减轻了冷害带来的影响,提高其抗冷性。且黄瓜果实尾部的冷害指数一直低于其他处理组,黄瓜头部、中部、尾部的抗冷性存在差异,这种差异与POD和CAT的活性以及渗透作用存在密切的联系。各处理组对黄瓜冷害抑制的程度为热处理组>对照组,尾部>中部>头部。
[1] 高元惠,刘凤娟,高丽朴,等.1-MCP处理对黄瓜采后生理及品质的影响[J].食品科技,2015,41(12):131-134.
[2] 张慜,刘倩.国内外果蔬保鲜技术及其发展趋势[J].食品与生物技术学报,2014,33(8):785-792.
[3] ZHAO Y,CHEN J,TAO X,et al.The possible role of BAX and BI-1 genes in chilling-induced cell death in cucumber fruit[J].Acta Physiologiae Plantarum,2014,36(6):1 345-1 351.
[4] 励建荣,朱丹实.果蔬保鲜新技术研究进展[J].食品与生物技术学报,2012,31(4):337-347.
[5] 沈丽雯,刘娟,董红敏,等.热激处理对黄瓜低温贮藏特性的影响[J].食品工业科技,2015,36(22):343-348.
[6] SHAO X,TU K.Hot air treatment improved the chillingresistance of loquat fruit under cold storage[J].Journal of Food Processing and Preservation,2014,38(2):694-703.
[7] 李秀杰,王海荣,王海波,等.热水处理对‘鲁星’油桃贮藏效果的影响[J].山东农业科学,2016,48(8):120-122;129.
[8] 乔勇进,冯双庆,赵玉梅.热处理对黄瓜冷害及生理变化的影响[J].食品科学,2003,24(1):131-135.
[9] NASEF IBRAHIM N.Short hot water as safe treatment induces chilling tolerance and antioxidant enzymes, prevents decay and maintains quality of cold-stored cucumbers[J].Postharvest Biology and Technology, 2018,138:1-10.
[10] 王志伟.间歇热处理对柑橘冷害调控研究[J].包装工程,2019,40(17):131-134.
[11] 李春晖,张敏,艾文婷,等.不同温度场响应对西葫芦采后贮藏品质的影响[J].食品工业科技,2018,39(2):272-277;284.
[12] 范林林,毛宇豪,夏春丽,等.热激处理对青椒的保鲜效果研究[J].安徽农业科学,2016,44(19):76-79.
[13] 马永硕.黄瓜中苦味素的生物合成、调控及转运机制[D].北京:中国农业科学院,2017.
[14] 曹建康,陈文化,赵玉梅,等.壳聚糖结合1-甲基环丙烯处理对李果实货架期品质的影响[J].食品科学,2009,30(22):366-368.
[15] CHEN Binxia,YANG Huqing.6-Benzylaminopurine alleviates chilling injury of postharvest cucumber fruit through modulating antioxidant system and energy status[J].J Sci Food Agric,2013,93(8):1 915-1 921.
[16] 张婷,陈娟,潘俨,等.不同贮藏温度对采后86-1哈密瓜果实冷害及品质的影响[J].食品工业科技,2015,36(3):345-348.
[17] 王静,茅林春,李学文,等.热处理降低哈密瓜果实活性氧代谢减轻冷害[J].农业工程学报,2016,32(2):280-286.
[18] 任军,黄志霖,曾立雄,等.低温胁迫下植物生理反应机理研究进展[J].世界林业研究,2013,26(6):15-20.
[19] 邵婷婷,姜雪,张敏,等.贮前强制对流热空气处理对低温胁迫下青椒果实 AsAGSH 循环代谢的影响[J].食品与发酵工业,2019,45(18):65-72.
[20] 杨婷.膜脂过氧化对植物细胞的伤害[J].科技与创新,2018(8):61-62.
[21] ENDO H,OSE K,BAI J,et al.Effect of hot water treatment on chilling injury incidence and antioxidative responses of mature green mume(Prunus mume)fruit during low temperature storage[J].Scientia Horticulturae,2019,246:550-556.
[22] AGHAEE A,MORADI F,ZARE-MAIVAN H,et al.Physiological responses of two rice(Oryza sativa L.)genotypes to chilling stress at seedling stage[J].African Journal of Biotechnology, 2013,10(39):7 617-7 621.
[23] 解越.低温逆境下冷敏果实组织冷损伤及半致死温度的研究[D].上海:上海海洋大学,2016.
[24] 阎世江,刘洁,张继宁,等.低温对黄瓜若干生理指标的影响[J].河北科技师范学院学报,2013,27(2):12-17.
[25] 张福平,陈蔚辉,郑楚萍,等.超声波结合气调包装对番石榴贮藏品质与生理的影响[J].南方农业学报,2017,48(3):493-498.
[26] LUO Z S,CHEN C,XIE J.Effect of salicylic acid treatment onalleviating postharvest chilling injury of‘Qingnai’plum fruit[J].Postharvest Biology and Technology,2011,62(2):115-120.
[27] 闫媛媛,胡文忠,姜爱丽,等.茉莉酸甲酯和乙烯利处理对鲜切富士苹果抗氧化酶活力和苯丙烷代谢的影响[J].食品工业科技,2015,36(16):324-327.
[28] 高元惠,刘凤娟,高丽朴,等.1-MCP处理对西葫芦采后生理及品质的影响[J].食品科技,2012,33(6):44-47.
[29] 朱赛赛,艾文婷,张敏,等.热空气处理对西葫芦采后低温贮藏生理的影响[J].食品工业科技,2017,38(21):281-287.
[30] 周文娟,陈晨,胡文忠,等.热水处理对桃果实采后病害及生理变化的影响[J].食品工业科技,2012,33(13):311-314;319.
[31] 汝学娟,汝学玲,尹贤贵,等.热处理对番茄品质和耐贮性的影响[J].分子植物育种,2017(2):322-326.
[32] 陈德琴.不同热激处理对采后普鲁登斯牛角椒冷害控制作用的研究[J].农产品加工,2016(15):15-18.
[33] 孔祥佳,林河通,郑俊峰,等.热空气处理诱导冷藏橄榄果实抗冷性及其与膜脂代谢的关系[J].中国农业科学,2012,45(4):752-760.
[34] 赵宇瑛,杨静,陈金凤,等.黄瓜果实不同部位的耐冷性差异[J].园艺学报,2009,36(7):1 060-1 064.