甘薯(Ipomoea batatas(L.)Lam.)味美甜糯,营养丰富,药食兼用,我国的种植面积和产量均居世界首位。对其进行高附加值利用,对促进我国农村经济的发展具有积极意义[1]。甘薯在16~35 ℃的储运环境下极易发芽,严重影响商品价值,原因在于甘薯收获时,块根周皮下已分化形成大量潜伏的不定芽原基[2]。因甘薯无生理休眠期的生理特性,芽原基在16~35 ℃环境中极易萌发。萌芽前期所需的养分,主要由甘薯本身供给,随着幼苗生长,逐渐转为靠根系吸收床土中养分生长[3]。因此,甘薯前期发芽会促进块根内部营养物质转化为小分子物质,释放能量,供于芽的生长。为保持甘薯的营养品质,抑芽非常重要。
目前应用于甘薯抑芽的技术主要有:辐照抑芽、植物生长调节剂抑芽、植物提取物抑芽等。辐照抑芽通过直接破坏甘薯芽体细胞内DNA,使块根产生的活性自由基与核内物质作用,发生交联反应,从而抑制甘薯芽生长[4]。但目前存在辐照资源紧张、操作不便、运输成本高等难题。植物生长调节剂中有氯苯胺灵(chlor-propham,CIPC)[5]、NaClO溶液和萘乙酸。CIPC属于低毒性物质,而NaClO溶液和萘乙酸对甘薯品质会产生不良影响[6-7]。植物提取物抑芽主要是从植物中提取出香芹酮、茉莉酸甲酯[8]、薄荷醇[5]等物质,此法提取成本较高,并不适于商业应用。
乙烯利(外源乙烯)成本低,安全性好,可商业化批量生产。有研究表明,外源乙烯可有效抑制马铃薯[9-11]、洋葱[12-14]等的采后萌芽现象。迄今为止,乙烯已在部分国家被注册为洋葱、马铃薯商业抑芽剂,但在甘薯抑芽方面的研究鲜有报道。本试验以甘薯为原材料,探讨了不同浓度外源乙烯对25 ℃(模拟常温物流温度)贮藏下甘薯的抑芽作用及其品质的影响,为外源乙烯在甘薯抑芽中的应用提供理论依据和技术支撑。
1 材料与方法
1.1 材料与试剂
“渝薯7号”甘薯购于北碚区天生农贸市场,要求同一批次、大小均匀、机械伤少、无发芽、无病虫害。标准邮政6号纸箱(260 mm×150 mm×180 mm),3层B瓦楞,山东冠县万林纸制品有限公司。
2.5 g/包乙烯利(有效成分20%),山东营养源食品科技有限公司;NaOH、BaCl2、无水乙醇、乙酸铅、无水Na2SO4、甲醇、草酸、2,6-二氯靛酚钠、CuSO4、酒石酸钾钠、Na2CO3,成都科龙化工试剂厂;石油醚,重庆川东化工(集团)有限公司;浓HCl、丙酮,重庆北碚化学试剂厂;L(+)-抗坏血酸标准品,北京索莱宝科技有限公司。
1.2 仪器与设备
RXZ-8000智能人工气候箱,宁波东南仪器有限公司;H1650R台式高速冷冻离心机,湖南湘仪公司;UV-2450PC紫外可见分光光度计、UV-2450手持式折光仪,日本岛津公司;GY-4数显式果实硬度计,浙江乐清艾德堡仪器有限公司;CENTER®314数位温湿度表,群特科技股份有限公司。
1.3 实验方法
1.3.1 样品制备
挑选大小均匀、无发芽、无病虫害的甘薯进行处理,将甘薯随机放入纸箱,每箱1 500 g左右,再放入一定量乙烯利后封箱。试验中乙烯利浓度分别为0(CK)、0.5、1、2 g/L(乙烯利质量与气体空间体积比)。最后将装箱后的甘薯放入气候箱中,模拟常温物流,在(25±1)℃、相对湿度(90±5)%的条件下贮藏18 d,每3 d每组随机取3箱取样进行指标测定。
1.3.2 发芽指数和发芽率的测定
以薯皮出现肉眼可见的芽点视为发芽[15],参考PANKOMERA[16]的方法,观察并记录每个甘薯的发芽数,发芽指数记录为:1级=0芽;2级=1~3芽;3级=4~6芽;4级= 7~9芽;5级=10芽及以上。按照公式(1)和(2)分别计算甘薯的发芽指数和发芽率:
(1)
(2)
式中:i,发芽级数;Xi,i级甘薯个数;K,甘薯总个数。
1.3.3 开裂率的测定
以薯皮出现肉眼可见的裂纹视为裂果。按照公式(3)计算甘薯的裂果率。
(3)
1.3.4 呼吸强度的测定
参考曹建康等[17]的方法,按静置法测定甘薯的呼吸强度[mg/(kg·h)]。
1.3.5 硬度的测定
使用艾德堡GY-4硬度计测定甘薯硬度,探头直径为3.5 mm。在甘薯横向赤道部位均匀取4点测定,取平均值。
1.3.6 可溶性固形物含量的测定
称取2.5 g甘薯,按NY/T 2637—2014《水果和蔬菜可溶性固形物含量的测定折射仪法》测定甘薯的可溶性固形物含量。
1.3.7 淀粉含量的测定
称取2.5 g甘薯,按NY/T 2637—2014《水果和蔬菜可溶性固形物含量的测定折射仪法》执行,测定甘薯的可溶性固形物含量,以%表示。
1.3.8 总酚含量的测定
参考曹建康等[17]的方法,测定甘薯的总酚含量,以OD280/g表示。
1.3.9 类黄酮含量的测定
参考曹建康等[17]的方法,测定甘薯的类黄酮含量,以OD325/g表示。
1.3.10 抗坏血酸(ascorbic acid, ASA)含量的测定
按GB 5009.86—2016《食品安全国家标准食品中抗坏血酸的测定》中2, 6-二氯酚靛酚滴定法测定甘薯的ASA含量。
1.3.11 类胡萝卜素含量的测定
按NY/T 1320—2007《中华人民共和国农业行业标准农作物种质资源鉴定技术规程甘薯》中丙酮直提法测定甘薯的类胡萝卜素含量。
1.4 数据统计分析
使用Microsoft Excel 2007对各指标进行数据计算;用IBM SPSS Statistics 22对指标进行显著性分析,最后用OriginPro 8.6制图。
2 结果与分析
2.1 甘薯发芽率和发芽指数
甘薯在愈伤期间和储运后期易发芽,发芽将增加其营养物质的消耗,块根本身则萎缩干枯,品质下降以致不堪食用[18]。如图1、图2所示,在常温储存期间处理组甘薯发芽率和发芽指数均远低于CK组,差异极显著(P<0.01)。0.5、1、2 g/L乙烯处理组分别在第12、15、18天观察到芽点,CK组在第3天观察到芽点。第18天时,CK组发芽率、发芽指数分别高达(83.33±4.71)%和(2.7±0.08);0.5、1、2 g/L乙烯处理组发芽率为(30±8.16)%、(10±8.16)%、(3.33±4.71)%;处理组发芽指数均处于较低水平,与CK组差异极显著(P<0.01),0.5 g/L乙烯组发芽指数显著高于1、2 g/L乙烯组(P<0.05),1 g/L乙烯组发芽指数略高于2 g/L乙烯组,差异不显著(P>0.05)。表明在常温储运时,外源乙烯处理不能完全抑制甘薯发芽,但能有效延迟甘薯初芽时间,且浓度越高效果越好,0.5、1、2 g/L乙烯处理能有效控制甘薯在12、15、18 d内不发芽。
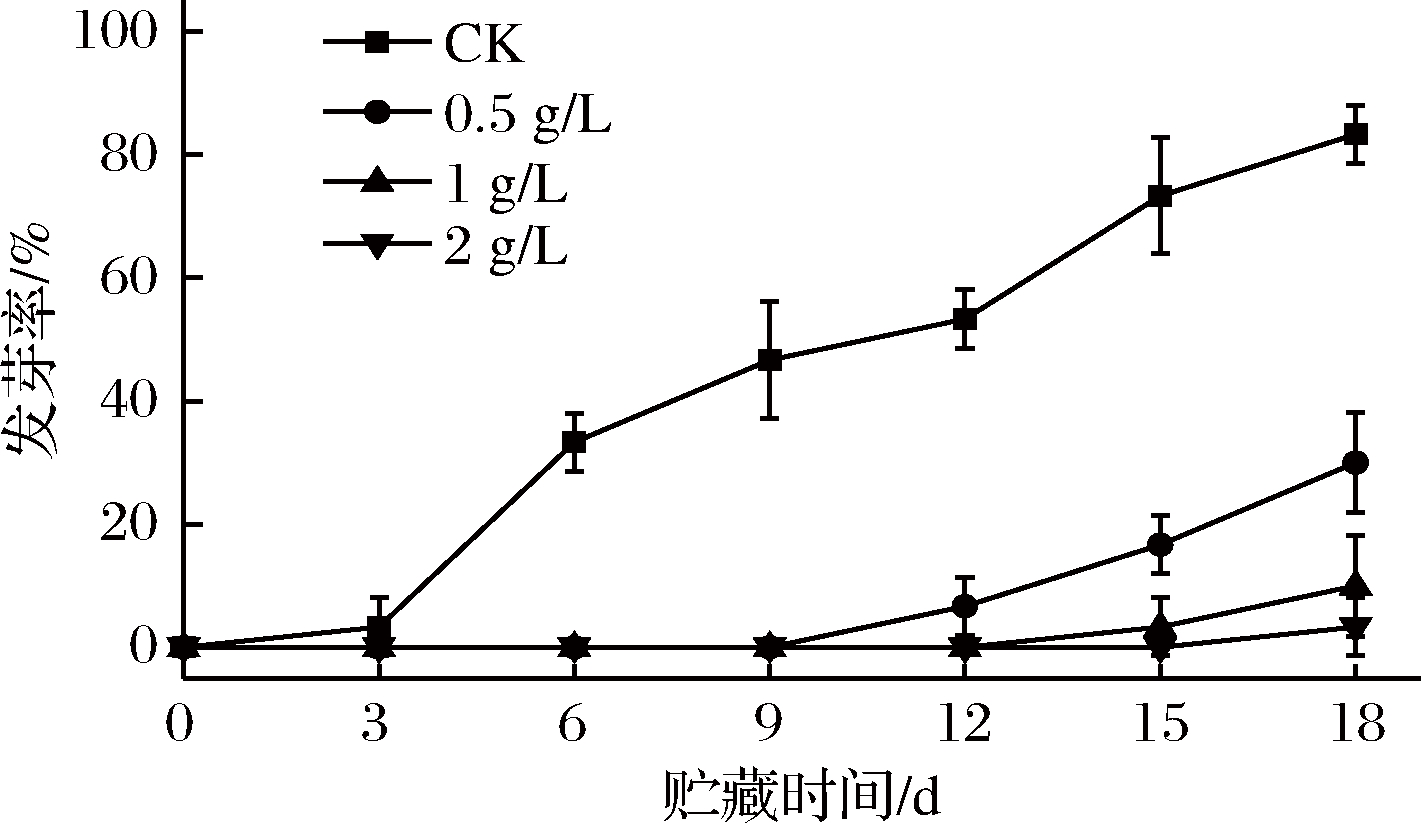
图1 外源乙烯处理对甘薯发芽率的影响
Fig.1 The effect of exogenous ethylene treatment on germination rate of sweet potato
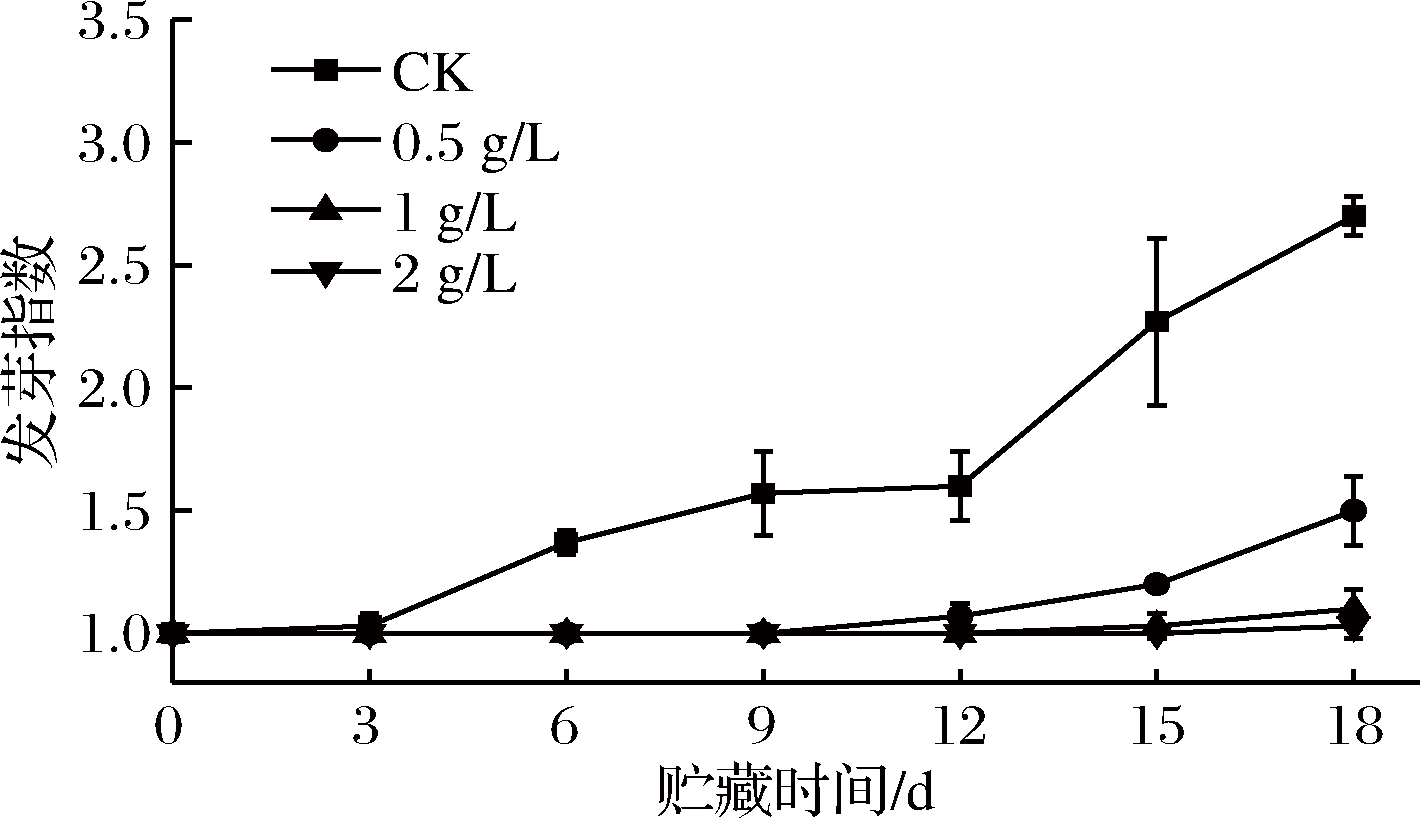
图2 外源乙烯处理对甘薯发芽指数的影响
Fig.2 The effect of exogenous ethylene treatment on germination index of sweet potato
2.2 外源乙烯对甘薯开裂率的影响
甘薯周皮开裂影响其商品性,将增加微生物的浸染,进而导致其腐烂。周皮开裂的实质是周皮和果肉组织之间增长速度不平衡而产生开裂[19]。如表1所示,2 g/L乙烯组在6 d时观察到表皮开裂现象,18 d时开裂率为(33.33±4.71)%。而CK组、0.5和1 g/L乙烯组直至储运末期均未出现周皮开裂现象。表明2 g/L外源乙烯处理将导致甘薯周皮出现裂纹,可能是由于高浓度的外源乙烯处理使甘薯果实膨大,而甘薯果肉和周皮组织增大速度不一致使周皮开裂。
表1 甘薯开裂率
Table 1 Sweet potato cracking rate
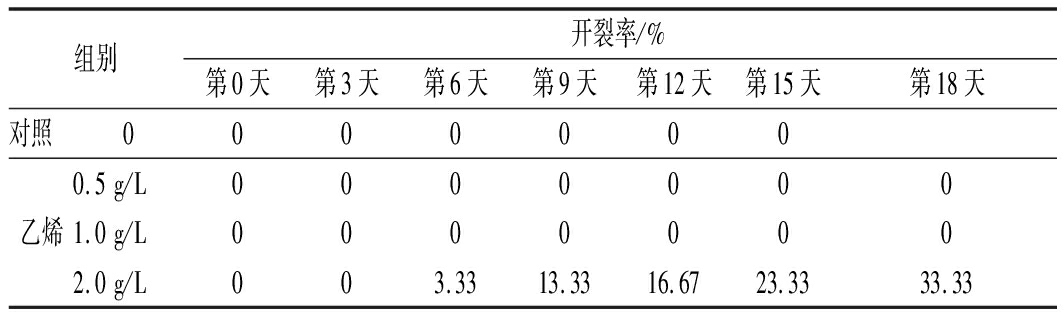
组别开裂率/%第0天第3天第6天第9天第12天第15天第18天对照0000000乙烯0.5g/L00000001.0g/L00000002.0g/L003.3313.3316.6723.3333.33
2.3 外源乙烯对甘薯呼吸强度的影响
呼吸作用是甘薯采后重要的生理代谢方式,如图3所示,各组甘薯呼吸强度呈现出随储运时间先上升再下降再上升的动态趋势。CK组在6 d时达到峰值(34.09±3.76)mg/(kg·h)后下降,12 d后再次上升并趋于稳定。这是由于环境温度较高,块根呼吸强度增大,甘薯达到呼吸跃变峰值后萌芽,导致块根呼吸强度再次增大[20- 21]。尽管如此,在整个储运过程中CK组呼吸强度仍显著低于0.5、1 g/L乙烯组(P<0.05),极显著低于2 g/L乙烯组(P<0.01)。2、1 g/L 乙烯组呼吸强度在第3天达到峰值,较CK组呼吸峰值提高了77.86%、34.81%;0.5 g/L乙烯组在第6天达到峰值,比CK组提高了27.74%;2 g/L乙烯组峰值显著高于0.5、1 g/L处理组(P<0.05);1 g/L乙烯组峰值稍高于0.5 g/L乙烯组,但差异不显著(P>0.05)。
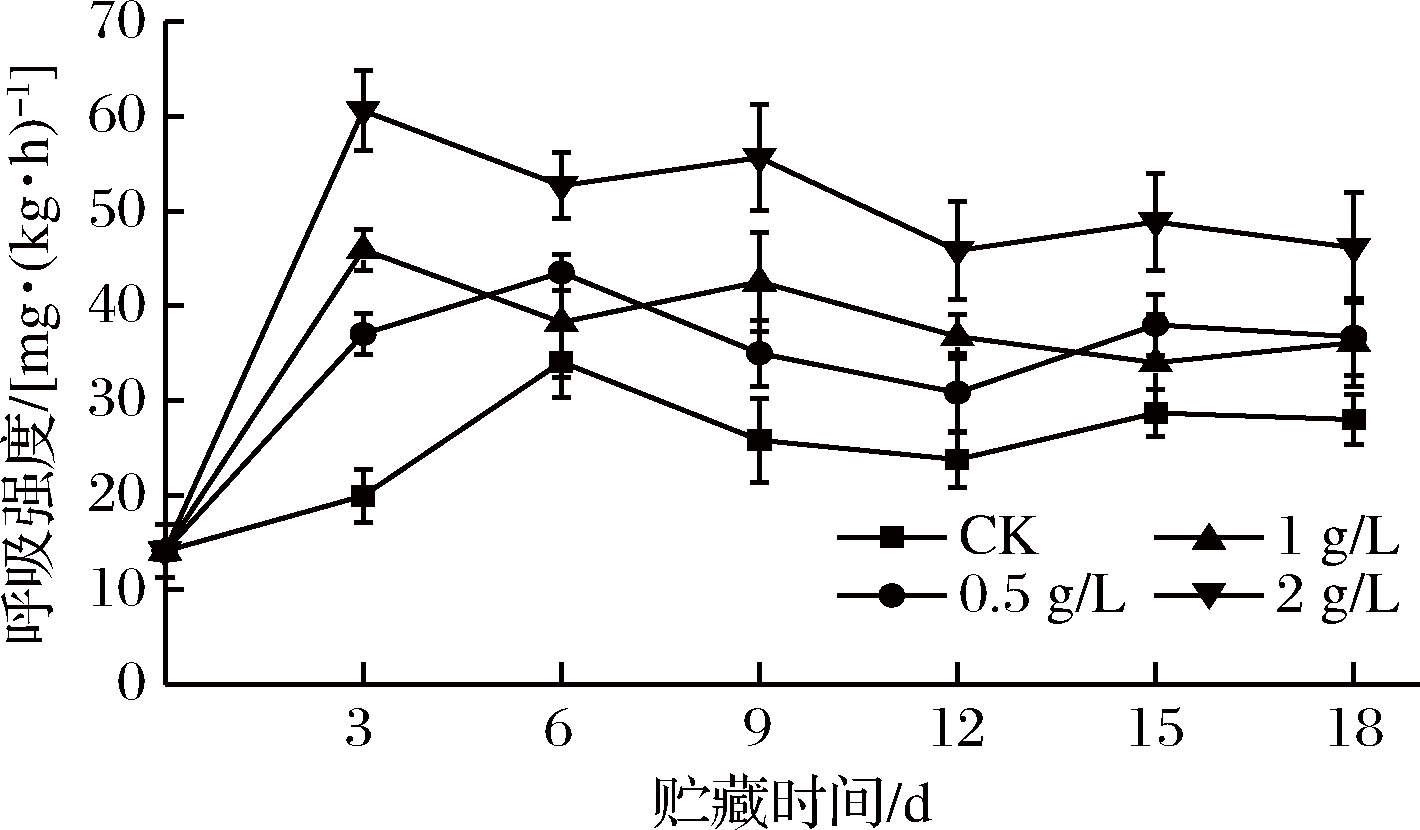
图3 外源乙烯处理对甘薯呼吸强度的影响
Fig.3 The effect of exogenous ethylene treatment on respiration rate of sweet potato
2.4 外源乙烯对甘薯硬度的影响
果蔬的硬度与纤维素、果胶和半纤维素形成的交联结构密切相关,在果蔬成熟衰老过程中,此交联结构在内切-β-1,4-葡聚糖酶(EGase)、β-葡萄糖苷酶(β-Glu)、多聚半乳糖醛酸酶(PG)和果胶甲酯酶(PME)作用下发生水解,从而导致果蔬软化[22]。如图4所示。
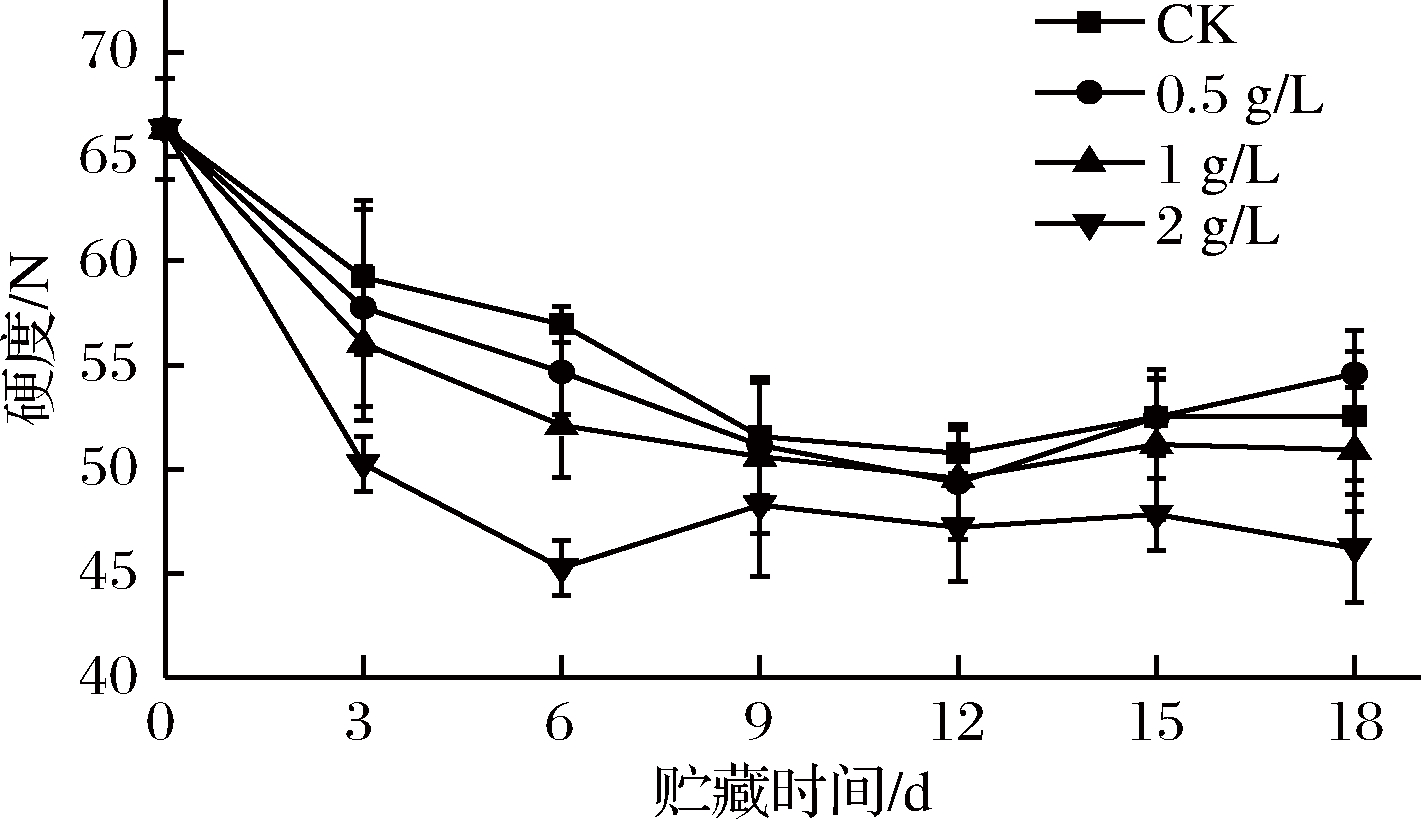
图4 外源乙烯处理对甘薯硬度的影响
Fig.4 The effect of exogenous ethylene treatment on firmness of sweet potato
在整个常温储运期间,各组甘薯硬度值基本呈下降趋势,但在储运中后期硬度值有所回升,这是由于25 ℃下甘薯水分流失、组织木质化加剧所致。所有组中2 g/L乙烯组硬度值最低,与其余3组差异显著(P<0.05),0.5、1 g/L乙烯组硬度值稍低于CK组,但差异不显著(P>0.05)。
2.5 外源乙烯对甘薯可溶性固形物含量的影响
可溶性固形物是果蔬甜味的主要来源,能作为呼吸代谢底物,并可保护生物膜[15]。如图5所示,在整个常温储运期间,外源乙烯处理组甘薯可溶性固形物含量先上升再下降再上升又下降,其中CK组全程处于较低水平,与处理组差异显著(P<0.05),在第6天,CK组可溶性固形物含量达到最大值(14±0.33)%,此后持续下降,可能是由于甘薯发芽消耗了甘薯果实的有机物所致。0.5、1、2 g/L乙烯组均在12 d时达到最大值,分别为(16.4±0.16)%、(18.4±0.16)%、(18±0.16)%,直到储运结束,处理组可溶性固形物含量仍处于较高水平。
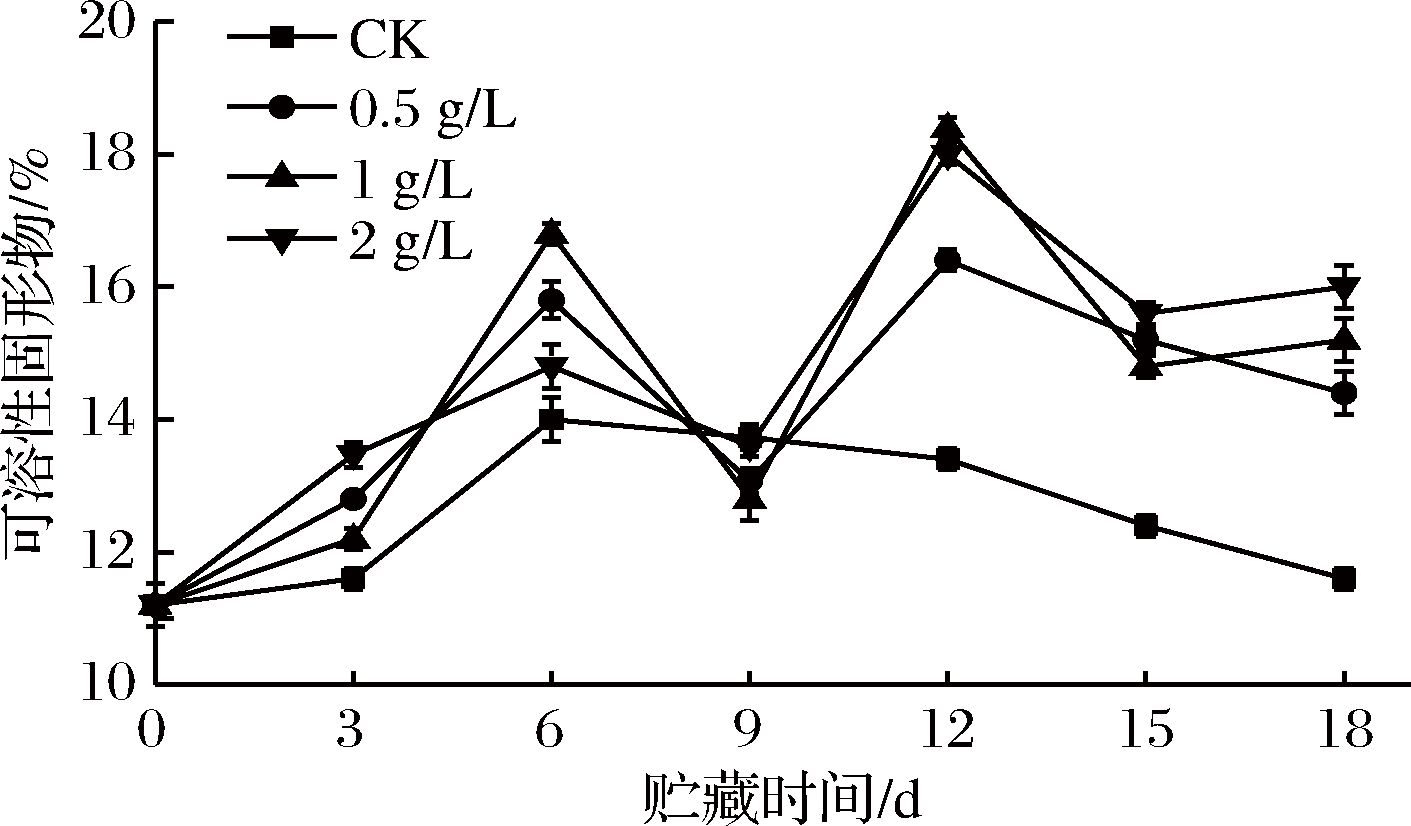
图5 外源乙烯处理对甘薯可溶性固形物含量的影响
Fig.5 The effect of exogenous ethylene treatment on soluble solid content of sweet potato
2.6 外源乙烯甘薯淀粉含量的影响
淀粉是甘薯块根除水分以外含量最多的成分,在储运过程中,甘薯淀粉经淀粉酶作用降解为小分子糖类,为甘薯萌芽和生长提供养分与能量[5]。如图6所示,在整个常温储运期间,CK组淀粉含量均高于处理组,由于处理组更高的呼吸强度导致甘薯淀粉快速分解消耗,含量下降。在第3天增大后持续下降,在前期变化较缓,9 d后下降趋势加快,可能是由于甘薯在储运中后期发芽旺盛,淀粉等高分子化合物被分解为低聚糖等较简单的化合物供给甘薯发芽,造成淀粉含量下降。尽管如此,CK组淀粉含量全程仍处于较高水平,15 d前与处理组差异显著(P<0.05)。所有外源乙烯处理组甘薯淀粉含量在第3天均略微升高,但增大幅度显著低于CK组(P<0.05),可能是由于乙烯处理增大了甘薯的呼吸强度,导致淀粉分解速度较快。3 d后,2 g/L乙烯组淀粉含量迅速降低,直到储运结束均处于最低水平,而0.5、1 g/L乙烯组甘薯淀粉含量在第9天有所回升,9 d后,0.5 g/L乙烯组淀粉含量下降速度加快,此时,甘薯开始萌芽,淀粉大量消耗分解为小分子物质。
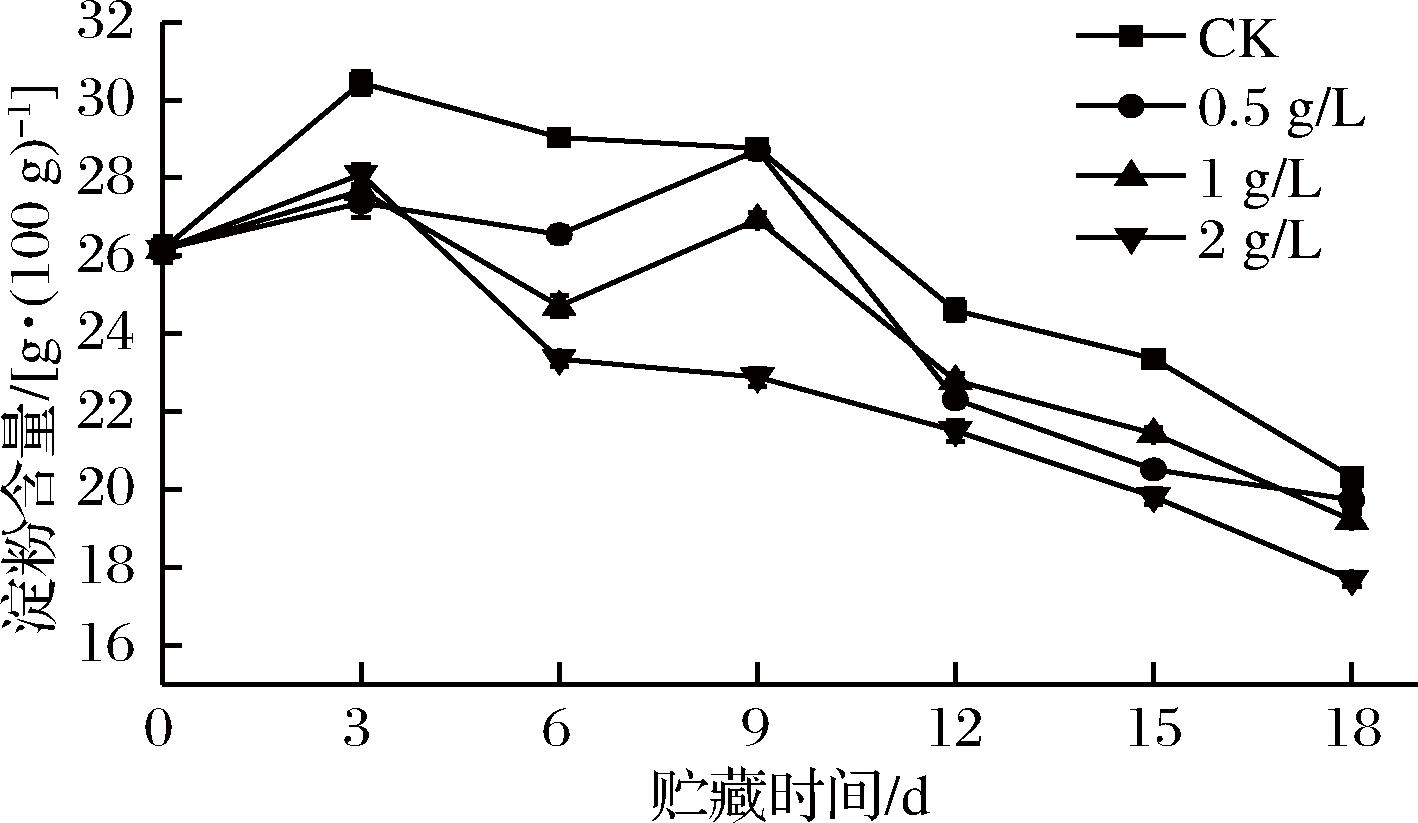
图6 外源乙烯处理对甘薯淀粉含量的影响
Fig.6 The effect of exogenous ethylene treatment on starch content of sweet potato
2.7 外源乙烯对甘薯总酚含量的影响
酚类化合物是植物次生代谢产物,由于其羟基具有清除自由基的能力,被认为是抗氧化剂,并为细胞损伤提供保护[23-24]。如图7所示,在整个常温储运过程中,所有甘薯总酚含量均呈波动上升趋势。储运0~6 d,各组甘薯总酚含量均有不同程度的上升,其中CK组上升幅度最小,与2 g/L乙烯组差异极显著(P<0.01),与0.5、1 g/L乙烯组差异显著(P<0.05)。储运6~18 d,各组甘薯总酚含量有所下降后再上升,2 g/L乙烯组总酚含量仍处于最高水平,与其余组差异显著(P<0.05),其次是0.5、1 g/L乙烯组,两组间差异不大(P>0.05),但均与CK组差异显著(P<0.05)。
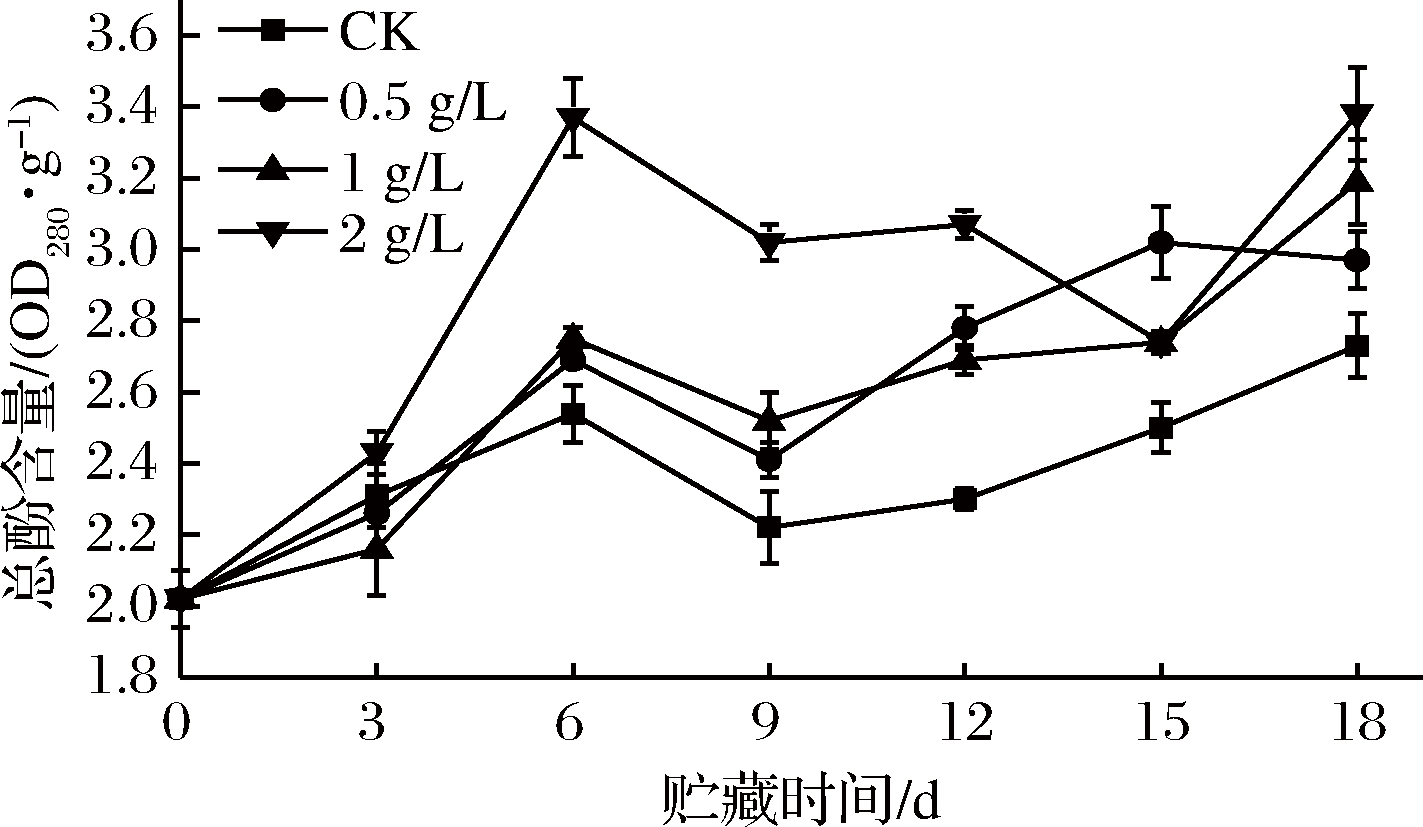
图7 外源乙烯处理对甘薯总酚含量的影响
Fig.7 The effect of exogenous ethylene treatment on total phenol content of sweet potato
2.8 外源乙烯对甘薯类黄酮含量的影响
如图8所示,在整个常温储运过程中,所有甘薯类黄酮含量均呈波动上升趋势。其中2 g/L乙烯组类黄酮含量全程处于较高水平,极显著高于CK组(P<0.01),显著高于其余2个处理组(P<0.05);其次是0.5、1 g/L乙烯组,均显著高于CK组(P<0.05);18 d时1 g/L乙烯组显著高于0.5 g/L乙烯组(P<0.05)。
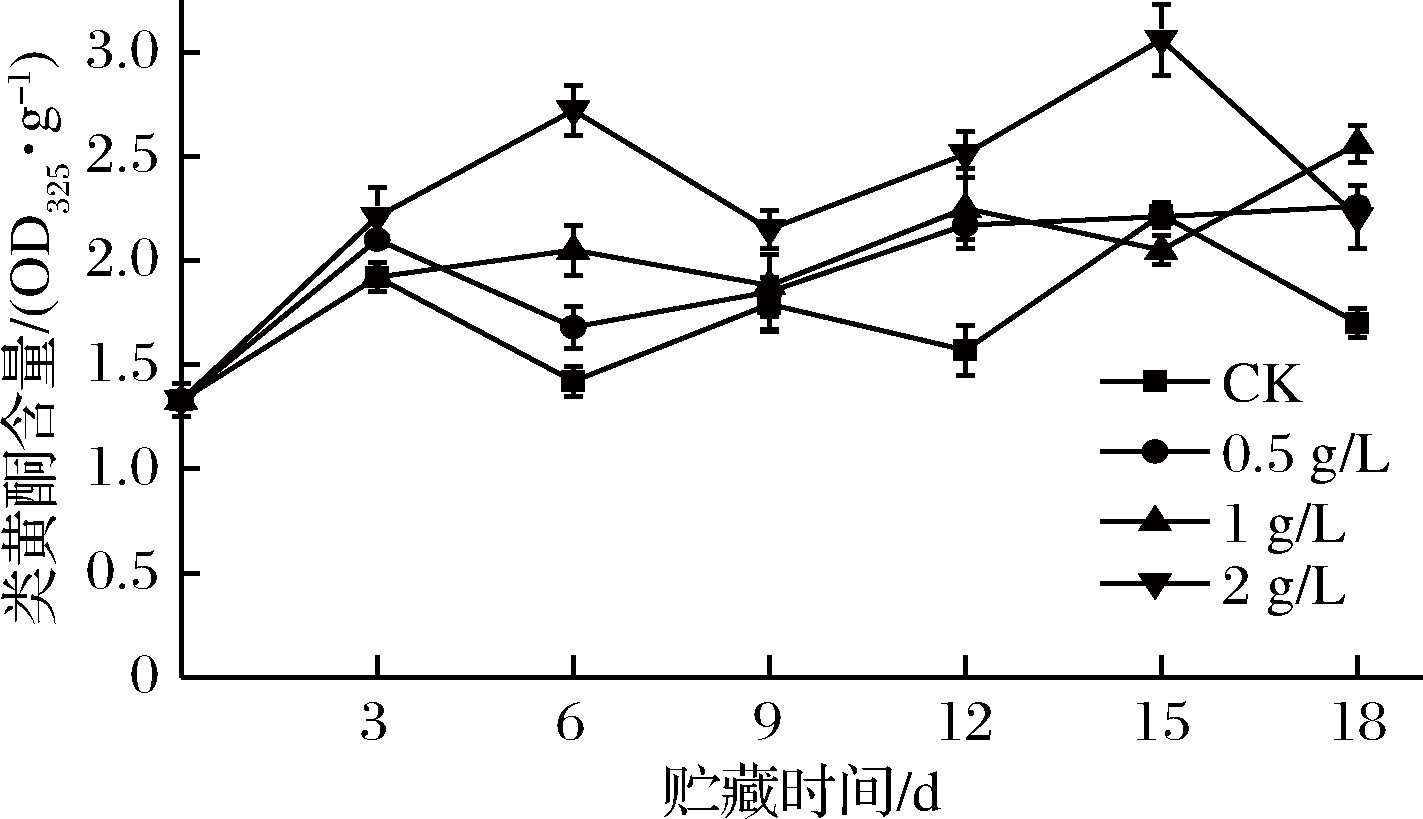
图8 外源乙烯处理对甘薯类黄酮含量的影响
Fig.8 The effect of exogenous ethylene treatment on flavonoid content of sweet potato
2.9 外源乙烯对甘薯ASA含量的影响
如图9所示,在储运第3天,各组ASA含量差异不大(P>0.05)。6 d时,CK组、2 g/L乙烯组ASA含量最低,与其余2组差异显著(P<0.05);1 g/L乙烯组ASA含量最高,与0.5 g/L乙烯组差异不显著(P>0.05)。直到储运末期,1 g/L乙烯组ASA含量仍保持在最高水平,与其余3组差异极显著(P<0.01),18 d时,较CK组高出39.91%,此时0.5、2 g/L 乙烯组略高于CK组,一方面可能是由于甘薯发芽和高浓度的外源乙烯处理使块根ASA加速分解。
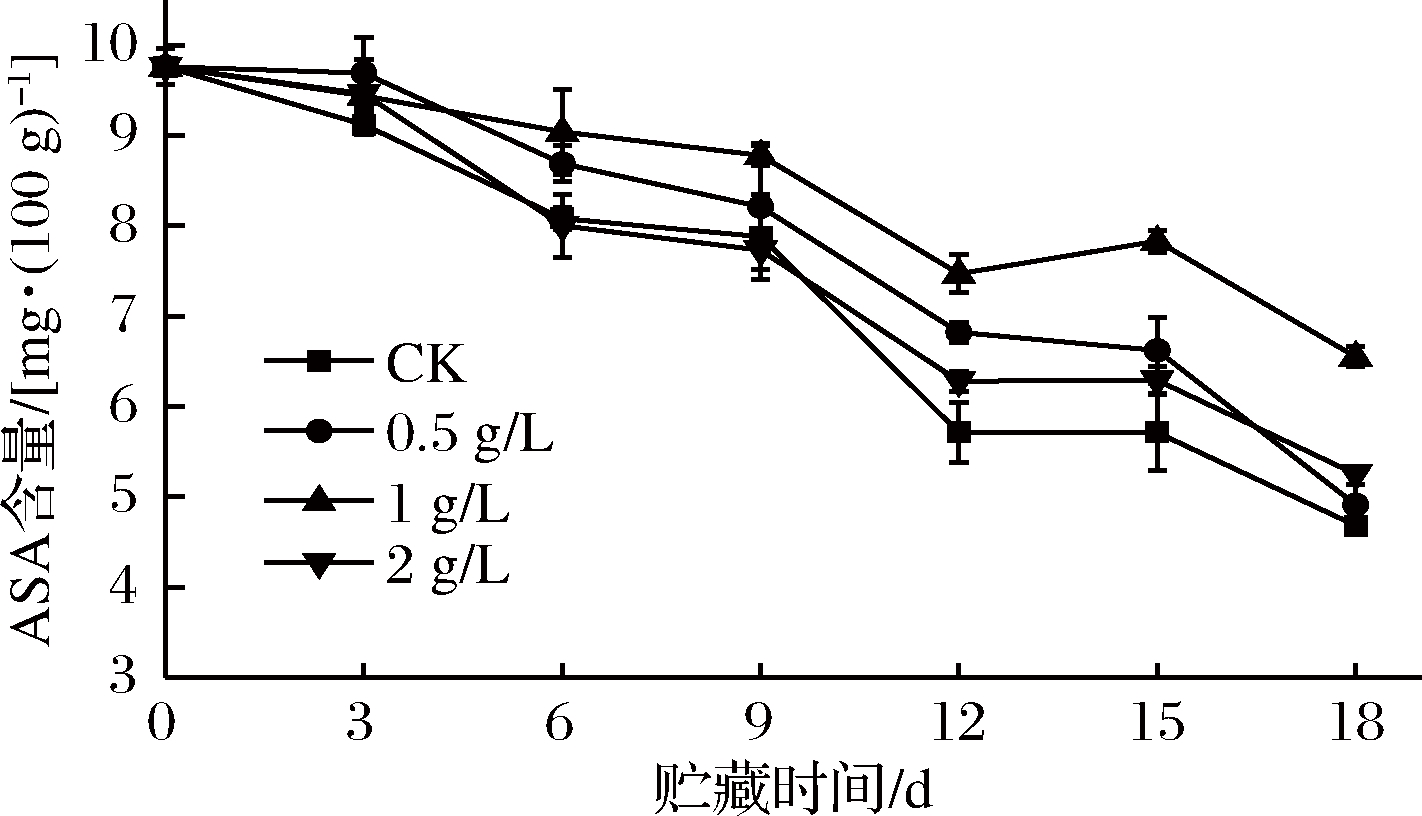
图9 外源乙烯处理对甘薯ASA含量的影响
Fig.9 The effect of exogenous ethylene treatment on ascorbic acid of sweet potato
2.10 外源乙烯对甘薯类胡萝卜素含量的影响
如图10所示,在整个常温储运过程中,CK组甘薯类胡萝卜素含量呈先升后降的趋势,乙烯处理组均呈波动上升趋势。各组甘薯类胡萝卜素含量在储运0~6 d均有不同程度的上升,其中CK组上升幅度最小,与处理组差异显著(P<0.05),CK组类胡萝卜素含量在第6天上升至峰值(4.72±0.97)mg/100 g后波动下降;2 g/L和1 g/L处理组的类胡萝卜素含量仍继续上升,其中2 g/L乙烯组类胡萝卜素含量全程处于最高水平,与其余3组差异显著(P<0.05),18 d时较CK组高出44.22%,此时1 g/L和0.5 g/L乙烯组类胡萝卜素含量较CK组分别高出35.17%和30.22%。
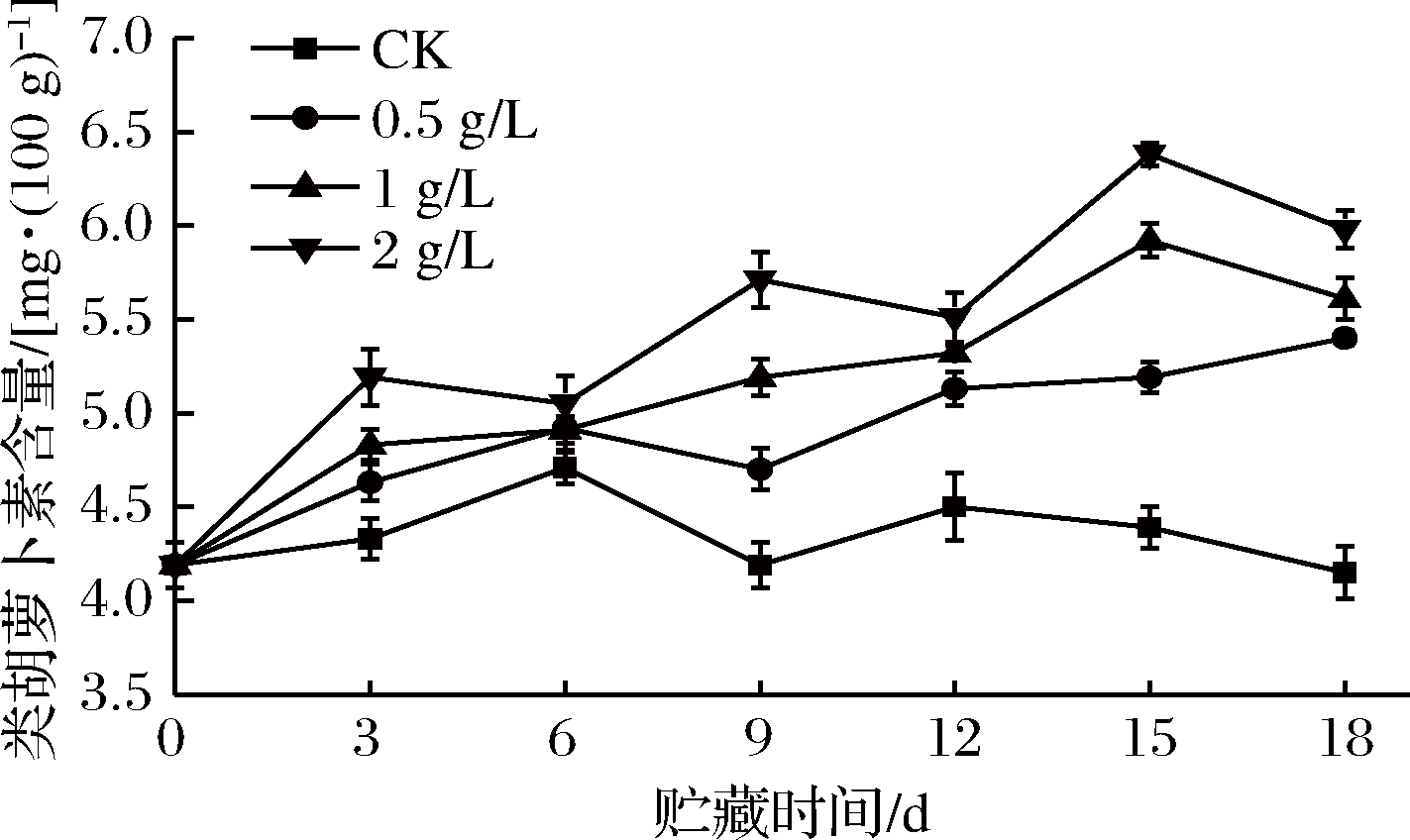
图10 外源乙烯处理对甘薯类胡萝卜素含量的影响
Fig.10 The effect of exogenous ethylene treatment on carotenoid content of sweet potato
3 结论与讨论
实验结果表明,外源乙烯处理能极显著(P<0.01)延缓甘薯发芽时间。CK组在第3天开始发芽,而0.5、1、2 g/L乙烯组能有效控制甘薯在12、15、18 d内不发芽,但过高质量浓度的2 g/L乙烯组会促使甘薯周皮开裂。陈晶晶等[25]研究表明,乙烯通过诱导番荔枝细胞壁水解酶、氧化酶基因高水平量表达,引起果实细胞壁快速降解,使细胞壁变得疏松,细胞之间的结合力减弱从而导致果皮开裂,且高浓度乙烯会加剧这种效应[26]。
在整个储运过程中外源乙烯处理会使甘薯的呼吸强度提高,一方面是由于乙烯通过受体与细胞膜结合,增强膜透性,使气体交换加速,氧化作用加强[27];另一方面乙烯可诱导呼吸酶mRNA的合成,提高呼吸酶含量并增强了呼吸酶活性,对抗氰呼吸有显著的诱导作用,进而使呼吸强度增大[28-29],这与代红飞[30]在马铃薯中实验结果相一致。乙烯处理组的淀粉含量均低于CK组,这可能与处理组呼吸强度较高,导致淀粉分解速度加快有关。而0.5、1 g/L乙烯组甘薯淀粉含量在第9天有所回升,是由于甘薯储运一定时间后,甘薯呼吸代谢逐渐趋缓,甘薯内比淀粉更复杂的化合物分解,重新合成淀粉,机体为了维持生理代谢平衡而进行自我调节所致[31]。实验中还发现,处理组中可溶性固形物与CK组差异显著(P<0.05),一方面在于外源乙烯处理延迟了甘薯的发芽时间,使得萌芽消耗的营养物质较少;另一方面在储运过程中,乙烯处理促进甘薯呼吸,促使淀粉分解转化为糖和糊精[32],从而提高甘薯可溶性固形物含量,这与石小玉等[33]在猕猴桃中的研究结果一致。此外,所有组前期硬度均呈下降趋势,可能是因为糖和淀粉为细胞的主要内含物质,其含量和比例的改变,影响果蔬风味品质,能显著影响细胞的膨压,最后通过影响细胞的张力而参与软化进程[34],导致甘薯的硬度变化。
在储运期间,外源乙烯处理有利于甘薯总酚含量的提升,原因可能与苯丙氨酸解氨酶(PAL)活性有关,柳洪鹃等[35]表示呼吸强度增大,PAL酶活力将提高,PAL催化的酚类物质含量也相应地增多。MURKUTE等[36]、DOWNES[37]等也得出外源乙烯会增加洋葱总酚含量的结论,也有研究显示外源乙烯会增加苹果[38]、柑橘[39]中的游离酚含量。甘薯富含能消除体内自由基、具有抗氧化功能的类黄酮物质[40],而外源乙烯处理能保持更高的类黄酮含量,曲文颖等[41]也发现外源乙烯处理有助于蓝莓中类黄酮的积累。此外,ASA是普遍存在于植物组织中的一种重要的抗氧化物质[42],在整个常温储运过程中,所有组甘薯ASA含量均呈下降趋势,同时ASA作为甘薯中的营养物质在储运过程中也会被不断消耗吸收和氧化分解[43],但1 g/L外源乙烯组的ASA含量能始终保持最高的水平。甘薯中的类胡萝卜素是有效的抗氧化剂,能消灭人体中活性氧,消除自由基,具有良好的营养保健功能[44],外源乙烯可明显提高甘薯的类胡萝卜素含量,且乙烯浓度越高,提升程度越大。
总体而言,外源乙烯处理能显著延迟甘薯发芽时间,促进甘薯淀粉转化,保持块根较高的可溶性固形物、总酚、类黄酮和类胡萝卜素含量,且浓度越高效果越好。0.5 g/L乙烯组与CK组ASA含量、硬度差异不显著;1 g/L乙烯组能维持较高的ASA含量;但2 g/L乙烯浓度会明显降低甘薯ASA含量、硬度,并会导致甘薯块根开裂。综合比较,1 g/L外源乙烯处理组既能达到抑芽的效果又能有效保持甘薯的品质。
[1] 郁志芳,夏志华,陆兆新.鲜切甘薯酶促褐变机理的研究[J].食品科学,2005,26(5):54-59.
[2] 江苏省农业科学院,山东省农业科学院.中国甘薯栽培学[M].上海:上海科学技术出版社,1984:64.
[3] 陈慧芳.甘薯发芽特点及苗床管理[J].陕西农业科学, 2010,56(6):104-106.
[4] 刘红锦,王炜,李鹏霞,等.辐照处理对2种甘薯的保鲜效果[J].江苏农业学报, 2011, 27(1): 160-163.
[5] 邹雪,丁凡,余韩开宗,等.植物源抑芽物质对延长甘薯贮藏期的作用效果[J].核农学报, 2019(3): 530-537.
[6] LEWTHWAITE S L, TRIGGS C M.Sprout suppression in sweetpotato roots following immersion in sodium hypochlorite solutions[J].New Zealand Journal of Crop and Horticultural Science, 1995, 23(3): 283-287.
[7] PATON J E,SCRIVEN F M.Use of NAA to inhibit sprouting in sweet potatoes(Ipomea batatas)[J].Journal of the Science of Food & Agriculture, 2010, 48(4): 421-427.
[8] 忻晓庭.抑芽处理对“心香”甘薯品质的影响[D].杭州:浙江农林大学, 2018.
[9] DANIELS-LAKE B J, PRANGE R K, NOWAK J, et al.Sprout development and processing quality changes in potato tubers stored under ethylene: 1.Effects of ethylene concentration[J].American Journal of Potato Research, 2005, 82(5): 389-397.
[10] SUTTLE J C.Auxin-induced sprout growth inhibition:role of endogenous ethylene[J].American Journal of Potato Research,2003,80(5):303.
[11] DAI H,FU M,YANG X,et al.Ethylene inhibited sprouting of potato tubers by influencing the carbohydrate metabolism pathway[J].Journal of Food Science and Technology,2016,53(8):3 166-3 174.
[12] SHARMA K,ROK LEE Y,PARK S W,et al.Importance of growth hormones and temperature for physiological regulation of dormancy and sprouting in onions[J].Food Reviews International,2016,32(3):233-255.
[13] BUFLER G.Exogenous ethylene inhibits sprout growth in onion bulbs[J].Annals of Botany,2008,103(1):23-28.
[14] CHOPE G A,COOLS K,TERRY L A,et al.Transcriptional analysis suggests sprout suppression of onion during storage using ethylene and/or 1-MCP is mediated via differential modes of action[C]//VI International Symposium on Edible Alliaceae 969,2012:175-182.
[15] 陈曦,邓吉良,陈日东,等.UV-C处理对甘薯贮藏品质的影响[J].热带作物学报, 2019(2): 373-379.
[16] PANKOMERA P.Effects of postharvest treatments on sweetpotato(Ipomoea batatas)storage quality:a thesis presented in partial fulfilment of the requirements[D].New Zealand:Massey University,2015.
[17] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007.
[18] 刘兴华,寇莉苹.果菜瓜贮藏保鲜(北方本)[M].北京:中国农业出版社, 2000: 35.
[19] MILAD R E,SHACKEL K A.Water relations of fruit end cracking in French prune(Prunus domestica L.cv.French)[J].Journal of the American Society for Horticultural Science,1992,117(5):824-828.
[20] 白珅茯雪.贮藏温度和高温灭菌对甘薯的生理代谢及营养品质的影响研究[D].杭州:浙江农林大学,2013.
[21] 朱红,李洪民,张爱君,等.贮藏温度对甘薯呼吸强度的影响[J].江苏农业科学, 2009(4): 299-300.
[22] 程玉娇,秦文霞,赵霞,等.间歇热处理对血橙变温物流保鲜品质的影响[J].食品与发酵工业,2016,42(10): 196-203.
[23] JANIFER R X,BAJPJPAI P K,PHANI K G,et al.Determination of total phenols,free radical scavenging and antibacterial activities of Mentha longifolia Linn.Hudson from the cold desert,Ladakh,India[J].Pharmacognosy Journal,2010,2(12): 470-475.
[24] OGAH O,WATKINS C S,UBI B E,et al.Phenolic compounds in Rosaceae fruit and nut crops[J].Journal of Agricultural and Food Chemistry,2014,62(39):9 369-9 386.
[25] 陈晶晶,段雅婕,莫亿伟,等.裂果性不同的番荔枝品种果皮中细胞壁代谢相关基因的表达分析[J].果树学报, 2015, 32(5):769-776.
[26] 郑莉荔,张震宇,田多嫁,等.植物及植物生理学[M].北京:农业出版社, 1980: 226-227.
[27] 张春云,周会玲,张维,等.热处理对红富士苹果虎皮病和贮藏效果的影响[J].西北农林科技大学学报(自然科学版), 2013, 41(6): 117-123;132.
[28] 吕双双.钙调控乙烯诱导网纹甜瓜果实软化效果及其作用机制研究[D].沈阳:沈阳农业大学, 2009.
[29] 金志强.香蕉果实生长发育的生理学与分子生物学[M].北京:中国农业大学出版社, 2006: 31.
[30] 代红飞.外源乙烯对马铃薯抑芽机制的研究及加工品质的影响[D].济南:齐鲁工业大学,2016
[31] 连喜军,李洁,王咳,等.不同品种甘薯常温贮藏期间呼吸强度变化规律[J].郑州:农业工程学报,2009,25(6):310-313.
[32] 李建中,张学林.古今农事(科普通鉴11)[M].河南科技出版社, 2013.
[33] 石小玉,谢国芳,王先彬,等.外源乙烯对“贵长”猕猴桃货架品质的影响[J].食品工业,2018,39(6):74-76.
[34] ITAI A,TANAHASHI T.Inhibition of sucrose loss during cold storage in Japanese pear(Pyrus pyrifolia Nakai)by 1-MCP[J].Postharvest Biol.Technol.,2008,48(3):355-363.
[35] 柳洪鹃,史春余,张海峰.甘薯贮藏过程中营养品质变化及生理机制研究进展[J].山东农业大学学报,2012,43(1):159-162.
[36] MURKUTE A A,ANANDHAN S.Onion quality affected by ethanol and ethephon during storage[J].National Academy Science Letters,2016,39(3):163-169.
[37] DOWNES K,CHOPE G A,TERRY L A.Postharvest application of ethylene and 1-methylcyclopropene either before or after curing affects onion(Allium cepa L.)bulb quality during long term cold storage[J].Postharvest Biology and Technology,2010,55(1): 36-44.
[38] JU Z,BRAMLAGE W J.Cuticular phenolics and scald development in delicious' apples[J].Journal of the American Society for Horticultural Science,2000,125(4):498-504.
[39] SDIRI S,NAVARRO P,MONTERDE A,et al.Effect of postharvest degreening followed by a cold-quarantine treatment on vitamin C, phenolic compounds and antioxidant activity of early-season citrus fruit[J].Postharvest Biology and Technology,2012,65:13-21.
[40] 周郑坤,郑元林.甘薯营养价值与保健功能的再认识[J].江苏师范大学学报(自然科学版),2016,34(4):16-19;87.
[41] 曲文颖,刘真真,谢琳淼,等.外源脱落酸和乙烯利对蓝莓重要品质的调控[J].江苏农业科学,2017,45(17): 126-129.
[42] AKRAM N A,SHAFIQ F,ASHRAF M.Ascorbic acid-a potential oxidant scavenger and its role in plant development and abiotic stress tolerance[J].Frontiers in Plant Science,2017,8:613.
[43] 林婕.甘薯贮藏保鲜及抗冷性技术研究[D].福州:福建农林大学, 2016.
[44] 柳洪鹃,史春余,张海峰.甘薯贮藏过程中营养品质变化及生理机制研究进展[J].山东农业大学学报,2012,43(1):159-162.