地参俗称虫草参、银条菜、瓜儿苗,为唇形科植物毛叶地瓜苗(Lycopus lucidus Turcz.var.hirtus Regel)的干燥根茎,是一种传统的药食兼用佳品[1-2]。地参含有丰富的多糖类、萜类与甾体、酚酸类、黄酮类、挥发油等化合物[3-6],其中地参多糖因具有抗氧化[7]、抗肿瘤[8]、免疫调节[6,9]、降血糖[10]等生物活性而备受关注。
地参在我国分布较为广泛,主要产区包括云南、重庆、山东、四川、陕西、河北及东北等地[11]。目前有关地参多糖的研究多集中于总多糖的提取工艺优化[12-14]及其生物活性[7-10]方面,但是对地参多糖整体的单糖组成分析及深入研究鲜见报道。而植物多糖的生物活性与其单糖组成、比例等密切相关[15-18]。本研究采用1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone, PMP)柱前衍生化法[19-22],即单醛糖在碱性条件下,与PMP相结合生成具有紫外吸收的化合物,建立高效液相色谱仪-二极管阵列检测器(high performance liquid chromatography-photo diode array, HPLC-PDA)检测地参单糖组成的方法,并通过主成分分析对不同产地的地参样品中单糖进行差异分析,旨在为地参多糖的研究提供参考。
1 材料与方法
1.1 材料与试剂
地参采自或委托采集于云南、重庆、广西、江苏、山东等地参栽培基地(表4),鉴定为唇形科植物毛叶地瓜苗(Lycopus lucidus Turcz.var.hirtus Regel)的干燥根茎。
D-甘露糖、鼠李糖、葡萄糖醛酸、D-半乳糖、阿拉伯糖、岩藻糖标准品(批号分别为:DST170307-047、DST190315-033、DST1180427-567、DST190312-063、DST190304-011、DST180427-565,纯度均≥98%以上),成都德思特生物技术有限公司;半乳糖醛酸标准品(批号:111646-200301,纯度≥98%以上),中国食品药品检定研究院;D-无水葡萄糖标准品(批号:Must-3122601,纯度≥98%以上),成都曼思特生物科技有限公司。
石油醚(60~90 ℃)、无水乙醇、正丁醇、三氯甲烷、三氟乙酸(TFA)、HCl、NaOH、PMP、NaH2PO4、Na2HPO4均为分析纯,成都科龙化学品有限公司;色谱纯乙腈,迪马科技公司。
1.2 仪器与设备
LC-20AT型高效液相色谱仪(配二极管阵列检测器PDA),日本岛津公司;Milli-Q Advantage A10型超纯水机(电阻率≥18.2 MΩ·cm),美国Millipore公司;Sigma 4-16S型与Sigma 3-30KS型高速离心机,德国Sigma公司;IKA MS3型涡旋混合器,德国IKA公司;Sartorius SQP电子分析天平(精密度为0.01 mg),德国Sartorius公司;KH-2000DB型超声波清洗机(功率2 000 W,频率40 kHz),昆山禾创超声仪器有限公司;DZKW-S-6型电热恒温水浴锅,北京市永光明医疗仪器有限公司;BPG-9240A型精密鼓风干燥箱,上海一恒科学仪器有限公司。
1.3 实验方法
1.3.1 对照品溶液的制备
分别称取D-甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、D-无水葡萄糖、D-半乳糖、阿拉伯糖、岩藻糖8种单糖对照品适量,用水溶解制得质量浓度分别为0.672 2、1.330 8、0.834 0、0.568 0、2.071 7、2.039 4、0.514 5、0.576 2 mg/mL的对照品储备液,并逐级稀释成不同质量浓度的混合对照品溶液。
1.3.2 样品溶液的制备
1.3.2.1 地参多糖的提取[12-14]
地参样品经50 ℃干燥,粉碎过35目筛,备用。
脱脂:取一定量的地参粉末,加入适量石油醚(60~90 ℃),在60 ℃水浴中回流1.5 h脱脂,挥干溶剂。
提取:准确称取1 g(精确至0.000 1 g)脱脂后的样品于50 mL离心管中,加入10 mL 80 ℃蒸馏水超声提取(功率300 W,频率40 kHz),30 min取出放至室温,加入Sevage试剂[V(正丁醇)∶V(三氯甲烷)=1∶5]10 mL,涡旋2 min,4 000 r/min离心5 min,取上清液于锥形瓶中,加水10 mL,重复操作2次,合并上清液,加入5倍体积的无水乙醇,摇匀。于4 ℃条件下静置24 h,离心,弃去上清液,用无水乙醇洗涤沉淀2次,除掉单糖及低聚糖成分,水浴挥干无水乙醇,用水将沉淀溶解并转移至10 mL容量瓶中,定容至刻度,摇匀,制得地参多糖溶液,备用。
1.3.2.2 地参多糖的水解
取上述地参多糖溶液1.0 mL于顶空瓶中,加入2.0 mol/L三氟乙酸溶液2.0 mL,迅速密封。110 ℃条件下水解5 h,取出,冷却至室温,用5 mol/L NaOH溶液调节pH至7.0,转移至5 mL容量瓶中并定容至刻度,摇匀备用。
1.3.2.3 地参单糖的衍生
分别取1.3.1的单糖混合标准溶液及1.3.2.2中的地参多糖水解溶液200 μL于10 mL离心管中,加入0.5 mol/L NaOH溶液200 μL,混匀,再加入0.5 mol/L PMP甲醇溶液500 μL,混匀,在70 ℃水浴条件下衍生1 h,取出,冷却至室温,加入0.5 mol/L HCl溶液200 μL,混匀,加入三氯甲烷1.0 mL,涡旋1 min,8 000 r/min冷冻离心5 min,弃去下层液,重复3次,除掉多余的PMP溶液,取上清液定容至2 mL,用0.22 μm微孔滤膜过滤,即得。
1.3.3 色谱条件[19-20,22]
色谱柱:资生堂CAPCELL PAK C18柱(4.6 mm×250 mm,5 μm);检测波长249 nm;柱温30 ℃;进样量10 μL;流速1.0 mL/min;流动相:A为乙腈,B为0.1 mol/L磷酸盐缓冲溶液(pH 6.75),梯度洗脱程序如表1所示。
表1 单糖衍生物的梯度洗脱程序
Table 1 Gradient elution procedure for monosaccharide derivatives

时间/min流动相A/%流动相B/%0178328178340307045307045.11783501783
1.3.4 地参多糖水解条件的单因素实验
1.3.4.1 三氟乙酸浓度的考察
分别取1.0 mL多糖水溶液(S1)于5个顶空瓶中,平行3份,分别加入2.0 mL浓度为1.0、1.5、2.0、2.5、3.0 mol/L的三氟乙酸溶液,110 ℃水解5 h,以水解后的葡萄糖、半乳糖含量以及单糖总含量考察三氟乙酸溶液浓度的影响。
1.3.4.2 水解温度的考察
分别取1.0 mL多糖水溶液(S1)于5个顶空瓶中,平行3份,加入2 mol/L三氟乙酸溶液2.0 mL,分别在80、90、100、110、120 ℃水解5 h,以水解后的葡萄糖、半乳糖含量以及单糖总含量考察水解温度的影响。
1.3.4.3 水解时间的考察
分别取1.0 mL多糖水溶液(S1)于5个顶空瓶中,平行3份,加入2 mol/L三氟乙酸溶液2.0 mL,于110 ℃下分别水解3、4、5、6、7 h,以水解后的葡萄糖、半乳糖含量以及单糖总含量考察水解时间的影响。
1.3.5 数据处理
采用Microsoft Excel 2007软件和SPSS 22.0软件对数据进行处理。
2 结果与分析
2.1 流动相体系的选择
参考文献[19-20,22],流动相体系主要为磷酸盐缓冲液-乙腈反相等度洗脱。本试验采用V(0.1 mol/L磷酸盐缓冲液)∶V(乙腈)=83∶17等梯度洗脱时,8种单糖衍生物均能够很好的分离,但是分析时间长达65 min。提高乙腈比例可以有效缩短分析时间,但是会造成鼠李糖和葡萄糖醛酸分离度不够,故本试验采用梯度洗脱,既能达到良好的分离度,同时缩短分析时间,目标物在45 min出峰完成。在优化后的色谱条件下对标准品和样品进行测定,结果见图1。
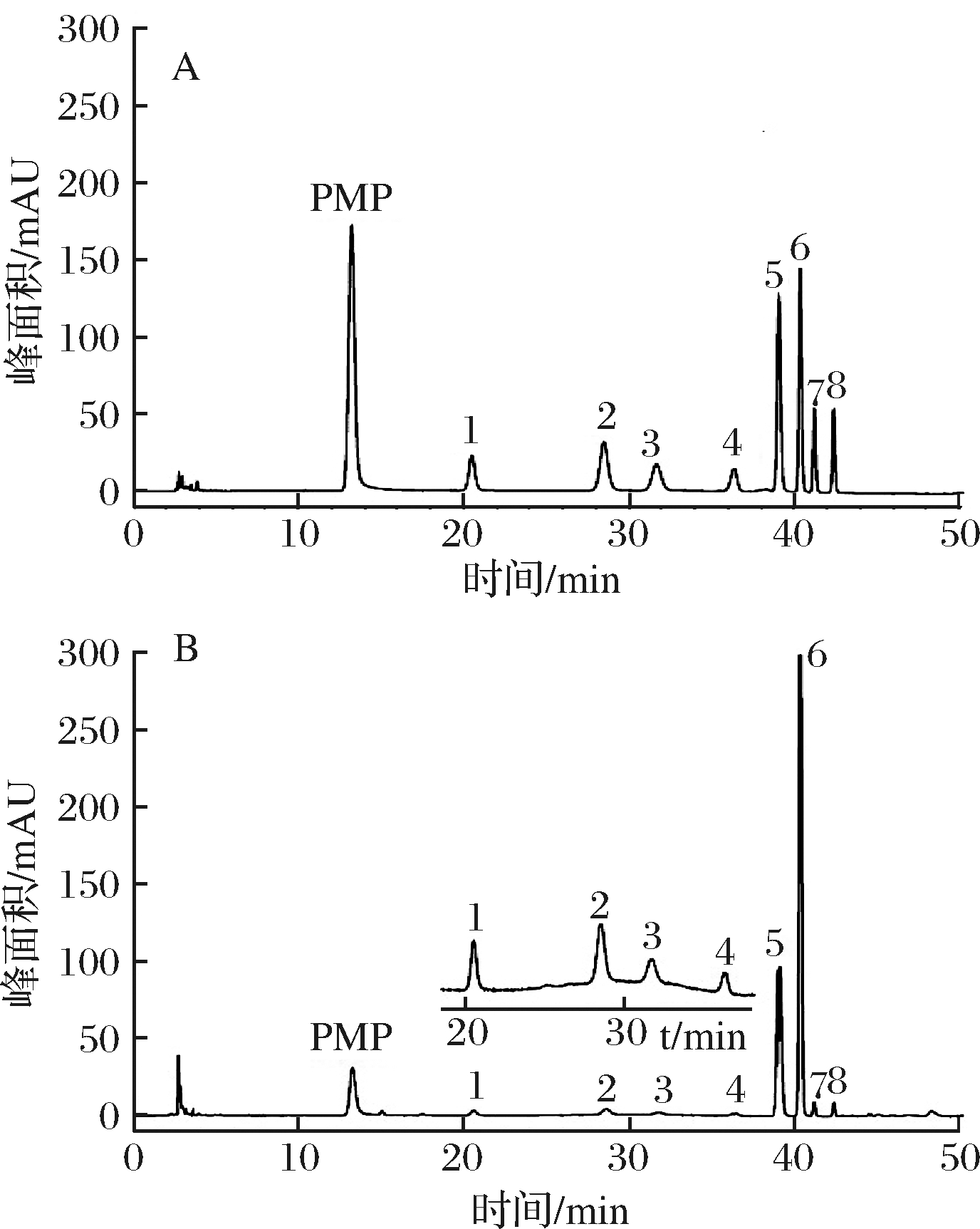
1-甘露糖;2-鼠李糖;3-葡萄糖醛酸;4-半乳糖醛酸;5-葡萄糖;6-半乳糖;7-阿拉伯糖;8-岩藻糖
图1 八种单糖对照品(A)与样品(B)的色谱图
Fig.1 The HPLC spectra of monosaccharides
2.2 地参多糖水解条件的确定
2.2.1 三氟乙酸浓度对地参多糖水解的影响
由图2可知,随着三氟乙酸浓度的增大,地参多糖水解能力增强,相应的单糖含量增多,当浓度大于2.0 mol/L时,单糖含量略有下降趋势,这可能与多糖在高浓度酸的条件下发生水解逆反应有关,故本实验选择三氟乙酸的浓度为2.0 mol/L。
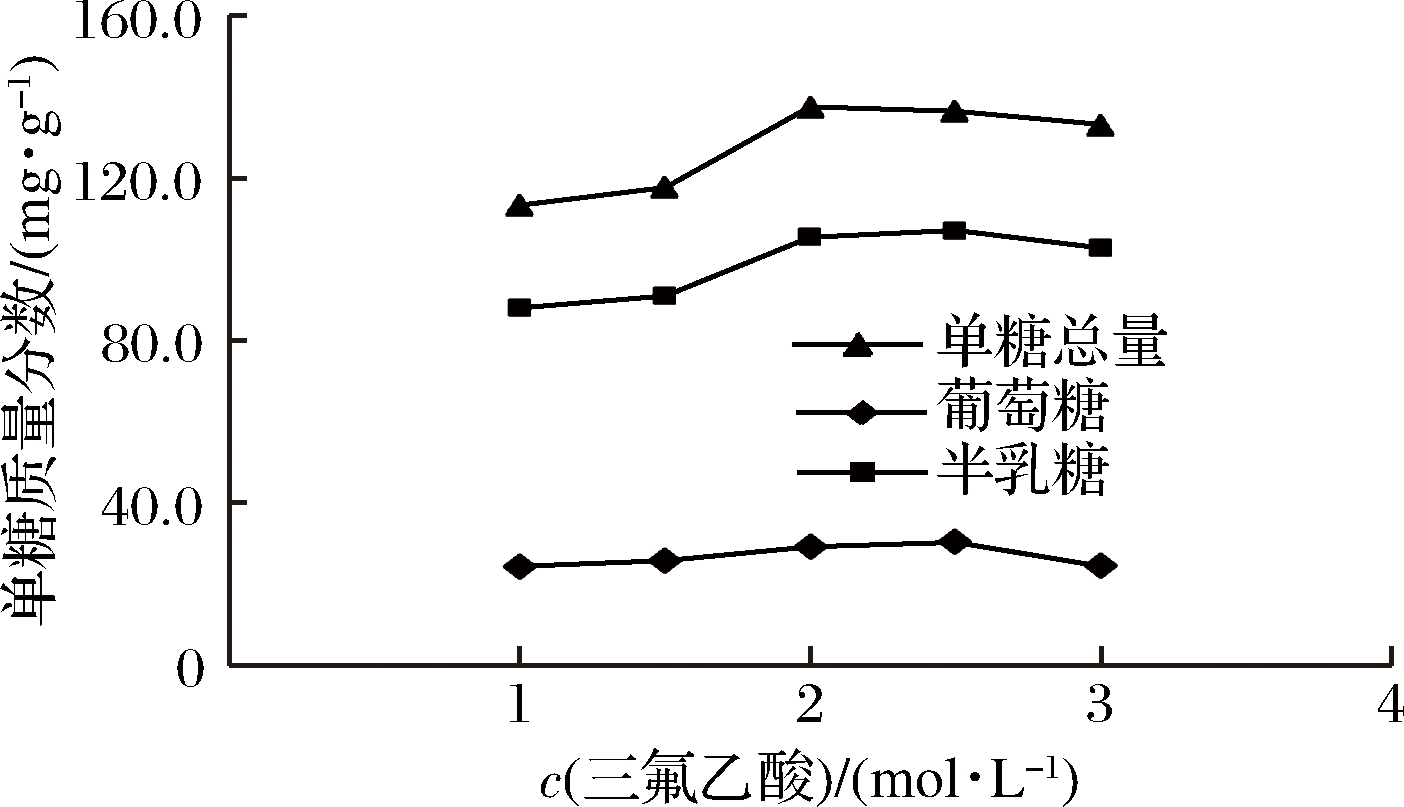
图2 三氟乙酸浓度对地参多糖水解的影响
Fig.2 Effects of TFA concentration on polysaccharide hydrolysis
2.2.2 水解温度对地参多糖水解的影响
由图3可知,随着水解温度的升高,地参多糖糖苷键水解成单糖的速率加快,温度在110 ℃后单糖含量基本稳定,表明地参多糖已经水解完全,故本方法确定水解温度为110 ℃。
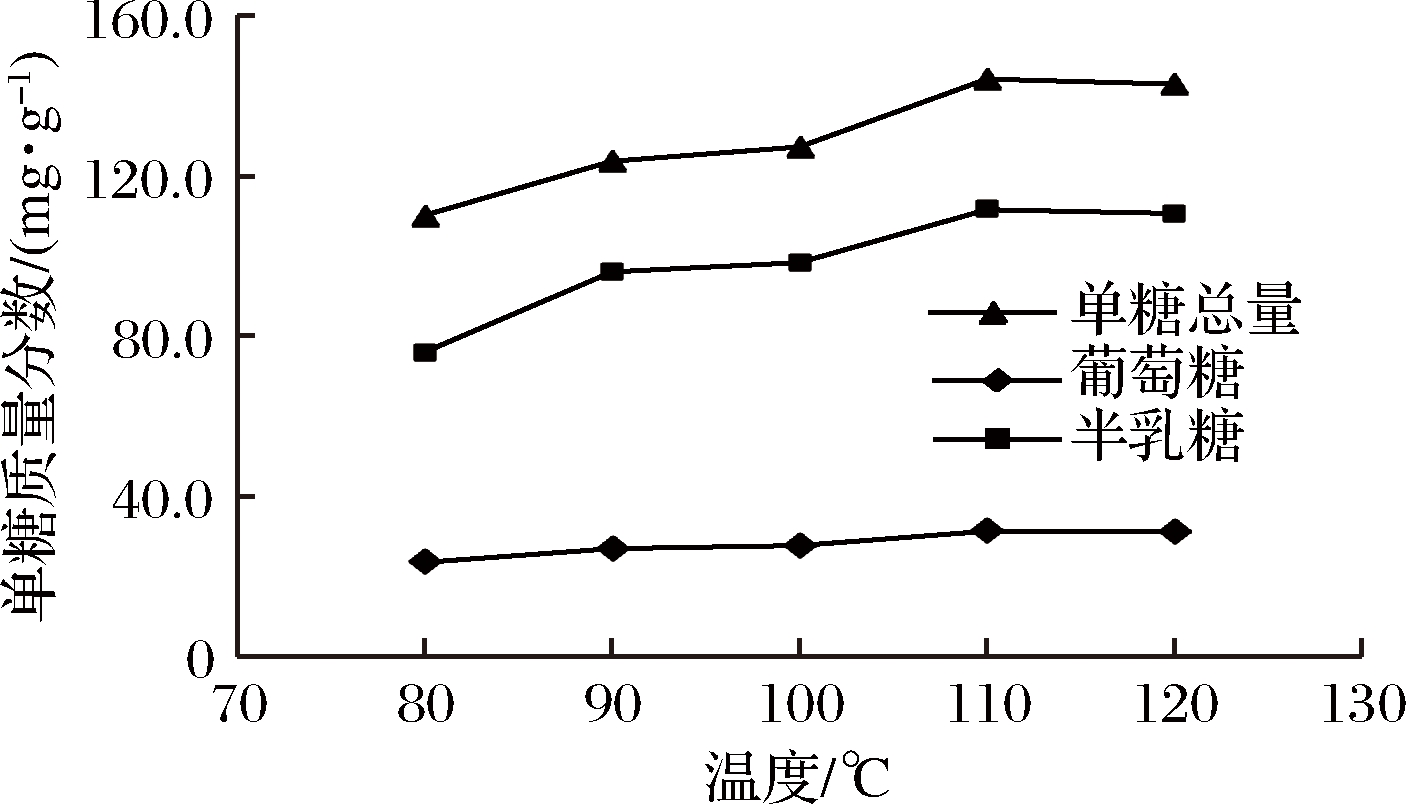
图3 水解温度对地参多糖水解的影响
Fig.3 Effects of temperature on polysaccharide hydrolysis
2.2.3 水解时间对地参多糖水解的影响
由图4可知,随着水解时间的延长,地参多糖水解效率提高,在5 h内达到峰值随后趋于稳定,表明地参多糖已经水解完全,为了缩短分析时间、节约能源,本实验确定水解时间为5 h。
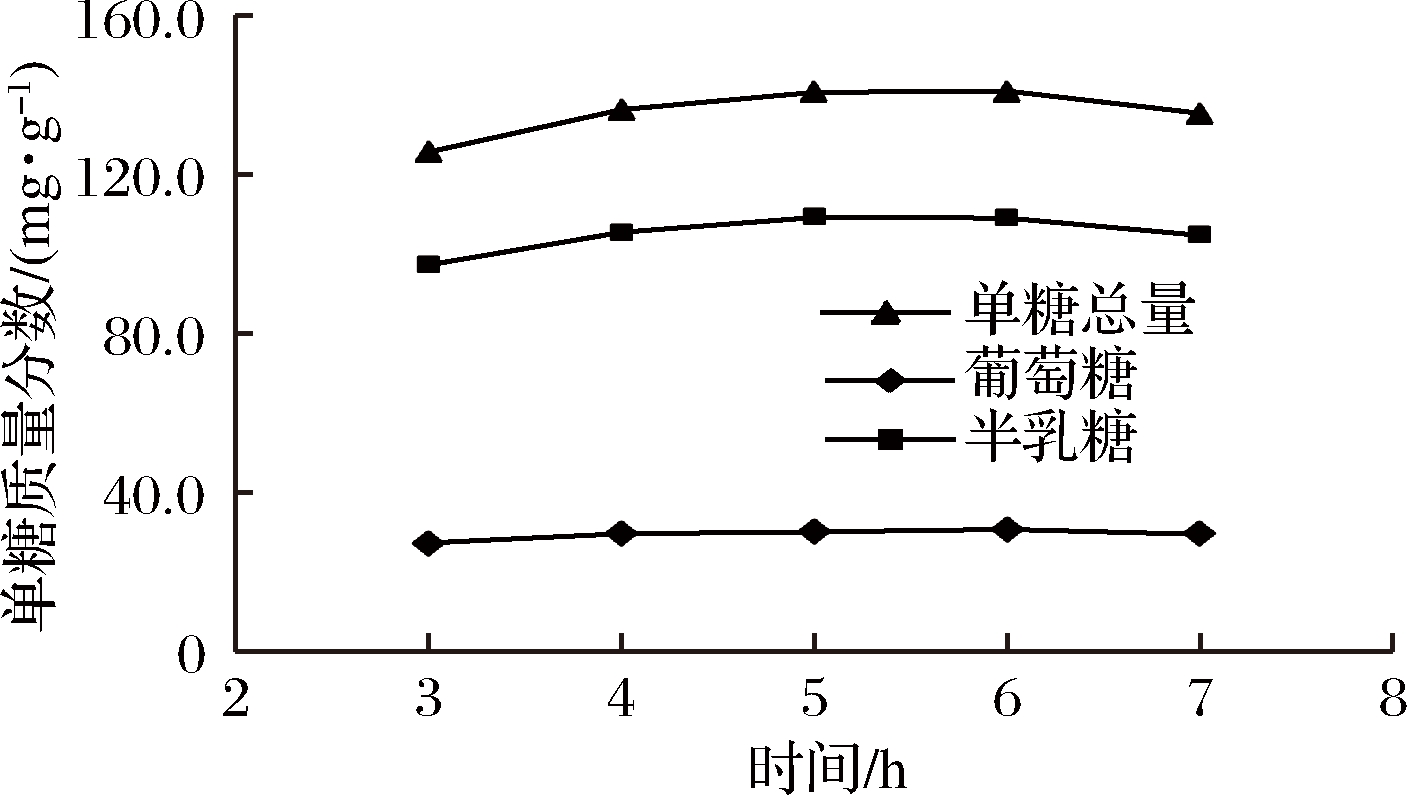
图4 水解时间对地参多糖水解的影响
Fig.4 Effects of time on polysaccharide hydrolysis
2.2.4 最佳条件的确定
根据单因素实验结果,地参多糖完全水解最佳条件为:三氟乙酸浓度2.0 mol/L,水解温度110 ℃,水解时间5 h。
2.3 线性关系、检出限的考察
取1.3.1的8种单糖混合标准工作液按照1.3.2.3的步骤进行衍生,以1.3.3的色谱条件依次进样分析,记录色谱峰面积,以各单糖标准品的峰面积(y)与其相应的质量浓度(x)进行线性回归,绘制标准曲线,根据信噪比计算检出限(RS/N=3),结果如表2所示。8种单糖的相关系数均大于0.999 5,表明线性关系良好;8种单糖的检出限范围为0.16~0.85 μg/mL,表明仪器灵敏度高。
2.4 仪器精密度考察
取同一衍生后的标准品溶液按照1.3.3的色谱条件连续进样6次,记录各单糖色谱峰峰面积,并计算相对标准偏差(relative standard deviation, RSD)值。结果表明:甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖、岩藻糖峰面积的RSD值分别为0.50%、0.38%、0.60%、0.56%、1.09%、1.20%、0.37%、0.38%,均小于1.50%,表明仪器精密度良好,可进行样品分析。
表2 八种单糖的标准曲线、线性范围、相关系数和检出限
Table 2 Calibration curve, linear range, correlation coefficient, limit of detection(LOD)of monosaccharides by HPLC

单糖标准曲线方程线性范围/(μg·mL-1)相关系数检出限/(μg·mL-1)甘露糖y=84712x-357591.344~67.2200.99990.51鼠李糖y=80765x-715852.662~133.1000.99990.73葡萄糖醛酸y=80557x-470381.668~83.4000.99990.85半乳糖醛酸y=71527x-300631.136~56.8000.99990.58葡萄糖y=83199x+103764.143~207.2000.99990.26半乳糖y=75470x+68954.079~203.9000.99980.22阿拉伯糖y=112283x-522941.029~51.4500.99950.16岩藻糖y=90764x-117601.152~57.6200.99990.17
2.5 衍生试样稳定性考察
取衍生后的样品溶液(S1),分别在0、2、4、8、12、16、24 h时间点按照1.3.3进样,计算各单糖色谱峰的RSD值。结果表明:甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖、岩藻糖峰面积的RSD值分别为2.81%、1.55%、2.64%、1.90%、0.26%、0.71%、1.92%、2.75%,表明单糖经衍生后生成的物质在24 h内稳定性良好,对进样时间无特殊要求。
2.6 方法重复性考察
精密称取样品(S1)1.0 g,平行6份,按照1.3.2制备样品溶液,并按1.3.3的色谱条件进样测定,记录各单糖色谱峰峰面积,并计算RSD值。结果表明:甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖、岩藻糖峰面积的RSD值分别为2.86%、2.15%、1.17%、2.10%、0.25%、0.68%、1.83%、3.07%,表明该方法的重复性良好,可用于其他地参样品中单糖的组成和含量测定。
2.7 加标回收试验考察
移取制备好的多糖样品溶液(S1)0.50 mL于顶空瓶中,分别加入高、中、低3个水平的混合标准储备液,按照1.3.2.2及1.3.2.3进行水解、衍生化操作,各加标水平平行测定6次,计算回收率及RSD值,见表3。
表3 八种单糖的回收率测定结果(n=6)
Table 3 Recoveries of monosaccharides in spiked sample(n=6)
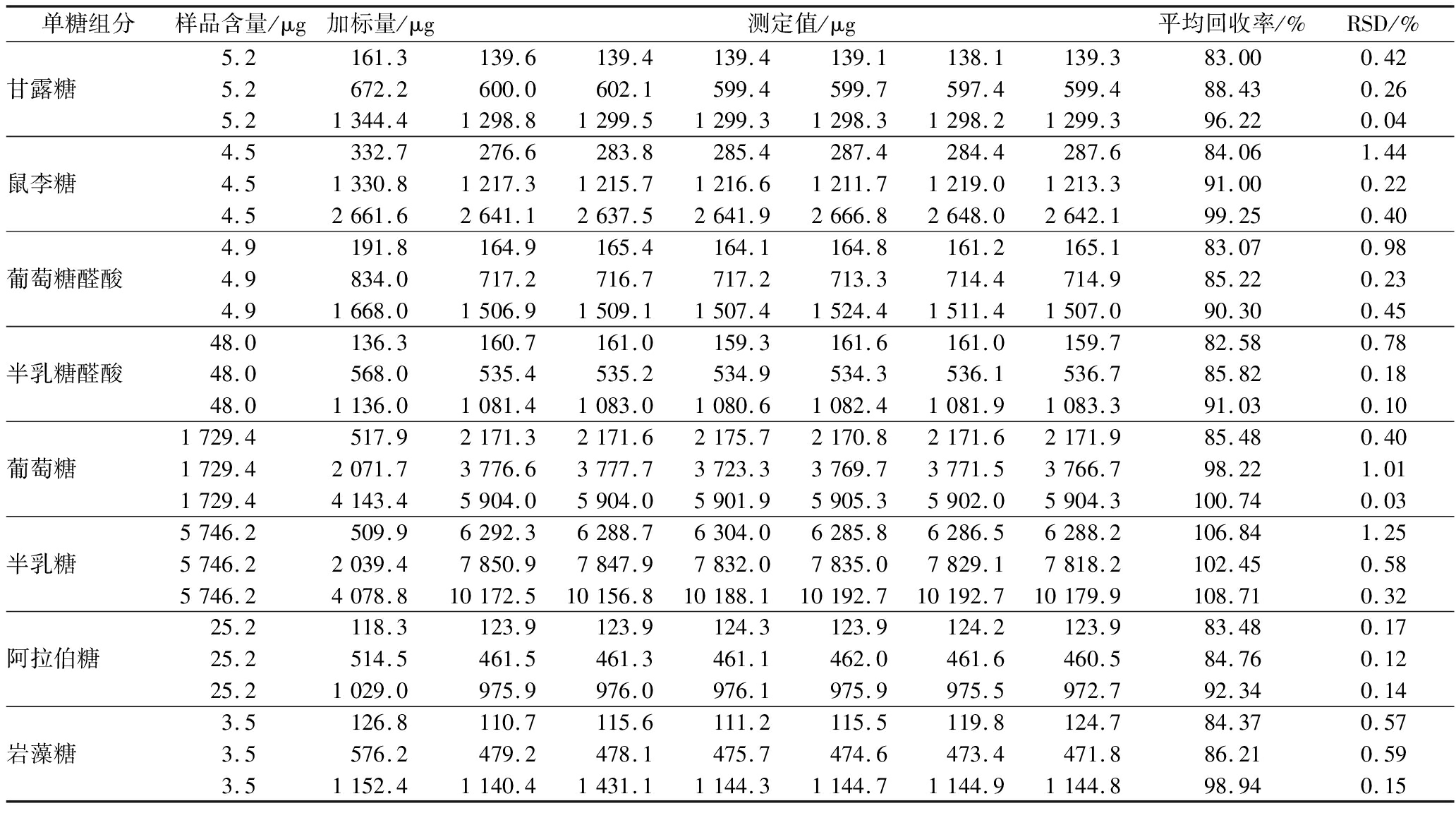
单糖组分样品含量/μg加标量/μg测定值/μg平均回收率/%RSD/%5.2161.3139.6139.4139.4139.1138.1139.383.000.42甘露糖5.2672.2600.0602.1599.4599.7597.4599.488.430.265.21344.41298.81299.51299.31298.31298.21299.396.220.044.5332.7276.6283.8285.4287.4284.4287.684.061.44鼠李糖4.51330.81217.31215.71216.61211.71219.01213.391.000.224.52661.62641.12637.52641.92666.82648.02642.199.250.404.9191.8164.9165.4164.1164.8161.2165.183.070.98葡萄糖醛酸4.9834.0717.2716.7717.2713.3714.4714.985.220.234.91668.01506.91509.11507.41524.41511.41507.090.300.4548.0136.3160.7161.0159.3161.6161.0159.782.580.78半乳糖醛酸48.0568.0535.4535.2534.9534.3536.1536.785.820.1848.01136.01081.41083.01080.61082.41081.91083.391.030.101729.4517.92171.32171.62175.72170.82171.62171.985.480.40葡萄糖1729.42071.73776.63777.73723.33769.73771.53766.798.221.011729.44143.45904.05904.05901.95905.35902.05904.3100.740.035746.2509.96292.36288.76304.06285.86286.56288.2106.841.25半乳糖5746.22039.47850.97847.97832.07835.07829.17818.2102.450.585746.24078.810172.510156.810188.110192.710192.710179.9108.710.3225.2118.3123.9123.9124.3123.9124.2123.983.480.17阿拉伯糖25.2514.5461.5461.3461.1462.0461.6460.584.760.1225.21029.0975.9976.0976.1975.9975.5972.792.340.143.5126.8110.7115.6111.2115.5119.8124.784.370.57岩藻糖3.5576.2479.2478.1475.7474.6473.4471.886.210.593.51152.41140.41431.11144.31144.71144.91144.898.940.15
结果表明8种单糖高、中、低3个水平的平均回收率为82.58%~108.71%,RSD值为0.03%~1.44%,表明该方法的准确性好,精密度高。
2.8 地参多糖的单糖组成及含量
取6个不同产地地参样品按照1.3.2进行制备样品溶液,注入高效液相色谱仪测定其多糖中单糖组成及含量,并计算各单糖组分间物质的量比,结果见表4、表5。地参样品中均含有甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖和岩藻糖8种单糖,但含量上存在一定的差异,甘露糖的含量为0.099~0.230 mg/g,鼠李糖的含量为0.048~0.114 mg/g,葡萄糖醛酸含量为0.052~0.093 mg/g,半乳糖醛酸含量为0.150~1.429 mg/g,葡萄糖含量为26.063~47.666 mg/g,半乳糖含量为98.693~145.308 mg/g,阿拉伯糖含量为0.454~0.566 mg/g,岩藻糖含量为0.099~0.176 mg/g。同时,从表4可以看出地参中半乳糖、葡萄糖的含量较高,为地参单糖的主要成分。由表5可知,8种单糖组分的平均物质的量比为:甘露糖∶鼠李糖∶葡萄糖醛酸∶半乳糖醛酸∶葡萄糖∶半乳糖∶阿拉伯糖∶岩藻糖=1.00∶0.60∶0.54∶5.15∶266.53∶890.11∶4.12∶1.05。
表4 地参多糖的单糖组成及含量![]() 单位:mg/g
单位:mg/g
Table 4 Monosaccharides composition and content of six samples from different areas![]()
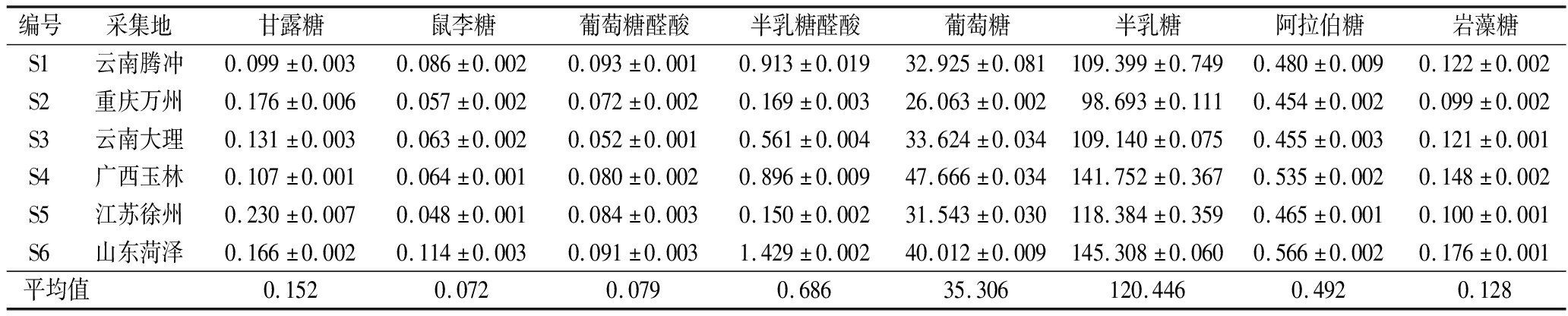
编号采集地甘露糖鼠李糖葡萄糖醛酸半乳糖醛酸葡萄糖半乳糖阿拉伯糖岩藻糖S1云南腾冲0.099±0.0030.086±0.0020.093±0.0010.913±0.01932.925±0.081109.399±0.7490.480±0.0090.122±0.002S2重庆万州0.176±0.0060.057±0.0020.072±0.0020.169±0.00326.063±0.00298.693±0.1110.454±0.0020.099±0.002S3云南大理0.131±0.0030.063±0.0020.052±0.0010.561±0.00433.624±0.034109.140±0.0750.455±0.0030.121±0.001S4广西玉林0.107±0.0010.064±0.0010.080±0.0020.896±0.00947.666±0.034141.752±0.3670.535±0.0020.148±0.002S5江苏徐州0.230±0.0070.048±0.0010.084±0.0030.150±0.00231.543±0.030118.384±0.3590.465±0.0010.100±0.001S6山东菏泽0.166±0.0020.114±0.0030.091±0.0031.429±0.00240.012±0.009145.308±0.0600.566±0.0020.176±0.001平均值0.1520.0720.0790.68635.306120.4460.4920.128
表5 地参多糖中单糖的物质的量比(n=3)
Table 5 Molar ratio of monosaccharides(n=3)
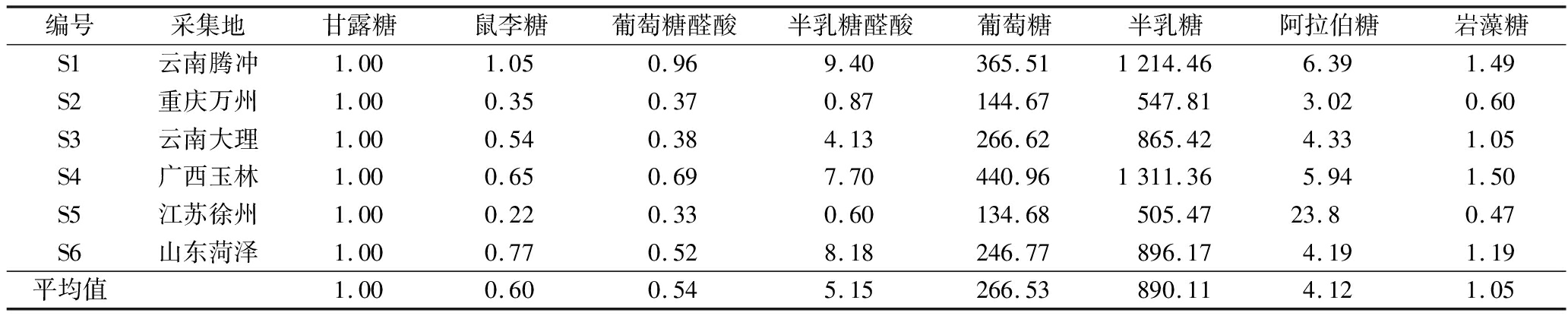
编号采集地甘露糖鼠李糖葡萄糖醛酸半乳糖醛酸葡萄糖半乳糖阿拉伯糖岩藻糖S1云南腾冲1.001.050.969.40365.511214.466.391.49S2重庆万州1.000.350.370.87144.67547.813.020.60S3云南大理1.000.540.384.13266.62865.424.331.05S4广西玉林1.000.650.697.70440.961311.365.941.50S5江苏徐州1.000.220.330.60134.68505.4723.80.47S6山东菏泽1.000.770.528.18246.77896.174.191.19平均值1.000.600.545.15266.53890.114.121.05
2.9 主成分分析
采用SPSS 22.0软件对6个样品的单糖含量进行主成分分析,并对其进行主成分得分计算以及排序,结果见表6、表7。
表6 样品主成份距阵
Table 6 Principal component matrix of samples
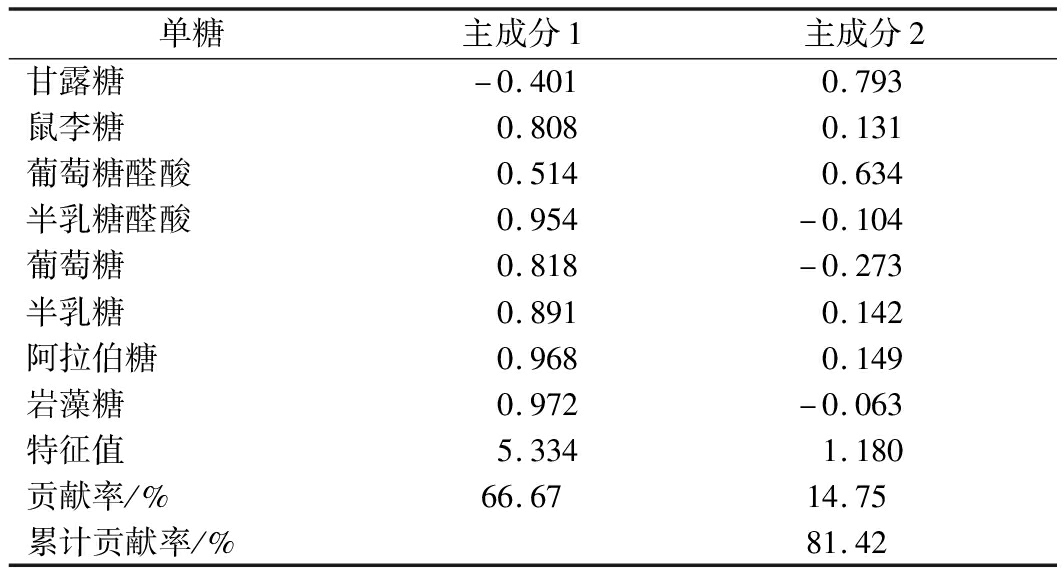
单糖主成分1主成分2甘露糖-0.4010.793鼠李糖0.8080.131葡萄糖醛酸0.5140.634半乳糖醛酸0.954-0.104葡萄糖0.818-0.273半乳糖0.8910.142阿拉伯糖0.9680.149岩藻糖0.972-0.063特征值5.3341.180贡献率/%66.6714.75累计贡献率/%81.42
表7 样品主成分得分、综合得分及其排序
Table 7 Principal component scores, comprehensive scores and ranking

编号采集地PC1排序PC2排序C排序S1云南腾冲-0.0573-0.2034-0.2604S2重庆万州-1.06660.2163-0.8505S3云南大理-0.5604-1.3566-1.9166S4广西玉林0.8262-0.80150.0253S5江苏徐州-0.80151.32410.5232S6山东菏泽1.48510.82022.3051
注:PC1,PC2为主成分得分;C为综合得分
从多糖的8个单糖组分中提取出了2个主成分(特征值>1),主成分1的特征值为5.334,特征贡献率为66.67%;主成分2的特征值为1.180,特征贡献率为14.75%,2个主成分的累积贡献率为81.42%。主成分1中岩藻糖、阿拉伯糖、半乳糖醛酸、半乳糖、葡萄糖和鼠李糖为主要影响因子;主成分2中甘露糖、葡萄糖醛酸为主要影响因子。
根据得分排序来看:相对于主成分1,采自山东菏泽的地参得分最高;相对于对主成分2,采自江苏徐州的地参得分最高;说明采自山东菏泽、江苏徐州单糖成分含量较高。综合得分排序由高到低依次为:山东菏泽、江苏徐州、广西玉林、云南腾冲、重庆万州、云南大理。说明地参单糖含量的高低在我国地域上呈现出北方>南方>西南的趋势,这可能与日照时间、昼夜温差等因素影响了糖分的积累有关[23-24]。
3 结论
不同产地地参多糖均具有相似的单糖组成,即甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖和岩藻糖等,其中半乳糖、葡萄糖为主要成分,但各单糖含量及组成比例有明显差异。因此,基于地参多糖的特征单糖组分分析研究,有助于完善地参的质量控制与开发利用。
本研究建立了水提醇沉法、PMP柱前衍生HPLC法测定地参多糖中8种单糖组成和含量,该方法的灵敏度高、分离效果好,线性范围宽、检出限低,精密度、重复性、稳定性和回收率良好,操作简便,结果稳定可靠,可用于地参样品中多糖的单糖组成分析及定量测定,也可为其他药食同源植物多糖组成研究提供参考。
[1] 湖南省食品药品监督管理局.湖南省中药材标准(2009 年版)[S].长沙: 湖南科学技术出版社, 2010: 57.
[2] 郭琦, 高春燕.硬毛地笋酚类化合物对DNA损伤的保护作用[J].食品科学, 2018, 39(23): 54-59.
[3] 杨保成, 彭涛, 康文艺.地笋属植物化学成分研究进展[J].中国实验方剂学杂志, 2013, 19(4): 346-350.
[4] REN Q, DING L, SUN S S, et al.Chemical identification and quality evaluation of Lycopus lucidus Turcz by UHPLC-Q-TOF-MS and HPLC-MS/MS and hierarchical clustering analysis[J].Biomedical Chromatography Bmc, 2017, 31(5): 3 867-3 869.
[5] LU Y H, HUANG J H, LI Y C, et al.Variation in nutritional compositions, antioxidant activity and microstructure of Lycopus lucidus Turcz.root at different harvest times[J].Food Chemistry, 2015, 183: 91-100.
[6] YANG X B,LV Y,TIAN L M, et al.Composition and systemic immune activity of the polysaccharides from an herbal tea(Lycopus lucidus Turcz)[J].Agriculture And Food Chemistry, 2010, 58: 6 075-6 080.
[7] 王文净, 高春燕.地参多糖抗氧化活性的研究[J].食品研究与开发, 2016, 37(13): 19-22.
[8] 熊伟, 焦扬, 罗永会, 等.地参多糖对实验肿瘤细胞体内外增殖的影响[J].生物加工过程, 2012, 10(4): 64-69.
[9] 熊伟, 谭德勇, 陈贵元, 等.地参多糖对小鼠免疫功能影响的实验研究[J].时珍国医国药, 2011, 22(1): 11-13.
[10] 熊伟, 谭德勇, 陈贵元, 等.地参多糖对正常及实验性糖尿病小鼠血糖的影响实验研究[J].生命科学仪器, 2010, 8(5): 64-66.
[11] 《中华本草》编委会.中华本草(第7卷)[M].上海: 上海科学技术出版社, 1999: 76-77.
[12] 陈贵元, 张翠香, 罗永会, 等.地参多糖的提取工艺研究[J].中国实验方剂学杂志, 2011, 17(21): 38-40.
[13] 吴红燕, 汪思洁, 刘彩琴, 等.地参多糖提取工艺研究[J].浙江树人大学学报(自然科学版), 2016, 16(3): 26-29.
[14] 朱苗, 陈宠, 李刚凤, 等.超声辅助提取地参多糖及其功能性质[J].北方园艺, 2018(14): 123-130.
[15] 郭元亨, 张利军, 曹丽丽, 等.植物多糖中单糖组成分析技术的研究进展[J].食品科学, 2018, 39(1): 326-332.
[16] 芮雯, 李婵艺, 陈宏远.黄芪多糖的结构表征与生物活性研究进展[J].中药新药与临床药理, 2019, 30(2): 264-270.
[17] 宋瑞琦, 南铁贵, 袁媛, 等.不同产地猪苓多糖含量及猪苓多糖中的单糖组成研究[J].中国中药杂志, 2019, 44(17): 3 608-3 614.
[18] 鲍素华, 查学强,郝杰,等.不同分子量铁皮石斛多糖体外抗氧化活性研究[J].食品科学, 2009, 30(21): 123-129.
[19] 王向红, 吉爽爽, 生庆海, 等.柱前衍生高效液相色谱法检测8种枣水溶性多糖的单糖组成[J].中国食品学报, 2014, 14(9): 257-262.
[20] 符梦凡, 赵一帆, 阎卫东.柱前衍生化HPLC法分析枸杞多糖中单糖组成[J].食品科学, 2018, 39(18): 186-191.
[21] 张萍, 陈燕, 尚永辉, 等.柱前衍生高效液相色谱法测定石榴皮多糖的单糖组成[J].分析试验室, 2019, 38(5): 523-528.
[22] 周彦强, 吴光斌, 陈发河.PMP柱前衍生化HPLC法测定黄秋葵多糖的单糖组成[J].食品科学, 2019, 40(4): 266-271.
[23] 刘玉兰.酿酒葡萄的品质指标分析及其与气象条件关系的试验研究[D].南京: 南京信息工程大学, 2006.
[24] 李欢.气象因子对新疆灰枣品质的影响[D].乌鲁木齐: 新疆农业大学, 2015.