肠道是一个极其复杂的生态系统,是1 000万亿厌氧微生物的寄居地。肠道菌群对于维持人体健康具有重要的意义[1]。肠道菌群中的微生物主要由细菌、古细菌、真菌、病毒等构成,具有抵御感染和患病风险的能力,还能控制人体对癌症治疗药物的反应。越来越多的证据表明,丰富的肠道菌群有助于人体吸收和利用食物中的营养物,增强机体免疫系力。
菊粉,又叫果聚糖,菊糖,是由D-呋喃果糖通过β-2,1糖苷键连接而成的一类天然果聚糖的混合物。菊粉作为最好的天然益生元、水溶性膳食纤维双补食品,具有控制血脂、降低血糖、调节肠道微生物菌落等功能,已被世界40多个国家批准为食品的营养增补剂。目前研究人员在菊粉调节肠道菌群的研究上已取得了较大进展,本文结合近年来国内外的研究概况,重点综述菊粉及其调节肠道菌群机制的研究,以期为菊粉的进一步研究与应用提供参考。
1 菊粉概述
1.1 菊粉来源
菊粉是一种天然的多糖,属于膳食纤维,存在于约36 000种植物的球茎和块茎中,在医药和食品工业中具有广泛的应用。菊粉是德国科学家最先从菊花中分离出的一种特殊物质[2],后来被命名为菊粉[3],是自然界中含量第二大的贮藏多糖。菊糖在自然界中的存在广泛,如大丽花(Dahlia pinnata)、蒲公英(Taraxacum officinale)、天冬(Asparagus officinalis)、菊芋(Helianthus tuberosus)、芦笋(Asparagus racemosus)、菊苣(Cichorium intybus)等中均存在[4-5]。在百合科、石蒜科、禾本科和菊科作物中都有几种富含果聚糖的植物种类[6],表1中列出了部分富含菊粉的作物。除上述来源外,其他一些食物,如小麦(Triticum aestivum)(1%~3.8%)、燕麦(Avena sativa L.)、干小麦(bulgur)、黑麦(Secale cereale)、番茄(Solanum lycopersicum)、香蕉(Musa nana Lour.)(0.5%)等,也有菊粉,但数量较少[7]。其他谷草中也有较高的菊粉含量,但它们对工业规模化的生产没有太大用处。在工业规模化生产中,菊粉主要来自于菊苣根和菊芋块茎,其中在菊苣(Cichorium intybus L.)根中的菊粉含量最高(干重65%~79%),且菊粉中果糖∶葡萄糖比值也较高。
表1 几种植物不同部位菊粉含量
Table 1 Statistics of inulin content in different parts of different plant sources

序号来源植物学名称部位菊粉含量/%参考文献1大蒜Alliumsativum鳞茎湿重12.5~23.5,干重75[8]2生芦笋Asparagusofficinalis根2~3[9]3龙须草TragopogonporrifoliusL.根4~11[10]4菊芋HelianthustuberosusL.块茎8.16~13.46[11]5大丽花Dahliapinnata块茎湿重6~9.5,干重59[12-13]6菊苣CichoriumintybusL.根干重65~79[10,13-14]7雪莲果Smallanthussonchifolius根7~8[15]8洋葱AlliumcepaL.块茎湿重1.1~7.5,干重48[9,13]
1.2 菊粉理化性质和结构
菊粉的理化性质包括颜色、气味、味道、稳定性、物理状态、溶解度、黏度等。菊粉的凝胶强度取决于多种因素,如来源(天然/合成)、化学组成、链长、聚合度等。首先菊粉由31个β-D-呋喃果糖和1~2个吡喃菊糖残基聚合而成,果糖残基之间能通过β-2,1-键连接。菊粉是由D-果糖(D-fructose, F)经β(1→2)糖苷键链接而成的线性直链多糖,末端常带有一个葡萄糖(glucose, G)残基,聚合度(degree of polymerization, DP)为2~60(图1)。

图1 菊粉的分子结构
Fig.1 Molecular structure of inulin
菊粉是由果糖经β-1,2链连接而成的线性直链多糖,根据聚合度的不同,菊粉型果聚糖可分为低聚果糖(DP≤10)和菊粉(DP>10)。由于菊粉结构中存在β-连锁结构,不能被人的唾液和肠胰消化酶消化或水解。因此,菊粉可被结肠细菌选择性地在结肠/肠内发酵/代谢,其代谢形式为CO2和CH4。表2显示了菊粉的一些常见物理化学性质。
表2 菊粉理化性质
Table 2 Physicochemical properties of inulin

理化性质菊粉标准状态固体粉末化学结构GFn(2≤n≤60)类型晶态或非晶态颜色淡黄色至白色气味无气味味道甜pH微酸性-中性在298.15K水中溶解度12g/L稳定性室温下稳定耐热性高热稳定ω(菊粉)=5%时在10℃水中的黏度1.6mP·s
1.3 菊粉的聚合度及其作用
菊粉已被欧盟公认为天然食品成分。菊粉的聚合度为20~60个果糖单元。从植物中提取的菊粉DP(DP<200)比细菌菊粉低(DP<10 000)。菊粉的DP与植物种类、生理年龄、气候条件、成熟度等有关[5]。富含菊粉的植物在储存过程中导致DP降低,这是由于高分子量菊粉部分解聚的结果。菊粉的DP还影响其热值、益生元活性、消化率、水结合能力、甜味等。此外,DP还决定菊粉在水中的溶解度,一般短链低聚物的溶解度大于长链聚合物。不同链长的聚合物在工业中有不同的利用。例如在食品加工工业中,通常将短链菊粉适当地溶解,用来制备凝胶,这对于保持产品的体积和质地是非常重要的。然而,在制药工业中通常采用结晶形式的长链菊粉,这是因为此种形式的菊粉在作为疫苗的水中具有较低溶解度。
1.4 菊粉合成、分离及提取工艺
在植物细胞中利用蔗糖:蔗糖1-果糖基转移酶(1-SST)合成菊粉,基本原理是它催化一个蔗糖分子上的果糖基转移到另一个蔗糖分子上而形成一个果聚三糖(1-蔗果三糖)和一个葡萄糖分子,从而开始果聚糖的合成,该酶在高浓度蔗糖(6%~15%)中活性较高。另一种酶,果聚糖:果聚糖1-果糖基转移酶(1-FFT)利用所形成的三糖类由SST将果糖从一个蔗糖部分转移到主要的羟基上,在三糖类的果糖分子的C1处通过亚甲基连接到异常碳,或另一种低聚糖。这导致链伸长,果聚糖聚合物将菊粉作为主要终产物释放。而在细菌和真菌的情况下,菊粉的合成是通过将蔗糖的附加果糖分子转移到蔗糖酶或转移到左旋蔗糖酶。这些来源的菊粉通常具有非常高的DP,植物中的菊粉生物合成还可以通过代谢工程或酶工程改进以提高通路效率。
近年来,菊粉的提取、分离、纯化和特性得到了很大的关注。目前市场上已经有许多成熟的提高菊粉纯度的生产工艺和方法。本文以从菊苣根中分离菊粉为例,其过程包括3个基本步骤:(1)提取;(2)分离纯化化合物(纯化);(3)干燥。在提取过程中,用自来水将磨碎的菊苣根洗净,放入温水中,提取出含菊粉的亲水性物质。值得提出的是,在提取过程中培养基的pH值、煮沸温度、培养时间、水的量等因素都会影响提取液中菊粉的含量。第二步超滤、结晶、沉淀、离心、分离等纯化工艺的选择决定了萃取的菊粉的聚合度和分子量,直接关系到菊粉在各种溶剂中的溶解度。从菊苣根中提取的菊粉具有较低的DP(<20),较易于分离且亲水性较强。第三步是喷雾干燥。根据纯菊粉的微观结构和菊粉溶液的流变行为,需要对溶液的温度、进气压力、给水泵转速等参数进行优化。ZEAITER等[16]对洋蓟废料中菊粉型果聚糖的提取进行了研究,该研究为制备长链菊粉型果聚糖提供了一种较简单的方法,并将菊芋菊粉与不同的乳酸菌和双歧杆菌结合制备益生菌制剂,以供后续体外肠道模拟模型和体内试验研究。
2 菊粉对宿主肠道菌群的调节机制
2.1 菊粉通过调节抗氧化性调控宿主肠道菌群
在最近的研究中发现,添加菊粉可以增加产蛋母鸡血清总抗氧化能力(total antioxidant capacity, T-AOC)和降低丙二醛浓度[17]。SHANG等[18]研究了蛋鸡日粮中添加菊粉对冷藏鸡蛋抗氧化能力的影响,结果表明,蛋鸡日粮中添加菊粉能够延长鸡蛋保质期。NOOSHKAM等[19]通过美拉德反应研究了壳聚糖-菊粉缀合物的抗氧化潜力和抗微生物活性,结果表明,高双壳聚糖和菊粉的结合物比壳聚糖和其他共轭组分具有更高的抗氧化性能。此外,在低pH值下得到的共轭物比在高pH条件下制备的共轭物具有更强的抗菌活性。今后壳聚糖-菊粉结合物可作为新型的抗氧化剂和抗菌性益生元成分应用于食品中。
2.2 菊粉通过调节微生物群落改善宿主肠道菌群
据报道,菊糖摄取与排便频率的显著增加相关,这表明菊粉对人体肠道微生物区系组成有潜在影响,因此了解菊粉对人体肠道微生物群的影响是了解其作用机制的关键[20]。WANG等[21]研究表明,由肠道微生物发酵的含有低聚果糖、菊粉和菊粉型果聚糖的不可消化碳水化合物可以调节肠道菌群,并具有缓解非酒精性脂肪性肝病的作用;OLIVEIRA等[22]通过用16s rRNA扩增产物的高通量测序手段研究发现,没有喂食纤维素、果胶和菊粉的小鼠会出现更严重的感染隐孢子虫病,且小鼠粪便微生物区系的特征是细菌相对丰度较低。LI等[23]对从党参中提取的3种菊粉类型果糖的益生活性进行了研究,结果表明,浓度为2.0 g/L的3种果糖对长双歧杆菌具有明显的促生长作用(P<0.01),党参中菊粉型果糖具有潜在的益生作用。BERALDI等[24]研究了益生菌球蛋白是否调节了高脂饮食小鼠的细菌数量和结肠神经元丢失,结果表明在瑞士小鼠中,虽然由于高脂饮食导致了小鼠神经元丢失,但并没有改变其肠道微生物的主要群体结构,这表明尽管有益细菌的增加,其他与饮食脂肪摄入过多直接相关的因素会影响肠道神经系统。高脂饮食的情况下,小鼠肠道菌群发生明显改变,粪便菌群代谢组发生明显改变,菊粉喂食的小鼠体重、血糖、血脂的改变均不明显,但对小鼠肠道菌群及代谢产物的影响却十分显著[25]。SASAKI等[26]采用菊粉喂养长时间禁食的小鼠,研究了小鼠体内微生物组成的变化。结果表明,在早晨喂食菊粉的小鼠其盲肠内pH值降低,短链脂肪酸增加,且盲肠内的微生物菌群结构发生了改变。肠道菌群与宿主之间的共生关系赋予健康个体代谢、免疫和肠道保护功能。这种相互作用在很大程度上取决于营养状况和生活习惯等因素。因此,肠道微生物的代谢活性会对宿主健康产生重要影响,可能是有益的,也可能是有害的。
2.3 菊粉通过抗炎调节宿主肠道菌群
研究发现,肥胖、糖尿病等脂质代谢紊乱相关疾病是慢性低度炎症反应,这种炎症状态能够诱导并促进疾病的发生和发展。食用纤维的摄入与健康和患病成人的全身炎症降低有关,在哮喘患者的食物中补充可溶性纤维可降低全身炎症并改善肺的功能。研究发现,使用单剂量的可溶性纤维(3.5 g菊粉),可使哮喘成人的气道炎症明显减少且改善肺功能和气道高反应性。MCLOUGHLIN等[27]研究了补充可溶性纤维(含和不含益生菌)对哮喘成人血浆短链脂肪酸、气道炎症、哮喘控制和肠道微生物的影响。结果表明,补充菊粉后气道炎症、哮喘控制和肠道微生物组合物得到有效的改善。CAI等[28]采用复合多糖进行了通过调节肠道微生物组成和功能进而改善实验性结肠炎的研究,结果表明,复合多糖可减轻2,4,6-三硝基苯磺酸诱导的大鼠实验性结肠炎模型的炎症反应,改善实验性结肠炎。有学者对结肠炎动物的组织学和生化参数进行了分析,结果表明,益生菌具有抗炎作用。益生菌补充剂可增加双歧杆菌或乳酸菌的数量,并在某些研究中增加肠道中丁酸的浓度[29-31]。XUE等[32]利用菊粉和二甲双胍对小鼠多囊卵巢综合征的治疗进行了实验研究,结果表明菊粉和二甲双胍通过抗炎和调节肠道微生物来减轻多囊卵巢综合征,这可能有助于该疾病的潜在临床治疗。VALCHEVA等[33]研究了利用菊粉型果聚糖改善与微生物群相关的活性溃烂性结肠炎,在溃疡性结肠炎中,15 g/d剂量的菊粉型果糖能使肠道微生物的功能发生转变,但不能改变肠道微生物的成分,揭示了肠道微生物菌群结构的改变与组分改变相比对溃疡性结肠炎的益处更佳。菊粉通过调节植物的营养功能,对炎症性肠病的预防有积极的作用。菊粉通过诱导结肠产生短链脂肪酸促进本地乳杆菌和(或)双歧杆菌的生长,这些特性与降低黏膜损伤和减轻黏膜炎症有关[34]。GUO等[35]的研究表明,菊粉可减轻炎症状态,结合多酚芦丁和多糖菊粉作为一种饮食策略,以改善肠道失调,改善炎症状态,从而减少由于高脂饮食引起的肥胖相关的医学疾病。LI等[36]的研究表明,饮食中的菊粉通过抑制炎症和调节肠道微生物来减轻2型糖尿病不同阶段的症状。因此在有条件的情况下,可以通过在每日饮食中增加适量益生菌来调节身体炎症,降低抗菌药的滥用,尤其是随着年龄的增长,肠道中的有益菌随之减少,今后是否可以对高龄老人预防性使用益生菌以抑制相关身体炎症的发生发展还有待进一步讨论。
2.4 菊粉通过基因调控调节宿主肠道菌群
通过服用菊粉可部分减轻由于部分基因缺失引起的肠道炎症。KADEN-VOLYNETS等[37]研究表明,通过口服菊粉或丁酸可部分减轻caspase-8基因敲除小鼠的回肠结肠炎、屏障功能障碍和消化不良等症状。SONG等[38]报道了益生素对转基因肥胖小鼠盲肠转录组的影响,研究发现,添加菊粉后,盲肠组织中的AMPK信号通路被上调。肠道菌群在维持机体健康稳态中起至关重要的作用,这种作用主要依赖于菌种的多样性、菌群结构的稳定性和微生态的平衡性。以后可通过后基因组时代基于对微生物菌群如何与宿主生理相互作用更好地了解,最终通过对作用机制的理解,更有针对性且有效地治疗疾病。
2.5 不同聚合度菊粉对宿主肠道的调节作用
目前有关菊粉和肠道菌群之间相互作用的研究并不多,且市面上菊粉种类繁多,而各种聚合度的菊粉对肠道微生物的影响不一。刘冰[39]的研究表明,低聚合度菊粉对肠道菌群结构的影响更明显。ZHU等[40]研究了不同链长菊粉对高脂饮食C57BL/6小鼠脂质代谢及结肠微生物多样性的影响,结果表明肠道微生物谱中6个属的丰度发生显著变化,表明菊粉具有调节脂代谢的能力,而不受链长的影响。这主要是由于它对结肠微生物的影响。AST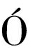 等[41]研究了果聚糖聚合度对离体发酵人肠道菌群的影响,结果表明果聚糖的益生元活性似乎取决于果聚糖的活性,在聚合程度上,高聚果糖比低聚果糖具有更大的效力。MELILLI等[42]对不同类型的菊粉进行了评价,结果表明高聚合度型菊粉对结肠微生物区系有明显的有益作用。今后可针对菊粉聚合度对不同宿主肠道菌群结构、pH、物质代谢等方面的影响开展相关研究,筛选并研发出适宜不同宿主的菊粉产品以保障人类健康。
等[41]研究了果聚糖聚合度对离体发酵人肠道菌群的影响,结果表明果聚糖的益生元活性似乎取决于果聚糖的活性,在聚合程度上,高聚果糖比低聚果糖具有更大的效力。MELILLI等[42]对不同类型的菊粉进行了评价,结果表明高聚合度型菊粉对结肠微生物区系有明显的有益作用。今后可针对菊粉聚合度对不同宿主肠道菌群结构、pH、物质代谢等方面的影响开展相关研究,筛选并研发出适宜不同宿主的菊粉产品以保障人类健康。
3 结语
人类和微生物的系统发育及协同进化导致了宿主黏膜表面的多样性和有益的共生微生物区系,目前的研究表明,肠道菌群与人类的众多疾病有关。人体是庞大的动态微生物群落的天然寄居场所,千百年来随着人类不断进化,人体中的微生物已经达到与机体互惠共生的状态,但随着外界环境的不断变化,不确定的因素可诱导并打破这种平衡,进而造成人类疾病的发生与蔓延。相关研究表明,短期内单靠食用可溶性纤维,虽然可以改变宿主肠道微生物群,但是并不能降解有害菌群。因此,我们需要更好的了解肠道菌群与疾病之间的关系,通过采取不同的手段和方式,掌握提升人体有益微生物菌群的方法和途径,为更好地保护我们自身健康,预防和治疗疾病提供了有效的方法和手段。
菊粉作为一种水溶性膳食纤维,它不仅具备普通膳食纤维全部的保健功效,也克服了其他膳食纤维的不足。菊粉对血糖还有具有双向调节作用,同时还能够提升人体对矿物质的吸收率,长期服用菊粉对人体骨健康具有非常大的益处。近年来,菊粉由于其独特的保健功效,已被世界上多个国家和地区批准为营养补充剂,在我国菊粉也已被确定为新的资源食品,菊粉目前已被广泛应用于制药、保健和食品工业中。总之,菊粉功能价值的开发和利用是未来发展的方向,也希望菊粉在人类健康中能发挥巨大功效。
[1] 朱立猛.菊粉对小鼠肠道微生物调节作用的研究[D].烟台:中国科学院烟台海岸带研究所,2017.
[2] ROSE V.Ueber eine eigenthümliche vegetabilische substanz[J].Neues Allgemein Chemistry, 1804, 3: 217-219.
[3] THOMSON T.A System of Chemistry[M].(Fourth ed)London, UK.1817.
[4] SINGH R S, SINGH R P.Production of fructooligosaccharides from inulin by endoinulinases and their prebiotic potential[J].Food Technol.Biotechnol, 2010, 48: 435-450.
[5] SINGH R S, CHAUHAN K.Inulinase production from a new inulinase producer, Penicillium oxalicum BGPUP-4[J].Biocatalysis and Agricultural Biotechnology, 2017, 9: 1-10.
[6] MENSINK M A, FRIJLINK H W, VAN DER VOORT MAARSCHALK K, et al.Inulin, a flexible oligosaccharide I: review of its physicochemical characteristics[J].Carbohydrate Polymers, 2015, 130: 405-419.
[7] KORURI S S, BANERJEE D, CHOWDHURY R, et al.Studies on prebiotic food additive(inulin)in Indian dietary fibre sources-garlic(Allium sativum), wheat(Triticum spp.), oat(Avena sativa)and dalia(Bulgur)[J].International Journal of Pharmacy and Pharmaceutical, 2014, 6(9): 278-282.
[8] ZHANG N, HUANG X S, ZENG Y H, et al.Study on prebiotic effectiveness of neutral garlic fructan in vitro[J].Food Science and Human Wellness, 2013, 2(3-4): 119-123.
[9] NAIR K, KHARB S, THOMPKINSON D K.Inulin dietary fiber with functional and health attributes-a review[J].Food Reviews International, 2010, 26(2): 189-203.
[10] BEIR O-DA-COSTA M L, ISABEL M, JANU
O-DA-COSTA M L, ISABEL M, JANU RIO N, et al.Characterisation of inulin from chicory and salsify cultivated in portugal[J].Alimentos E Nutrição, 2005, 16(3): 221-225.
RIO N, et al.Characterisation of inulin from chicory and salsify cultivated in portugal[J].Alimentos E Nutrição, 2005, 16(3): 221-225.
[11] BRKLJA![]() A J, BODRO
A J, BODRO![]() A-SOLAROV M, KRULJ J, et al.Quantification of inulin content in selected accessions of Jerusalem artichoke(Helianthus tuberosus L.)[J].Helia, 2014, 37(60): 105-112.
A-SOLAROV M, KRULJ J, et al.Quantification of inulin content in selected accessions of Jerusalem artichoke(Helianthus tuberosus L.)[J].Helia, 2014, 37(60): 105-112.
[12] KOSASIH W, PUDJIRAHARTI S, RATNANINGRUM D, et al.Preparation of inulin from dahlia tubers[J].Procedia Chemistry, 2015, 16: 190-194.
[13] LEYVA-PORRAS C, L PEZ-PABLOS A L, ALVAREZ-SALAS C, et al.Physical properties of inulin and technological applications[M].Springer International Publishing: Polysaccharides Bioactivity Biotechnol,2015: 959-984.
PEZ-PABLOS A L, ALVAREZ-SALAS C, et al.Physical properties of inulin and technological applications[M].Springer International Publishing: Polysaccharides Bioactivity Biotechnol,2015: 959-984.
[14] NWAFOR I C, SHALE K, ACHILONU M C.Chemical composition and nutritive benefits of chicory(Cichorium intybus)as an ideal complementary and/or alternative livestock feed supplement[J].The Scientific World Journal, 2017: 7343928.
[15] ALVAREZ F P P, JURADO T B, CALIXTO C M, et al.Prebiotic inulin/oligofructose in Yacón root(Smallanthus sonchifolius), phytochemistry and standardization as basis for clinical and pre-clinical research[J].Rev gastroenterologia Peru, 2008, 28: 22-27.
[16] ZEAITER Z, REGONESI M E, CAVINI S, et al.Extraction and Characterization of inulin-type fructans from artichoke wastes and their effect on the growth of intestinal bacteria associated with health[J].Bio Med Research International, 2019:1-8.
[17] SHANG H M, ZHOU H Z, YANG J Y, et al.In vitro and in vivo antioxidant activities of inulin[J].Plos One, 2018, 13(2): e0192273.DOI: 10.1371/journal.pone.0192273.
[18] SHANG H, ZHANG Y, GUO H, et al.Effects of inulin supplementation in laying hens diet on the antioxidant capacity of refrigerated stored eggs[J].International Journal of Biological Macromolecules, 2019, 43: e13022.
[19] NOOSHKAM M, FALAH F, ZAREIE Z, et al.Antioxidant potential and antimicrobial activity of chitosan-inulin conjugates obtained through the Maillard reaction[J].Food Sci Biotechnol, 2019, 28(6): 1 861-1 869.
[20] LE BASTARD Q, CHAPELET G, JAVAUDIN F, et al.The effects of inulin on gut microbial composition: a systematic review of evidence from human studies[J].European Journal of Clinical Microbiology & Infectious Diseases, 2019.DOI.org/10.1007/s10096-019-03721-w.
[21] WANG X, SHI L L, WANG X P, et al.MDG-1, an Ophiopogon polysaccharide, restrains process of non-alcoholic fatty liver disease via modulating the gut-liver axis[J].International Journal of Biological Macromolecules, 2019, 141: 1 013-1 021.
[22] OLIVEIRA B C M, BRESCIANI K D S, WIDMER G.Deprivation of dietary fiber enhances susceptibility of mice to cryptosporidiosis[J].PLoS Negl Trop Dis, 2019, 13(9): 0007411.DOI: 10.1101/620203.
[23] LI J K, ZHANG X, CAO L Y, et al.Three inulin-type fructans from Codonopsis pilosula(Franch.)Nannf.roots and their prebiotic activity on Bifidobacterium longum[J].Molecules, 2018, 23: 3123.DOI:10.3390/molecules23123123.
[24] JOSÉ BERALDI E, CARVALHO BORGES S, LOSI ALVES DE ALMEIDA F,et al.Colonic neuronal loss and delayed motility induced by high-fat diet occur independently of changes in the major groups of microbiota in Swiss mice[J].Neurogastroenterology & Motility, 2020, 32:e13745.
[25] 张璐.高脂饮食中添加菊粉对小鼠肠道菌群及其代谢产物的影响[D].北京:清华大学, 2017: 10-15.
[26] SASAKI H, MIYAKAWA H, WATANABE A, et al.Mice microbiota composition changes by inulin feeding with a long fasting period under a two-meals-per-day schedule[J].Nutrients, 2019, 11: 2802.DOI: 10.3390/nu11112802.
[27] MCLOUGHLIN R F, BERTHON B S, JENSEN M E, et al.Short-chain fatty acids, prebiotics, synbiotics, and systemic inflammation: a systematic review and meta-analysis[J].The American Journal of Clinical Nutrition, 2017, 106(3): 930-945.
[28] CAI Y, LIU W, LIN Y X, et al.Compound polysaccharides ameliorate experimental colitis by modulating gut microbiota composition and function[J].Journal of Gastroenterology and Hepatology, 2019, 34(9): 1 554-1 562.
[29] VIDELA S, VILASECA J, ANTOL N M, et al.Dietary inulin improves distal colitis induced by dextran sodium sulfate in the rat[J].American Journal of Gastroenterology, 2001, 96: 1 486-1 493.
N M, et al.Dietary inulin improves distal colitis induced by dextran sodium sulfate in the rat[J].American Journal of Gastroenterology, 2001, 96: 1 486-1 493.
[30] CHERBUT C, MICHEl C, LECANNU G.The prebiotic characteristics of fructooligosaccharides are necessary for reduction of TNBS-induced colitis in rats[J].Journal of Nutrition, 2003, 133(1): 21-27.
[31] HOENTJEN F, WELLING G W, HARMSEN H J M, et al.Reduction of colitis by prebiotics in HLA-B27 transgenic rats is associated with microflora changes and immunomodulation[J].Inflammatory Bowel Diseases, 2005, 11(11): 977-985.
[32] XUE J, LI X R, LIU P, et al.Inulin and metformin ameliorate polycystic ovary syndrome via anti-in ammation and modulating gut microbiota in mice[J].Endocrine Journal, 2019, 66(10): 859-870.
[33] VALCHEVAA R, KOLEVAB P, MART NEZ I, et al.Inulin-type fructans improve active ulcerative colitis associated with microbiota changes and increased short-chain fatty acids levels[J].Gut Microbes, 2019, 10(3): 334-357.
NEZ I, et al.Inulin-type fructans improve active ulcerative colitis associated with microbiota changes and increased short-chain fatty acids levels[J].Gut Microbes, 2019, 10(3): 334-357.
[34] AKRAM W, GARUD N, JOSHI R.Role of inulin as prebiotics on inflammatory bowel disease[J].Drug Discoveries & Therapeutics.2019, 13(1):1-8.
[35] GUO X, TANG R, YANG S, et al.Rutin and its combination with inulin attenuate gut dysbiosis, the inflammatory status and endoplasmic reticulum stress in paneth cells of obese mice induced by high-fat diet[J].Front Microbiol, 2018, 9: 2651.
[36] LI K, ZHANG L, XUE J, et al.Dietary inulin alleviates diverse stages of type 2 diabetes mellitus via anti-inflammation and 2 modulating gut microbiota in db/db mice[J].Food & Function, 2019, 10: 1 915-1 927.
[37] KADEN-VOLYNETS V, GÜNTHER C, ZIMMERMANN J, et al.Deletion of the Casp8 gene in mice results in ileocolitis, gut barrier dysfunction and malassimilation, which can be partially attenuated by inulin or sodium butyrate[J].American Journal of Physiology-Gastrointestinal and Liver Physiology, 2019, 317(4): 493-507.
[38] SONG X F, ZHONG L, LYU N, et al.Inulin can alleviate metabolism disorders in ob/ob mice by partially restoring leptinrelated pathways mediated by gut microbiota[J].Genomics Proteomics Bioinformatics, 2019, 17(1): 64-75.
[39] 刘冰.不同聚合度菊粉对健康肠道微生物群落结构影响的研究[D].兰州: 兰州大学, 2018: 8-11.
[40] ZHU Z Z, HUANG Y Q, LUO X, et al.Modulation of lipid metabolism and colonic microbial diversity of high-fatdiet C57BL/6 mice by inulin with different chain lengths[J].Food Research International, 2019, 123: 355-363.
[41] AST E, M
E, M NDEZ I, RODR
NDEZ I, RODR GUEZ-PRADO M, et al.Effect of the degree of polymerization of fructans on ex vivo fermented human gut microbiome[J].Nutrients, 2019, 11: 1 293.
GUEZ-PRADO M, et al.Effect of the degree of polymerization of fructans on ex vivo fermented human gut microbiome[J].Nutrients, 2019, 11: 1 293.
[42] MELILLI K G, BRANCA F, SILLITTI C, et al.Germplasm evaluation to obtain inulin with high degree of polymerization in Mediterranean environment[J].Natural Product Research, 2020, 34(1):187-191.