乳酸链球菌肽(Nisin)是由乳酸链球菌产生的一种小分子抗菌肽[1],具有广谱抑菌作用,对致病性病原体如李斯特菌、金黄色葡萄球菌、芽孢杆菌等革兰氏阳性菌有抗菌活性。微生物引起的食品腐败变质造成大量食物浪费问题,防腐剂可以减缓食品腐败变质,延长产品保质期。然而大多数消费者考虑到化学合成食品防腐剂的安全性问题,对天然食品防腐剂的关注越来越多。Nisin具有抑菌效果好、热稳定性好及安全无毒等优点,可用于食品防腐保鲜,既可确保食品质量及安全性,又能满足消费者对天然健康食品的需求,而且不改变最终产品的感官特性。1969年,Nisin被世界卫生组织(WHO)批准用作食品防腐剂,并于1988年被美国食品药品管理局(FDA)列入GRAS(一般认为安全)名单,批准用于食品防腐剂[2]。
Nisin作为一种国际公认的安全无毒的天然防腐剂,已被商业化广泛应用[3]。但Nisin对革兰氏阴性菌、酵母及霉菌抑制作用较弱,2种或更多种抗菌剂组合使用可增强其对病原体的抗菌作用,拓展抗菌谱,同时可降低各种抗菌剂的浓度[4]。近年来,国内外研究人员对Nisin与一种或多种抗菌剂组合使用开展了广泛研究。2019年,MAR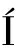 A等[3]研究发现,Nisin和有机酸盐联用具有协同抗菌作用,可显著提高对硬质奶酪中李斯特菌的抗菌能力。杨雯舸等[5]制备了含有Nisin和植物乳杆菌素的复合抗菌薄膜,与只含有Nisin的抗菌薄膜相比,其对冷鲜猪肉的保鲜作用至少延长了4 d。
A等[3]研究发现,Nisin和有机酸盐联用具有协同抗菌作用,可显著提高对硬质奶酪中李斯特菌的抗菌能力。杨雯舸等[5]制备了含有Nisin和植物乳杆菌素的复合抗菌薄膜,与只含有Nisin的抗菌薄膜相比,其对冷鲜猪肉的保鲜作用至少延长了4 d。
虽然像Nisin这样的细菌素几十年来一直用做食品防腐剂,但近些年来研究人员开始关注其医药价值。鉴于抗生素耐药性问题的日益严重,因此迫切需要新的策略来阻止耐药菌株的进一步蔓延。已有报道Nisin可以抑制耐药菌株如耐甲氧西林的金黄色葡萄球菌及耐万古霉素的艰难梭菌、肠球菌等的生长[6-7],因此,Nisin可以作为已有抗生素的有前途的替代品。另外,癌症的传统化学治疗方法对正常身体细胞具有非特异性毒性,引发一系列毒副作用,并且癌细胞在治疗过程中会出现化疗耐药性,因此迫切需要开发具有低毒副作用的替代抗癌策略。使用Nisin来治疗癌症是一种很有前途的新方法,2019年,PRINCE等[8]研究发现,Nisin可在不同癌细胞系中选择性诱导细胞凋亡并减少细胞增殖;还可以与传统化疗药物联合使用,获得更好治疗效果的同时可减小传统化疗药物的副作用及耐药性[9]。此外,Nisin也具有治疗腹泻、口腔保健和免疫调节等方面的潜力。本文对Nisin的生物合成、抑菌机制及其应用进行了总结,详细介绍了它在食品和生物医药等方面的应用,并对其未来的研究方向进行了展望。
1 Nisin结构及生物合成过程
1971年,GROSS和MORELL[10]报道了Nisin的分子结构,分子式为C143H228N42O37S7。分子质量为3 500 Da,常常形成二聚体或四聚体结构,分子质量分别为7 000 Da和14 000 Da。成熟的Nisin由34个氨基酸残基构成,分子结构中含有羊毛硫氨酸(lanthionine,Ala-S-Ala)、β-甲基羊毛硫氨酸(β-methyllanthionine,Abu-S-Ala)、脱氢丙氨酸(dehydroalanine,Dha)和脱氢丁氨酸(dehydrobutyrine,Dhb)等稀有氨基酸,它们通过硫醚键连接成五环结构。目前,已经报道的天然Nisin有NisinA,NisinZ,NisinF,NisinQ,NisinH,NisinP,NisinU,NisinU2等8种变体(图1)。NisinA和NisinZ的研究最为广泛,二者区别在于结构中第27位氨基酸不同,NisinA为组氨酸,NisinZ为天冬氨酸[11]。这种结构不同导致2种Nisin的热稳定性,抗pH能力,对蛋白水解酶的敏感性和抗菌作用谱有所不同。Nisin的溶解度和稳定性与溶液pH值有关,相同条件下,NisinZ的溶解性高于NisinA,而抗菌性几乎无差别。

图1 乳酸链球菌肽的8种变体结构[11]
Fig.1 Structure of eight kinds of variants of Nisin [11]
黑色表示变体之间的氨基酸差异,灰色表示翻译后修饰部分
NisinA由nisABTCIPRKFEG基因簇编码产生,其中,结构基因nisA编码Nisin前体,该前体通过核糖体翻译合成后经过一系列的修饰才能形成成熟且有活性的Nisin分子。Nisin前体中的丝氨酸和苏氨酸在脱水酶NisB的催化下脱水生成Dha和Dhb残基[12]。随后产生的脱氢残基在环化酶NisC的催化下与半胱氨酸偶联,形成甲基羊毛硫氨酸环。完全修饰的Nisin前体在转运蛋白NisT的作用下可以跨膜运输到细胞外,最后在体外需要蛋白酶NisP对Nisin前体进行前导肽的切割才能形成成熟且有活性的抗菌肽[13]。双组分调节系统NisRK调控Nisin的生物合成。当细胞外出现成熟的Nisin分子时,它会与组氨酸激酶NisK结合,引发NisK上的组氨酸磷酸化,随后通过特定信号传输通道将磷酸基团转移至转录激活因子NisR上,NisR磷酸化后结合到nisABTCIPRK和nisFEG的启动子区,激活相应基因的转录调控(图2)。
由于Nisin具有强烈的抑菌性,特定的自我保护机制是必不可少的。脂蛋白NisI和ABC转运蛋白NisFEG是Nisin生产菌株的免疫系统,2者协同表达保护菌株免受其对自身的攻击。脂蛋白NisI位于细胞质膜的外部,会在细胞质膜表面直接结合Nisin,防止其与脂质体Ⅱ分子结合在细胞膜上形成小孔[14],保护自身免受Nisin的损害。ABC转运蛋白NisFEG能够把入侵细胞膜的Nisin分子排出到细胞外,减少已经进入细胞膜的数量[13],从而防止了Nisin分子局部浓度过高形成孔洞。
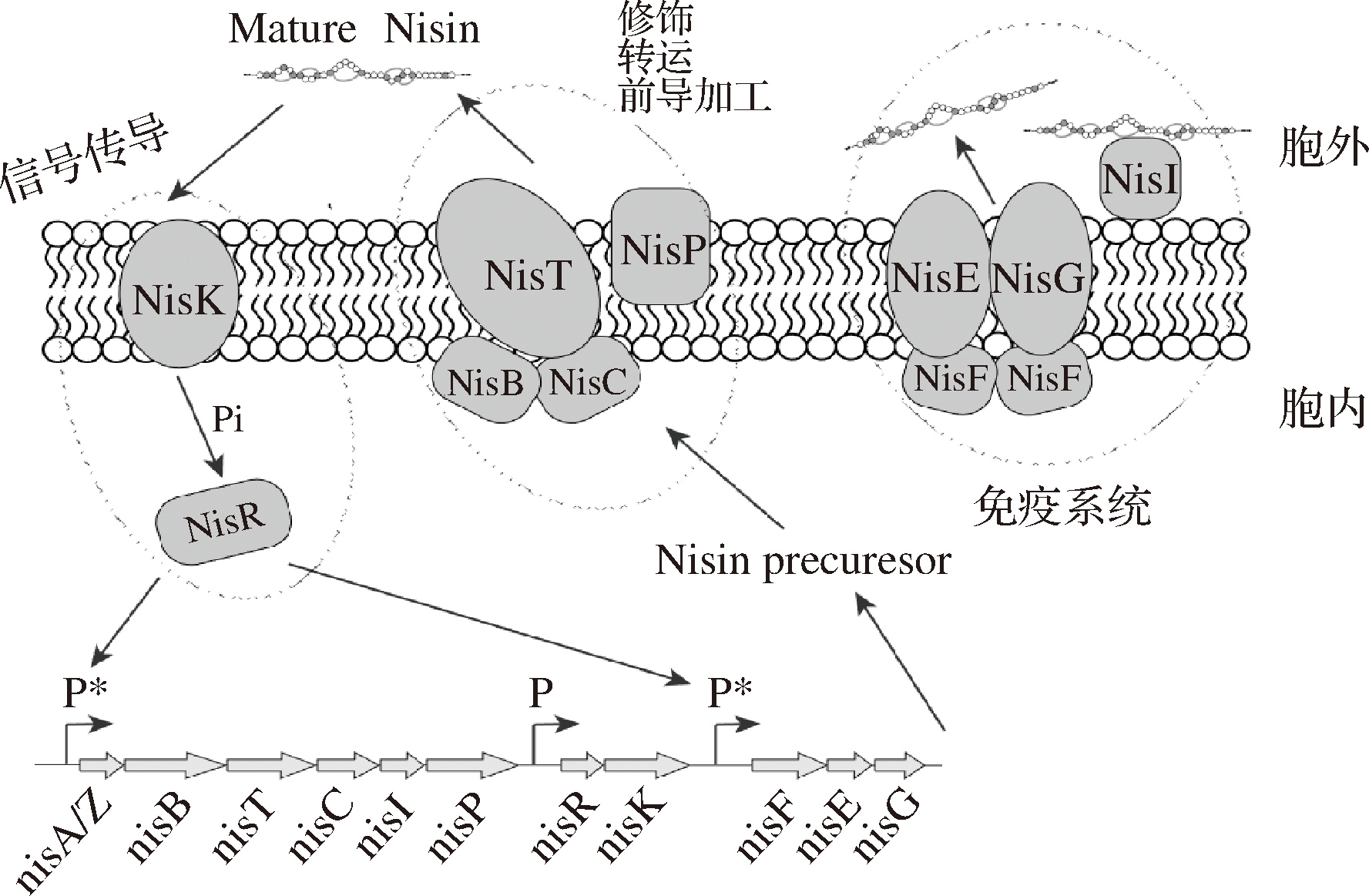
图2 乳酸链球菌肽生物合成示意图[14]
Fig.2 Schematic diagram of Nisin biosynthesis [14]
2 Nisin抑菌性及抑菌机制
Nisin具有广谱抑菌作用,在纳摩尔浓度下对食源致病性病原体如李斯特菌、金黄色葡萄球菌、芽孢杆菌等革兰氏阳性菌有抗菌活性,由于革兰氏阴性菌具有外膜屏障,因此对其没有显著抑菌活性。研究发现,Nisin与破坏外膜稳定性的方法[乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)]、高压或热处理或冷冻)联合使用时可以抑制一些革兰氏阴性菌[15]。
MATARACI等[7]研究发现,Nisin与抗生素联合使用24 h内均表现出对耐甲氧西林金黄色葡萄球菌生物膜形成的显著抑制活性,其联合使用产生协同效应,抗生物膜活性显著提高,可预防或延迟抗生素耐药性的出现。金属螯合剂可以螯合微量过渡金属并控制模型系统中的氧化降解,还可以增强抗菌剂的功效[16]。研究发现食品级螯合剂(如EDTA,六偏磷酸钠)可以克服细菌细胞质的膜渗透屏障,使大肠杆菌、肠道沙门氏菌等革兰氏阴性菌对乳链菌肽的敏感度增加[15,17]。
Nisin抑菌作用机制主要是在细胞膜中形成孔道,导致细胞内小分子物质(例如三磷酸腺苷、氨基酸、核苷酸和离子等)快速流出,细胞质膜的离子梯度和质子动力被破坏,细胞的生物合成过程受阻,导致细胞裂解死亡[18]。主要有以下2种模式,第一种是“楔形”模型(见图3-a),Nisin与细胞膜相互作用紧密结合,其C端与脂质的静电吸引力使Nisin慢慢插入到脂质双分子层,在膜上形成孔道复合物[19]。微摩尔浓度Nisin即可形成这种孔道模型;另一种是Nisin的N端双环系统能够与细胞壁的合成前体脂质Ⅱ相结合[20](见图3-b),在纳摩尔浓度下具有活性主要是因为Nisin将脂质Ⅱ作为后续孔形成的对接分子,阻止前体参与聚合肽聚糖中,破坏细胞壁的合成并形成高度特异性的孔。该孔道比第一种模式形成的孔孔径更大且更稳定。
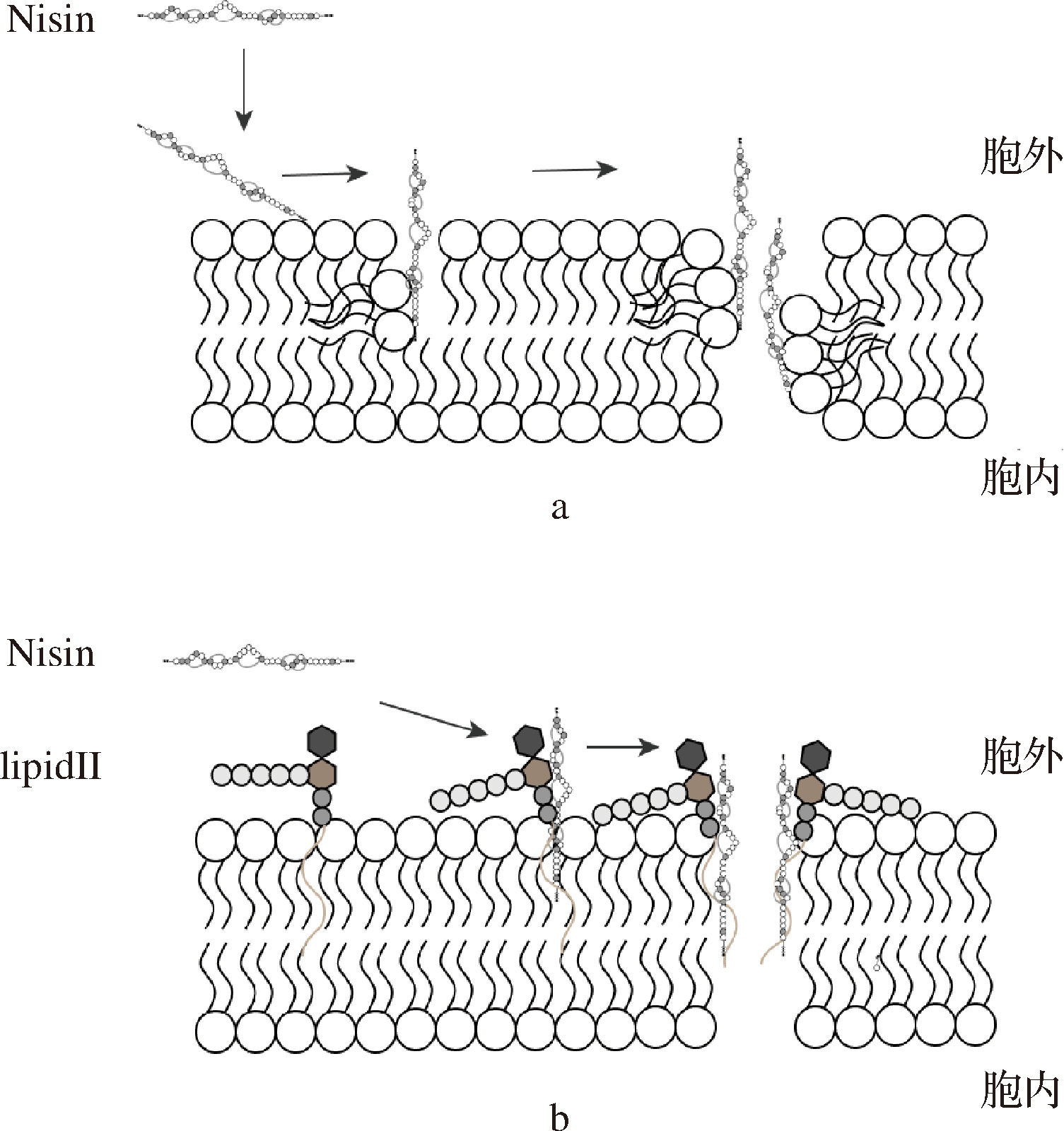
a- Nisin与细胞膜脂质相互作用形成孔道b- Nisin与脂质Ⅱ相互作用形成孔道
图3 Nisin抑菌机制[19-20]
Fig.3 Antibacterial mechanism of Nisin [19-20]
3 提高Nisin产量的技术研究
Nisin作为一种安全无毒的天然防腐剂,需求量持续增长,但仍有许多因素限制其广泛应用。现阶段Nisin主要通过微生物发酵生产,尚存在发酵活力低、产量较低及生产成本高等问题。目前,研究人员主要通过改造工程菌株和优化发酵系统等方法提高Nisin产量。
在利用基因工程技术构建高产菌株方面,研究发现在乳酸乳球菌LS01中共过表达某些参与Nisin生物合成的多拷贝基因(nisA,nisRK和nisFEG),可显著提高Nisin产量[21]。发酵液中乳酸的积累会抑制菌株生长,抑制Nisin产量,因此提高菌株的耐受性对提高其产量有促进作用。本课题组张健等[22]将17个耐酸基因在乳酸乳球菌F44中异源表达或过表达。其中,过表达hdeAB、ldh和murG基因的工程菌株在发酵过程中,菌株的耐酸能力显著提高,细胞内pH值更稳定且可有效提高Nisin产量。同时,利用转录因子和非编码小RNA分别从转录和转录后修饰水平提高菌株耐酸能力,可间接提高菌株的Nisin产量[23-24]。
同时,研究人员对发酵培养基进行了改造,并基于培养基设计改造工程菌株。刘家亨等人选择农业废弃物脱脂米糠作为培养基碳源,利用脱脂米糠水解液作为发酵培养基的碳源和部分氮源,通过强化木糖转录调控因子的表达及驯化培养,得到可有效利用木糖以及米糠中葡萄糖木糖混合碳源的乳酸乳球菌[25]。同时,以豆粕酶解液为唯一氮源进行发酵优化,得到适合培养乳酸乳球菌的豆粕培养基,通过协同表达蛋白水解酶、多肽水解酶和多肽转运系统,强化了乳酸乳球菌的蛋白利用能力,进一步提高了菌体对氮源的利用率[26]。
此外,对Nisin发酵分离方法进行了优化,以更有效地解除Nisin的反馈抑制。如GAO等[27]设计利用κ-角叉菜胶和丝瓜海绵载体来固定乳酸乳球菌悬浮液,连续发酵耦合泡沫分离技术与固定化细胞相结合生产Nisin,与常规分批发酵相比,Nisin产量增加了66.1%。
4 Nisin在食品工业中的应用
Nisin具有较好的抑菌防腐性能,安全无毒,目前被广泛应用于肉制品、乳制品和酒精饮料的防腐保鲜中。
4.1 在肉制品中的应用
肉制品保藏中常添加硝酸盐或亚硝酸盐来抑制肉毒梭状芽胞杆菌的生长,而亚硝酸盐在肉制品中与二级胺结合会产生有致癌性的亚硝胺。在肉制品中添加安全无毒的防腐剂如Nisin可以降低亚硝酸盐的添加量。研究发现在新鲜的瘦牛肉里添加Nisin可有效抑制单核细胞增生李斯特菌及芽胞杆菌等的生长[28],延长肉制品的贮存期。
近年来,研究者重点开发了Nisin与其他制剂联合使用的策略。研究发现螯合剂EDTA可有效控制氧化引起的腐败反应,Nisin与EDTA联合使用有助于肉制品的保存,防止食品腐败[17-18]。此外,纳米材料也应用于Nisin抗菌剂的开发。研究发现负载Nisin的壳聚糖-单甲基富马酸纳米颗粒可有效抑制肉末中金黄色葡萄球菌和李斯特菌的生长[29]。
4.2 在乳制品中的应用
Nisin作为防腐剂在乳制品中的应用十分广泛。乳制品经过巴氏杀菌后冷藏仍有致病菌存活,加工奶酪仍然存在被单核细胞增生李斯特菌、金黄色葡萄球菌污染的风险。研究发现,添加Nisin可以有效抑制奶酪中李斯特菌、金黄色葡萄球菌的生长[30-31]。
研究者们越来越多地通过将2种或更多种抗菌药物组合使用增强对病原体的抗菌作用,拓展抗菌谱,同时可降低各种抗菌剂的浓度[4]。MAR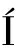 A等[3]研究了Nisin和有机酸盐联用对硬质奶酪中李斯特菌的抑制作用,发现Nisin与山梨酸钾、丙酸钙和乳酸钠具有协同抗菌作用。同时,添加乳杆菌素AL705后显著提高了二元混合物的抗菌能力,这是首次在乳制品中使用含乳杆菌素的三元混合物来有效抑制李斯特菌的生长。
A等[3]研究了Nisin和有机酸盐联用对硬质奶酪中李斯特菌的抑制作用,发现Nisin与山梨酸钾、丙酸钙和乳酸钠具有协同抗菌作用。同时,添加乳杆菌素AL705后显著提高了二元混合物的抗菌能力,这是首次在乳制品中使用含乳杆菌素的三元混合物来有效抑制李斯特菌的生长。
4.3 在酒精饮料中的应用
在啤酒酿造过程中很容易受到革兰氏阳性菌侵染,Nisin可以广泛抑制啤酒中存在的革兰氏阳性菌,同时不会影响酵母的活性。研究发现添加Nisin可以延长啤酒、葡萄酒等酒精饮品的货架期[32]。
壳聚糖纳米颗粒在食品工业中常用作食品防腐剂,也可以用作递送载体。LEE等[33]研究发现载有Nisin的壳聚糖纳米颗粒对橙汁中食源性病原体的体外抗菌活性更高,包埋Nisin的壳聚糖纳米颗粒在食品的抗菌保鲜中具有良好的应用前景。
5 Nisin在医药行业的应用
目前,越来越多的研究发现Nisin有潜力应用于医药行业,有利于解决抗生素耐药性问题,符合未来医药行业的发展要求。已发现Nisin具有抑制癌细胞生长、治疗腹泻、口腔保健及免疫调节等潜力。
5.1 抑制癌细胞生长
细菌素作为抗癌新型治疗剂是一种非常有前途的治疗方法。研究发现当Nisin作用于神经母细胞瘤细胞时,导致细胞膜的流动性增强和偶极电位降低,进而抑制神经母细胞瘤细胞的生长[8]。KAMARAJAN等[34]研究发现了Nisin可作为治疗头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)的新型潜在治疗药物。Nisin利用其阳离子转运一种促凋亡调节因子的蛋白同系物1(cation transport regulator homolog 1,CHAC1),同时伴随细胞外钙流入对HNSCC发挥作用,诱导细胞凋亡及细胞周期停滞,减少HNSCC中的细胞增殖。
此外,Nisin对肝脏癌、胃肠道癌、乳腺癌以及皮肤癌细胞等均有毒性作用。在Nisin浓度高于IC50处理后观察到细胞活力降低,并出现细胞收缩、细胞质空泡化、细胞核收缩及细胞脱离现象,一定浓度下会导致细胞凋亡[35-37]。表1总结了近年来报道的各种癌细胞系用Nisin处理24 h后 IC50值。多种药物联合使用治疗癌症是临床常采用的治疗方法,与单一药物治疗相比,可以获得更好的治疗效果同时减小副作用和耐药性。研究发现Nisin与DOX联合使用具有协同抗癌作用,当添加2 μg/mL的Nisin时,DOX的IC50值减半[9],降低达到显著抗癌作用所需的最低DOX化疗剂量,从而降低其相关副作用。由于Nisin在消化系统中可被蛋白酶分解,研究人员开发了利用纳米颗粒材料控制Nisin的释放和递送技术[37-38]。GOUDARZI等[38]研究发现载有Nisin的聚乳酸-聚乙二醇-聚乳酸纳米颗粒对AGS,KYSE-30,HepG2和K562癌细胞系的细胞毒性大于游离Nisin。这是第一个报道的Nisin及其包裹形式对胃肠道、肝和血液癌细胞系的细胞毒性作用的研究。
表1 癌细胞用Nisin处理24 h后 IC50值
Table 1 IC50 values of Nisin on cancer cells after 24 h
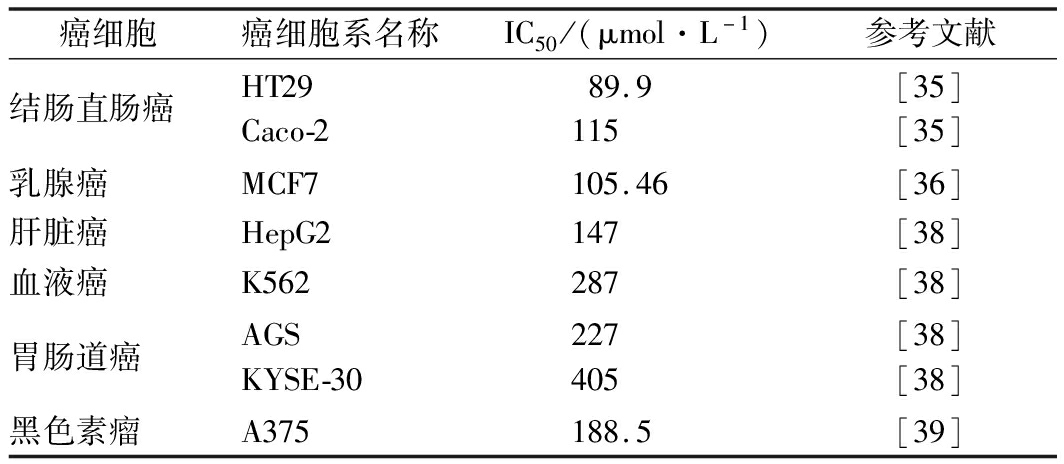
癌细胞癌细胞系名称IC50/(μmol·L-1)参考文献结肠直肠癌HT29Caco-289.9115[35][35]乳腺癌MCF7105.46[36]肝脏癌HepG2147[38]血液癌K562287[38]胃肠道癌AGSKYSE-30227405[38][38]黑色素瘤A375188.5[39]
5.2 治疗腹泻
艰难梭菌是抗生素相关性腹泻和假膜性结肠炎患者中最常发现的引起肠道感染的病原体。甲硝唑和万古霉素是治疗艰难梭菌相关性腹泻(Clostridium difficile associated diarrhea,CDAD)比较有效的方法,但由于具有多重耐药性的艰难梭菌的出现,抗生素治疗失败和感染复发的人数正在逐年增加,迫切需要开发新的抗菌药物。研究人员模拟人类的结肠模型,发现Nisin生产菌株乳酸乳球菌UL719能够在人结肠模型中存活和增殖,Nisin浓度为76 μmol/L(MIC的20倍)时可有效杀死艰难梭菌病原体[40]。BARTOLONI等[41]从医院中患有CDAD的受试者收集了60种艰难梭菌菌株,测试甲硝唑、万古霉素和Nisin对产毒菌株的体外活性,发现Nisin相对于甲硝唑、万古霉素对艰难梭菌具有更强的杀菌作用,并且它对肠道其他菌群的抑制作用相对较小。Nisin可能是治疗CDAD的有前途的抗菌药物。
猪断奶后腹泻(post-weaning diarrhea,PWD)给全球养猪行业造成巨大的经济损失,它通常是由猪肠道产肠毒素的大肠杆菌的增殖引起的。目前的控制策略通常是使用多粘菌素,大环内酯类和氟喹诺酮类抗生素。研究发现Nisin、肠球菌素DD14细菌素和多粘菌素的组合使用可提高药物对猪源大肠杆菌的抗菌活性[42],这种组合对多粘菌素抗性表型的猪源大肠杆菌浮游菌也是有效的。该项研究表明可以通过细菌素与多粘菌素组合使用来减少抗生素所需的有效剂量,以此阻止或延缓抗性的出现。此外,FIELD等[43]也研究发现Nisin、EDTA和肉桂醛等联合使用治疗PWD比单独使用任一种抗菌剂具有更高的抗大肠杆菌活性。以上研究为治疗PWD提供了新的思路。
5.3 口腔保健
口腔内含有的微生物共同构成了一个复杂的微生态环境。龋齿和牙周炎是2种最常见的口腔疾病,与口腔微生物菌群密切相关。龋齿是一种由致龋微生物如乳杆菌,链球菌,放线菌等引起的慢性传染病,口腔致龋微生物主要是革兰氏阳性菌,因此,Nisin被认为是预防和治疗龋齿的合适的抗菌剂。体外研究发现Nisin在龋齿发展的早期、中期和晚期对9种常见致龋微生物具有抗菌活性[44]。变异链球菌、沙门氏菌和嗜酸乳杆菌等致龋菌代谢糖类产生酸性物质,使牙菌斑保持在低pH。Nisin在低pH下具有高抗菌活性和稳定性,同时低毒无臭、无色无味,唾液中的成分不影响其抗菌活性,因此,Nisin被认为是有效的抗龋剂。
此外,由于Nisin易被蛋白酶水解且自身不易溶解,限制其应用范围,而利用脂质体等材料包埋Nisin可提高其抑菌活力。研究发现载有Nisin的阳离子脂质体可以对变形链球菌发挥持续抗菌作用,并在体外抑制不溶性葡聚糖的合成[45],改善口腔健康问题。同时,CUNHA等[46]研究发现当使用瓜耳胶将Nisin局部递送给药时,Nisin对口腔致病的肠球菌的抗菌活性提高了52.2%;在牙膏中添加Nisin至100 μg/mL时,抗菌活性由10%提高到95%。以上研究对进一步评估Nisin的潜在临床应用至关重要。
5.4 免疫调节
宿主防御肽(host-defence peptides,HDPs)在生物体的先天免疫应答中起着至关重要的作用。Nisin和HDPs都是两亲性阳离子抗菌肽,具有相似的理化特性,因此可能也具有HDPs相关的免疫调节特性[47]。研究发现Nisin能够通过诱导趋化因子合成和抑制细菌脂多糖诱导的促炎细胞因子来调节先天免疫应答[48]。JOANNA等[49]研究了添加Nisin对猪外周血白细胞的体外免疫作用,发现Nisin质量浓度为50 μg/mL时,刺激白细胞介素(interleukin,IL)的产生,并增加了CD4+CD8+ T细胞的百分比。用大肠杆菌刺激血液吞噬细胞后,Nisin具有抗增殖活性,并抑制IL-6的合成,降低了细菌刺激的细胞炎症反应强度。因此,Nisin可能是潜在的具有附加抗菌特性的免疫调节剂。
利用这一特性,Nisin也可以用于治疗难愈性伤口。研究发现Nisin可以增加皮肤细胞的流动性,抑制脂多糖和促炎细胞因子的作用,促进猪皮肤伤口的再上皮化[50]。Nisin的免疫调节功能拓展了其在医药行业的应用,该领域值得进一步研究。
6 前景与展望
目前,Nisin已在全球50多个国家和地区广泛使用,作为一种国际公认的安全无毒的天然防腐剂,需求量持续增长,但仍有许多因素限制其广泛应用。现阶段Nisin主要通过微生物发酵生产,尚存在发酵活力低、产量较低及生产成本高等问题,因此,在研究应用的同时,应该更多地关注于开发高产Nisin的优良工程菌株和优化发酵系统,提高产量,降低生产成本。Nisin作为生物防腐剂和医学治疗剂具有巨大的潜力,与其他药物联合使用可以增强对病原体的抗菌作用,拓展抗菌谱,同时减少药物副作用,但添加药物的最适比例仍有待研究,并且很多研究仍处于在动物体内进行理论研究阶段,需要进行临床研究以评估其功效。正常条件下Nisin溶解性和稳定性较差,开发Nisin不同变体和形式使其更好应用于食品工业和临床也是未来研究的重点。Nisin以它独特的优点吸引了越来越多研究者的关注,具有非常好的发展前景。
[1] LIU W, HANSEN J N.Some chemical and physical properties of nisin, a small-protein antibiotic produced by Lactococcus lactis[J].Applied and Environmental Microbiology,1990,56(8): 2 551-2 558.
[2] ALI A H, HALE T W, KHASAWNEH F A, et al.NISIN and clostridium difficile:A potentially effective treatment for an increasingly problematic disease[J].American Journal of Gastroenterology, 2013, 108(4):625-625.
[3] MAR A C V, MELIAN C, CASTELLANO P, et al.Synergistic antimicrobial effect of lactocin AL 705 and nisin combined with organic acid salts against Listeria innocua 7 in broth and a hard cheese[J].International Journal of Food Science & Technology, 2019, 55(1):267-275.
A C V, MELIAN C, CASTELLANO P, et al.Synergistic antimicrobial effect of lactocin AL 705 and nisin combined with organic acid salts against Listeria innocua 7 in broth and a hard cheese[J].International Journal of Food Science & Technology, 2019, 55(1):267-275.
[4] AHMAD V, KHAN M S, JAMAL Q M S, et al.Antimicrobial potential of bacteriocins:in therapy, agriculture and food preservation[J].International Journal of Antimicrobial Agents, 2017, 49(1):1-11.
[5] 杨雯舸, 冯广莹, 孙铭, 等.乳酸菌素复合抗菌膜的制备及其在冷鲜猪肉保鲜中的应用[J].北京农学院学报, 2018, 33(3): 88-92.
[6] AHIRE J J, DICKS L M T.Nisin incorporated with 2,3-dihydroxybenzoic acid in nanofibers inhibits biofilm formation by a methicillin-resistant strain of Staphylococcus aureus[J].Probiotics and Antimicrobial Proteins, 2015, 7(1):52-59.
[7] MATARACI E, DOSLER S.In vitro activities of antibiotics and antimicrobial cationic peptides alone and in combination against methicillin-resistant Staphylococcus aureus biofilms[J].Antimicrobial Agents and Chemotherapy, 2012, 56(12):6 366-6 371.
[8] PRINCE A, TIWARI A, ROR P, et al.Attenuation of neuroblastoma cell growth by nisin is mediated by modulation of phase behavior and enhanced cell membrane fluidity[J].Physical Chemistry Chemical Physics, 2019, 21(4):1 980-1 987.
[9] PREET S, PANDEY S K, SAINI N, et al.Nisin augments doxorubicin permeabilization and ameliorates signaling cascade during skin carcinogenesis[J].Translational Medicine,2015, 6(1): 1-5.
[10] GROSS E, MORELL J L.Structure of nisin[J].Journal of the American Chemical Society, 1971, 93(18):4 634-4 635.
[11] 刘家亨.高产nisin乳酸乳球菌的构建及新型nisin生产体系的开发[D].天津:天津大学, 2018.
[12] KARAKAS S A, NARBAD A, HORN N, et al.Post-translational modification of nisin:The involvement of NisB in the dehydration process[J].Febs Journal, 2010, 261(2):524-532.
[13] CHEIGH C I, PYUN Y R.Nisin biosynthesis and its properties[J].Biotechnology Letters, 2005, 27(21):1 641-1 648.
[14] LI H, O″SULLIVAN D J.Identification of a nisI promoter within the nisabctip operon that may enable establishment of nisin immunity prior to induction of the operon via signal transduction[J].Journal of Bacteriology, 2006, 188(24):8 496-8 503.
[15] KHAN A,VU K D,RIEDL B,et al.Optimization of the antimicrobial activity of nisin, Na-EDTA and pH against gram-negative and gram-positive bacteria[J].LWT-Food Science and Technology, 2015, 61(1):124-129.
[16] HERSKOVITZ J E, WOROBO R W, GODDARD J M.The role of solid support bound metal chelators on system-dependent synergy and antagonism with Nisin[J].Journal of Food Science, 2019, 84(3):580-589.
[17] BINGOL E B, AKKAYA E, HAMPIKYAN H, et al.Effect of Nisin-EDTA combinations and modified atmosphere packaging on the survival of salmonella Enteritidis in Turkish type meatballs[J].CyTA-Journal of Food, 2018, 16(1):1 030-1 036.
[18] SAHL H G, KORDEL M, BENZ R.Voltage-dependent depolarization of bacterial membranes and artificial lipid bilayers by the peptide antibiotic nisin[J].Archives of Microbiology, 1987, 149(2):120-124.
[19] GHARSALLAOUI A, OULAHAL N, JOLY C, et al.Nisin as a food preservative:Part 1:physicochemical properties, antimicrobial activity, and main uses[J].Critical Reviews in Food Science & Nutrition, 2016, 56(8):1 262-1 274.
[20] SUKRITA P, PARICHAT P, PONGSAK P.Nisin: production and mechanism of antimicrobial action[J].International Journal of Current Research & Review, 2015, 7(2):47-53.
[21] NI Z J,ZHANG X Y,LIU F,et al.Effect of co-overexpression of nisin key genes on nisin production improvement in Lactococcus lactis LS01[J].Probiotics & Antimicrobial Proteins, 2017, 9(2):204-212.
[22] ZHANG J, CAIYIN Q, FENG W, et al.Enhance nisin yield via improving acid-tolerant capability of Lactococcus lactis F44[J].Scientific Reports, 2016, 6:27 973.
[23] QI J, CAIYIN Q, WU H, et al.The novel sRNA s015 improves nisin yield by increasing acid tolerance of Lactococcus lactis F44[J].Applied Microbiology and Biotechnology, 2017, 101(16):6 483-6 493.
[24] WU H, LIU J, MIAO S, et al.Contribution of YthA, a PspC family transcriptional regulator to Lactococcus lactis F44 acid tolerance and nisin yield:a transcriptomic approach[J].Applied & Environmental Microbiology, 2018, 84(6):UNSP e02483-17.
[25] LIU J, MA Z, ZHU H, et al.Improving xylose utilization of defatted rice bran for nisin production by overexpression of a xylose transcriptional regulator in Lactococcus lactis[J].Bioresource Technology, 2017, 238:690-697.
[26] LIU J, ZHOU J, WANG L, et al.Improving nitrogen source utilization from defatted soybean meal for nisin production by enhancing proteolytic function of Lactococcus lactis F44[J].Scientific Reports, 2017, 7(1):6 189.
[27] GAO Y, ZHENG H, HU N, et al.Technology of fermentation coupling with foam separation for improving the production of nisin using a κ-carrageenan with loofa sponges matrix and an hourglass-shaped column[J].Biochemical Engineering Journal, 2018, 133:140-148.
[28] KARINA P, JULIO C, LEDA G, et al.Behavior of Listeria monocytogenes type1 355/98(85)in meat emulsions as affected by temperature,pH,water activity,fat and microbial preservatives[J].Food Control, 2011, 22(10):1 573-1 581.
[29] CHATZIDAKI M D, BALKIZA F, GAD E, et al.Reverse micelles as nano-carriers of nisin against foodborne pathogens.Part II:The case of essential oils[J].Food Chemistry, 2019, 278: 415-423.
[30] WEMMENHOVE E, VALENBERG H J F, HOOIJDONK A C M V, et al.Factors that inhibit growth of Listeria mono-cytogenes in nature-ripened Gouda cheese:A major role for undissociated lactic acid[J].Food Control, 2017, 84:413-418.
[31] FELICIO B A, PINTO M S, OLIVEIRA F S, et al.Effects of nisin on Staphylococcus aureus count and physicochemical properties of Minas Frescal cheese[J].Journal of Dairy Science, 2015, 98(7):4 364-4 369.
[32] SUN J, ZHU H X, GUO J, et al.The bacteriostasis study of nisin for the raspberry health draft beer[J].Physics Procedia, 2012, 25:973-977.
[33] LEE E H, KHAN I, OH D.Evaluation of the efficacy of nisin-loaded chitosan nanoparticles against foodborne pathogens in orange juice[J].Journal of Food Science and Technology-Mysore, 2018, 55(3):1 127-1 133.
[34] KAMARAJAN P, HAYAMI T, MATTE B, et al.Nisin ZP, a bacteriocin and food preservative, inhibits head and neck cancer tumorigenesis and prolongs survival[J].PloS One, 2015, 10(7):1-20.
[35] MAHER S, MCCLEAN S.Investigation of the cytotoxicity of eukaryotic and prokaryotic antimicrobial peptides in intestinal epithelial cells in vitro[J].Biochemical Pharmacology,2006, 71(9):1 289-1 298.
[36] PAIVA A D,DE OLIVEIRA M D,DE PAULA S O,et al.Toxicity of bovicin HC5 against mammalian cell lines and the role of cholesterol in bacteriocin activity[J].Microbiology, 2012, 158(11):2 851-2 858.
[37] AHMADI S,GHOLLASI M,HOSSEINI H M.The apoptotic impact of nisin as a potent bacteriocin on the colon cancer cells[J].Microbial Pathogenesis, 2017, 111:193-197.
[38] GOUDARZI F, ASADI A, AFSHARPOUR M, et al.In vitro, characterization and evaluation of the cytotoxicity effects of Nisin and Nisin-loaded PLA-PEG-PLA nanoparticles on gastroin -testinal(AGS and KYSE-30), Hepatic(HepG2)and blood(K562)cancer cell lines[J].Aaps Pharmscitech,2018,19(4):1 554-1 566.
[39] LEWIES A,WENTZEL J F,MILLER H C,et al.The antimic -robial peptide nisin Z induces selective toxicity and apoptotic cell death in cultured melanoma cells[J].Biochimie, 2018, 144: 28-40.
[40] CHRISTOPHE L L,BENOIT F,RIADH H,et al.On Lactoco-ccus lactis UL719 competitivity and nisin(Nisaplin)capacity to inhibit Clostridium difficile in a model of human colon[J].Frontiers in Microbiology, 2015, 6:1 020.
[41] BARTOLONI A,MANTELLA A,GOLDSTEIN B P,et al.In-vitro activity of nisin against clinical isolates of clostridium difficile[J].Journal of Chemotherapy, 2004, 16(2):119-121.
[42] AlATYA A K,Abriouel H,Kempf I,et al.Effects of colistin and bacteriocins combinations on the in vitro growth of escherichia coli strains from swine origin.[J].Probiotics & Antimicrobial Proteins, 2016, 8(4):183-190.
[43] FIELD D,BAGHOU I,REA M C,et al.Nisin in combination with cinnamaldehyde and edta to control growth of Escherichia coli strains of swine origin[J].Antibiotics, 2017, 6(4):35-45.
[44] TONG Z, DONG L, ZHOU L, et al.Nisin inhibits dental caries-associated microorganism in vitro[J].Peptides, 2010, 31(11):2 003-2 008.
[45] YAMAKAMI K,TSUMORI H,SHIMIZU Y,et al.Cationic lipid content in liposomeencapsulated nisin improves sustainable bactericidal activity against[J].The Open Dentistry Journal, 2016, 10(1):360-366.
[46] CUNHA E, TROV O T, PINHEIRO A, et al.Potential of two delivery systems for nisin topical application to dental plaque biofilms in dogs[J].BMC Veterinary Research, 2018, 14(1):375.
O T, PINHEIRO A, et al.Potential of two delivery systems for nisin topical application to dental plaque biofilms in dogs[J].BMC Veterinary Research, 2018, 14(1):375.
[47] SHIN J M, GWAK J W, KAMARAJAN P, et al.Biomedical applications of nisin[J].Journal of Applied Microbiology, 2016, 120(6):1 449-1 465.
[48] KINDRACHUK J,JENSSEN H,ELLIOTT M,et al.Manipulation of innate immunity by a bacterial secreted peptide: Lantibiotic nisin Z is selectively immunomodulatory[J].Innate Immunity, 2013, 19(3):315-327.
[49] JOANNA M,EDYTA K,ROMAN W,et al.In vitro immunom-odulatory effect of nisin on porcine leucocytes[J].Journal of Animal Physiology and Animal Nutrition, 2019, 103(3):882-893.
[50] MOURITZEN M V,ANDREA A,QVIST K,et al.Immunomodulatory potential of Nisin A with application in wound healing[J].Wound Repair and Regeneration, 2019, 27(6):650-660.