纤维素在自然界中来源丰富且分布广泛,是地球上数量巨大的可再生资源。工农业生产过程中常产生大量的纤维质废弃物,如农作物秸秆、白酒酒糟、食品加工废弃物、林业加工下脚料等,但这部分资源并没有得到合理有效的利用,不仅造成极大的资源浪费而且产生环境污染等问题。利用微生物生产的纤维素酶,将植物性纤维原料转化为人类急需的能源、食品和化工原料,对解决全球能源危机、食品和饲料资源紧张以及缓解环境问题等有着重大意义[1]。纤维素酶是一类多酶复合体,主要由内切型葡萄糖苷酶、外切型葡萄糖苷酶和β-葡萄糖苷酶3大类具有不同催化反应功能的酶组成[2]。自然界中能产纤维素酶的微生物种类繁多,主要包括真菌、放线菌和部分酵母菌、细菌等[3]。长期以来,高产菌株缺乏一直是制约纤维素酶大规模工业化生产的瓶颈,因此筛选得到优良的菌株是实现纤维素酶批量生产的关键[4]。
我国是白酒生产大国,酒糟是白酒酿造中数量最大的副产物,其主要成分是纤维素和木质素,同时含有部分蛋白质、淀粉和粗脂肪等[5]。新鲜酒糟具有水分含量高、酸度大、有机质含量高等特点,由于纤维质及有机酸含量较高,生物利用度较低[6-7],若不及时处理极易腐败变质,造成环境污染及资源浪费。白酒酒糟中纤维素的降解转化对于酒糟的综合利用具有潜在的经济价值,实现酒精资源的综合利用将有助于白酒企业的可持续发展。白酒的固态酿造具有开放式生产、多菌种共发酵的特点,其发酵副产物中含有丰富的微生物资源。曾林等[8]从白酒黄水中筛选得到18株产纤维素酶的菌株。其中SW02被鉴定为植物内生芽孢菌(Bacillus endophyticus),其滤纸酶活力为30.48 U/mL。董丹等[9]从白酒酒糟中筛选出3株高产纤维素酶菌株,经鉴定分别为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、枯草芽孢杆菌(Bacillus subtilis)、甲基营养型芽孢杆菌(Bacillus methylotrophicus)。由于细菌纤维素酶活力不如真菌,前期研究多集中于真菌源纤维素,如曲霉、木霉、白耙齿菌等[10-12],但细菌源纤维素酶具有耐酸碱性、耐热性、生产周期短、易于培养等优点[13-14]。因此,对产纤维素酶细菌的筛选研究仍然具有重要的意义。
笔者从白酒酒糟中筛选到1株产纤维素酶的细菌,对其进行形态观察、分子生物学鉴定和生理生化鉴定,并进一步研究其酶学特性,为进一步研究细菌纤维素酶生产菌株提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
白酒酒糟:采集于河南省某知名白酒企业。
1.1.2 试剂
葡萄糖、MgSO4、牛肉膏、蛋白胨、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid, DNS)等常规生化试剂,上海国药集团。羧甲基纤维素(carboxy methyl cellulose,CMC)、微晶纤维素、刚果红、4-硝基苯基-D-吡喃葡萄糖苷(pNPG),美国Sigma公司。
1.1.3 培养基
(1)筛选培养基(刚果红培养基)(g/L):KH2PO4 0.5、MgSO4·7H2O 0.5、酵母粉0.4、琼脂16.0、刚果红0.2、CMC 10,121 ℃灭菌20 min。
(2)种子培养基(g/L):牛肉膏3、蛋白胨 5、葡萄糖5、NaCl 5,121 ℃灭菌20 min。
(3)发酵产酶培养基(g/L):KH2PO4 2、(NH4)2SO4 1.4、蛋白胨1、尿素0.3、CaCl2 0.34、MgSO4·7H2O 0.3、FeSO4·7H2O 0.005、MnSO4 0.001 6、ZnSO4·7H2O 0.001 4、CoCl2 0.002、CMC 10,121 ℃灭菌20 min。
1.2 仪器与设备
ZWY-100H往复式恒温摇床,上海智城分析仪器制造有限公司;SW-CJ-2D超净工作台,苏州安泰空气技术有限公司;DMEX30生物显微镜,宁波舜宇仪器有限公司;HH-S数显恒温水浴锅,金坛市医疗仪器厂;UV7504紫外可见分光光度计,上海精密仪器仪表有限公司;DYY-6C型电泳仪,北京市六一生物科技有限公司;GNP-9160型隔水式恒温培养箱,上海精宏实验设备有限公司;C1000聚合酶链式反应(polymerase chain reaction,PCR)仪,美国伯乐公司;GelK8160凝胶成像系统,北京科创锐新生物科技有限公司。
1.3 实验方法
1.3.1 菌株初筛
称取10 g白酒酒糟混悬于100 mL无菌水中,置于磁力搅拌器充分混匀,取悬浊液稀释为10-3、10-4和10-5 3个梯度,各稀释梯度取100 μL涂布于刚果红筛选培养基,37 ℃恒温培养2 d,挑取水解圈直径(D)与菌落直径(d)比值大的菌株进行复筛。
1.3.2 菌株复筛
将初筛的菌株纯化,接种于种子培养基,37 ℃,180 r/min摇床培养24 h,以2%的接种量接种到100 mL发酵培养基,37 ℃、180 r/min 摇床培养48 h,5 000 r/min、4 ℃离心10 min,上清液即为粗酶液,测定粗酶液纤维素酶活力。
纤维素酶酶活力的测定:采用DNS法测定粗酶液酶活力[15],取0.5 mL粗酶液,加入1.5 mL体积分数1%的CMC缓冲液(pH 4.8, 0.1 mol/L),50 ℃反应30 min,加入2 mL DNS 沸水浴中显色10 min,540 nm测定吸光度。酶活力的定义为:每分钟催化底物生成1 μmol葡萄糖所需的酶量为1个酶活力单位(U)。
1.3.3 菌株鉴定
1.3.3.1 形态观察
将菌株接种到牛肉膏蛋白胨固体平板上观察菌落形态特征。通过革兰氏染色法在显微镜下观察菌株形态特征。
1.3.3.2 分子生物学鉴定[16]
基因组DNA试剂盒提取目的菌株总DNA,采用细菌16S rDNA基因通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGTTACCTTGTTACGACTT-3′)进行PCR扩增,将PCR产物送生工生物工程(上海)股份有限公司测序。测序结果在NCBI上用Blast进行同源检索,利用MEGA 6.0软件构建系统发育树。
1.3.3.3 生理生化鉴定
参照《伯杰细菌鉴定手册》[17]和《常见细菌系统鉴定手册》[18]进行生理生化特征鉴定。包括V-P试验、产吲哚试验、糖发酵试验、甲基红试验等。
1.3.4 菌株纤维酶素酶学性质分析
1.3.4.1 最适作用温度及温度稳定性
最适作用温度:将酶液在不同温度(30、35、40、45、50、55、60、65和70 ℃)条件下与体积分数1% CMC进行酶促反应,DNS法测定CMC酶活力。温度稳定性:先将粗酶液置于30、35、40、45、50、55、60、65和70 ℃的水浴锅中分别孵育30 min,然后进行酶促反应,DNS法测定残余CMC酶活力。以最高酶活为100%,其他酶活则换算成相对于最高活力的百分比。
1.3.4.2 最适作用pH及pH稳定性[19]
最适作用pH:将CMC酶活测定反应体系pH值分别调整至pH 3.0~8.0,测定纤维素酶在不同pH条件下的CMC酶活。pH稳定性:将粗酶液分别置于于pH 3.0~8.0反应体系中,50 ℃保温30 min,然后进行酶促反应,DNS法测定残余CMC酶活力。以最高酶活为100%,其他酶活力则换算成相对于最高活力的百分比。
1.3.4.3 金属离子对酶活力的影响
将终浓度为1 mmol/L的金属离子Cu2+、Fe2+、Ca2+、Zn2+、Mg2+、Mn2+、Co2+、K+、Ba2+分别添加至酶活力测定体系中,以不添加任何金属离子组做对照(CK),测定不同浓度各金属离子对酶活力的影响。以最高酶活力为100%,其他酶活则换算成相对于最高活力的百分比。
1.3.4.4 底物特异性
将粗酶液加入到以微晶纤维素(1%)、滤纸条(50 mg)、CMC(1%)和pNPG(0.5%)为底物的反应体系中,按前述测酶活的方法,在最适温度和最适pH条件下反应30 min(滤纸条为底物的体系反应60 min),测定其在不同底物体系中粗酶液的活力。以最高酶活为100%,其他酶活力则换算成相对于最高活力的百分比。
1.4 数据处理
采用Excel 2010和Origin Pro 9.0进行数据处理和作图。
2 结果与分析
2.1 产纤维素酶细菌的分离筛选
刚果红可以与纤维素形成红色的复合物,当纤维素被降解后,培养基会形成以菌落为中心的水解圈,根据水解圈(D)与菌落直径(d)比以及水解圈的清晰程度可初步筛选出具有降解纤维素能力的菌株[20]。从白酒酒糟中共筛选出28株产纤维素酶细菌,以H/C值>8作为初筛标准,选取16株产纤维素酶能力较高的菌株,如表1所示。
表1 16株菌在刚果红平板的透明圈直径
Table 1 Transparent circle diameter of 16 cellulase-producing bacteria on Congo red plates
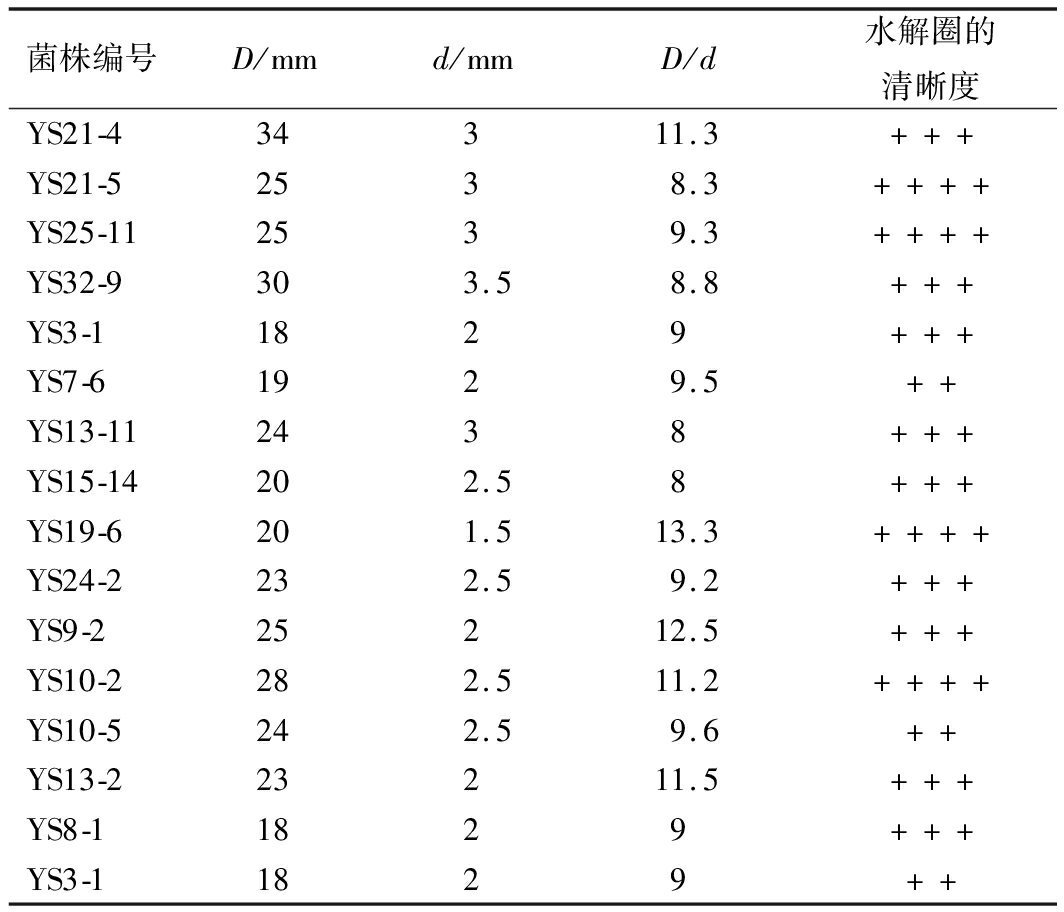
菌株编号D/mmd/mmD/d水解圈的清晰度YS21-434311.3+++YS21-52538.3++++YS25-112539.3++++YS32-9303.58.8+++YS3-11829+++YS7-61929.5++YS13-112438+++YS15-14202.58+++YS19-6201.513.3++++YS24-2232.59.2+++YS9-225212.5+++YS10-2282.511.2++++YS10-5242.59.6++YS13-223211.5+++YS8-11829+++YS3-11829++
注:“++++”为透明圈清晰可见;“+++”为透明圈较清晰;“++”为透明圈浑浊
其中YS21-4、YS19-6、YS9-2、YS10-2、YS13-2五株菌的D/d>10,且透明圈清晰,对CMC降解性能较好,菌株YS32-9虽然水解圈直径较大,但菌落本身直径也比较大,因此D/d值仅为8.8。由于菌株在刚果红培养基上水解圈的大小与实际产酶能力不一定呈现一致的关系[21],因此将初筛得到的16株菌进行进一步的发酵产酶复筛。
将初筛得到的16株细菌进行发酵产酶复筛,酶活见表2。其中菌株YS10-2胞外酶活力最高,为(36.73±2.45)U/mL,且在刚果红平板上产生清晰的透明圈(图1),因此将YS10-2作为出发菌株,进行下一步的研究。
表2 16株菌产纤维素酶活力测定
Table 2 Cellulase activities of 16 cellulase-producing bacteria
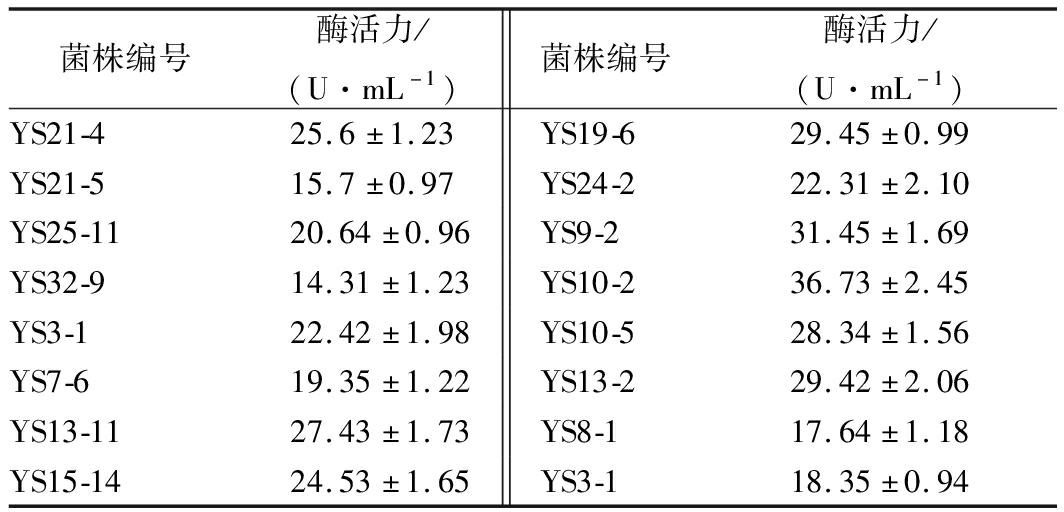
菌株编号酶活力/(U·mL-1)菌株编号酶活力/(U·mL-1)YS21-425.6±1.23YS19-629.45±0.99YS21-515.7±0.97YS24-222.31±2.10YS25-1120.64±0.96YS9-231.45±1.69YS32-914.31±1.23YS10-236.73±2.45YS3-122.42±1.98YS10-528.34±1.56YS7-619.35±1.22YS13-229.42±2.06YS13-1127.43±1.73YS8-117.64±1.18YS15-1424.53±1.65YS3-118.35±0.94
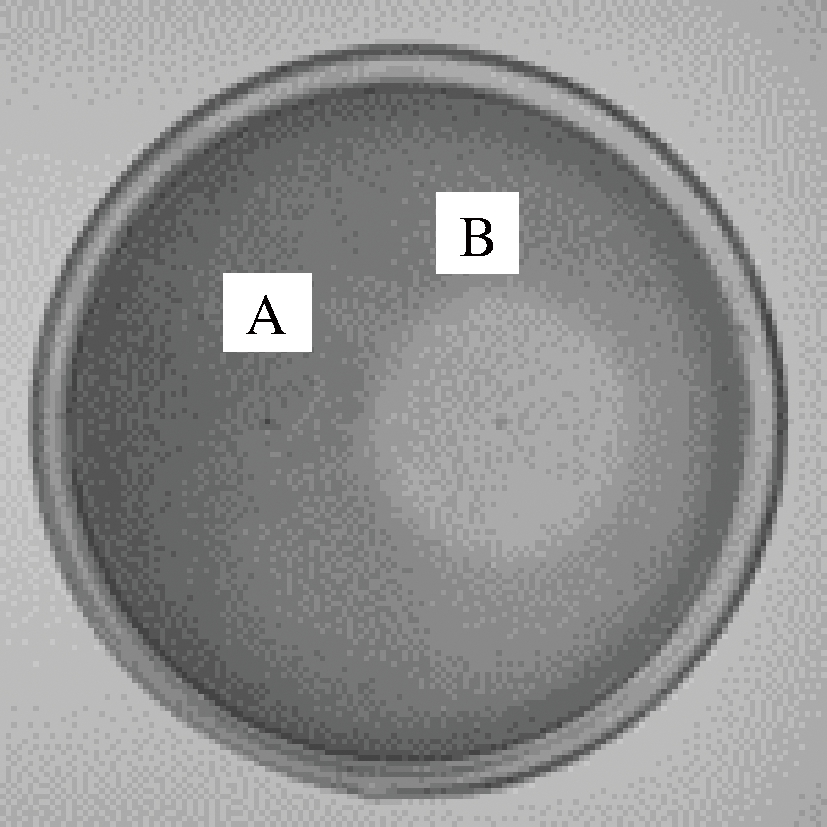
A-对照菌株;B-纤维素酶产生菌YS10-2
图1 纤维素酶产生菌在刚果红平板上的透明圈形态
Fig.1 Transparent circle morphology of cellulase-producing bacterium on Congo red plate
2.2 菌株YS10-2的鉴定
2.2.1 菌株YS10-2的形态学特征
如图2所示,菌株YS10-2在牛肉膏蛋白胨平板上菌落形态为乳白色,近圆形,表面较湿,富有光泽,不透明,显微镜下菌体呈杆状,有芽孢,革兰氏染色为阳性。
2.2.2 菌株YS10-2分子生物学鉴定
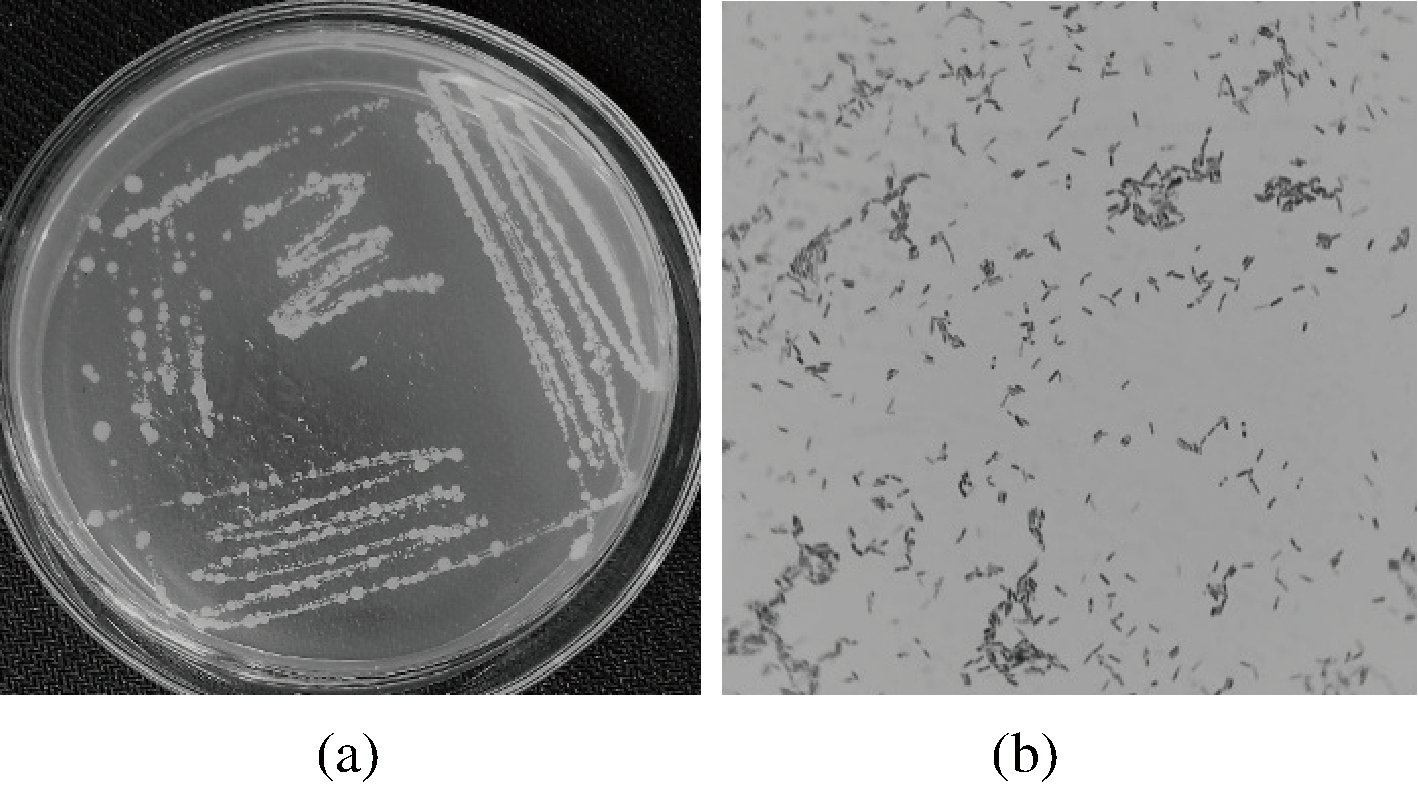
a-菌落形态;b-菌株形态
图2 菌株YS10-2菌落形态及菌株形态
Fig.2 Colonial and morphology of strain YS10-2
以菌株YS10-2总DNA为模板,采用16S rDNA通用引物进行PCR扩增,检验得到约为1.5 kb条带(图3),将目的菌株的16S rDNA序列和该属有代表性细菌的16s rDNA序列构建的遗传进化树,如图4所示。菌株YS10-2的16S rDNA 基因序列与GenBank数据库中的序列进行比对,为芽孢杆菌属,与Bacillus megaterium同源性最高,达到100%,判断菌株YS10-2 属于巨大芽孢杆菌(Bacillus megaterium)。研究表明,芽孢杆菌做为益生菌具有促进机体消化吸收和增强免疫力的作用[22],因此在酒糟再利用转化为饲料方面具有应用潜力。

M-marker
图3 菌株YS 10-2的16S rDNA PCR扩增产物琼脂糖凝胶电泳图
Fig.3 Agarose gel electrophoresis of 16S rDNA PCR amplification product of strain YS10-2
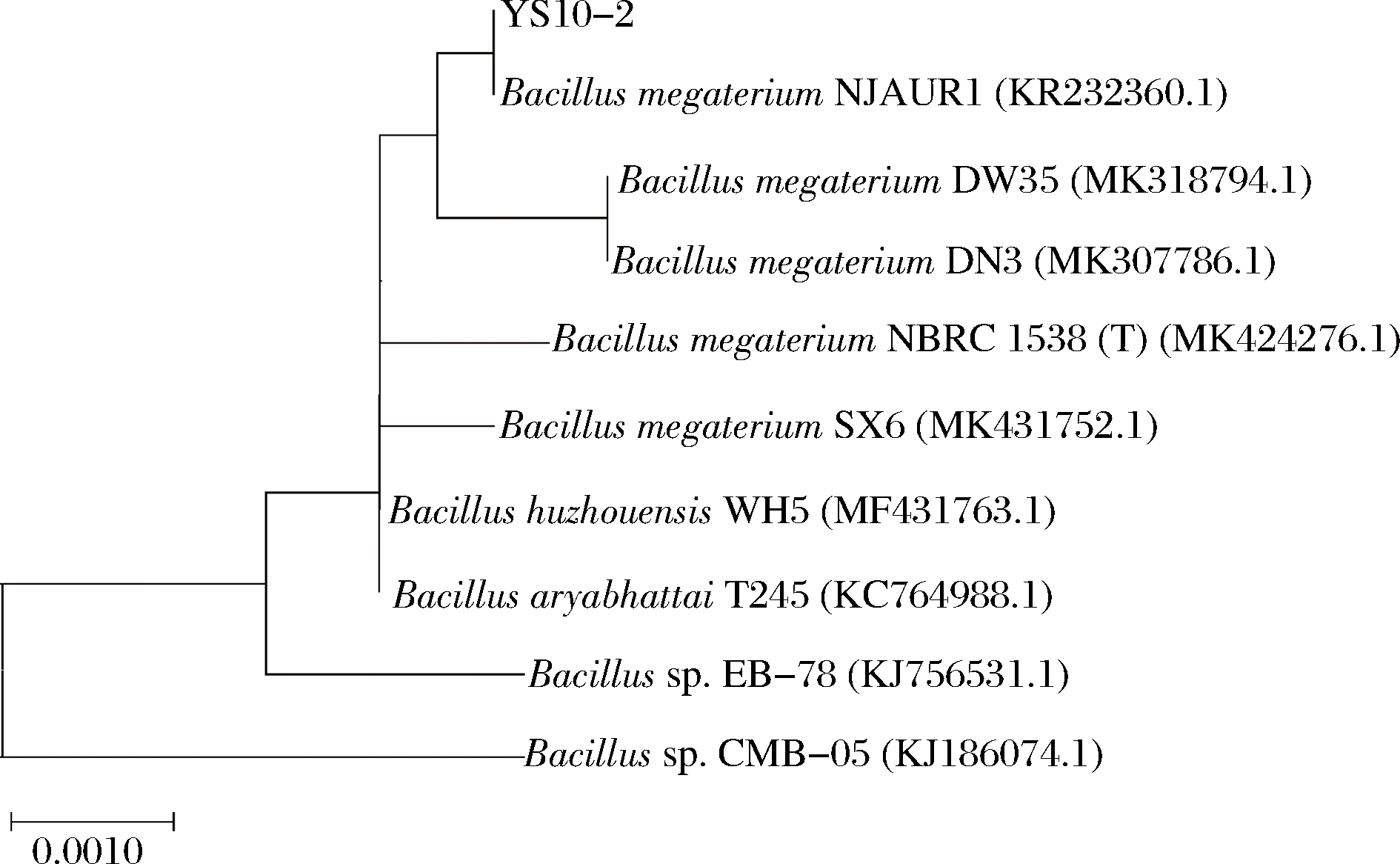
图4 基于16S rDNA序列菌株YS10-2的系统发育树
Fig.4 Phylogenetic tree of strain YS10-2 based on 16S rDNA sequences
2.2.3 菌株YS10-2生理生化鉴定
对菌株YS10-2进行生理生化鉴定,结果如表3。菌株YS10-2具有水解淀粉、吲哚阴性、接触酶阳性及发酵糖产酸生理生化特性[17],与巨大芽孢杆菌属特征一致。
表3 菌株YS10-2的生理生化鉴定结果
Table 3 Identification results of physiological and biochemical experiments of strain YS10-2
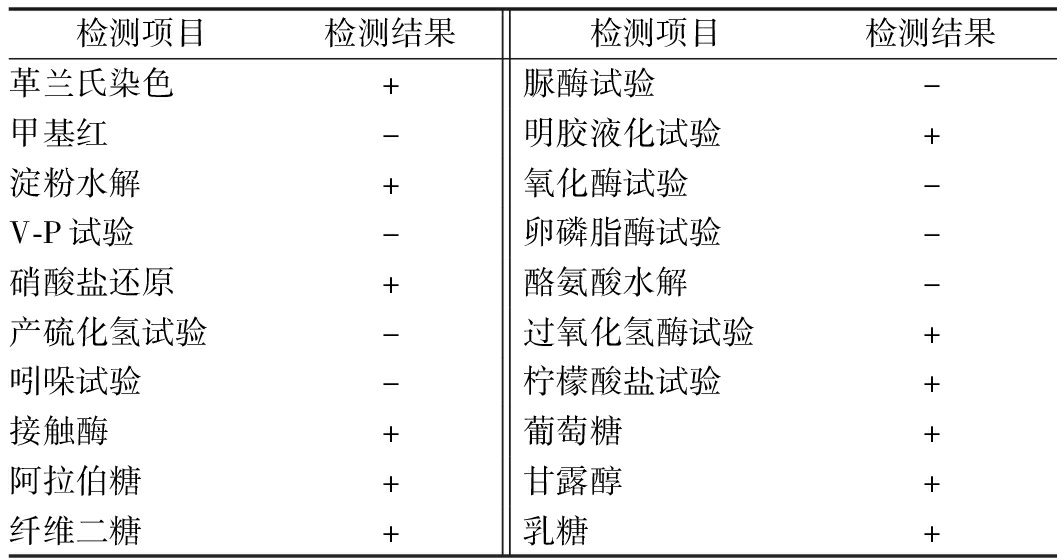
检测项目检测结果检测项目检测结果革兰氏染色+脲酶试验-甲基红-明胶液化试验+淀粉水解+氧化酶试验-V-P试验-卵磷脂酶试验-硝酸盐还原+酪氨酸水解-产硫化氢试验-过氧化氢酶试验+吲哚试验-柠檬酸盐试验+接触酶+葡萄糖+阿拉伯糖+甘露醇+纤维二糖+乳糖+
注:-代表阴性结果,+代表阳性结果
2.3 纤维素酶酶学性质研究
2.3.1 纤维素酶最适温度及温度稳定性
考察不同温度(30~70℃)对纤维素酶活性的影响,结果如图5所示。YS10-2胞外粗酶液最适反应温度为50 ℃,在40~55 ℃温度范围内,其酶活力在80%以上,高于60 ℃,酶活力逐渐下降,当反应温度为70 ℃时,酶活力降至50%。
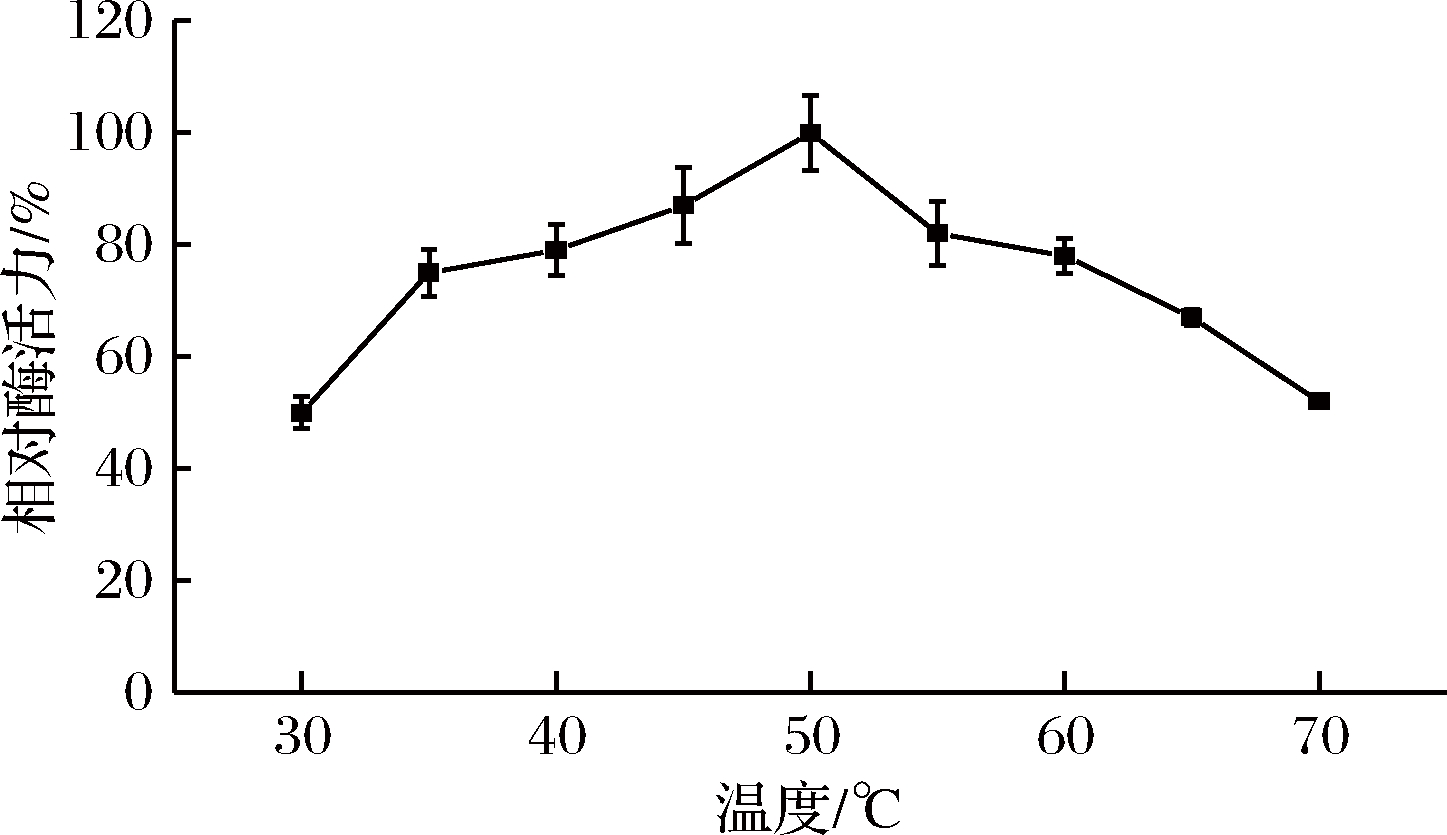
图5 温度对纤维素酶活力的影响
Fig.5 Effect of temperature on cellulase activity
纤维素粗酶液经30~70 ℃处理30 min后,其酶活力变化情况如图6所示。纤维素酶在30~55 ℃酶活均保持稳定(>80%),当温度高于60 ℃时,酶活力稳定性下降,70 ℃时,相对酶活力为50%,仍保持有一定的酶活力,说明菌株YS10-2所产的纤维素酶具有一定的热稳定性。
2.3.2 纤维素酶最适pH及pH稳定性
如图7所示,50 ℃条件下纤维素酶最适作用pH值为5.0,pH在4.0~5.5范围内,纤维素酶的酶活在90%左右,该酶最适作用pH为弱酸性,当pH>6.0,酶活迅速下降,pH为8.0时,酶活力仅剩余20%,说明该酶不耐碱性条件。

图6 纤维素酶热稳定性
Fig.6 Thermal stability of cellulase
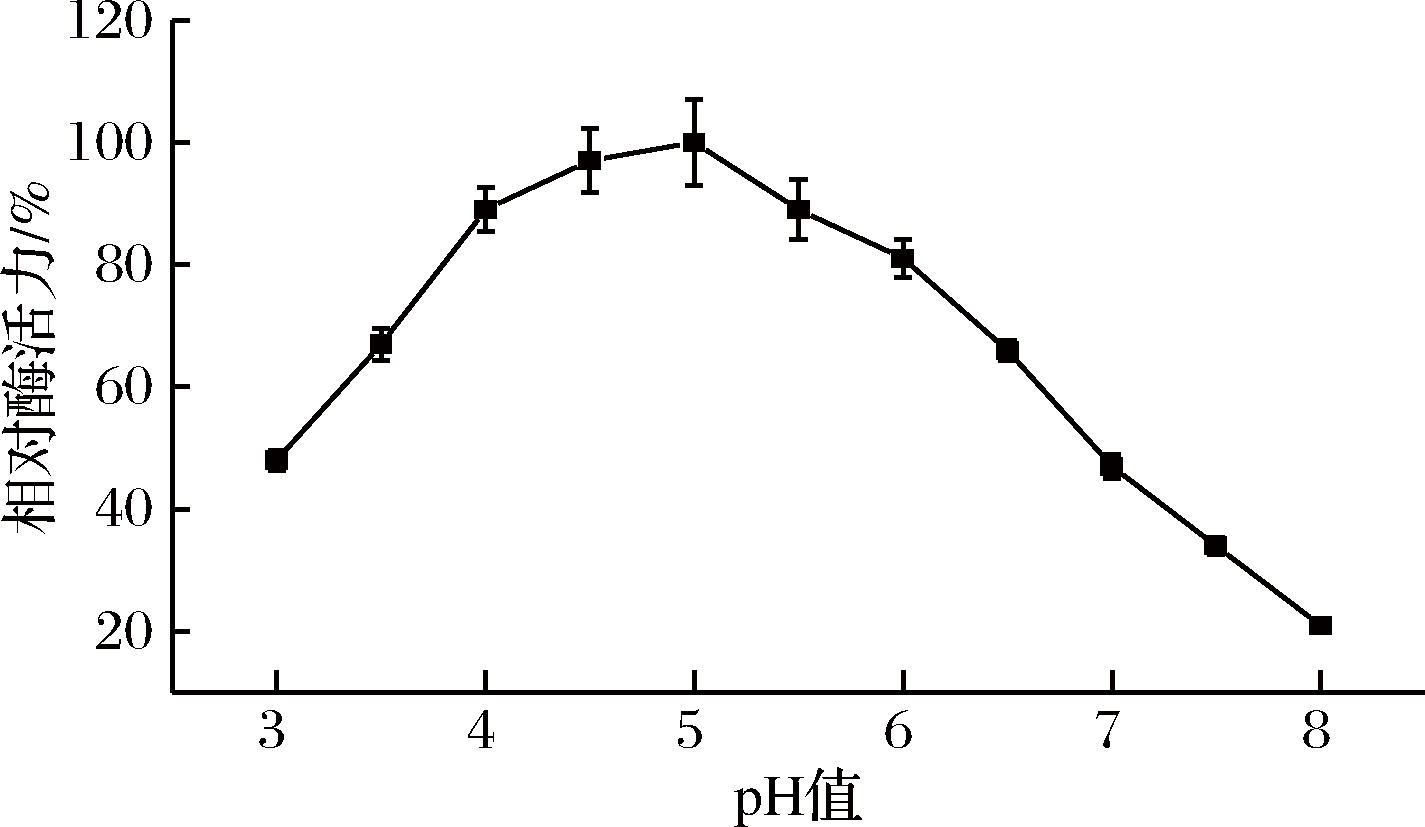
图7 不同pH值对纤维素酶活力的影响
Fig.7 Effect of pH on cellulase activity
考察菌株YS10-2胞外粗酶液在不同pH条件下的稳定性,结果如图8所示,该酶在pH 4.0~5.5范围内,酶活力稳定在90%以上,当pH<3.5或pH>6.0时,其酶活力损失较多,稳定性变差,该酶在弱酸性条件下相对比较稳定。
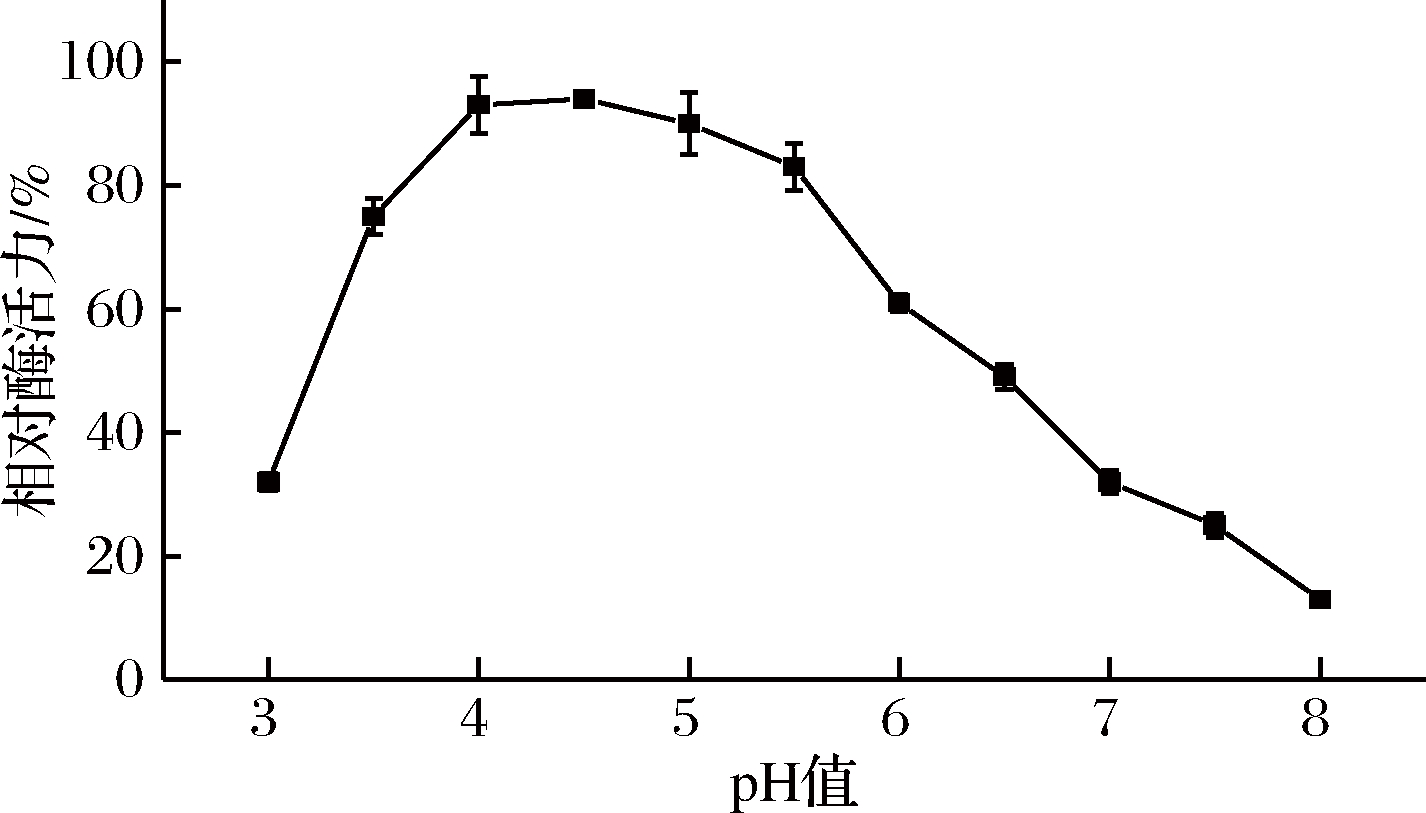
图8 不同pH值下纤维素酶的稳定性
Fig.8 Stability of cellulase activity at different pH
2.3.3 金属离子对纤维素酶活性的影响
考察不同金属离子对纤维素酶活性的影响,以不添加任何金属离子作为空白对照,由图9可知,金属离子Ca2+、Zn2+、Mg2+是该酶的激活剂,酶活力分别增加28%、12%和26%,而Cu2+和Ba2+是该酶的抑制剂,添加后酶活力分别下降50%和60%,其他离子添加则对纤维素酶活力无显著影响(P>0.05)。
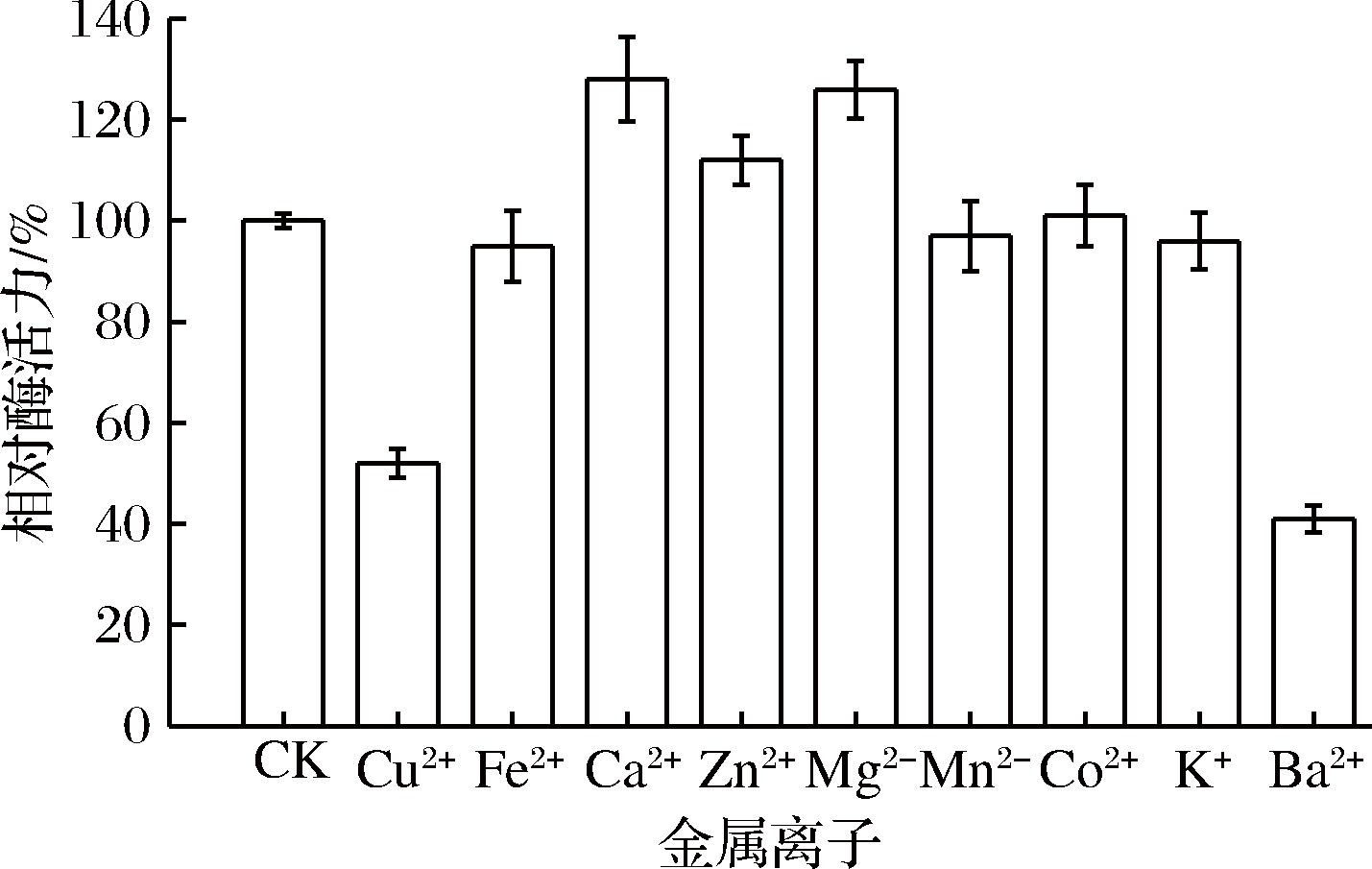
图9 不同金属离子对纤维素酶活力的影响
Fig.9 Effect of metal ions on cellulase activity
2.3.4 纤维素酶最适作用底物
分别以CMC、微晶纤维素、滤纸、pNPG为底物测定YS10-2粗酶液的活力,如图10所示,该酶对CMC的降解效果最好,其次为滤纸,对pNPG的降解性较差。纤维素酶为一种复合酶,主要是由葡聚糖外切酶、葡聚糖内切酶及β-葡萄糖苷酶组成[2]。CMC主要评价葡聚糖内切酶活力,微晶纤维素主要评价葡聚糖外切酶活力,pNPG为β-葡萄糖苷酶的水解底物[23-24],通过对比不同底物降解性试验,YS10-2所产胞外酶以葡聚糖内切酶为主,对CMC的降解具有一定的底物特异性,同时滤纸酶活力也较高。
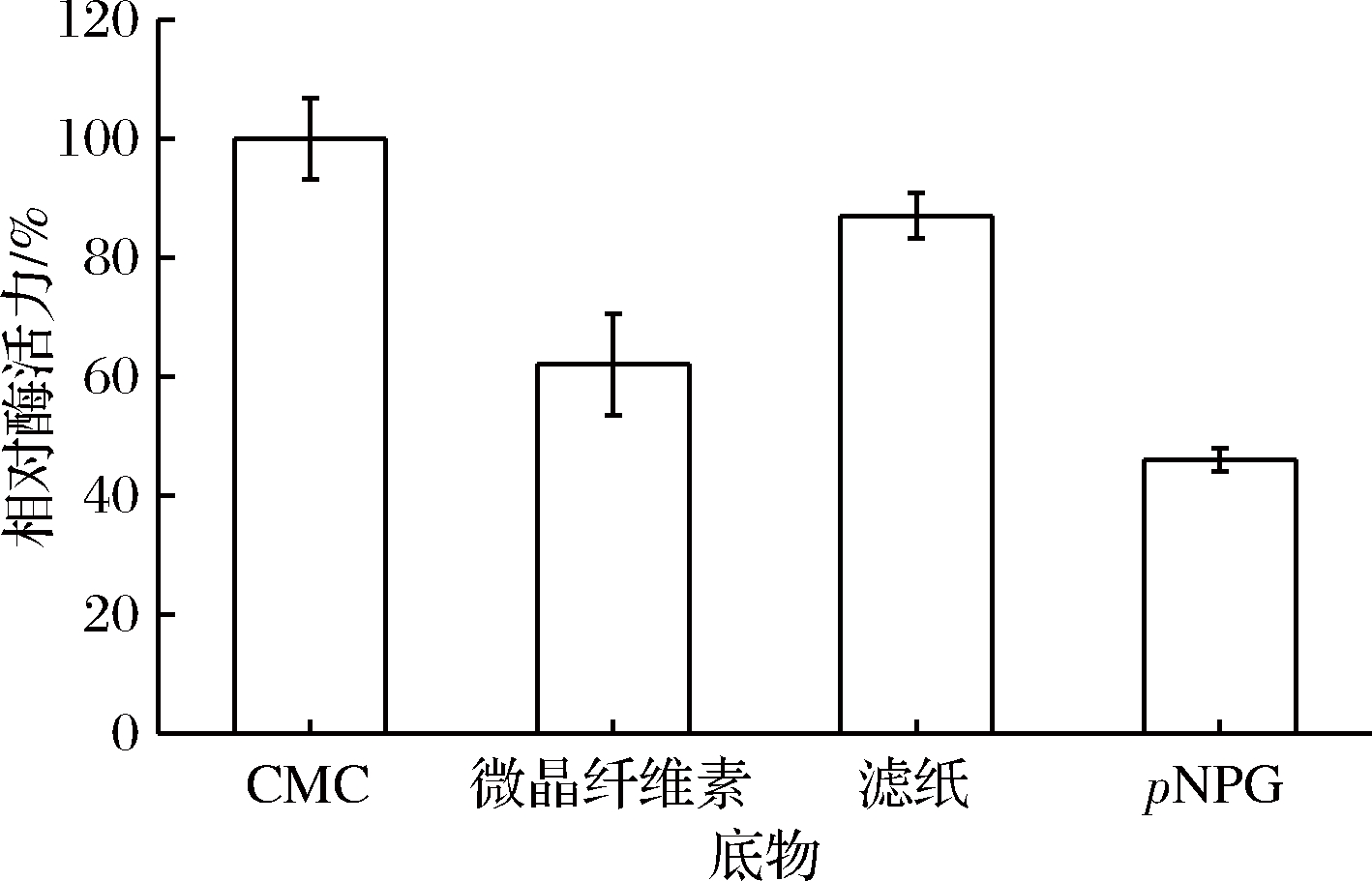
图10 纤维素酶对不同底物的水解活力
Fig.10 Hydrolytic activity of esterase on different substrates
白酒酿造环境蕴含丰富的纤维素降解菌资源[25],研究表明芽孢杆菌属优势菌,如植物内生芽孢杆菌[8]、枯草芽孢杆菌[9]、解淀粉芽孢杆菌[21]等,芽孢杆菌具有耐酸、耐碱、耐高温等显著优势,作为益生菌,具有促进机体消化吸收等功效[22,26]。本研究筛选得到的YS10-2为巨大芽孢杆菌,对白酒酿造环境中芽孢杆菌属纤维素降解菌资源是重要的补充。菌株YS10-2的纤维素酶活与现在报道的从白酒酿造环境筛选得到的芽孢杆菌产纤维素酶活相当[8-9,21,25],对结构类似于天然纤维素的滤纸也有较高的酶活力,表明该菌株对白酒酒糟纤维质资源转化利用具有应用潜力。
3 结论
本研究从白酒酒糟中筛选出1株纤维素酶菌株YS10-2,其CMC酶活力为(36.73±2.45)U/mL,经形态学观察、分子生物鉴定及生理生化鉴定其为巨大芽孢杆菌(Bacillus megaterium)。对菌株YS10-2所产纤维素酶酶学性质研究表明,其最适反应温度为50 ℃,最适反应pH为5.0,在30~55 ℃,pH为4.0~5.5范围内,纤维素酶的稳定性较高。金属离子Ca2+、Zn2+、Mg2+是该酶的激活剂,而Cu2+和Ba2+则对酶活有抑制作用,该酶的最适反应底物为CMC,对滤纸的降解效果也较好。本研究为产纤维素酶菌株资源的开发利用提供补充,以期为白酒酒糟的综合利用提供参考。
[1] JUTURU V, WU Jinchuan.Microbial cellulases: Engineering, production and applications[J].Renewable and Sustainable Energy Reviews, 2014, 33:188-203.
[2] SANGRILA S.Cellulase production by bacteria: a review[J].British Microbiology Research Journal, 2013, 3(3):235-258.
[3] DUTTA S D, TARAFDER M, ISLAM R, et al.Characterization of cellulolytic enzymes of Fusarium soil isolates[J].Biocatalysis and Agricultural Biotechnology, 2018, 14:279-285.
[4] ANIL K P, REETA R S, SANG J S, et al.Thermostable cellulases: Current status and perspectives[J].Bioresource Technology, 2019, 279:385-392.
[5] AO Tianjie, RAN Yi, CHEN Yihao, et al.Effect of viscosity on process stability and microbial community composition during anaerobic mesophilic digestion of Maotai-flavored distiller’s grains[J].Bioresource Technology, 2020,297:124 460.
[6] LIAW J D, BAJWA D S, SHOJAEIARANI J, et al.Corn distiller’s dried grains with solubles(DDGS)-A value added functional material for wood composites[J].Industrial Crops and Products, 2019,139(1):111 525.
[7] 张丽华,王小媛,李昌文,等.酒糟再利用的研究进展[J].食品与发酵工业,2017,43(11):250-256.
[8] 曾林,谭霄,袁春红,等.白酒黄水中纤维素降解菌的分离鉴定及产酶活性研究[J].中国酿造,2016,35(11):59-63.
[9] 董丹,车振明,关统伟.白酒酒糟中产纤维素酶菌株的筛选及其酶活力特性检测[J].中国酿造,2015,34(8):44-48.
[10] 肖瑶,杨建远,张炳火,等.白耙齿菌F036液态发酵产纤维素酶条件优化及纤维素酶酶学性质初步研究[J].食品与发酵工业,2019,45(6):70-76.
[11] 李豪,邹伟,白光剑,等.高产纤维素酶真菌的筛选及鉴定[J].食品与发酵工业,2019,45(6):54-58.
[12] ZHAO Chunhai, LIU Xiaoyan, ZHAN Tong, et al.Production of cellulase by Trichoderma reesei from pretreated straw and furfural residues[J].RSC Advances, 2018,8(63):36 233-36 238.
[13] BEHERA S S, RAY R.Solid state fermentation for production of microbial cellulases: Recent advances and improvement strategies[J].International Journal of Biological Macromolecules, 2016,86:656-669.
[14] 王霞,华琳,张海龙,等.纤维素降解菌CMC-4的分离鉴定、诱变和酶学特性研究[J].土壤, 2017, 49(5):919-925.
[15] MILLER G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Analytical Biochemistry, 1959,31(3):426-428.
[16] 韩丽,李磊,曾毅,等.一株产酯酶窖泥细菌的筛选、鉴定及酶学性质研究[J].中国酿造, 2019, 38(6):43-48.
[17] BUCHANAN R E, GIBONNS N E.伯杰细菌鉴定手册(第8版)[M].中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组译.北京: 科学出版社, 1984.
[18] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京: 科学出版社, 2001.
[19] 李碧婵,陈金燕,苏雅娜,等.纤维素酶高产细菌的筛选、鉴定及酶学特性分析[J].湖北农业科学,2016,55(17):4 572-4 576.
[20] HATEFI A, MAKHDOUMI A, ASOODEH A, et al.Characterization of a bi-functional cellulase produced by a gut bacterial resident of Rosaceae branch borer beetle, Osphranteria coerulescens(Coleoptera: Cerambycidae)[J].International Journal of Biological Macromolecules, 2017,103:158-164.
[21] 何颂捷,左勇,张鑫,等.降解白酒酒糟中纤维素的细菌的分离鉴定[J/OL].食品与发酵工业:1-11[2019-12-10].https://doi.org/10.13995/j.cnki.11-1802/ts.022028.
[22] RAMLUCKEN U, RAMCHURAN S O, MOONSAMY G.A novel Bacillus based multi-strain probiotic improves growth performance and intestinal properties of Clostridium perfringens challenged broilers[J].Poultry Science, 2020,99(1):331-341.
[23] WANG Mengmeng, MA Lei, KONG Zhijian, et al.Insights on the aerobic biodegradation of agricultural wastes under simulated rapid composting conditions[J].Journal of Cleaner Production, 2019, 220:688-697.
[24] 梁倩,李荷,王卓娅.产纤维素酶细菌的分离、鉴定与酶学性质研究[J].广东药科大学学报,2019,35(1):120-125.
[25] 刘茂柯,唐玉明,熊洪,等.白酒酒醅纤维素降解菌的多样性分析及其分离筛选[J].食品与发酵工业, 2018, 44(4):35-41.
[26] SRIARIYANUN M, PRAPAKORN T, PATCHANEE Y, et al.Production, purification and characterization of an ionic liquid tolerant cellulase from Bacillus sp.isolated from rice paddy field soil[J].Electronic Journal of Biotechnology, 2016,19:23-28.