肠道微生物在人体中扮演着重要的角色。人体肠道中存在着约100万亿个微生物,超过人体自身细胞的10倍以上[1]。肠道菌群、宿主、外界环境3者保持着动态平衡,但一些因素,如饮食、药物代谢、年龄等发生改变,就会打破平衡,从而导致一些疾病[2]。因此,肠道微生物的调控越来越引起人们的关注。益生元物质的发酵利用是调控肠道微生物的有效策略,目前被广泛认可的益生元有果胶低聚糖、菊粉、低聚半乳糖、低聚葡聚糖等[3]。由于植物多糖来源广泛,毒副作用小,所以越来越多的植物多糖被研究者开发为益生元物质[4]。
已有研究表明,许多植物多糖对肠道微生物的生长和代谢具有积极的影响。它们经过口腔、胃和小肠,但却不能被降解,最后到达大肠结肠而被肠道微生物发酵利用,通过改善肠道菌群结构和增加短链脂肪酸[5]等代谢产物促进人体健康[6]。例如,四君子汤多糖可以调节人肠道中微生物的丰度,其降解产物可以增加乙酸和总酸的含量[7];桑椹多糖与粪便培养物发酵48 h后,粪便培养物的pH从7.12降至6.14,并且总SCFA、乙酸、丙酸和丁酸含量都显著增加[8]。此外,铁皮石斛多糖[9]、大麦葡聚糖[10]和灵芝多糖[11]等都具有相似的功能。
黄芪(Astragalus propinquus Schischkin)是我国的一种特色食材、药材,含有多糖、苷类、氨基酸和黄酮等多种化学成分。其中多糖是重要的有效成分之一。已有研究表明,黄芪多糖具有抗氧化[12]、抗心血管疾病[13]、增强免疫力[14]等多种功效。同时黄芪多糖作为植物多糖,也可能具有一定的益生活性。但对于黄芪多糖益生活性的研究多集中于动物实验,动物实验成本高,实验繁琐,实验周期也较长,并且鲜有研究涉及黄芪多糖对肠道微生物的益生作用研究。课题组从黄芪中获得一种水溶性黄芪粗多糖,并基于人体粪便体外发酵,利用实验室建立的模拟人体肠道平台系统,采用人体粪便体外发酵来研究人体肠道微生物对黄芪多糖的代谢及益生活性物质分析,为开发黄芪多糖作为益生元物质提供理论基础。
1 材料与方法
1.1 实验材料
黄芪饮片,北京同仁堂(产地:蒙古);填料DEAE Fast Flow,美国GE公司;木瓜蛋白酶,阿拉丁;菊粉,比利时Cosucra公司;其他试剂均为分析纯。
1.2 仪器与设备
3K15 型冷冻高速离心机,美国 Sigma 公司; LC-1200 型高效液相色谱,美国 Agilent 公司; ICS5000离子色谱仪,美国戴安公司;NEXUS傅里叶变换红外光谱仪,美国尼高力仪器公司;AV-500 MHz全数字化核磁共振波谱仪,德国布鲁克公司;7890A气相色谱仪,美国Agilent公司。
1.3 实验方法
1.3.1 黄芪多糖的分离纯化
黄芪饮片在60 ℃烘箱中干燥后粉碎成粉末,石油醚超声30 min以除去脂类。自然挥干石油醚后采用传统热水浸提的方法[经试验得出最佳提取条件为:料液比1∶50(g∶mL),浸提温度80 ℃,浸提时间2.5 h]得到糖溶液,浓缩至100 mL后加入5倍体积乙醇醇沉。沉淀复溶于去离子水中,按1.5 g/L的比例加入木瓜蛋白酶,60 ℃水浴2 h后于95 ℃下灭酶30 min。然后用Savage法去蛋白,其中V(氯仿)∶V(正丁醇)=4∶1,V(Savage试剂)∶V(样液)=5∶1,充分振荡后离心小心取上清液,重复操作直至中间无蛋白层出现。再次加入5倍体积乙醇醇沉,沉淀依次用丙酮和无水乙醇洗涤2次,复溶于去离子水中,使用截留分子质量为3 500 Da的透析袋,于自来水和去离子水中分别透析2 d,冻干得黄芪粗多糖(Astragalus crude polysaccharide, APS)。
称取50 mg APS,溶于10 mL去离子水中,过0.45 μm滤膜后经DEAE Fast Flow(80 cm×1.5 cm)离子交换柱纯化,用水、0.1、0.2和0.3 mol/L的NaCl依次洗脱,每管收集5 mL洗脱液,并利用苯酚硫酸法测定每管的吸光度(A490),绘制洗脱曲线。收集主要洗脱组分,透析除盐后冻干得到纯化后黄芪多糖(APS-1和APS-2)。
1.3.2 黄芪多糖的总糖和蛋白含量测定
分别利用苯酚硫酸法[15]和考马斯亮蓝G-250法[16]分别测定总糖和蛋白含量。得率按公式(1)计算,总糖和蛋白含量按公式(2)计算:
(1)
式中:m1,提取液中总糖质量或APS-1、APS-2的质量,g;m2,黄芪粉的质量,g。
(2)
式中:m1,测定的APS、APS-1、APS-2中的总糖或蛋白的质量,g;m2,APS、APS-1、APS-2的质量,g。
1.3.3 黄芪多糖的分子质量和单糖组成分析
利用高效凝胶过滤色谱(high perfomance size exclusion chromatography, HPGFC)法测定APS-1和APS-2的分子质量,由葡聚糖标准品(Mw:3.65、21、55.5、123.5和326.6 kDa)得到标准曲线方程。色谱条件如下:LC-1200 型高效液相色谱仪; RID检测器; Superose12(1.0×30 cm)色谱柱; 流动相0.01 mol/L NaOH; 流速0.5 mL/min; 柱温30 ℃;进样量20 μL。
配制单糖混合标准溶液1 mg/mL(鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、核糖、半乳糖醛酸、葡萄糖醛酸)。称取5 mg APS-1和APS-2,分别加入300 μL 2 mol/L的三氟乙酸,100 ℃下降解12 h,氮气吹干,加入300 μL甲醇,吹干,重复操作3次以除去三氟乙酸,然后定容至25 mL。使用离子色谱仪(脉冲安培检测器)进行色谱分析。采用CarboPac PA20色谱柱,进行梯度洗脱,程序如表1所示。
表1 离子色谱的洗脱程序
Table 1 The elution program of ion chromatography
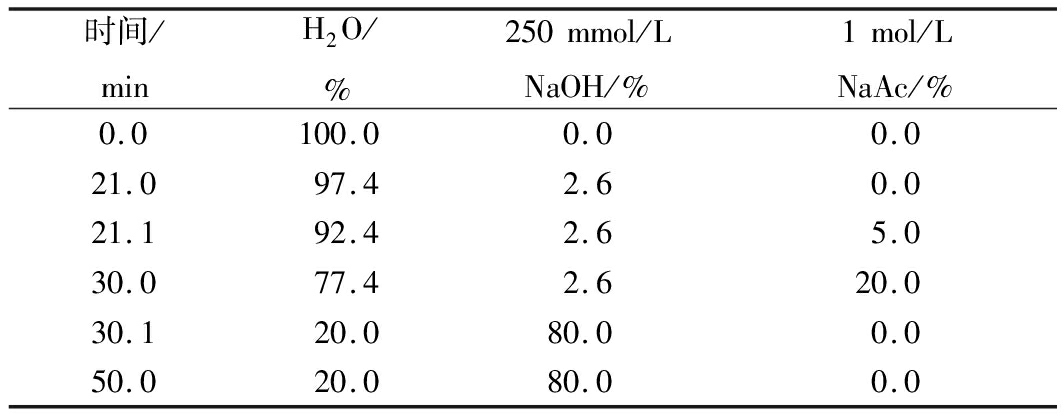
时间/minH2O/%250mmol/LNaOH/%1mol/LNaAc/%0.0100.00.00.021.097.42.60.021.192.42.65.030.077.42.620.030.120.080.00.050.020.080.00.0
1.3.4 黄芪多糖的FT-IR分析
取干燥的APS-1和APS-2 1~2 mg,利用KBr压片的方法[17],在400~4 000 cm-1内进行检测。
1.3.5 黄芪多糖的1H-NMR分析
取干燥的APS-1和APS-2样品50 mg溶于0.5 mL D2O中,在AV-500 MHZ核磁共振波谱仪上进行NMR实验获得1H谱。
1.3.6 培养基
采用PHAM等[18]的方法,稍作修改,具体配方如下:胰蛋白胨2 g,酵母浸粉2 g,NaCl 0.1 g,K2HPO40.04 g,KH2PO4 0.04 g,MgSO4·7H2O 0.01 g,CaCl2·6H2O 0.01 g,NaHCO3 2 g,吐温-80 2 mL,氯化血红素0.025 g,L-半胱氨酸盐酸盐0.5 g,胆汁盐0.5 g,刃天青0.25 g,VK1 0.002 g(过滤除菌)溶于1 L去离子水中,115℃灭菌20 min。
1.3.7 粪便接种物
新鲜的粪便来自3个健康的志愿者(1男2女),志愿者均遵循正常饮食(中国饮食),没有消化系统疾病,并且至少3个月没有接受抗生素治疗。将粪便样品收集到无菌小瓶中,粪便样品按一定比例(根据DNA含量计算[19])混合后,以1∶10(g∶mL)加入pH 7.3磷酸盐缓冲液,均质化,并通过4层无菌纱布过滤最终获得人体粪便接种物[8]。
1.3.8 体外发酵
实验组:APS 5 g/L作为唯一碳源(由于APS-1和APS-2的量很少,不足以用于发酵,并且两者由黄芪粗多糖得到,所以采用APS来进行体外发酵实验也可以代表黄芪多糖);阴性对照组:不加任何碳源;阳性对照组:5 g/L菊粉作为唯一碳源。并以10%的接种量加入粪便接种物。在37 ℃的厌氧环境下培养48 h,分别在发酵0、12、24和48 h时取样,12 000 r/min离心5 min后,移取发酵上清液测定pH值,所有样品在-40 ℃保存用于后续检测。
1.3.9 SCFA含量的测定
取发酵液1 mL,加入10 μL 2-甲基丁酸(1 mol/L)作为内标,缓缓加入250 μL浓HCl,混匀,加入1 mL乙醚,涡旋1 min,静置,待有机相和水相分层。取有机相,加入无水Na2SO4,涡旋,过0.22 μm有机滤膜,取5 μL做气相。色谱条件如下:仪器,Agilent-7890A;色谱柱,HP-INNOWAX;检测器温度250 ℃;进样口温度220 ℃;流速1.5 mL/min;分流比1∶20;加热程序60~190 ℃,4 min;进样量5 μL。
1.4 数据分析
所有实验均重复3次,结果表示为平均值±标准偏差(SD)。采用SPSS软件进行单因素方差分析(ANOVA),P<0.05表示差异显著。
2 结果与分析
2.1 黄芪多糖的分离纯化
APS经DEAE Fast Flow色谱用水和不同浓度的NaCl洗脱,洗脱曲线见图1,洗脱后得到2个吸光度值较高的洗脱峰,分别命名为APS-1和APS-2,冻干备用。
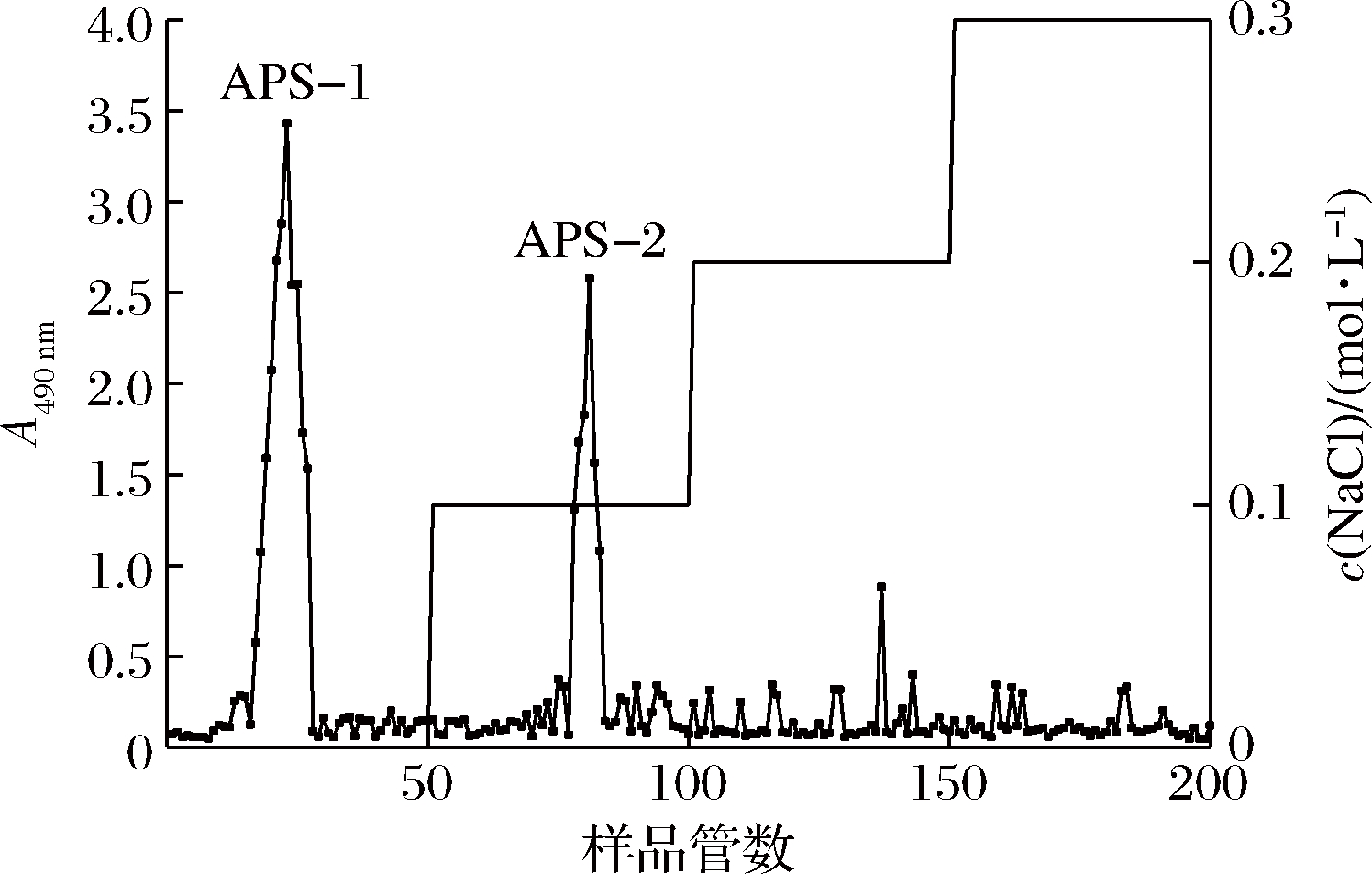
图1 DEAE Fast Flow色谱柱的洗脱曲线
Fig.1 Elution curve of DEAE Fast Flow column
2.2 黄芪多糖的总糖和蛋白含量测定
根据苯酚硫酸法和考马斯亮蓝G250法分别测得APS、APS-1和APS-2的总糖和蛋白含量。结果如表2所示,APS和APS-2均含有30%左右的蛋白,APS-1则不含有蛋白。
表2 黄芪多糖的得率、总糖和蛋白含量 单位:%
Table 2 Yield, total sugar and protein content of Astragalus polysaccharide
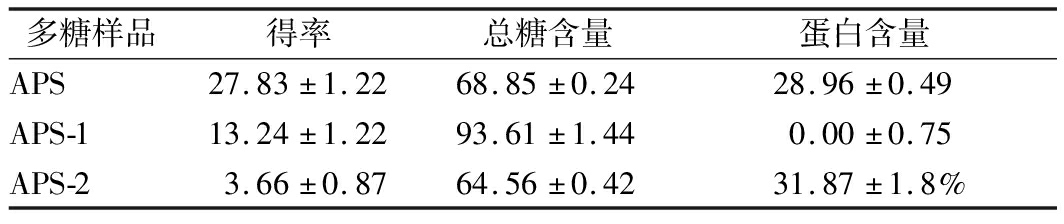
多糖样品得率总糖含量蛋白含量APS27.83±1.2268.85±0.2428.96±0.49APS-113.24±1.2293.61±1.440.00±0.75APS-23.66±0.8764.56±0.4231.87±1.8%
2.3 黄芪多糖的分子质量和单糖组成分析
分子质量和单糖组成的结果显示,APS主要由鼠李糖、半乳糖和葡萄糖组成,摩尔比为1∶2.62∶21.32。APS-1的分子质量为38.4 kDa,主要由半乳糖和葡萄糖组成,摩尔百分比为1∶49.76。APS-2的分子质量为5.2 kDa,主要由鼠李糖、半乳糖和葡萄糖组成,摩尔百分比为1∶2.99∶16.26。
LI等[20]采用水提醇沉法从甘肃兰州的黄芪中获得一种分子质量为36 kDa的水溶性黄芪多糖,其仅由葡萄糖组成。李宏全等[21]应用微波萃取技术从蒙古黄芪中提取了一种新杂聚黄芪多糖,分子质量为10 kDa,单糖组成及分子摩尔比为鼠李糖∶葡萄糖∶半乳糖∶阿拉伯糖=1.19∶72.01∶5.85∶20.95。LIAO等[22]运用热水浸提的方法从一种蜂蜜加工的黄芪中获得黄芪多糖(HAPS),并应用HPGFC和PMP柱前衍生后的超高效液相色谱四极杆飞行时间质谱(UPLC/ESI-Q-TOF-MS)分析了HAPS的相对分子质量为1 695.7 kDa,单糖组成及摩尔比为甘露糖∶葡萄糖∶木糖∶阿拉伯糖∶葡萄糖醛酸∶鼠李糖=0.06∶28.34∶0.58∶0.24∶0.33∶0.21。本研究获得的APS-1和APS-2分子质量和单糖组成与以往研究存在差异,这可能是提取方法和黄芪产地的不同所导致的。
2.4 黄芪多糖的FT-IR分析
由图2可知,APS-1在3 420.1 cm-1处的吸收峰属于—OH的伸缩振动,在2 918.9 cm-1处的吸收峰是由于γ—CH2和C—H的伸缩振动,1 647.4 cm-1的吸收峰归因于羧基的C—O键的振动,1 412.6和1 384.1 cm-1的吸收峰属于δ—CH2的弯曲振动,1 154.6和1 080.4 cm-1的吸收峰归因于C—O—C和C—O的伸缩振动,1 019.6 cm-1的吸收峰表明存在吡喃糖环,931.4和849.5 cm-1的吸收峰属于α-型糖苷键[23],即APS-1以α-型吡喃糖苷键为主。APS-2在3 412.4 cm-1处的宽吸收峰是—OH的特征伸缩振动[24],在2 925.5 cm-1处的吸收峰是由于γ—CH2和C—H的伸缩振动[25],1 647.9和1 570.7 cm-1的吸收峰归因于羧基的C—O键的存在[26],1 418.8和1 384.6 cm-1的吸收峰属于δ—CH2的弯曲振动[27],1 151.3和1 078.9 cm-1的吸收峰归因于C—O—C和C—O的伸缩振动,1 026.9 cm-1的吸收峰表明存在吡喃糖环。另外,896.6和864.3 cm-1处的峰表明APS-2中存在相应的α-D-吡喃糖苷和β-D-吡喃糖苷变形模式[23]。综上,APS-1以α-型糖苷键为主,APS-2同时包含α-型糖苷键和β-型糖苷键。
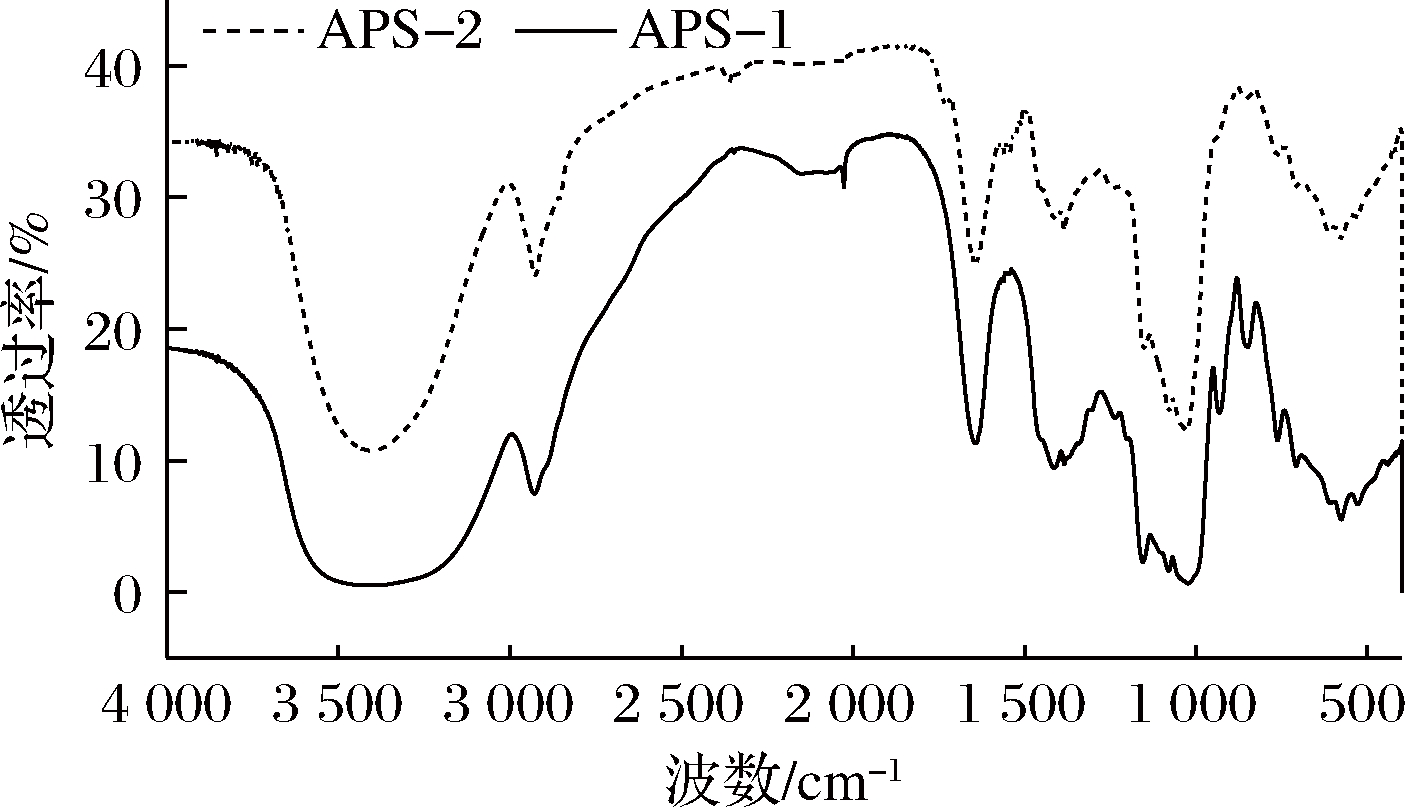
图2 APS-1和APS-2的红外光谱图
Fig.2 Infrared spectrum of APS-1 and APS-2
2.5 黄芪多糖的1H-NMR分析
采用1H-NMR进一步鉴定APS-1和APS-2的糖苷键构型,通常δ4.5~5.5 ppm之间为异头质子(H-1)共振区,其中α-型吡喃糖1H的化学位移大于5.0 ppm,而小于5.0 ppm则表明为β-型吡喃糖。
图3-a为APS-1的1H-NMR谱图,异头质子H-1区域共有4个共振峰信号,分别在δ 5.40、δ 5.22、δ 4.96和δ 4.65 ppm处出现,表明APS-1中同时存在α-型吡喃糖和β-型吡喃糖,但α-型吡喃糖的比例远高于β-型吡喃糖。结合APS-1的红外光谱中未出现β-型吡喃糖的特征吸收峰的结果,表明APS-1主要以α-型糖苷键为主。如图3-b所示,异头质子H-1的化学位移有大于5.0 ppm,也有小于5.0 ppm,说明APS-2同时包含α-型吡喃糖和β-型吡喃糖,且两者所占比例相差不大。
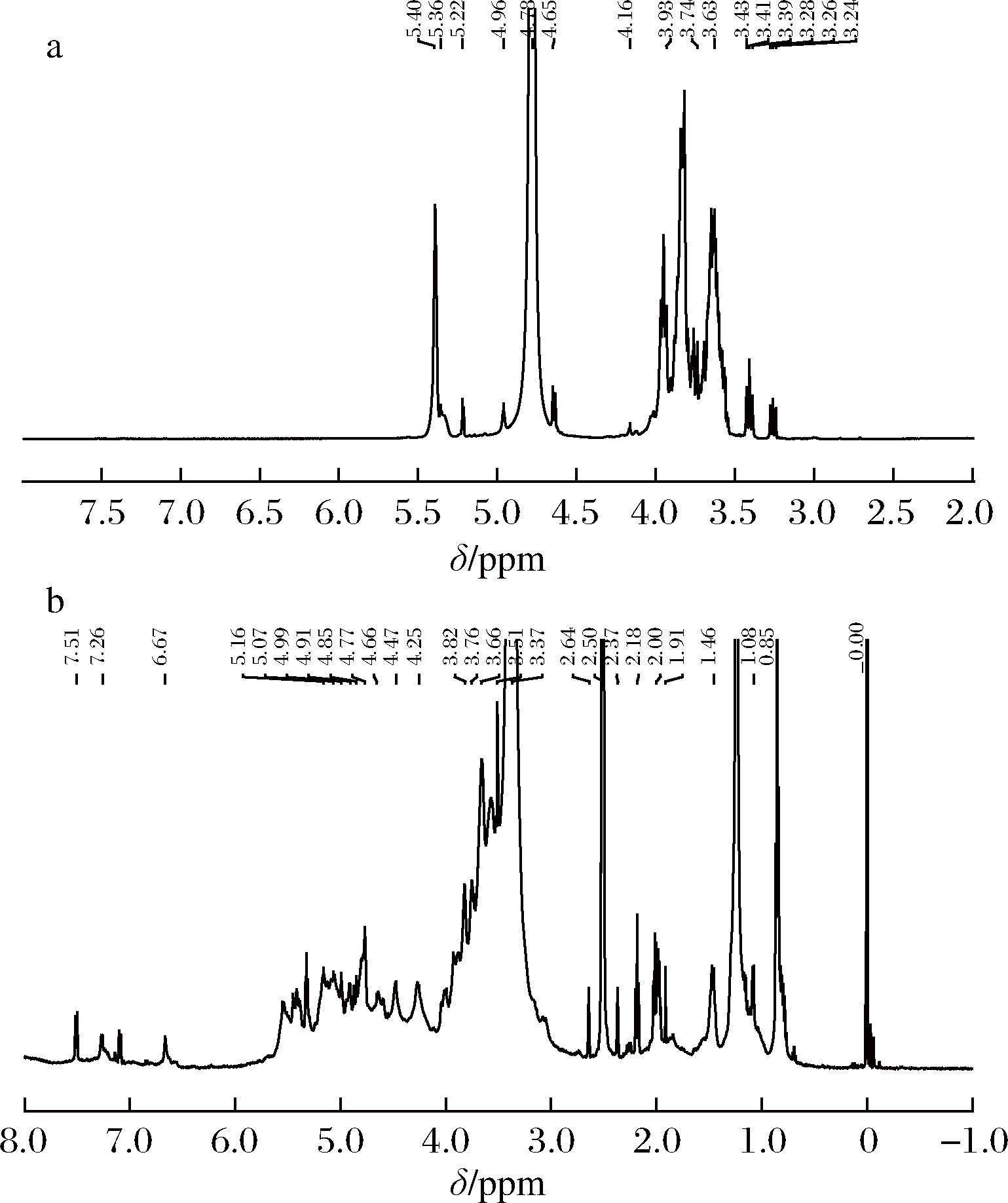
a-APS-1的1H谱图;b-APS-2的1H谱图
图3 APS-1和APS-2的1H-NMR谱图
Fig.3 1H-NMR spectrum of APS-1 and APS-2
FU等[28]采用沸水浸提法从来自甘肃定西的黄芪中获得一种分子质量为301 kDa的水溶性黄芪多糖,其单糖组成及摩尔比为鼠李糖∶木糖∶葡萄糖∶半乳糖=1∶4∶5∶1.5,并同时含有α-型糖苷键和β-型糖苷键。李宏全等[21]分析了一种从蒙古黄芪中获得的新杂聚黄芪多糖的1H-NMR图谱,结果表明其主要构型为α-吡喃构型。LIAO等[22]运用1H-NMR分析了一种来自蜂蜜加工的黄芪制剂的黄芪多糖(HAPS),结果显示其同时含有α-型糖苷键和β-型糖苷键,且存在糖醛酸和乙酰基。不同黄芪多糖包含不同的糖苷键构型,这也可能是黄芪的产地不同或者提取方法不同所引起的。
2.6 pH和总糖含量的变化
发酵培养基的pH变化可以反映发酵过程的产酸量,如图4所示。
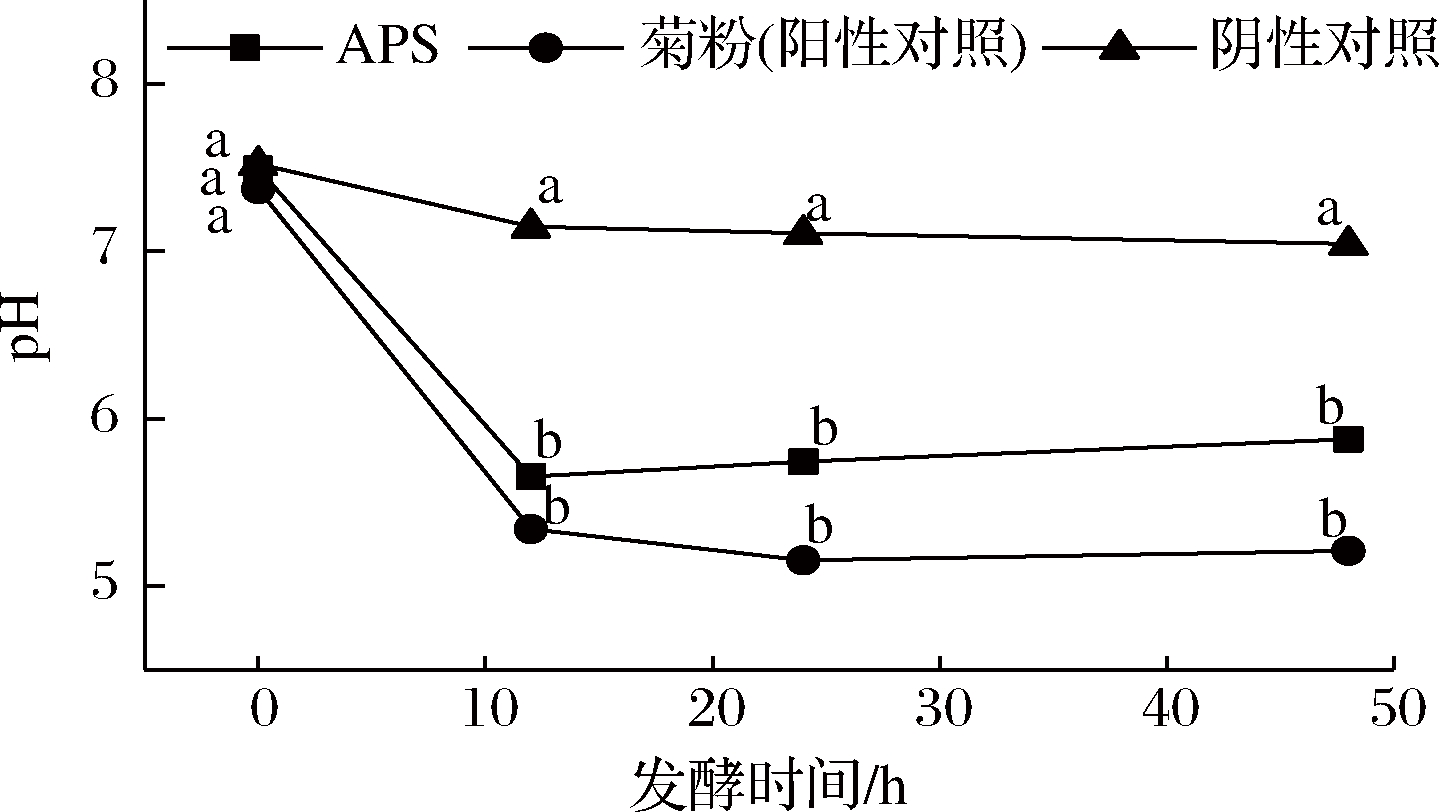
图4 不同处理组在人体粪便体外发酵过程中的pH变化
Fig.4 pH changes in different treatment groups during in vitro fermentation of human feces
注:值为平均值±标准偏差(n=3)。同一发酵时间标记的不同字母表示差异显著(P<0.05)(下同)
发酵48 h,阴性对照组的pH从7.52变化到7.07;APS组的pH从7.49降低至5.88(P<0.05);菊粉(阳性对照)组的pH从7.37降为5.21(P<0.05)。另外,在发酵的各个时间点APS和菊粉组的pH都较阴性对照组低很多。结果与之前的研究一致,例如添加铁皮石斛多糖发酵时观察到pH明显降低,发酵48 h后pH由6.59降为4.70[9]。pH与芦荟多糖[6]类似,但低于桑椹多糖[8]。
不同处理组在不同发酵时间点培养基中总糖含量的变化见表4。由表可知,发酵12h后,APS组中90%以上的总糖已被消耗,由此说明APS可以被人类肠道微生物利用。
表4 不同处理组在人体粪便发酵过程中的总糖含量变化
Table 4 Changes in total sugar content in human feces during fermentation in different treatment groups

发酵时间/h总糖含量/(g·L-1)APS菊粉(阳性对照)阴性对照03.01±0.05a5.54±0.17a0.25±0.02a120.23±0.01b0.23±0.07b0.09±0.01b240.13±0.02c0.15±0.07bc0.07±0.01b480.12±0.05c0.13±0.01c0.07±0.01b
注:值为平均值±标准偏差(n=3)。不同时间点数据后的不同小写字母表示差异显著(P<0.05)
2.7 短链脂肪酸(short-chain fatty acids, SCFA)的产生
肠道微生物可以利用不宜被消化的碳水化合物,并产生有益于人体健康的短链脂肪酸(SCFA)。在人体粪便发酵APS和菊粉(阳性对照)的过程中SCFA浓度的变化见图5。发酵48 h后,在APS组中,总SCFA的浓度从(3.85±0.06)mmol/L增加到(73.98±0.08)mmol/L,其中乙酸浓度由(2.96±0.04)mmol/L增加至(43.94±0.02)mmol/L,丙酸由(0.72±0.01)mmol/L增加到(23.74±0.02)mmol/L,丁酸从(0.18±0.01)mmol/L增加到(6.30±0.04)mmol/L。在菊粉组(阳性对照)中,总SCFA的浓度从(3.35±0.04)mmol/L增加至(67.27±0.22)mmol/L,乙酸浓度由(2.43±0.01)mmol/L增至(37.27±0.01)mmol/L,丙酸浓度从(0.71±0.02)mmol/L增至(28.20±0.12)mmol/L,丁酸的浓度从(0.21±0.01)mmol/L增加到(1.80±0.09)mmol/L。在阴性对照组中,总SCFA的浓度从(2.57±0.03)mmol/L增加到(26.32±0.09)mmol/L,乙酸的浓度从(1.87±0.01)mmol/L增至(17.13±0.02)mmol/L,丙酸浓度由(0.49±0.01)mmol/L增加到(5.39±0.03)mmol/L,丁酸浓度从(0.20±0.01)mmol/L增加到(3.79±0.04)mmol/L。由此可知,APS组和菊粉组(阳性对照)中SCFA的产生相比于阴性对照组都显著增加(P<0.05)。其中,菊粉组(阳性对照)中丙酸的产生高于APS组,但APS组中乙酸和丁酸的产生都高于菊粉组(阳性对照)。结果表明,APS可以在体外被肠道微生物降解利用产生丰富的SCFA,具有较好的益生活性。
乙酸是肠道中重要的脂肪酸,也是评价益生效应的重要指标[29]。如图5-A所示,APS组中乙酸的产量显著高于菊粉组(阳性对照)和阴性对照组(P<0.05),并且是该发酵过程生成最多的SCFA,发酵液pH的降低可能主要是由于乙酸的产生。如图5-D所示,在发酵48 h后,APS组的总SCFA的产量高于菊粉组,而APS组的pH却低于菊粉组,这可能是由于发酵还产生了其他未检测的酸性物质,如乳酸等。丙酸是一种葡萄糖异生物,能够抑制肝脏中胆固醇和脂肪酸的合成,进而引起血脂水平下降[30]。并且通过降低乙酸和丙酸的比例能够降低血脂和一些心血管疾病的产生[6]。由图5-B可知,APS组中丙酸的产量显著低于菊粉组(阳性对照),乙酸和丙酸的比例高于菊粉组(阳性对照),由此可以推断,APS的降血脂功能可能低于菊粉。丁酸是结肠上皮细胞的重要底物,并且在细胞增殖和分化的调节中也起主要作用,还有研究表明丁酸可以促进癌细胞凋亡和强化结肠黏膜各种功能[31-32]。本研究中,如图5-C所示,APS组丁酸的产量显著高于菊粉组(阳性对照)(P<0.05),这在一定程度上表明APS在促进癌细胞凋亡和强化结肠黏膜功能方面可能具有相应的潜力。

图5 不同处理组在人体粪便发酵过程中的SCFA浓度变化
Fig.5 Changes in SCFA concentration during fermentation of human feces in different treatment groups
3 结论
本研究通过对黄芪粗多糖的分离纯化而获得APS-1和APS-2,并应用HPLC、IC、FT-IR和1H-NMR等结果的分析了解到APS-1主要以α-型糖苷键为主,APS-2含有α-型糖苷键和β-型糖苷2种构型。然后在体外利用人体粪便发酵黄芪粗多糖(APS),结果显示,APS发酵降低了培养基的pH,总糖含量随发酵时间增加而降低,乙酸、丙酸和丁酸等短链脂肪酸的产生显著增加。推断APS在体外人体粪便发酵过程中可以被肠道微生物分解利用,产生丰富的SCFA等代谢产物,有益于人体肠道健康,研究结果表明APS具有较好的益生活性。
[1] LI J H, JIA H J,CAI X H,et al.An integrated catalog of reference genes in the human gut microbiome[J].Nature Biotechnology, 2014, 32(8): 834-841.
[2] 李蒙子,邱芳驰,陈倩,等.中药多糖调节肠道菌群研究进展[J].中国食物与营养, 2017, 23(12): 13-16.
[3] GIBSON G R, PROBERT H M, LOO J V, et al.Dietary modulation of the human colonic microbiota: updating the concept of prebiotics[J].Nutrition Research Reviews,2004, 17(2): 259-275.
[4] 祁玉丽,高坤,孙印石,等.植物多糖对肠道微生态的作用研究进展[J].中国微生态学杂志, 2018, 30(4): 489-494.
[5] LAYDEN B T, ANGUEIRA A R, BRODSKY M, et al.Short chain fatty acids and their receptors: new metabolic targets[J].Translational Research, 2013, 161(3): 131-140.
[6] GULLON B, GULLON P, TAVARIA F, et al.In vitro assessment of the prebiotic potential of Aloe vera mucilage and its impact on the human microbiota[J].Food Function, 2015, 6(2): 525-531.
[7] GAO B B, WANG R J,PENG Y,et al.Effects of a homogeneous polysaccharide from Sijunzi decoction on human intestinal microbes and short chain fatty acids in vitro[J].Journal of Ethnopharmacology, 2018, 224(2018): 465-473.
[8] CHEN C,HUANG Q,FU X, et al.In vitro fermentation of mulberry fruit polysacchrides by human fecal inocula and impact on microbiota[J].Food Function,2016,7(11):4 637-4 643.
[9] FU Y S, ZHANG J N, CHEN K N, et al.An in vitro fermentation study on the effects of Dendrobium officinale polysaccharides on human intestinal microbiota from fecal microbiota transplantation donors[J].Journal of Functional Foods, 2019, 53: 44-53.
[10] NERURKAR P V, MIYAMOTO J, WATANABE K, et al.Barley β-glucan improves metabolic condition via short-chain fatty acids produced by gut microbial fermentation in high fat diet fed mice[J].Plos One, 2018, 13(4): e0196579.
[11] LUO J, ZHANG C, LIU R, et al.Ganoderma lucidum polysaccharide alleviating colorectal cancer by alteration of special gut bacteria and regulation of gene expression of colonic epithelial cells[J].Journal of Functional Foods, 2018, 47: 127-135.
[12] CHEN R Z, TAN L, JIN C G, et al.Extraction, isolation, characterization and antioxidant activity of polysaccharides from Astragalus membranaceus[J].Industrial Crops and Products, 2015, 77: 434-443.
[13] WANG Y F, YANG X F, CHENG B, et al.Protective effect of Astragalus polysaccharides on ATP binding cassette transporter A1 in THP-1 derived foam cells exposed to tumor necrosis factor-alpha[J].Phytotherapy research, 2010, 24(3): 393-398.
[14] ZHAO L H, MA Z X, ZHU J, et al.Characterization of polysaccharide from Astragalus radix as the macrophage stimulator[J].Cell Immunol, 2011, 271(2): 329-334.
[15] 唐雨薇,张宇,王宇亮,等.黄芪多糖分离与结构特征分析[J].时珍国医国药,2014,25(5):1 097-1 100.
[16] 夏泉,刘钢,葛朝亮,等.Sevag法去除黄芪粗多糖中蛋白质成分的研究[J].安徽医药,2007, 11(12): 1 069-1 071.
[17] YAN H, XIE Y, SUN S, et al.Chemical analysis of Astragalus mongholicus polysaccharides and antioxidant activity of the polysaccharides[J].Carbohydrate Polymers,2010,82(3): 636-640.
[18] PHAM T, TEOH K T, SAVARY B J,et al.In vitro fermentation patterns of rice bran components by human gut microbiota[J].Nutrients, 2017, 9(11):1 237.
[19] LAM K L, KO K C, LI X, et al.In vitro infant faecal fermentation of low viscosity barley beta-glucan and its acid hydrolyzed derivatives: evaluation of their potential as novel prebiotics[J].Molecules, 2019, 24(828):doi:10.3390/molecules 24050828.
[20] LI S G, ZHANG Y Q, Characterization and renal protective effect of a polysaccharide from Astragalus membranaceus[J].Carbohydrate Polymers,2009,78(2):343-348.
[21] 李宏全,赵万国,吕小虎等,黄芪中一种新杂聚多糖的理化分析[J].中国药学杂志,2009,44(9):654-657.
[22] LIAO J Z, LI C Y, HUANG J, et al.Structure characterization of honey-processed Astragalus polysaccharides and its anti-inflammatory activity in vitro[J].Molecules, 2018,23(1):168.
[23] LIU Y M, LIU W, LI J, et al.A polysaccharide extracted from Astragalus membranaceus residue improves cognitive dysfunction by altering gut microbiota in diabetic mice[J].Carbohydrate polymers, 2019, 205: 500-512.
[24] WIOLETA W A K, LUCYNA D, JERZY H, et al.Fibres from flax overproducing β-1,3-glucanase show increased accumulation of pectin and phenolics and thus higher antioxidant capacity[J].BMC Biotechnology, 2013, 13(1): 10.
[25] PHUKAN M M, CHUTIA R S, KONWAR B K, et al.Microalgae chlorella as a potential bio-energy feedstock[J].Applied Energy, 2011, 88(10): 3 307-3 312.
[26] LI R, CHEN W C, WANG W P, et al.Extraction, characterization of Astragalus polysaccharides and its immune modulating activities in rats with gastric cancer[J].Carbohydrate polymers, 2009, 78(4): 738-742.
[27] SCHENZEL K, FISCHER S.FT Raman spectroscopy-a rapid analytical tool for detecting the transformation of cellulose polymorphs[J].Cellulose, 2001, 8(1): 49-57.
[28] FU J, HUANG L F, ZHANG H T, et al.Structural features of a polysaccharide from Astragalus membranaceus(Fisch.)Bge.var.mongholicus(Bge.)Hsiao[J].Journal of Asian Natural Products Research,2013,15(6):687-692.
[29] OLIVERIRA D L, COSTABILE A, WILBEY R A, et al.In vitro evaluation of the fermentation properties and potential prebiotic activity of caprine cheese whey oligosaccharides in batch culture systems[J].Biofactors, 2012, 38(6): 440-449.
[30] KOK N M D A N.Effects of fructans-type prebiotics on lipid metabolism[J].American Society for Clinical Nutrition, 2001, 73(2): 456S-458S.
[31] WE R.Role of anaerobic bacteria in the metabolic welfare of the colonic mucosa in man[J].Gut, 1980, 21: 793-798.
[32] LAPARRA J M, SANZ Y.Interactions of gut microbiota with functional food components and nutraceuticals[J].Pharmacological Research, 2010, 61(3): 219-225.