石花菜(Gelidium amansii)又名海冻菜、鸡毛菜,是一种石花菜科(Gelidiaceae)石花菜属(Gelidium)的海洋经济红藻,在日本、韩国以及我国自北到南沿海地带均有分布[1-3]。作为提取琼胶的主要原料之一,石花菜在医药、生物研究、水产养殖、食品、化妆品等领域被广泛应用[4-6]。多糖是石花菜中含量最高的成分,也是石花菜中具有重要生物活性的主成分之一,相关研究表明[7-10],石花菜多糖在降血脂、降血糖、抗病毒、抗炎、免疫调节等方面效果显著。目前,国内外研究石花菜多糖生物活性的报道较多,但多数研究未对石花菜多糖进行分离纯化,仍保留了大量蛋白质、色素等杂质[11-13]。为了更深层次解析石花菜多糖的结构性质及生物活性,对所提粗多糖进行分离纯化的研究必不可少。
实验室前期已对石花菜多糖的提取方法进行了优化,本研究以石花菜为原料,采用优化的复合酶法提取工艺对石花菜多糖进行提取,利用Sevage法对粗多糖中的蛋白质进行脱除,进一步应用DEAE-52纤维素阴离子交换柱联合Sephadex G-200凝胶过滤层析对所得多糖进行分离纯化,对所得高纯度多糖的理化性质进行了分析,并通过1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone, PMP)对多糖进行柱前衍生化处理,采用高效液相色谱技术对其单糖组成进行了测定,以期为石花菜多糖结构解析及功能性产品的研究开发提供初步理论依据。
1 材料与方法
1.1 材料与试剂
石花菜(Gelidium amansii),产自山东威海。
DEAE-52纤维素、Sephadex G-200,合肥博美生物科技有限责任公司;纤维素酶(酶活性≥30 U/mg)、木瓜蛋白酶(酶活性≥2.0×105 U/mg),广州领驭生物科技有限公司。
14种单糖标准品:D(+)-葡萄糖(glucose, Glu)、D-甘露糖(mannose, Man)、L-鼠李糖(rhamnose, Rha)、D-半乳糖(galactose, Gal)、D-阿拉伯糖(arabinose, Arb)、L(-)-岩藻糖(fucose, Fuc)、木糖(xylose, Xyl)、核糖(ribose, Rib)、氨基葡萄糖(glucosamine, GlcN)、氨基半乳糖(galactosamine, GalN)、古洛糖醛酸(guluronic acid, G)、甘露糖醛酸(mannuronic acid, M)、葡萄糖醛酸(glucuronic acid, GlcUA)、半乳糖醛酸(galacturonic acid, GalUA),均购自广州领驭生物科技有限公司;1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone, PMP)、无水乙醇、NaCl、苯酚、浓H2SO4、浓HCl、氯仿、正丁醇、三氟乙酸(trifluoroacetic acid, TFA)、Na2HPO4、NaH2PO4、NaOH等试剂均为国产分析纯;乙腈为国产色谱纯。
1.2 仪器与设备
UV2550紫外可见分光光度计,日本岛津公司;EYELAN-1000旋转蒸发仪,日本东京理化器械株式会社;Alphal-4冷冻干燥机,德国Christ公司;SUNRISE吸光酶标仪,瑞士TECAN公司;3K30台式高速冷冻离心机,德国Sigma公司;THZ-82水浴恒温振荡器,金坛市精达仪器制造厂;Agilent 1100液相色谱仪,美国安捷伦科技公司;N-EVAP24氮吹仪,美国ORGANOMATION公司;IRAffinity-1红外光谱仪,日本岛津公司。
1.3 实验方法
1.3.1 石花菜粗多糖的提取工艺流程
将石花菜干藻用自来水浸泡、反复冲洗以去除砂砾及贝壳等杂质,洗净后的石花菜自然晾晒一段时间后置于55 ℃恒温干燥箱中鼓风烘干,干燥后用粉碎机粉碎,过80目筛,以无水乙醇作为溶剂,置于恒温振荡器中8 h进行脱脂操作。在复合酶[m(木瓜蛋白酶)∶m(纤维素酶)=2∶1]添加量23 g/L、酶解温度60.5 ℃、料液比1∶32(g∶mL)条件下提取2 h,沸水处理10 min灭酶活力,4 500 r/min离心15 min,取上清液于60 ℃旋蒸浓缩。取浓缩糖液加入1/4体积的Sevage试剂[V(三氯甲烷)∶V(正丁醇)=4∶1],置于振荡器中振荡30 min以脱蛋白,7 500 r/min离心15 min,取上清液重复上述操作至无蛋白沉淀层,离心,取上清液以超纯水透析48 h,每隔4 h换水1次,再将透析液旋蒸浓缩至约原体积1/4,加入4倍体积的无水乙醇醇沉过夜,7 500 r/min离心15 min,取沉淀进行冷冻干燥,即得石花菜粗多糖,备用。
1.3.2 石花菜多糖的分离纯化
1.3.2.1 DEAE-52阴离子交换柱层析
将DEAE-52填料活化后采用湿法装柱(1.6 cm×30 cm),以3倍柱体积的超纯水进行平衡。取脱蛋白冻干后的粗多糖样品100 mg加入20 mL超纯水溶解,上样DEAE-52纤维素柱进行分离纯化,按顺序依次以超纯水及浓度为0.1、0.3、0.5、0.7、0.9 mol/L的NaCl溶液进行梯度洗脱,每5 mL收集1管,每个梯度收集60管,以苯酚-H2SO4法[14]隔管检测洗脱液在490 nm处的吸光度,以管数为横坐标,吸光度为纵坐标绘制洗脱曲线。根据洗脱曲线选取最佳洗脱峰段,按峰对洗脱液进行合并收集,浓缩后经10 000 D透析袋透析48 h,冷冻干燥备用[15]。
1.3.2.2 Sephadex G-200凝胶柱层析
将经DEAE-52离子交换柱分离纯化得到的组分GAP1用超纯水溶解,上样于平衡好的Sephadex G-200葡聚糖凝胶柱(1.6 cm×50 cm),以超纯水进行洗脱,每5 mL收集1管,采用苯酚-H2SO4法逐管检测洗脱液在490 nm处吸光度,以管数为横坐标,吸光度为纵坐标绘制洗脱曲线。根据所得洗脱曲线收集主要峰段洗脱液,旋蒸浓缩后冷冻干燥,得精制石花菜多糖。
1.3.3 石花菜多糖单糖组成分析
采用PMP柱前衍生高效液相色谱法[16-19]。
14种单糖混合标准液配制:各单糖的质量浓度均为0.2 mg/mL,置于4 ℃冰箱中备用,使用时先与0.6 mol/L的NaOH溶液按照体积比1∶1混合后再进行衍生化处理。
待测样品前处理:取GAP1干燥粉末10.0 mg于离心管中,加入2 mL TFA(2 mol/L),105 ℃条件下水解4 h,氮气吹干,用甲醇洗涤以除去残留的TFA,再以氮气吹干,重复上述操作2次,最后在干燥样品中加超纯水定容至10 mL,得1.0 mg/mL的样品水解液备用。
PMP衍生化处理:分别取单糖混合标准液及多糖样品水解液各500 μL于试管中,分别加入500 μL NaOH溶液(0.3 mol/L),涡旋30 s后加入500 μL PMP-甲醇(0.5 mol/L),置于水浴锅中80 ℃水浴1 h,待冷却后加入500 μL HCl(0.3 mol/L),混匀后再加入1 mL氯仿涡旋30 s,8 000 r/min离心10 min,吸弃氯仿层,重复上述操作3次,上清液过0.22 μm滤膜,置于4 ℃条件下备用。
色谱条件:色谱柱:Great smart RP18液相色谱柱(4.6 mm×250 mm,5 μm);流动相:A相为0.1 mol/L pH 6.85磷酸盐缓冲液,B相为甲醇,C相为乙腈;梯度洗脱程序:0~9 min,83.0%A、0%B、17.0%C;9~26 min,78%A、0%B、22%C;26~32 min,40%A、0%B、60%C;32~36 min,86%A、0%B、14%C;流速:1.0 mL/min;柱温:30 ℃;进样量:10 μL;波长:250 nm。
1.3.4 石花菜多糖理化性质分析
1.3.4.1 总糖含量测定
采用苯酚-H2SO4法测定粗多糖、脱蛋白多糖及GAP1的总糖含量。
1.3.4.2 蛋白质含量测定
采用南京建成公司提供的BCA法蛋白浓度定量试剂盒,测定粗多糖、脱蛋白多糖及GAP1的蛋白质含量。
1.3.4.3 糖醛酸含量测定
参照王文平等[20]的方法,采用H2SO4-咔唑法对粗多糖、脱蛋白多糖及GAP1中糖醛酸含量进行测定,方法略有改动:
标准曲线的制作:分别精确吸取半乳糖醛酸标准液(0.1 mg/mL)0、0.2、0.4、0.6、0.8、1.0 mL置于10 mL具塞试管中,各加水至1 mL;在冰水浴中向各管加入5 mL的硼砂-H2SO4溶液(0.956 g硼砂溶于200 mL浓H2SO4),混匀后沸水浴中加热5 min,取出后冷却至室温;再加入0.1%咔唑溶液0.2 mL,涡旋30 s,沸水浴5 min,冷却测定各管在523 nm处的吸光度。由所得结果建立糖醛酸质量浓度(μg/mL)和吸光度的线性回归方程为:y=0.007 3x+0.028 9,R2=0.994 9。
多糖样品中糖醛酸含量测定:取适量粗多糖、脱蛋白多糖及GAP1配制成0.1 mg/mL的样品液,按照相同方法测定各样品液在523 nm处的吸光度。对照标准曲线计算糖醛酸含量。
1.3.4.4 硫酸基含量测定
参照宫春宇等[21]的方法,采用BaSO4比浊法测定硫酸基含量,方法略有改动:
标准曲线的制作:取适量K2SO4干燥至恒重,精密称取108.75 mg,以1 moL/L的HCl溶解定容至100 mL,配制成0.6 mg/mL的硫酸基标准液,置于4 ℃冰箱中备用。
分别吸取0、0.04、0.08、0.12、0.16及0.20 mL标准液于试管中,加入适量1 moL/L的HCl溶液补至0.2 mL,以HCl溶液作为空白,每管分别加入3.8 mL三氯乙酸及1 mL BaCl2-明胶溶液(称取1 g BaCl2以0.5%的明胶溶液定容至100 mL,4 ℃冰箱备用),置于室温下静置15 min,于360 nm测定吸光度,记为A1;用1.0 mL明胶溶液代替BaCl2,同法测吸光度,记为A2;以硫酸基质量(mg)为横坐标,吸光度差值A1-A2为纵坐标绘制标准曲线。由所得结果建立硫酸基质量(mg)和吸光度差值的线性回归方程为y=1.749 4x+0.021 8,R2=0.993 8。
多糖样品硫酸基含量测定:分别取50 mg石花菜粗多糖、脱蛋白多糖及GAP1于具塞试管中,加入1 mol/L的HCl溶液10 mL,混匀后置于100℃水浴锅中水解4 h,待水解液冷却后加入适量HCl溶液定容至50 mL,用滤纸过滤除去不溶物质,即得1 mg/mL的样品待测液。以同样方法测定吸光度,对照标准曲线计算样品液中硫酸基含量。
2 结果与分析
2.1 DEAE-52阴离子交换柱层析结果
通过DEAE-52离子交换层析柱对石花菜多糖进行分离纯化,利用苯酚-H2SO4法测定洗脱液490 nm处吸光值,以管数为横坐标,吸光度为纵坐标绘制洗脱曲线如图1所示。

图1 石花菜多糖DEAE-52离子交换柱层析洗脱曲线
Fig.1 Elution curves of crude polysaccharides on DEAE-52 ion exchange column
从图1中可以看出,石花菜多糖在经DEAE-52分离后出现4个较为明显的吸收峰,分别为超纯水洗脱组分、0.1 mol/L NaCl洗脱组分、0.3 mol/L NaCl洗脱组分、0.5 mol/L NaCl洗脱组分,其中以0.3 mol/L NaCl洗脱组分含量最高,将其主峰组分收集,命名为GAP1,冷冻干燥后备用。
2.2 Sephadex G-200凝胶柱层析结果
取干燥后的GAP1组分10 mg,加超纯水配制成5 mg/mL的多糖样品液上样于Sephadex G-200葡聚糖凝胶柱,以超纯水洗脱,每5 mL收集1管,每组分收集30管,苯酚-H2SO4法检测每管的多糖含量,绘制洗脱曲线如图2所示。由图2可知,GAP1组分在经Sephadex G-200凝胶柱后呈现单一对称的洗脱峰,表明GAP1为单一组分多糖,将主峰组分合并浓缩,冷冻干燥后得白色絮状精制多糖。
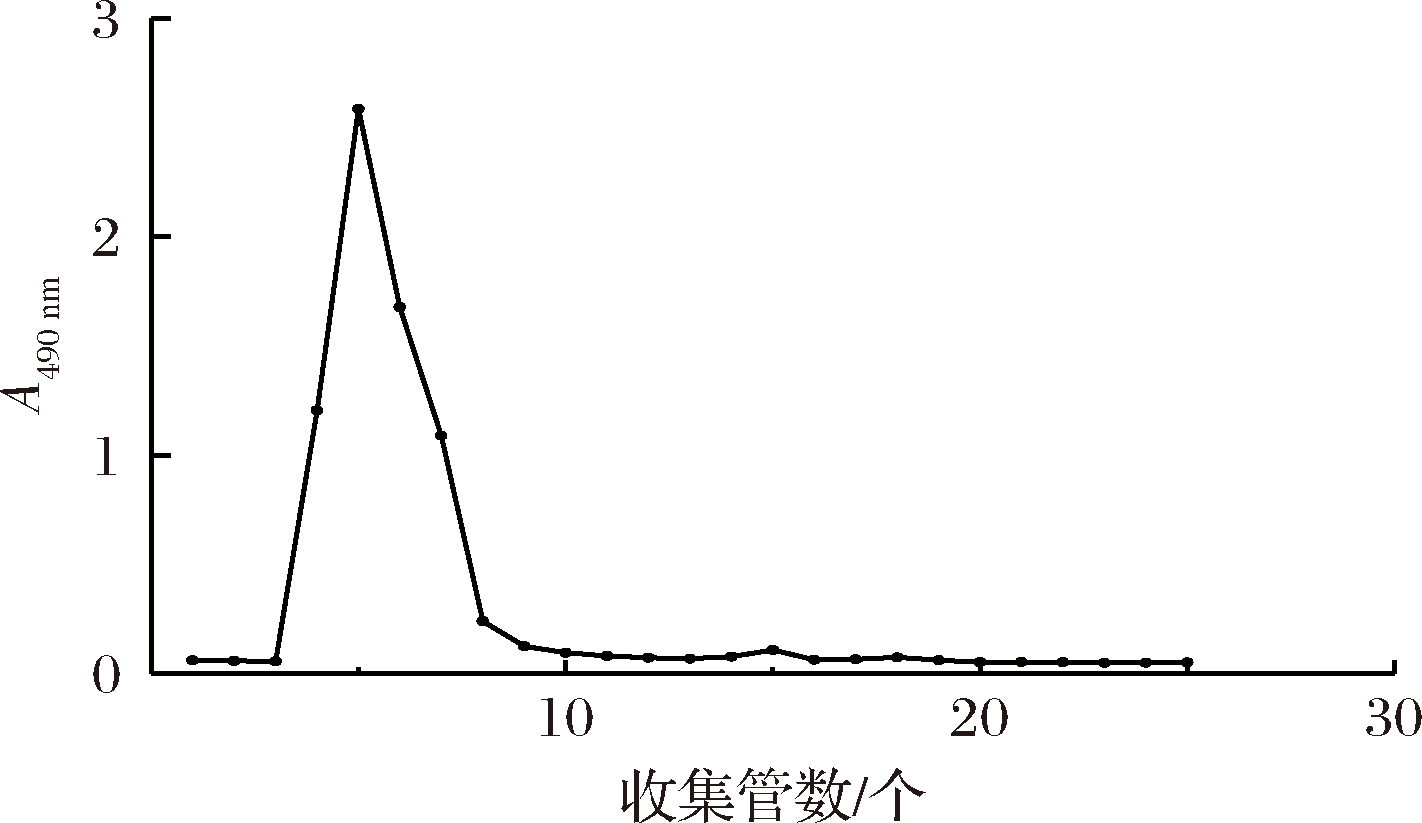
图2 GAP1在Sephadex G-200凝胶柱中的洗脱曲线
Fig.2 Elution curves of crude GAP1 on Sephadex G-200 gel column
2.3 石花菜多糖的化学组分分析结果
由表1可看出,提取得到的石花菜粗多糖、脱蛋白多糖以及纯化后的精制多糖GAP1都为酸性多糖,硫酸基含量及糖醛酸含量都比较高。石花菜多糖在脱蛋白后总糖含量、糖醛酸含量以及硫酸基含量都有一定程度的增加,其中总糖含量增加明显;蛋白质含量明显降低,蛋白质脱除率达85.35%,说明Sevage脱蛋白法效果良好;在经DEAE-52及Sephadex G-200分离纯化后,精制石花菜多糖GAP1中糖醛酸含量和硫酸基含量进一步增加,总糖含量可达92.56%,且未检出蛋白质,进一步说明了分离纯化操作可更好的去除蛋白质及各种小分子物质,从而提高多糖的纯度。
表1 石花菜多糖的化学组分分析 单位:%
Table 1 Chemical composition of polysaccharides from Gelidium amansii

样品名称总糖蛋白质糖醛酸硫酸基粗多糖52.04±0.0315.22±0.0532.62±0.034.92±0.07脱蛋白多糖81.70±0.022.23±0.0341.11±0.016.88±0.02GAP192.56±0.08—44.53±0.026.92±0.01
注:“—”表示该物质未检出
2.4 石花菜多糖的化学组分分析结果
由于单糖本身缺乏生色基团,不同单糖之间在结构上又具有一定的相似性,故而通过常规的HPLC检测方法很难对糖类物质进行高灵敏度的检测[22-23],为提高检测的灵敏度,研究者通常会选择对糖类物质进行柱前衍生化处理,使其变为具有较强紫外吸收的物质,再经色谱柱进行分离,其中PMP柱前衍生化高效液相色谱法因其具有操作简便、准确高效、耗时短的特点得到广泛的应用[24-26]。
采用PMP柱前衍生化高效液相色谱法对GAP1的单糖组成进行分析,结果如图3、图4所示,在保留时间8.863~10.571 min之间为PMP峰。
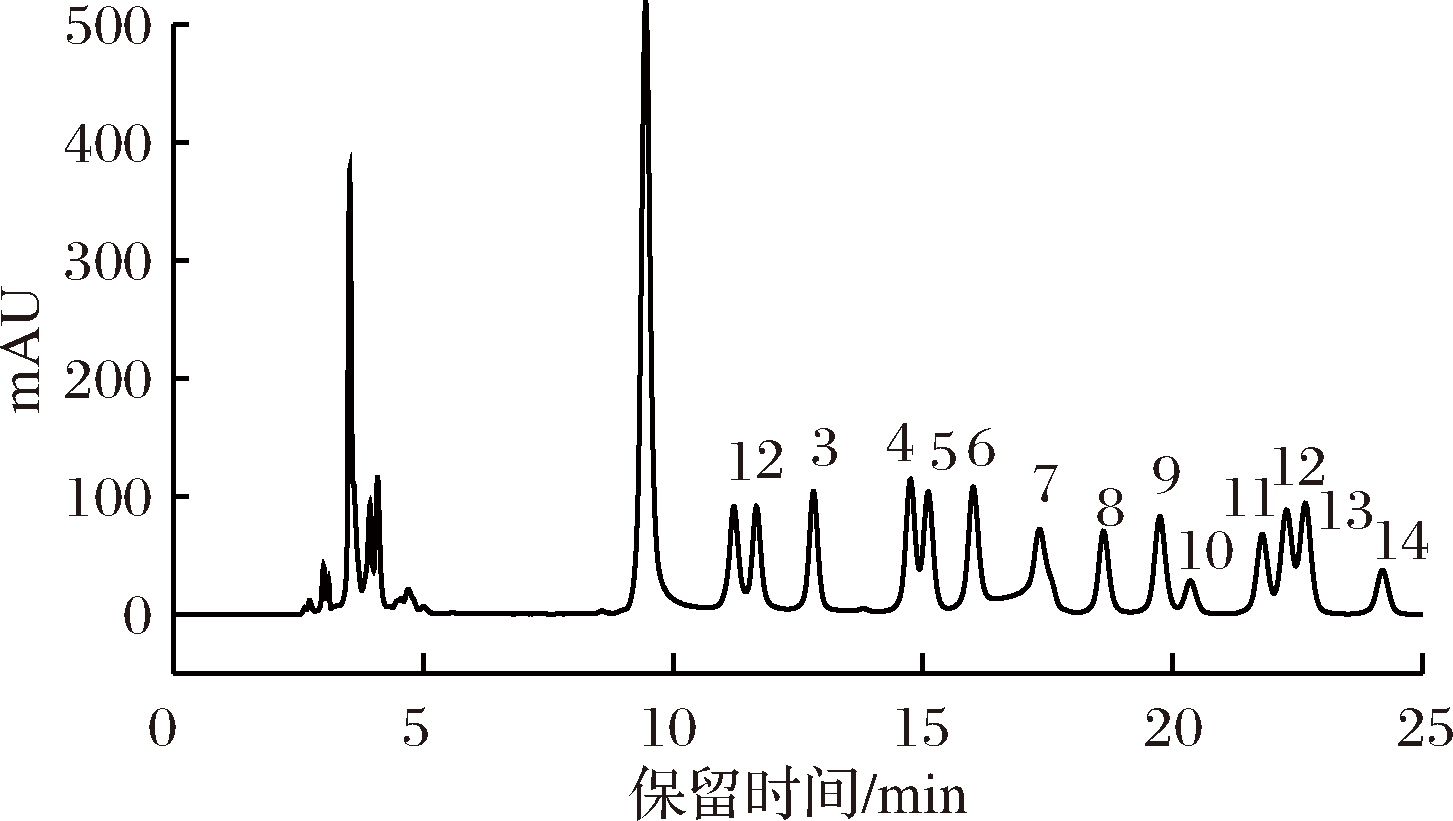
1-古洛糖醛酸;2-甘露糖醛酸;3-Man;4-Rib;5-Rha;6-GlcN;7-GlcUA;8-GalUA;9-GalN;10-Glu;11-Gal;12-Xyl;13-Arb;14-Fuc(下同)
图3 混合标准单糖的高效液相色谱图
Fig.3 HPLC chromatogram of monosaccharide standards
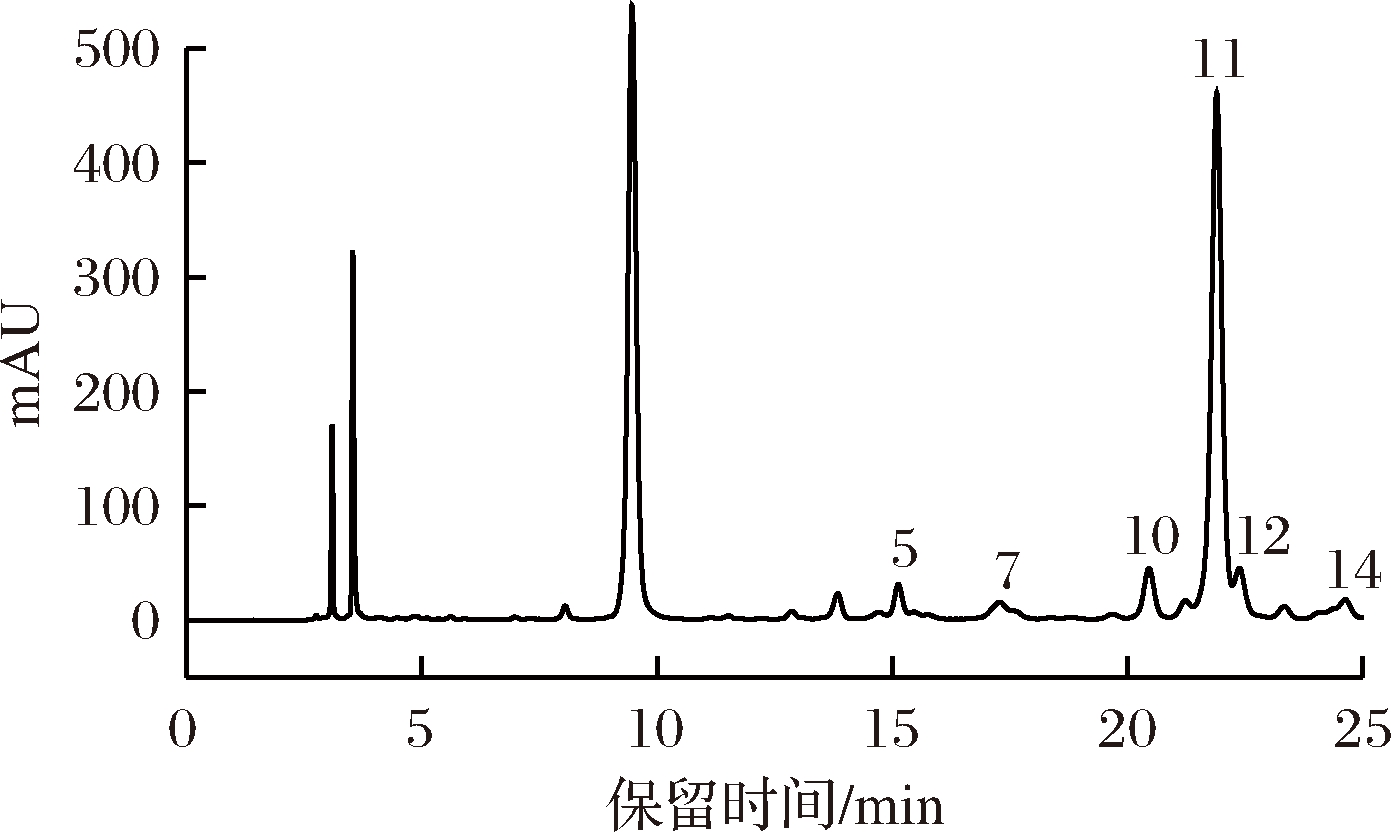
图4 GAP1的高效液相色谱图
Fig.4 HPLC chromatogram of GAP1
由图3可得各标准单糖的保留时间依次为:古洛糖醛酸 11.220 min,甘露糖醛酸 11.672 min,Man 12.813 min,Rib 14.754 min,Rha 15109 min,GlcN 16.011 min,GlcUA 17.339 min,GalUA 18.620 min,GalN 19.747 min,Glu 20.358 min,Gal 21.797 min,Xyl 22.283 min,Arb 22.658 min,Fuc 24.203 min;从图4分析可知,GAP1的高效液相色谱图中显示出的峰分别对应单糖标准品峰5、7、10、11、12、14,表明GAP1主要是由鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖、木糖和L-岩藻糖组成,其中以半乳糖含量最高,各单糖物质的量比为1.00∶1.00∶4.45∶27.31∶2.27∶1.88。KANG等[12]对石花菜热水提取物(碳水化合物含量68.54%)中单糖组成进行了测定,结果显示半乳糖是其水溶性多糖中的主要单糖组分,占其物质的量的86.0%,其次还含有岩藻糖(8.3%)、甘露糖(1.5%)、木糖(1.1%)、鼠李糖和葡萄糖(<1%)及少量葡萄糖醛酸(2.0%),与本实验的测定结果在单糖组成类型上是一致的,在单糖组成比例上存在一些差异,可能是多糖的提取纯化方法、单糖测定方法不同造成的;CUI等[8]采用GC-MS分析方法,对石花菜同属的大石花菜(Gelidium pacificum Okamura)纯化多糖GPOP-1的单糖组成进行了分析,结果显示,大石花菜纯化多糖GPOP-1主要单糖组成为7.1%木糖、59.7%半乳糖、19.76%半乳糖醛酸,与本实验测定结果相比,二者单糖组成不完全相同,但二者单糖含量最高的组分都是半乳糖。
3 结论
石花菜粗多糖经过复合酶法提取、多糖溶液加入Sevage试剂[V(三氯甲烷)∶V(正丁醇)=4∶1]脱蛋白后,再依次经过DEAE-52阴离子交换柱、Sephadex G-200凝胶柱进行分离,苯酚-H2SO4法对多糖含量进行测定,对主要的洗脱峰进行收集,得单一组分GAP1。理化性质测定结果显示:GAP1多糖总糖含量为92.56%,不含蛋白质,糖醛酸质量分数为44.93%,硫酸基质量分数为6.92%,由此结果可以说明,采用DEAE-52阴离子交换柱层析结合Sephadex G-200凝胶柱层析的方法可对石花菜多糖起到良好的分离纯化效果。将GAP1组分进行PMP衍生化处理,采用HPLC对多糖衍生物进行分析,通过与混标的单糖标准品色谱图进行对比分析得出结论,GAP1主要是由鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖、木糖和L-岩藻糖6种单糖按照不同比例缩合而成,其中以半乳糖含量最高,各单糖物质的量比为1.00∶1.00∶4.45∶27.31∶2.27∶1.88。
石花菜广泛分布于中国沿海,具有重要的经济价值[27-28],近年来随着海洋药物的发展,对石花菜多糖等海洋藻类多糖的研究也逐渐深入。为进一步探索其生物学功能及作用机理,对石花菜多糖的详细结构分析,如单糖组成、糖苷键连接方式等的研究刻不容缓。本研究对石花菜多糖进行了分离纯化,对其理化性质和单糖组成进行了分析,可为石花菜多糖的精细结构解析及进一步的开发利用奠定基础。
[1] LEE S J, SHIN N, JEONG J, et al.Effects of Gelidium amansii extracts on in vitro ruminal fermentation characteristics, methanogenesis, and microbial populations[J].Asian-Australasian Journal of Animal Sciences, 2018, 31(1): 71-79.
[2] YANG Tsunghan, CHIU Chenyuan, LU Tingjang, et al.The anti-obesity effect of polysaccharide-rich red algae(Gelidium amansii)hot-water extracts in high-fat diet-induced obese hamsters[J].Marine drugs, 2019, 17(9): 532.
[3] 崔明晓, 王晓晨, 王玉, 等.超声辅助提取大石花菜多糖及其抗氧化研究[J].上海海洋大学学报, 2018, 27(5): 797-804.
[4] PARK Jeong-Hoon, HONG Ji-Yeon, JANG Hyun Chul, et al.Use of Gelidium amansii as a promising resource for bioethanol: a practical approach for continuous dilute-acid hydrolysis and fermentation[J].Bioresource Technology, 2012, 108: 83-88.
[5] 侯萍, 何进武, 刘肖冰, 等.海藻多糖在食品添加剂中的应用研究进展[J].保鲜与加工, 2019, 19(5): 196-200.
[6] 秦益民.海藻活性物质在功能食品中的应用[J].食品科学技术学报, 2019, 37(4): 18-23.
[7] 王慧, 周星, 唐菲, 等.石花菜多糖对糖尿病大鼠降血糖作用的实验研究[J].保健医学研究与实践, 2011, 8(4): 8-10.
[8] CUI M,WU J,WANG S,et al.Characterization and anti-inflammatory effects of sulfated polysaccharide from the red seaweed Gelidium pacificum Okamura[J].International Journal of Biological Macromolecules, 2019: 377-385.
[9] YANG T H,YAO H T,CHIANG M T.Red algae(Gelidium amansii)hot-water extract ameliorates lipid metabolism in hamsters fed a high-fat diet[J].Journal of Food and Drug Analysis, 2017, 25(4): 1-8.
[10] 张颖, 岑颖洲, 黄日明, 等.南海七种海藻多糖的抗病毒活性初步研究[J].病毒学报, 2006(4): 282-285.
[11] KANG M C,KANG N,KIM S Y,et al.Popular edible seaweed, Gelidium amansii prevents against diet-induced obesity[J].Food and Chemical Toxicology, 2016, 90:181-187.
[12] KANG J H,LEE H A,KIM H J,et al.Gelidium amansii extract ameliorates obesity by down-regulating adipogenic transcription factors in diet-induced obese mice[J].Nutrition Research and Practice, 2017, 11(1): 17-24.
[13] SEO M J,LEE O H,CHOI H S,et al.Extract from edible red seaweed(Gelidium amansii)inhibits lipid accumulation and ROS production during differentiation in 3T3-L1 cells[J].Preventive Nutrition and Food Science, 2012, 17(2):129-135.
[14] 王文洁, 唐炜, 俞玲娜, 等.蒽酮-硫酸法与苯酚-硫酸法测定凉粉草多糖的比较[J].食品科技, 2017,42(9): 274-279.
[15] 王中华.鸡血藤多糖的分离纯化、初步表征、硫酸化修饰及活性研究[D].南宁: 广西大学, 2018: 13-15.
[16] 赵孟欣, 王泽岚, 孟哲, 等.温和条件下柱前标记-高效液相色谱-质谱法测定枸杞多糖中单糖组成[J].色谱, 2019, 37(11): 1 162-1 172.
[17] 张萍, 陈燕, 尚永辉, 等.柱前衍生高效液相色谱法测定石榴皮多糖的单糖组成[J].分析试验室, 2019, 38(5): 523-528.
[18] 黄卉, 杨丽芝, 杨贤庆, 等.南海鸢乌贼墨汁多糖分离纯化及组分分析[J].食品科学, 2017, 38(24): 118-123.
[19] 周彦强, 吴光斌, 陈发河.PMP柱前衍生化HPLC法测定黄秋葵多糖的单糖组成[J].食品科学, 2019, 40(4): 266-271.
[20] 王文平, 郭祀远, 李琳, 等.野木瓜多糖中糖醛酸含量测定[J].食品科技, 2007(10):84-86.
[21] 宫春宇, 潘迎捷.硫酸钡比浊法对龙须菜多糖中硫酸基含量的测定[J].天然产物研究与开发, 2009(B10): 402-405.
[22] 钟碧萍, 吴晓青, 周津, 等.柱前衍生化HPLC法分离不同聚合度的壳寡糖[J].生物化工, 2019, 5(3): 16-19.
[23] BAI Weidong, FANG Xiaodi, ZHAO Wenhong, et al.Determination of oligosaccharides and monosaccharides in Hakka rice wine by precolumn derivation high-performance liquid chromatography[J].Journal of Food and Drug Analysis, 2015, 23(4):645-651.
[24] DAI J,WU Y,CHEN S W,et al.Sugar compositional determination of polysaccharides from Dunaliella salina by modified RP-HPLC method of precolumn derivatization with 1-phenyl-3-methyl-5-pyrazolone[J].Carbohydrate Polymers, 2010, 82(3):629-635.
[25] 符梦凡, 赵一帆, 阎卫东.柱前衍生化HPLC法分析枸杞多糖中单糖组成[J].食品科学, 2018, 39(18): 186-191.
[26] 李婷婷,王雪吟,胡丹荔, 等.柱前衍生法测定桂花多糖中的6种单糖的含量[J].食品工业, 2019, 40(4): 323-327.
[27] 王旭雷.中国海洋红藻分子系统发育初步分析及石花菜目的分类学研究[D].青岛: 中国科学院研究生院(海洋研究所), 2016: 2-4.
[28] 许柑叶.石花菜(Gelidium amansii)凝集素的理化性质及部分生物学活性[D].福州: 福建师范大学, 2007: 9-12.