在日常膳食中,人们会因过量摄入食物而导致血清中胆固醇含量异常,进而增大心脑血管疾病的患病率[1]。乳酸菌具有降胆固醇的功能特性[2-4],其中乳酸菌所产的胆盐水解酶(bile salt hydrolase, BSH)在降解机制中发挥着至关重要的作用[5]。BSH能水解胃肠道中的结合态胆盐(甘氨胆酸盐),将其转变成氨基酸和游离态胆酸,游离态胆酸能与胆固醇共同沉淀,以粪便的形式排出体外,从而降低血清中的胆固醇含量[6]。此现象亦称“共沉淀现象”[7],是目前较认可的降解机制[8-9]。
本试验对产BSH的乳酸菌进行筛选与鉴定,以BSH酶解甘胆酸钠后的甘氨酸生成量作为BSH活性判定指标,旨在研究产BSH的乳酸菌在不同条件下产BSH酶的活性及氨基酸生成量的变化规律,为进一步优化BSH水解反应条件和深入探讨乳酸菌降解胆固醇机制提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜牛奶,湖南省畜牧场牛奶贮藏罐;植物乳杆菌(Lactobacillus plantarum WCFS1),湖南农业大学食品科技学院实验室提供。
1.1.1 试剂
MRS肉汤固(液)体培养基,广东环凯微生物科技有限公司;牛胆酸钠,北京索莱宝科技有限公司;甘胆酸钠,上海麦克林生化科技有限公司;脱脂奶粉,澳优乳业股份有限公司;CaCO3、NaOH、HCl、NaCl、葡萄糖、柠檬酸、柠檬酸三钠、甘油、茚三酮、乙醇、甘氨酸、三氯乙酸(分析纯试剂),国药集团化学试剂有限公司;革兰氏染色液,广东环凯微生物科技有限公司。
茚三酮显色液:12.5 mL 10 g/L茚三酮柠檬酸溶液(称取0.5 g茚三酮溶解于50 mL pH 5 0.5 mol/L柠檬酸盐缓冲液中)+32.5 mL体积分数30%甘油+5 mL 0.5 mol/L柠檬酸盐缓冲液
1.2 仪器与设备
HX-20G恒温金属浴锅,上海泸析实业有限公司;HH-601超级恒温水浴,常州市万丰仪器制造有限公司;Bante920 pH计,上海般特仪器制造有限公司;XW-80A漩涡混匀仪,海门市其林贝尔仪器制造有限公司;1510全波长酶标仪,赛默飞世尔科技(中国)有限公司;TG16-WS台式高速离心机,湖南湘仪实验室仪器开发有限公司;BH-2光学显微镜,日本Olympus公司。
1.3 实验方法
1.3.1 乳酸菌的分离与纯化
取25 mL牛奶置于盛有225 mL无菌生理盐水的锥形瓶中(瓶中预置适量的无菌玻璃珠),充分混匀得10-1的样品匀液,再稀释成10-2、10-3、10-4的样品。分别吸取稀释液0.1 mL于含10 g/L CaCO3的MRS固体培养基平板上,涂布分离,37 ℃下培养24~48 h[10]。乳酸菌代谢产生的乳酸可溶解CaCO3,在培养基上形成透明的溶钙圈[11],挑取有明显溶钙圈,且革兰氏染色为阳性的菌落,于MRS固体培养基上3代划线纯化后,编号并保存备用。
1.3.2 产胆盐水解酶菌株的筛选
依据乳酸菌降胆固醇的机理[7]:乳酸菌产生的BSH使胆盐共轭活性增强,将结合态胆盐水解为游离态胆酸,游离态胆酸与胆固醇共同沉淀。若菌株能够产BSH,则菌落在含胆盐培养基中形成乳白色沉淀圈。
将分离纯化得到的乳酸菌接种于MRS液体培养基中活化2代,参照王玉文等[12]的牛津杯法将菌悬液接种至含3 g/L牛磺胆盐的MRS固体培养基上,接种量为0.15 mL,37 ℃培养72 h后,观察菌落周围是否出现乳白色沉淀圈。挑取沉淀,于蒸馏水中完全溶解,旋涡振荡后滴加茚三酮显色液,溶液变蓝紫色则初步确认存在胆盐水解酶[13]。
植物乳杆菌WCFS1含4个胆盐水解酶活性基因[14],具有高胆盐水解酶活性,因此以WCFS1作为阳性对照菌株,在筛选及不同条件下BSH的活性测定的试验中作参比对照。
1.3.3 菌株N1、N12的细胞形态观察及分子生物学鉴定
对N1和N12进行革兰氏染色,并在光学显微镜下观察细胞形态。参照吴诗敏等[15]的分子生物学鉴定方法,将液体培养基中的菌株纯化得到PCR产物,随即送至上海生工生物工程有限公司进行测序并构建系统发育树。
1.3.4 不同条件下胆盐水解酶的活性测定
BSH是一类由肠道微生物合成的胞内酶,能水解结合型胆盐从而增强菌体对胆盐毒性的抵御能力,延长菌体在肠道中的生存时间[16]。BSH特异性识别底物甘胆酸钠,将其水解生成甘氨酸,试验中以测定甘氨酸的生成量为判定BSH水解活性的指标。甘氨酸与茚三酮作用生成蓝紫色物质[17],记录其在570 nm处的吸光值。
1.3.4.1 酶活力的测定及标准曲线的绘制
参照姜金康[18]测定酶活力的部分方法作修改。将培养24 h的发酵液、空白组加入体积分数15%三氯乙酸,添加量为体积分数为30%,混匀静置15 min,8 000 r/min离心10 min,吸取1 mL上清液,加入0.5 mL茚三酮显色液,旋涡振荡,密封沸水浴15 min,迅速冰浴3 min,再加入0.5 mL体积分数95%的乙醇,混匀静置5 min后测定在570 nm处的吸光度。
配制1 mmol/L甘氨酸标准溶液,准确吸取上述溶液0、200、400、600、800、1 000 μL至离心管中,用蒸馏水补足体积为1 mL,再分别加入0.5 mL显色液,旋涡振荡后密封沸水浴15 min,迅速冰浴冷却3 min,加入0.5 mL体积分数95%的乙醇混匀,静置5 min,在570 nm下测定吸光度。以吸光度为纵坐标,甘氨酸标准溶液浓度为横坐标绘制标准曲线。
1.3.4.2 pH对胆盐水解酶活性的影响
制备7组不同pH的脱脂牛奶培养基(含3 g/L甘氨胆酸钠的12%脱脂牛奶),用1 mol/L HCl和1 mol/L NaOH将每组培养基pH调节至1.0、3.0、5.0、7.0、9.0、11.0、13.0,N1、N12、WCFS1活化2代后,以10%接种于上述培养基中。每组设置空白对照,于37 ℃培养24 h,测定胆盐水解酶的活性。
1.3.4.3 紫外照射时间对胆盐水解酶活性的影响
N1、N12、WCFS1活化2代后,以10%接种于脱脂牛奶培养基(含3 g/L甘氨胆酸钠的体积分数12%脱脂牛奶)中,并分为7组。紫外光(30 W)照射上述培养基0、5、10、15、20、25、30 min,每组设置空白对照,于37 ℃培养24 h,测定胆盐水解酶活性。
1.3.4.4 温度对胆盐水解酶活性的影响
活化2代后的N1、N12、WCFS1以10%接种于脱脂牛奶培养基(含3 g/L甘氨胆酸钠的12%脱脂牛奶)中,制备5组实验组于26、37、48、59、70℃下处理30 min,每组设置空白对照,于37 ℃培养24 h,测定胆盐水解酶活性。
1.3.4.5 糖浓度对胆盐水解酶活性的影响
制备7组不同葡萄糖浓度的脱脂牛奶培养基(含3 g/L甘氨胆酸钠的12%脱脂牛奶),葡萄糖添加量为:1%、5%、10%、15%、20%、25%、30%。N1、N12、WCFS1活化2代后,以10%接种于以上7组中。每组设置空白对照,于37 ℃培养24 h,测定胆盐水解酶活性。
1.3.4.6 盐浓度胆盐水解酶活性的影响
制备7组脱脂牛奶培养基(含3 g/L甘氨胆酸钠的12%脱脂牛奶),NaCl添加量为:1%、4%、7%、10%、13%、16%、19%,N1、N12、WCFS1活化2代后,以10%接种于上述培养基中。每组设置空白对照,于37 ℃培养24 h,测定胆盐水解酶活性。
2 结果与分析
2.1 乳酸菌分离与纯化的结果
从湖南省畜牧场牛奶中分离得到27株乳酸菌,分离纯化后按照挑选顺序编号为N1~N27,用40%甘油于-20 ℃冷冻保藏。
2.2 产胆盐水解酶菌株的筛选
27株乳酸菌中仅有2株产BSH,为菌株N1和N12。图1是3株菌(包含阳性对照菌WCFS1)在含牛磺胆盐的培养基上呈现的乳白色沉淀圈,且3株菌刮下的沉淀溶于蒸馏水后滴加茚三酮显色剂,均呈蓝紫色。

图1 沉淀圈现象
Fig.1 Sediment circle phenomenon
2.3 菌株N1、N12的细胞形态观察与分子生物学鉴定
由图2可知,菌株N1、N12细胞均成杆状或圆柱形,菌体有平直状、弯曲状,细胞两端呈弧状,单生、成对、成链排列,无芽孢,革兰氏染色结果为阳性。因此,初步判定2株菌为乳杆菌属(Lactobacillus)。
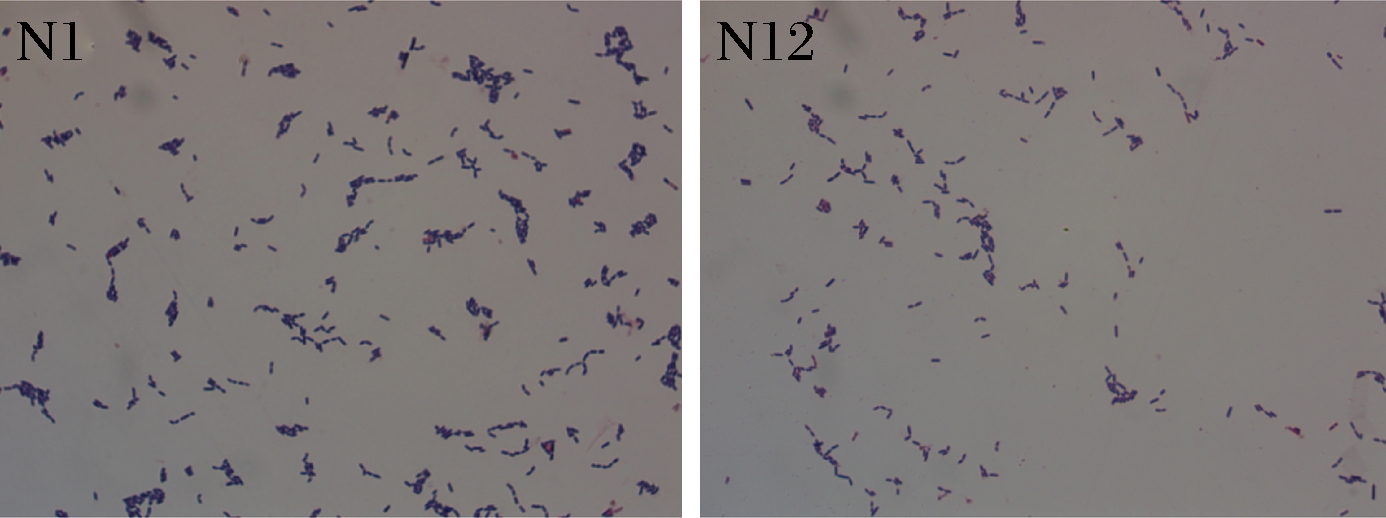
图2 菌株N1和N12的细胞形态
Fig.2 Cell morphology of strain N1 and N12
经测序获得菌株N1、N12的16S rRNA 基因序列,基因序列大小分别为1 449、1 437 bp。测序结果通过BLAST序列对比后,构建菌种系统发育树,如图3所示。N1、N12与L.plantarum MG5204、L.plantarum TSGB1272聚于一支。因此,菌株N1和N12为植物乳杆菌(L.plantarum),结合菌株细胞形态的观察而进一步确认2株菌均为植物乳杆菌(L.plantarum)。

图3 基于16S rDNA基因序列菌株N1和N12的系统发育树
Fig.3 Phylogenetic tree of strain N1 and N12 based on 16S rDNA gene sequences
2.4 不同条件下胆盐水解酶的活性测定
2.4.1 甘氨酸标准曲线的绘制
甘氨酸含量测定标准曲线方程为y=2.685 5x-0.497 5,R2=0.999 2,其中x代表甘氨酸浓度,y代表在570 nm下的吸光值。
2.4.2 pH对胆盐水解酶活性的影响
为了探究pH对BSH活性影响,本试验对N1和N12的BSH酶解后的生成物含量(甘氨酸)进行分析,结果如图4所示。
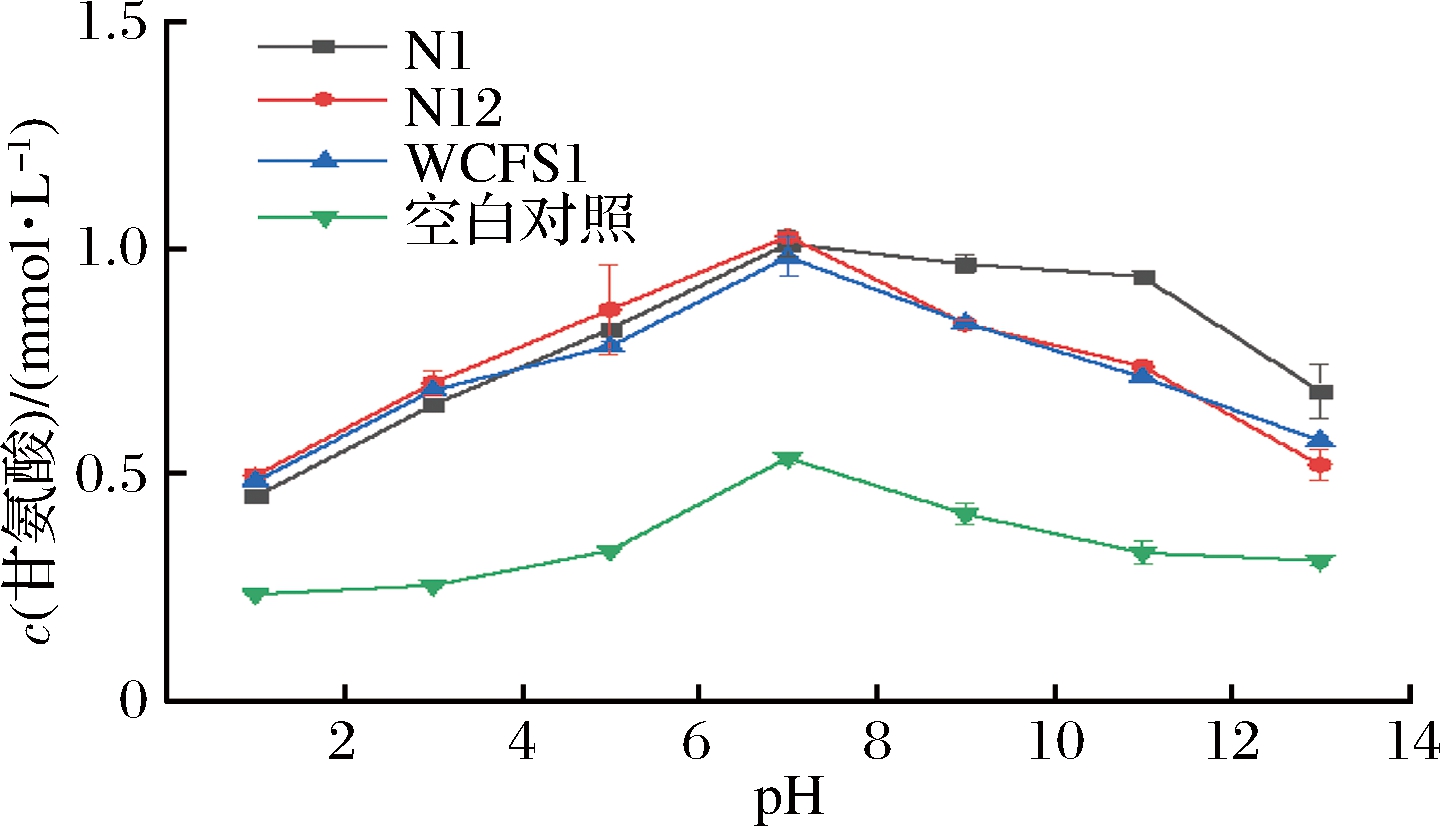
图4 pH对酶活性的影响
Fig.4 Effect of pH on enzyme activity
3株菌(N1、N12和WCFS1)培养上清液中的甘氨酸含量随着pH值的上升,先增加后减少,则胆盐水解酶的活性随pH值的增加呈现先增高后降低的变化趋势。N1、N12和WCFS1的酶活性变化趋势符合,均在pH为7.0时,其酶活性最强,当pH超过7.0时,酶活性受到抑制作用。同时,pH对胆盐水解酶活性有极显著影响(P<0.01),分析以上现象,在培养环境过酸、过碱时,会导致BSH化学变性而引起空间结构的改变,可能影响与底物结合的活性位点,导致水解效率降低。
2.4.3 紫外照射时间对胆盐水解酶活性的影响
菌株经不同紫外照射时间处理后的BSH活性变化趋势如图5所示。
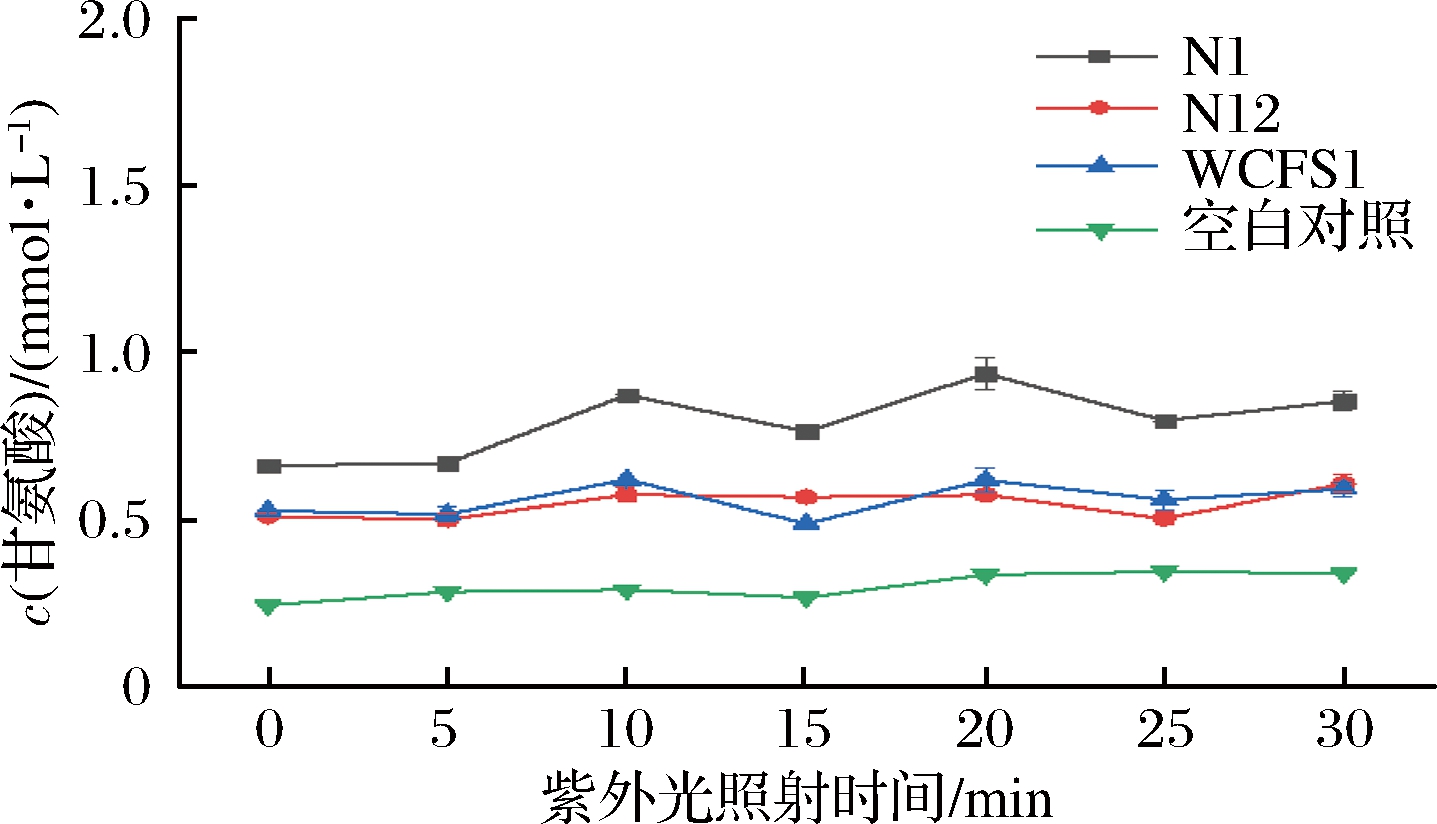
图5 紫外照射时间对酶活性影响
Fig.5 Effect of UV irradiation time on enzyme activity
紫外照射时间与上清液甘氨酸浓度不成线性关系,随时间的延长,甘氨酸浓度波动无规律。N12与WCFS1经一定时间的紫外照射后,其水解生成的甘氨酸浓度较低,均低于在相同处理条件下N1的甘氨酸生成量,因此猜测N1菌株对紫外的耐性比N12、WCFS1强。由此现象可知,3株菌在紫外照射30 min内,其酶活性紊乱不定,水解生成的甘氨酸浓度呈波动变化,无法判断此条件对酶活力是否产生明显的促进作用或抑制作用。
2.4.4 温度对胆盐水解酶活性的影响
菌株经不同温度处理后的BSH活性变化趋势如图6所示。

图6 温度对酶活性影响
Fig.6 Effect of temperature on enzyme activity
N1、N12和WCFS1的酶活性随短时温度处理的度数增加,呈现先增强后减弱的变化趋势,3株菌均在59 ℃下处理30 min后,其水解生成的甘氨酸浓度最大,胆盐水解酶活性最强,耐热性能良好,但在70 ℃下处理30 min后,菌种几乎失活无法经过后期培养产生胆盐水解酶,且结果显示温度处理对胆盐水解酶活性有极显著影响(P<0.01)。此项试验意在探究短时温度处理能否起到激活酶活性的作用,分析此现象,菌种均在试验温度下处理30 min后于37 ℃培养24 h,并未在试验温度下直接培养24 h,因此猜测酶的空间结构并未全部破坏,短时间的高热处理,甚至可能使酶在保证原有活性的基础上暴露更多的酶活性位点,以提高酶水解能力。
2.4.5 葡萄糖浓度对胆盐水解酶活性的影响
菌株在不同糖浓度环境下培养后,其BSH活性变化趋势如图7所示。

图7 葡萄糖添加量对酶活性影响
Fig.7 Effect of glucose addition on enzyme activity
葡萄糖作为培养基中的重要碳源,碳源直接影响菌体的生长与代谢及水解酶的合成与作用。添加量过少,菌体生长缓慢导致水解酶合成量受限,添加量过多产生阻遏作用,抑制水解酶的合成。结果显示,随葡萄糖浓度的逐增,3株菌生成的甘氨酸先增后减,N12在葡萄糖重量百分比浓度为5%时,酶活性已达峰值,而N1与WCFS1峰值在浓度增至10%才出现峰值,N12糖浓度的耐受力弱于N1。当浓度由10%增至15%时,酶活性骤减,此后再增大糖浓度对酶活性的影响甚微。根据统计,糖添加量对BSH活性有极显著影响(P<0.01),其葡萄糖质量百分比浓度在5~10%范围内,BSH持有较高酶活力。
2.4.6 NaCl浓度胆盐水解酶活性的影响
菌株在不同盐浓度环境下培养后,其BSH活性变化趋势如图8所示。
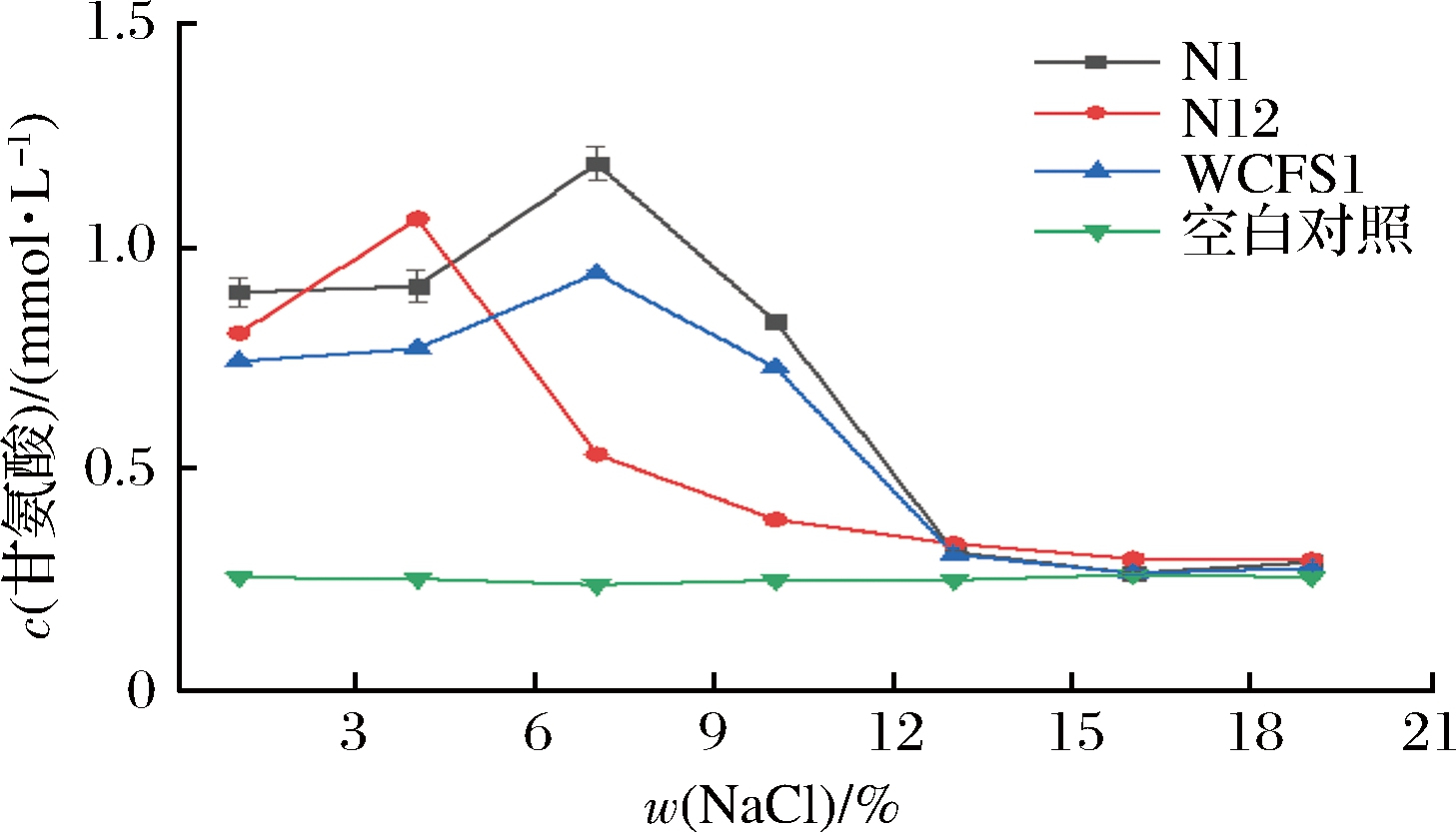
图8 NaCl添加量对酶活性影响
Fig.8 Effect of sodium chloride addition on enzyme activity
NaCl可调节细胞内外渗透压,在等渗环境下菌株正常生长,高渗环境下菌株失水抑制其生长。结果显示,甘氨酸浓度随NaCl量的增加呈先增后减的趋势。N12在NaCl质量分数为4%时,酶活力最强,此后活力骤减再趋于平稳,N1的耐盐能力强于N12,当质量分数增至7%时,酶活力最强,NaCl质量在7%~13%,酶活性骤减。根据统计,盐添加量对BSH活性有极显著影响(P<0.01)。
3 讨论与结论
本研究从生鲜牛奶中共计分离乳酸菌27株,其中产胆盐水解酶的乳酸菌共计2株,分别为N1、N12。通过细胞形态观察和分子生物学技术,N1与N12被鉴定为植物乳杆菌(L.plantaruma)。N1、N12与植物乳杆菌Lp529[18]的BSH活性相比,后者较强,但N1、N12的BSH活性又强于植物乳杆菌KLDS6.0330[19]。
根据单因素多水平试验,0~30 min的紫外照射处理对BSH活性影响甚微,不构成变化规律。但pH、温度、糖盐添加量对BSH活性有极显著影响,从而确定了N1、N12保持BSH高活性的最适pH为7,最适温度为59 ℃。其中N1的最适糖添加量为10%,最适盐添加量7%。N12对糖、盐的耐受力不及N1,其最适糖质量百分数为5%,最适盐质量百分数为4%。这与李婷婷等[20]研究的屎肠球菌90-1的胆盐水解酶的最适反应温度(37 ℃)与最适反应pH(6.0)均不一致,可能因为李婷婷的试验中仅仅在单因素条件下处理30 min,并未继续培养24 h,导致出现的菌种水解活性差异性较大,以及菌种之间的差异性导致结果不同。惠明等[21]研究发现BSH活性与还原糖的消耗速率有关,酶活性与消耗速率呈正相关,因此本试验中确定了菌株N1、N12最适的糖质量百分比浓度。要将此类乳酸菌开发应用于食品工业中并发挥良好降解胆固醇能力,食盐乃为食品工艺中最重要的调味品,其添加量过大对乳酸菌的抑制明显[22],添加量过小影响食品风味与质构,因此确定了N1、N12的最佳盐质量百分比浓度,为后续的投入生产提供可靠的理论基础。不同的培养条件对乳酸菌降解胆固醇的效率影响显著[23],对菌株N1和N12的培养条件等进行深入研究,为2株菌后续应用工业化生产奠定基础。
[1] JAMES W, ANDERSON, STANLEY E, et al.Effect of fermented milk(Yogurt)containing Lactobacillus acidophilus L1 on serum cholesterol in hypercholesterolemic humans[J].Journal of the American College of Nutrition, 1999,18(1):43-50.
[2] 付永岩,赵悦含,王毅超,等.降胆固醇乳酸菌的益生特性及其作用机理[J].中国乳品工业,2019,47(7):23-27.
[3] 李尧,张羽竹,张利,等.分离自传统自然发酵食品中降胆固醇乳酸菌的筛选与评价[J].中国食品学报,2019,19(6):212-222.
[4] 范颖,陈思涵,党芳芳,等.一株降胆固醇乳酸菌的筛选及其在模拟消化环境活性的研究[J].中国乳品工业,2018,46(9):4-7.
[5] 董改香,张勇刚.具有胆盐水解酶活性乳酸菌体内降胆固醇功效机理的研究[J].甘肃畜牧兽医,2018,48(4):68-71.
[6] 王继超.胆盐水解酶的分离纯化及酶学性质的研究[D].哈尔滨:黑龙江大学,2013.
[7] KLAVER F A, VAN DER MEER R.The assumed assimilation of cholesterol by Lactobacilli and Bifidobacterium bifidum is due to their bile salt-deconjugating activity[J].Appl.Environ.Microbiol, 1993, 59(4): 1 120-1 124.
[8] 任大勇,曲天铭,杨柳,等.东北传统发酵食品中降胆固醇乳酸菌的筛选及降解机制研究[J].食品科学:1-12[2019-12-04].http://kns.cnki.net/kcms/detail/11.2206.TS.20190329.1349.002.html.
[9] 田建军,张开屏,李权威,等.乳酸菌调控胆固醇代谢的物质基础研究进展[J].食品科学,2019,40(19):334-339.
[10] 武昌俊,戴陈伟,李舜,等.一株安徽本地泡菜中产细菌素乳酸菌的筛选与鉴定[J].中国食品添加剂,2019,30(7):112-120.
[11] 胡虹,杜迅,张秀江,等.液体发酵饲料植物乳杆菌诱变育种的研究[J].河南科学,2019,37(4):570-574.
[12] 王玉文,刘慧,李平兰,等.产胆盐水解酶乳酸菌的分离、鉴定及降解胆固醇机理的初步研究[J].食品科学,2006(10):215-218.
[13] 欧伶, 俞建瑛, 金新根.应用生物化学[M].北京:化学工业出版社, 2001:74-87.
[14] LAMBERT J M, BONGERS R S, VOS W M, et al.Functional analysis of four bile salt hydrolase and penicillin acylase family members in Lactobacillus plantarum WCFS1[J].Appl Environ Microbiol, 2008, 74(15): 4 719-4 726.
[15] 吴诗敏,雷文平,周辉,等.南山牧场牛乳中具有抑菌活性乳酸菌的筛选及鉴定[J].中国酿造,2019,38(5):108-112.
[16] 毕洁.胆盐水解酶提高乳酸菌胆盐耐受能力的酶学与生理学机制研究[D].无锡:江南大学,2016.
[17] 汤慧勤,姚晓敏,徐一涵,等.产胆盐水解酶植物乳杆菌降胆固醇作用的研究[J].上海交通大学学报(农业科学版),2018,36(4):35-40.
[18] 姜金康.乳杆菌属胆汁盐水解酶的活性多样性、底物特异性及相关基因研究[D].上海:上海交通大学,2008.
[19] 刘静,王瑾,秦雪梅,等.具有胆固醇去除能力和胆盐水解酶活性的乳酸菌的体外筛选[J].食品科技,2011,36(5):18-22.
[20] 李婷婷,张洋,林超,等.降胆固醇优良菌株的筛选及其胆盐水解酶特性研究[J].食品工业科技,2012,33(24):191-194.
[21] 惠明,刘勇,张红星,等.产胆盐水解酶BSH乳酸菌的鉴定及发酵条件优化[J].中国食品学报,2011,11(1):214-221.
[22] 李奕佳.芥菜的清洁发酵工艺及产品开发研究[D].长沙:湖南农业大学,2017.
[23] 蒲博,张驰翔,王周,等.乳酸菌降胆固醇作用及其机理的研究进展[J].中国酿造,2014,33(7):5-9.