副溶血性弧菌(Vibrio parahaemolyticus,VP)是一种革兰氏阴性嗜盐菌, 常存在于沿海环境及水产品中,是沿海地区的一种高发性食源性致病菌[1-3]。食用VP污染的食物可能会引起腹泻、恶心、呕吐、急性肠胃炎,重症患者表现为脱水、休克甚至死亡[4-5],随着全球变暖以及VP生长条件改善,在中国、日本、东南亚爆发了多次因误食VP污染的食物而造成的死亡安全事件[6]。VP的污染和增殖已经成为了水产品检测与监管的关键因素之一。目前对VP的检测主要依据并遵守GB4789.7—2013[7-8],该方法虽然较为成熟可靠,但是操作繁琐、费时费力。而基于分子扩增手段的检测方法,如传统PCR技术[9]、环介导等温扩增技术、荧光定量PCR、多重PCR等[10-13],有效克服了上述缺点,且方法特异性好、灵敏度高,但这些方法对检测设备和技术人员要求较高,不适合现场快速、批量检测。
酶联免疫吸附法是将抗原、抗体的特异性反应和酶的高效催化性质结合起来的一种分析检测方法,具有特异性强、灵敏度高、检测时间短等优点,被广泛应用于VP的检测[14-15]。谢曼曼等[16]用甲醛灭活VP免疫小鼠成功制备单抗,虽然特异性较强但是灵敏度较差;SAKATA等[17]使用2种针对VP-F0F1-ATP合成酶的单克隆抗体制备免疫层析试纸,实现VP的快速检测,覆盖率高,但存在交叉反应;LIU等[18]基于荧光能量共振转移原理建立荧光免疫检测法,检测限低至10 CFU/mL,无需预富集,适用于检测实际食品样品中的VP,但这类方法稳定性相对较差。本研究通过热灭活VP免疫大白兔制备了效价高、特异性好的多克隆抗体,并建立和优化了检测VP的间接竞争酶联免疫吸附法(indirect competitive enzyme-linked immunosorbent assay,ic-ELISA)方法。利用该方法检测实际水样中的VP,实验结果与国标方法结果一致,方法为进一步研究VP的快速检测奠定了基础。
1 材料与方法
1.1 试验菌株
副溶血性弧菌ATCC17802(V. parahaemolyticus ATCC17802),广东环凯微生物科技有限公司;霍乱弧菌53105(V. cholera 53105)、创伤弧菌ATCC27562(V. vulnificus 27562)、金黄色葡萄球菌LMGT3242(Staphylococcus aureus LMGT3242)、单增李斯特菌LMGT2813(Listeria monocytogenes LMGT2813)、蜡样芽孢杆菌LMGT2805(Bacillus subtilis LMGT2805)、伤寒沙门氏菌LMGT8004(Salmonella enterica LMGT8004)、大肠杆菌LMGT3704(Escherichia coli LMGT3704)、粪肠球菌LMGT3355(Enterococcus faecalis LMGT3355)、铜绿假单胞菌LMGT8020(Pseudomonas aeruginosa LMGT8020),均来自本实验室。
1.2 材料与试剂
纯种新西兰大白兔,上海交通大学农业与生物学院。弗氏完全佐剂、弗氏不完全佐剂、脱脂奶粉,Sigma公司;胰蛋白胨(tryptone)、酵母提取物,英国OXIOD;TCBS肉汤,青岛高科技工业园海博生物技术有限公司;羊抗兔IgG-HRP,上海索莱宝科技有限公司;明胶、牛血清白蛋白(bovine serum albumin,BSA)、卵清蛋白(ovalbumin,OVA),国药集团化学试剂有限公司。本实验所用其他生物试剂纯度均大于98%,化学试剂均为分析纯及以上纯度。
Multiskan MK3酶标仪,赛默飞世尔(上海)仪器有限公司;YXQ-LS-SLL立式压力蒸汽灭菌器、酶标板,上海生工生物工程有限公司。
1.3 多克隆抗体的制备
1.3.1 菌株培养和VP免疫原的制备
新购进标准菌株VP17802用LB培养基37 ℃有氧培养12 h,于TCBS平板上划线分离观察菌落形态,挑取典型的VP单菌落进行培养并保存。将过夜培养的VP在灭菌锅中121 ℃灭活15 min后4 000 r/min离心10 min,用生理盐水洗脱沉淀3次,最后用生理盐水将菌液浓度调整为2×108CFU/mL保存备用。分别取免疫原与弗氏完全佐剂或弗氏不完全佐剂按1∶1体积比装入试管中混匀备用。
1.3.2 免疫方法与血清效价测试
以热灭活VP为免疫原,采用小剂量多部位交替注射的方式进行免疫,实验周期内共计进行9次免疫注射,初次免疫3周后,每2周进行1次加强免疫,免疫部位交替选取颈部和大腿[19]。具体免疫方法如表1所示。第3次免疫后1周,由耳静脉处取血液2 mL,并用间接ELISA法进行效价检测;此后每隔2周取1次血,用于效价测试。
1.4 抗血清的纯化和抗体蛋白浓度测定
当效价达到适当水平后终止免疫,颈部动脉取全血,采用硫酸盐沉淀法纯化抗血清。将纯化后的抗体用PBS稀释至适当浓度,用紫外分光光度计测量VP抗体在260、280 nm处的OD值,通过公式(1)计算纯化后的抗体蛋白质量浓度:
CIgG/(g·L-1)=1.45×OD280-0.74×OD260
(1)
表1 实验动物免疫方案
Table 1 Immunization program of experimental animals
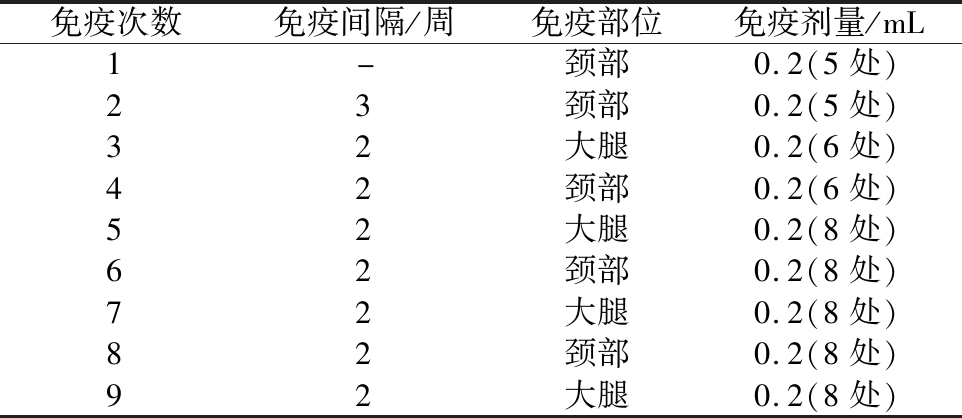
免疫次数免疫间隔/周免疫部位免疫剂量/mL1-颈部0.2(5处)23颈部0.2(5处)32大腿0.2(6处)42颈部0.2(6处)52大腿0.2(8处)62颈部0.2(8处)72大腿0.2(8处)82颈部0.2(8处)92大腿0.2(8处)
注:-表示无
1.5 实验条件优化
抗原抗体结合反应受多种因素影响,本实验考察了包被原和抗体反应浓度,封闭液种类以及酶标二抗浓度对ic-ELISA检测方法的影响。
1.5.1 抗原抗体浓度的优化
采用棋盘法优化包被原和抗体工作浓度。在包被阶段,用CBS(磷酸盐缓冲液)将包被原稀释一系列浓度梯度,每个浓度做3次平行;在抗原抗体反应时,用PBS将抗体稀释一系列梯度浓度,研究不同浓度下抗原抗体反应情况。
1.5.2 封闭液的选择
在ELISA分析实验中,常用的封闭液主要有BSA、明胶、OVA、脱脂奶粉等。本实验选用质量分数为5%脱脂奶粉、0.5%明胶、1% OVA、1% BSA作为封闭液,研究不同封闭液条件对实验的影响,并选出最佳封闭液。
1.5.3 酶标二抗浓度的优化
在抗体与二抗反应阶段,用PBS溶液将酶标二抗分别稀释4个浓度,分别为500、1 000、1 500和2 000 倍,研究不同二抗浓度对实验的影响,并选择最佳工作浓度。
1.6 ic-ELISA方法的建立
用CBS将热灭活VP稀释至一定浓度,加入96孔酶标板中,每孔100 μL,37 ℃包被1 h;倒掉包被液,每孔加入200 μL PBST,洗涤3次后每孔加入200 μL封闭液, 37 ℃封闭1 h;PBST洗板后,用PBS将抗体和竞争物稀释至适当浓度,每孔加入 50 μL竞争物、50 μL抗体,阴性对照孔加入50 μL阴性血清和50 μL的PBS缓冲液,空白对照孔加入100 μL PBS稀释液,37 ℃温育1 h;PBST洗板后,用PBS将二抗羊抗兔IgG-HRP稀释,每孔100 μL加入酶标板中,保鲜膜密封,37 ℃温育1 h;用PBST洗板5次,甩干。每孔加入100 μL新鲜配制的显色液,室温下反应15 min;每孔加入50 μL终止液,酶标仪读取450和630 nm的吸光度。
1.7 标准曲线的建立
用PBS将VP标准品梯度稀释(107、 5×106、 106、 5×105、 105、 5×104 CFU/mL),在最佳实验条件下,采用 ic-ELISA法分析测定,依据吸光度计算各浓度样品对抗体的抑制率。其中不添加竞争物的空白孔OD值为A0,添加VP标准品的孔OD值为A。每个VP标准品浓度进行3组平行实验,取平均OD值计算抑制率,抑制率/%=(1-A/A0)×100,并以其为纵坐标,以VP标准品浓度的对数为横A坐标绘制标准曲线。依据线性回归方程计算检测下限浓度IC15,即抑制率为15%时所对应的标准品浓度。
1.8 抗体特异性分析
分别以5株副溶血性弧菌与12株非副溶血性弧菌作为抗体和包被原的竞争物,用公式(2)分别计算其对抗体的交叉反应率(cross-reactivity,CR)。
(2)
式中:IC50VP和IC50Com分别为抑制率为50%时VP与竞争物的浓度。
1.9 样品检测
采集的水样品来自于上海市水产批发市场中鱼、贝暂养池以及东海研究所实验室用水,样品处理方法参考WU等[20]的方法。将水样过0.45 μm膜后添加一定浓度的VP菌液进行加标实验。将处理好的实际样品及加标样品分别用ic-ELISA和国标法进行检测,对比2种方法的测定结果,评价ic-ELISA方法的可靠性。
2 结果与分析
2.1 间接ELISA检测多克隆抗体效价
以热灭活VP免疫2号、3号、4号兔子,采用间接ELISA测试血清效价。如图1所示,随着免疫次数的增加,血清效价显著上升,3只兔子血清效价都达到了90 000,但是到达第8次免疫时,2号、4号兔子血清上升缓慢,3号兔子抗血清有下降趋势,因此在第9次加强免疫后考虑取血收获抗血清。
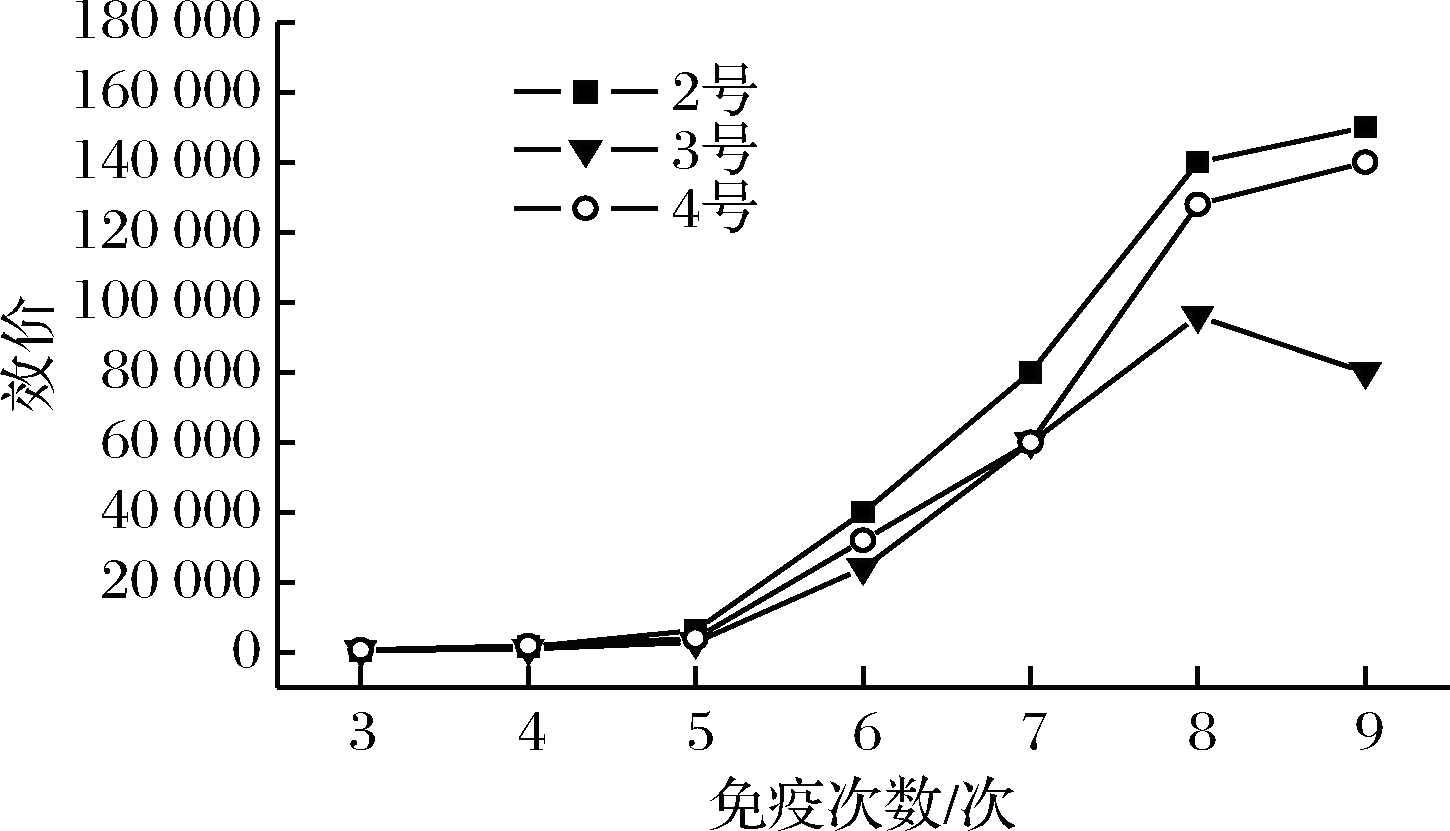
图1 抗血清效价趋势图
Fig.1 The trend chart of serum titer
2.2 多克隆抗体蛋白质含量测定
将抗体稀释至适当倍数,分别测量其在260 nm和280 nm的OD值,通过公式(1)计算纯化后抗体的蛋白质量浓度为14.24 g/L。
2.3 ic-ELISA实验条件优化
2.3.1 抗原抗体浓度的优化
抗原抗体结合反应遵循一定的量比关系,只有在两者比例相当时,反应最彻底,形成的免疫复合物最多。本实验采用棋盘法对抗原抗体的浓度进行优化,选择OD450值接近1.0的反应体系所对应的抗原抗体浓度为最佳抗原抗体浓度。结果显示,当包被原稀释100倍(106 CFU/mL),抗体稀释比例在64 000时,OD450 值接近1.0,抗原抗体反应更充分(表2)。
表2 检测VP的间接ELISA中包被原、抗体浓度的优化
Table 2 The optimization of coating antigen and antibody concentration for VP detection by indirect ELISA

包被原稀释比例抗体稀释比例1∶80001∶160001∶320001∶640001∶1280001∶2560001∶1001.891.611.300.990.510.401∶2001.511.060.920.710.450.421∶4000.880.630.480.360.310.271∶8000.430.330.240.180.270.23
2.3.2 二抗浓度的优化
在以上优化好的抗原抗体稀释比例条件下,以106 CFU/mL的活菌作为竞争物,将二抗羊抗兔IgG-HRP分别进行1∶500、1∶1 000、1∶1 500、1∶2 000稀释,对二抗浓度优化。根据抑制率和OD空白选择最佳二抗浓度。由图2可知当二抗稀释1 000倍时抑制率最大且OD空白最低,因此选择该浓度为最佳二抗浓度。

图2 检测VP的ic-ELISA中羊抗兔IgG-HRP浓度的优化
Fig.2 The optimization of goat anti-rabbit IgG-HRP concentration for VP detection by ic-ELISA
2.3.3 封闭液的选择
封闭液的使用可以有效减少ELISA中的非特异性结合,降低背景值。通过比较不同封闭液所得的抑制率和OD空白,以最大抑制率和最低OD空白选取最优封闭液。如图3所示,以质量分数为0.5%明胶为封闭液时抑制率最高且背景值最低,因此选择质量分数为0.5%明胶为最佳封闭液。

图3 检测VP的ic-ELISA中最佳封闭液的选择
Fig.3 The Selection of the blocking buffer for VP detection by ic-ELISA
2.4 标准曲线的建立
建立了 ic-ELISA 检测VP的标准曲线,该法的线性范围为5×104~107 CFU/mL,线性回归方程为y = 0.21x-0.74(R2 = 0.99),IC50为106CFU/mL,最低检出限IC15为1.7×104 CFU /mL。通过3次独立实验,得板间变异系数为4.71%~8.74%,板内变异系数为2.61%~4.15%,表明该法具有良好的稳定性。

图4 基于ic-ELISA检测VP的标准曲线
Fig.4 Standard curve for detection of VP by ic-ELISA
2.5 抗体特异性分析
免疫原是获取高特异性抗体关键。VP具有多个抗原决定簇,实验中直接以灭活VP为免疫原。为保证抗体的特异性,在制备免疫原过程中注意无菌操作,防止其他菌污染免疫原;免疫过程中注意兔子的健康状况,防止感染其他致病菌,在体内产生非特异性抗体。
用ic-ELISA 分析多克隆抗体与常见致病菌的交叉反应,结果如表3所示,所得抗体与5株副溶血性弧菌均能结合,与V. cholerae、V. vulnificus、V. fluvialis的交叉反应率接近10%,而与其他菌株交叉反应率在0.3%以下,表明该抗体对VP具有较高的特异性。
表3 抗体与细菌反应谱
Table 3 Specmcity of monoelonal antibodies

编号菌株名称交叉反应率/%1副溶血性弧菌ATCC178021002副溶血性弧菌800788.953副溶血性弧菌803093.214副溶血性弧菌803192.535副溶血性弧菌803291.286霍乱弧菌5310510.877创伤弧菌ATCC275629.158河流弧菌LMGT80348.779铜绿假单胞菌LMGT8020<0.310大肠杆菌LMGT3704<0.311乳酸乳球菌LMGT1403<0.312植物乳杆菌LMGT2799<0.313金黄色葡萄球菌LMGT3242<0.314粪肠球菌LMGT3355<0.315伤寒沙门氏菌LMGT8004<0.316单增李斯特菌LMGT2813<0.317蜡样芽胞杆菌LMGT2805<0.3
2.6 样品检测
采集的样品分别来自市场中鱼、贝暂养池和实验室用水,样品经预处理后分别用ic-ELISA和平板计数法进行检测(表4)。结果显示,ic-ELISA对样品的检测结果均为未检出;平板计数法对市场上采集的水样检出VP浓度均为1 CFU/mL,实验室用水VP为未检出。依照国家限量标准,2种方法检测结果一致,所有样品均为阴性样品。
为了考察方法的准确性,将样品过滤后加入7.5×104 CFU/mL浓度的VP,用建立的ic-ELISA进行加标水样检测。结果显示,3种水样的加标检验均为阳性结果,与平板计数法结果一致。由此表明新方法具有较高的可靠性,而且整个ic-ELISA检测样品的时间约为5 h,相比于国标方法大幅缩短了检测时间,可以用于实际样品中VP的快速分析检测。
表4 ic-ELISA法分析水样中的副溶血性弧菌
Table 4 Analysis of VP in the water samples by ic-ELISA

样品初始浓度/(CFU·mL-1)添加浓度/(CFU·mL-1)检测结果水样鱼养殖水10-贝养殖水10-实验室用水00-加标水样鱼养殖水07.50×104+贝养殖水07.50×104+实验室用水07.50×104+
注: +表示阳性;-表示阴性
3 结论
本实验以热灭活副溶血性弧菌免疫新西兰大白兔成功制备抗VP多克隆抗体,并建立了检测VP的 ic-ELISA 分析方法,优化了抗原抗体浓度、封闭液等实验条件,选择包被原稀释倍数 100、抗体稀释倍数64 000,二抗稀释倍数1 000,封闭液为0.5%的明胶为最佳实验条件,该方法的检出限为1.7×104 CFU/mL,本方法具有特异性强、灵敏度高、廉价实用等特点,对实际样品的检测结果与国标方法一致,具有较好的准确性,该方法有望开发成试剂盒用于食品实际样品中VP的检测。
[1] HUEHN S, EICHHORN C, URMERSBACH S, et al. Pathogenic vibrios in environmental, seafood and clinical sources in Germany[J]. International Journal of Medical Microbiology, 2014, 304(7):843-850.
[2] HAO Hongshun,HAO Shouchen,HOU Hongman,et al. A novel label-free photoelectrochemical immunosensor based on CdSe quantum dots sensitized Ho3+/Yb3+ -TiO2 for the detection of Vibrio parahaemolyticus[J]. Methods,2019,168:94-101.
[3] WANG Tao, SONG Xinxin,LIN Han, et al. A Faraday cage-type immunosensor for dual-modal detection of Vibrio parahaemolyticus by electrochemiluminescence and anodic stripping voltammetry[J]. Analytica Chimica Acta, 2019,1 062:124-130.
[4] WANG W, LI M, LI Y. Intervention strategies for reducing vibrio parahaemolyticus in seafood: A review[J]. Journal of Food Science, 2015,80(1):10-19.
[5] SU Y C, LIU C. Vibrio parahaemolyticus: A concern of seafood safety[J]. Food Microbiology, 2007, 24(6):549-558.
[6] BROBERG C A, CALDER T J, ORTH K. Vibrio parahaemolyticus cell biology and pathogenicity determinants[J]. Microbes & Infection, 2011, 13(12):992-1 001.
[7] WU Wei, ZHOU Meng, HE Hong,et al.A sensitive aptasensor for the detection of Vibrio parahaemolyticus[J].Sensors and Actuators B: Chemical, 2018, 272, 550-558.
[8] A R ALABOUDI, M ABABNEH, T M OSAILI, K. Al Shloul, Detection, identification, and prevalence of pathogenic vibrio parahaemolyticus in fish and coastal environment in Jordan[J]. J Food Sci,2016,81(1):130-134.
[9] TAIWO M, BAKER-AUSTIN C, POWELL A, et al. Comparison of toxR and tlh based PCR assays for Vibrio parahaemolyticus[J]. Food Control, 2017, 77:116-120.
[10] KONGRUENG J, TANSILA N, MITRAPARP-ARTHORN P, et al. LAMP assay to detect Vibrio parahaemolyticus causing acute hepatopancreatic necrosis disease in shrimp[J]. Aquaculture International, 2015, 23(5):1 179-1 188.
[11] ZHANG Z, XIAO L, LOU Y, et al. Development of a multiplex real-time PCR method for simultaneous detection of Vibrio parahaemolyticus, Listeria monocytogenes and Salmonella spp. in raw shrimp[J]. Food Control, 2015, 51:31-36.
[12] LEE J E, MUN H,KIM S R,et al. A colorimetric loop-mediated isothermal amplification (LAMP) assay based on HRP-mimicking molecular beacon for the rapid detection of Vibrio parahaemolyticus[J]. Biosensors and Bioelectronics,2019,151:111 968.
[13] ESCHBACH E, MARTIN A, HUHN J, et al. Detection of enteropathogenic Vibrio parahaemolyticus, Vibrio cholerae and Vibrio vulnificus: Performance of real-time PCR kits in an interlaboratory study[J]. European Food Research & Technology, 2017, 243(8):1-8.
[14] KUMAR B K, RAGHUNATH P, DEVEGOWDA D, et al. Development of monoclonal antibody based sandwich ELISA for the rapid detection of pathogenic Vibrio parahaemolyticus in seafood[J]. International Journal of Food Microbiology, 2011, 145(1):244-249.
[15] SAKATA J, KAWATSU K, KAWAHARA R, et al. Production and characterization of a monoclonal antibody against recombinant thermolabile hemolysin and its application to screen for Vibrio parahaemolyticus contamination in raw seafood[J]. Food Control, 2012, 23(1):171-176.
[16] 谢曼曼, 李建武, 王广彬,等. 副溶血性弧菌单克隆抗体的制备及特性鉴定[J]. 食品科学, 2017, 38(8):63-68.
[17] SAKATA J, KAWATSU K, IWASAKI T, et al. Development of a rapid and simple immunochromatographic assay to identify Vibrio parahaemolyticus[J]. Journal of Microbiological Methods, 2015, 116:23-29.
[18] LIU Y, CHAO Z, FU K, et al. Selective turn-on fluorescence detection of Vibrio parahaemolyticus in food based on charge-transfer between CdSe/ZnS quantum dots and gold nanoparticles[J]. Food Control, 2017, 80:380-387.
[19] 杨光昕. 基于免疫PCR生物条形码技术检测多氯联苯的研究[D]. 上海:上海交通大学,2014.
[20] WU S, WANG Y, DUAN N, et al. Colorimetric aptasensor based on enzyme for the detection of vibrio parahemolyticus[J]. Journal of Agricultural and Food Chemistry,2015,63(35): 7 849-7 854.