桑葚是桑科植物桑树的果实,富含多糖和白藜芦醇等功能组分,有增强人体免疫力、降血脂血糖和防癌抗变等作用[1]。桑葚采摘期仅在每年的4~6月,且不耐压、易腐烂,不宜在室温下储存和运输。除以鲜食外,深加工主要是生产浓缩糖浆、果酱、醋和果酒等[2],其中生产桑葚酒是提高附加值的重要途径之一[3]。目前桑葚酒技术开发关注的是原料加工性能、菌株筛选和特征及功能组分的剖析等[4-6]。
酵母菌的性质对果酒风味特征影响显著,基于酿酒酵母菌和非酿酒酵母菌的共培发酵技术不仅可改善果酒的风味特征,还使之高度发酵,是生产高品质果酒常用的技术之一[7-8]。Torulaspora delbrueckii具有产异戊醇、苯乙醇、乙酯类和萜烯等物质并赋予其风味特色组分的能力[9-10],可采用其与Saccharomyces酵母菌共培养发酵方式改善果酒的品质。
本文报道了不同类型桑葚原料、预处理方式对桑葚酒品质及风格影响的研究结果。同时探讨了酵母属的S. cerevisiae和S. bayanus分别与T. delbrueckii共培及不同温度发酵对桑葚酒风味特征的影响,旨在开发生产高质量桑葚酒的生产技术。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
新鲜桑葚果,购于本地农贸市场;冷冻桑葚,成都世煌生物科技有限责任公司馈赠。白砂糖(一级),购于本地副食品商店。
S.cerevisiae Y1(CCTCC M 2019521)、S. bayanus Y4(CCTCC M 2019522)、T.delbrueckii Y7 (CCTCC M 2019523),本实验室从果酒厂的发酵醪中分离,经菌落及菌体细胞形态观察、生理生化试验结果[11]初步鉴定和ITS测序确认,送中国典型培养物保藏中心保藏。
1.1.2 试剂
标品草酸、柠檬酸、酒石酸、L-苹果酸、乳酸、乙酸和丙酸,Sigma(CP,上海,中国);Lallzyme EX-V复配果胶酶制剂P1,康禧食品饮业有限公司(上海,中国)。
1.1.3 仪器与设备
Trace GC Ultra-DSQⅡ气相色谱质谱联用仪,Thermo Fisher Electron;HP-INNOWAX毛细管色谱柱(30 m×0.25 mm×0.25 μm)、1260高效液相色谱仪,美国Aglient;Alltech OA-1000有机酸色谱柱(300 mm×6.5 mm),美国GRACE;SPE小柱,成都SWELL;CAR/PDMS/DVB萃取头(50/30 μm),美国Supelco。
1.2 试验方法
桑葚破碎后,先加入NaHSO3(120 mg/L),随即加入果胶酶(70 mg/L),室温静置10 h。然后添加(NH4)2HPO3(150 mg/L),加蔗糖调整至23.5 Brix。
原料的影响:S.bayanus Y4的菌悬液接种到预处理后的原料中,使其菌体初始浓度为5×106 CFU/mL,17 ℃下发酵12 d,取发酵清液分析。这些原料包括鲜全果(FG)、冷冻全果(RG1,贮存1年)、冷冻全果汁(RZ)和冷冻全果(RG2,贮存2个月)等4种不同类型。
不同种属酵母共培养的影响:预处理的鲜桑葚全果汁分为6份,其中4份的操作步骤为分别接种S.cerevisiae和T.delbrueckii菌悬液(1∶1,5×106 CFU/mL,Y1&Y7);S. bayanus和T. delbrueckii 菌悬液(1∶1,5×106 CFU/mL,Y4&Y7),接种S. cerevisiae(Y1)和S. bayanus(Y4)为对照,菌体初始浓度和过程参数同前。置于(25±2) ℃条件下,发酵6 d时,补糖4%调整糖度,继续发酵4 d,过滤得原酒液。
温度的影响:剩余2份操作步骤分别与Y1&Y7和Y4&Y7相同,仅发酵的温度控制在(20±2)℃以探讨温度影响。样品简称为LY1&Y7和LY4&Y7。
1.3 分析检测方法
1.3.1 理化指标的测定
原料及原酒的主要理化指标按照GB/T15038—2006所述的方法检测。
1.3.2 有机酸的测定
按照参考文献[12]所述方法,应用HPLC检测。主要操作步骤为3 mL离心上清液加载到活化的SPE小柱,洗脱液经0.22 μm滤膜过滤后,高效液相色谱法检测,检测波长为210 nm。以柠檬酸,酒石酸,L-苹果酸,琥珀酸,乳酸和乙酸标准品的保留时间鉴定样品中有机酸,并采用外标法定量。
1.3.3 挥发性组分的测定及分析
按照参考文献[13]所述应用顶空固相微萃取-气相质谱方法检测。主要操作步骤为精确取0.5 mL样品置于顶空瓶中,用NaCl饱和,加入混合内标2-辛醇(69 mg/L,GC级)和辛酸甲酯(71 mg/L,GC级) 10 μL,60 ℃平衡15 min,插入萃取头,萃取40 min, 然后GC进样口中解吸析3 min。通过待测样品组分质谱数据与标准谱库(NIST2005)比对,匹配度>800(最大为1 000)的物质予以报道,采用内标法进行半定量计算。
1.4 数据处理
每个样品3次平行样品检测结果,采用SPSS 19.0软件对测得各项指标分析其单因素方差(Dancan’s test,P<0.05)。
2 结果与分析
2.1 原料类型及预处理方式对理化性质的影响
如表1所示,冷冻桑葚因其内源酶或原料表面栖息的微生物的作用使有机酸、总酸及挥发酸较其余类型的原料高,且酸类的含量也与贮存周期有关,如RZ的总酸和挥发酸含量高于RG2的。各样品间的残糖和乙醇浓度无显著区别。
如表2所示,琥珀酸、苹果酸和草酸等是原料中优势有机酸[14]。冷冻贮存过程中因物理除酸作用,尤其是酒酒球菌的作用[15-16]诱导了苹果酸—乳酸发酵。柠檬酸和酒石酸的含量降低了,从而导致酒体失去温和爽快和后苦时间短的新鲜口感[17]。苹果酸部分被转换为琥珀酸使RG2中琥珀酸含量显著高于其他样品,赋予了原酒鲜味和酸味[18],而苹果酸含量降低则减弱了果酒的酸涩及粗糙感。此外乳酸含量适量提高使之有更柔和的口感[5],但乳酸及乙酸含量偏高,不仅酸度高,还致使果酒出现酸刺激味等诸多欠愉悦的缺陷,冷冻或浓缩的桑葚不适合做酿酒原料。
表1 不同原料及预处理对桑葚酒主要理化性质的影响
Table 1 Effect of different raw material and pretreatment pattern on major physicochemical properties
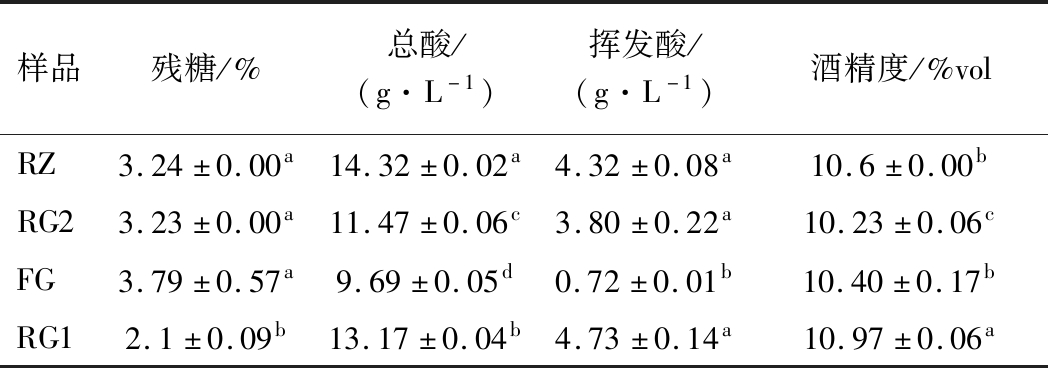
样品残糖/%总酸/(g·L-1)挥发酸/(g·L-1)酒精度/%volRZ3.24±0.00a14.32±0.02a4.32±0.08a10.6±0.00bRG23.23±0.00a11.47±0.06c3.80±0.22a10.23±0.06cFG3.79±0.57a9.69±0.05d0.72±0.01b10.40±0.17bRG12.1±0.09b13.17±0.04b4.73±0.14a10.97±0.06a
注:表中不同小写字母表示差异显著(P<0.05)(下同)
表2 不同原料及预处理对桑葚酒有机酸含量的影响 单位:g/L
Table 2 Effect of different materials and pretreatment pattern on organic acid contents
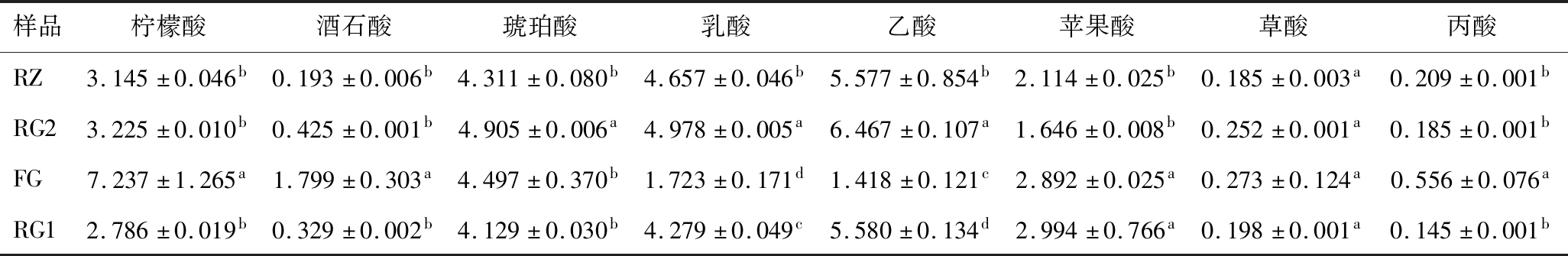
样品柠檬酸酒石酸琥珀酸乳酸乙酸苹果酸草酸丙酸RZ3.145±0.046b0.193±0.006b4.311±0.080b4.657±0.046b5.577±0.854b2.114±0.025b0.185±0.003a0.209±0.001bRG23.225±0.010b0.425±0.001b4.905±0.006a4.978±0.005a6.467±0.107a1.646±0.008b0.252±0.001a0.185±0.001bFG7.237±1.265a1.799±0.303a4.497±0.370b1.723±0.171d1.418±0.121c2.892±0.025a0.273±0.124a0.556±0.076aRG12.786±0.019b0.329±0.002b4.129±0.030b4.279±0.049c5.580±0.134d2.994±0.766a0.198±0.001a0.145±0.001b
2.2 不同类型酵母共培的桑葚果酒生产工艺
2.2.1 共培发酵温度对理化指标的影响
S. cerevisiae常用于新世纪葡萄酒的酿造[19]。在其过程中接种S. bayanus,可提高其甘油、乳酸和琥珀酸含量,使乙酸和乙醇的含量略低[20]。如表3所示,二者用于鲜全桑葚汁酿酒时,乙醇、残糖及总酸含量并没有显著差异,仅降低发酵温度时,残糖含量略高而乙醇浓度略低。
2.2.2 共培养发酵对挥发组分的影响
同系Saccharomyces的S. cerevisiae和S. bayanus所酿桑葚原酒的主要理化指标相同,但挥发性组分含量差异显著。这2株酵母菌分别与T. delbrueckii共培时,对挥发性组分的贡献因种属不同而异。S. cerevisiae与T. delbrueckii共培,挥发性组分总量略增,其中酚和酮类的含量显著提高,但酯和酸类含量降低,比例或增或减。S. bayanus与T. delbrueckii共培,其总量及各组分比例均略增高。
表3 酵母菌间共培及温度对主要理化指标的影响
Table 3 Effect of co-culture by different yeast strain and fermentation temperature on major physicochemical properties of mulberry wine
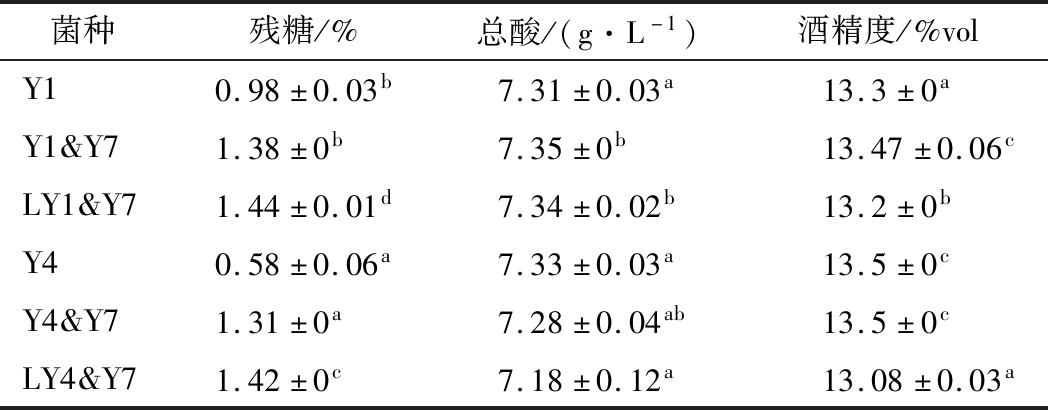
菌种残糖/%总酸/(g·L-1)酒精度/%volY10.98±0.03b7.31±0.03a13.3±0aY1&Y71.38±0b7.35±0b13.47±0.06cLY1&Y71.44±0.01d7.34±0.02b13.2±0bY40.58±0.06a7.33±0.03a13.5±0cY4&Y71.31±0a7.28±0.04ab13.5±0cLY4&Y71.42±0c7.18±0.12a13.08±0.03a
如图1所示,6种酒样中共检出了73种挥发性组分,包括酯(32)、醇(10)、酸(4)、醛(6)、酮(1)、酚(6)、萜烯类(7)和其他(7)等不同类型。Y4样品55种,Y1样品54种,分别与T. delbrueckii共培,使组分数量增多。Y1&Y7和 Y4&Y7分别检出了64种和59种,降低发酵温度,前者减少了1种,而后者增加了6种。样品间含量差异显著的是酯、酚和醇3类组分,这些组分占总挥发组分总含量的92.95%~95.73%。
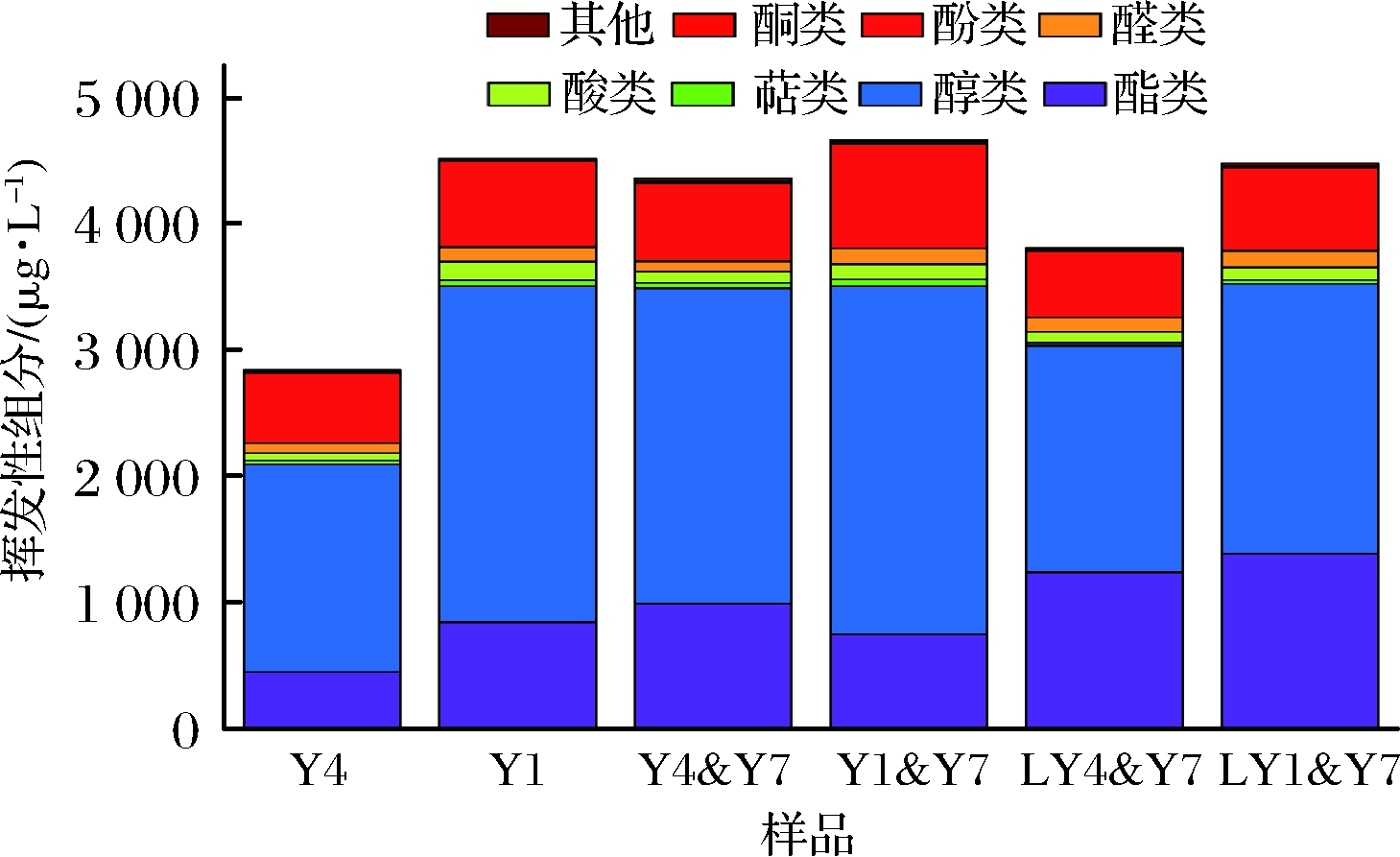
图1 不同酵母菌共培及发酵温度的桑葚酒挥发组分轮廓的差异
Fig.1 Difference of volatiles profile among mulberry wine brewed by different co-cultured yeast and fermentation temperature
此外,这2株酵母菌分别与T. delbrueckii共培,也使桑葚酒的多种组分含量差异显著。T. delbrueckii的贡献主要是提高脂肪酸乙酯的含量,如辛酸乙酯和十二烷酸乙酯[21-22]。共培养增加了乳酸、辛酸、己酸和苯甲酸的乙酯类衍生物、十二烷酸甲酯和丁二酸二乙酯6种组分的含量,使己酸丁酯等4种组分的含量略降,且新检出了肉桂酸乙酯和十四酸乙酯(图2-a)。S.bayanus和S. cerevisiae因代谢途径及生理生化性质不同,与T. delbrueckii组合共培使己酸乙酯等8种酯类组分含量的增减幅度不同(图2-b)。S. bayanus与T. delbrueckii共培,酯类组分略增,而S. cerevisiae 与T. delbrueckii共培,酯类组分略降,新检出了苯甲酸乙酯、磷酸三丁酯和丙位癸内酯3种组分。共培发酵使异戊醇、1-己醇、异丁醇和十一醇4种醇类组分的含量增高,苯甲醇和辛醇含量降低(图2-d),可能与T. delbrueckii中β-葡萄糖苷酶的活性有关[23]。1-癸醇、3-甲硫基丙醇和正庚醇等3种组分仅在S. cerevisiae和T. delbrueckii共培养时才被检出。T. delbrueckii合成芳樟醇和α-萜品醇的能力较强,橙花醇是芳樟醇的重要前体物之一[10],所以前者的含量减少,而后者略增。此外,萜类及除癸酸外的酸类组分含量略增(图2-e)。
温度影响T. delbrueckii的代谢速率,低温降低了其合成苯乙醇的能力,使醇类组分的含量减少[24]。己酸、辛酸、十二烷酸、苯乙酸和肉桂酸的乙酯衍生物和4-羟基丁酸乙酰酯的含量减少,而甲酸辛酯、丁二酸二乙酯和戊二酸二乙酯的含量较高(图2-c)。T. delbrueckii与S. bayanus共培使苯甲酸、苯乙酸、苯丙酸、软脂酸的乙酯衍生物的含量增高,与S. cerevisiae共培则使这些组分的含量减少。
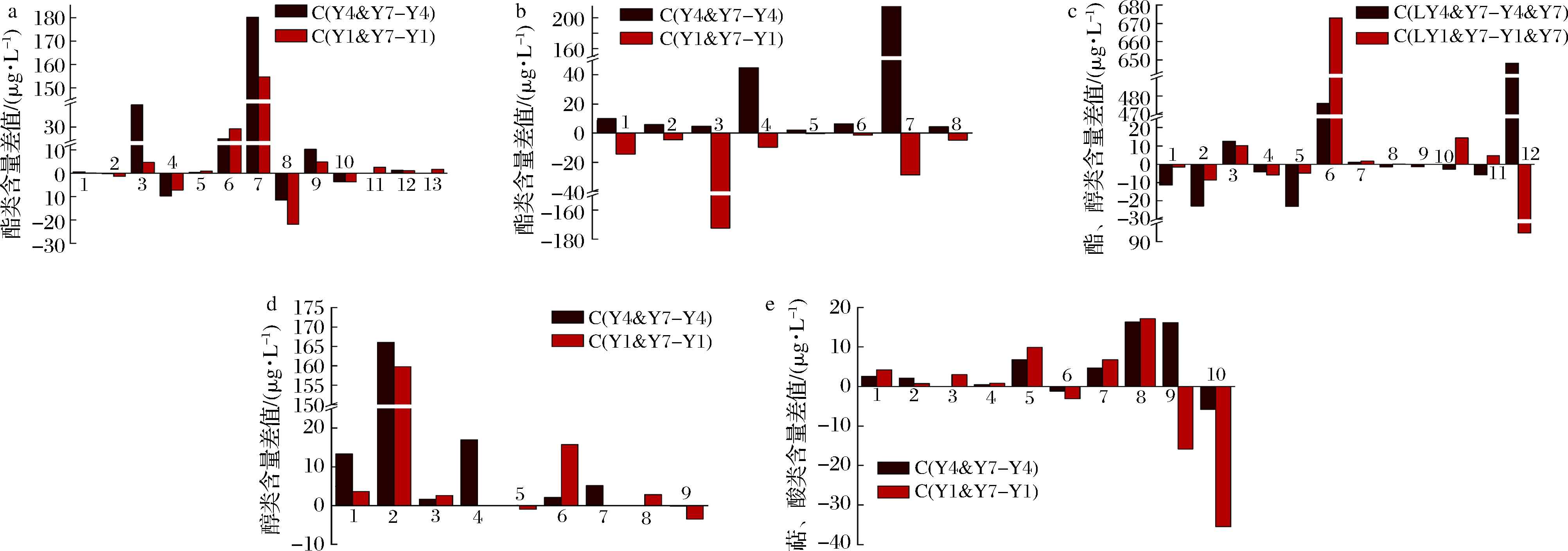
a-共培前后变化趋势相似的酯类物质的差异;b-共培前后变化相反的酯类物质的差异;c-不同温度共培酯类和醇类物质的差异;d-共培前后醇类物质的差异;e-共培前后萜类和酸类物质的差异
图2 不同酵母菌共培及发酵温度的桑葚酒主要挥发组分之间的差异
Fig.2 Difference of major volatile among mulberries wine brewed by different co-cultured yeast and fermentation temperature
注:a:1-乳酸乙酯;2-己酸丁酯;3-辛酸乙酯;4-甲酸辛酯;5-十二烷酸甲酯;6-苯甲酸乙酯;7-丁二酸二乙酯;8-乙酸苯乙酯;9十四酸乙酯;10-磷酸二乙基壬酯;11-磷酸三丁酯;12-肉桂酸乙酯;13-丙位癸内酯;b:1-己酸乙酯;2-苯甲酰甲酸酯;3-4-羟基丁酸乙酰酯;4-十二烷酸乙酯;5-苯乙酸乙酯;6-苯丙酸乙酯;7-软脂酸乙酯;8-十八烷酸乙酯;c:1-己酸乙酯;2-辛酸乙酯;3-甲酸辛酯;4-4-羟基丁酸乙酰酯;5-十二烷酸乙酯;6-丁二酸二乙酯;7-戊二酸二乙酯;8-苯乙酸乙酯;9-肉桂酸乙酯;10-苯甲酸乙酯;11-苯丙酸乙酯;12-苯乙醇;13-丙位葵内酯;d:1-异丁醇;2-异戊醇;3-1-己醇;4-正庚醇;5-1-辛醇;6-十一醇;7-3-甲硫基丙醇;8-1-癸醇;9-苯甲醇;e:1-芳樟醇;2-(-)-4-萜品醇;3-松油醇;4-香茅醇;5-(+)-3-蒈烯,10-(乙酰基甲基);6-反式-橙花叔醇;7-2-甲基乙酸;8-己酸;9-辛酸;10-癸酸
对桑葚酒风味贡献度大的7种挥发组分(OAVs>1)的轮廓图如图3所示。癸醛气味活度值(odor activity value,OAV)值最高,S. bayanus与T. delbrueckii共培养使之显著降低,显著减弱了酒样中青草味、桔皮味和不愉快的脂肪味。S. cerevisiae与T. delbrueckii共培养使己酸乙酯、苯丙酸乙酯和苯乙醇升高,多种愉悦的芳香的强度增大。(20±2) ℃发酵时,LY4&Y7中己酸乙酯、苯丙酸乙酯和苯乙醇的OAV降低,癸醛、癸酸和苯乙醛的OAV上升,且未检出肉桂酸乙酯。除苯丙酸乙酯的OAV显著上升和癸醛、苯乙醛的OAV略微下降外,LY1&Y7中呈现了类似的结果。S. bayanusy和S. cerevisiae分别与T. delbrueckii共培,降低温度共培发酵,对果香、花香等果酒的特色芳香呈负贡献,使样品中不愉悦的脂肪味和腐败味及青草气味增浓。
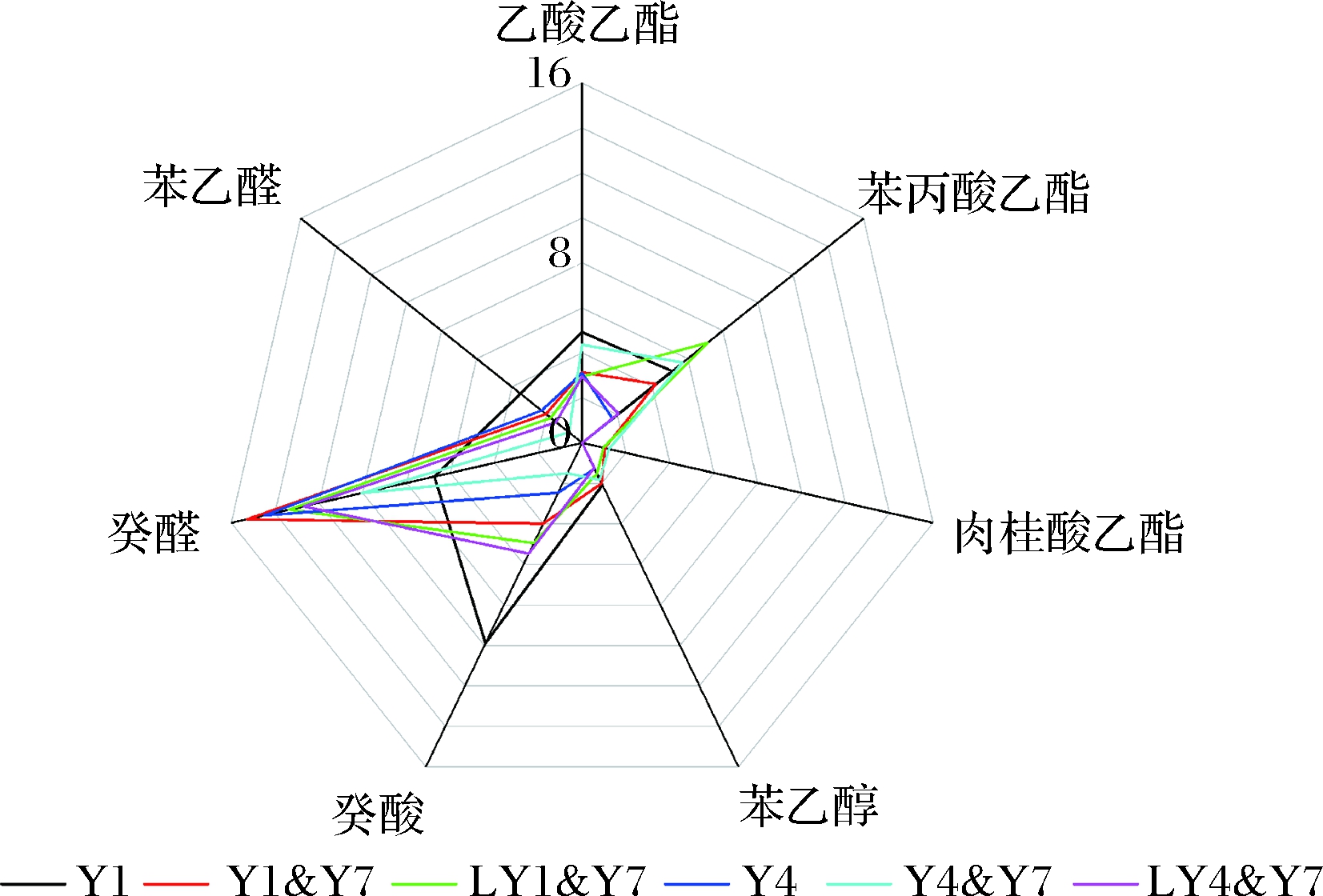
图3 不同温度及酵母菌共培样品的OAVs轮廓
Fig.3 OAVs profiles of mulberry wine samples with different co-cultured yeast and co-cultured temperature
注:挥发性物质感觉阈值参考文献[25-27]
2.2.3 共培发酵对有机酸的影响
T. delbrueckii 是与S.cerevisiae共培改善葡萄酒感官特征的非酿酒酵母之一,能有效提高葡萄酒的感官特征,发酵高糖度葡萄汁,降低乙酸及挥发性酸含量[28]。如图4所示,Y1和Y1&Y7聚为一簇,而Y4和Y4&Y7聚为一簇,Saccharomyces酵母菌影响桑葚酒的有机酸含量,且S. cerevisia的原酒8种有机酸的含量较S. bayanus的略低。S. cerevisiae和S. bayanus分别与T. delbrueckii 共培,乙酸含量略降。S. bayanus与T. delbrueckii 共培,柠檬酸含量略降;S. cerevisiae与T. delbrueckii 共培,琥珀酸含量略低,其他有机酸无显著差异。

图4 基于8种主要的有机酸不同酵母共培桑葚酒样品的热图分析
Fig.4 Heatmap analysis based on the 8 major organic acids of mulberry wine samples with different co-cultured yeast
3 结论
桑葚原料的类型、预处理方式、不同种属的酵母菌共培养发酵及温度显著影响桑葚酒的品质,尤其是有机酸和关键挥发组分。冷冻后的桑葚用于酿酒,挥发酸和乳酸含量增高,不适合酿酒。鲜果破碎直接酿酒,挥发酸含量低,酸涩及粗糙感减弱。S. cerevisiae和S. bayanus分别与T. delbrueckii共培养,改变了检出的8种有机酸的比例,乙酸含量减少,也使检出的挥发组分数量增多,含量和比例与相应单一种属菌株不同,致使果酒的果香、花香等特色芳香及特征风味增强。发酵温度降至(20±2) ℃则使不愉悦气味强度增大。
[1] 谢小花,陈静,安晓婷,等.桑葚的化学成分和功效作用研究进展[J].吉林工程技术师范学院学报,2017,33(9):85-87.
[2] GUNDOGDU M,MURADOGLU F,SENSOY R I G,et al.Determination of fruit chemical properties of Morus nigra L.,Morus alba L. and Morus rubra L. by HPLC[J]. Scientia Horticulturae,2011,132(1):37-41.
[3] 胡康,周金虎,颜雪辉,等.桑葚酒发酵工艺的研究[J].酿酒,2017,44(5):42-47.
[4] 杨新,卢红梅,杨双全,等.桑葚及桑葚果酒的研究进展[J].食品与发酵工业,2019,45(4):257-262.
[5] LUCHAI B,MONTRI J,SUJITAR J,et al. HS-SPME-GC-MS analysis of volatile aromatic compounds in alcohol related beverages made with mulberry fruits[J]. Food Science and Biotechnology,2011,20(4):1 021-1 032.
[6] KALKAN Y. Evaluation of colour parameters and antioxidant activities of fruit wines[J]. International Journal of Food Sciences and Nutrition,2006,57(1-2):47-63.
[7] HU Kai,JIN Guojie,MEI Wenchao,et al. Increase of medium-chain fatty acid ethyl ester content in mixed H.uvarum/S.cerevisiae fermentation leads to wine fruity aroma enhancement[J]. Food Chemistry,2018,239:495-501.
[8] SADOUDI M,TOURDOTMARECHAL R,ROUSSEAUX S,et al.Yeast-yeast interactions revealed by aromatic profile analysis of Sauvignon Blanc wine fermented by single or co-culture of non-Saccharomyces and Saccharomyces yeasts[J]. Food Microbiology,2012,32(2):243-253.
[9] CHEN D,YAP Z Y,LIU S Q.Evaluation of the performance of Torulaspora delbrueckii,Williopsis saturnus,and Kluyveromyces lactis in lychee wine fermentation[J].International Journal of Food Microbiology,2015,206:45-50.
[10] KING A,RICHARD D J. Biotransformation of monoterpene alcohols by Saccharomyces cerevisiae,Torulaspora delbrueckii and Kluyveromyces lactis[J]. Yeast,2000,16(6):499-506.
[11] 程池, 杨梅,李金霞,等. Biolog微生物自动分析系统——酵母菌鉴定操作规程的研究[J].食品与发酵工业,2006,32(5):50-54.
[12] ZHANG Liqiang,HUANG Jun,ZHOU Rongqing,et al.Evaluating the feasibility of fermentation starter inoculated with Bacillus amyloliquefaciens for improving acetoin and tetramethylpyrazine in Baoning bran vinegar[J]. International Journal of Food Microbiology,2017,255:42-50.
[13] ZHENG J,LIANG R,HUANG J,et al. Volatile compounds of raw spirits from different distilling stages of Luzhou-flavor Spirit[J]. Food Science and Technology Research,2014,20(2):283-293.
[14] 乔宇,吕辉华,吴继军,等.不同品种桑椹中糖酸组成和甜酸风味评价[J].食品科学技术学报,2016,34(4):44-49.
[15] 任晓宁,张宇,陈其玲,等.不同发酵条件对模拟葡萄酒中酒酒球菌柠檬酸代谢的影响[J].食品工业科技,2017,38(4):180-185;190.
[16] LONVAUD F,ALINE.Lactic acid bacteria in the quality improvement and depreciation of wine[J]. Anotine van Leeuwenhoek,1999,76(1):317-331.
[17] 刘晓艳,白卫东,蒋爱民,等.荔枝果酒加工过程中有机酸的变化研究[J].中国酿造,2011(11):65-69.
[18] ROTZOLL N,DUNKEL A,HOFMANN T.Quantitative studies,taste reconstitution,and omission experiment on the key taste compounds in morel mushrooms (Morchella deliciosa Fr)[J].Journal of Agricultural and Food Chemistry,2006,54:2 705-2 711.
[19] HENSCHKE P.Wine yeast[A].Yeasts sugar metabolism,biochemistry,genetics,biotechnology and application[C].UK:Technomic:Lancaster,1997:527-560.
[20] EGLINTON J M,MCWICLLIAM S J,FOGARTY M W,et al.The effect of Saccharomyces bayanus-mediated fermentation on the chemical composition and aroma profile of Chardonnay wine[J]. Australian journal of grape and wine research,2000,6(3):190-196.
[21] RENAULT P,COULON J,DE R G,et al.Increase of fruity aroma during mixed T. delbrueckii/S. cerevisiae wine fermentation is linked to specific esters enhancement[J]. International Journal of Food Microbiology,2015:40-48.
[22] 原苗苗,姜凯凯,孙玉霞,等.戴尔有孢圆酵母对葡萄酒香气的影响[J].食品科学,2018,39(4):99-105.
[23] FRANCESCA C,MIRKO G,PAOLA D,et al.Selected non-Saccharomyces wine yeasts in controlled multistarter fermentations with Saccharomyces cerevisiae[J]. Food Microbiology,2011,28(5):873-882.
[24] BREDA V V,JOLLY N,WYK J V.Characterisation of commercial and natural Torulaspora delbrueckii wine yeast strains[J]. International Journal of Food Microbiology,2013,163(2-3):80-88.
[25] JORGE A P,OSCAR Q.Analysis of volatile compounds of mango wine[J]. Food Chemistry,2010,125(4):1 141-1 146.
[26] WELKE J E,ZANUS M,LAZZAROTTO M,et al.Quantitative analysis of headspace volatile compounds using comprehensive two-dimensional gas chromatography and their contribution to the aroma of Chardonnay wine[J]. Food Research International,2014,59:85-99.
[27] G AMEZ G E,S
AMEZ G E,S NCHEZ P E,GONZ
NCHEZ P E,GONZ LEZ M A.Volatile composition of Bobal red wines subjected to alcoholic/malolactic fermentation with oak chips[J]. LWT - Food Science and Technology,2014,55(2):586-594.
LEZ M A.Volatile composition of Bobal red wines subjected to alcoholic/malolactic fermentation with oak chips[J]. LWT - Food Science and Technology,2014,55(2):586-594.
[28] CIANI M,COMITINI F,MANNAZZU I,Domizio P. Controlled mixed culture fermentation:A new perspective on the use of non-Saccharomyces yeasts in winemaking[J]. FEMS Yeast Res,2010,10(2):123-133.