沙门氏菌(Salmonella)是一类革兰氏阴性、具有鞭毛的兼性需氧菌[1],是细菌性食源性疾病的主要致病菌之一,易引起食物中毒以及肠胃炎等疾病[2-3]。所以针对食品原料、产品等进行沙门氏菌检测是我国食品监管部门及食品相关企业的必检项目[4-5]。传统的沙门氏菌分离、检测和鉴定方法主要有常规培养法、免疫学方法等[6],然而,这些方法操作较复杂、检测周期较长,且需要消耗大量培养基和生化试剂,对检测人员的技术水平也有较高的要求[7-8]。因此,随着分子生物学技术的发展,越来越多的实验室选择实时荧光定量PCR技术进行沙门氏菌检测[9-10]。实时荧光定量PCR技术具有操作简单、耗时短、效率高等优点[11],但该技术能否准确检测沙门氏菌还有待验证。
本研究选择沙门氏菌DNA标准物质候选物,使用实时荧光定量PCR技术来验证标准物质的均匀性和稳定性。为确保数据的准确性,还设计不同PCR仪精度分析、不同酶体系比较以及添加小牛胸腺载体DNA作为保护剂分析等。本文对沙门氏菌的稳定性研究可为各实验室进行比对实验以及快速检测方法研究提供基础参考。
1 材料与方法
1.1 试剂与仪器
沙门氏菌菌株,中国工业微生物菌种保藏中心,冻存于-80℃冰箱。Fast TaqMan Mixture,北京康为世纪生物科技有限公司;SuperRealPreMix(Probe),天根生化科技(北京)有限公司;Premix Ex TaqTM(Probe qPCR),宝日医生物技术(北京)有限公司(takara中国);TaqMan Gene Expression Master Mix,美国应用生物系统公司;小牛胸腺DNA(calf-thymus DNA,CT-DNA),上海泽叶生物科技有限公司;沙门氏菌DNA标准物质,中国计量科学研究院研制;引物和探针由英潍捷基(上海)贸易有限公司合成(表1)。
Q-POD纯水仪,仪默克化工技术(上海)有限公司;XS205电子秤,梅特勒-托利多国际贸易(上海)有限公司;生物安全柜,美国赛博飞公司;超低温保存箱,海尔生物医疗股份有限公司;3K15台式高速冷冻离心,德国Sigma公司;AB quant Studio 12K Flex、Roche罗氏LightCycler® 480Ⅱ实时荧光定量PCR仪,上海普迪生物技术有限公司。
表1 PCR所用引物和探针
Table 1 Primers and probes for PCR
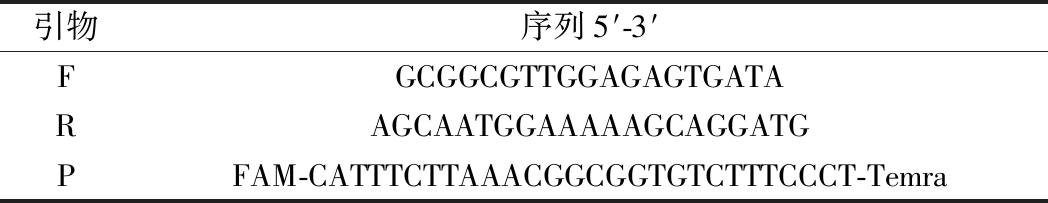
引物序列5′-3′FGCGGCGTTGGAGAGTGATARAGCAATGGAAAAAGCAGGATGPFAM-CATTTCTTAAACGGCGGTGTCTTTCCCT-Temra
1.2 实验方法
1.2.1 沙门氏菌DNA模板制备
沙门氏菌DNA作为定量标准物质候选物,使用灭菌去离子水对沙门氏菌DNA进行10倍系列稀释备用[12],最终得到的浓度分别为2.27×105copy/μL,2.27×104copy/μL,2.27×103copy/μL,227 copy/μL,22.7 copy/μL,2.27 copy/μL。
使用TE缓冲液(10 mmol/L Tris+0.1 mmol/L EDTA,pH 7.4)对小牛胸腺DNA溶液进行稀释,得到终浓度为20 μg/mL。并使用稀释过后的小牛胸腺DNA溶液对沙门氏菌DNA进行10倍系列稀释,稀释得到的最终浓度分别为2.27×105copy/μL,2.27×104copy/μL,2.27×103copy/μL,227 copy/μL,22.7 copy/μL,2.27 copy/μL。
1.2.2 PCR检测体系的建立
PCR反应采用25 μL体系,2×PCR Mix 12.5 μL,引物F(10 μmol/L)1 μL,引物R(10 μmol/L)1 μL,探针P(10 μmol/L)1μL,DNA模板5 μL,ddH2O 4.5 μL。PCR反应程序为95 ℃预热3 min;94 ℃ 5 s、60 ℃ 40 s,共40个循环,4 ℃保存反应产物。
1.2.3 实时荧光PCR检测方法的特异性验证
PCR引物探针的设计参考了肠道沙门氏菌肠毒素伤寒杆菌亚种,NCBI的Genebank序列号为NC_003198.1。特异性实验采用的菌株如表2所示,所有菌株皆为本实验室提供。将所有的菌株进行平板划线培养,挑选单菌落加入50 μL的灭菌去离子水中,煮沸裂解后分别离心收集上清液作为模板,进行PCR扩增。灭菌去离子水作为空白对照,本研究使用的沙门氏菌DNA标准物质作为阳性对照,验证沙门氏菌检测时本研究建立的PCR检测方法的特异性。
表2 沙门氏菌DNA的特异性检测
Table 2 Specific detection of Salmonella DNA
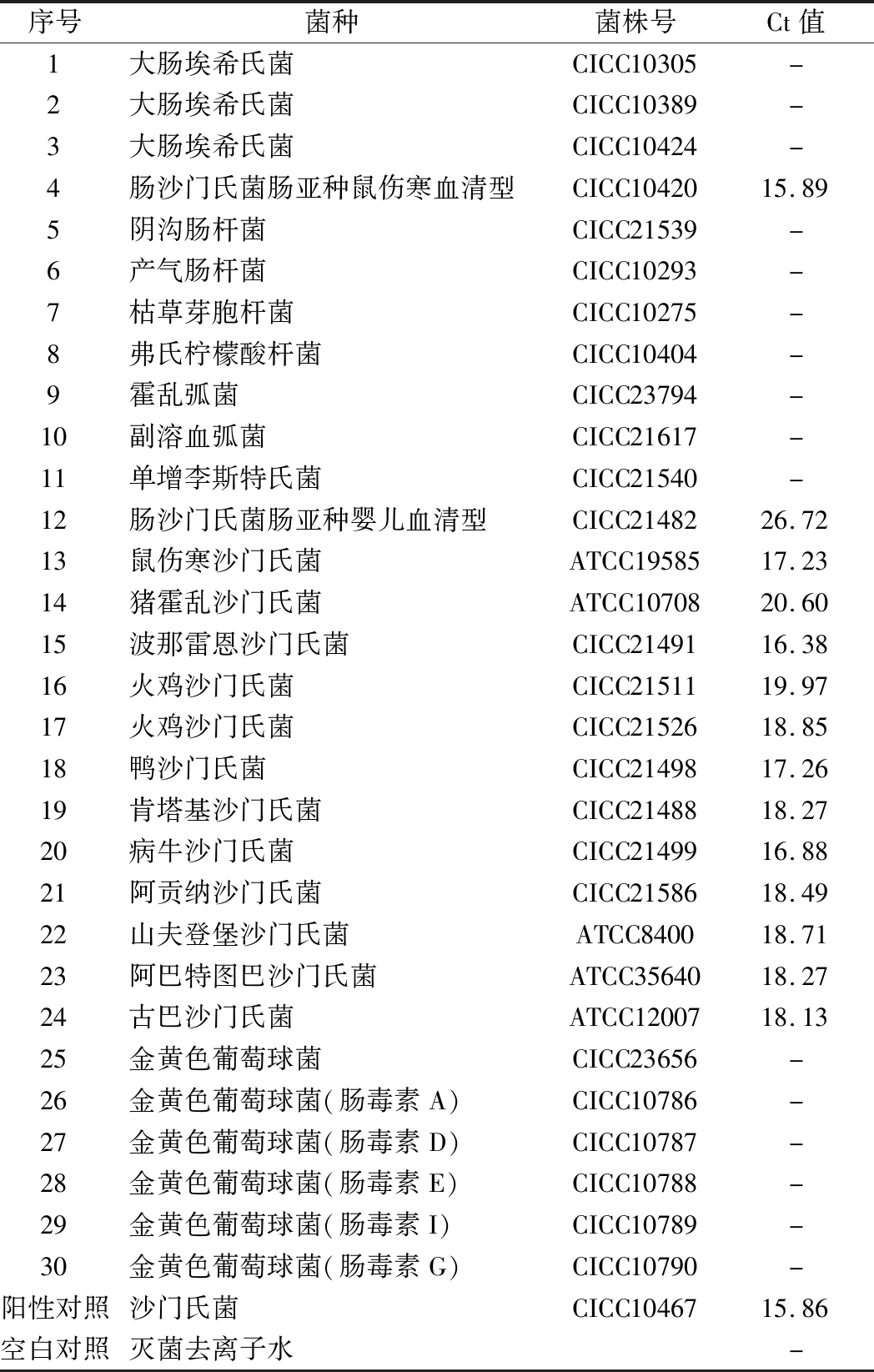
序号菌种菌株号Ct值1大肠埃希氏菌CICC10305-2大肠埃希氏菌CICC10389-3大肠埃希氏菌CICC10424-4肠沙门氏菌肠亚种鼠伤寒血清型CICC1042015.895阴沟肠杆菌CICC21539-6产气肠杆菌CICC10293-7枯草芽胞杆菌CICC10275-8弗氏柠檬酸杆菌CICC10404-9霍乱弧菌CICC23794-10副溶血弧菌CICC21617-11单增李斯特氏菌CICC21540-12肠沙门氏菌肠亚种婴儿血清型CICC2148226.7213鼠伤寒沙门氏菌ATCC1958517.2314猪霍乱沙门氏菌ATCC1070820.6015波那雷恩沙门氏菌CICC2149116.3816火鸡沙门氏菌CICC2151119.9717火鸡沙门氏菌CICC2152618.8518鸭沙门氏菌CICC2149817.2619肯塔基沙门氏菌CICC2148818.2720病牛沙门氏菌CICC2149916.8821阿贡纳沙门氏菌CICC2158618.4922山夫登堡沙门氏菌ATCC840018.7123阿巴特图巴沙门氏菌ATCC3564018.2724古巴沙门氏菌ATCC1200718.1325金黄色葡萄球菌CICC23656-26金黄色葡萄球菌(肠毒素A)CICC10786-27金黄色葡萄球菌(肠毒素D)CICC10787-28金黄色葡萄球菌(肠毒素E)CICC10788-29金黄色葡萄球菌(肠毒素I)CICC10789-30金黄色葡萄球菌(肠毒素G)CICC10790-阳性对照沙门氏菌CICC1046715.86空白对照灭菌去离子水-
注:-代表无
1.2.4 不同PCR仪对沙门氏菌DNA荧光定量PCR的影响
使用AB quant Studio 12K Flex和Light Cycler 480Ⅱ Roche实时荧光定量PCR仪分别对沙门氏菌DNA进行实时荧光定量PCR,以灭菌去离子水10倍系列稀释的沙门氏菌DNA为模板,经实时荧光定量PCR后的Ct值,从斜率,线性相关数,标准偏差以及扩增效率方面来分析不同PCR仪对沙门氏菌DNA扩增的影响[13]。其中扩增效率的计算如公式(1)所示:
(1)
式中:E表示扩增效率,slope表示斜率。
1.2.5 TaqDNA聚合酶对沙门氏菌DNA荧光定量PCR的影响
分别采用市面上常用的TaqDNA聚合酶Fast TaqMan Mixture、SuperRealPreMix(Probe)、Premix Ex TaqTM(Probe qPCR)、TaqMan Gene Expression Master Mix对沙门氏菌DNA进行实时荧光定量PCR,以灭菌去离子水10倍系列稀释的沙门氏菌DNA为模板,经实时荧光定量PCR后的Ct值,从斜率、截距、线性相关数以及扩增效率方面来分析不同的TaqDNA聚合酶对沙门氏菌DNA扩增的影响。
1.2.6 添加保护剂对沙门氏菌DNA荧光定量PCR的影响
以10倍系列稀释的沙门氏菌DNA为模板进行定量PCR(每组实验重复3次),同时以去离子水作为空白对照,根据DNA浓度的对数和Ct值建立沙门氏菌的荧光定量PCR法标准曲线,从斜率、截距、线性相关数以及扩增效率方面来分析载体DNA是否会影响沙门氏菌DNA荧光定量PCR检测。
1.2.7 沙门氏菌DNA均匀性测试
选取7组沙门氏菌DNA作为平行样品,经实时荧光定量PCR仪测定Ct值,每组实验重复3次,同时以灭菌去离子纯水作为阴性对照,用Excel整理数据,计算由灭菌去离子水存放的低浓度沙门氏菌DNA的均匀性。其中均匀性分析使用方差分析法,如公式(2)所示:
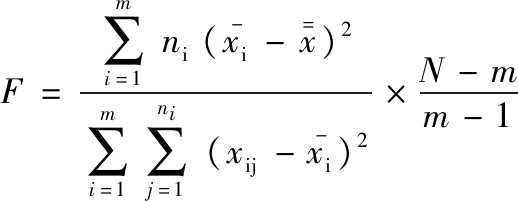
(2)
式中: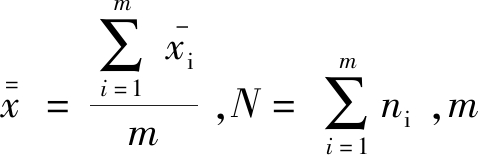 为平行样品的数量,m-1为组间自由度,N-m为组内自由度。若F<Fα(m-1,N-m)(在95%的置信水平下,Fα可由F表查得),则认为组内与组间无明显差异,样品是均匀的,反之,则样品不均匀。
为平行样品的数量,m-1为组间自由度,N-m为组内自由度。若F<Fα(m-1,N-m)(在95%的置信水平下,Fα可由F表查得),则认为组内与组间无明显差异,样品是均匀的,反之,则样品不均匀。
1.2.8 短期稳定性测试
将沙门氏菌DNA标准物质候选物储存于温度为(40±2) ℃的烘箱中,设计存储时间(0、24、48、72、144 h或0、24、120、144、168 h)[14],每个时间点包括3组平行样品。使用实时荧光定量PCR仪测定Ct值(每组实验重复3次),同时以去离子纯水作为阴性对照,用Excel整理数据计算平均值,绘图分析未稀释的沙门氏菌DNA以及保护剂中存放的低浓度沙门氏菌DNA检测样的短期稳定时间。
其中重复性计算如公式(3)、公式(4)所示:
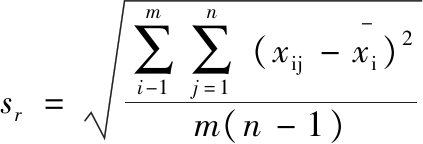
(3)
(4)
复现性计算如公式(5)~公式(7)所示:
(5)
(6)
(7)
公式(3)、公式(4)表示的是置信概率为95%时实时荧光定量PCR检测方法的重复性,公式(5)~公式(7)表示的是检测方法的复现性,其中m为平行样品的数量,n为平行测定次数。
稳定性计算如公式(8)、公式(9)所示:
(8)
(9)
公式(8)表示的是直线的标准偏差,公式(9)表示的是斜率k的不确定度,自由度为n-2,95%置信水平的t分布因子查表可知,若|k|<t0.95,n-2×s(k),则斜率是不显著的,表明该标准物质在稳定性监测期内是稳定的,反之,是不稳定的[15]。
1.2.9 反复冻融稳定性测试
将沙门氏菌DNA标准物质候选物放入冰箱(温度-80 ℃,时间5 min),常温下解冻(时间10 min),计划操作次数(1、3、6、10次),每次操作取3个平行样品放入4 ℃冰箱备用。使用实时荧光定量PCR仪测定Ct值(每个样品重复实验3次),同时以去离子纯水作为阴性对照,用Excel整理数据计算平均值,绘图分析未稀释的沙门氏菌DNA以及保护剂中存放的低浓度沙门氏菌DNA检测样能够经受温度变化的次数。
1.2.10 数据分析
基本数据采用Excel 2013进行分析(计算平均值、斜率、截距、扩增效率、重复性、复现性),采用GraphPad Prism 5.0对不同研究条件的沙门氏菌检测参数进行分析(方差分析法、直线拟合法、t检验统计检验法)[16]。
2 结果与分析
2.1 方法验证结果分析
2.1.1 沙门氏菌荧光定量PCR检测方法特异性分析
引物/探针组合对实验所检测各物种的特异性实验结果显示(表2),当使用引物和探针组合对31种DNA样本进行扩增时,只有在沙门氏菌的DNA样本出现扩增曲线,可以获取Ct值,而在其他细菌种类中没有出现扩增曲线。因此建立的沙门氏菌实时荧光PCR检测方法具有高度的特异性。
2.1.2 不同PCR仪荧光定量PCR分析
根据实时荧光定量PCR技术检测结果,对相关数据进行分析(表3),得到AB quant Studio 12K Flex和Light Cycler 480Ⅱ Roche两台PCR仪的线性分布图(图1)。从斜率和线性相关系数上分析,两台仪器的检测结果相近,无明显区别,均可用于沙门氏菌荧光定量PCR检验。
2.1.3 TaqDNA聚合酶荧光定量PCR分析
使用市面上常见的4种酶,对沙门氏菌DNA建立不同的酶体系进行Ct值分析(图2),评估不同酶体系作用于沙门氏菌DNA的荧光扩增效率[公式(1)],基本输出是一个线性关系,表示不同浓度梯度的沙门氏菌DNA的Ct值,相关统计量如表4所示。不同的酶相关系数约为0.99和扩增效率(在90%~100%)都处在实验接受范围内,表明这4种酶都适用于检测沙门氏菌DNA,可根据自己的实验条件,选择和调整适当的酶体系。
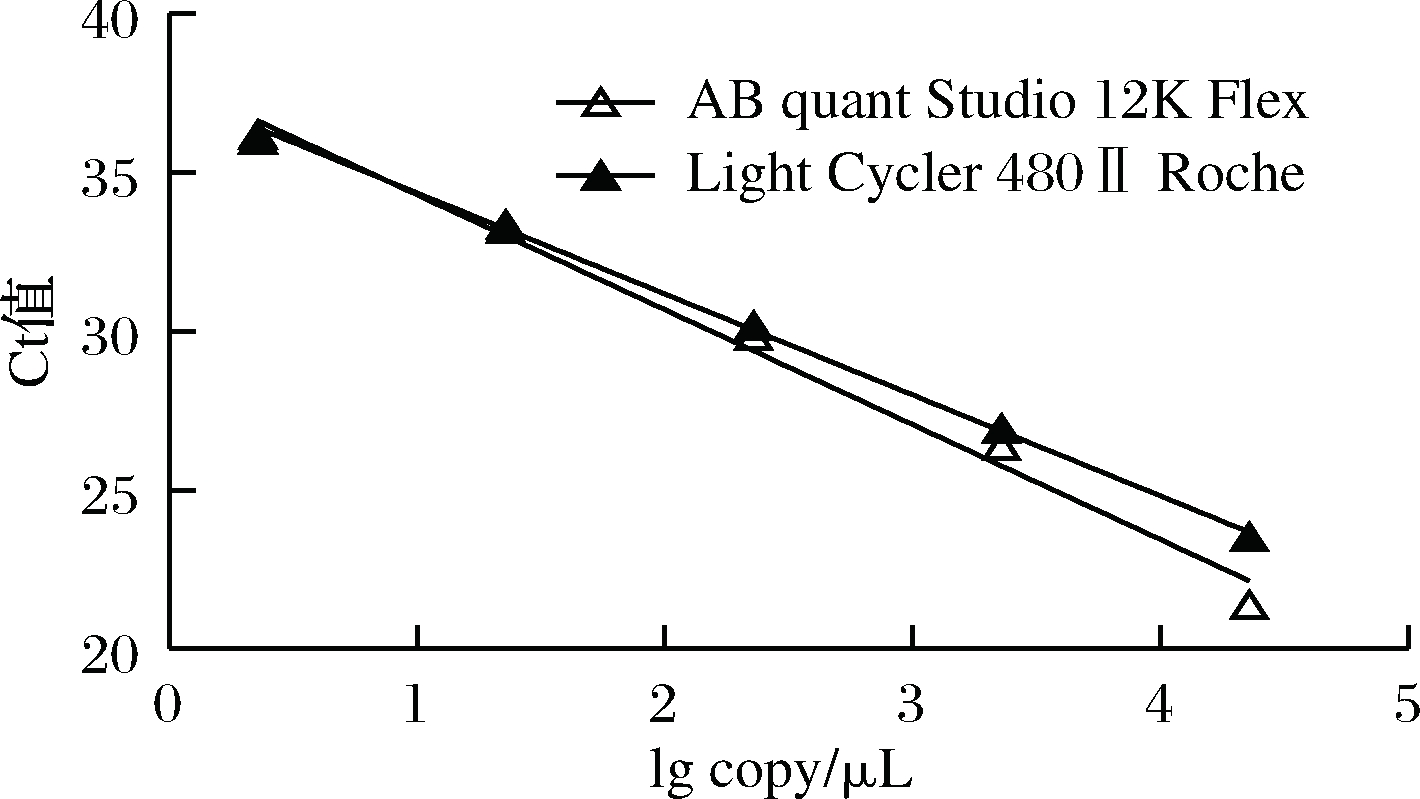
图1 不同PCR仪比较线性分布图
Fig.1 Comparison of linear distribution of different PCR instruments
表3 不同PCR仪实验结果分析
Table 3 Analysis of the experimental results of different PCR instruments

仪器类型斜率线性相关数标准偏差/%扩增效率/%ABquantStudio12KFlex-3.4-0.99870.19596.84LightCycler480ⅡRoche-3.37-0.99860.18598.03
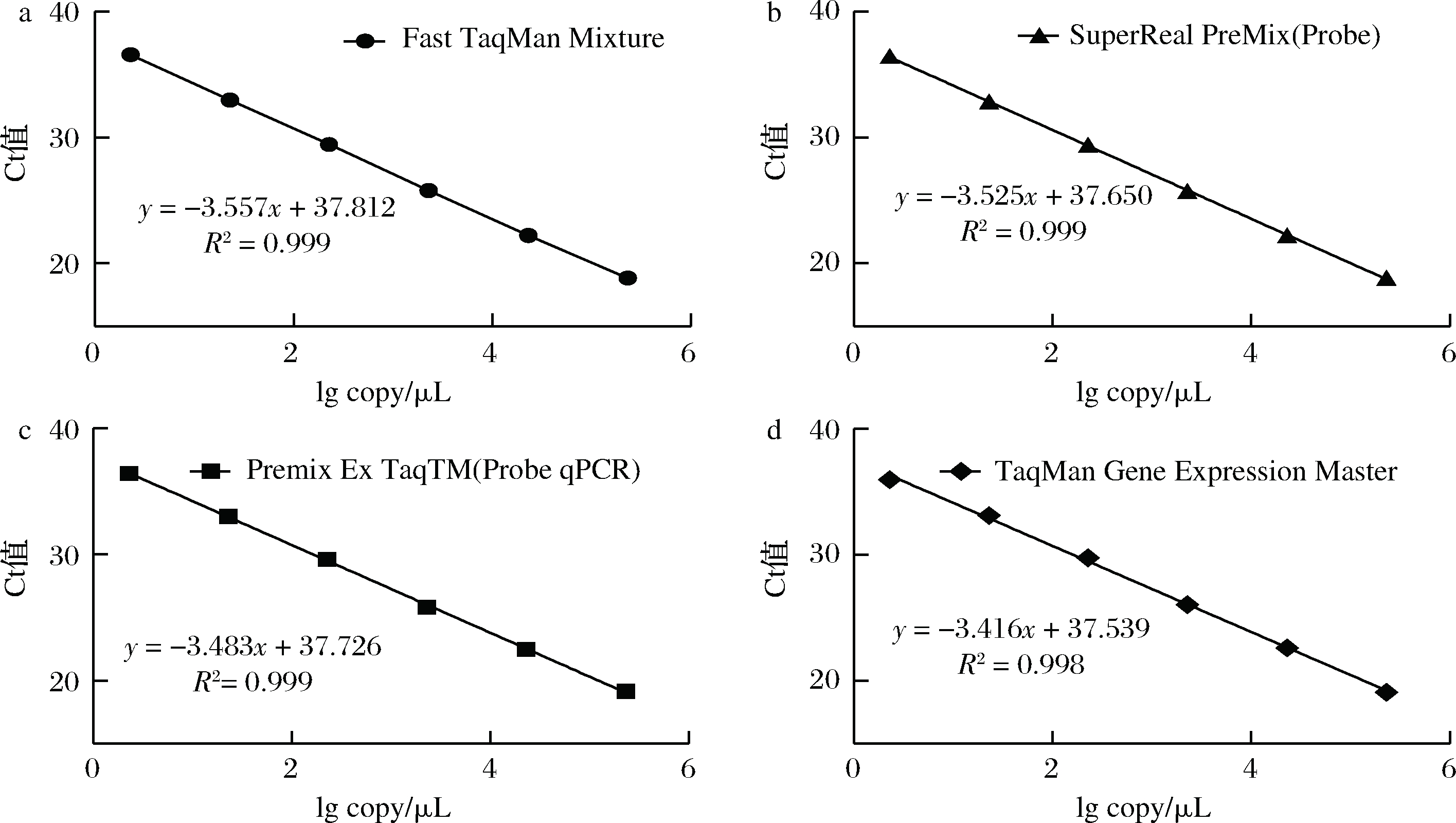
a-Fast TagMan Mixture;b-SuperReal PreMix;c-Premix Ex TaqTM;d-TaqMan Gence Expressin Master
图2 不同酶比较实验
Fig.2 Comparison of different enzymes
表4 酶比较实验参数分析
Table 4 Analysis of experimental parameters of enzyme comparison
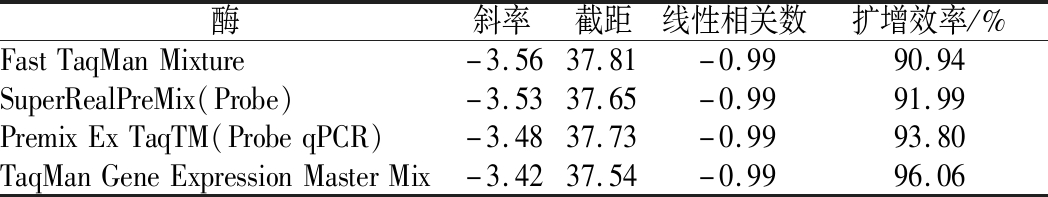
酶斜率截距线性相关数扩增效率/%FastTaqManMixture-3.5637.81-0.9990.94SuperRealPreMix(Probe)-3.5337.65-0.9991.99PremixExTaqTM(ProbeqPCR)-3.4837.73-0.9993.80TaqManGeneExpressionMasterMix-3.4237.54-0.9996.06
2.1.4 保护剂荧光定量PCR分析
通过添加保护剂与未添加保护剂的沙门氏菌Ct值的比较(图3),用以验证添加的保护剂小牛胸腺载体DNA是否影响沙门氏菌DNA的荧光扩增,相关统计量参数如表5所示。由表5可知,添加保护剂后的沙门氏菌DNA与为添加保护剂的沙门氏菌DNA荧光扩增后有相近的斜率,截距,线性相关数以及扩增效率[公式(1)],可知小牛胸腺载体DNA不会影响沙门氏菌DNA的PCR检测。
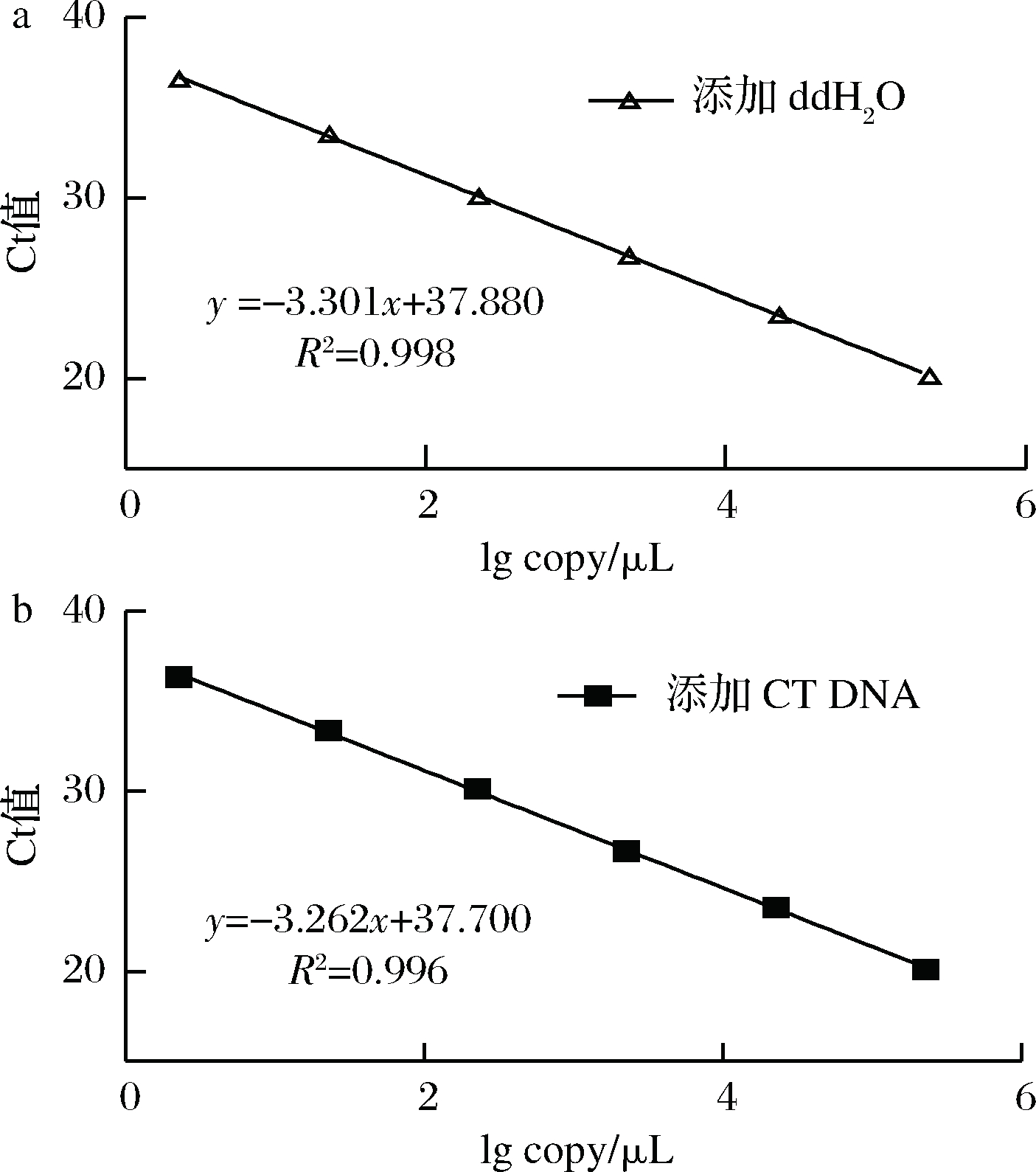
a-添加ddH2O;b-添加CT DNA
图3 验证实验标准曲线图
Fig.3 Standard curve of validation experiment
表5 验证实验参数分析
Table 5 Analysis of validation experimental parameters
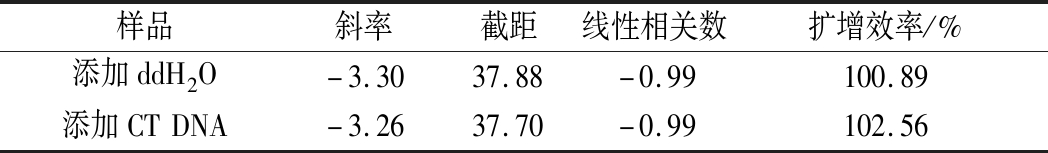
样品斜率截距线性相关数扩增效率/%添加ddH2O-3.3037.88-0.99100.89添加CTDNA-3.2637.70-0.99102.56
2.2 均匀性检测分析
由于沙门氏菌标准物质候选物包装单位约为100个,因此,随机抽取7个包装单位作为均匀性检测的样品,每个样品在不同的部位分别取3个试样进行实时荧光定量PCR检测。沙门氏菌均匀性检测结果以及相关统计量如表6所示。
表6 沙门氏菌均匀性检测结果
Table 6 Detection results of homogeneity of Salmonella
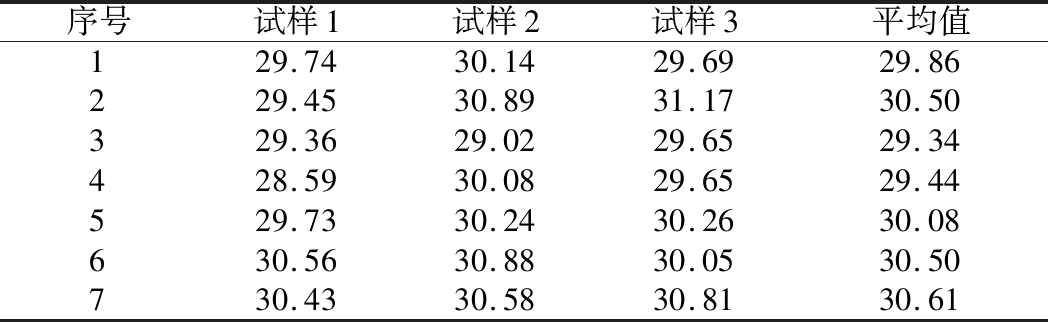
序号试样1试样2试样3平均值129.7430.1429.6929.86229.4530.8931.1730.50329.3629.0229.6529.34428.5930.0829.6529.44529.7330.2430.2630.08630.5630.8830.0530.50730.4330.5830.8130.61
均匀性检验使用的是方差分析法,检测标准物质在规定细分范围内其特性是否保持不变。根据表5和公式(2)可以计算出F=2.99,由F表可以查询出F0.05(6,14)=3.96,可见F<F0.05(6,14),故在95%置信水平时,沙门氏菌标准物质样品均匀。
2.3 短期稳定性检测分析
标准物质的短期稳定性,主要关注的是标准物质运输过程中的稳定性。一般情况下,运输过程中的高温环境对标准物质有较大的影响。在不同的存储时间中,沙门氏菌Ct值的会产生不同程度的变化(图4)。根据直线拟合法的计算分析[公式(3)~公式(9)],计算结果如表7所示,初始浓度的沙门氏菌DNA和保护剂中存放的低浓度沙门氏菌DNA量值是比较稳定的,但是由灭菌去离子水中存放的低浓度沙门氏菌DNA量值不稳定。

图4 短期稳定性测试
Fig.4 Short-term stability test
表7 短期稳定性结果分析
Table 7 Stability analysis of Short-term
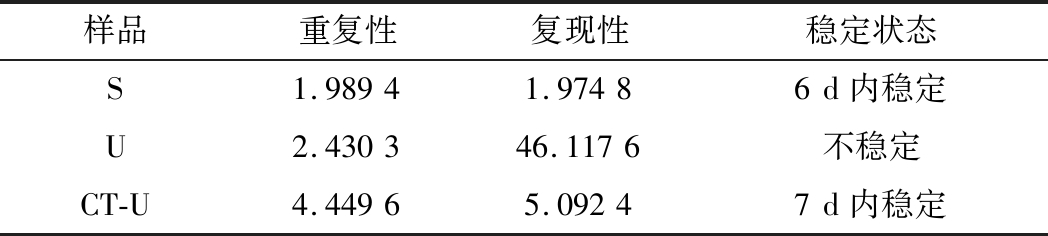
样品重复性复现性稳定状态S1.98941.97486d内稳定U2.430346.1176不稳定CT-U4.44965.09247d内稳定
注:S,未稀释过的沙门氏菌DNA;U,由灭菌去离子水存放的低浓度沙门氏菌DNA检测样;CT-U,由保护剂存放的低浓度沙门氏菌DNA检测样(下同)
2.4 反复冻融稳定性检测分析
反复冻融稳定性,主要关注的是标准物质在进行实验分析过程中的稳定性[17]。进行反复冻融实验时,沙门氏菌Ct值的变化情况可以呈线性分布(图5)。但是根据直线拟合法的计算分析(表8),初始浓度沙门氏菌DNA经过数次反复冻融仍然稳定,可以进行多次重复实验。但是低浓度的沙门氏菌DNA不允许反复冻融,为保证数据的可靠性,需对获取的样品进行一次性操作。
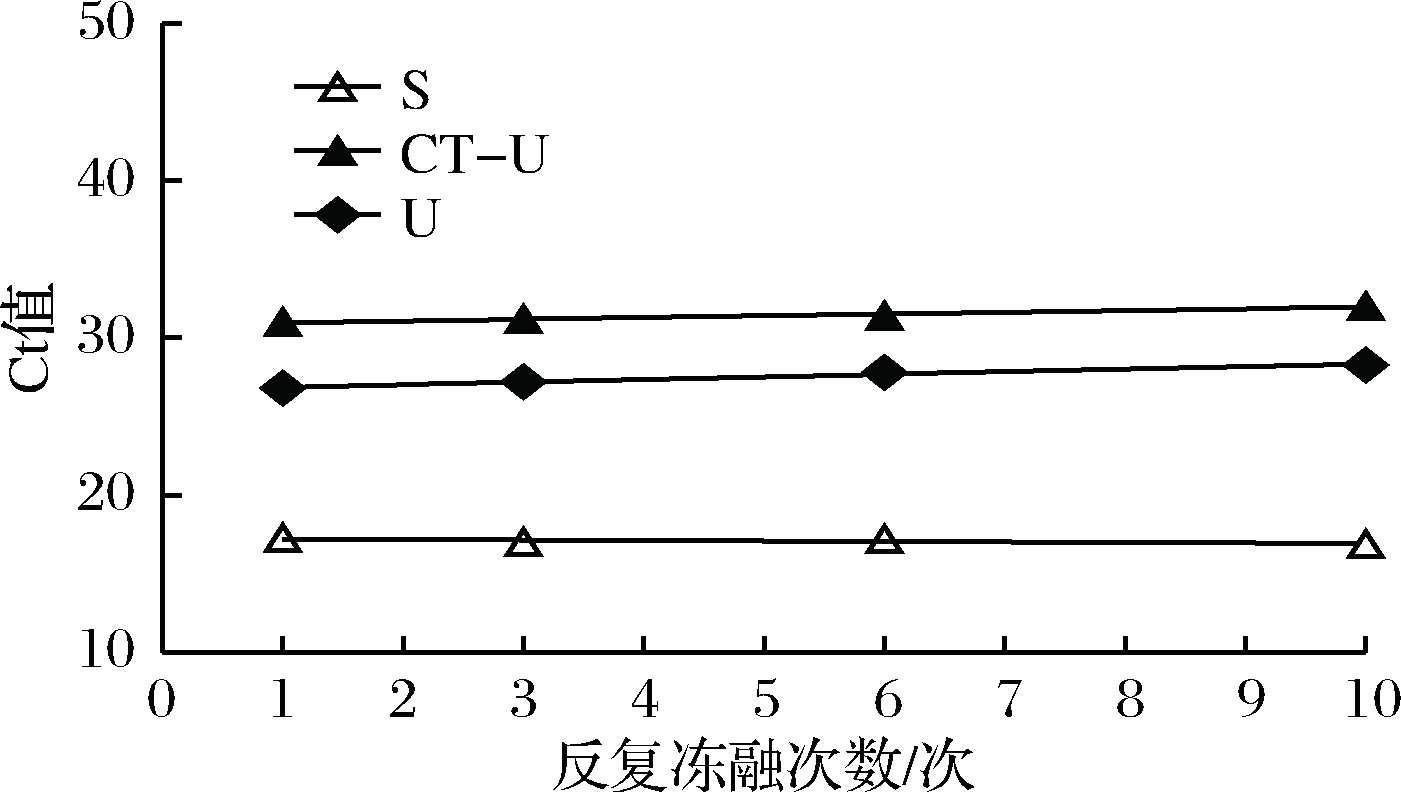
图5 反复冻融稳定性测试
Fig.5 Testing of the stability of repeated freezing and thawing
表8 反复冻融稳定性分析
Table 8 Stability analysis of repeated freezing and thawing
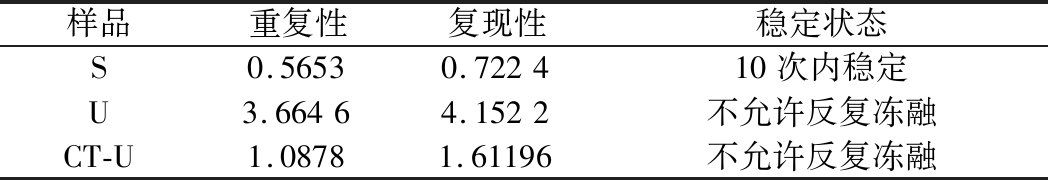
样品重复性复现性稳定状态S0.56530.722410次内稳定U3.66464.1522不允许反复冻融CT-U1.08781.61196不允许反复冻融
3 结论
本研究使用沙门氏菌DNA标准物质对实时荧光定量PCR检测方法进行规范验证[18-20],并选择2台不同的PCR仪[21]对检测方法进行比较验证。为优化PCR体系,选择4种不同的酶[22]进行比较。在初步的实验中,直接使用沙门氏菌DNA进行实验表明沙门氏菌DNA并不稳定,所以为了降低沙门氏菌DNA的降解率,选择使用小牛胸腺载体DNA[23]作为保护剂。
实验显示,在95%置信水平时,沙门氏菌标准物质样品均匀。沙门氏菌标准物质的稳定性研究[24]主要分为两个部分,一个是模拟短期高温稳定性,另一个是反复冻融稳定性,分别对初始浓度沙门氏菌DNA、ddH2O保存的低浓度沙门氏菌DNA检测样以及小牛胸腺DNA缓冲液保存的低浓度沙门氏菌DNA检测样进行实验。研究表明初始浓度沙门氏菌DNA检测样6 d内量值稳定,而且可以进行反复冻融10次,针对一个样品进行多次实验操作,不会影响实验数据的准确性;由小牛胸腺DNA溶液保存的低浓度沙门氏菌DNA检测样7 d内量值稳定,但是进行反复冻融实验时,沙门氏菌DNA结构遭到破坏未能测到有效数据。总的来说,这两种浓度的沙门氏菌短期稳定时间长,作为标准物质在运输过程中高温影响小[25],但实验时避免反复冻融。但是由ddH2O保存的低浓度沙门氏菌DNA检测样不管是短期稳定实验还是反复冻融稳定实验都表现出不稳定,建议实验时对沙门氏菌DNA添加保护剂,降低沙门氏菌DNA的消耗。
在未来研究中将进行长期稳定性实验并分析影响沙门氏菌降解的影响因素,为沙门氏菌稳定性研究提供参考资料。
实时荧光定量PCR方法[26-28]在病原微生物快速检测应用中准确性高,且沙门氏菌DNA稳定性好,可用来检验各实验室开展微生物核酸PCR方法的测量能力,保障微生物核酸检测技术的溯源性和准确性,从而提高我国在病原微生物核酸快速检测的水平。
[1] 佘容,罗丹,刘耀敏,等.TaqMan荧光定量PCR在饲料沙门氏菌检测中的应用评估[J]. 中国预防兽医学报, 2015, 37(12): 947-951.
[2] 庄春红,吴小凤,郑迎翔,等.福建省泉州地区2013-2016年沙门氏菌的PFGE分子分型及耐药性研究[J]. 医学动物防制, 2019, 35(6):540-543.
[3] XIONG Dan, SONG Li, PAN Zhiming, et al. Identification and Discrimination of Salmonella enterica serovar gallinarum biovars pullorum and gallinarum based on a one-step multiplex PCR[J]. Frontiers in Microbiology, 2018, 9:1 718.
[4] 段小丽,董立伟,朱国强,等.双重PCR检测肠炎沙门氏菌方法的建立[J]. 中国家禽, 2012, 34(17): 20-22.
[5] CARLONJ E,ROTUDOL,BRAND I, et al. Rapid and simultaneous detection of Salmonella spp., Escherichia coli O157, and Listeria monocytogenes by magnetic capture hybridization and multiplex real-time PCR[J]. Folia Microbiologica, 2018, 63(6):735-742.
[6] ALFAMAE R G,HESSEL C T,DEOLIVEIRA E S, et al. Assessment of temperature distribution of cold and hot meals in food services and the prediction growth of Salmonella spp. and Listeria monocytogenes[J]. Food Control, 2019,91:501-970.
[7] 杨云斌,许月琴.不同选择性培养基中沙门氏菌和干扰菌的分离鉴定[J]. 食品安全质量检测学报, 2019,10(4): 977-982.
[8] 刘骆强,姚艳玲,管佳丽,等.5种食源性致病菌PCR检测方法的建立[J]. 食品安全质量检测学报, 2019,10(5): 1 330-1 335.
[9] NADIN-DAVIS S, POPE L, OGUNREMI D, et al. A real-time PCR regimen for testing environmental samples for Salmonella enterica subsp. enterica serovars of concern to the poultry industry, with special focus on Salmonella Enteritidis[J].Canadian Journal of Microbiology, 2019, 65(2): 162-173.
[10] 汪华,李俊岐,常怡虹.运用实时荧光PCR法辅助鉴定能力验证样品中的沙门氏菌[J]. 食品安全质量检测学报, 2019, 10(3): 598-602.
[11] 陈旭,毛瑞,乔宇,等.基于竞争性互补介导核酸恒温扩增技术快速检测沙门氏菌[J]. 沈阳农业大学学报, 2019,50(2): 179-184.
[12] 张红莉,李勇,许均华,等.4种检测方法对巧克力中亚利桑那沙门氏菌的检测结果比较[J]. 食品研究与开发, 2019,40(9):172-176.
[13] 黄宝莹,余之蕴,林耀文,等. 四种方法检测食品中沙门氏菌的比较[J]. 食品工业科技, 2014,35(15):185-187;192.
[14] 国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准食品微生物学检测沙门氏菌检验GB4789.4——2016[S]. 北京:中国标准出版社, 2017.
[15] LIU Yuejiao, SINGH P, MUSTAPHA A. Multiplex high resolution melt-curve real-time PCR assay for reliable detection of Salmonella[J].Food Control, 2018, 91(9): 225-230.
[16] 赵莹彤,浑婷婷,詹悦维,等.基于微流控的真菌单细胞捕获和培养[J]. 微生物学通报, 2019, 46(3): 522-530.
[17] 刘祥琴,刘小琦.荧光定量PCR仪检测HBV DNA结果比对分析[J]. 检验医学与临床, 2016, 13(6): 791-792.
[18] 李小龙,吴群,徐岩.乙醇与酸度协同作用推动芝麻香型白酒固态发酵过程的微生物群落演替[J]. 微生物学通报, 2019, 46(1): 1-10.
[19] 全国标准物质管理委员会. 标准物质定值原则和统计学原理[M]. 北京:中国质检出版社, 2011:72-73.
[20] LUGERT R, SCHETTLER C, GROSS U. Comparison of different protocols for DNA preparation and PCR for the detection of fungal pathogens in vitro[J]. Mycoses, 2006, 49(4):298-304.
[21] FEY H, PFISTER H, RÜEGG O. Comparative evaluation of different enzyme-linked immunosorbent assay systems for the detection of staphylococcal enterotoxins A, B, C, and D[J]. Clin Microbiol. 1984, 19(1):34-38.
[22] VECCIO P D. Effect of osmoregulatory solutes on the thermal stability of calf-thymus DNA[J]. Journal of the Chemical Society, Faraday Transactions, 1996, 92(8):1 361-1 367.
[23] 汤妍雯,曹帅英,黄世英,等.溴化丁基橡胶门尼黏度标准物质均匀性与稳定性评价[J]. 合成材料老化与应用, 2018,47(5):83-87.
[24] YANG Mengrui, LIU Fang, WANG Min, et al. Development of a whole liquid egg certified reference material for accurate measurement of enrofloxacin residue[J].Food Chemistry, 2019, 309:125 253.
[25] DJEBBL-SIMMONS D, XU W Q, JANES M, et al. Survival and inactivation of Salmonella enterica serovar Typhimurium on food contact surfaces during log, stationary and long-term stationary phases[J]. Food Microbiology, 2019, 84:103 272.
[26] HAIM-VILMOVSKY L. High-throughput single-cell real-time quantitativePCR analysis[J]. Methods in Molecular Biology, 2019,1979:177-183.
[27] NIU D L, ZHAO Y E, GONG X J, et al. Screening of reference genes and quantitative real-time PCR detection and verification in Dermatophagoides farinae under temperature stress[J]. Experimental Parasitology, 2019,206:107 754.
[28] SAKURIA A,NOMURAN,NANBAR, et al. Rapid typing of influenza viruses using super high-speed quantitative real-time PCR[J]. Journal of Virological Methods, 2011,178(1-2):75-81.