茶叶微生物发酵是以茶叶为基质,接种特定微生物进行共培养,通过它们的代谢等作用使茶叶发生生理生化变化。经过微生物发酵后的茶叶增加了许多微生物代谢活性物质,使有效成分种类增加,品质得到很大的改善。因此,近年来“茶+食用菌”的探索一直受研究者的青睐[1]。茶叶中富含茶多酚、咖啡碱、儿茶素等多种活性物质[2-3],在药理上具有降血压、降血糖、预防动脉粥样硬化、抗菌消炎、利尿止痢等作用,同时其还具有抗氧化、抗衰老、助消化、缓解疲劳等保健功效[4-7]。白参菌是一种食药兼用的珍稀菇菌,其多糖具有抗癌作用,可治疗小儿腹泻、头晕、偏头痛等疾病,在白参菌的发酵液中含有丰富的鹰眼物质,具体包括氨基酸、多肽、蛋白质、单糖、多糖、有机酸、酚类化合物和油脂等多种活性化学成分。以茶为基质,接种白参菌进行固体发酵[8-9],加工具有茶和白参菌双重功效的新型功能菌茶,可提高茶叶中活性成分的含量,产生对人体健康更有益的次生代谢产物,并可提升茶叶的综合利用率。因此,对于白参菌发酵茶的研究具有十分重要的意义。
茶叶经过发酵后其活性物质种类和含量会在一定程度上发生变化[10-11]。目前茶叶中活性成分的检测通常包括化学分析方法[12]、高效液相色谱法[13-16]、气相色谱法[17]、气相色谱-质谱联用[18-19]、红外光谱法[20]、紫外可见光谱法[21-22]等。但化学分析方法准确度不够高,光学分析法很难得到茶中茶多酚类单体活性成分的含量,电化学分析方法同样只能确定茶多酚的总量,而高效液相色谱分析法可同时测定出复杂样品中多种成分的含量,具有操作简单、快速、准确的优点。本研究通过建立高效液相色谱(high-performance liquid chromatography,HPLC)检测方法,同时对茶叶发酵前后6种活性成分进行比较研究,为进一步探讨功能菌茶的品质研究提供重要依据,为茶产业的深加工提供新途径。
1 材料与方法
1.1 材料与试剂
咖啡碱(纯度≥ 98%),上海阿拉丁生化科技股份有限公司;可可碱(纯度100%),上海源叶生物科技有限公司;表儿茶素、表没食子儿茶素、表儿茶素没食子酸酯(纯度≥ 98%),上海安谱科学仪器有限公司;表没食子儿茶素没食子酸酯(纯度≥ 98%),上海诗丹德生物技术有限公司;乙腈、甲醇(色谱纯),Fisher Scientific;85%H3PO4,国药集团化学试剂有限公司。
1.2 仪器与设备
1260型高效液相色谱仪(配有DAD 检测器),美国Agilent公司;RV8旋转蒸发仪,上海人和科学仪器有限公司;ZHJH-1109B超净工作台,苏净集团安泰公司;HPS-160生化培养箱,哈尔滨东明医疗仪器厂;DHG-9146A电热恒温鼓风干燥箱,上海精密实验设备有限公司;G154D高压灭菌锅,致微(厦门)仪器有限公司;BS110S电子天平,北京赛多利斯仪器有限公司。
1.3 实验方法
1.3.1 HPLC 条件
色谱柱,wondaSil C18柱(4.6 mm×250 mm,5 μm),流动相乙腈(A)和0.2%磷酸溶液(B),梯度洗脱(见表1),流速,1 mL/min,柱温30 ℃,进样量,20 μL,检测波长 280 nm。
表1 梯度洗脱流动相比例 单位:%
Table 1 The gradient elution program

流动相0min15min40min45minA515255B95857595
1.3.2 白参菌种的活化
将经过高压蒸汽灭菌的马铃薯PDA 培养基于超净工作台中倒入平板中,挑取白参菌丝接种在凝固的PDA培养基平板上,置于31 ℃生化培养箱中培养,等菌丝体长满平板时,于4 ℃冰箱保存备用。挑取活化的菌丝逐步接种于葡萄糖含量不断降低的茶叶水培养基上,至菌丝接种在无糖茶水培养基上能够快速生长,铺满平板,再以茶叶作为培养基质,继续培养菌种,逐步降低培养基中的葡萄糖含量,直至菌种可在无糖茶叶培养基上能够快速生长,将驯化好的菌种保存于4 ℃。
1.3.3 白参菌发酵茶的制备
取驯化好的白参菌菌种接种于湿度为75%的40 g绿茶培养基中,封口后充分摇晃置于室温下培养。待菌丝长满平板时,持续培养4~6 d。然后,将培养基里长满菌丝后的发酵茶叶置于烘箱中,在65 ℃下烘干至恒重,密封干燥,得白参菌发酵茶。
1.3.4 样品前处理
绿茶处理:称量10.0 g绿茶,加100 mL蒸馏水浸提1 h,过滤浸提液,将滤液旋转蒸发浓缩至膏状,用蒸馏水溶解浸膏转移至25 mL容量瓶中定容,得绿茶提取液。移取绿茶提取液1 mL于25 mL容量瓶定容,得待测绿茶提取液,4 ℃保存备用。
菌茶处理:菌茶的处理与上述绿茶处理方式一致。
1.3.5 标准溶液的制备
精密称取可可碱10.0 mg、表没食子儿茶素5.0 mg、咖啡碱50.0 mg、表儿茶素5.0 mg、表没食子儿茶素没食子酸酯5.0 mg、表儿茶素没食子酸酯10.0 mg于25 mL棕色容量瓶中,用甲醇溶解并定容至25 mL,配制成标准品的混合溶液。逐级稀释,用甲醇定容,得混合标准品质量浓度为可可碱(12.5~400 μg/mL),表没食子儿茶素(6.25~200 μg/mL),咖啡碱(62.5~2 000 μg/μL),表儿茶素(6.25~200 μg/mL),表没食子儿茶素没食子酸酯(6.25~200 μg/mL),表儿茶素没食子酸酯(12.5~400 μg/mL)。4 ℃保存备用。
2 结果与分析
2.1 标准混合样品色谱图
图1为6种混合标准品样品色谱图,标准品可可碱、表没食子儿茶素、咖啡碱、表儿茶素、表没食子儿茶素没食子酸酯、表儿茶素没食子酸酯; 6种成分的出峰时间为10.62、16.14、17.61、22.16、24.33、32.28 min。由图1可知,各标准品在35 min内均完全分离,各成分分离度高、峰型好。表明该方法适合于同时对茶叶中可可碱、表没食子儿茶素、咖啡碱、表儿茶素、表没食子儿茶素没食子酸酯、表儿茶素没食子酸酯的分离检测。
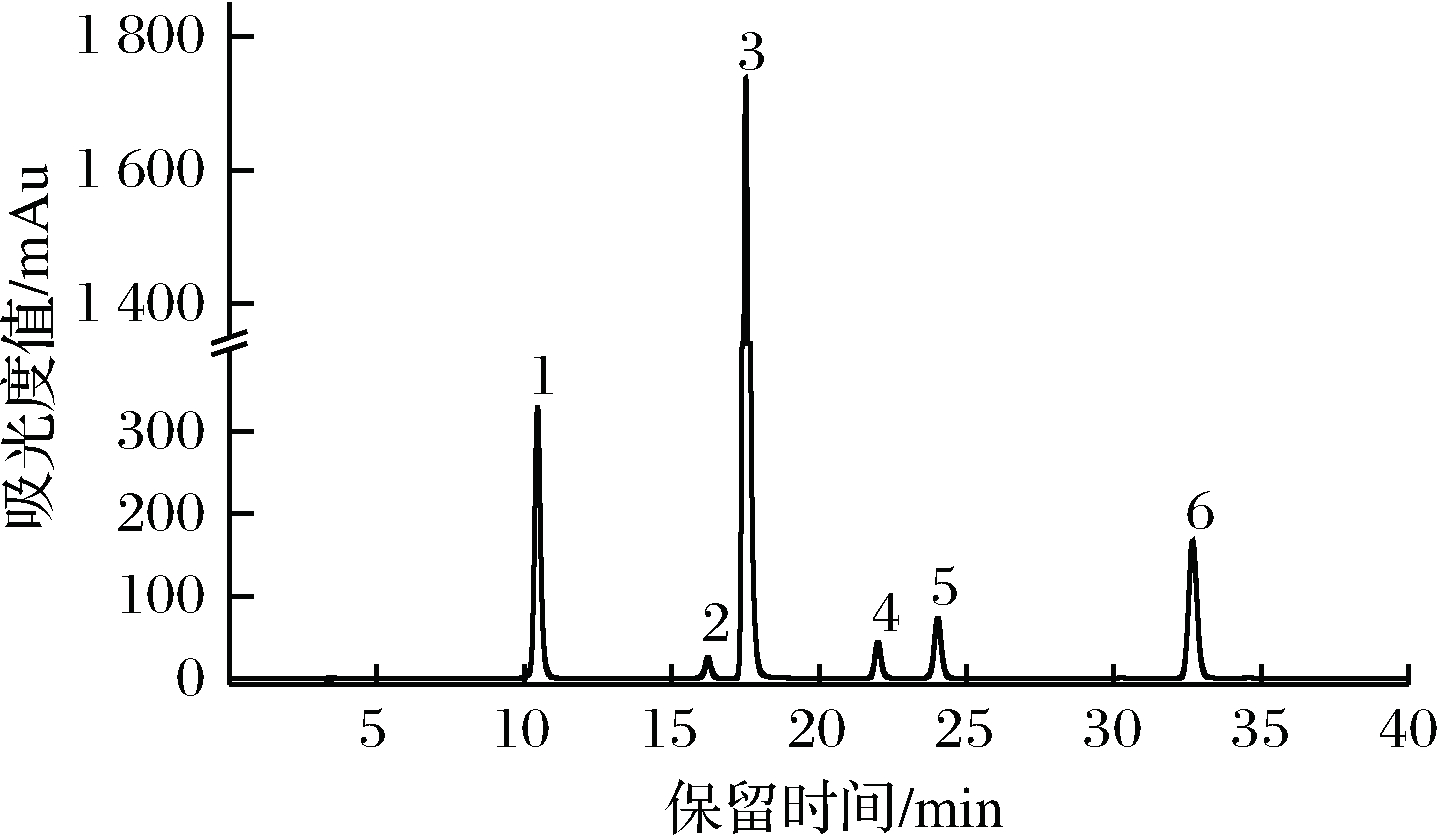
1-可可碱;2-表没食子儿茶素;3-咖啡碱;4-表儿茶素;5-表没食子儿茶素没食子酸酯;6-表儿茶素没食子酸酯
图1 六种混合对照品的HPLC色谱图
Fig.1 HPLC chromatogram of 6 mixed reference substances
2.2 线性关系、检出限和定量限
分别取“1.3.5”项下不同浓度的混合标准溶液1 mL,经0.45 μm微孔滤头过滤,按照“1.3.1”项下色谱条件注入高效液相色谱仪中,重复进样5次,记录色谱峰面积。以峰面积S对浓度C作图,绘制标准曲线并进行回归计算,具体结果见表2。测定仪器信噪比(S/N),当标准溶液稀释至信噪比3<S/N<10时,以该溶液浓度计算仪器检出限(LOD,S/N=3)在0.312 5~1.870 μg/mL,定量限(LOQ,S/N=10) 在1.038~6.240 μg/mL。6种标准样品的线性范围、回归方程、相关系数、检出限和定量限如表2 所示,6种标准样品质量浓度与峰面积呈现良好的线性关系,R2值在0.995 5以上。
表2 六种不同浓度混合标准品的线性关系、检出限和定量限
Table 2 The linear relativity,LOD and LOQ of six mixed standard substances with different concentrations
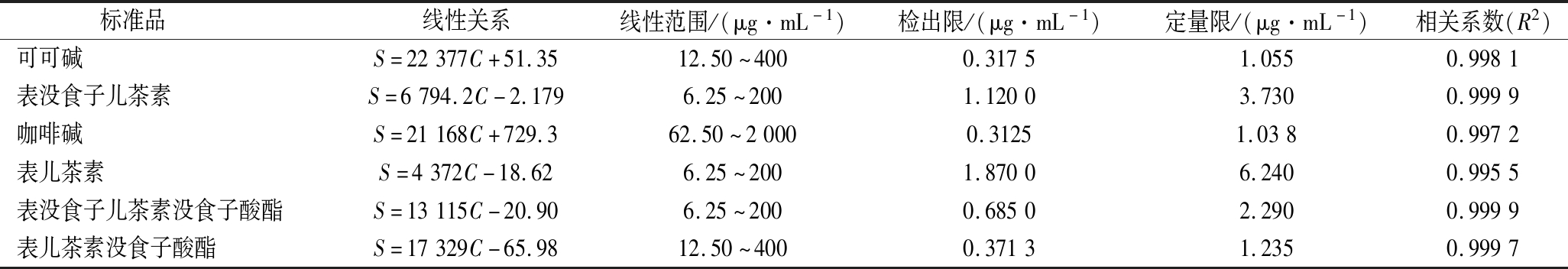
标准品 线性关系线性范围/(μg·mL-1)检出限/(μg·mL-1)定量限/(μg·mL-1)相关系数(R2)可可碱S=22377C+51.3512.50~4000.31751.0550.9981表没食子儿茶素S=6794.2C-2.1796.25~2001.12003.7300.9999咖啡碱S=21168C+729.362.50~20000.31251.0380.9972表儿茶素S=4372C-18.626.25~2001.87006.2400.9955表没食子儿茶素没食子酸酯S=13115C-20.906.25~2000.68502.2900.9999表儿茶素没食子酸酯S=17329C-65.9812.50~4000.37131.2350.9997
2.3 重复性试验
分别吸取“1.3.4”项中绿茶和发酵菌茶提取液各5份,经0.45 μm微孔水系滤头过滤,按照 “1.3.1”项下色谱条件进行测定,记录色谱图峰面积,带入“2.2”项下线性方程并计算。绿茶样品中6种活性成分(可可碱、表没食子儿茶素、咖啡碱、表儿茶素、表没食子儿茶素没食子酸酯、表儿茶素没食子酸酯)的RSD依次为2.92%、5.13%、3.05%、4.03%、2.47%、4.54%。发酵菌茶样品中6种活性成分的RSD依次为3.29%、2.61%、3.13%、5.19%、2.78%、4.17%,表明该方法重复性良好。
2.4 稳定性试验
分别吸取“1.3.4”项中同一绿茶和发酵菌茶提取液,经0.45 μm微孔水系滤头过滤,按照“1.3.1”项下色谱条件分别在0、 3、 6、 9、 12、 15 h进行测定,记录色谱峰面积,计算绿茶样品中6种活性成分(可可碱、表没食子儿茶素、咖啡碱、表儿茶素、表没食子儿茶素没食子酸酯、表儿茶素没食子酸酯)的RSD依次为0.25%、1.07%、0.04%、0.24%、1.04%、1.14%。发酵菌茶样品中6种活性成分的RSD依次为0.46%、4.37%、0.30%、5.19%、1.75%、0.43%。结果表明,绿茶和发酵菌茶提取液在15 h内稳定。
2.5 加样回收率与精密度
分别称取绿茶和发酵菌茶各3份,每份10.0 g,精密称定,分别加入加标水平为20、 40、 80 μg/g 3个浓度水平的混合标准品溶液,按照1.3.4项样品前处理步骤对加标绿茶和发酵茶样品进行处理,得加标绿茶和发酵菌茶提取液进行加标回收率实验,结果如表3和表4所示,绿茶提取液中可可碱、表没食子儿茶素、咖啡碱、表儿茶素、表没食子儿茶素没食子酸酯、表儿茶素没食子酸酯的加标回收率均≥95.06%,6种有效成分回收率RSD均≤0.86%;发酵菌茶提取液中上述6种有效成分加标回收率分别≥85.06%,6种有效成分回收率RSD均≤4.23%。
表3 绿茶加标回收试验结果(n=6)
Table 3 Results of recovery tests of green tea
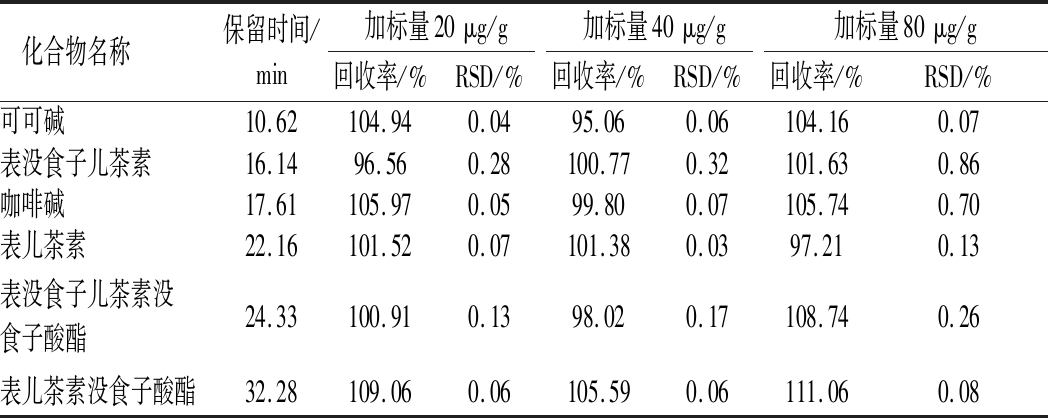
化合物名称 保留时间/min加标量20μg/g加标量40μg/g加标量80μg/g回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%可可碱10.62104.940.0495.060.06104.160.07表没食子儿茶素16.1496.560.28100.770.32101.630.86咖啡碱17.61105.970.0599.800.07105.740.70表儿茶素22.16101.520.07101.380.0397.210.13表没食子儿茶素没食子酸酯24.33100.910.1398.020.17108.740.26表儿茶素没食子酸酯32.28109.060.06105.590.06111.060.08
表4 白参菌茶加标回收试验结果(n=6)
Table 4 Results of recovery testsof Schizophyllum communeh fermented tea

化合物名称 保留时间/min加标量20μg/g加标量40μg/g加标量80μg/g回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%可可碱10.62118.880.45112.390.05102.050.10表没食子儿茶素16.14105.610.67102.071.8686.703.28咖啡碱17.61114.570.05106.160.06100.520.07表儿茶素22.1686.021.75102.800.6793.080.95表没食子儿茶素没食子酸酯24.3394.041.5793.001.1390.550.75表儿茶素没食子酸酯32.28102.034.2395.253.0185.060.80
2.6 绿茶和发酵茶样品测定
分别称取绿茶和发酵菌茶各5份,每份10.0 g,精密称定,按照“1.3.4”项的方法制备供试品溶液,分别吸取按照“1.3.1”项色谱条件进行测定各供试品溶液中6种有效成分含量,比较发酵前后各有效成分含量的变化,结果如图2所示,绿茶与白参菌共发酵后,茶叶中可可碱和咖啡碱的含量几乎没有变化,但表没食子儿茶素含量降低了0.46%,表儿茶素含量降低了1.82%,表没食子儿茶素没食子酸酯含量降低了2.81%,表儿茶素没食子酸酯含量降低了2.78%,RSD值为0.08%~3.39%。性状上,绿茶提取液颜色较浅,而发酵后提取液颜色较深,呈棕黄色,苦涩感降低,口感更佳。
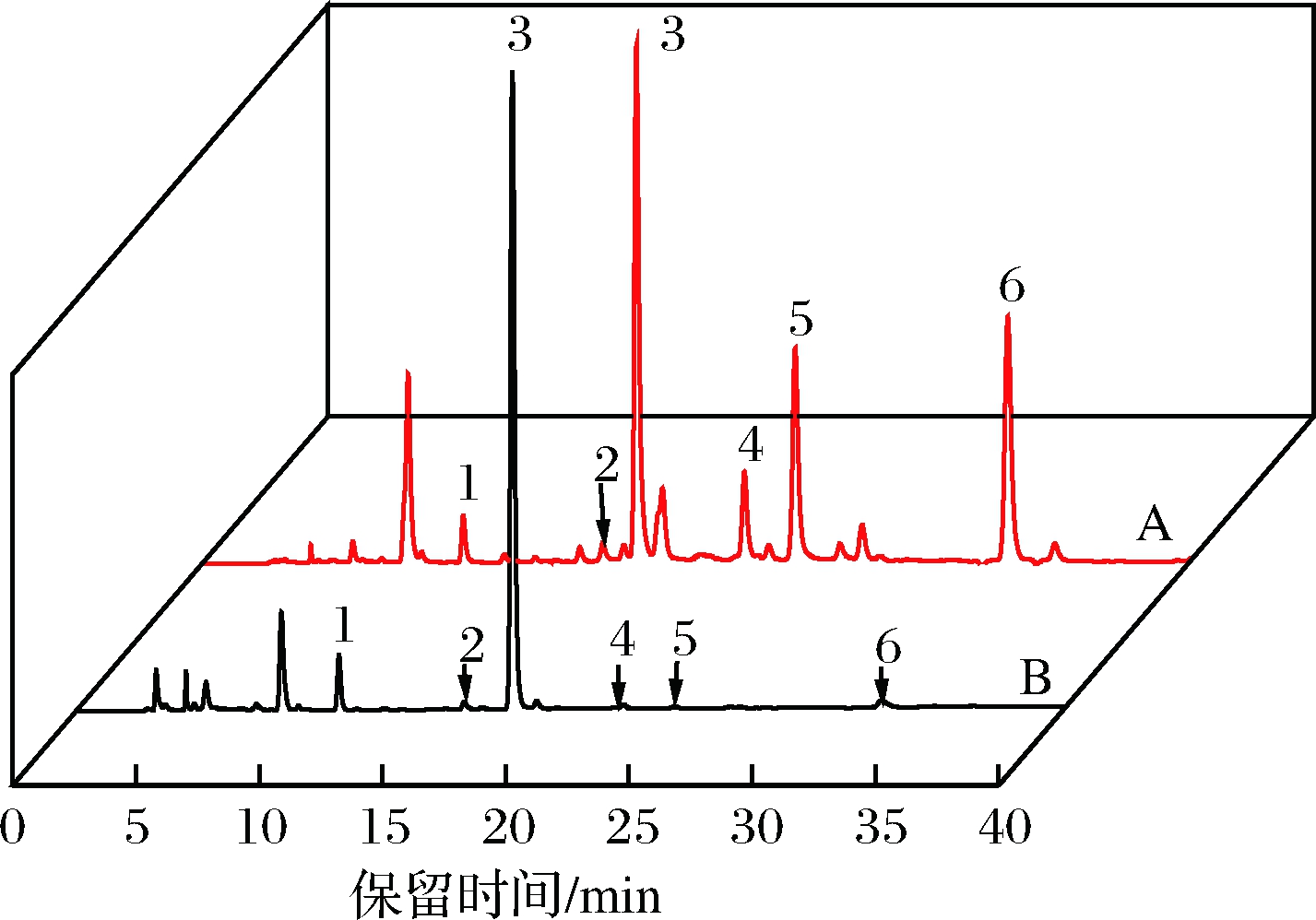
1-可可碱;2-表没食子儿茶素;3- 咖啡碱;4-表儿茶素;5-表没食子儿茶素没食子酸酯;6-表儿茶素没食子酸酯
图2 高效液相色谱图绿茶和白参菌茶
Fig.2 HPLC chromatograms of green tea and Schizophyllum communeh fermented tea
3 结论
本研究建立了同时检测茶叶发酵前后6种活性成分含量变化的高效液相色谱方法。6种活性成分质量浓度在6.25~2 000 μg/mL下线性关系良好,相关系数R2在0.995 5~0.999 9,检出限在0.312 5~1.870 μg/mL。本方法快速、准确、灵敏度高,能够满足茶叶中多种活性成分的定性、定量检测需求。
对白参菌茶发酵前后的活性成分进行测定,结果表明,绿茶与白参菌共发酵后,茶叶中咖啡碱和可可碱含量几乎没有变化,表没食子儿茶素、表儿茶素、表没食子儿茶素没食子酸酯、表儿茶素没食子酸酯的含量均大幅下降,降低比例高达80 %以上,从而改善了粗茶的活性成分,提高茶汤口感,有利于促进兼备茶叶和药食用真菌双重效用的新型保健茶品的开发。
[1] BARBOSA D S. Green tea polyphenolic compounds and human health[J]. Journal für Verbraucherschutz und Lebensmittelsicherheit, 2007, 2(4): 407-413.
[2] 卢明. 茶叶的研究与应用[J].中国社区医师, 2005,7(22):16.
[3] 陈睿. 茶叶功能性成分的化学组成及应用[J]. 安徽农业科学, 2004,32(5):1 031-1 033;1 036.
[4] 宛晓春,李大祥,张正竹,等. 茶叶生物化学研究进展[J]. 茶叶科学, 2015(1):1-10.
[5] 龚智宏,陈思,高江涛,等.半制备型液相色谱法分离纯化茶叶鲜叶中7种儿茶素类化合物[J].色谱, 2017,35(11): 1 192-1 197.
[6] 王向阳,周政子,刘绘景. 茶多酚对萝卜干3种致病菌的抑菌机理研究[J].中国食品学报, 2013,13(8):96-101.
[7] 王丽丽,黄建安,刘仲华. 茶叶降脂功效及其作用机理研究进展[J].中国茶叶, 2011(9):12-15.
[8] LI Qin, LI Yongdi, LUO Yu, et al. Shifts in diversity and function of the bacterial community during the manufacture of Fu brick tea[J]. Food microbiology,2019,80:70-76.
[9] 夏丽飞,陈玫,蔡丽. 白参菌发酵茶品质及安全性研究[J]. 中国农学通报, 2019,35(4):143-146.
[10] WANG Q ![]() B,JURASOVIC J. Evaluation of microbial toxins, trace elements and sensory properties of a high-theabrownins instant Pu-erh tea produced using Aspergillus tubingensis via submerged fermentation[J]. International Journal of Food Science & Technology, 2019, 54(5):1 541-1 549.
B,JURASOVIC J. Evaluation of microbial toxins, trace elements and sensory properties of a high-theabrownins instant Pu-erh tea produced using Aspergillus tubingensis via submerged fermentation[J]. International Journal of Food Science & Technology, 2019, 54(5):1 541-1 549.
[11] 刘佳奇,熊涛,李军波,等.乳酸菌发酵茶饮料的工艺优化及其发酵前后香气成分分析[J].食品与发酵工业,2016,42(8):109-114.
[12] 侯冬岩,刁全平,李铁纯.不同发酵类型的茶叶茶多酚含量的比较分析[J]. 鞍山师范学院学报, 2015,17(6):38-40.
[13] 王峰.超高效液相色谱法(UPLC)快速测定茶饮料中的咖啡因[J].食品与发酵工业,2011,37(11):213-215.
[14] 朱叶梅,张雯,杨少杰,等.HPLC法测定茶叶中的7种多酚类化合物的含量[J].云南化工,2018,45(9):66-68.
[15] 孔谦,陈栋,陈庄,等.柱前衍生-反相高效液相色谱测定茶叶中19种氨基酸含量[J].食品科技,2018,43(10):320-325.
[16] 王富花.HPLC分析测定不同茶叶中的游离氨基酸[J].食品研发与开发,2018,39(1):141-146.
[17] GE Yahui, BIAN Xiong, SUN Baoqing. Dynamic profiling of phenolic acids during Pu-erh tea fermentation using derivatization LC-MS approach[J]. Journal of agricultural and food chemistry, 2019, 67(16): 4 568-4 577.
[18] 王玉娇,刘通,邓亚美,等.QuEChERS-气相色谱-串联质谱法快速检测茶叶中6种禁用香精成分[J].色谱,2019,37(7):766-772.
[19] 李志,焦彦朝,王兴宁.气相色谱-质谱联用法测定茶叶中21种农药残留[J].中国酿造,2019,38(3):181-186.
[20] 邝柏贤,陈曼,周慈敏,等.茶多酚检测方法综述[J]. 广东茶业, 2016(2):14-16.
[21] ZHANG M H, LUYPAERT J,FERN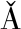 NDEZ P J A, et al. Determination of total antioxidant capacity in green tea by near-infrared spectroscopy and multivariate calibration[J]. Talanta, 2004, 62(1):25-35.
NDEZ P J A, et al. Determination of total antioxidant capacity in green tea by near-infrared spectroscopy and multivariate calibration[J]. Talanta, 2004, 62(1):25-35.
[22] 孙延春,张英.紫外光谱法测定饮料中的咖啡因含量[J]. 化学研究, 2011,22(1):77-79.