结构脂质(structured lipids,SLs),简称结构脂,是指经化学或酶法改变甘油三酯碳链骨架上脂肪酸组成或者位置分布,且具有特定分子结构、特殊功能作用的一类甘油三酯(triglyceride,TAG)。结构脂质在其结构上的差异不仅包含接入甘油三酯骨架上脂肪酸的不同种类,也包含由脂肪酸在甘油骨架上的随机/选择性定位效应(外侧的sn-1和sn-3位,或中间的sn-2位)。由于甘油骨架特定位置上连接了具有特殊营养或生理功能的脂肪酸,所以结构脂质在保留天然油脂的部分或全部性质外,还能够最大程度上发挥各种脂肪酸的功能[1]。有多项研究表明[2],结构脂作为一类新型油脂在体内消化吸收快,能量供应少,兼具有特定的保健营养和生物学功能,已逐步应用于食品、保健品、医药和化妆品等众多行业。美国、日本先后开发出在减肥及脂肪替代等领域商用的结构脂Salatrim(美国纳贝斯克)、Caprenin(美国宝洁)、Salatrim (美国Nabisco)、Olestra(美国宝洁)、diacylglycerol(日本花王)、NovaLipidTM以及Loders Croklaan CrokvitolTM系列产品。在所有结构脂中,长链多不饱和脂肪酸MLM型结构脂被认为是结构脂最理想的结构形式,具有吸收好、功能性强、营养特性显著的优势和特点。本文针对长链多不饱和脂肪酸结构酯的合成方法及产物合成影响因素的最新研究现状进行综述,以期为相关功能性结构脂的制备及结构修饰研究提供参考。
1 结构脂的分类及应用
结构脂并不是甘油三酯经简单掺合形成的混合物,而是将不同脂肪酸以交叉组合的方式与甘油碳链骨架酯化后形成结构多样的甘油三酯。结构脂有两种公认的分类形式,一种是基于脂肪酸碳链长度分类。由于脂肪酸可分为短链脂肪酸(S,少于6个碳原子)、中链脂肪酸(M,6~12个碳原子)和长链脂肪酸(L,多于12个碳原子),因此,基于甘油三酯中sn-1,sn-2及sn-3位置的差异和脂肪酸碳链的长度,结构脂可划分为sn-1-短链-2-中链-3-短链型(SMS)、sn-1-短链-2-长链-3-短链型(SLS)、sn-1-长链-2-中链-3-长链型(LML)、sn-1-中链-2-长链-3-中链型(MLM)、sn-1-中链-2-中链-3-中链型(MMM)、sn-1-中链-2-长链-3-长链型(MLL)等种类多样的结构类型。此外,结构脂还可以基于结构的对称性进行分类:非对称性结构脂和对称性结构脂。其中,对称性结构脂还包括单酸型对称结构脂(2-MAG)和二酸型对称结构脂(1,3-DAG),非对称结构脂包括二酸性非对称结构脂(1,2-DAG)和三酸性非对称结构脂(MLM或MMM等)[3]。有证据表明[4],结构脂的脂肪酸组成及其在甘油碳链骨架上的位置均与天然油脂原料有所不同,这些不同使得结构脂在物理、化学性质上与天然油脂有较为明显的差异,特别是在油脂结晶构型、界面配向性、氧化稳定性和低热值等方面有较大的差异。此外,甘油三酯的3个酰基位还可以连接低聚糖类、聚酯类化合物、淀粉类、生物碱等多种化合物,从而发挥更多理化及生理功能。SUN等[5]用蓖麻油作为咖啡酰基受体,通过酶促酯交换成功制备了一种新型蓖麻油基咖啡酰结构脂,该结构脂质具有较强的生物抗氧化和紫外吸收能力,目前已用于多个食品和化妆品领域用作抗氧化剂和紫外线吸收剂。在营养和医疗领域,结构脂还广泛用于生产模拟母乳的婴儿配方奶粉、塑性脂肪、可可脂替代脂以及低热量脂肪的生产与应用[6]。
2 长链多不饱和脂肪酸结构脂的合成方法
长链多不饱和脂肪酸结构脂可以通过物理调配、化学催化、酶催化等方法改性制得。在这些方法中,物理调配法虽然较为安全,但产物合成率较低,往往无法有效定量得到理想的结构脂。化学催化法虽然能够通过特定的反应合成路线获得目标结构脂,但催化反应是随机的酯交换反应,无特异选择性,且反应产物难控制,不易生产出具有特定结构的重构脂质。此外,化学法反应条件剧烈(>100 ℃)、副反应多,产物得率低且分离困难,生产过程中的化学试剂也容易污染环境[7]。与化学催化法相比,酶催化法是一种较为安全、绿色和可控的有效制备方法,具有反应时间短、条件温和(<70 ℃)、选择性强、高效可控、操作简单、环境友好等优点,可以通过调控反应条件(如时间、温度、底物摩尔比、酶量等)来增加产品的纯度和产量,是结构脂制备的首选方法。SUBAJINY等[8]认为酶法合成结构脂不含反式脂肪酸的优势也是其可以广泛用于食品工业油脂合成的重要原因。目前长链多不饱和脂肪酸结构脂的合成方法主要有3种:酯交换法、酸解法和醇解法。
2.1 酶法制备长链多不饱和脂肪酸结构脂方法
对于天然油脂而言,脂肪酸在甘油酰基位上的分布是随机的。目前学术界主要有3种分布学说,分别是:全随机分布学说、sn-1-随机-sn-2-随机-sn-3-随机分布学说、sn-1,3-随机-sn-2-随机分布学说。对于天然植物油的甘三酯来说,sn-1,3-随机-sn-2-随机分布学说具有更广泛的普适性。与天然油脂的结构相比,脂肪酶可定向作用于甘油三酯的特殊酰基位置,因此酶法合成结构脂的产物主要由结构脂的制备方法决定。KIM等[9]用两种固定化脂肪酶将二十碳戊烯酸(EPA,eicosatrmacnioc acid)与葵花籽油进行酯化,不仅降低了天然玉米油中三油酸甘油三酯的含量,改性后的甘油三酯还含有更高含量的EPA。PINA-RODRIGUEZ等[10]使用Novozym 435脂肪酶在苋菜油sn-2位置接入了棕榈酸,然后用脂肪酶RM IM在sn-1,3位置接入二十二碳六烯酸(DHA,docosahexaenoic acid),最终将DHA作为目标脂肪酸加入至苋菜油甘油三酯中,改变了原有天然苋菜油的脂肪酸组成。
2.2 基于脂肪酶的长链多不饱和脂肪酸结构脂酯交换法
酯交换法是酰基脂肪酸在TAG内部和TAG之间随机化或定向交换位置的过程。酶促酯交换反应分两步完成,脂肪酶Ser—OH基团亲核进攻酰基碳,形成酰基-酶共价复合物后导致脂肪酸和甘油骨架碳链之间的键发生断裂,待释放后的脂肪酸与游离脂肪酸混合后,再随机或定向接入至甘油骨架“空白”的位置形成新的甘油三酯。TEICHERT等[11]通过Novozym 435脂肪酶催化三棕榈酸甘油酯(PPP)与硬脂酸大豆油酯交换反应合成sn-2位棕榈酸结构甘油三酯,在反应时间18 h,反应温度65 ℃,底物摩尔比1∶2条件下得到了含量为60.63%的sn-2位棕榈酸酯。NAGACHINTA等[12]则通过Lpozyme TL IM脂肪酶催化三棕榈甘油酯与二十二碳六烯酸、花生四烯酸(AA)乙酯乙酸进行酯交换合成含有sn-2位富含棕榈酸与不饱和脂肪酸的结构脂质,其sn-2位棕榈酸含量可高达40%以上。在脂肪酶作用的酯交换反应中,当原料油脂与目标产物均为甘油三酯时,目标产物分离较为困难且无法通过分离副产物的方式使反应平衡向目标产物方向移动。因此,针对不同的原料脂肪酸差异化的选择定向脂肪酶是降低副产物、提高最终产物合成率的关键因素之一(图1)。

图1 酯交换法制备结构脂反应示意图
Fig.1 Schematic diagram of structural lipid reaction prepared by transesterificatio
2.3 基于脂肪酶的长链多不饱和脂肪酸结构脂酸解法
与酯交换法类似,结构脂的脂肪酶酸解反应也需要两步完成:水解与酯化。首先TAG在酶作用下水解生成游离脂肪酸和DAG(或MAG),在脂肪酶的作用下新的游离脂肪酸再与DAG(或MAG)酯化合成TAG。对于酸解反应而言,要制备sn-2长链多不饱和脂肪酸TAG,游离脂肪酸最好来源于单一长链多不饱和脂肪酸,在此条件下得到的目标TAG含量才会比较高。TEICHERT等[13]通过脂肪酶催化sn-2位含棕榈酸的单硬脂酸大豆油结构脂与DHA和α-亚麻酸(ALA)酸解反应制成含PUFA的结构脂,其sn-2位棕榈酸含量均能够达到54%以上。酸解反应常被用于在非水介质中由sn-1,3-特异性脂肪酶催化合成sn-2长链多不饱和脂肪酸结构脂,其优势在于能够更简单地预测反应产物的组成[14]。但是,在无溶剂系统中使用热稳定性较好的脂肪酶可以有效降低最终产品中脂肪酶纯化和回收,因此,基于脂肪酶的酸解反应通常需要增加中长链多不饱和脂肪酸的含量来提高结构脂的合成率。
在酸解法制备多不饱和脂肪酸TAG过程中,辛酸和癸酸常被用作sn-1,3位置的酰基供体积。YANG等[15]利用脂肪酶对金枪鱼油和辛酸进行酸解,得到的MLM型结构脂类反应产物中sn-1,3位的辛酸占比为22.50%,sn-2位点DHA+EPA的含量则与生金枪鱼油相似。该研究表明制备sn-2长链多不饱和脂肪酸TAG的供体最好以富含长链多不饱和脂肪酸的动植物油为供体进行酯基化反应为宜。除了酰基供体以外,在水解过程中影响酸解反应的主要因素还包括特异性脂肪酶和底物的摩尔比,适量増加脂肪酸和选择适当的脂肪酶均可提高结构脂的产量。WEI等[16]在有溶剂条件下使用sn-1,sn-3特异性脂肪酶催化油酸与PPP生成sn-2位棕榈酸甘油酯,并研究了酶添加量和底物摩尔比对酸解反应的影响,结果显示,结构脂质在无溶剂和有溶剂情况下得到的产率分别为40.23%和32.34%,其中sn-2位棕榈酸酯的含量分别高达86.62%、92.92%。由于酸解法中的甘油三酯可根据需要直接采用各种油脂,由于原料来源广泛,所以生产成本相对较低,产物中过量的游离脂肪酸可采用蒸馏的方法从混合物中简便的分离出去。因此,工业化生产选择性结构脂质生产大多采用酸解法。
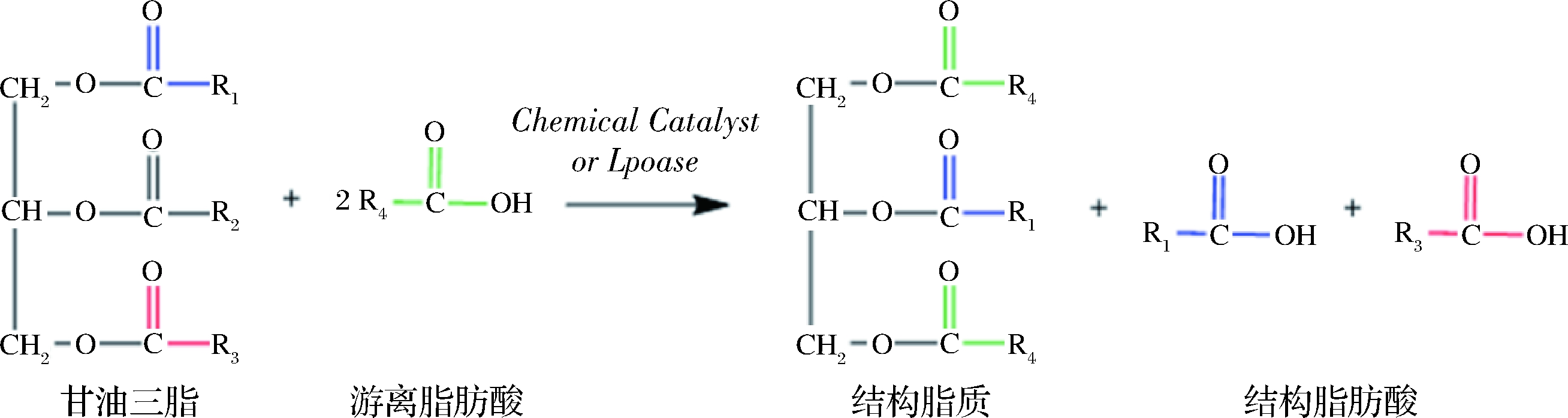
图2 酶促酸解法制备结构脂反应示意图
Fig.2 Schematic diagram of enzymatic hydrolysis reaction
2.4 基于脂肪酶的长链多不饱和脂肪酸结构脂醇解法
酶催化醇解合成多不饱和脂肪酸TAG通常采用两步法:首先是富含PUFA的油脂或三多不饱和脂肪酸甘油酯(如DHA甘油三酯)与乙醇在sn-1,3特异性脂肪酶作用下催化醇解反应生成sn-2单甘酯(2-MAG);其次是游离脂肪酸与2-MAG在脂肪酶的催化下进行酯化得到长链多不饱和脂肪酸TAG。SCHMID等[17]通过sn-1,3位特异脂肪酶催化醇解法制备sn-2位棕榈酸甘油酯,第一步将PPP醇解得到MPG,使用低温溶剂结晶法分离MPG,其纯度超过95%且得率达85%;第二步在相同酶催化作用下使油酸与MPG进行酯化反应制得sn-2位棕榈酸甘油酯,其含量高达96%。PFEFFER等[18]也采用相同的方法合成sn-2位棕榈酸甘油酯,第一步得到的2-MPG纯度为77%且产率为73%,第二步制得sn-2位棕榈酸含量达95%。尽管采用醇解法制备的TAG副产物较少且易分离,目标产物sn-2不饱和脂肪酸TAG的纯度和产量也较高,但是醇解反应分两步进行,反应中间环节还需要分离单甘酯,因此酶催化醇解方法的成本较高,并不适用于工业化生产。

图3 酶促醇解法制备结构脂反应示意图
Fig.3 Schematic diagram of enzymatic hydrolysis reaction
尽管如此,与一步催化反应相比,醇解法制备TAG的过程可大大减少酰基转移的发生,在增强反应特异性的同时,还提高了工艺生产率,适合于制备结构复杂、生产成本高的结构脂。一般情况下,在结构脂质合成的过程中甘油酯的酰基容易发生转移,这个过程会产生不必要的甘油酯致使目标产物纯度下降。即使采用sn-1,3区域选择性脂肪酶,也会发生酰基迁移现象生成TAG的副产物。因此,酰基迁移必须主要通过控制反应参数(如反应温度、催化剂负载、含水量和溶剂类型)来加以控制。操丽丽等[19]以菜籽油和无水CH3CH2OH为原料,用Lipozyme TL IM固定化脂肪酶催化制备高纯度的2-MAG来获取中长碳链型(MLM)结构脂。在最优化工艺条件下,2-MAG的含量从38.82%上升到90.76%。结果证实醇解法减少了sn-2酰基迁移并提高了工艺生产率。ABED等[20]在无溶剂体系中,用Lipozyme RM IM脂肪酶催化醇解微生物油与辛酸,得到的结构脂质在sn-2位含有49.45%的花生四烯酸,在sn-1,3位含有29.7%辛酸。
表1 长链多不饱和脂肪酸结构脂酶法合成研究底物及合成方法
Table 1 Studies on the Lipase Synthesis of PUFAs for Structured lipids
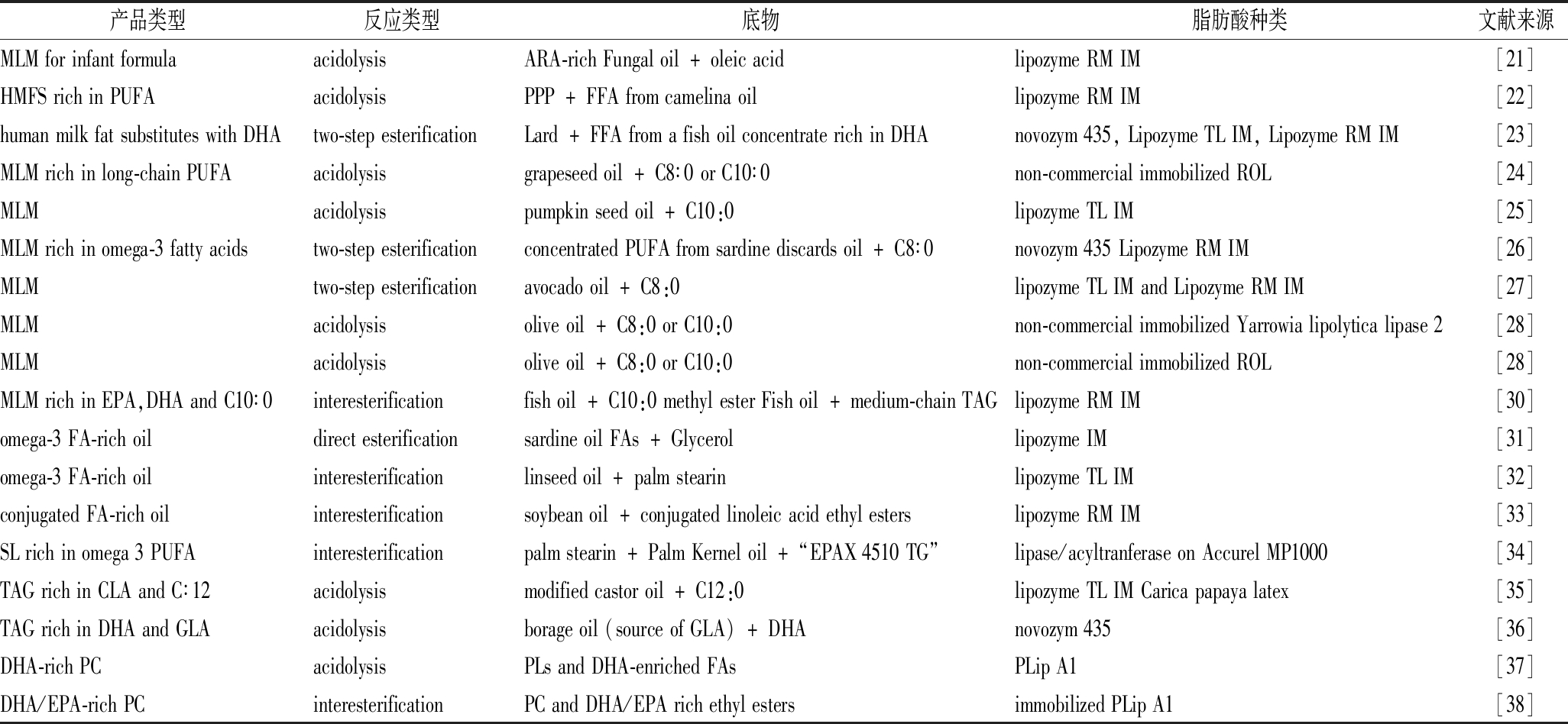
产品类型反应类型底物脂肪酸种类文献来源MLMforinfantformulaacidolysisARA-richFungaloil+oleicacidlipozymeRMIM[21]HMFSrichinPUFAacidolysisPPP+FFAfromcamelinaoillipozymeRMIM[22]humanmilkfatsubstituteswithDHAtwo-stepesterificationLard+FFAfromafishoilconcentraterichinDHAnovozym435,LipozymeTLIM,LipozymeRMIM[23]MLMrichinlong-chainPUFAacidolysisgrapeseedoil+C8∶0orC10∶0non-commercialimmobilizedROL[24]MLMacidolysispumpkinseedoil+C10:0lipozymeTLIM[25]MLMrichinomega-3fattyacidstwo-stepesterificationconcentratedPUFAfromsardinediscardsoil+C8∶0novozym435LipozymeRMIM[26]MLMtwo-stepesterificationavocadooil+C8:0lipozymeTLIMandLipozymeRMIM[27]MLMacidolysisoliveoil+C8:0orC10:0non-commercialimmobilizedYarrowialipolyticalipase2[28]MLMacidolysisoliveoil+C8:0orC10:0non-commercialimmobilizedROL[28]MLMrichinEPA,DHAandC10∶0interesterificationfishoil+C10:0methylesterFishoil+medium-chainTAGlipozymeRMIM[30]omega-3FA-richoildirectesterificationsardineoilFAs+GlycerollipozymeIM[31]omega-3FA-richoilinteresterificationlinseedoil+palmstearinlipozymeTLIM[32]conjugatedFA-richoilinteresterificationsoybeanoil+conjugatedlinoleicacidethylesterslipozymeRMIM[33]SLrichinomega3PUFAinteresterificationpalmstearin+PalmKerneloil+“EPAX4510TG”lipase/acyltranferaseonAccurelMP1000[34]TAGrichinCLAandC∶12acidolysismodifiedcastoroil+C12:0lipozymeTLIMCaricapapayalatex[35]TAGrichinDHAandGLAacidolysisborageoil(sourceofGLA)+DHAnovozym435[36]DHA-richPCacidolysisPLsandDHA-enrichedFAsPLipA1[37]DHA/EPA-richPCinteresterificationPCandDHA/EPArichethylestersimmobilizedPLipA1[38]
2.5 基于脂肪酶的长链多不饱和脂肪酸结构脂直接酯化法
直接酯化法是以长碳链脂肪酸、中碳链脂肪酸(酰基供体)和甘油为原料,在合适的温度下,控制好底物相应的摩尔比,在脂肪酶的催化作用下使反应平衡向有利于酯化的方向进行。SNEHAL等研究[39]在异辛烷中用直接酯化法探究了反应时间、脂肪酶的用量、底物摩尔比对合成胆固醇癸二酸单烯酯的影响,结果该实验的平均酯化率与响应面拟合方程酯化率的预估值较吻合,表明直接酯化法工艺反应时间短,合成条件简单,取得了理想的结果。姜洋等[40]在传统的直接酯化法上,改变不同环境介质体系,将辛酸、癸酸和甘油等物料混合,用 Novozyme435 脂肪酶制备中碳链TAG,研究所得的中碳链TAG的产率为 95.1%,酯化率为 98.62%。结果表明,该制备工艺不仅有效提高了脂肪酸的利用率及中碳链TAG的产率,而且所得酯化产物色泽比较浅。由此可见,直接酯化法可一步完成,且反应时间较短,酶反应器利用率高,生成的副产物少,产物纯度高,易分离纯化出产品。但是,直接酯化法在反应过程中的酯化反应均为一次性完成,因此反应过程中需要及时脱水,水量的不断增加会加厚酶分子表面的水膜,会阻碍底物与酶活性部位的结合,致使产率降低。因此,在sn-2位长链结构脂直接酯化法反应中要随时除去水分,以防止逆向水解反应降低结构脂质的产率。
3 酶法合成长链多不饱和脂肪酸结构脂的影响因素
脂肪酶(lipase),又称甘油三酯水解酶,是由以甘露糖为主的亲水糖基部分和以蛋白质为主体的疏水部分组成,其活性中心靠近分子的蛋白质部分。脂肪酶的来源很多,商业用途脂肪酶主要来源于微生物、植物和动物源性。其中,微生物脂肪酶大多属于依赖于由 Ser、His 和 Asp 残基形成的催化三联体的α/β脂解酶,热稳定性好,催化过程中无需辅酶,应用范围较广。尽管脂肪酶用于酶解合成结构脂,并作为生物催化剂用于TAG的水解和酯化,但是在酶法合成结构脂反应中,并不是所有的脂肪酶都具有酰基位置选择性,大多数脂肪酶水解TAG的酰基位置也具有随机性,只有一部分特异性脂肪酶(如sn-1,3脂肪酶)在接近室温和常压条件下才会在甘油三酯的某个酰基位点发挥定点催化作用。
尽管来自微生物源的商业固定化脂肪酶已广泛用于结构脂的制备,但因为其价格昂贵,限制了某些工艺和产品难以工业化生产[41]。相对于化学反应来说,酶法合成结构脂的优点是操作温度较低,热降解最小,且可得到理想的反应产物。尽管如此,受反应条件的制约,还是有诸多因素会影响酶法合成结构脂,这些因素包括:酶的种类、酰基供体种类、反应温度、反应时间、水分活度、酶量及底物比例等[42]。在众多影响因素中,酶的种类对结构脂合成类别尤为重要,是结构脂合成的主要限制性条件之一。因此,脂肪酶的活性、稳定性、重复利用次数、成本和可得到性等因素也决定着酶催化结构脂工业化生产的可行性。
3.1 长链多不饱和脂肪酸结构脂脂肪酶种类及特性
脂肪酶对结构脂位置及酰基种类的特异选择性与脂肪酶来源、脂肪酶结合位点、界面处物理化学状态以及底物结构特征有较大关系。根据反应特异性类型,长链结构脂脂肪酶大致可以分为三类:第一类脂肪酶催化时具有位置或区域选择性,这类脂肪酶会定向专一水解TAG中sn-1和/或sn-3的酰基连接位置,使反应环境中较多的脂肪酸优先连接在TAG的sn-1和/或sn-3位置上。由于空间位阻及催化活性效应,这类脂肪酶对sn-2位酰基连接位点不产生催化连接作用,因此适用于选择sn-1和/或sn-3的酰基合成的TAG。位置专一性由脂肪酶种类和底物浓度所决定。LIN等[43]研究证实,使用sn-1,3特异性脂肪酶催化甘油和sn-2位不饱和脂肪酸含量高的甘三酯的酯交换,可以降低甘油三酯整体的饱和程度,提高不饱和脂肪酸的在甘油三酯的相对含量。第二类脂肪酶由于自身结合位点的局限性,能够有效识别TAG的sn-1和sn-3酰基结合位置,其水解这两类酯键的速度存在较大差异。立体专一性由脂肪酶来源,底物浓度和TAG连接的酰基所决定。HE等[44]分别使用Novozym 435, Lipozyme 435, Lipozyme TL-IM和Lipozyme RM IM四种sn-1,3特异性脂肪酶催化微藻油与PUFA酸解合成出富含PUFA的母乳模拟结构脂,结果表明,尽管4种特异性脂肪酶催化效果存在差异,但其均能够较好实现对sn-1,3酰基位的有效识别。第三类脂肪酶能够有效识别脂肪酸种类。对于不饱和脂肪酸、长碳链脂肪酸、中碳链脂肪酸以及短碳链脂肪酸具有差别化的催化能力。胰脂肪酶对短链脂肪酸具有专一性作用,Lipozyme TL IM则对中长链脂肪酸具有特异选择性。
表2 常用的商业化结构脂固定脂肪酶
Table 2 Common commercial lipid-immobilized lipase

脂肪酶来源固定相参考文献LipozymeRMIMRhizomucormiehei阴离子交换树脂上[45]LipozymeTLIMThermomyceslanuginose二氧化硅颗粒上Novozym435Candidaantarctica的脂肪酶B大孔丙烯酸树脂上[46]Lipozyme435C.antarctica的重组脂肪酶Aspergillusniger固定化脂肪酶PCL卡门柏青霉菌树脂ECR8806[47]
3.2 长链多不饱和脂肪酸结构脂脂肪酶反应温度
脂肪酶是一种活性蛋白质,其催化作用受温度的影响较大,提高温度可以增加酶促反应的速度。大多数sn-2位长链结构脂脂肪酶的最佳温度为30~60 ℃,在此温度范围,脂肪酶活性最强,酶促反应速度最大。当温度每升高10 ℃时反应速度加快一倍左右,温度继续升高后,高温则会破坏脂肪酶分子的二硫键,导致肽键水解、天门冬氨酸和谷氨酰胺残基的脱氨反应,进而降低脂肪酶在反应体系中的稳定性、亲和力和竞争反应优势,最终导致sn-2位长链结构脂脂肪酶失活。一般而言,动物和植物来源脂肪酶通常比胞外微生物来源脂肪酶的热稳定差。在酯交换反应中所用的最佳温度选择主要是考虑对原料性质及反应体系的影响。无溶剂体系中,温度必须保持足够高以保持底物的液体状态,在某些情况下温度必须超过一定温度才能使底物液化,此时热稳定性更强的脂肪酶才能发挥催化作用,因此,有/无溶剂体系是结构脂合成反应选择脂肪酶的重要考量之一。
3.3 长链多不饱和脂肪酸结构脂酶用量及底物组成
一般情况下,催化反应中反应速率与脂肪酶浓度成正比关系,即酶浓度越高,催化反应速率越快。但这种量效线性关系仅在一定范围内是成立的,反应速率不会由于酶浓度的持续升高而无休止的增加。KADIVAR等[48]研究发现,随着Lipozyme RM IM脂肪酶加入量的增加,油酸在甘油三酯中sn-2位的插入率有显著提高,当脂肪酶添加量超过底物质量的10%时,产物的得率不再发生明显变化。究其原因是由于脂肪酶量的增加会加快反应速度,与此同时油脂副水解反应也会相应加速。随着脂肪酶催化作用的增强,水解作用会逐步减少酶对底物的酶解作用。此外,由于具有特异性脂肪酶的来源途径比较单一,制备成本较高,因此脂肪酶的作用效率与产物的生产成本密切相关,这两者均决定了结构脂在合成过程中对脂肪酶的需求量水平。
尽管底物浓度对酶的活性不产生影响,但底物浓度和底物分子构型却能通过增加底物和酶接触面积从而影响脂肪酶催化酯交换的速率。当底物浓度不断增加,酶促反应速率也会逐渐加快,达到某一值后酶促反应不再随着底物浓度的增加而增加。有研究证实[46],低底物摩尔比较高底物摩尔比需要更长的催化反应时间,后者的反应平衡会更容易向产物生成的方向进行移动,此时酰基与甘油碳链的结合比率也会有所提高。此外,反应过程中间产物(例如水)也会影响脂肪酶对结构脂的催化效果。在脂肪酶催化酯化反应中,反应的本质是酯化和水解反应的结合。随着酯化过程的深入,反应中的水会逐步增加,当水含量过高时,则会诱导脂肪酶对TAG的水解反应,为了增加酯化反应减少水解,获得高产率的产物,在反应过程中不断地去除水分是很重要的。然而,在系统中保持一定的水分是很重要的,因为脂肪酶在非共价反应中的动力学行为需要水来维持。另一方面,有水存在的环境会阻碍脂肪酶的整体构象移动从而限制脂肪酶催化作用的发挥。因此,水解和酯化之间的底物之间的平衡关系对脂肪酶发挥催化作用十分关键[49]。
4 结论
相比一步酶法和三步酶法而言,两步酶法是一种形成的副产物相对较少的理想方法,这种方法能够很好地利用sn-1,3特异性脂肪酶酶解天然油脂,生成2-MAG,再通过脂肪酶催化纯化的2-MAG和中链脂肪酸酯化得到纯MLM型结构脂。在天然甘油三酯的所有组成类型中,当长链多不饱和脂肪酸位于sn-2位置时其吸收效果要优于位于sn-1,3位置或随机分布状态。因此,今后有必要开展将DHA、ALA等n-3长链多不饱和脂肪酸通过两步酶法接入甘三酯的sn-2位合成sn-2长链多不饱和脂肪酸结构脂的相关研究。此外,由于脂肪酶醇解法获得的TAG副产物较少且易分离,目标产物不饱和脂肪酸TAG的纯度和产量也较高,因此是未来长链多不饱和脂肪酸结构脂合成路线中极具潜力的绿色高效方法。
[1] KORMA S A, ZOU X, ALI A H, et al. Preparation of structured lipids enriched with medium- and long-chain triacylglycerols by enzymatic interesterification for infant formula[J]. Food and Bioproducts Processing, 2018, 107:121-130.
[2] LU J, JIN Q, WANG X, et al. Preparation of medium and long chain triacylglycerols by lipase-catalyzed interesteri?cation in a solvent-free system[J]. Process Biochemistry, 2017, 54: 89-95.
[3] LIN M T, YEH S L, YEH C L, et al. Parenteral N-3 fatty acids modulate inflammatory and immune response in rats undergoing total gastrectomy[J]. Shock, 2006, 25(1):56-60.
[4] ZHANG H, ZHAO H, ZHANG Y, et al. Characterization of positional distribution of fatty acids and triacylglycerol molecular compositions of marine fish oils rich in omega-3 polyunsaturated fatty acids[J]. BioMed Research International, 2018, 10:1 432-1 439.
[5] SUN S, WANG P, ZHU S. Enzymatic incorporation of caffeoyl into castor oil to prepare the novel castor oil-based caffeoyl structured lipids[J]. Journal of Biotechnology, 2017, 249:66-72.
[6] ZIA K M, ZIA F,AL I M. Lipid functionalized biopolymers: A review[J]. International Journal of Biological Macromolecules, 2016, 93:1 057-1 068.
[7] KADHUM A A H, SHAMMA M N. Edible lipids modification processes: A review[J]. Critical Reviews in Food Technology, 2017, 57(1):48-58.
[8] SIVAKANTHAN S,JAYASOORYA A P,MADHJITH T. Optimization of the production of structured lipid by enzymatic interesterification from coconut (Cocos nucifera) oil and sesame (Sesamum indicum) oil using response surface methodology[J]. LWT-Food Science and Technology, 2019, 101:723-730.
[9] KIM B H, SANDOCK K D, ROBERTSON T P, et al. Dietary structured lipids and phytosteryl esters: Blood lipids and cardiovascular status in spontaneously hypertensive rats[J]. Lipids, 2008, 43(1):55-64.
[10] M PINA-RODRIGUEZ A M, AKOH C C. Composition and oxidative stability of a structured lipid from amaranth oil in a milk-based infant formula[J]. Journal of Food Science, 2010, 75(2):C140-C146.
[11] TEICHERT S A, AKOH C C. Characterization of stearidonic acid soybean oil enriched with palmitic acid produced by solvent-free enzymatic interesterification[J]. Journal of Agricultural & Food Chemistry, 2011, 59(17):9 588-9 595.
[12] NAGACHINTA S, AKOH C C. Synthesis of structured lipid enriched with omega fatty acids and sn-2 palmitic acid by enzymatic esterification and its incorporation in powdered infant formula[J]. Journal of Agricultural and Food Chemistry, 2013, 61(18):4 455-4 463.
[13] TEICHERT S A, AKOH C C. Modifications of stearidonic acid soybean oil by enzymatic acidolysis for the production of human milk fat analogues[J]. Journal of Agricultural & Food Chemistry, 2011, 59(24):1 300-1 310.
[14]  AHIN-YE
AHIN-YE ILÇUBUK N, AKOH C C. Biotechnological and novel approaches for designing structured lipids intended for infant nutrition[J]. Journal of the American Oil Chemists′ Society, 2017, 94(1):1 005-1 034.
ILÇUBUK N, AKOH C C. Biotechnological and novel approaches for designing structured lipids intended for infant nutrition[J]. Journal of the American Oil Chemists′ Society, 2017, 94(1):1 005-1 034.
[15] LEE K T, FOGLIA T A, OH M J. Lipase-catalyzed synthesis of structured lipids with fatty acids fractionated from saponified chicken fat and menhaden oil[J]. European Joyrnal of Lipid Science and Technology,2001, 103(12):777-782.
[16] WEI W, FENG Y, XI Z, et al. Synthesis of structured lipid 1,3-dioleoyl-2-palmitoylglycerol in both solvent and solvent-free system[J]. LWT-Food Science and Technology, 2015, 60(2):1 187-1 194.
[17] SCHMID U, BORNSCHEUER U T, SOUMANOU M M, et al. Highly selective synthesis of 1,3-oleoyl-2-palmitoylglycerol by lipase catalysis[J]. Biotechnology & Bioengineering, 2015, 64(6):678-684.
[18] PFEFFER J, FREUND A, BEL-RHLID R, et al. Highly efficient enzymatic synthesis of 2-monoacylglycerides and structured lipids and their production on a technical scale[J]. Lipids, 2017, 42(10):947-953.
[19] 操丽丽, 姜绍通, 寿佳菲, 等. 两步酶法合成MLM型结构脂质中醇解反应的研究[J]. 食品科学, 2012, 33(20):65-68.
[20] ABED S M, WEI W, ALI A H, et al. Synthesis of structured lipids enriched with medium-chain fatty acids via solvent-free acidolysis of microbial oil catalyzed by Rhizomucor miehei lipase[J]. LWT-Food Science and Technology, 2018, 93:306-315.
[21] ABED S M, ZOU X, ALI A H, et al. Synthesis of 1,3-dioleoyl-2-arachidonoylglycerol-rich structured lipids by lipase-catalyzed acidolysis of microbial oil from Mortierella alpina[J]. Bioresource Technology, 2017, 243:448-456.
[22] FAUSTINO A R, OS RIO N M, TECEL
RIO N M, TECEL O C, et al. Camelina oil as a source of polyunsaturated fatty acids for the production of human milk fat substitutes catalyzed by a heterologous Rhizopus oryzae lipase[J]. European Journal of Lipid Science and Technology, 2016, 118(4):532-544.
O C, et al. Camelina oil as a source of polyunsaturated fatty acids for the production of human milk fat substitutes catalyzed by a heterologous Rhizopus oryzae lipase[J]. European Journal of Lipid Science and Technology, 2016, 118(4):532-544.
[23] SIM E T, VALERO F, TECEL O C, et al. Production of human milk fat substitutes catalyzed by a heterologous rhizopusoryzae lipase and commercial lipases[J]. Journal of the American Oil Chemists Society, 2014, 91(3):411-419.
[24] COSTA C M, OS RIO N M, CANET A, et al. Production of MLM type structured lipids from grapeseed oil catalyzed by non-commercial lipases[J]. European Journal of Lipid Science and Technology, 2017, 120(1):170-172.
RIO N M, CANET A, et al. Production of MLM type structured lipids from grapeseed oil catalyzed by non-commercial lipases[J]. European Journal of Lipid Science and Technology, 2017, 120(1):170-172.
[25] SOUSA V, CAMPOS V, NUNES P, et al. Incorporation of capric acid in pumpkin seed oil by sn-1,3 regioselective lipase-catalyzed acidolysis[J]. Oils & Fats Crops and Lipids, 2018, 25(3):A302-A305.
[26] MORALES-MEDINA R, MUNIO M, GUADIX A, et al. Development of an up-grading process to produce MLM structured lipids from sardine discards[J]. Food Chemistry, 2017, 228:634-642.
[27] CABALLERO E, SOTO C, OLIVARES A, et al. Potential use of avocado oil on structured lipids mlm-type production catalysed by commercial immobilised lipases[J]. Plos one, 2014, 23, 9(9):e107 749.
[28] CASAS-GODOY L, MARTY A, SANDOVAL G, et al. Optimization of medium chain length fatty acid incorporation into olive oil catalyzed by immobilized Lip2 from Yarrowia lipolytica[J]. Biochemical Engineering Journal, 2013, 77:20-27.
[29] NUNES P A, PIRES-CABRAL P, GUILL N M, et al. Batch operational stability of immobilized heterologous Rhizopus oryzae lipase during acidolysis of virgin olive oil with medium-chain fatty acids[J]. Biochemical Engineering Journal, 2012, 67(15):265-268.
N M, et al. Batch operational stability of immobilized heterologous Rhizopus oryzae lipase during acidolysis of virgin olive oil with medium-chain fatty acids[J]. Biochemical Engineering Journal, 2012, 67(15):265-268.
[30] FELTES M M C, DEOLIVEIRA P L, CORREIA J F G, et al. Incorporation of medium chain fatty acids into fish oil triglycerides by chemical and enzymatic interesterification[J]. Grasasy Aceites, 2009, 60(2):168-176.
[31] BISPO P, BATISTA I, BERNARDINO R J, et al. Preparation of triacylglycerols rich in omega-3 fatty acids from sardine oil using a Rhizomucor mieheiLipase: Focus in the EPA/DHA ratio[J]. Applied Biochemistry and Biotechnology, 2014, 172(4):1 866-1 881.
[32] FARF N M, VILLAL
N M, VILLAL N M J, ORT
N M J, ORT Z M E, et al. The effect of interesterification on the bioavailability of fatty acids in structured lipids[J]. Food Chemistry, 2013, 139(1-4):571-577.
Z M E, et al. The effect of interesterification on the bioavailability of fatty acids in structured lipids[J]. Food Chemistry, 2013, 139(1-4):571-577.
[33] YANG B, WANG W, ZENG F, et al. Production and oxidative stability of a soybean oil containing conjugated linoleic acid produced by lipase catalysis[J]. Journal of Food Biochemistry, 2011, 35(6):1 612-1 618.
[34] OS RION M, DUBREUCQ E, DAFONSECA M M R, et al. Operational stability of immobilised lipase/acyltransferase during interesterification of fat blends[J]. European Journal of Lipid Science and Technology, 2009, 111(4):358-367.
RION M, DUBREUCQ E, DAFONSECA M M R, et al. Operational stability of immobilised lipase/acyltransferase during interesterification of fat blends[J]. European Journal of Lipid Science and Technology, 2009, 111(4):358-367.
[35] VILLENEUVE P, BAROUH N, BAR A B. et al. Chemoenzymatic synthesis of structured triacylglycerols with conjugated linoleic acids (CLA) in central position[J]. Food Chemistry, 2007, 100(4):1 443-1 452.
A B. et al. Chemoenzymatic synthesis of structured triacylglycerols with conjugated linoleic acids (CLA) in central position[J]. Food Chemistry, 2007, 100(4):1 443-1 452.
[36] SENANAYAKE S P I N, SHAHIDI F. Structured lipids via lipase-catalyzed incorporation of eicosapentaenoic acid into borage (Borago officinalis L.) and evening primrose (Oenothera biennis L.) oils[J]. Journal of Agricultural and Food Chemistry, 2002, 50(3):477-483.
[37] CHEN W, GUO W, GAO F, et al. Phospholipase A1-catalysed synthesis of docosahexaenoic acid-enriched phosphatidylcholine in reverse micelles system[J]. Applied Biochemistry and Biotechnology, 2017, 182(3):1 037-1 052.
[38] LI D, QIN X, WANG W, et al. Synthesis of DHA/EPA-rich phosphatidylcholine by immobilized phospholipase A1: Effect of water addition and vacuum condition[J]. Bioprocess and Biosystems Engineering, 2016, 39(8):1 305-1 314.
[39] MORE S, GOGATE P WAGHMARE J, et al. Intensified synthesis of structured lipids from oleic acid rich moringa oil in the presence of supercritical CO2[J]. Food and Bioproducts Processing, 2018, 112:843-849.
[40] 姜洋, 李丹, 王彤, 等. 超临界CO2体系下酶法制备中碳链甘三酯的研究[J]. 中国粮油学报, 2017, 32(12):75-80.
[41] FARF N M,
N M,  LVAREZ A, G
LVAREZ A, G RATE A, et al. Comparison of chemical and enzymatic interesterification of fully hydrogenated soybean oil and walnut oil to produce a fat base with adequate nutritional and physical characteristics[J]. Food Technology and Biotechnology, 2015, 53(3):361-366.
RATE A, et al. Comparison of chemical and enzymatic interesterification of fully hydrogenated soybean oil and walnut oil to produce a fat base with adequate nutritional and physical characteristics[J]. Food Technology and Biotechnology, 2015, 53(3):361-366.
[42] KIM B H, AKOH C C. Recent Research Trends on the Enzymatic Synthesis of Structured Lipids[J]. Journal of Food Science, 2015, 80(8):C1 713-C1 724.
[43] LIN T J, CHEN S W, CHANG A C. Enrichment of n-3 PUFA contents on triglycerides of fish oil by lipase-catalyzed trans-esterification under supercritical conditions[J]. Biochemical Engineering Journal, 2006, 29(1-2):27-34.
[44] HE Y, QIU C, GUO Z, et al. Production of new human milk fat substitutes by enzymatic acidolysis of microalgae oils from, Nannochloropsis oculata and Isochrysis galbana[J]. Bioresource Technology, 2017, 238:129-138.
[45] CHEN B, ZHANG H, CHEONG L Z, et al. Enzymatic production of ABA-Type structured lipids containing omega-3 and medium-chain fatty acids: Effects of different acyl donors on the acyl migration rate[J]. Food and Bioprocess Technology, 2012, 5(2):541-547.
[46] PINA-RODRIGUEZ A M, AKOH C C. Composition and oxidative stability of a structured lipid from amaranth oil in a milk-based infant formula[J]. Journal of Food Science, 2010, 75(2):C140-C146.
[47] 刘楠. 固定化脂肪酶PCL的制备及其催化合成α-亚麻酸甘油二酯的应用研究[D]. 广州:华南理工大学, 2018.
[48] KADIVAR S, DE CLERCQ N, DANTHINE S, et al. Crystallization and polymorphic behavior of enzymatically produced sunflower oil based cocoa butter equivalents[J]. European Journal of Lipid Science and Technology, 2016, 118(10):1 521-1 538.
[49] OCHOA-FLORES A A, HERN NDEZ-BECERRA J A, CAVAZOS-GARDU
NDEZ-BECERRA J A, CAVAZOS-GARDU OA, et al. Optimization of the synthesis of structured phosphatidylcholine with medium chain fatty acid[J]. Journal of Oleo Science, 2017, 66(11):1 207-1 215.
OA, et al. Optimization of the synthesis of structured phosphatidylcholine with medium chain fatty acid[J]. Journal of Oleo Science, 2017, 66(11):1 207-1 215.