茶多酚有益于人体健康,具有抗癌、抗氧化、预防心血管疾病、治疗糖尿病和骨质疏松等作用[1-2],茶多酚本身具有苦涩感,人们习惯将茶和牛奶结合,这样既减少了茶的苦涩味,也提高了牛奶的抗氧化和乳化性等功能特性[3]。目前市场上推出越来越多与茶和牛奶相关的产品,主要有奶茶、抹茶冰淇淋、抹茶酸奶、绿茶干酪等。茶多酚对乳制品功能特性的影响与乳制品成分的相互作用密不可分。明确茶多酚对牛奶蛋白结构的影响,可以为乳制品功能特性的分析提供理论指导。本文旨在探讨添加多酚对牛奶蛋白质结构的修饰作用。已有研究表明了儿茶素和模型溶液中纯化牛奶蛋白之间的强相互作用。儿茶素与酪蛋白结合强烈,但与乳清蛋白,即α-乳清蛋白,β-乳球蛋白和牛血清白蛋白相互作用也有报道[4-6]。
早期研究表明茶多酚对蛋白质的修饰是通过分子间形成的氢键、疏水相互作用、离子键和范德华力等非共价键发生作用[7-8]。然而茶多酚与蛋白质相互作用还存在共价键的形式,主要是茶多酚在食品加工过程中酶促或非酶促氧化形成醌,醌作为一种极具高反应性的化合物,可以与其他醌进一步反应生成棕黑色化合物,也与蛋白质中赖氨酸的ε-氨基、半胱氨酸的巯基和色氨酸的吲哚基团形成C—N或C—S共价键[9-10]。在很多情况下,茶多酚-蛋白质的共价和非共价复合物可能同时存在,例如多酚与玉米醇溶蛋白形成的复合物[11]及茶多酚与牛血清白蛋白弱碱性条件下形成可溶性和不溶性的混合物[12]。
茶多酚与牛奶蛋白相互作用受多种因素的影响,乳制品加工过程中,热处理是关键步骤之一,其主要是灭菌,但热处理可能会导致一定程度的蛋白质变性。有研究表明向牛奶中添加茶多酚,能够提高脱脂牛奶的热稳定性[13]。但茶多酚与牛奶蛋白相互作用对牛奶蛋白质在热处理过程中蛋白质结构的影响尚不完全清楚。因此,本研究主要是探讨茶多酚对不同热处理下牛奶蛋白结构变化规律,为乳制品功能特性的分析提供理论依据。
1 材料与方法
1.1 材料与试剂
牛奶,内蒙古伊利乳业公司兰州分公司;茶多酚,酷尔化学试剂有限公司;没食子酸、8-苯胺-1-萘磺酸(ANS)、5,5′-二硫代双(2-硝基苯甲酸),阿拉丁生化科技股份有限公司;EDTA、十二烷基磺酸钠(SDS)、Na2HPO4、NaH2PO4等,天津市化学试剂三厂。
1.2 仪器与设备
高速台式冷冻离心机(TGL-20),长沙湘仪离心机仪器有限公司;荧光分光光度计(Shimadzu RF-540),日本岛津仪器公司; FTIR光谱仪(370),美国Nicolet公司;紫外分光光度计(UV 5500PC),上海元析仪器有限公司;集热式磁力加热搅拌(DF-Ⅱ),器金坛市顺华仪器有限公司。
1.3 试验方法
1.3.1 样品的制备
新鲜的牛奶进行标准化处理后进行15 413.3×g,15 min脱脂,再经0.45 μm的微孔过滤膜过滤以除去剩余的杂质,最后得到牛奶蛋白乳液加入0.02%的叠氮化钠,用0.1 mol/L的HCl和0.1 mol/L的NaOH调pH至6.7。100 mL牛奶蛋白乳液中直接添加0.1、0.2、0.3 g的茶多酚粉末,然后用磁力搅拌器搅拌30 min[14],再分别进行常温25 ℃、65 ℃(30 min)和95 ℃(5 min)水浴加热处理,加热后的溶液立即进行冷却处理,放置4 ℃备用。不加茶多酚的牛奶蛋白乳液进行同样处理作为对照组。
1.3.2 浊度测定
以添加茶多酚前后的牛奶蛋白溶液为样品,分别以添加0.01、0.2、0.3 g/100mL茶多酚的水溶液为参比,所用的样品和参比溶液先进行适当稀释(样品的蛋白质量浓度在5 mg/mL),然后在600 nm波长下采用紫外可见分光光度计测定牛奶蛋白溶液的吸光值,平行测定3次,取平均值,即为浊度[15]。
1.3.3 结合度测定
按照Folin-Ciocalteau方法测定总酚含量和复合到牛奶蛋白中的茶多酚量,首先制备没食子酸的校准标准液,然后将茶多酚-牛奶蛋白复合物以截留分子质量为3 500 Da的再生纤维素膜4 ℃透析12 h,将透析液外的溶液(或没食子酸标准液)取200 μL与7.8 mL蒸馏水和0.5 mL的Folin-Ciocateu试剂混合,静置5 min。然后加入1.5 mL 20%的碳酸钠溶液,摇匀,室温下避光静置2 h,使用分光光度计以蒸馏水做空白测765 nm处的吸光值。形成茶多酚复合物的百分比和每毫克牛奶蛋白结合的茶多酚百分比计算如公式(1)和公式(2)[14]所示:
绑定的茶多酚/%
(1)
绑定茶多酚/牛奶蛋白/%
(2)
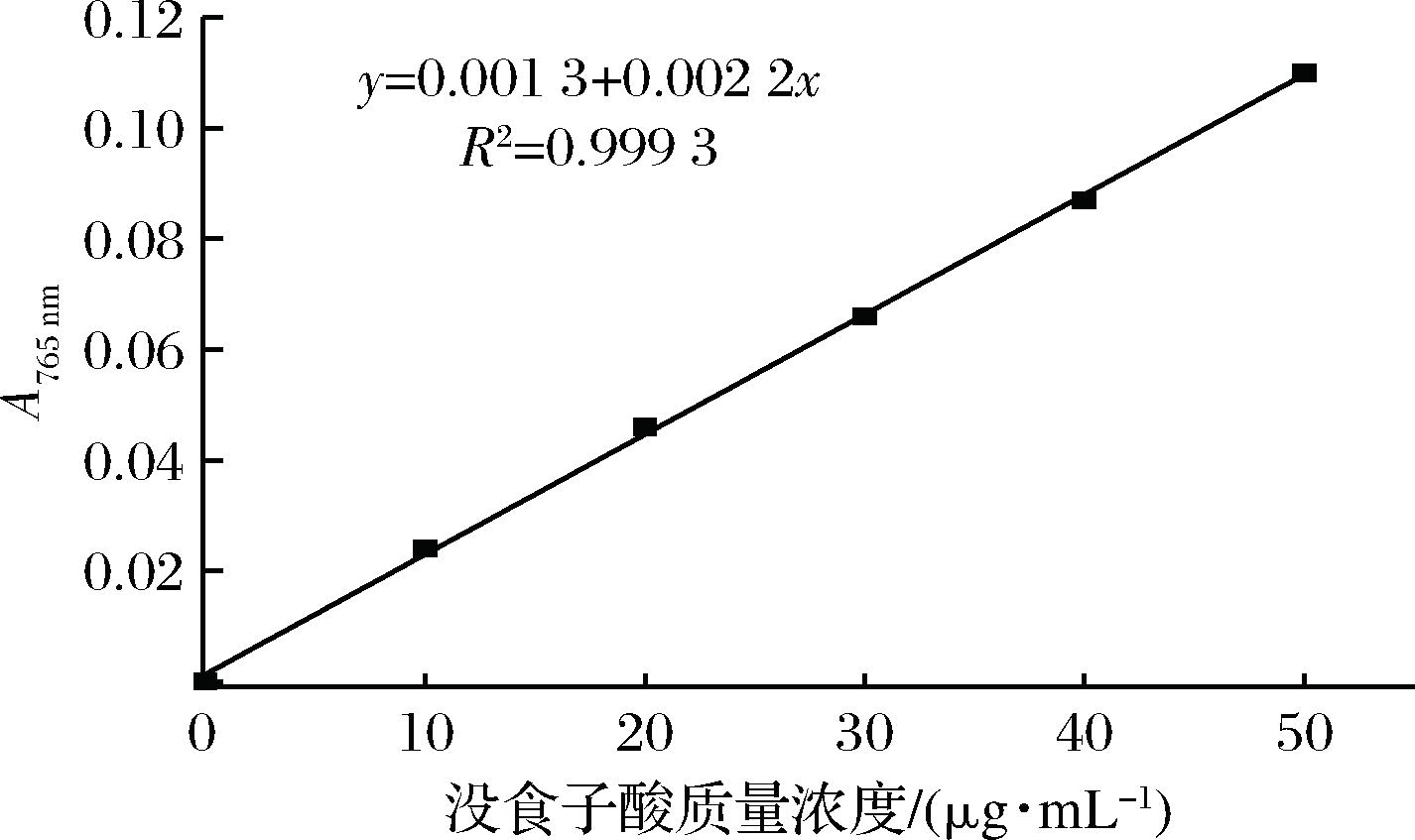
图1 没食子酸标准曲线
Fig.1 Gallic acid standard curve
1.3.4 荧光测定
将牛奶蛋白溶液和茶多酚-牛奶蛋白复合物用PBS (0.01 mol/L,pH 7.0)缓冲溶液制成 2 mg/mL的溶液。采用荧光分光光度计在25 ℃下测定其内源荧光发射光谱,激发波长设定为280 nm,发射光谱采集范围为 290~500 nm,激发波长与发射波长狭缝均为 5.0 nm[16];ANS荧光测定时,取上述溶液8 mL,再加入200 μL浓度为 8.0×10-3 mol/L的 ANS 荧光试剂,振荡,静置3 min。采用荧光分光光度计在室温下测定其荧光发射光谱,激发波长设定为390 nm,发射光谱采集范围为400~650 nm [17]。
1.3.5 傅里叶变换红外光谱
将牛奶蛋白和茶多酚-牛奶蛋白复合物冷冻干燥。通过混合300 mg光谱级KBr与2~3 mg所得样品制备KBr颗粒,并用压机在4 t压力下将混合物压制成13 mm片状固体。用370 FTIR光谱仪从400~4 000 cm-1记录颗粒的光谱[18]。
1.3.6 巯基含量测定
移去牛奶蛋白或茶多酚-牛奶蛋白复合物加入到2.5 mL的Tris-Gly缓冲溶液(含8 mol/L尿素)中,再加入0.02 mL Ellman’s试剂(含5,5′-二硫代双(2-硝基苯甲酸)的Tris-Gly缓冲溶液)静置5 min,在412 nm处测定吸光值,游离巯基含量计算如公式(3)[19]:
游离硫基含量![]()
(3)
式中:A412,412 nm处的吸光值;D,稀释因子,6.04;C,样品浓度。
1.4 统计学分析
实验数据采用Excel软件统计,Origin 64软件作图,最终实验结果应用SPSS 19.0软件中的ANOVA进行显著性分析,以P<0.05具有统计学意义。
2 结果与分析
2.1 牛奶蛋白的主要成分分析
生鲜牛奶是制备其他乳制品的关键原料,牛奶蛋白的主要成分是影响茶多酚与蛋白质相互作用的关键因素。本实验所用的原料乳为荷斯坦牛奶,对其进行标准化,表1是对原料乳进行标准化的结果,所测结果均符合GB19301—2010食品安全国家标准生乳要求。
表1 原料乳的基本成分
Table 1 Comical composition of raw milk
成分蛋白/%脂肪/%灰分/%水分/%荷斯坦牛奶3.03±0.013.57±0.130.52±0.2288.74±0.34
注:表中数据均为平均值±标准差
2.2 浊度
由图2可以看出,在不同热处理下,茶多酚对牛奶蛋白浊度影响趋势不同。25 ℃和65 ℃处理下,牛奶蛋白的浊度随茶多酚质量浓度的增加而降低,而95 ℃时,随茶多酚质量浓度增加,浊度有所增加。茶多酚富含大量活性羟基,能与蛋白质的肽羰基间形成氢键,多酚芳香环能与蛋白质中脯氨酸残基的吡咯烷环之间形成疏水相互作用[7],降低了牛奶蛋白在热处理下的热聚效应,因此降低了蛋白质的浊度。O′CONNELL等[13]研究表明向牛奶中添加茶多酚,能够提高脱脂牛奶的热稳定性和酒精稳定性。95 ℃热处理时,牛奶蛋白中的乳清蛋白高度变性,增强了蛋白质之间的相互作用,这可能是影响蛋白质浊度增加的主要原因。早期研究发现酪蛋白可与茶多酚形成可溶性的复合物,而乳清蛋白的存在似乎影响了茶多酚与酪蛋白的作用;在没有酪蛋白的情况下,乳清蛋白与茶多酚的相互作用形成可溶或不溶的蛋白质-多酚复合物[20]。
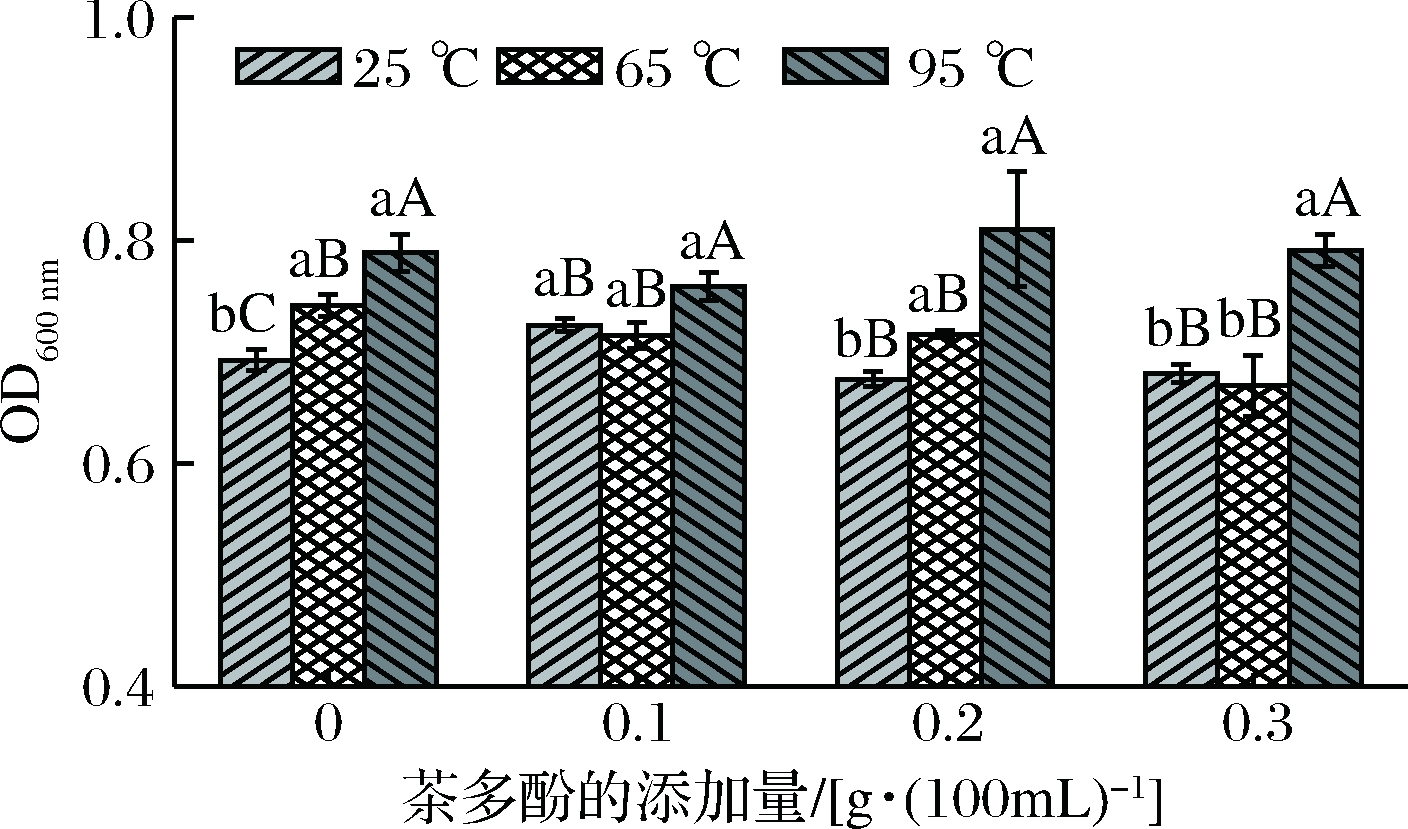
图2 茶多酚-牛奶蛋白复合物的浊度
Fig.2 Turbidity of tea polyphenol-milk protein complexs
注:不同小写字母表示组间差异显著(P<0.05),不同大写字母表示组内差异显著(P<0.05)(下同)
2.3 结合度
茶多酚与牛奶蛋白复合物经过透析后得到与牛奶蛋白未结合的游离茶多酚,通过福林酚法测定游离茶多酚含量,然后再经公式(1)和公式(2)计算结合在牛奶蛋白上的茶多酚和茶多酚/牛奶蛋白的比例。由图3-A可以看出,同一温度不同茶多酚添加量下,与蛋白质结合的茶多酚随茶多酚添加量的增加而呈上升趋势,在65 ℃时,茶多酚结合度明显高于25 ℃和95 ℃处理,这可能归因于65 ℃处理时,乳清蛋白中除去乳球蛋白(β-Lg),其他乳清蛋白单体略有热变性现象[21],而变性的乳清蛋白球状结构会去折叠化变得舒展,表面暴露出更多疏水性基团簇,为茶多酚的结合提供位点,使得茶多酚的结合度提高。
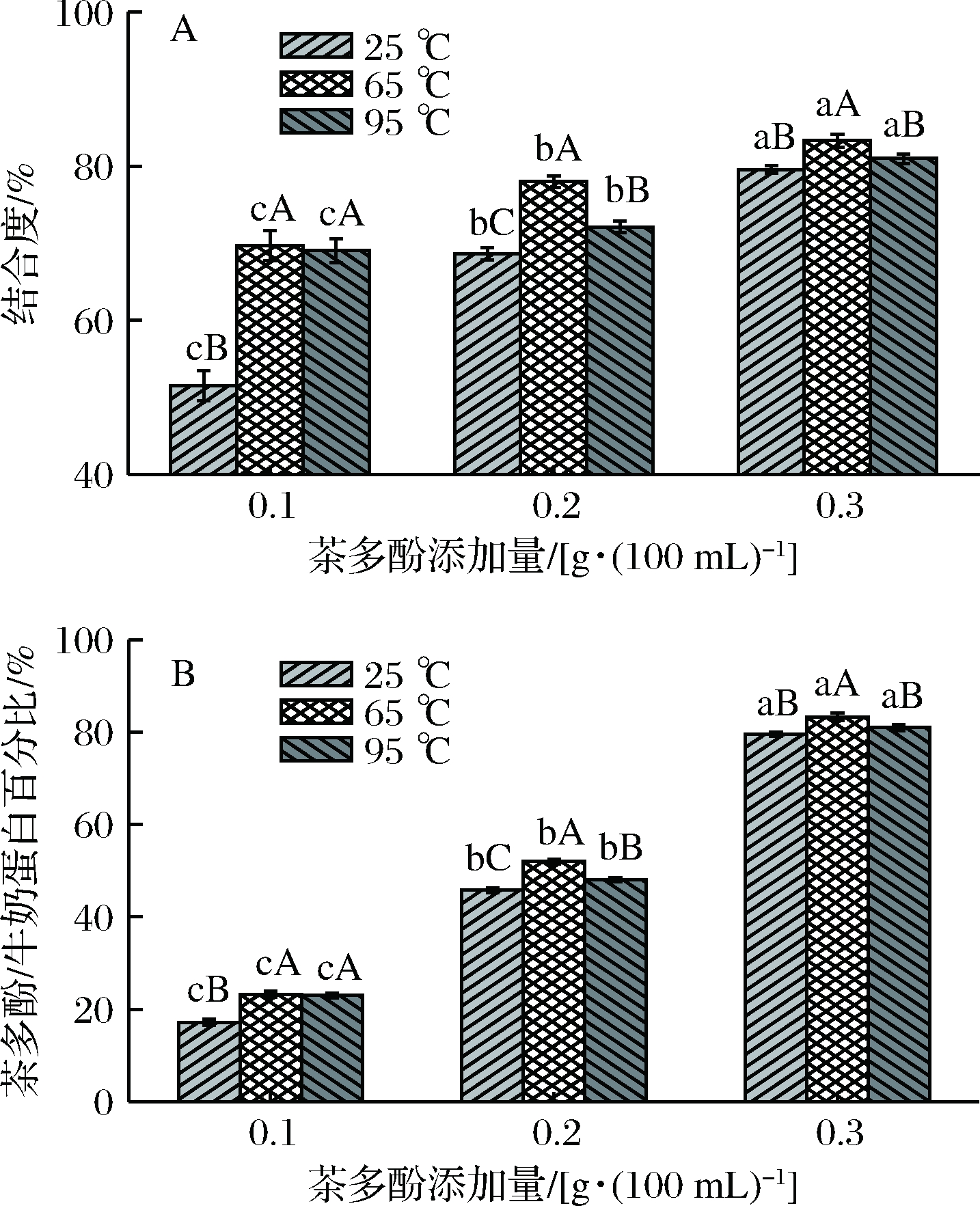
A-茶多酚-牛奶蛋白复合物中茶多酚的结合度图;B-茶多酚/牛奶蛋白的百分比图
图3 茶多酚-牛奶蛋白的结合能力分析图
Fig.3 Binding capacity of tea polyphenol-milk protein complexs
在生鲜脱脂牛奶蛋白中,低浓度的茶多酚主要以结合酪蛋白为主,当茶多酚与酪蛋白结合度达到饱和状态时,牛奶蛋白中剩余的茶多酚会与乳清蛋白结合[1],致使牛奶蛋白质与茶多酚的结合度增加。由图3-B可以看出,随着茶多酚添加量的增加,每毫克牛奶蛋白结合的茶多酚以恒定的增量变化,这与孙红波等[22]对花青素和大豆蛋白相互作用的研究结果类似。茶多酚-牛奶蛋白复合物在65 ℃和95 ℃加热后,茶多酚/蛋白质百分比例高于25 ℃处理,这主要归因于牛奶蛋白中存在的乳清蛋白在热处理后会发生热变性,使得与茶多酚有效结合的蛋白含量增加,茶多酚/蛋白质百分比例升高。当茶多酚添加量为0.2 g/100mL和0.3 g/100mL,95 ℃处理的茶多酚/蛋白质百分比例显著(P<0.05)低于65 ℃处理。牛奶蛋白中的乳清蛋白热敏性极高,研究表明,乳清蛋白发生变性包括2个主要的阶段:一是当温度大于60 ℃时,蛋白质的球状结构发生改变,进而发生变性反应;二是未折叠乳清蛋白与其他乳清蛋白或酪蛋白胶粒结合[23]。因此,95 ℃处理时,茶多酚/蛋白质百分比例的降低可能归因于变性的乳清蛋白与酪蛋白间相互作用增强,使得茶多酚对蛋白质的作用效果减弱。
2.4 蛋白质内源荧光和外源荧光分析
荧光猝灭被认为是测量结合亲和力的有用技术。荧光猝灭是由于猝灭剂分子与大分子化合物相互作用诱导荧光基团的荧光量子产率降低的现象。茶多酚作为一种小分子化合物与牛奶蛋白质结合,导致蛋白质中色氨酸(Trp)基团的荧光强度降低。由图4可知,同一温度处理下,随着茶多酚添加量的增加,荧光强度明显降低。说明Trp微环境发生变化,这可能归结于茶多酚被蛋白质包埋在疏水性区域,茶多酚的芳香族环与蛋白质脯氨酸残基的吡咯烷环之间形成疏水相互作用,酚羟基和羰基之间形成氢键[8]。热处理同样会改变牛奶蛋白的荧光强度,在65 ℃和95 ℃热处理下的牛奶蛋白,荧光强度相对于25 ℃时的略显先升后减的变化,其结果与HE等[24]研究的β-CN热处理的结果相似。由此可见,加热温度从25 ℃上升至65 ℃时,热诱导对牛奶蛋白的结构伸展和亲和性的影响较小,而热处理温度从65 ℃升高至95 ℃时,热诱导对牛奶蛋白结构的影响较大。在茶多酚-牛奶蛋白体系中,所有富含茶多酚的蛋白质样品,其三级结构稳定性都比未添加茶多酚时的强。除此之外,所有样品的Trp最大发射波长均在336~339 nm。研究指出,当 λmax为335~350 nm 时,Trp处于极性较低的微环境中,也就是说它们被包埋于蛋白质内部疏水性较强的区域;λmax为350~353 nm,Trp残基暴露于水中,微环境亲水性增强[25]。因此,可以看出,在茶多酚存在的情况下,对牛奶蛋白进行热处理Trp仍处于疏水性环境中,表明蛋白质内部结构完好,说明茶多酚对牛奶蛋白的修饰只是在疏水性环境中改变Trp微环境并没有破坏蛋白质的三级结构。
图5显示了牛奶蛋白的ANS探针荧光发射光谱。由图5可以看出牛奶蛋白胶束的ANS荧光强度随着茶多酚添加量的增加而降低,这与蛋白质内源荧光的测定结果相似。ANS作为荧光探针监测蛋白结构的变化其主要原因是其带有负电荷的—SO3,可以与牛奶蛋白疏水性区域表面肽段阳离子氨基酸残基结合,如赖氨酸(Lys)、精氨酸(Arg)、组氨酸(His)[25]。ANS的荧光强度取决于这些氨基酸残基所处微环境的极性。茶多酚与牛奶蛋白相互作用会产生几种作用力,其中之一是离子键,茶多酚带负电荷的酚羟基与Lys 的ε-氨基残基正负电荷相互作用,而这种相互作用可能会影响ANS结合在牛奶蛋白胶束上,所以才会导致ANS的荧光强度降低[26]。
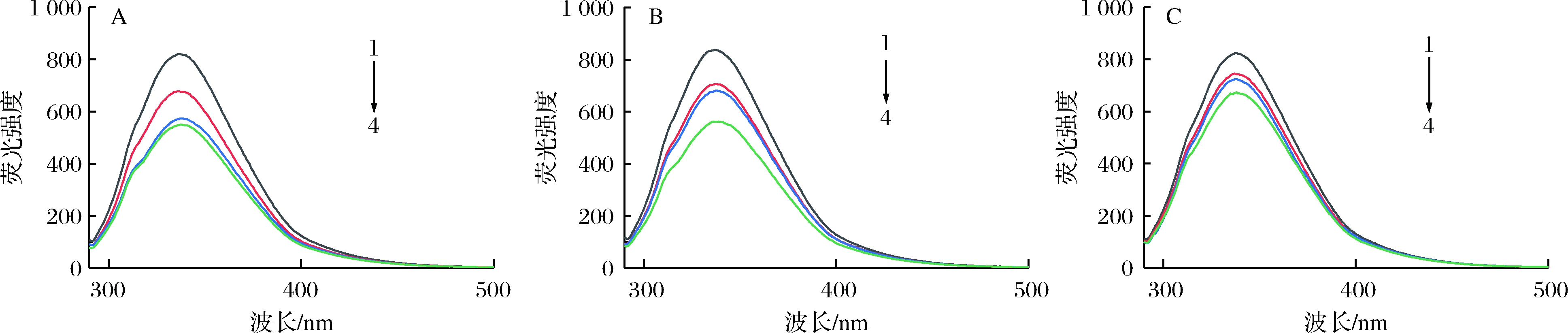
A-25 ℃;B-65 ℃;C-95℃;数字1~4分别表示茶多酚添加量为0、0.1、0.2和0.3 g/100mL
图4 茶多酚-牛奶蛋白内源荧光发射光谱
Fig.4 Endogenous fluorescence emission spectra of tea polyphenol-milk protein complexs
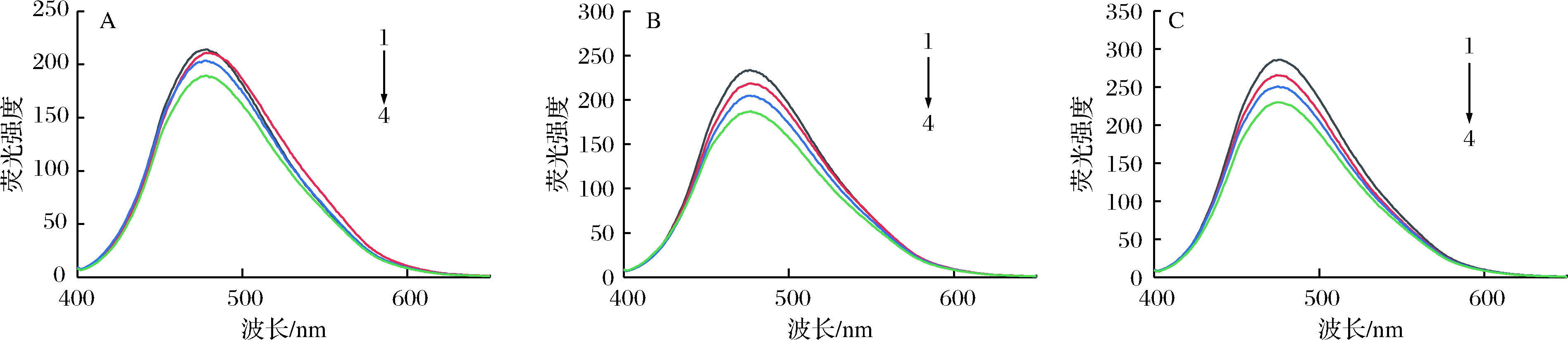
A-25 ℃;B-65 ℃;C-95℃;数字1~4分别表示茶多酚添加量为0、0.1、0.2和0.3 g/100mL
图5 茶多酚-牛奶蛋白外源ANS荧光发射光谱
Fig.5 Fluorescence emission spectra of ANS in tea polyphenol-milk protein complexs
由图4和图5可以看出,蛋白质内源和ANS外源荧光强度都随茶多酚浓度的增加而降低,说明蛋白质表面疏水性降低,蛋白质疏水性基团内卷,使得蛋白质三级结构更稳定,这可能是由于茶多酚与牛奶蛋白通过分子间相互作用(如氢键)收紧蛋白质结构所致。HASNI等[27]研究认为茶多酚与酪蛋白单体(即α-CN和β-CN)之间的相互作用似乎也使得色氨酸包埋在更疏水的环境中。
2.5 蛋白质二级结构分析
采用Peak Fit软件处理酰胺I带(1 600 ~ 1 700 cm-1),根据积分面积计算各种二级结构的相对百分含量,二级结构波数范围划分如下:其中1 615~1 637 cm-1为β-折叠,1 638~1 645 cm-1为无规卷曲;1 646~1 664 cm-1为α-螺旋;1 665~1 685 cm-1为β-转角;1 690~1 700 cm-1为反β-折叠[18]。牛奶蛋白和茶多酚-牛奶蛋白复合物红外光谱酰胺 Ⅰ 带高斯拟合图见如6所示,各二级结构含量如表2所示。从表2中可以看出,牛奶蛋白二级结构以α-螺旋和β-转角为主,其含量分别为28.54%和 30.37%。蛋白结构中18.36% β-折叠,18.87%无规卷曲和3.86%反β-折叠。这与YE等[18]测定的脱脂乳蛋白二级结构结果类似。
表2 热处理牛奶蛋白和茶多酚-牛奶蛋白复合物中二级结构的相对含量
Table 2 Relative content of secondary structure in heat-treated milk protein and tea polyphenol-milk protein complex
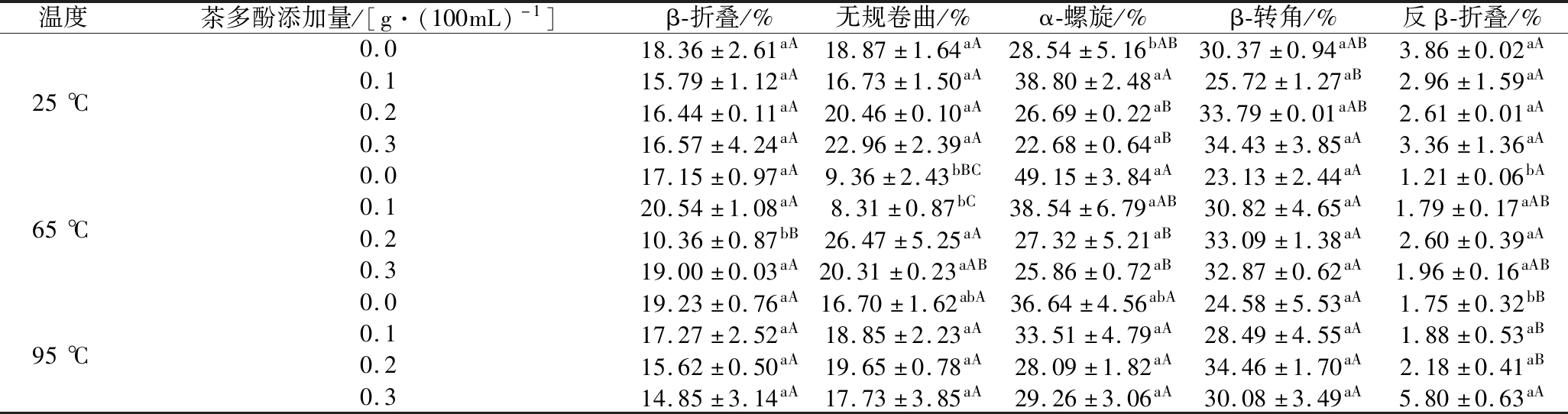
温度茶多酚添加量/[g·(100mL)-1]β-折叠/%无规卷曲/%α-螺旋/%β-转角/%反β-折叠/%0.018.36±2.61aA18.87±1.64aA28.54±5.16bAB30.37±0.94aAB3.86±0.02aA25℃0.115.79±1.12aA16.73±1.50aA38.80±2.48aA25.72±1.27aB2.96±1.59aA0.216.44±0.11aA20.46±0.10aA26.69±0.22aB33.79±0.01aAB2.61±0.01aA0.316.57±4.24aA22.96±2.39aA22.68±0.64aB34.43±3.85aA3.36±1.36aA0.017.15±0.97aA9.36±2.43bBC49.15±3.84aA23.13±2.44aA1.21±0.06bA65℃0.120.54±1.08aA8.31±0.87bC38.54±6.79aAB30.82±4.65aA1.79±0.17aAB0.210.36±0.87bB26.47±5.25aA27.32±5.21aB33.09±1.38aA2.60±0.39aA0.319.00±0.03aA20.31±0.23aAB25.86±0.72aB32.87±0.62aA1.96±0.16aAB0.019.23±0.76aA16.70±1.62abA36.64±4.56abA24.58±5.53aA1.75±0.32bB95℃0.117.27±2.52aA18.85±2.23aA33.51±4.79aA28.49±4.55aA1.88±0.53aB0.215.62±0.50aA19.65±0.78aA28.09±1.82aA34.46±1.70aA2.18±0.41aB0.314.85±3.14aA17.73±3.85aA29.26±3.06aA30.08±3.49aA5.80±0.63aA
注:小写字母a~c表示组间差异显著(P<0.05),大写字母A~C表示组内差异显著(P<0.05)

图6 茶多酚和热处理共同作用对牛奶蛋白胶束酰胺Ⅰ带高斯拟合图
Fig.6 Gaussian curve fitting of Amide I regions in milk protein micelle with tea polyphenols and heat treatment
茶多酚对牛奶蛋白二级结构的影响如表2所示,在25 ℃时,蛋白质二级结构中无规卷曲和β-转角含量随着茶多酚浓度的增加而增加,β-折叠和α-螺旋含量减少。当热处理温度为65 ℃时,茶多酚的添加量对β-转角和反α-折叠含量变化并不显著(P<0.05),但β-转角含量随茶多酚浓度的升高从23.13%增加至32.87%,同时无规卷曲含量从9.36%增加至20.31 %,而α-螺旋含量从49.15 %显著(P<0.05)降低至25.86%。热处理温度达95 ℃时,其测定结果与25 ℃处理相似。由此可以得到,在同一温度不同茶多酚浓度处理下,蛋白质二级结构变化趋势为α-螺旋和β-折叠含量减少,无规卷曲和β-转角含量增加。而α-螺旋和β-折叠层的形成主要是蛋白质分子间氢键的作用,α-螺旋和β-折叠层减少,说明茶多酚与牛奶蛋白的相互作用破坏了蛋白质分子间的氢键[28],氢键的断裂使得蛋白质结构由规则向无规则转化;β-转角含量增加,说明蛋白质结构中又重回新组合成新的氢键,这与茶多酚酚羟基与蛋白质肽羰基之间形成的氢键有关[7]。KANAKIS等[29]指出添加多酚后蛋白质结构的变化,即α-螺旋和β-折叠二级结构的增加以及无规卷曲的减少。而HASNI等[27]探讨了在多酚相互作用下,酪蛋白二级结构中α-螺旋和β-折叠层发生了主要的减少,而多酚-酪蛋白复合物中出现了转角和无序结构的增加。SHPIGELMAN等[30]研究发现EGCG与加热的β-Lg的结合将蛋白质二级结构向无规卷曲转变。蛋白质二级结构的变化可能会引起蛋白凝胶结构的变化。
2.6 蛋白质巯基含量
巯基是蛋白质凝胶形成的一个关键因素。由图7可知,牛奶蛋白的巯基含量约在15~20 μmol/g,这与罗明江等[19]测定的牛奶中巯基含量相似。在25 ℃处理时,巯基含量与茶多酚添加量无规律关系;而在65 ℃时,随着茶多酚添加量的增加,游离巯基从17.61 μmol/g增加至19.11 μmol/g;当温度达95 ℃时,游离巯基从19.89 μmol/g减少到16.58 μmol/g。
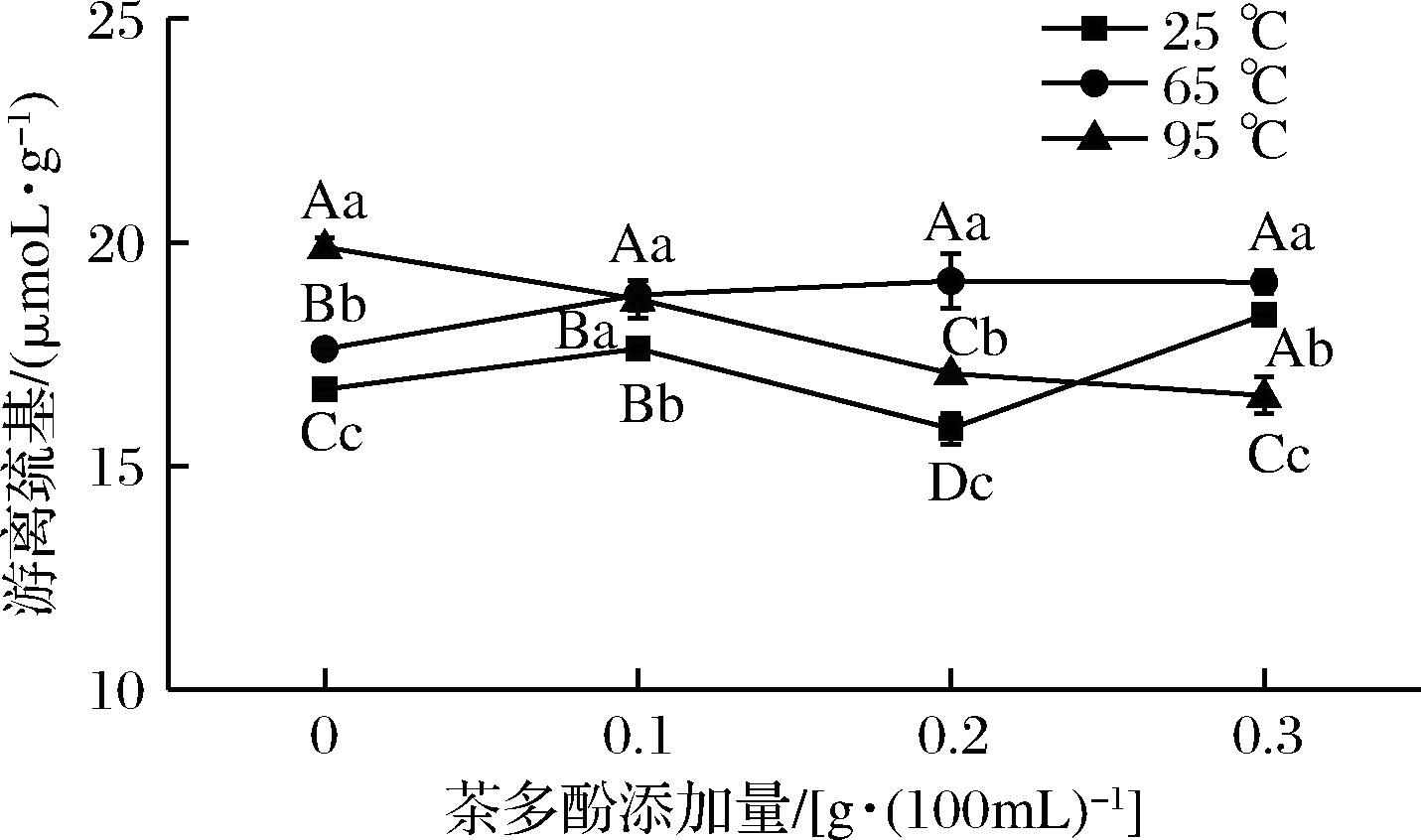
图7 茶多酚对热处理过程中牛奶蛋白巯基含量的影响
Fig.7 Effect of tea polyphenols on the content of milk protein sulfhydryl content during heat treatment
乳清蛋白属于热敏性蛋白,65 ℃加热处理后,其球状结构开始去折叠化变得舒展,此时加入茶多酚,会导致牛奶蛋白质中游离的巯基数量增加,主要是因为乳清蛋白结构中引入了酚羟基,而茶多酚芳香族环的空间效应使得蛋白结构中原有的二硫键断裂。当温度达95 ℃时,乳清蛋白的热变性程度增大,β-Lg的变性程度约为60%,α-LA为50%[21],蛋白质去折叠化释放游离巯基成为引起硫醇/二硫化物与其他蛋白质交换关键作用基团[31-32]。加入茶多酚后,游离巯基数量显著减少,可能与茶多酚作为一种含有大量酚羟基基团的化合物,可以与牛奶蛋白中的巯基结合,进而造成巯基含量的降低有关;也可能是牛奶蛋白经高温处理后,乳清蛋白所暴露出来的巯基与其自身或κ-酪蛋白发生巯基-二硫化物交换形成二硫键有关[23];此外,也有可能是茶多酚通过某种途径形成醌化合物与牛奶蛋白以共价键C—S的形式结合使巯基含量减少[33]。徐洁琼[34]探讨了热处理对茶多酚与牛奶对蛋白相互作用的影响,证实了热处理条件下,茶多酚单体与蛋白质单体之间主要以非共价形式作用,但不排除茶多酚与乳清蛋白之间存在共价结合形式。茶多酚对蛋白质游离巯基的影响可能会使得蛋白质凝胶结构不同。
3 结论
本试验探究了茶多酚对不同热处理下牛奶蛋白结构影响规律。试验结果显示,随着茶多酚添加量的增加,茶多酚与牛奶蛋白的结合程度增加。65 ℃时,结合程度达到最大,此时,其蛋白质浊度随着茶多酚添加量的增加而降低,游离巯基含量增加;而95 ℃时,蛋白质浊度随茶多酚添加量的增加而升高,游离巯基含量降低;蛋白质二级结构中α-螺旋和β-折叠含量减少,无规卷曲和β-转角含量增加,蛋白质分子间的氢键断裂,蛋白质结构由规则向无规则转化。此外,蛋白质内源和ANS外源荧光强度降低,表面疏水性降低,蛋白质疏水性基团内卷,茶多酚在较疏水的环境中改变Trp微环境并没有破坏蛋白质内部结构,进而使得蛋白质三级结构较稳定。茶多酚对牛奶蛋白结构的影响不容小觑,其宏观表现在对牛奶蛋白浊度影响规律不同,此研究为富含茶多酚-牛奶蛋白复合物食品,在分析功能特性和生物学效应方面提供理论指导。
[1] HARATIFAR S, CORREDIG M. Interactions between tea catechins and casein micelles and their impact on renneting functionality[J]. Food Chemistry, 2014, 143(1):27-32.
[2] DE AMORIM L M N, VAZ S R, CES RIO G, et al. Effect of green tea extract on bone mass and body composition in individuals with diabetes[J]. Journal of Functional Foods, 2018, 40:589-594.
RIO G, et al. Effect of green tea extract on bone mass and body composition in individuals with diabetes[J]. Journal of Functional Foods, 2018, 40:589-594.
[3] VALEILLE K, F R
R ZOU J, PARQUET M, et al. The natural concentration of the conjugated linoleic acid, cis-9,trans-11, in milk fat has antiatherogenic effects in hyperlipidemic hamsters[J]. The Journal of Nutrition, 136(5): 1 305-1 310.
ZOU J, PARQUET M, et al. The natural concentration of the conjugated linoleic acid, cis-9,trans-11, in milk fat has antiatherogenic effects in hyperlipidemic hamsters[J]. The Journal of Nutrition, 136(5): 1 305-1 310.
[4] KARTSOVA L A, ALEKSEEVA A V. Effect of milk caseins on the concentration of polyphenolic compounds in tea[J]. Journal of Analytical Chemistry, 63(11):1 107-1 111.
[5] LI B, DU W, JIN J, et al. Preservation of (-)-epigallocatechin-3-gallate antioxidant properties loaded in heat treated β-lactoglobulin nanoparticles[J]. Journal of Agricultural and Food Chemistry, 60(13):3 477-3 484.
[6] STOJADINOVIC, M, RADOSAVLJEVIC, J, OGNJENOVIC, J, et al. Binding affinity between dietary polyphenols and β-lactoglobulin negatively correlates with the protein susceptibility to digestion and total antioxidant activity of complexes formed[J]. Food Chemistry, 136(3-4):1 263-1 271.
[7] SPENCER C M, CAI Y, MARTIN R, et al. Polyphenol complexation—some thoughts and observations[J]. Phytochemistry, 27(8):2 397-2 409.
[8] MURRAY N J, WILLAMSON M P, LILLEY T H, et al. Study of the interaction between salivary proline-rich proteins and apolyphenol by 1H-NMR spectroscopy[J]. European Journal of Biochemistry, 1994, 219(3): 923-935.
[9] 刘夫国,马翠翠,王迪,等.蛋白质与多酚相互作用研究进展[J].食品与发酵工业,2016,42(2):282-288.
[10] BOURVELLEC C, RENARD C M G C. Interactions between polyphenols and macromolecules: quantification methods and mechanisms[J]. Critical Reviews in Food Science & Nutrition, 2012, 52(3):213-248.
[11] LIU F, MA C, MCCLEMENTS D J, et al. A comparative study of covalent and non-covalent interactions between zein and polyphenols in ethanol-water solution[J]. Food Hydrocolloids, 2016, 63:625-634.
[12] CHEYNIER V, SARNI-MANCHADO P, QUIDEAU S. Recent Advances in Polyphenol Research[M]. Oxford: Wiley-Blackwell, 2012:71-97.
[13] O′CONNELL J E, FOX P D, TANKINTIA R, et al. Effects of tea, coffee and cocoa extracts on the colloidal stability of milk and concentrated milk[J]. International Dairy Journal, 1998, 8(8):689-693.
[14] RODRIGUEZ, SILVIO D, VON STASZEWSKI M, et al. Green tea polyphenols-whey proteins nanoparticles: Bulk, interfacial and foaming behavior[J]. Food Hydrocolloids, 2015, 50:108-115.
[15] MARTINI S, POTTER R, WALSH M. Optimizing the use of power ultrasound to decrease turbidity in whey protein suspensions[J].Food Research International, 2010, 43(10): 2 444-2 451.
[16] YAZDI S R, CORREDIG M. Heating of milk alters the binding of curcumin to casein micelles. A fluorescence spectroscopy study[J]. Food Chemistry, 2012, 132(3):1 143-1 149.
[17] PHILIPPE M, LEGRAET Y, GAUCHERON F. The effects of different cations on the physicochemical characteristics of casein micelles[J]. Food Chemistry, 2005(4):673-683.
[18] YE J, FAN F, XU X, et al. Interactions of black and green tea polyphenols with whole milk[J]. Food Research International, 2013, 53(1):449-455.
[19] 罗明江, 罗春霞, 吴赣香. Ellman′s试剂比色法测定食品中蛋白质的巯基和二硫键[J]. 郑州粮食学院学报, 1986(1):96-99.
[20] BROWN P J, WRIGHT W B. An investigation of the interactions between milk proteins and tea polyphenols[J]. J Chromatogr, 1963.11(4):504-514.
[21] WANG L, MA Y, CUI J, et al. Yak milk whey protein denaturation and casein micelle disaggregation/aggregation at different pH and temperature[J]. International Dairy Journal, 2017, 71:131-135.
[22] 孙红波, 李杨, 王立敏, 等. 大豆分离蛋白与花青素非共价及共价作用对蛋白构象变化的影响[J]. 食品科学, 2018, 39(12):33-39.
[23] 屈雪寅, 郑楠, 李松励, 等. 热处理对液态乳中乳清蛋白的影响研究进展[J]. 食品科学, 2017, 38(9):307-313.
[24] HE Z Y, CHEN J, MOSER S E, et al. Interaction of β-casein with (-)-epigallocatechin-3-gallate assayed by fluorescence quenching: effect of thermal processing temperature[J]. International Journal of Food Science & Technology, 2016, 51(2): 342-348.
[25] LIU Y, GUO R. pH-dependent structures and properties of casein micelles[J]. Biophysical Chemistry, 2008, 136(2-3):67-73.
[26] ASANO K, SHINAGAWA K, HASHIMOTO N. Characterization of haze forming proteins of beer and their roles in chill haze formation[J]. Journal of the American Society of Brewing Chemists, 1982, 40: 147-154.
[27] HASNI I, BOURASSA P, HAMDANI S, et al. Interaction of milk α- and β-caseins with tea polyphenols[J]. Food Chemistry, 2011, 126(2):630-639.
[28] 王松, 夏秀芳, 黄莉, 等. 湿法糖基化改性对大豆分离蛋白功能性质的影响[J]. 食品科学, 2014, 35(9):38-42.
[29] KANAKIS C D, HASNI I, BOURASSA P, et al. Milk β-lactoglobulin complexes with tea polyphenols[J]. Food Chemistry, 2011,127(3):1 046-1 055.
[30] SHPIGELMAN A, COHEN Y, LIVNEY Y D. Thermally-induced β-lactoglobulin-EGCG nanovehicles: Loading, stability, sensory and digestive-release study[J]. Food Hydrocolloids, 2012, 29(1):57-67.
[31] BABBAR N, AGGARWAL P, OBEROI H S. Influence of green tea polyphenols on the colloidal stability and gelation of WPC[J]. Food Hydrocolloids, 2011, 25(5):1 077-1 084.
[32] ROEFS SP E M, KRUIF K G D. A model for the denaturation and aggregation of β-lactoglobulin[J]. Eur J Biochem, 1994, 226(3):883-889.
[33] STRAUSS G, GIBSON S M. Plant phenolics as cross-linkers of gelatin gels and gelatin-based coacervates for use as food ingredients[J]. Food Hydrocolloids, 2004, 18(1): 81-89.
[34] 徐洁琼. 乳蛋白与茶多酚的相互作用及茶多酚生物可及性的研究[D]. 无锡:江南大学, 2017.