魔芋作为食品和传统药材在中国,日本,东南亚广泛种植。魔芋中75%的水溶性纤维多糖是魔芋葡甘露聚糖(konjac glucomannan, KGM),一般认为,魔芋葡甘露聚糖是由β-D-葡萄糖和β-D-甘露糖以1∶1.69或1∶1.6 的比例通过β-1,4糖苷键链接而成相对分子质量在20万~200万的复合多糖[1-2]。KGM及其衍生物不能被人类肠道上表皮细胞的酶直接水解,因此KGM被认为是难消化的食用纤维[3]。天然魔芋胶分子质量过大,黏度高、溶解度小,使得KGM 的应用受到了限制,所以将天然 KGM 降解成魔芋低聚糖的研究成为热点。
魔芋低聚糖(konjac oligosaccharides, KOGM)是指通过酶解、酸解、辐射等方法使天然魔芋葡甘露聚糖降解而得到的2~10个单糖单位组成的功能性低聚糖[4]。研究表明魔芋低聚糖具有促进肠道有益菌的增殖[5-6];抑制淀粉老化,清除自由基,抑制致病菌的生长[7];保持肠道菌群平衡,改善肠道功能,保持肠黏膜紧密完整,提高机体免疫[8];减少盲肠内游离氨的含量[9];降低胆固醇[10];预防和治疗痤疮等功效[11]。
不同分子质量魔芋低聚糖具有的不同结构和功效,侯占伟等[12]对不同分子质量的魔芋甘露聚糖黄酰化证明分子质量在10 kDa~30 kDa时抗凝血性,抗肿瘤,抑菌效果最好;YOSHIMURA等[13]研究表明2.56×105,4.38×105,4.44×105,9.6×105四种不同分子质量KOGM相同条件下分子质量越大凝胶速度越快且凝胶的弹性模量和储能模量越大;陈琴音等[14]利用纤维素酶和半纤维素酶酶解,经处理后得到分子质量为2 kDa~3 kDa(药用特定分子质量)的魔芋低聚糖;SONG等[15]乙酰化处理酶解后的魔芋低聚糖并通过硅胶柱分离纯化后去乙酰化得到甘露糖-葡萄糖-半乳糖,摩尔比为2∶1∶1的甘露三糖,对其进行ACE抑制活性试验表明,P3对ACE也具有一定的抑制活性。目前少有报道单一聚合度功效差异比较,因此,探究不同分子质量魔芋葡甘露聚糖的抗氧化活性以及对肠道有益菌的促进生长作用具有重要意义,为特异性切割特定功能低聚糖提供指导作用。
本实验采用自主构建的毕赤酵母产耐高温β-甘露聚糖酶对魔芋胶进行水解,通过控制水解条件得到低聚糖最高水解率为43.56%的样品,采用透析,超滤等分离技术得到不同分子质量KGM样品。比较不同分子质量KGM功能性差异。采用ORAC法比较不同样品抗氧化活性,并进行6种乳酸菌发酵实验,测定乳酸菌生长过程的延滞期和ΔOD以及发酵结束后产乳机酸含量。为进一步探究乳酸菌对魔芋低聚糖的代谢利用机制以及特异性切割功能性聚合度益生元糖苷酶的改造奠定基础。
1 材料与方法
1.1 菌株和试剂
毕赤酵母工程菌 GS115/Auman26A,由作者所在实验室构建并保藏;乳酸菌L.acidophilus,L.rhamnosus,L.bulgaricus,P.acidilactici,E.lactis,E.faecium由作者实验室实验室提供;魔芋粉,购自武汉靖江魔芋制品有限公司; D-甘露糖、 瓜儿豆胶,购自阿拉丁;蛋白胨,牛肉膏,酵母粉,葡萄糖,CH3COONa、K2 HPO4、MgSO4·7H2O、MnSO4·7H2O、 CaCO3、正丁醇、柠檬酸氢二铵、乙酸、 3,5-二硝基水杨酸、酒石酸钾钠、苯酚、Na2SO3、NaOH等,分析纯,购自上海国药集团;透析袋,上海桥星贸易有限公司。
1.2 培养基
MRS培养基(g/L):蛋白胨10.0,牛肉浸取物10.0,酵母提取液5.0,葡萄糖5.0,CH3 COONa 5.0,柠檬酸氢二铵2.0,吐温80 1.0, K2HPO4 2.0, MgSO4· 7H2O 0.2, MnSO4·7H2O 0.05, pH 6.2~6.4,sMRS培养基为不添加碳源MRS培养基。
1.3 仪器与设备
G180T灭菌锅,美国致微仪器有限公司;高速冷冻离心机,美国赛默飞世尔科技公司;酶标仪,美国BioTek公司;Agilent-1260高效液相色谱仪,美国安捷伦科技公司。
1.4 实验方法
1.4.1 魔芋胶溶液的制备[16]:
取1.00 g魔芋胶溶于100 mL pH 5.5的乙酸钠缓冲液,25 ℃ 500 r/min 条件下磁力搅拌30 min,制成魔芋胶溶解液KGM样品。
1.4.2 魔芋酶解液样品的制备
1.4.2.1 魔芋胶的酶解[17]
用重组毕赤酵母菌产甘露聚糖酶水解魔芋胶得到魔芋低聚糖。控制酶解条件为:底物质量浓度20 g/L,酶添加量90 U/mL,pH 5.5,45 ℃条件下水解,每隔10 min取样立即煮沸,10 000 r/min 离心10 min,取上清用DNS法测定还原糖的含量并计算水解率。
1.4.2.2 酶解产物的定性和定量分析
随着酶解时间的加长,水解程度越来越高,得到具有不同水解度的样品。通过薄层层析法对酶解产物进行定性半定量检测。展开剂:V(正丁醇)∶V(乙酸)∶V(水)= 4∶4∶3,显色剂:Orcinol, 115 ℃下显色5 min[18]。样品经0.2 kDa透析袋处理24 h除去样品中单糖,通过高效液相色谱法进行水解液成分的定量分析,色谱条件为色谱柱:Agilent ZORBAX-NH2(4.6 mm×250 mm,5 μm);流动相:V(乙腈)∶V(水)=65∶35; 流速:1 mL/min; 柱温:35 ℃; 进样量:15 μL; 检测器:RID检测器[19]。
1.4.2.3 不同分子质量KGM样品制备
样品经0.2 kDa透析袋处理24 h除去样品中单糖和小分子盐得到样品KOGMI,KOGMI经5 kDa超滤管离心得到相对分子质量大于5 000的截留样品KOGMII以及分子质量小于5 000的透过液,透过液经3 kDa超滤管超滤得到样品分子质量为3 000~5 000的截留样品KOGMIII,以及小于3 000的透过样品KOGMIV,将各样品浓缩后冻干保存。
1.4.3 魔芋胶水解液的相对分子质量(MW)分布
取冻干保存的样品用水复溶配成2 mg/mL样品溶液,样品过0.22 μm滤膜,高效液相法检测样品的各分子质量分布。色谱条件为色谱柱:Waters UltrahydrogelTM Llnear (7.8 mm×300 mm);流动相:0.1 mol/L NaNO3溶液;流速:0.6 mL/min;柱温:30 ℃;进样量:10 μL;检测波长250 nm。
1.4.4 不同聚合度魔芋低聚糖功能性差异
1.4.4.1 ORAC法测定抗氧化活性
使用氧自由基吸收能力-荧光素(ORAC-FL)测试估计总抗氧化能力,向96孔(黑)板各孔加入25 μL空白(PBS)和不同浓度(3.125、6.250、12.50、25、50、75 μmol/L)Trolox标准溶液,样品用75 mmol/L pH 7.4磷酸盐缓冲液稀释适当倍数,每孔加入150 μL FL(4×10-3 mmol/L)溶液,37 ℃ 孵育10 min,然后迅速向每个孔中加入25 μL AAPH(153 mmol/L)。控制激发波长485 nm和发射波长535 nm进行连续测定,每90 s测定1次各孔荧光强度,测定时间一般设定在荧光衰减呈基线后为止,约91次循环[20]。根据Trolox标准曲线方程,计算各样品以Trolox当量(TE)计的自由基吸收能力,结果以μmol TE/g表示。测定结果以ORAC值表示,得到所有数据经Excel软件处理,计算各样品ORAC值。[21]
计算如公式(1)和公式(2)所示:
(1)
(2)
式中:f0,第1次荧光读数;fi,第i次荧光读数;AUC0,空白液荧光衰减下的面积;AUC1,Trolox标准液荧光衰减下的面积;AUC2,样品荧光衰减下的面积;CTrolox,Trolox标准液的摩尔浓度,μmol/L;C样,样品质量浓度,mg/mL。
1.4.4.2 乳酸菌菌体生长曲线的测定[16]
将细菌菌株从冷冻原液(20%甘油,体积分数)中接种到MRS肉汤培养基,37 ℃厌氧生长12 h。将1%(体积分数)接种量接种至3 mL含10 g/L葡萄糖的sMRS(s MRS不含碳源培养基)肉汤中,并在37 ℃厌氧培养过夜。当生物量OD600=0.8时,取2 mL菌液于离心管中12 000 r/min 离心5 min,用1 mL pH 7.4的PBS(磷酸盐)缓冲液重悬12 000 r/min,5 min离心洗涤2次。将PBS洗涤过的菌球用2 mL sMRS培养基重悬。
分别吸取125 μL重悬菌液于无菌洁净的96孔板中,加入125 μL 2%糖样品作为唯一碳源供乳酸菌菌体生长并向孔内添加50 μL无菌矿物油,将孔板放置37 ℃厌氧培养箱培养48 h,每隔30 min测量乳酸菌OD600,每次测量前添加板振荡30 s,每种碳水化合物进行3个独立重复实验。
1.4.4.3 乳酸菌产有机酸的测定
将乳酸菌发酵48 h培养液于12 000 r/min,5 min离心获得上清,准确吸取2 mL发酵液上清,分别加入800 μL硫酸锌(300 g/L)和800 μL亚铁氰化钾(106 g/L),振荡混匀,离心。上清液用0.22 μm微孔滤膜过滤后通过HPLC检测,检测条件为色谱柱:Waters Atlantis T3(4.6 mm×250 mm,5 μm);流动相:20 mmol/L NaH2PO4,用磷酸调pH=2.7;流速:0.7 mL/min;柱温:30 ℃;进样量:10 μL;检测波长:210 nm。
2 结果与分析
2.1 魔芋胶的酶解
控制底物质量浓度20 g/L,酶添加量90 U/mL,pH 5.5,45 ℃反应条件下每隔10 min取样,样品水解率随时间变化如图1所示,在0~50 min酶解反应迅速,随着反应时间的延长样品水解率不断增大,在50~70 min水解率变化趋于平稳,其中酶解反应50 min时样品水解程度达到44.26%。
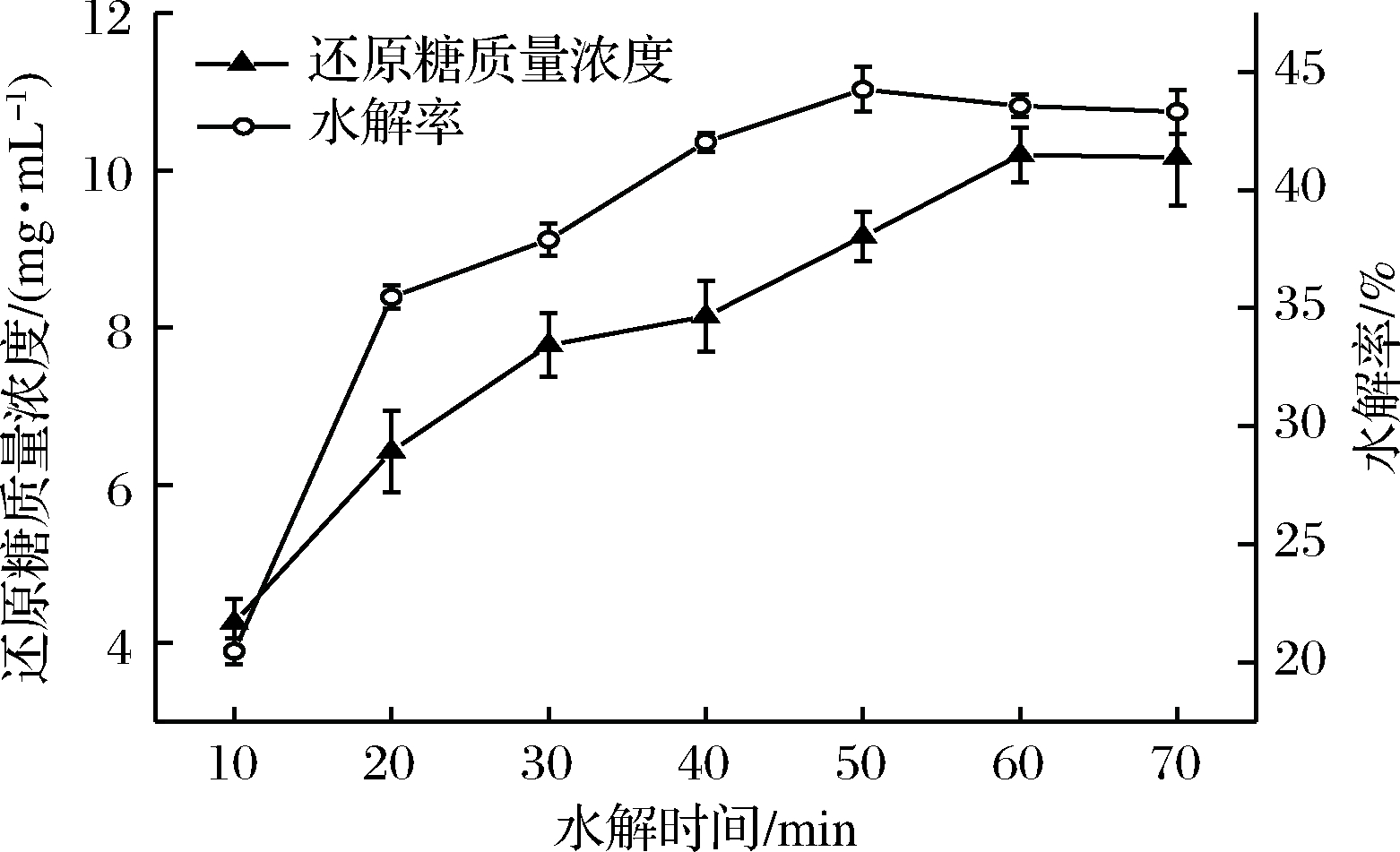
图1 魔芋胶水解率随时间的变化曲线
Fig.1 The curve of the degree of hydrolysis of konjac gum with time
2.2 魔芋胶水解产物的定性定量分析
不同水解时间酶解产物进行TLC检测,结果如图2所示。随反应不断进行,魔芋胶水解率不断增加,高聚合度糖在不断减少,低聚合度三糖二糖单糖的含量在不断增加,且水解后存在G-G,M-M,M-G,M-M-M,M-G-G,M-M-G等多种不同聚合形式的单糖聚合体。对水解样品经过透析和超滤分离后经HPLC检测结果如图3所示。水解60 min后各聚合度低聚糖分布均匀,二糖含量23.65%,三糖27.76%,四糖28.08%,五糖11.72%,六糖8.79%,选用酶解60 min水解率为43.56%的样品进行后续的样品准备分析。
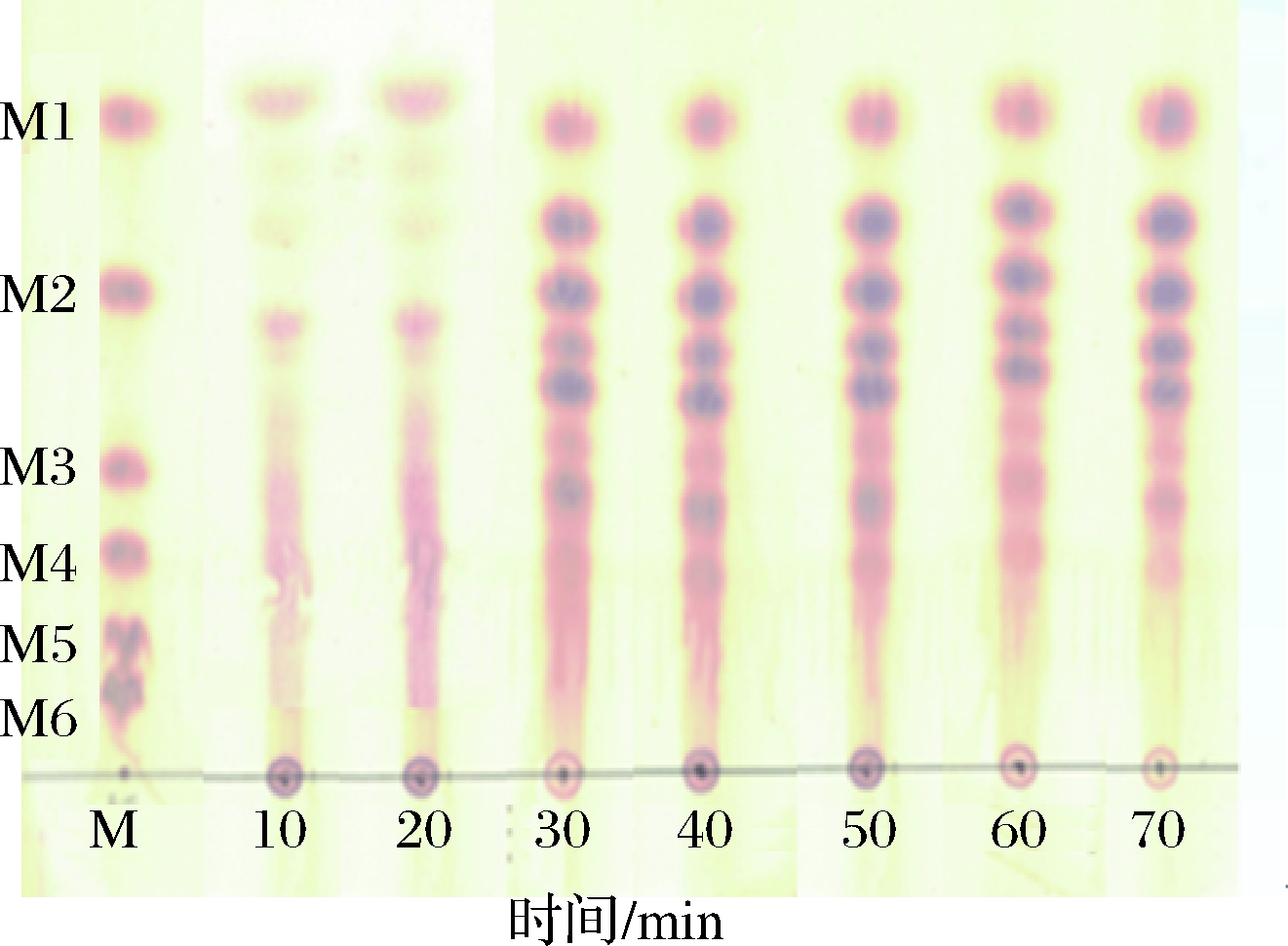
图2 不同水解时间酶解产物的TLC图
Fig.2 TLC diagram of enzymatic hydrolysis products at different hydrolysis times
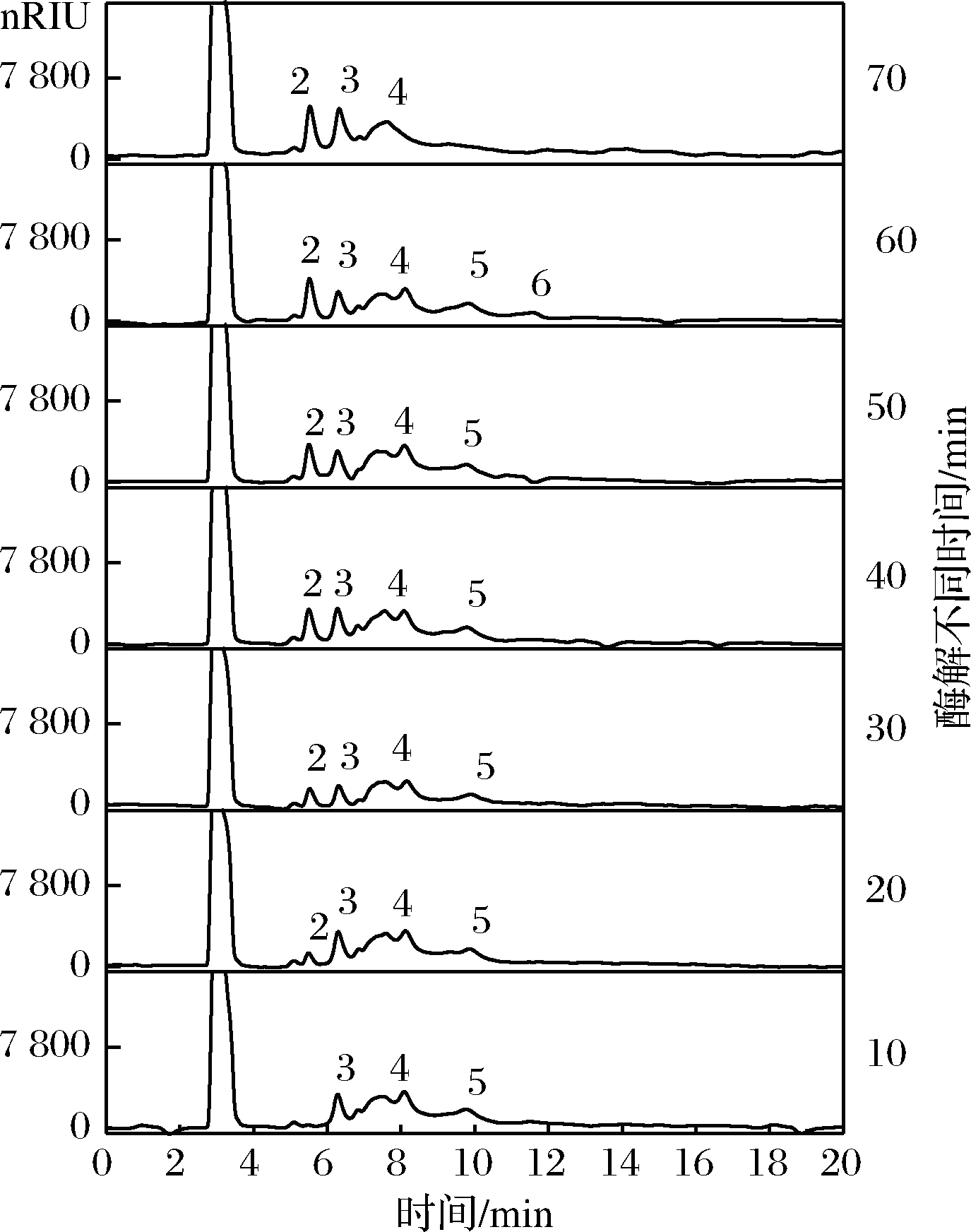
图3 酶解产物组分的 HPLC 色谱图
Fig.3 HPLC chromatogram of enzymatic product components
2.3 酶解产物样品聚合度分析
目前报道的KGM重均分子质量在1×104~2×106[22],通过酶解超声等方式可以降低KGM的分子质量[23]。本实验用不同分离方法得到KOGM样品的GPC谱图如图4所示,从上到下依次为KGM,KOGMI, KOGMII,KOGMIII,KOGMIV。

图4 不同KOGM样品GPC谱图
Fig.4 GPC spectra of different KOGM samples
样品的Mn,Mw及PDI如表1所示,酶解后魔芋胶分子质量大幅度降低,相对分子质量为1 306,经3 kDa超滤管超滤得到样品KOGMIV相对分子质量最低为787,因此β-甘露聚糖酶水解KGM后超滤处理可快速有效地得到不同分子质量聚合的魔芋甘露聚糖样品。
表1 凝胶渗透色谱法(GPC)测定魔芋样品的相对分子质量
Table 1 Relative molecular weights of konjac samples as determined by gel permeation chromatography(GPC)
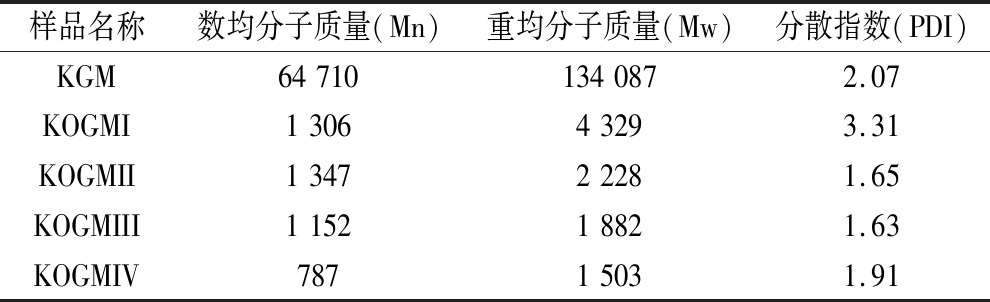
样品名称数均分子质量(Mn)重均分子质量(Mw)分散指数(PDI)KGM647101340872.07KOGMI130643293.31KOGMII134722281.65KOGMIII115218821.63KOGMIV78715031.91
2.4 不同分子质量KOGM功能性分析
2.4.1 ORAC法测定抗氧化活性
以Trolox浓度为横坐标,净面积为纵坐标计算并绘制Trolox标准溶液标准曲线,曲线方程y=0.262 7x+22.134,R2=0.998 1。ORAC法测定不同分子质量KOGM的抗氧化活性(n=6)如表2所示,同一浓度条件下,KOGMIII样品(1.033 3 mg/mL)ORAC值最高,为870.303 7 μmol Trolox当量/g,水解后的魔芋低聚糖均具有一定的抗氧化活性,其中相对分子质量在3 000~5 000 KOGMIII抗氧化活性最高,是甘露糖的58.2倍,是葡萄糖的95.93倍。
2.4.2 酶解产物的乳酸菌生长发酵
实验选取实验室保藏的6株微生态饲料添加有益乳酸菌为实验对象以不同糖样品为唯一碳源进行发酵,以葡萄糖、甘露糖、菊粉、KGM作为对照,5种不同分子质量魔芋低聚糖为实验样品进行乳酸菌发酵,生长情况如图5所示。由图5-A得出除L.bulgaricus外,菌体代谢利用低聚糖样品的速度相比代谢葡萄糖略慢。但图5-B和图5-C显示,菌体代谢低聚糖使得菌体对数生长期延长,且菌体利用低聚糖样品最终生物量ΔOD普遍高于代谢利用葡萄糖、甘露糖单糖,且KOGMIV的样品促进生长作用最明显。高效液相检测发酵液中乳酸的含量,如图6所示,乳酸菌发酵KOGMIV发酵结束后产乳酸含量最高。
表2 ORAC法测定不同分子量KOGM的抗氧化活性(n=6)
Table 2 ORAC method for determination of antioxidant activity of different molecular weight KOGM (n=6)

样品质量浓度/(mg·mL-1)ORAC值/(μmolTrolox当量·g-1)Glu1.02539.1670Man1.067515.704Inulin1.02908.8241KGM1.061137.839KOGMI1.0155403.57KOGMII1.0627656.88KOGMIII1.03333870.30KOGMIV1.1851149.25
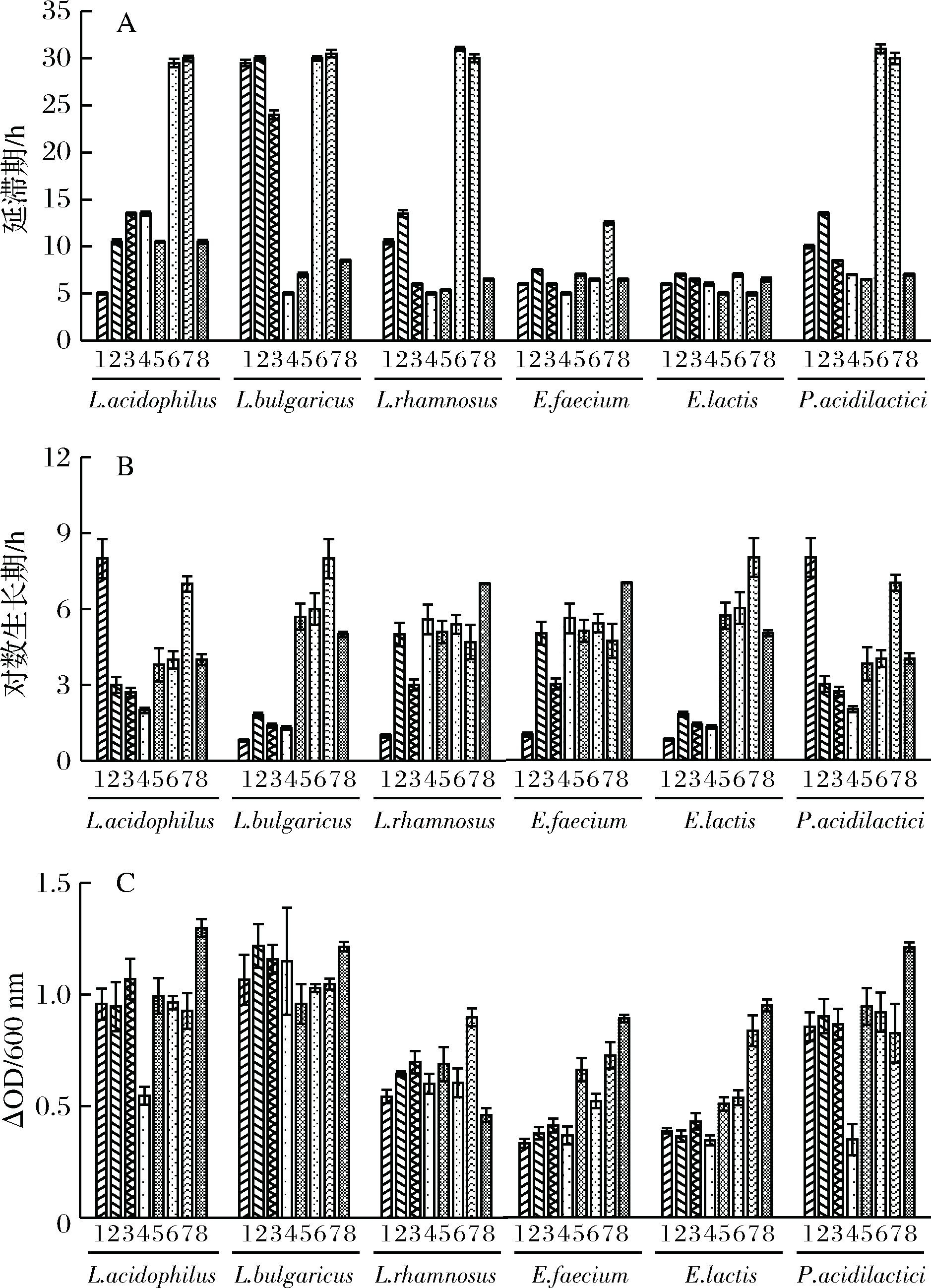
A-乳酸菌生长延滞期;B-乳酸菌生长对数期;C-乳酸菌正常ΔOD
图5 六种乳酸菌发酵不同魔芋甘露聚糖样品(n=3)
Fig.5 Growth of different konjac mannan samples fermented by six types of lactic acid bacteria
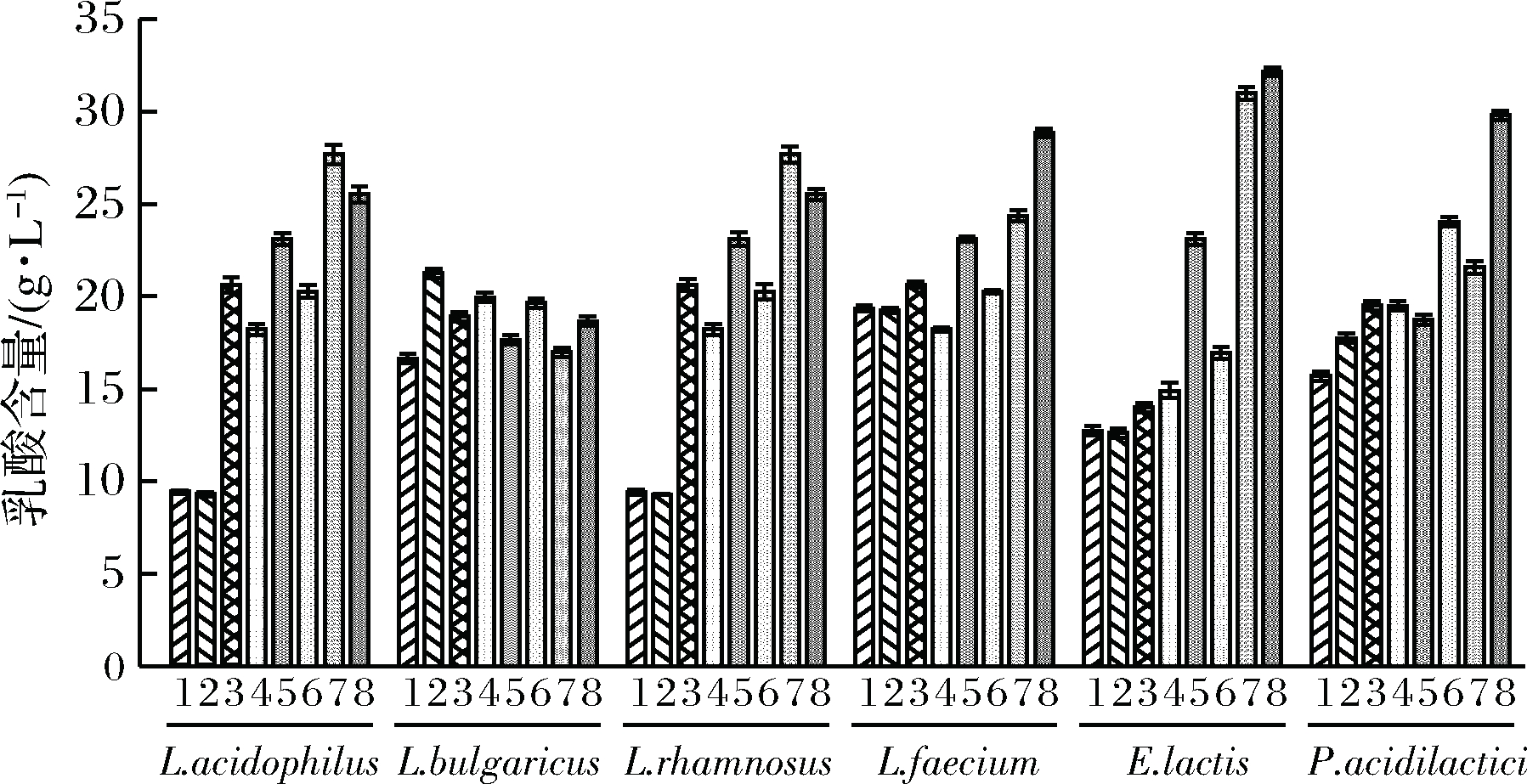
图6 六种乳酸菌发酵不同样品生成乳酸的含量
Fig.6 Contents of lactic acid produced by fermentation of six lactic acid bacteria in different samples
3 结论
魔芋甘露聚糖可以通过物理法化学法以及酶法水解制成不同分子质量聚合度的低聚糖[24],然而不同方法得到的不同聚合度低聚糖结构和功效差异性较大[25]。因此本实验旨在探究酶法制备的不同分子质量魔芋甘露聚糖抗氧化活性以及对乳酸菌促进作用的差异。利用实验室自主构建保藏的毕赤酵母菌产β-甘露聚糖酶酶解魔芋甘露聚糖,控制水解条件为:底物质量浓度20 g/L,酶添加量90 U/mL,pH 5.5,45 ℃条件下水解60 min得到水解率为43.56%的样品,经过除单糖以及不同孔径超滤处理得到不同相对分子质量的样品。对得到的样品进行抗氧化能力分析以及6种饲料添加有益乳酸菌发酵实验,结果显示相对分子质量在3 000~5 000时魔芋甘露低聚糖抗氧化活性最高,6种乳酸菌均能利用魔芋甘露低聚糖作为唯一碳源进行生长代谢,且相对分子质量为787的低聚糖对乳酸菌促进生长效果最为显著,且发酵结束后乳酸含量最高。为探究乳酸菌代谢魔芋低聚糖途径以及定向切割特定聚合度低聚糖酶的改造提供依据。
[1] KOBAYASHI S, TSUJIHATA S, HIBI N, et al. Preparation and rheological characterization of carboxymethyl konjac glucomannan[J]. Food Hydrocolloids,2002,16(4):289-294.
[2] IGLESIAS-OTERO MA, BORDER AS J, TOVAR C A. Use of Konjac glucomannan as additive to reinforce the gels from low-quality squid surimi[J]. Journal of Food Engineering,2010,101(3):281-288.
AS J, TOVAR C A. Use of Konjac glucomannan as additive to reinforce the gels from low-quality squid surimi[J]. Journal of Food Engineering,2010,101(3):281-288.
[3] 骆薇, 张迎庆. 益生元魔芋葡甘低聚糖研究进展[J]. 食品与药品, 2014,16(4):296-298.
[4] 龙力.功能性低聚糖产业及市场发展分析[C].北海:全国淀粉糖、多元醇技术与发展研讨会,2013:11-23.
[5] CONNOLLY M L, LOVEGROVE J A, TUOHY K M. Konjac glucomannan hydrolysate beneficially modulates bacterial composition and activity within the faecal microbiota[J]. Journal of Functional Foods, 2010, 2(3):219-224.
[6] 张琳. 魔芋低聚糖的制备及其性质研究[D].长春:吉林大学, 2013.
[7] AL-GHAZZEWI F H, TESTER R F. Efficacy of cellulase and mannanase hydrolysates of konjac glucomannan to promote the growth of lactic acid bacteria[J]. Journal of the Science of Food & Agriculture, 2012, 92(11):119-127.
[8] TAE-HWAN J, HYEON P J, WOO-MIN J, et al. Butyrate modulates bacterial adherence on LS174T human colorectal cells by stimulating mucin secretion and MAPK signaling pathway[J]. Nutrition Research and Practice, 2015, 9(4):343-352.
[9] 王敏,帅天罡,秦清娟.魔芋葡甘低聚糖对大鼠肠道环境的影响[J].食品科学, 2016, 524(7):221-227.
[10] OMAR J M, CHAN Y M, JONES M L, et al. Lactobacillus fermentum and Lactobacillus amylovorus as probiotics alter body adiposity and gut microflora in healthy persons[J]. Journal of Functional Foods, 2013, 5(1):116-123.
[11] TESTER R F, AL-GHAZZEWI F H. Beneficial health characteristics of native and hydrolysed konjac (Amorphophallus konjac) glucomannan[J]. Journal of the Science of Food and Agriculture, 2015, 96(10):3 283-3 291.
[12] 侯占伟. 魔芋葡甘聚糖的化学改性及其性质研究[D].武汉:武汉理工大学, 2008.
[13] ZHANG H, YOSHIMURA M, NISHINARI K, et al. Gelation behaviour of konjac glucomannan with different molecular weights[J]. Biopolymers, 2001, 59(1):38-50.
[14] 徐琴音, 唐少锋, 唐文娟. 鲜魔芋生产药用特定分子质量葡甘低聚糖的工艺方法:中国,CN201210130077.1[P].2012-09-19.
[15] QIAOYING S, TING L, WEI X, et al. Preparation, structure analysis and ACE inhibitory activity of konjac oligosaccharide[J]. Industrial Crops and Products, 2018, 124(11):812-821.
[16] YANG J, VITTORI N, WANG W, et al. Molecular weight distribution and fermentation of mechanically pre-treated konjac enzymatic hydrolysates[J]. Carbohydrate Polymers, 2017, 159(24):58-65.
[17] 赵梅,王春娟,董运海,等. 重组β-甘露聚糖酶制备低聚葡甘露糖工艺条件的优化[J]. 食品与生物技术学报2016,(7):704-708.
[18] 陈秀霞,尹业师,朱立颖,等. 益生菌及人体肠道菌群对低聚甘露糖的降解[J]. 中国微生态学杂志2016,(7):745-750.
[19] 龚芳红, 贺松, 张德纯,等. 双歧杆菌发酵果蔬汁中低聚果糖的高效液相色谱法分析[J]. 中国微生态学杂志, 2010, 22(6):489-491.
[20] DU Z, LIU J, ZHANG D, et al. Individual and synergistic antioxidant effects of dipeptides in in vitro antioxidant evaluation systems[J]. International Journal of Peptide Research and Therapeutics, 2019,25(1):391-399.
[21] 严欢, 韩飞, 李慕春. ORAC法对薰衣草非精油组分的抗氧化活性研究[J].食品科技,2018,43(12):282-285.
[22] MEI X, DONG-SHENG L, BIN L, et al. Comparative study on molecular weight of konjac glucomannan by gel permeation chromatography-laser light scattering-refractive index and laser light-scattering methods[J]. Journal of Spectroscopy, 2017,17:1-4.
[23] ZIA F, ZIA K M, ZUBER M, et al. Glucomannan based polyurethanes: A critical short review of recent advances and future perspectives[J]. International Journal of Biological Macromolecules, 2016,87:229-236.
[24] ALBRECHT S,VAN MUISWINKELGCJ, XU J,et al. Enzymatic production and characterization of konjac glucomannan oligosaccharides[J]. Journal of Agricultural and Food Chemistry, 2011, 59(23):12 658-12 666.
[25] FARAGE HASHMI AL-GHAZZEWI, KHANNA S, TESTER R F, et al. The potential use of hydrolysed konjac glucomannan as a prebiotic[J]. Journal of the Science of Food and Agriculture, 2007, 87(9):1 758-1 766.