乳清分离蛋白-酪蛋白酸钠-甘油(whey protein isolate-sodium caseinate-glycerol,WPI-NaCas-GLY)复合蛋白薄膜作为一类优良的可食性薄膜,在食品的内包装方面,具备替代不可降解高分子聚合物PE等材料的潜力及优势[1],尤其是其气体阻隔性能达到49.92 cm3/(m2·d·0.1 MPa),高于高阻气性的PET塑料。此外,其基体改性的一级、二级空间也较大,具备优良的迁移控释性[2],有望开发出适合多类食品包装的薄膜。
然而,蛋白基薄膜作为生物极性聚合物,具有一定程度的亲水性,相较于塑料等高分子聚合物,蛋白基薄膜具有较高的水溶性和水蒸气透过率,因此,阻碍了其在高水分食品包装及高湿环境中的应用。成膜基质的改性是提高蛋白基薄膜疏水性的重要手段,包括物理法和化学法等。采用谷氨酰胺转氨酶催化蛋白质交联,是其化学改性方法之一,能够改善乳清蛋白浓缩物-羧甲基化壳聚糖薄膜的阻水性[3];此外,添加羧甲基化壳聚糖、酪蛋白酸钠、黄蓍胶等,同样能够达到改善蛋白基薄膜疏水性的效果[3-5]。相对而言,物理改性方法研究较少但也有效,如静态超高压处理成膜溶液的方法,能显著降低抗菌复合蛋白膜的水蒸气透过率,改善其疏水性[6];介电屏障放电(dielectric barrier discharge, DBD)系统等离子处理,通过改进蛋白质二级结构,也可提高薄膜的表面疏水性[7]。
等离子体(Plasma)技术是一种新兴的非热技术,它是利用含有离子、自由基、自由电子和中性物质的气相混合物在等离子体空间内及聚合物-等离子体界面上诱发某些物理和化学反应,以改变聚合物的性质,Plasma与蛋白质相互作用产生的反应包括氨基酸的二聚化、氧化、脱酰胺、硝化、磺化氧化、脱氢和/或羟基化等[8]。Plasma技术在包装材料改性方面的研究显示,Plasma处理玉米醇溶蛋白膜、凝胶膜和肌原纤维蛋白膜等,能够有效改善薄膜疏水性、机械性能、结构特性以及热性能等[7,9-10]。然而,关于该技术是否会对蛋白质功能产生正面或负面影响的研究报道十分有限。在成膜溶液的Plasma处理方面,现有研究发现,介电屏障放电系统等离子处理、大气压冷等离子体处理蛋白基溶液,能够改善其保水性、溶解性、发泡和乳化能力[7,11]。
为了探索Plasma处理对成膜溶液的改性机制,进一步开发疏水性的可食性薄膜,本研究在前期复合蛋白基薄膜的研究基础上,探讨了不同时长的Plasma处理对WPI-NaCas-GLY成膜溶液色度、pH、粒度、表面张力、发泡性能、乳化能力的影响,并将其制备成膜研究了其机械性能、光学性能和阻隔性能的变化,以期研发满足市场需求的新型绿色包装材料,推动可食性包装薄膜的产业化发展及应用。
1 材料与方法
1.1 实验材料
乳清蛋白粉(蛋白质>98%),美国ISOPURE公司;酪蛋白酸钠(蛋白>99.21%),上海麦克林生化科技有限公司;丙三醇(分析纯),上海麦克林生化科技有限公司;环氧大豆油,上海麦克林生化科技有限公司;0.1% SDS十二烷基磺酸钠(sodium dodecyl sulfate,SDS)溶液,福建领江生物科技有限公司。
1.2 仪器与设备
马尔文MS3000激光粒度仪,英国马尔文仪器有限公司; Piezobrush PZ2等离子处理仪,德国RP plasma公司;U-3900紫外分光光度计,日本日立高新技术科学公司; CR-400色差仪,日本柯尼卡美能达有限公司;T25数显型高速分散机,德国艾卡公司;JC2000C接触角测量仪,上海中晨数字技术设备有限公司;OX-TRAN 2/2H型氧气透过率测试仪,美国MOCON公司;PERMATRAN-W 1/50G型水蒸气透过率测试仪,美国MOCON公司;XLW(EC)型智能电子拉力试验机,济南蓝光机电技术有限公司;WGT/S 透光率/雾度测定仪,上海精科仪器有限公司。
1.3 实验方法
1.3.1 成膜溶液的制备及Plasma处理方法
称取6.84 g乳清分离蛋白粉以及5.11 g酪蛋白酸钠,分别溶入100 mL去离子水中,于25 ℃恒温磁力搅拌器搅拌1 h升温至85 ℃搅拌30 min。待溶液静置至室温后,将两者混合并且加入4.18 g甘油,将三者的混合物置于25 ℃磁力搅拌器搅拌1 h,再将溶液倒入抽滤瓶中进行真空脱气,制得蛋白质溶液[12]。将成膜溶液均分成8组,用30 W Plasma等离子处理仪分别对溶液处理0、5、10、15、20、30、40、60 min。处理后,将样品密封并在冷藏条件(4 ℃)下储存12 h直至进一步分析。
1.3.2 薄膜制备方法
将混合均匀的成膜溶液真空脱气后,倒入平板中,置于65 ℃恒温鼓风干燥箱中5 h以烘干成膜。薄膜置于23 ℃、50% RH的恒温恒湿箱中放置待测。
1.3.3 成膜溶液性能测试
1.3.3.1 色度
使用预校准的L*,a*,b*比色计在离溶液1 cm处,测量其色度。颜色报告值为至少6次测量的平均值。使用描述黄色的b*参数来评估颜色的变化[11]。
1.3.3.2 pH值
使用pH计测量处理前后的成膜溶液和缓冲液的pH值,实验组重复6次,求其平均值[11]。
1.3.3.3 粒度
实验采用折射率为1.33的蒸馏水作为分散剂,测量过程在20 ℃下进行。在样品杯中装入400 mL蒸馏水, 放置在马尔文MS3000激光粒度仪进样器的正确位置,颗粒类型为球形,折射率为1.4,吸收率设置为0.001,密度设置为1 g/cm3,加入混合均匀的测试样品,在非超声状态下测量试样[13]。每个样品的测量次数设定为5次,每次测量时间为10 s,全部测试完成后取其平均值作为参考数据,使用累积方法找到溶液粒子的体积分布和颗粒的平均尺寸。
1.3.3.4 蛋白质羰基的测定
蛋白质羰基的量根据LEVINE等[14]的方法进行测定。将2.4 mL的2,4-二硝基苯肼(在2 mol/L HCl中的量为10 mmol/L)添加至1.8 mL的蛋白质溶液中。静置60 min后,添加2.1 mL三氯乙酸(浓度10%)。将样品在冰上孵育10 min后离心(12 000 r/min,3 min)。蛋白质沉淀用6 mL乙醇和乙酸乙酯的混合物(体积比1∶1)洗涤3次,以去除过量的2,4-二硝基芊肼。将最终的沉淀溶解于3 mL的6 mol/L盐酸胍中,使用紫外分光光度计记录在370 nm处的吸光度。
1.3.3.5 游离巯基含量的测定
为了确定WPI样品中游离巯基的浓度,使用了Ellman试剂(DTNB,5,5′-二硫代双(2-硝基苯甲酸))[15]。将0.5 mL的WPI样品溶液添加到2.5 mL含8 mol/L尿素的三羟甲基氨基甲烷-甘氨酸(Tris-Gly)缓冲液(10.4 g Tris,6.9 g Gly,1.2 g EDTA,pH 8.0)和0.02 mL Ellman's试剂(在Tris-Gly缓冲液中质量浓度为4 mg /mL)中。避光静置15 min后,使用紫外分光光度计在412 nm 处测量吸光度。游离巯基的浓度按公式(1)计算:
(1)
式中:SH,游离巯基浓度,μmol/g;A412,在412 nm的吸光度;C,WPI溶液的质量浓度,mg/mL;D,稀释因子。
1.3.3.6 溶液表面张力
接触角是指在气、液、固三相的交界处作气液界面与固液界面的切线,两切线通过液体内部所成的夹角θ即称为接触角。可作为衡量液体对固体浸润能力的一个重要指标,是润湿程度的量度。实验采用悬滴法[16],在恒温恒湿的条件下,用接触角测量仪测定溶液的接触角,再通过采用理论计算法获得液体的表面张力。
根据Young’s 方程:
cosθα1=1+b(γc-γα1)
(2)
cosθα2=1+b(γc-γα2)
(3)
式中:θα1,成膜溶液在被测固体表面上的接触角,°;θα2,蒸馏水在被测固体表面上的接触角(93.2°,已知),°;γc,固体表面的表面张力(承接材料为PE薄膜,表面张力为31.0 mN/m,已知),mN/m;γα1,成膜溶液的表面张力,mN/m;γα2,蒸馏水的表面张力(72.02 mN/m,已知),mN/m;b,系数。
实验中,将PE薄膜剪成4 cm×4 cm的平整块状放置于载玻片上;依次往薄膜上滴加不同的溶液样品,测定其接触角,每种溶液测试3次,取其平均值作为数据, 再由式(1)、式(2)推导出成膜溶液的表面张力。
1.3.3.7 发泡性
根据ONODENALORE[17]描述的方法评估溶液发泡能力。蛋白质泡沫通常具有发泡能力和泡沫稳定性。发泡能力是将空气加入蛋白质溶液的能力,可以通过测量泡沫体积的增加来确定。泡沫的稳定性可以通过测量液体的排出速率或泡沫体积的下降速率来确定。使用均化器在烧杯中以1 000 r/min的转速将30 mL的成膜溶液均化2 min。根据公式(4)和公式(5)计算其发泡能力(foaming capacity,FC)和泡沫稳定性(foaming stablity,FS):
(4)
(5)
式中:VL,搅打前成膜溶液的体积,mL;VF0,搅打后立即(时间=0 min)测量的泡沫体积,mL;VF10,搅打后在室温下静置10 min后测量的泡沫体积,mL。
1.3.3.8 乳化性
实验通过研究乳液的稳定性来分析其乳化能力,乳液的稳定性通过分光光度法进行定量表征[18]。
在室温下采用均质机,将30 mL成膜溶液混合20%(体积分数)环氧大豆油在1 000 r/min下均质2 min 制备乳状液。之后使用1 g/L的SDS稀释乳状液体,获得1∶500的最终稀释度。将稀释后的乳液立即注入比色皿中,在500 nm处进行分光光度测定,并根据公式(6)计算其乳化活性指数(cmulsifying activityindex,EAI):
EAI![]()
(6)
1.3.4 薄膜性能测试
1.3.4.1 薄膜厚度测量
使用螺旋测微器测量膜的厚度,从每个薄膜样品中在不同位置进行5次测量,取平均值。
1.3.4.2 机械性能测试
用智能电子拉力试验机进行膜样品的抗拉强度(tensile atregth,TS)和断裂伸长率(elongation at break,E)的测试[19]。将膜样品裁成15 mm×50 mm的矩形,设置:初始夹持距离:50 mm,拉伸速度:500 mm/min。记录薄膜的拉伸强度和断裂伸长率,每个样品测试3次,取其平均值。
1.3.4.3 光学性能测试
使用透光率/雾度测定仪对薄膜样品进行透光率和雾度测定[20]。将膜裁成4 cm×4 cm的正方形大小,紧贴垂直放置于仪器夹具上,使光束垂直透过样品膜。每个样品测试3次,取其平均值。
1.3.4.4 透湿性能测试
根据ASTM E398[21]水蒸气透过率测试方法进行测试。仪器参数设置:两侧相对湿度分别为10%和100%,测试温度为37.8 ℃。水蒸气透过系数(water vapor permeability,WVP)根据公式(7)计算:
(7)
式中:WVTR,水蒸气透过率,%;n,样品薄膜厚度,nm;Δp,气体输出压力,0.20 MPa。
1.3.4.5 水溶性测试
使用RHIM[22]修改的方法测试薄膜水溶性(water solubility,WS)。将样品切成30 mm×30 mm的小块,在鼓风干燥箱中于105 ℃干燥24 h后,记录初始质量W1(g)。干燥后,在室温下,将薄膜置于50 mL蒸馏水中24 h。移出未溶解的薄膜样品并于105 ℃下再次干燥,称量直至恒重(0.000 2 g),最终质量记为W2(g)。每个样品测试均重复3次。薄膜水溶性(WS)根据公式(8)计算:
(8)
1.3.4.6 透氧性能测试
薄膜氧气透过率参照GOUNGA[23]的方法进行测试,通过氧气渗透率测试仪测量对膜的氧气渗透率。用样品切割器将膜切成φ= 50 mm的样品。在恒定温度(23 ℃)下测定薄膜的透氧率(OTR)。将气源的压力调节至0.5 MPa。所选的薄膜不应有物理损坏。每个样品测试3次,取其平均值。
2 结果与分析
2.1 蛋白基成膜溶液特性变化
2.1.1 蛋白基成膜溶液的色度变化
成膜溶液颜色随Plasma处理时间的变化如图1所示,溶液黄色强度变化显著,实验结果明显显示,膜液黄色强度的增加与处理时间正相关(P<0.05)。随着处理时间的延长,b*值不断上升。

图1 溶液b*值的变化
Fig.1 Change in b* value of solution
注:不同小写字母表示具有显著性差异(P<0.05)(下同)
蛋白质溶液中的氨基酸和还原糖之间有限的非酶促褐变反应——美拉德反应的早期产物,通常为弱黄色或无色,可导致膜液色泽的改变,然而,在4 ℃储藏完成后,初始pH值为7.2的蛋白质溶液中的乳糖含量可以忽略不计,该条件不利于发生美拉德反应,因此非酶促褐变的影响作用不大。
此外,样品的脂肪较低,也可排除任何可能的脂质过氧化变色的假设。由此可以推论,观察到的颜色变化或许是由于扩散到液体中的等离子体与乳清蛋白溶液之间的反应所致。在Plasma处理期间,当施加高电压时,放电产生了能够分解氧分子的高能电子,单重态的氧原子与分子氧(O2)结合形成![]() 臭氧是Plasma处理产生的化学性质最活跃的物质之一,因其具有相对长的半衰期和高氧化电位(2.07 V)。除臭氧外,等离子体源会产生激发态的氮物质(NO和NOx),它可以扩散到液体介质中与蛋白质反应产生硝酸和亚硝酸[25]。
臭氧是Plasma处理产生的化学性质最活跃的物质之一,因其具有相对长的半衰期和高氧化电位(2.07 V)。除臭氧外,等离子体源会产生激发态的氮物质(NO和NOx),它可以扩散到液体介质中与蛋白质反应产生硝酸和亚硝酸[25]。
2.1.2 pH值的变化
由图2可知,Plasma处理后pH值先上升后下降,处理20 min后,成膜溶液pH开始下降,并且有不断下降的趋势。
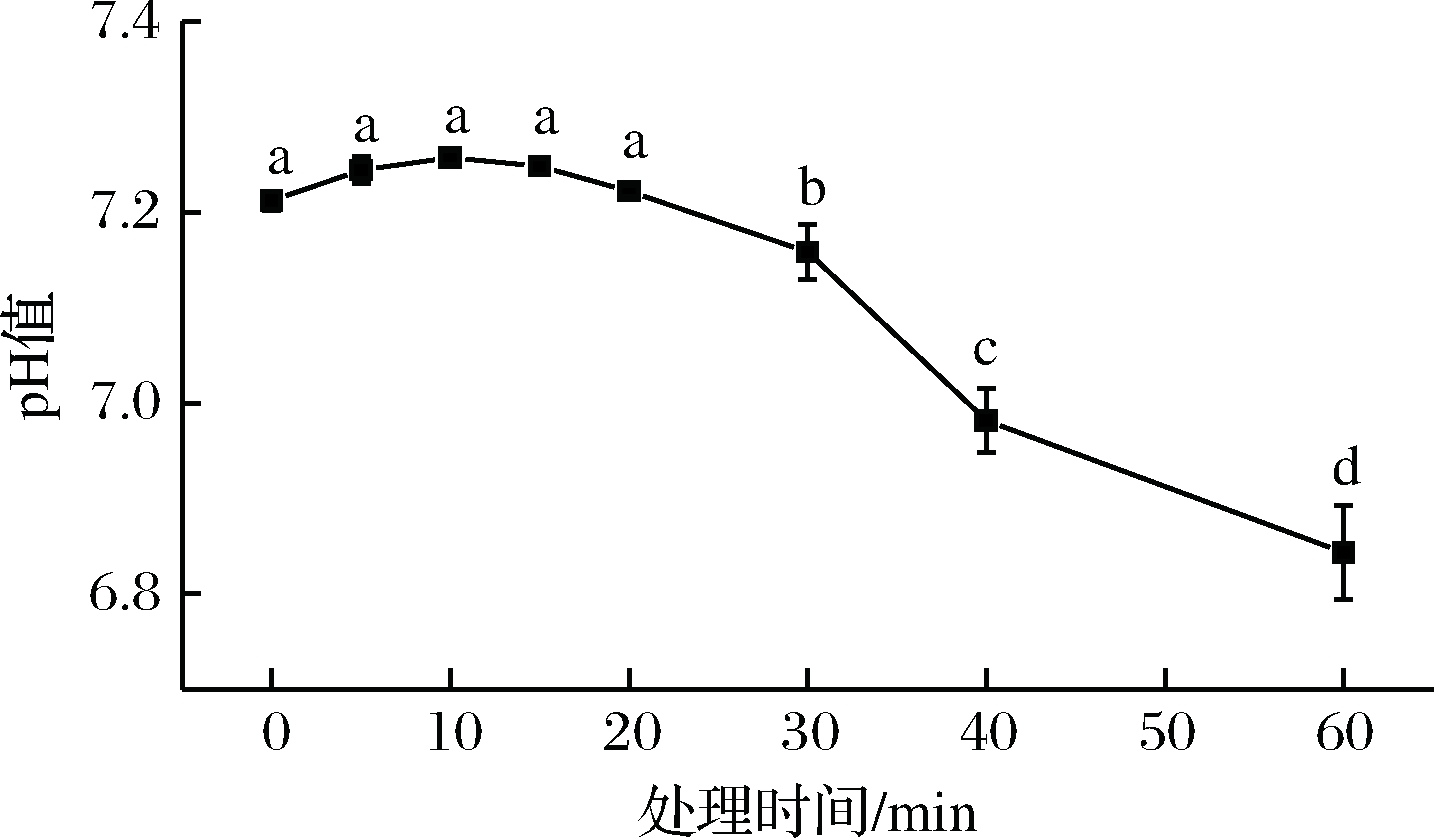
图2 溶液pH值的变化
Fig.2 Change in pH of solution
Plasma处理的前10 min,溶液pH值轻微上升。这可能是由于Plasma处理液体产生的活性氧和活性氮以及等离子体产生的电子与溶液中的大量水分碰撞形成的羟基,使得蛋白质氧化,改变了蛋白质的二级结构,蛋白质肽链断裂,产生游离的氨基,导致溶液pH上升[26]。
蛋白基成膜溶液的酸化可以解释为亚硝酸(HNO2)和硝酸(HNO3)从NO到NO2的过程而导致的结果,以及离子通过水分子与过氧化氢(H2O2)在空气或液体中反应产生酸性H3O+[27-28]。除此之外,Plasma处理液体的酸度差异可能由若干因素引起,包括处理的体积、处理时间、缓冲能力、等离子体源和诱导剂气体的类型等。
2.1.3 粒度的变化
如图3所示,D[4,3]、Dv(90)有明显的差异与起伏(P<0.05)。
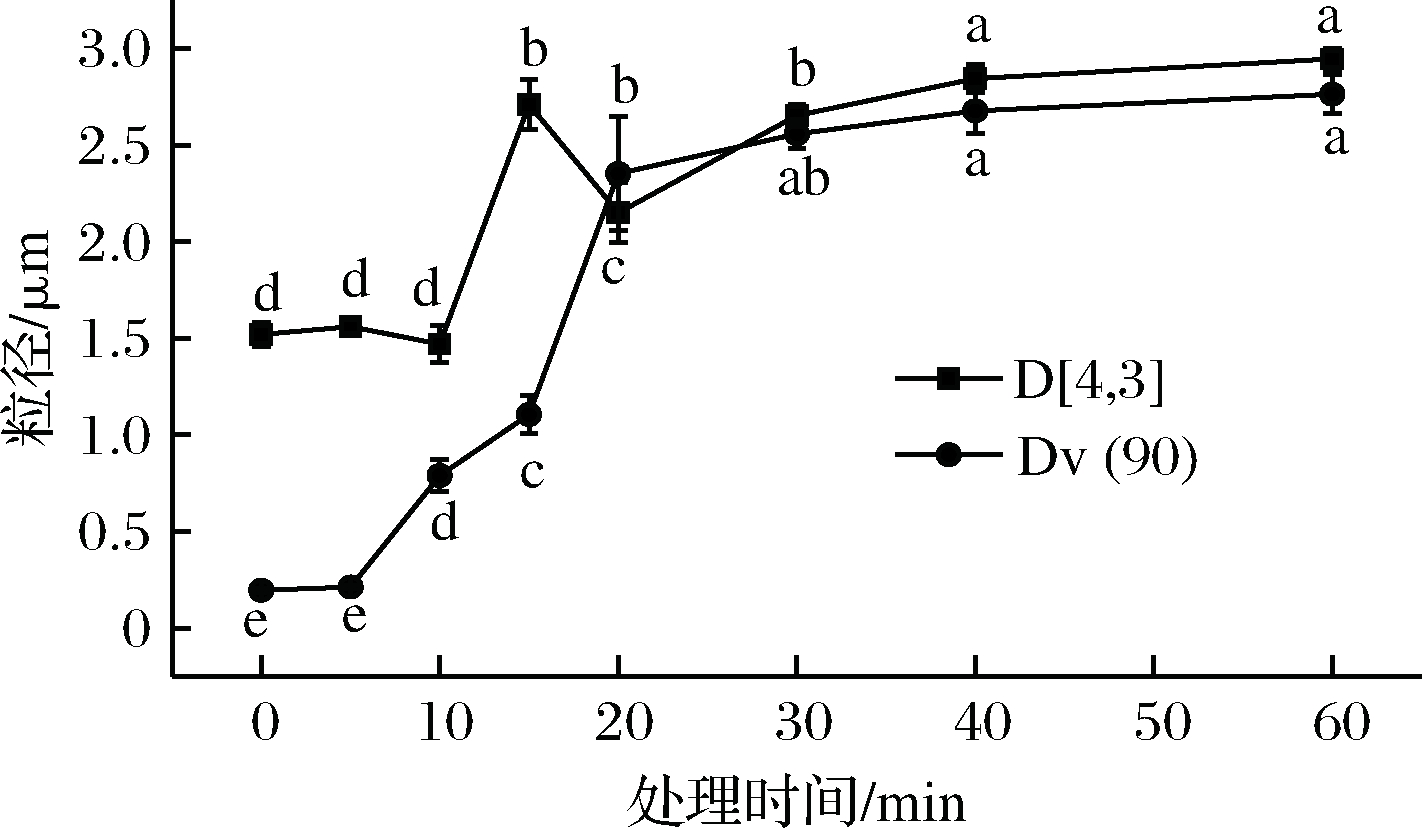
图3 溶液的粒度变化
Fig.3 Change in particle size of solution
与对照样品相比,成膜溶液平均粒度的变化在Plasma处理5 min之内时无显著差异(P>0.05)。当处理时间超过10 min后,其颗粒尺寸和多分散指数都发生了变化,尺寸参数显著提高,溶液中的大体积粒子的比例逐步上升这可能是由于成膜溶液中蛋白质折叠展开和蛋白质间的网络形成造成的。并且D[4,3]表示体积加权平均粒径,此值对大颗粒存在敏感[13],Dv(90)的数值随着处理时间的延长而逐步增大,这与D[4,3]数值先平稳后陡增的变化有所不同。等离子处理使得成膜溶液中的蛋白质颗粒相互撞击,蛋白质结构展开并且相互连接,重聚形成了更大的蛋白质粒子,此过程需要一定的时间积累,所以处理前期并无大幅变化。
2.1.4 蛋白质羰基的变化
蛋白质氧化可产生氨基酸残基侧链修饰和蛋白质多肽主链变化,导致蛋白质片段化、交联、展开和构象变化。为了确定蛋白质氧化的程度,采用测定蛋白质结合的羰基的量来定量。
结果如图4所示,Plasma处理导致蛋白质羰基含量的大幅增加。未经处理的成膜溶液含有少量羰基。Plasma处理后,羰基数值急剧增加;但是,延长处理时间(30 min后)并未导致羰基含量的显着增加(P>0.05)。
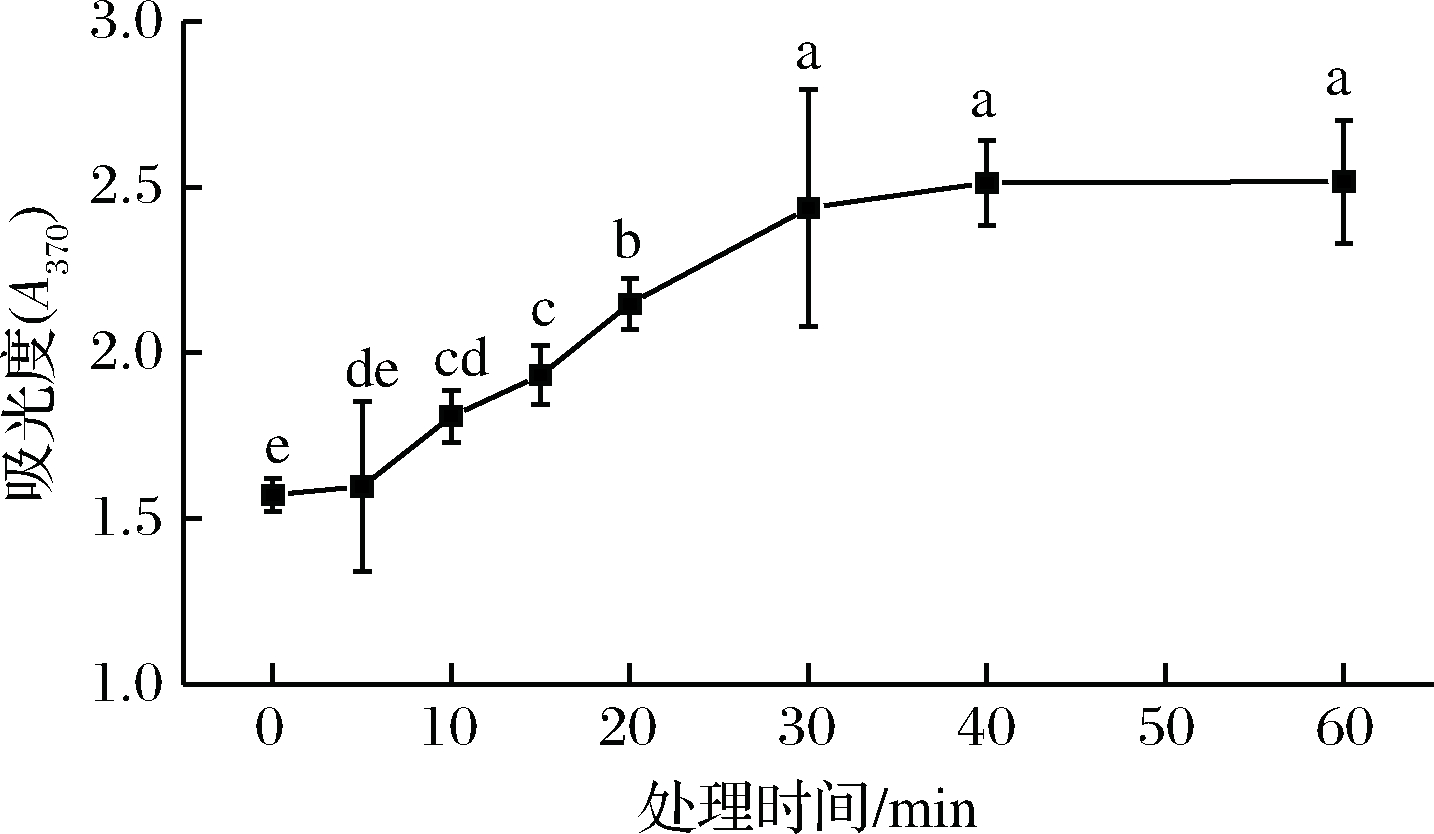
图4 蛋白质羰基的变化
Fig.4 Change in protein carbonyl groups
羰基的形成可以归因于许多氨基酸侧链基团的修饰,尤其是通过亚氨基、氨基和肽键裂解修饰。此外,有研究表明,蛋白质羰基的形成与温度有关[29]。因此,Plasma中的反应性物质和温度升高对蛋白质的形成具有协同作用,使得羰基含量增加。
2.1.5 游离巯基的变化
含硫氨基酸侧链极易被氧化,Plasma处理可以触发巯基等氨基酸残基侧链的许多变化。图5显示了未经Plasma处理和经处理的成膜溶液中蛋白质游离巯基的含量。结果表明,在处理的前几分钟内巯基含量急剧降低,而在10~15 min之后下降速度变缓慢。这可以说明Plasma处理导致蛋白质氨基酸中巯基基团的丢失。巯基基团的减少可能是由于巯基被氧化为二硫键和不可逆地形成了磺酸衍生物[30]。

图5 游离巯基的变化
Fig.5 Change in free sulfhydryl groups
2.1.6 溶液表面张力的变化
图6为蛋白质溶液接触角变化的影像图。接触角与表面张力之间为线性关系,接触角越小,溶液的表面张力也就越低。

图6 成膜溶液滴加在PE薄膜上的接触角影像
Fig.6 Contact angle image of solution with different treatment time on PE film
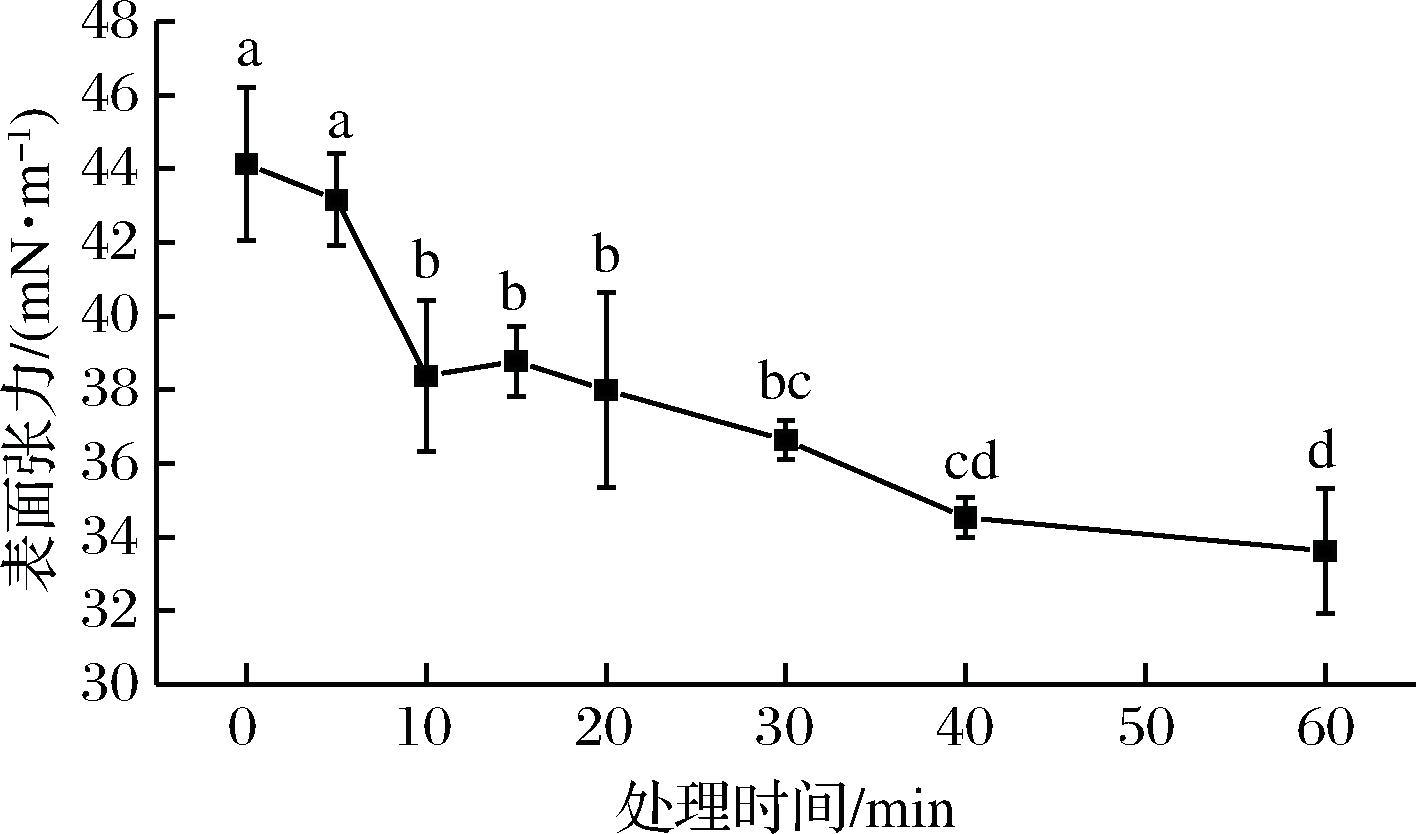
图7 溶液表面张力的变化
Fig.7 Change in surface tension of solution
计算获得的表面张力数据如图7所示。实验结果显示,Plasma处理的前5 min,膜液表面张力值有轻微的下降,并且在10~20 min时下降程度不显著(P>0.05)。在5~10 min以及20 min之后的处理时间范围,表面张力有明显的下降(P<0.05),其疏水性显著提高。
成膜溶液中的酪蛋白酸钠具有特殊的疏水性,有降低成膜溶液表面张力的作用。Plasma处理造成了蛋白质在液体界面的吸附聚合,并通过分子间的相互作用在界面上形成连续的薄膜,从而赋予界面结构刚性。蛋白质分子扩散吸附的速率、分子间相互作用和堆积形成络合物或结构转化都是影响溶液表面张力的因素。
2.1.7 发泡性能的变化
如图8所示, 在Plasma处理的前5 min,泡沫产生的能力显著提升(P<0.05),因该阶段蛋白质延展,构象灵活,能够分散吸附于空气-水界面,形成泡沫。其展开和部分表面变性涉及蛋白质结构修饰,膜液中分子重排以获得最低的自由能构象。然而,随着Plasma处理时间的延长,膜液的发泡能力有所下降,这可能是由于蛋白质中聚集体的形成,在泡沫形成中产生了反作用。
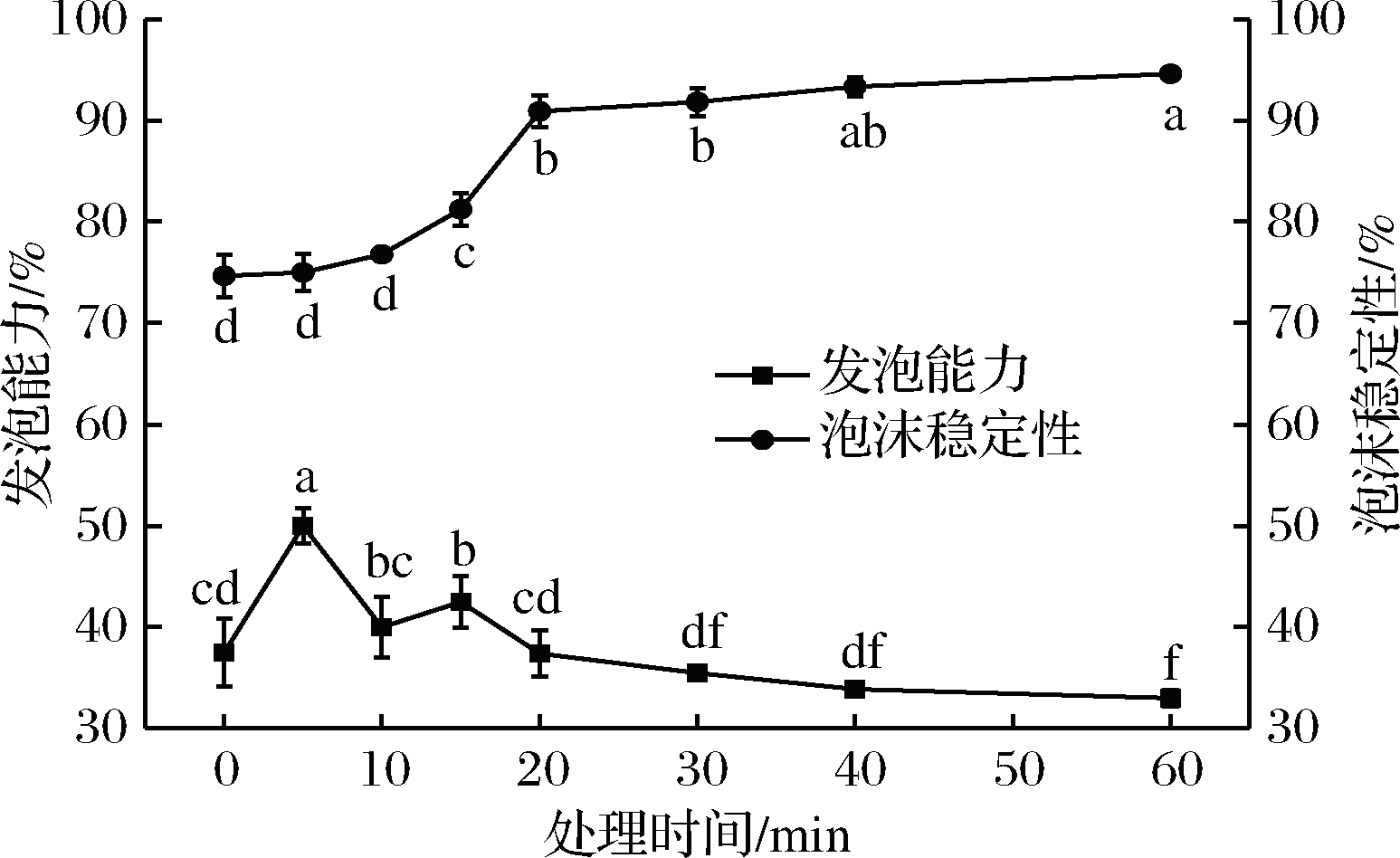
图8 溶液的发泡性能与泡沫稳定性的变化
Fig.8 Change in the foaming capacity and foaming stability of solution
蛋白质吸附层的形成是泡沫形成及稳定的关键[31]。为了形成吸附层,蛋白质分子需要扩散到空气-水界面,并转化为吸附状态。蛋白质更快地扩散和吸附到界面上,会产生更高的发泡能力。颗粒大小也是影响蛋白质在空气-水界面扩散和吸附的重要因素,蛋白质扩散速率与粒径呈负相关,结合图4可知,随着处理时间的延长,溶液的粒度逐步增大,因而与之相对应的发泡能力有降低的倾向。
同时,随着Plasma处理时间的延长,溶液的泡沫稳定性显著提高(P<0.05),发泡能力和发泡稳定性之间的变化趋势相反。长时间Plasma处理后增强的泡沫稳定性可以通过蛋白质的氧化和蛋白质链之间的共价键的形成来解释。界面表面弹性与泡沫稳定性高度相关,高表面弹性使泡沫稳定性得以改善,界面膜变得抗性更强并且构成了抵御气泡破裂和聚结的机械屏障。因此,Plasma处理导致的泡沫稳定性提高,可能是蛋白质聚集体形成的结果,蛋白质由于强分子间交联和高填充密度而产生高弹性的界面膜[32],此结果与SEGAT等[11]研究的结果一致。
2.1.8 乳化性能的变化
Plasma处理前期,乳液稳定性无较大变化(图9),处理10 min后,EAI值显著上升(P<0.05),表明乳液的稳定性逐步增强,蛋白质溶液的乳化性能逐渐提高,并且该曲线与溶液发泡稳定性曲线存在较强的相关性。而随着处理时间的进一步延长(20 min后)EAI值呈下降趋势。
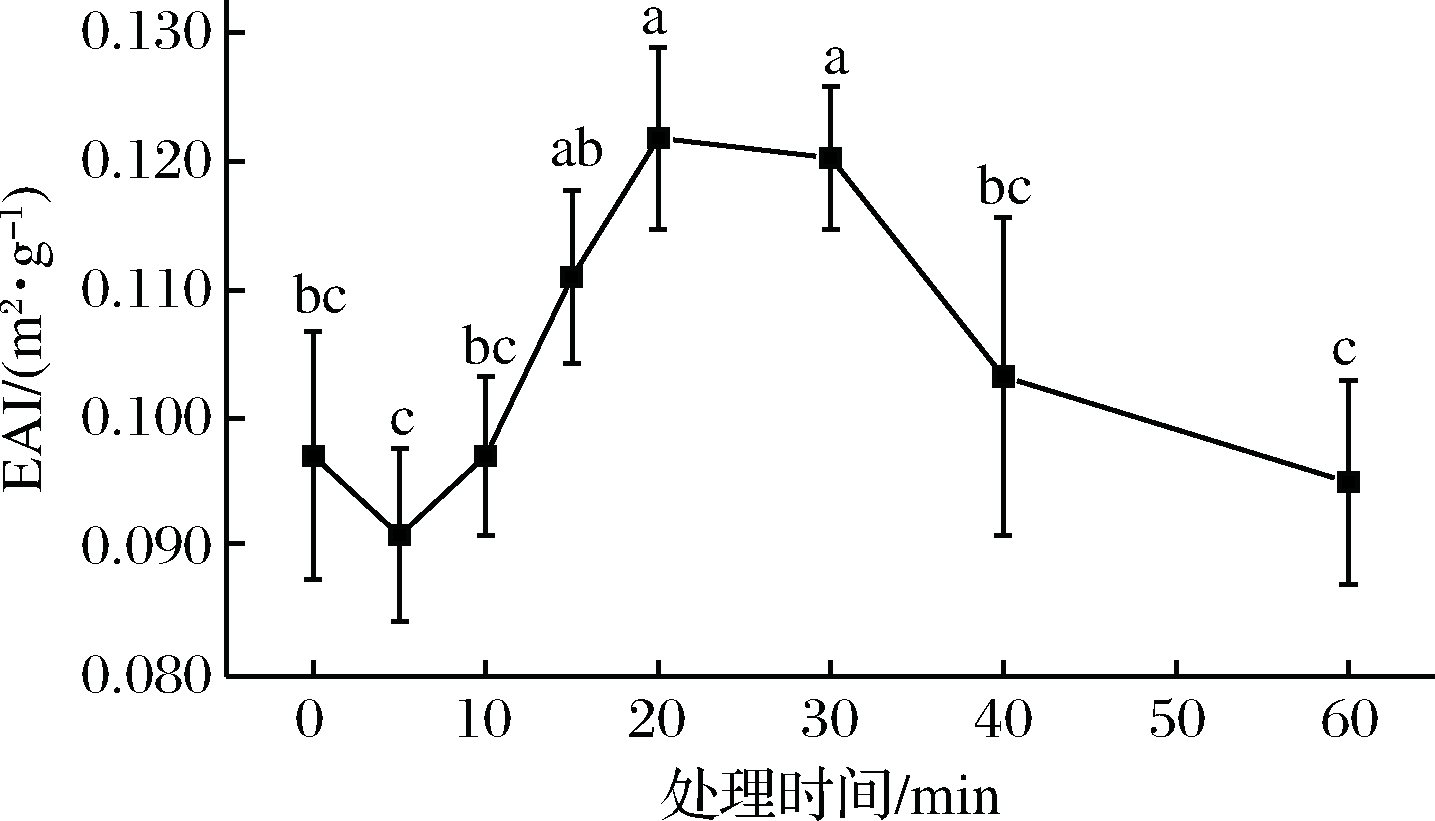
图9 溶液EAI值的变化
Fig.9 Change in EAI values of solution
Plasma处理期间乳化能力的提高,是蛋白质分子的疏水基团暴露引起的表面疏水性的增强的结果。蛋白质包含亲水和疏水氨基酸残基,后者通常隐藏在蛋白质的内部区域,而前者残基位于表面。由于疏水性氨基酸在蛋白质表面的暴露,表面疏水性提高。研究发现氧化是影响蛋白质表面疏水性的重要因素,蛋白质被氧化后,埋藏的疏水性氨基酸在表面展露,Plasma处理过程中产生的活性自由基会导致蛋白质的氧化[33],从而提高了蛋白质表面的疏水性。此外,蛋白基成膜溶液中存在的大量水分子与等离子体产生的电子碰撞形成羟基自由基[34],也造成了蛋白质的氧化。
Plasma处理超过20 min后乳化能力降低,可以解释为由于严重氧化而在氨基酸链之间形成聚集体,导致乳化能力下降。在轻度至中度氧化速率(羰基含量较低)下可能导致蛋白质部分展开和变性,进而可能提高乳化能力。而在较高的氧化速率(羰基含量较高)下,聚集体的形成可能会导致蛋白质功能受损[35]。
此外,成膜溶液中的乳清蛋白和甘油单酯被吸附到油-水界面上,其相互作用也影响了乳液的物理化学性质、乳液的稳定性和氧化稳定性。成膜溶液中的酪蛋白酸钠是一种食品级的乳化剂,在油-水界面提供了良好的物理屏障,抑制了促氧化剂由水相渗透到油相,也进一步改善了乳液的物理和氧化稳定性。
2.2 蛋白基薄膜性能变化
2.2.1 机械性能的变化
由图10可知,5 min处理组的抗拉强度减小,断裂伸长率增大,而长时间(10 min后)对成膜溶液的Plasma处理显着增加了薄膜的抗拉强度,降低了薄膜的断裂伸长率(P<0.05)。
可食用薄膜的结构会影响其对等离子处理的结果。短时间的处理使得蛋白质结构展开,降低了其结构的抗性,而长时间的处理会聚集蛋白质分子。乳清分离蛋白由不同的必需氨基酸组成,例如缬氨酸、异亮氨酸和半胱氨酸,因此,巯基是聚合物中分子二硫键突出的主要基团。游离巯基的减少表明形成了交联的二硫键,从而增加了蛋白质的聚集,与完整蛋白质相比,蛋白质聚集体的柔韧性较低,并且构象稳定性更高。因此蛋白质氧化产生的聚合和交联可以被认为是提高膜的拉伸强度以及降低薄膜断裂伸长率的重要因素[7]。

图10 薄膜抗拉强度(TS)和断裂伸长率(E)的变化
Fig.10 Change in tensile strength(TS)and elongation at break(E)of film
2.2.2 光学性能的变化
由表1可知,Plasma处理组制得薄膜的透光率有所降低,雾度上升。产生这一结果可能是由于随着处理时间的增加蛋白质分子颗粒尺寸变大(粒径增长至原来的2倍),并且聚集的大分子蛋白质增加了光散射,降低了薄膜的透光率,提高了雾度。
表1 薄膜透光率及雾度的变化
Table 1 Change in light transmittance and haze of film
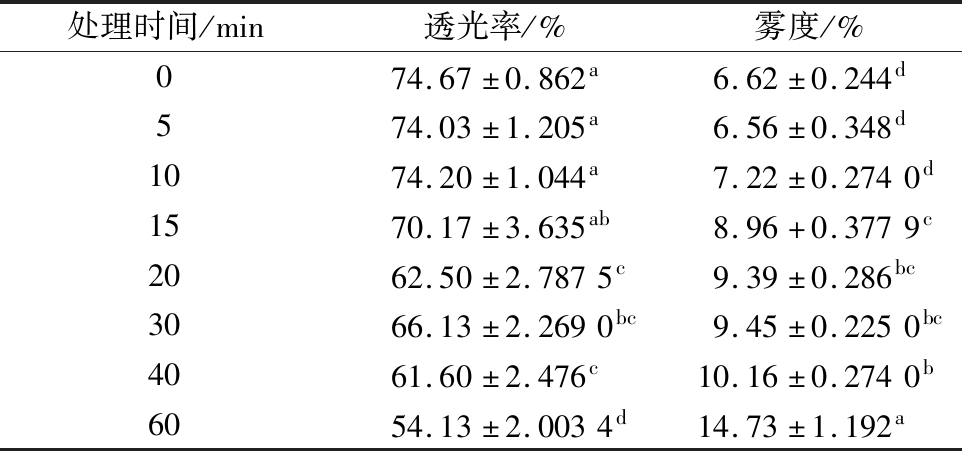
处理时间/min透光率/%雾度/%074.67±0.862a6.62±0.244d574.03±1.205a6.56±0.348d1074.20±1.044a7.22±0.2740d1570.17±3.635ab8.96+0.3779c2062.50±2.7875c9.39±0.286bc3066.13±2.2690bc9.45±0.2250bc4061.60±2.476c10.16±0.2740b6054.13±2.0034d14.73±1.192a
注:同一列不同小写字母表示具有显著性差异(P<0.05)
2.2.3 透湿性能和水溶性的变化
如图11所示,Plasma处理后的成膜溶液所制备的复合薄膜,其水蒸气透过系数以及水溶性显著降低(P<0.05)。由此可以看出,Plasma处理成膜溶液具有降低薄膜水蒸气渗透性和水溶性的能力,这可能是由于处理过程中羟基自由基与其他反应性物质的形成,使得肽和二硫键裂解氧化了氨基酸链,产生交联反应。此外表面水分减少以及蛋白质序列中氨基酸的疏水位点的暴露也使得薄膜降低了对水的敏感性[36]。
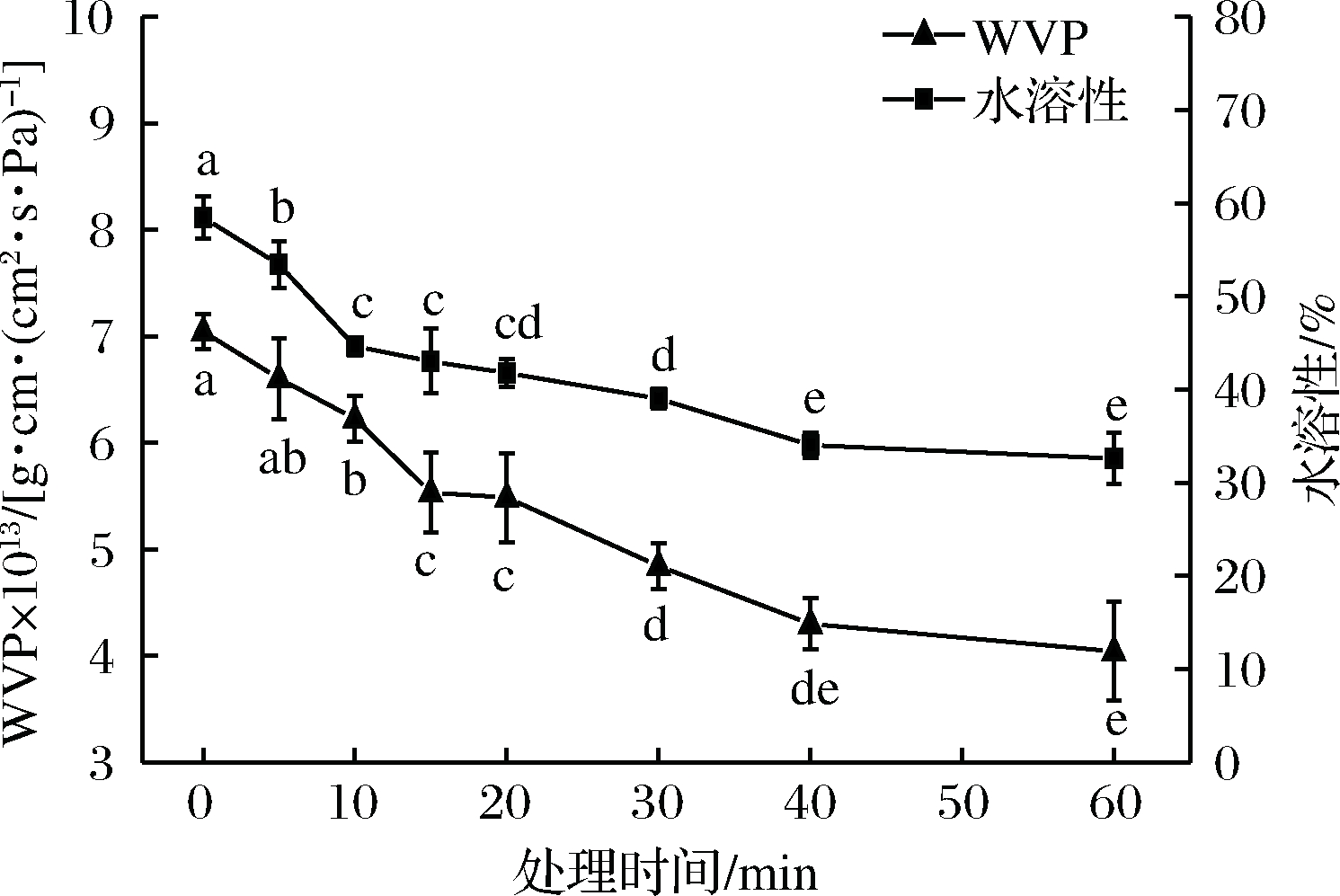
图11 薄膜水蒸气透过系数(WVP)的变化
Fig.11 Change in water vapor permeability(WVP)of film
2.2.4 透氧性能的变化
如图12所示,当处理时间超过15 min时,制得薄膜的氧气透过率开始显著下降(P<0.05),在Plasma处理60 min成膜溶液之后,制备所得的薄膜的氧气透过率降低至0.53 cc/(m2·d),相比于未处理组,其氧气透过率降低了一半。Plasma处理后蛋白质的交联是改善蛋白基薄膜的氧气阻隔性能的主要原因,聚合物链之间的交联量的增加导致聚合物链之间的自由体积减小,因此,氧分子的扩散减少[37]。

图12 薄膜氧气透过率的变化
Fig.12 Change in oxygen transmission rate of film
3 结论
Plasma处理对WPI-NaCas-GLY成膜溶液的性能有显著影响作用。研究结果显示,在Plasma处理过程中,臭氧和其他活性氧以及氮物质的形成使得成膜溶液黄度有所增强,与此同时由于他们的作用,成膜溶液pH值呈先上升后下降的变化趋势,显示其在处理中逐步酸化。延长Plasma处理时间,成膜溶液中蛋白质羰基不断增加,游离巯基不断减少,蛋白质氧化程度加深,溶液中蛋白质结构展开并重聚形成大尺寸的蛋白质粒子,随着蛋白质颗粒的扩散与吸附,蛋白质聚合体形成,使得单位面积油-水界面上的蛋白质聚合物增加,降低了其界面表面张力,溶液发泡能力下降,此外,溶液中蛋白质的聚集和氧化使溶液泡沫稳定性得以显著提升(P<0.05),在Plasma处理20 min时,溶液乳化能力表现为最佳。
经Plasma处理后的成膜溶液制备所得WPI-NaCas-GLY复合膜拥有相对较高的抗拉强度、较低的断裂伸长率以及透光率,其氧气透过率、水蒸气透过率以及水溶性均有所降低。由此得出,利用Plasma对复合蛋白基成膜溶液进行适时处理,能够有效改善成膜溶液的疏水性、发泡性和乳化能力,并得到机械性能较强、阻隔性良好的复合蛋白膜。
[1] CHEN G Y, LEI Q. Research on preparation and properties of edible composite protein films[J]. Applied Mechanics and Materials, 2011, 87:213-222.
[2] 张玉亭, 雷桥, 包建强, 等. 乳清蛋白抗菌薄膜中山梨酸钾的扩散性研究[J]. 食品工业科技, 2015, 36(13): 262-265.
[3] JIANG S J, ZHANG X, MA Y, et al. Characterization of whey protein-carboxymethylated chitosan composite films with and without transglutaminase treatment[J]. Carbohydrate Polymers, 2016, 153: 153-159.
[4] 寻倩男, 雷桥, 包建强, 等. 明胶-酪蛋白酸钠可食性膜的包装性能研究[J]. 包装工程, 2013(15): 40-45.
[5] TONYALI B, CIKRIKCI S, OZTOP M H. Physicochemical and microstructural characterization of gum tragacanth added whey protein based films[J]. Food Research International, 2018, 105:1-9.
[6] 种晓, 雷桥, 郄梓含. 静态超高压处理对抗菌复合蛋白薄膜的改性研究[J]. 食品工业科技, 2018, 39(22): 56-61;68.
[7] ATEFEH SHARIFIAN, NAFISEH SOLTANIZADEH, ROUZBEH ABBASZADEH. Effects of dielectric barrier discharge plasma on the physicochemical and functional properties of myofibrillar proteins[J]. Innovative Food Science & Emerging Technologies, 2019, 54: 1-8.
[8] TAKAI E, KITAMURA T, KUWABARA J, et al. Chemical modification of amino acids by atmospheric-pressure cold plasma in aqueous solution[J]. Journal of Physics D: Applied Physics, 2014, 47(28): 285 403.
[9] ROMANI VIVIANE PATR CIA, BRADLEY O, PINTO C M, et al. Improvement of fish protein films properties for food packaging through glow discharge plasma application[J]. Food Hydrocolloids, 2018, 87: 970-976.
CIA, BRADLEY O, PINTO C M, et al. Improvement of fish protein films properties for food packaging through glow discharge plasma application[J]. Food Hydrocolloids, 2018, 87: 970-976.
[10] GEZER P G, BRODSKY S, HSIAO A, et al. Modification of the hydrophilic/hydrophobic characteristic of zein film surfaces by contact with oxygen Plasma treated PDMS and oleic acid content[J]. Colloids and Surfaces B: Biointerfaces, 2015, 135: 433-440.
[11] SEGAT A, MISRA N, CULLEN P, et al. Atmospheric pressure cold plasma (ACP) treatment of whey protein isolate model solution[J]. Innovative Food Science & Emerging Technologies, 2015, 29: 247-254.
[12] CHEN G Y, LEI Q. Research on preparation and properties of edible composite protein films[J]. Applied Mechanics and Manufacturing Technology, 2011, 87: 213-222.
[13] 陈丹丹, 张晨夕, 徐禄. 马尔文MS3000粒度仪在碳酸钙粒径分析中的应用[J]. 黑龙江造纸, 2018, 46(1): 32-34.
[14] LEVINE R L, GARLAND D, OLIVER C N, et al. Determination of carbonyl content in oxidatively modified proteins[J]. Methods in Enzymology, 1990, 186: 464-478.
[15] BEVERIDGE T, TOMA S J, NAKAI S. Determination of SH-and SS-groups in some food proteins using Ellman′s reagent[J]. Journal of Food Science, 2006, 39(1): 49-51.
[16] 朱力杰, 张馨心, 刘秀英, 等. 界面扩张流变学性质在食品组分相互作用中的研究进展[J]. 食品工业科技, 2017, 38(11): 363-368.
[17] ONODENALORE A, FEREIDOONSHAHIDI. Protein Dispersions and Hydrolysates from Shark (Isurus oxyrinchus)[J]. Journal of Aquatic Food Product Technology, 1996, 5(4): 43-59.
[18] THIANSILAKUL Y, BENJAKUL S, SHAHIDI F. Compositions, functional properties and antioxidative activity of protein hydrolysates prepared from round scad (Decapterus maruadsi)[J]. Food Chemistry, 2007, 103(4): 1 385-1 394.
[19] SUKYAI P, ANONGJANYA P, BUNYAHWUTHAKUL N, et al. Effect of cellulose nanocrystals from sugarcane bagasse on whey protein isolate-based films[J]. Food Research International, 2018, 107: 528-535.
[20] ASTM D1003-61, 1997. Standard Test Method for Haze and Luminous Transmittance of Transparent Plastics[S].
[21] ASTM E-398, 2003. Standard Test Method for Water Vapor Transmission Rate of Sheet Materials Using Dynamic Relative Humidity Measurement[S].
[22] CARVALHO R A D, GROSSO C R F. Characterization of gelatin based films modified with transglutaminase, glyoxal and formaldehyde[J]. Food Hydrocolloids, 2004, 18(5): 717-726.
[23] GOUNGA M E, XU S Y, WANG Z. Whey protein isolate-based edible films as affected by protein concentration, glycerol ratio and pullulan addition in film formation[J]. Journal of Food Engineering, 2007, 83(4): 521-530.
[24] MISRA N N, ZUIZINA D, CULLEN P J, et al. Characterization of a novel atmospheric air cold plasma system for treatment of packaged biomaterials[J]. Transactions of the ASABE, 2013, 56(3): 1 011-1 016.
[25] LAROUSSI M, LEIPOLD F. Evaluation of the roles of reactive species, heat, and UV radiation in the inactivation of bacterial cells by air plasmas at atmospheric pressure[J]. International Journal of Mass Spectrometry, 2003, 233(1): 81-86.
[26] MISRA N N, KAUR S, TIWARI B K, et al. Atmospheric pressure cold plasma (ACP) treatment of wheat flour[J]. Food Hydrocolloids, 2015, 44:115-121.
[27] OEHMIGEN K, H HNEL M, BRANDENBURG R, et al. The role of acidification for antimicrobial activity of atmospheric pressure plasma in liquids[J]. Plasma Processes & Polymers, 2010, 7(3-4): 250-257.
HNEL M, BRANDENBURG R, et al. The role of acidification for antimicrobial activity of atmospheric pressure plasma in liquids[J]. Plasma Processes & Polymers, 2010, 7(3-4): 250-257.
[28] TRAYLOR M J, PAVLOVICH M J, KARIM S, et al. Long-term antibacterial efficacy of air plasma-activated water[J]. Journal of Physics D: Applied Physics, 2011, 44(47): 472 001.
[29] CUI X, XIONG Y L, KONG B, et al. Hydroxyl radical-stressed whey protein isolate: Chemical and structural properties[J]. Food and Bioprocess Technology, 2012, 5(6): 2 454-2 461.
[30] WEI X F, LIU H Z. Relationship between foaming properties and solution properties of protein/nonionic surfactant mixtures[J]. Journal of Surfactants and Detergents, 2012, 3(4):491-495.
[31] ZHANG T, XUE Y, LI Z, et al. Effects of ozone-induced oxidation on the physicochemical properties of myofibrillar proteins recovered from bighead carp (Hypophthalmichthys nobilis)[J]. Food and Bioprocess Technology, 2015, 8(1): 181-190.
[32] FOEGEDING E A, DAVIS J P. Food protein functionality: A comprehensive approach[J]. Food Hydrocolloids, 2011, 25(8): 1 853-1 864.
[33] KIM H J, YONG H I, PARK S, et al. Effects of dielectric barrier discharge plasma on pathogen inactivation and the physicochemical and sensory characteristics of pork loin[J]. Current Applied Physics, 2013, 13(7): 1 420-1 425.
[34] SURWSKY B,BUBLER S,SCHLÜTER O K.Cold Plasma in Food and Agriculture[M].Salt Lake Clty:Academic Press,2016:179-203.
[35] VOZIYAN P A, METZ T O, BAYNES J W, et al. A post-amadori inhibitor pyridoxamine also inhibits chemical modification of proteins by scavenging carbonyl intermediates of carbohydrate and lipid degradation[J]. Journal of Biological Chemistry, 2002, 277(5): 3 397-3 403.
[36] ROMANI, VIVIANE PATR CIA OLSEN, PINTO COLLARES B, et al. Plasma technology as a tool to decrease the sensitivity to water of fish protein films for food packaging[J]. Food Hydrocolloids, 2019, 94: 210-216.
CIA OLSEN, PINTO COLLARES B, et al. Plasma technology as a tool to decrease the sensitivity to water of fish protein films for food packaging[J]. Food Hydrocolloids, 2019, 94: 210-216.
[37] MOOSAVI M H, KHANI M R, SHOKRI B, et al. Modifications of protein-based films using cold plasma[J]. International Journal of Biological Macromolecules, 2019, 142: 769-777.