新疆天山北麓地区具有典型的大陆性气候的特点,光热资源丰富,气候条件、土壤、水资源完全满足生产优质葡萄原料的条件,是我国面积最大的酿酒葡萄产区[1-2]。但葡萄采收季节干旱少雨、光照强度高、昼夜温差大,葡萄采后易失水从而造成葡萄中酚类物质的损失,使酿造的葡萄酒糖高、酸低、色泽不稳定[3]。葡萄中的酚类物质主要来源于葡萄皮下组织,是葡萄酒中最主要的有效成分[4-5]。葡萄中酚类物质成分复杂,与葡萄酒的口感、色泽、香气密切相关[6]。葡萄酒中酚类物质变化不仅受到葡萄生长过程的积累,还受葡萄采后运输、加工、贮藏等多方面的影响[7-8]。
葡萄采后酚类物质的降解主要是与氧接触后发生酶促褐变,完整的葡萄果实中,酚类物质主要存在于液泡中,酶促褐变底物多酚氧化酶则存在于细胞质中,两者并未发生接触[9-10]。葡萄采后失水会使葡萄表皮蜡质层及细胞结构发生改变,温度和水分胁迫加速了中果皮细胞的萎缩和调亡,在不同温度水分胁迫下,葡萄采后失水使酚类物质与氧及多酚氧化酶发生反应,导致酚类物质的降解[11]。据报道[12],在7 ℃和35%相对湿度条件下葡萄质量损失达30%和40%时,葡萄失水增加了其糖酸含量及抗氧化活性,影响了葡萄中酚类物质的含量,葡萄采后失水使葡萄品质特性发生变化。在真空条件下,不同温度(50、60、70、80和90 ℃)对葡萄果实处理发现干燥温度对酚类化合物有显著影响,真空干燥后各温度抗氧化活性均降低,结果表明葡萄采后酚类物质变化与失水率、失水温度密切相关[13]。目前葡萄酚类物质的研究主要集中在葡萄成熟、酿造过程中其种类和含量的变化、葡萄酒中酚类物质组成及其与抗氧化活性的关系[14],对于酿酒葡萄采后失水对酚类物质与细胞超微结构的影响研究相对较少。
酿酒葡萄采后失水可应用于酿造甜型、半甜型葡萄酒[15-16],进一步研究葡萄采后失水机理,优化采后失水条件有利于酿造特种加强型葡萄酒。新疆干燥的气候条件易使葡萄发生失水反应,为酿造甜型、半甜型葡萄酒创造了得天独厚的地理优势,目前葡萄采后失水过程中生理变化机制尚不明确,明确葡萄采后失水过程中生理生化机制,为开发新的酿酒工艺及其设备提供必要的数据参考,为促进新疆葡萄酒产业的进一步发展奠定理论依据。
1 材料与方法
1.1 材料与试剂
挑选完全成熟“赤霞珠”葡萄(新疆农业科技园)可溶性固形物质量分数为20%~21%,湿基含水率为77.10%,果实色泽深紫、大小均匀(直径为1.25 mm)、单果平均果质量1.02 g,无病害、无损伤的果实为试验材料。芦丁、没食子酸、单宁酸标准品,美国 Sigma 北京分公司;NaOH、H3PO4、HCl、甲醇、Na2HPO3、无水醋酸钠、NaH2CO4、钨酸钠、磷钼酸、NaNO2、Al(NO3)3、乙醇(分析纯),天津光复科技有限公司;福林肖卡试剂(优级纯),北京索莱宝科技有限公司;Na2HPO4、Na2PO4、丙酮、环氧树脂、戊二醛(分析纯),生工生物(上海)股份有限公司。
1.2 仪器与设备
HR 手持折光仪,上海仪迈仪器科技有限公司;WB20004 电子天平,上海方瑞仪器有限公司;TU-1810紫外-可见分光光度计,北京普析通用仪器有限责任公司;TGL-16 gR高速冷冻离心机,上海安亭科学仪器厂;UC6超薄切片机,德国徕卡(Leica)仪器有限公司;JEOLM-1230透射电镜,日本电子株式会社;DHG-9123A电热恒温鼓风干燥箱,上海一恒科技有限公司;CS101型电热恒温恒湿干燥箱,乌鲁木齐电器设备制造厂,经本实验室改造后,可对样品质量进行实时自动检测和显示。
1.3 试验方法
1.3.1 样品的制备
所取样品随机分为15组,每组2 kg,将各组葡萄平铺于干燥箱中,分别在温度25 ℃和45 ℃,相对湿度<20%,风速1 m/s条件下进行失水处理,分别在12、24、36、48、72 h时取样并测定各项指标。另根据失水过程中的质量,分别在质量损失20%、40%、60%时取样,以备于葡萄皮超微结构的观察。
1.3.2 葡萄皮中酚类物质的提取
采用超声辅助法进行提取,准确称取3.00 g葡萄皮,用30 mL酸化甲醇溶液(1 mol/L HCl-甲醇-水,体积比1∶80∶19),在100 W、25 ℃功率条件下超声辅助提取30 min,然后8 000 r/min, 4 ℃离心15 min,收集上清液,重复3次,合并提取液。
1.3.3 葡萄皮中酚类物质的测定
采用手持折光仪测定可溶性固形物含量;总酚含量测定采用福林-肖卡法[17];总花色苷含量测定采用pH示差法[18];总黄酮的测定[19];单宁含量的测定采用福林-丹尼斯法[17]。
1.3.4 葡萄皮超微结构观察
用双面刀片将“赤霞珠”葡萄果皮切成1 mm×1 mm×2 mm大小的块,用4%戊二醛(0.1 mol/L磷酸缓冲液配制,pH 7.2)在4 ℃下前固定2 h。用pH 7.2的磷酸缓冲液漂洗3次,每次15 min。用1%锇酸(磷酸缓冲配制)4 ℃后固定2 h,用磷酸缓冲冲洗漂洗3次,每次30 min。用50%、70%、80%、90%、100%丙酮梯度脱水,各级30 min。环氧树脂EPon-812渗透包埋,37 ℃烘箱聚合12 h后,于45 ℃聚合12 h,最后在60 ℃下聚合24 h。用超薄切片机切成60 nm的薄片,再经铅铀电子染色后,透射电镜观察拍照。
1.3.5 数据统计分析
实验数据采用Origin 8.5软件作图,并采用SPSS 20.0软件进行单因素方差分析和相关性分析,采用邓肯氏多重比较法进行差异分析,P<0.05表示差异显著。
2 结果与分析
2.1 葡萄采后失水对可溶性固形物含量的影响
葡萄在采后失水过程中重量下降,可溶性固形物含量上升。由图1可知,采后新鲜葡萄果实葡萄总重为2 kg,可溶性固形物为28.1 °Brix,25 ℃和45 ℃失水72 h后,总质量分别为1.76、1.47 kg,可溶性固形物分别为32.4 °Brix、41.1 °Brix,随着葡萄采后失水处理时间的延长,葡萄发生失水及代谢反应,导致葡萄质量在不断下降,整个失水过程中,45 ℃葡萄失水量。大于25 ℃处理组葡萄失水量葡萄在失水过程中,可溶性固形物含量整体呈现不断上升趋势,0~24 h处理中25 ℃组和45 ℃组处理可溶性固形物含量升趋势基本一致,24 h后45 ℃处理组上升速率显著大于25 ℃处理组。
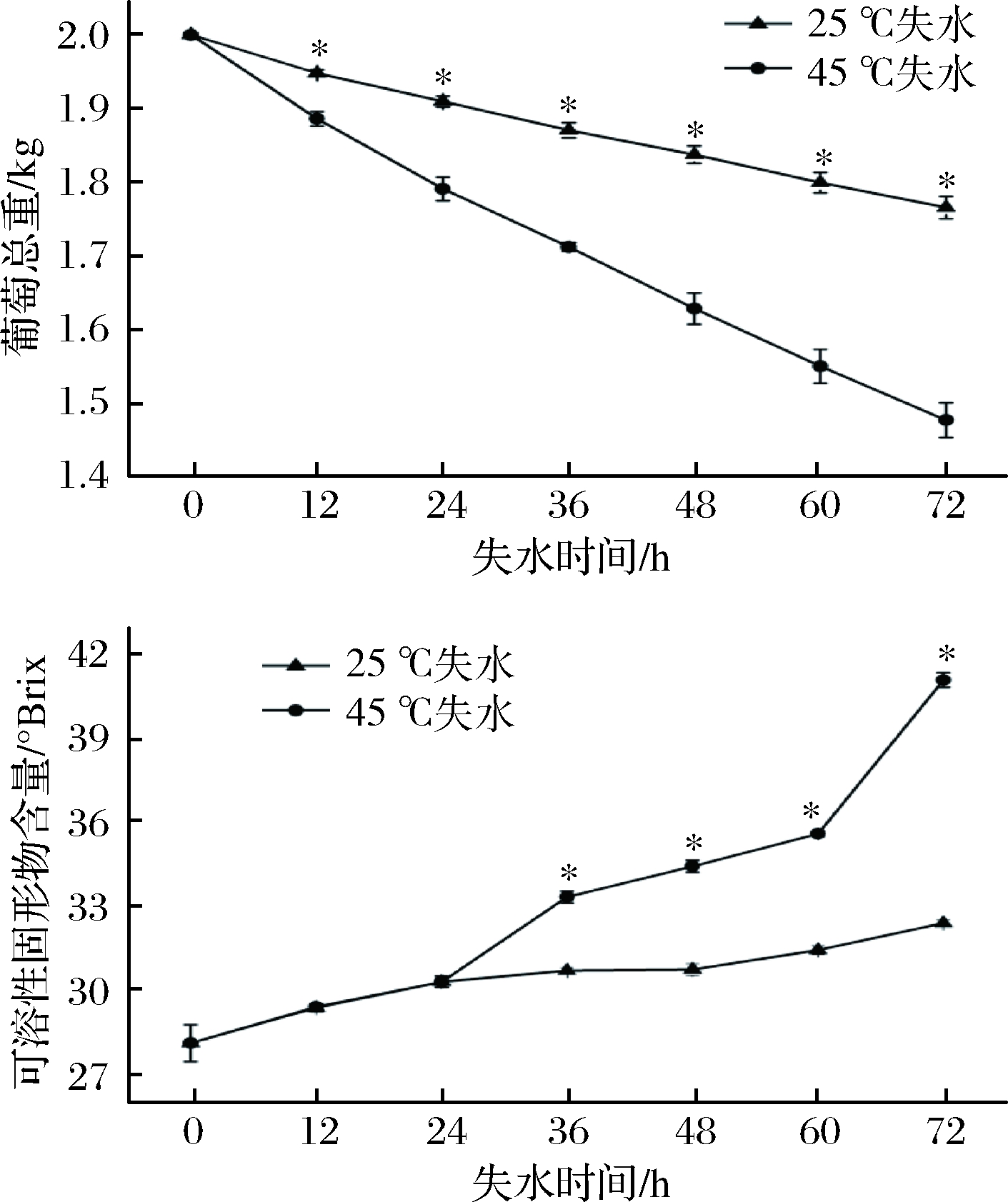
图1 葡萄采后失水对总重和可溶性固形物含量的影响
Fig.1 Effect of postharvest dehydration on total weight and soluble solid content of grape
注:*表示差异显著(P<0.05)(下同)
2.2 葡萄采后失水对皮中总酚含量的影响
酚类物质与葡萄的色泽、品质和风味等作用密切相关,对葡萄的贮藏、加工性能、营养价值和医疗保健作用都具有重要影响。由图2可知,采后新鲜葡萄果实皮中总酚含量为21.70 mg/g,随着葡萄采后失水处理时间的延长,0~12 h葡萄总酚含量呈现上升趋势,12 h后25 ℃和45 ℃处理组均呈现下降的趋势,且45 ℃处理组总酚含量下降速率显著大于25 ℃处理组,72 h时均达到最小值,分别为27.97 mg/g和14.32 mg/g,CK、25 ℃处理组在72 h时的总酚含量是45 ℃处理组的1.93和1.95倍。总酚含量随着失水处理整体呈现先上升后下降的趋势。有研究表明,20 ℃葡萄采后失水10%时白藜芦醇和儿茶素含量显著增加;失水20%时酚酸含量显著增加;花色苷在10 ℃和20 ℃显著增加,在30 ℃时下降;PPO酶活在10 ℃时活性持续时间较长,在20 ℃和30 ℃时活性持续下降;苯丙烷代谢相关酶活基因在10 ℃时表达上调,在30 ℃时表达下调。说明葡萄中酚类物质变化在采后失水中受温度影响较大[20]。
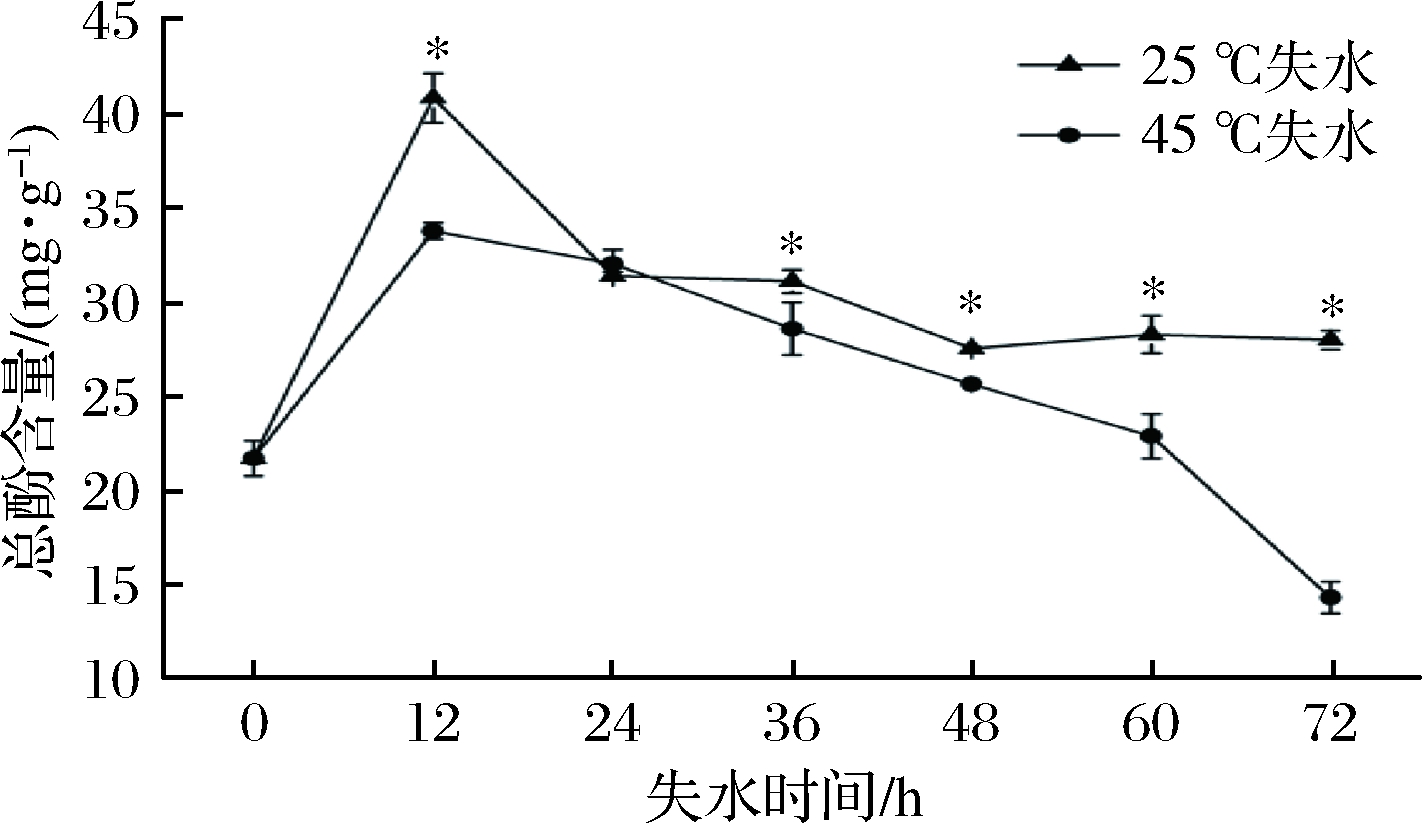
图2 葡萄采后失水对皮中总酚含量的影响
Fig.2 Effect of postharvest dehydration on total phenolics content in the skin
2.3 葡萄采后失水对皮中花色苷含量的影响
花色苷是葡萄酒中的主要呈色物质,对葡萄酒色泽至关重要[21-22]。花色苷稳定性受温度影响非常大,并且花色苷的热稳定性与其结构、pH、氧以及体系中其他化合物的反应有关。当温度升高时,花色苷转化为无色的查尔酮和甲醇假碱,最后查尔酮迅速降解,生成苯甲酸及2,4,6-三羟基苯甲醛等终产物[23-24]。由图3可知,采后新鲜葡萄果实皮中花色苷含量为3.38 mg/g,随着葡萄采后失水处理时间的延长,0~12 h葡萄25 ℃处理呈现先上升后下降的趋势,45 ℃处理在0~24 h时花色苷含量变化无显著性差异,24 h后呈现下降的趋势,且45 ℃处理下降速率总体显著大于25 ℃处理组,其中,25 ℃失水处理在48 h达到最小值2.61 mg/g。45 ℃失水处理在72 h达到最小值0.73 mg/g,花色苷含量随着失水处理整体呈现下降的趋势。但25 ℃处理组在0~12 h有显著上升的趋势,随着失水程度的升高,细胞破裂,导致花色苷分子的扩散和流动,与细胞间隙中所含氧气、空气中的氧气接触,致使其发生花色苷的氧化反应[25]。葡萄酒的色素主要来源于葡萄皮中的花色苷,葡萄采后失水花色苷含量的变化直接影响葡萄酒的色泽和品质。
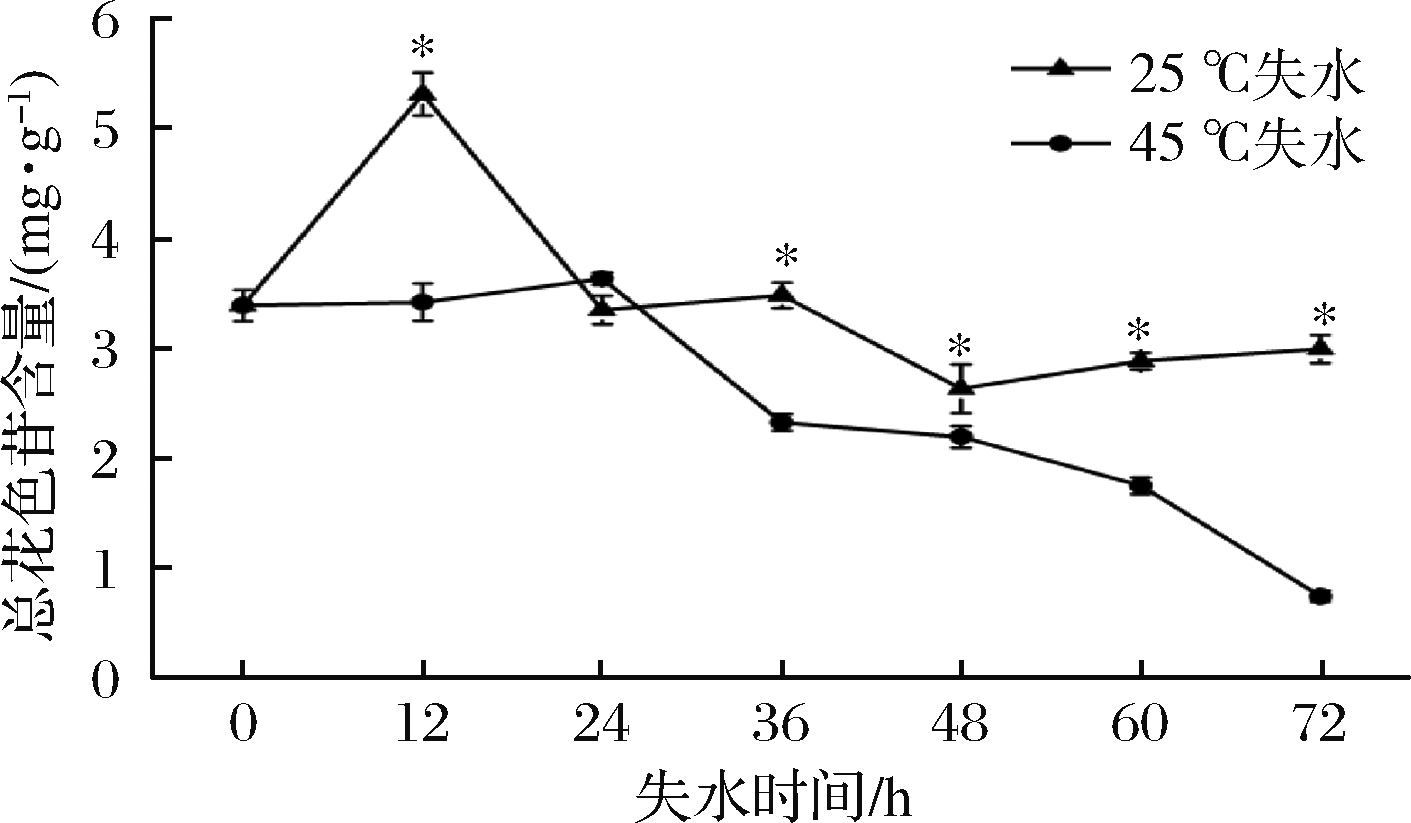
图3 葡萄采后失水对皮中总花色苷含量的影响
Fig.3 Effect of postharvest dehydration on total anthocyanin content in the skin
2.4 葡萄采后失水对皮中总黄酮含量的影响
黄酮类化合物是自然界存在的酚类化合物的最大类别之一,黄酮类化合物主要来自于葡萄皮、葡萄籽及果梗,在红葡萄酒中占酚类物质的80%以上[26]。由图4可知,采后新鲜葡萄果实总黄酮含量为19.23 mg/g,随着采后失水时间的延长,总黄酮含量随着葡萄失水处理时间呈现先上升后下降的趋势。72 h处理结束时25 ℃总黄酮含量为27.58 mg/g,45 ℃失水达到最小值13.33 mg/g。葡萄皮中总黄酮含量受温度和时间影响较大,与25 ℃处理组相比45 ℃处理在36~72 h处理时黄酮含量急剧下降。
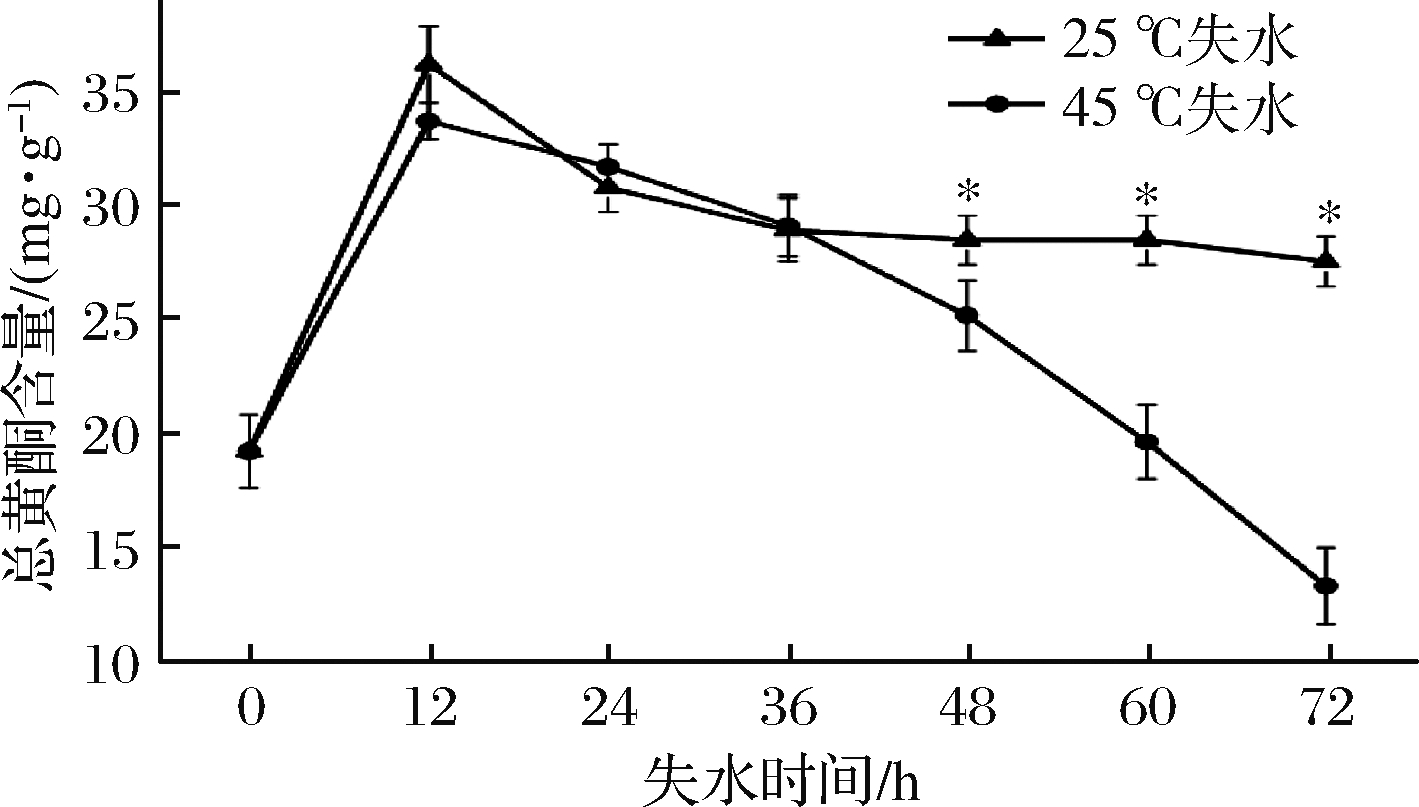
图4 葡萄采后失水对皮中总黄酮含量的影响
Fig.4 Effect of postharvest dehydration on the total flavonoids content in the skin
2.5 葡萄采后失水对皮中单宁含量的影响
单宁是主要的酚类物质,对葡萄酒的滋味与口感有显著影响。由图5可知,采后新鲜葡萄果实皮中单宁含量为18.33 mg/g,随着葡萄采后失水处理时间延长,0~12 h葡萄单宁含量呈现上升趋势,12 h后25 ℃处理和45 ℃处理单宁含量均呈现下降的趋势,且45 ℃处理组单宁含量下速率势显著大于25 ℃处理组,失水处理葡萄皮中单宁72 h均达到最小值,25 ℃和45 ℃单宁含量分别为18.84 mg/g和11.48 mg/g,25 ℃处理组在72 h时单宁含量高于采后新鲜葡萄,45 ℃处理组在72 h时单宁含量明显低于采后新鲜葡萄果实。葡萄中单宁含量随着葡萄失水处理整体呈现先下降后上升的趋势,45 ℃处理组单宁降解显著大于25 ℃处理组。

图5 葡萄采后失水对皮中单宁含量的影响
Fig.5 Effect of postharvest dehydration on tannin content in the skin
2.6 葡萄采后失水对果皮超微结构影响
新鲜葡萄果皮细胞,细胞核、叶绿体、细胞壁清晰可见。如图6中的A,在透射电镜下葡萄果皮细胞呈不规则状分布,液泡占细胞体积较大;细胞核结构完整,具有清晰的双层膜结构,染色质均匀地分散在细胞质中,细胞膜结构完整,细胞壁和细胞膜结合紧密;细胞壁均匀致密,结构清晰;叶绿体有完整的细胞膜,叶绿体内有较多的淀粉颗粒,可以观察到数量较多的线粒体。
随着葡萄不断失水,细胞核、叶绿体发生降解,细胞壁发生变形,不断出现质壁分离现象,且温度越高现象越明显。如图6中的B,质量损失20%时,25 ℃处理组细胞核结构完整,具有清晰的双层膜结构,染色质出现凝结现象;细胞壁结构整齐,结构清晰。与对照组相比,细胞结构无明显差异,细胞质壁分离现象不明显,可以观察到数量较多的线粒体。45 ℃处理组细胞核结构完整,具有清晰的双层膜结构,染色质出现大量凝结现象,细胞壁和细胞膜出现质壁分离;细胞壁整齐,但发生收缩变形;叶绿体数量减少,嗜锇颗粒明显增多,由于液泡膜的破坏,细胞基质中出现囊泡。如图6中的C,质量损失40%时,25 ℃处理组,细胞核已经降解消失,细胞质发生大量凝聚,出现明显的质壁分离现象;细胞壁发生变形、凝聚;细胞内出现大量嗜锇颗粒明显增多和囊泡。45 ℃处理组细胞核已经降解消失,细胞质发生大量凝聚,质壁分离现象严重;细胞壁发生凝集、降解。叶绿体、线粒体数量明显减少,嗜锇颗粒和囊泡大量出现。如图6中的D,质量损失60%时25 ℃处理组,细胞核降解消失,细胞质高度凝结;细胞壁不再致密,质壁分离严重。由于细胞器的融合降解,细胞内出现大量空洞。45 ℃处理组细胞核降解消失,细胞质松散凝结;细胞壁和细胞膜质壁分离;细胞内出现大量嗜锇颗粒和囊泡,细胞器降解消失。
嗜锇颗粒是叶绿体类囊体膜降解以及脂质类降解物聚集的结果,其出现作为细胞膜结构和色素瓦解的积累产物[27],叶绿体“囊泡化”是植物在逆境胁迫下普遍产生的共同现象[28]。URCAN 等[15]研究认为,在较高温度条件下脱水时,温度胁迫导致葡萄不断失水,阻止氧气的进入,脱水使表皮破损有利于酚类化合物转移至果肉中,但低温失水易与氧气接触发生褐变。ROGIERS等[29]分析发现果皮表面蜡质层在果实成熟后基本保持稳定,葡萄采后蜡质层不断减少,从而使葡萄表皮蒸腾速率加强。BONADA等[30]研究葡萄采后温度对细胞凋亡的影响结果显示,升高温度加速了葡萄采后中果皮细胞的死亡和萎缩。研究结果表明,葡萄采后不同温度失水使葡萄表皮发生皱缩、破裂、凋亡,葡萄中的酚类物质在失水过程中不断发生氧化降解,失水温度越高越显著。酚类物质的氧化降解与葡萄表皮的皱缩、破裂、凋亡密切相关。与上述研究结果基本一致。

A-采后新鲜葡萄果皮;B-质量损失20%处理组;C-质量损失40%处理组;D-质量损失60%处理组Ⅰ、Ⅱ分别为25 ℃和45 ℃失水处理
图6 葡萄采后失水对皮超微结构的影响
Fig.6 Effect of postharvest dehydration on the ultrastructure of the skin
3 结论
随着葡萄采后失水时间的变化,45 ℃失水质量下降较25 ℃失水快。失水过程中葡萄可溶性固形物含量呈上升趋势,失水后期45 ℃失水固形物含量显著高于25 ℃处理组。总酚、总花色苷、单宁、总黄酮含量随着葡萄失水均呈现初期上升后下降趋势,45 ℃处理组降解速率显著大于25 ℃处理组,失水初期葡萄失水速率较快,葡萄受到失水应激反应,失水初期酚类物质呈现一定的上升趋势,后期随着细胞的破裂死亡,与氧气接触后发生氧化降解,酚类物质含量不断下降。通过细胞表皮电镜观察,采后新鲜葡萄果实细胞表皮细胞呈扁平状,液泡占细胞体积较大;细胞膜结构完整,细胞中叶绿体数量较多且有一定的淀粉颗粒;细胞质中染色质分散均匀。随着葡萄不断失水,葡萄表皮细胞发生严重的皱缩、变形、死亡。
结合采后失水过程中各指标含量的检测分析与细胞表皮电镜观察,葡萄失水导致其质量不断下降、可溶性固形物含量升高,采后失水使葡萄中的水分散失,糖类物质发生浓缩结晶,葡萄皮细胞发生皱缩、破裂、细胞器消失、最终细胞发生凋亡。较高失水温度加速了葡萄采后失水速率,由于细胞中内容物溢流至细胞外,其中多酚氧化酶及酚类物质与外界氧气充分接触,使葡萄皮中总花色苷、总黄酮、单宁等酚类物质发生氧化降解,故其含量不断下降。通过采后失水的方式酿造甜型葡萄酒,需要进一步优化工艺条件以防酚类物质的降解。葡萄采后失水机制还需进一步的研究,以确定其采后失水代谢通路与关键代谢产物,以期为后续工业化生产提供理论依据。
[1] 褚晓泉, 朱君伟, 穆维松, 等. 我国葡萄酒产业现状及布局分析[J]. 中外葡萄与葡萄酒, 2019(3):71-75.
[2] 张轲, 袁琳, 杨兴元, 等. 天山北麓产区5个不同红色酿酒葡萄品种非花色苷酚类物质的积累特性[J]. 现代食品科技, 2019, 35(4):122-129.
[3] 唐虎利, 张振文, 孙莹, 等. 新疆玛纳斯县赤霞珠葡萄最佳采收期的研究[J]. 中国酿造, 2009, 28(10):78-81.
[4] HARDIE W J, O'BRIEN T P, JAUDZEMS V G. Morphology, anatomy and development of the pericarp after anthesis in grape, Vitis vinifera L[J]. Australian Journal of Grape and Wine Research, 2008, 2(2):97-142.
[5] PUBLISHING B. Australian journal of grape and wine research[J]. Australian Journal of Grape & Wine Research Pp, 2011, 65(6):854-856.
[6] BOULTON R. The copigmentation of anthocyanins and its role in the color of red wine: A critical review[J]. American Journal of Enology and Viticulture, 2001, 52:67-87.
[7] SIVILOTTI, FALCHI P, HERRERA R, et al. Combined effects of early season leaf removal and climatic conditions on aroma precursors in Sauvignon blanc grapes[J]. Journal of Agricultural and Food Chemistry, 2017, 65(38):8 426-8 434.
[8] ZHANG X K, HE F, ZHANG B, et al. The effect of prefermentative addition of gallic acid and ellagic acid on the red wine color, copigmentation and phenolic profiles during wine aging[J]. Food Research International, 2018, 106:568-579.
[9] 刘峰娟, 冯作山, 孟阳, 等. 脱水速度对“无核白”葡萄果皮褐变和细胞超微结构的影响[J]. 食品科学, 2016, 37(6):227-232.
[10] SAQUET A A, STREIF, BANGERTH. Energy metabolism and membrane lipid alterations in relation to brown heart development in 'Conference' pears during delayed controlled atmosphere storage[J]. Postharvest Biology & Technology, 2003, 30(2):123-132.
[11] BONADA M, VíCTOR SADRAS, MORAN M, et al. Elevated temperature and water stress accelerate mesocarp cell death and shrivelling, and decouple sensory traits in Shiraz berries[J]. Irrigation Science, 2013, 31(6):1 317-1 331.
[12] PANCERI C P, BORDIGNON-LUIZ M T. Impact of grape dehydration process on the phenolic composition of wines during bottle ageing[J]. Journal of Food Biochemistry, 2017,41(6): e12 417.
[13] L PEZ J
PEZ J SSICA, VEGA-G
SSICA, VEGA-G LVEZ ANTONIO, BILBAO-SAINZ C, et al. Influence of vacuum drying temperature on: Physico-chemical composition and antioxidant properties of murta berries[J]. Journal of Food Process Engineering, 2017,40(5): e12 569.
LVEZ ANTONIO, BILBAO-SAINZ C, et al. Influence of vacuum drying temperature on: Physico-chemical composition and antioxidant properties of murta berries[J]. Journal of Food Process Engineering, 2017,40(5): e12 569.
[14] MA T T, SUN X Y, GAO G T, et al. Phenolic characterisation and antioxidant capacity of young wines made from different grape varieties grown in helanshan donglu wine zone(China)[J]. South African Journal of Enology & Viticulture, 2016, 35(2):321-331.
[15] URCAN D E, GIACOSA S, TORCHIO F, et al. ‘Fortified’ wines volatile composition: Effect of different postharvest dehydration conditions of wine grapes cv. Malvasia moscata (Vitis vinifera L.)[J]. Food Chemistry, 2017, 219:346-356.
[16] MENCARELLI F, TONUTTI P, MENCARELLI F, et al. Sweet, reinforced and fortified wines: Grape biochemistry, technology and vinification[J]. Journal of Wine Research, 2013, 26(1):64-66.
[17] 王福荣. 酿酒分析与检测[M]. 北京: 化学工业出版社, 2012.
[18] 冯建光, 谷文英. 葡萄皮红色素的示差法测定[J]. 食品工业科技, 2002(9):85-86.
[19] HOSSAIN M A, KALBANI M S A A, FARSI S A J A, et al. Comparative study of total phenolics, flavonoids contents and evaluation of antioxidant and antimicrobial activities of different polarities fruits crude extracts of Datura metel L.[J]. Asian Pacific Journal of Tropical Disease, 2014, 4(5):378-383.
[20] MENCARELLI F, BELLINCONTRO A, NICOLETTI I, et al. Chemical and biochemical change of healthy phenolic fractions in winegrape by means of postharvest dehydration[J]. Journal of Agricultural and Food Chemistry, 2010, 58(13):7 557-7 564.
[21] CHAPPLE C. Genetic Characterization of Secondary Metabolism in Arabidopsis[M] Weat Lafayette:Department of Binchemisty Purdue University, 1994.
[22] SOPHIE P, ENRICO P, ALBERTO N, et al. Colour variation in red grapevines (Vitis vinifera L.): genomic organisation, expression of flavonoid 3'-hydroxylase, flavonoid 3,5′-hydroxylase genes and related metabolite profiling of red cyanidin-/blue delphinidin-based anthocyanins in berry skin[J]. BMC Genomics, 2006, 7(1):12.
[23] 陈健初. 杨梅汁花色苷稳定性、澄清技术及抗氧化特性研究[D]. 杭州:浙江大学, 2005.
[24] FURTADO P, FIGUEIREDO P, NEVES H C D, et al. Photochemical and thermal degradation of anthocyanidins[J]. Journal of Photochemistry & Photobiology A Chemistry, 1993, 75(2):113-118.
[25] 李晓丽, 王成, 朱靖蓉, 等. 干制速度对无核白葡萄酚类物质和多酚氧化酶细胞化学定位及褐变的影响[J]. 食品工业科技, 2019(5):99-107.
[26] 陶永胜, 李华, 王华. 葡萄酒中主要的黄酮类化合物及其分析方法[J]. 中外葡萄与葡萄酒, 2001(4):14-17.
[27] CARTER D R, CHEESEMAN J M. The effects of external NaCl on thylakoid stacking in lettuce plants[J]. Plant Cell and Environment, 1993, 16(2):215-222.
[28] 孙龙华, 简令成. 逆境中沙冬青叶片细胞叶绿体的结构(简报)[J]. 实验生物学报, 1995(4):427-396.
[29] ROGIERS S Y, HATFIELD J M, JAUDZEMS V G, et al. Grape berry cv. Shiraz epicuticular wax and transpiration during ripening and preharvest weight loss[J]. American Journal of Enology and Viticulture, 2004, 55(2):121-127.
[30] BONADA M, SADRAS V O, FUENTES S. Effect of elevated temperature on the onset and rate of mesocarp cell death in berries of Shiraz and Chardonnay and its relationship with berry shrivel[J]. Australian Journal of Grape and Wine Research, 2013, 19(1):87-94.