大曲是一种同时含有微生物菌系、微生物酶系和复合曲香物的微生态制品,是大曲酒酿造过程中重要的产酒剂和生香剂[1-2]。大曲中的微生物主要包括细菌、霉菌和酵母菌,而大曲中的酵母菌主要分为产酒酵母和产香酵母两大类[3-5]。产酒酵母多属于酿酒酵母属,为白酒发酵提供动力;而产香酵母多属于汉逊酵母属、假丝酵母属和球拟酵母属,既具备酒精发酵能力又具备醋酸发酵能力,是白酒中酯香的主要产生菌[6]。
目前,以纯种根霉和酵母为糖化发酵剂生产的小曲白酒因其用曲量少、发酵周期短、出酒率高、操作简便、价格实惠以及风格独特、味道适宜等特点在各地方稳定发展且深受消费者的喜爱[7]。但小曲白酒因其酒体单薄、香气不足等缺点,相较于大曲酒还缺乏市场竞争力[8]。近年来,随着酿酒技术的发展,人们在传统工艺的基础上,通过改进生产工艺、生产设备和生产菌株,逐步提高了小曲白酒的产量和质量。如池彬等[9]发现,利用多菌种大小曲混合酿造苦荞麦酒可以弥补和改善单一使用小曲造成的小曲酒酒质薄弱等问题;程伟等[10]表明,在固态小曲清香型白酒酿造生产工艺的基础上添加质量分数为0.05%的安琪生香活性干酵母,可明显提高原酒中的乙酸乙酯和总酯的含量,使原酒香味更加协调,口感清香纯正。
大曲中的微生物种类繁多且复杂。目前,鲜有利用大曲中的优质菌株生产高质量小曲白酒的有关报道,仅有夏玙等[11]从大曲中分离到1株异常威克汉逊酵母并用于制作纯种麸曲,优化制曲工艺后应用于清香型小曲白酒的生产,发现小曲酒中的乙酸乙酯增加了3倍,总酯增加了2倍。因此,本试验从大曲中分离纯化出产酒或产香酵母菌,通过制作米曲以及酿酒试验初步探索大曲中的酵母菌在小曲酒的发酵性能,以活菌数和酒精度为检测指标,以期将大曲中的酵母菌应用于小曲酒的发酵生产,为提高小曲酒的产量与质量提供理论基础。
1 材料与方法
1.1 材料与试剂
麸皮、糯米,市售;中高温浓香型大曲,四川某浓香型酒厂;麦芽汁琼脂,北京奥博星生物技术有限责任公司;葡萄糖(分析纯)、NaCl(分析纯)、琼脂粉,成都市科龙化工试剂厂;酵母提取物,生工生物工程(上海)股份公司;糖化酶(105 U/g),博立生物制品有限公司;DNA琼脂糖凝胶回收试剂盒,北京智杰方远科技有限公司。
1.2 仪器与设备
AR2140电子分析天平,梅特勒-托利多仪器有限公司;CI54DS立式压力蒸汽灭菌锅,厦门仪器有限公司;LRH-250生化培养箱,上海齐欣科学仪器有限公司;SW-CJ-1F超净工作台,上海博讯实业有限公司;ECLIPSE-E100光学显微镜,尼康仪器(上海)有限公司;C1000-Touch PCR仪,伯乐生命医学产品(上海)有限公司。
1.3 培养基
麦芽汁琼脂培养基(malt extract agar, MEA):麦芽汁琼脂20 g,蒸馏水定容至500 mL,pH(7.0±0.1)。
马铃薯葡萄糖琼脂培养基(potato dextrose agar, PDA):马铃薯200 g,葡萄糖20 g,琼脂15 g,蒸馏水定容至1 L,pH自然。
1.4 试验方法
1.4.1 中高温大曲中真菌群落分析
采用改良的CTAB法[12]提取中高温大曲中微生物DNA,将提取的DNA送至上海美吉生物医药科技有限公司完成PCR-DGGE高通量测序。
1.4.2 酵母菌的分离与纯化
称取粉碎后的大曲样品1.0 g,在无菌条件下加入99 mL带有玻璃珠的无菌水中,摇匀,制备成10-2稀释液,再将其浓度稀释至10-3~10-6,取各梯度稀释液100 μL涂布于MEA固体培养基上,28 ℃倒置培养3 d。挑取单菌落,平板划线至无杂菌后接于斜面保藏并编号。
1.4.3 酵母菌的形态学观察
将菌株接于PDA培养基上,观察并记录酵母菌在PDA培养基上的菌落颜色、形状、湿润程度、边缘是否整齐、表面是否光滑等菌落特征,并在显微镜下观察酵母菌的细胞形状及繁殖方式,参比《酵母菌的特征与鉴定手册》[13]对酵母菌进行鉴定。
1.4.4 酵母菌18s rRNA分子生物学鉴定
参考文献[14-16]提取酵母菌菌株的基因组DNA。以序列NS1:5′-GTAGTCATATGCTTGTCTC-3′为正向引物和NS4:5′-CTTCCGTCAATTCCTTTAAG-3′为反向引物扩增酵母菌18S rRNA序列。反应体系(50 μL)为:MasterMix 25 μL;引物NS1和 NS4各1 μL;模板DNA 2 μL;双蒸水21 μL。反应程序为94 ℃预变性5 min;94 ℃变性30 s;55 ℃退火30 s;72 ℃延伸90 s;循环29次;最后72 ℃延伸10 min;4 ℃保存。PCR产物经1%琼脂糖凝胶电泳后,按照试剂盒操作步骤回收条带,产物送至生工生物工程(上海)股份有限公司测序。
1.4.5 酵母菌菌株同源性分析
将测序结果在Genebank数据库中进行同源序列搜索,与相似性>99%的菌株作比较,采用MEGA 7.0 软件进行多序列对比,采用邻接法(neighbour-joining)构建系统发育进化树。
1.4.6 酵母菌发酵能力的测定
1.4.6.1 酵母菌种子液的制备
在无菌条件下,挑取2~3环酵母菌接入100 mL PDA液体培养基中,于28 ℃,150 r/min培养48 h,在显微镜下观察酵母菌的生长状态并计数。
1.4.6.2 纯种酵母麸曲的制作
称取50.0 g麸皮于500 mL三角瓶中并加入50 mL去离子水,搅拌均匀后,于121 ℃温度下灭菌20 min,冷却后在无菌条件下对麸皮进行搅拌,保证麸皮松散且不成团,按接种量为1.0×107CFU/g麸曲接入酵母菌种子液,于28 ℃,50 r/min培养5 d,将培养完成后的麸曲倒入托盘中,烘干后打碎成粉并计算麸曲中的活酵母数,于4 ℃冷藏待用。
1.4.6.3 米曲的制作
米曲的制作工艺流程[17]如下:

粉碎、润料:准确称取3.0 kg大米并将其粉碎,粉碎的大米经100目筛孔过筛,要求粗细比为3∶1。润料目的是使大米吸水膨胀,淀粉粒间隙增大,利于糊化。水温为100 ℃,要求润料后的大米含水质量分数在38%~50%[18]。
接种、制坯与培养:按活酵母菌数为6.0×108CFU/g米曲接种。将麸曲与米粉混合均匀后,揉合成质量约40 g、大小均匀且一致的球状曲,以便于在培养时控制温度和水分。28 ℃下培养9 d,湿度保持在90%;
烘干、贮存:米曲培养成熟出箱后,于60 ℃恒温箱中烘干48 h,使其水分降低至12% 以下,以利于保存。
1.4.6.4 米曲的工艺优化
含水量对酵母菌生长的影响:按照米曲的制作工艺,将润料后的米曲含水质量分数分别控制在38%、40%、42%、44%、46%、48%、50%,于28 ℃、湿度90%的条件下培养,每天观察其生长情况,5 d后装入托盘,烘干后粉碎并计算米曲中的活酵母菌数,确定米曲最佳含水量。
培养时间对酵母菌生长的影响:确定了米曲的最佳含水量后,按照米曲的制作工艺,将米曲分别在28 ℃、湿度90%的条件下培养1、 2、 3、 4、 5、 6、 7、 8 d,将培养完成的米曲烘干后粉碎并计算米曲中的活酵母菌数,确定米曲的最佳培养时间。
1.4.6.5 酿酒试验
酿酒工艺流程如下:
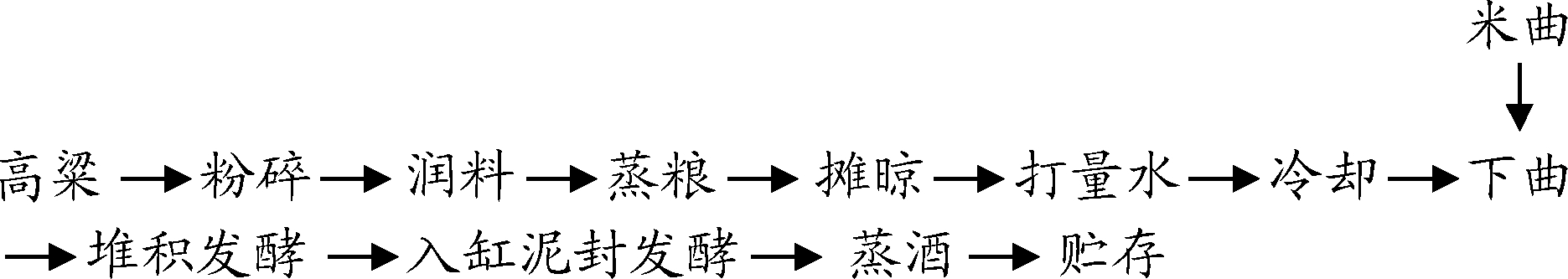
粉碎与润料:称取4.0 kg高粱并粉碎成2、4、6瓣,能通过100目筛孔的细粉占20%~40%,整粒和含壳量控制在0.5%以下。破碎后的高粱用常温水浸泡,使水面淹没粮食2~3 cm,翻动并刮平表面,浸泡12 h即可。
蒸粮:目的使高粱受热膨胀,促使淀粉粒细胞膜破裂。使用高温蒸汽直接加热,初蒸15~20 min后敞盖焖水55~60 min,再复蒸30~40 min。
打量水:在温度差的作用下,高粱皮外收缩,皮内淀粉粒收到挤压,从而导致淀粉粒细胞膜结构破坏,经过不断搅拌和蒸发收汗,使高粱的含水量增大,利于后续糖化发酵。量水温度温控制在70~80 ℃,用水量占原料总质量的50%,打完量水后冷却至40 ℃。
下曲:由于糖化发酵剂使用的是纯种酵母米曲,缺乏霉菌的作用,淀粉可能无法正常进行糖化,从而导致发酵不能正常启动。因此,以接种量为原料质量0.4%的糖化酶和0.6%的糖化酶为试验组,以只添加原料质量1.0%的糖化酶为对照组。
堆积发酵和入缸发酵:当曲与高粱混匀后,盖上纱布,堆积糖化12 h,使酵母在有氧条件下进行生长和繁殖,然后入缸泥封发酵7 d后上甑蒸酒。
1.5 测定方法
水分测定采用常压干燥法[19];酵母菌计数采用稀释平板计数法[20];酒精度采用定量蒸馏100 mL酒液的方法,用酒精计测定[21]。
1.6 数据处理
试验结果均用“平均值±标准差”表示。应用Excel 2007对试验数据进行分析,并采用SNK-q检验对结果进行多重比较。每组试验均重复3次。
2 结果与分析
2.1 中高温大曲中真菌群落组成分析
大曲作为一种营养载体,通过富集和筛选环境中的微生物以积累丰富的物系、酶系和菌系而具有酿造功能。基于属类水平对中高温大曲样品的高通量测序结果进行分析,如图1所示。结果表明,3种中高温大曲中均含7种相同优势真菌属(丰度>1%),分别为假丝酵母属(Candida)、赤霉菌属(Gibberella)、Wickerhamomyces、侧齿霉属(Engyodontium)、酵母菌属(Saccharomyces)、曲霉菌属(Aspergillus)、匍柄霉属(Stemphylium)。在3种不同的中高温大曲中,酵母菌和霉菌在真菌中占优势地位,且酵母菌占真菌的比例为48.16%~52.34%,而霉菌占 24.94%~29.04%。大曲中,大量的酵母菌保证了白酒酿造过程中的发酵能力、产酯能力和产酒能力[21-23],霉菌又保证了糖化力、液化力和酯化力[24-27],二者相辅相成,对白酒风味具有积极作用。
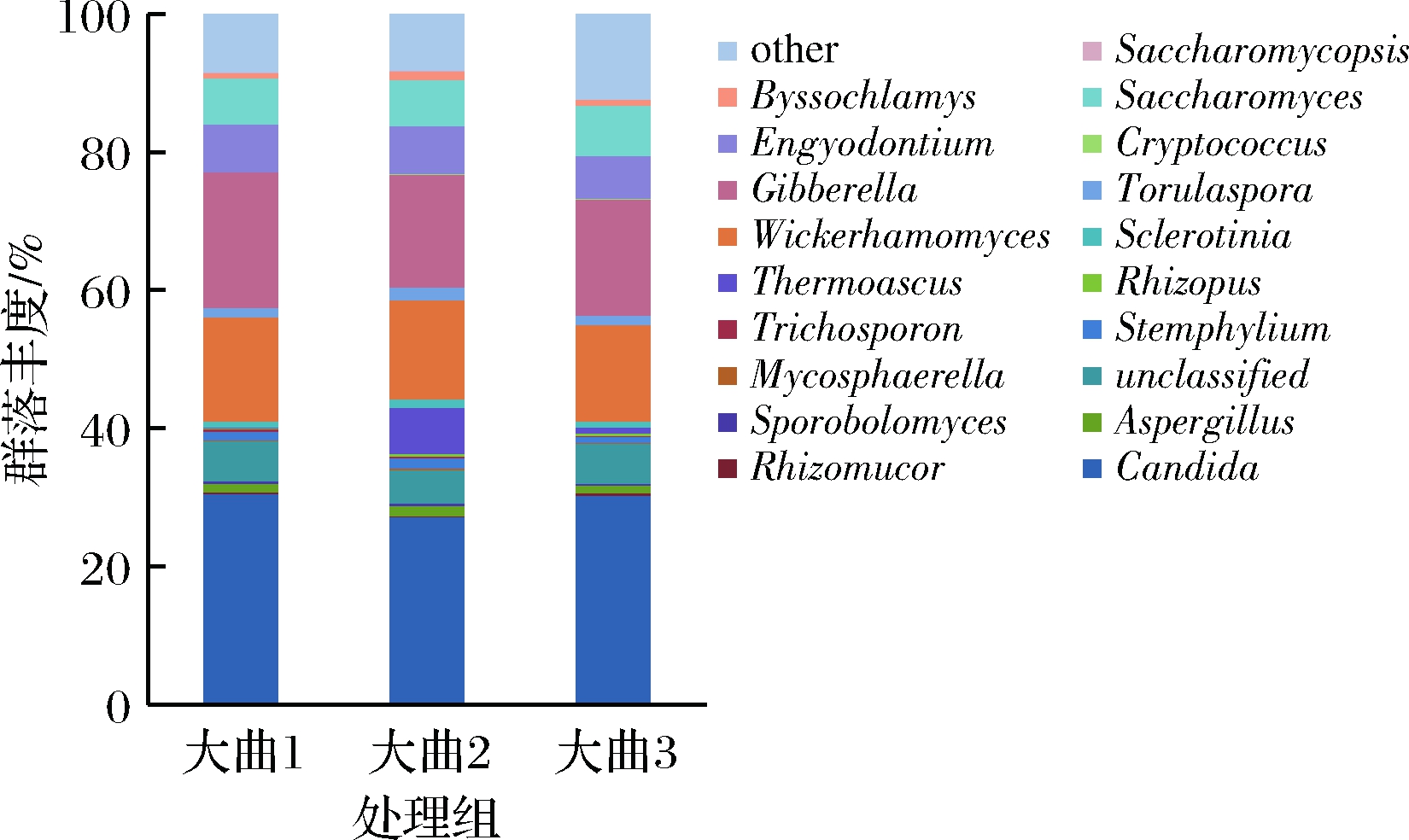
图1 不同中高温大曲中真菌群落结构
Fig.1 Structure chart of fungi community in different medium high-temperature Daqus
2.2 酵母菌的分离与鉴定
2.2.1 酵母菌株的形态学特征
在MEA培养基上共挑取了20个单菌落,经过3~4次划线纯化至无杂菌后,结合菌落特征以及显微镜下的观察结果,初步确定从大曲中分离出4株酵母菌,分别编号为Y1、Y2、Y3和Y4,其在PDA上的菌落形态特征和显微镜下形态特征如表1所示。
表1 四株酵母菌的菌落及细胞形态特征
Table 1 The cell and colony morphological characteristics of four kinds of yeasts

菌株编号颜色形状湿润程度边缘光滑程度透明度细胞形态繁殖方式Y1乳白色圆形湿润整齐光滑不透明卵圆形芽殖Y2乳白色圆形湿润不整齐光滑不透明椭圆形或近肠状芽殖Y3灰白色圆形湿润整齐光滑不透明椭圆形两端稍尖芽殖Y4乳白色圆形湿润不整齐光滑不透明椭圆形或近球形芽殖
2.2.2 酵母菌的分子生物学鉴定
2.2.2.1 酵母菌PCR扩增结果
4株酵母菌的PCR扩增产物电泳图如图2所示。由图2可知,4株菌株的扩增产物无拖尾现象,无降解,完整性较好。
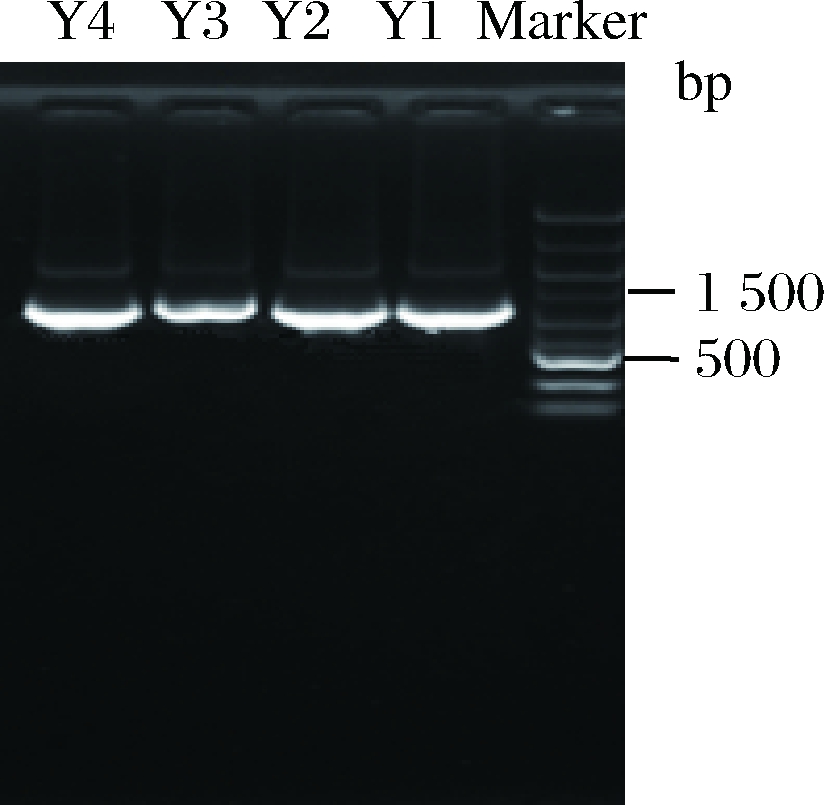
图2 四株酵母菌PCR扩增产物电泳图
Fig.2 The PCR products electrophoretogram of four kinds of yeasts
2.2.2.2 四株酵母菌的系统发育进化树
Y1、Y2、Y3和Y4 酵母菌的18S rRNA PCR扩增产物测序后的长度分别为1 480、1 365、1 389和1 264 bp。将4株酵母菌的18S rRNA测序结果在NCBI的GeneBank中进行BLAST对比,结果表明,Y1菌株序列与Wickerhamomyces anomalus strain 0939-5的同源性达99.75%,该菌株与其他近源菌株和模式菌株18S rRNA序列构建的系统发育进化树如图3所示,Y1菌株与序列号为MG712300.1的异常威克汉逊酵母遗传距离最近。Y2菌株序列与Candida odintsovae NRRL Y17730的同源性达99.36%,该菌株与其他近源菌株和模式菌株18S rRNA 序列构建的系统发育进化树如图4所示,Y2菌株与序列号为EF550442.1的东方假丝酵母遗传距离最近。Y3菌株序列与Saccharomyces cerevisiae YJM555的同源性达99.77%,Y4序列与Saccharomyces cerevisiae RY1的同源性达99.58%,这2株酵母菌与其他近源菌株和模式菌株18S rRNA序列构建的系统发育进化树如图5所示,Y3菌株与序列号为CP006452.1的酿酒酵母遗传距离最近,而Y4菌株与序列号为LC479088.1和MN117709.1的酿酒酵母遗传距离最近。结合4株酵母菌的形态学特征,初步确定Y1为异常威克汉逊酵母(Wickerhamomyces anomalus),Y2为东方假丝酵母(Candida odintsovae),Y3和Y4为酿酒酵母(Saccharomyces cerevisiae)。

图3 Y1菌株的系统发育进化树
Fig.3 The phylogenetic tree of strain Y1

图4 Y2菌株的系统发育进化树
Fig.4 The phylogenetic tree of strain Y2

图5 Y3和Y4菌株的系统发育进化树
Fig.5 The phylogenetic tree of strain Y3 and Y4
2.3 四株酵母菌的发酵性能测定
2.3.1 麸曲中4株酵母菌活菌数
由图6可知,4种酵母在麸曲中的活酵母菌数分别为异常威克汉逊酵母Y1为5.27×108CFU/g麸曲,东方假丝酵母Y2为4.77×108CFU/g麸曲,酿酒酵母Y3和Y4均为5.2×108CFU/g麸曲。4株酵母菌在麸曲中的数量差异不明显(P>0.05),且数量相较于培养前可放大一个数量级。
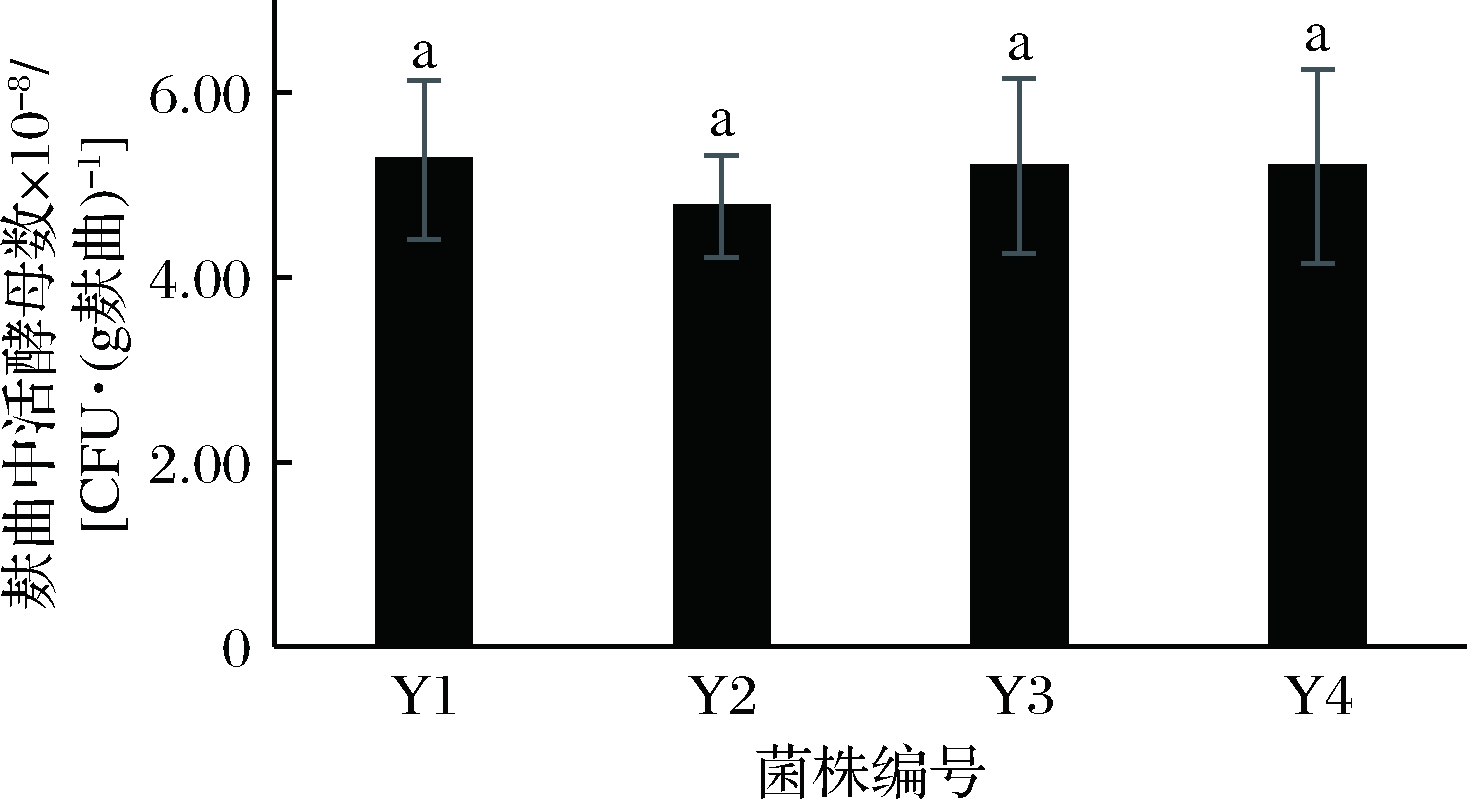
图6 四种酵母麸曲中的活酵母菌数
Fig.6 The number of viable yeasts in four kinds of fuqu
注:图中相同小写字母代表差异不显著(P>0.05)
2.3.2 米曲含水量对酵母菌生长的影响
在制曲过程中,水分含量对曲的质量起着重要作用[28]。大米淀粉是一种较易水解的淀粉,适当的水分不仅可以使大米充分吸水膨胀,溶解其营养物质于水中,为后期酵母的活动提供养料,同时还可以促进酵母菌的生长繁殖和酶的分泌[29]。由图7可知,4种酵母菌活菌数均随着米曲含水量的增加呈先增后降的趋势。异常威克汉逊酵母菌Y1在米曲含水质量分数为44%~48%时活酵母菌数与其他含水质量分数存在显著差异(P<0.05),东方假丝酵母Y2在米曲含水质量分数为42%~48%时活酵母菌数与其他含水质量分数存在显著差异(P<0.05),酿酒酵母Y3在米曲含水质量分数为44%~46%时活酵母菌数与其他水分含量存在显著差异(P<0.05),酿酒酵母Y4在米曲含水质量分数为46%时活酵母菌数与其他水分含量存在显著差异(P<0.05)。4种酵母菌米曲中的活酵母菌数均在含水质量分数为46%时达最大,其中酿酒酵母Y4米曲中活酵母数最高,为5.60×109CFU/g米曲,异常威克汉逊酵母Y1米曲中的活菌数为5.50×109CFU/g米曲,酿酒酵母Y3米曲中活酵母数为5.43×109CFU/g米曲,东方假丝酵母Y2米曲中活酵母数为5.1×109CFU/g米曲,这说明从大曲中分离出来的4株酵母菌均能在含水质量分数为46%的米曲中旺盛繁殖。但过高的水分含量不利于酵母菌的生长,可能是由于过高的水分招致了细菌的繁殖,从而抑制了酵母菌的生长。
2.3.3 制曲时间对酵母菌生长的影响
酵母菌是酒精发酵的主要动力。在一定程度上,酵母菌的数量越高,越有利于发酵产酒。由图8可知,随着培养时间的延长,4种米曲中的酵母菌均呈先增后降的趋势,且活酵母菌数均在培养3 d后出现显著差异(P<0.05)。在制曲第7天,4种米曲中的活酵母菌数均达最大,其中酿酒酵母Y4米曲中活酵母数最高,为8.37×109CFU/g米曲。东方假丝酵母Y2米曲中的活酵母数为8.17×109CFU/g米曲,酿酒酵母Y3米曲中活酵母数为8.10×109CFU/g米曲,异常威克汉逊酵母Y1米曲中的活酵母数为7.57×109CFU/g米曲。由图8可知,从大曲中分离的4株酵母在米曲含水质量分数为46%时培养7 d生长繁殖最为旺盛。
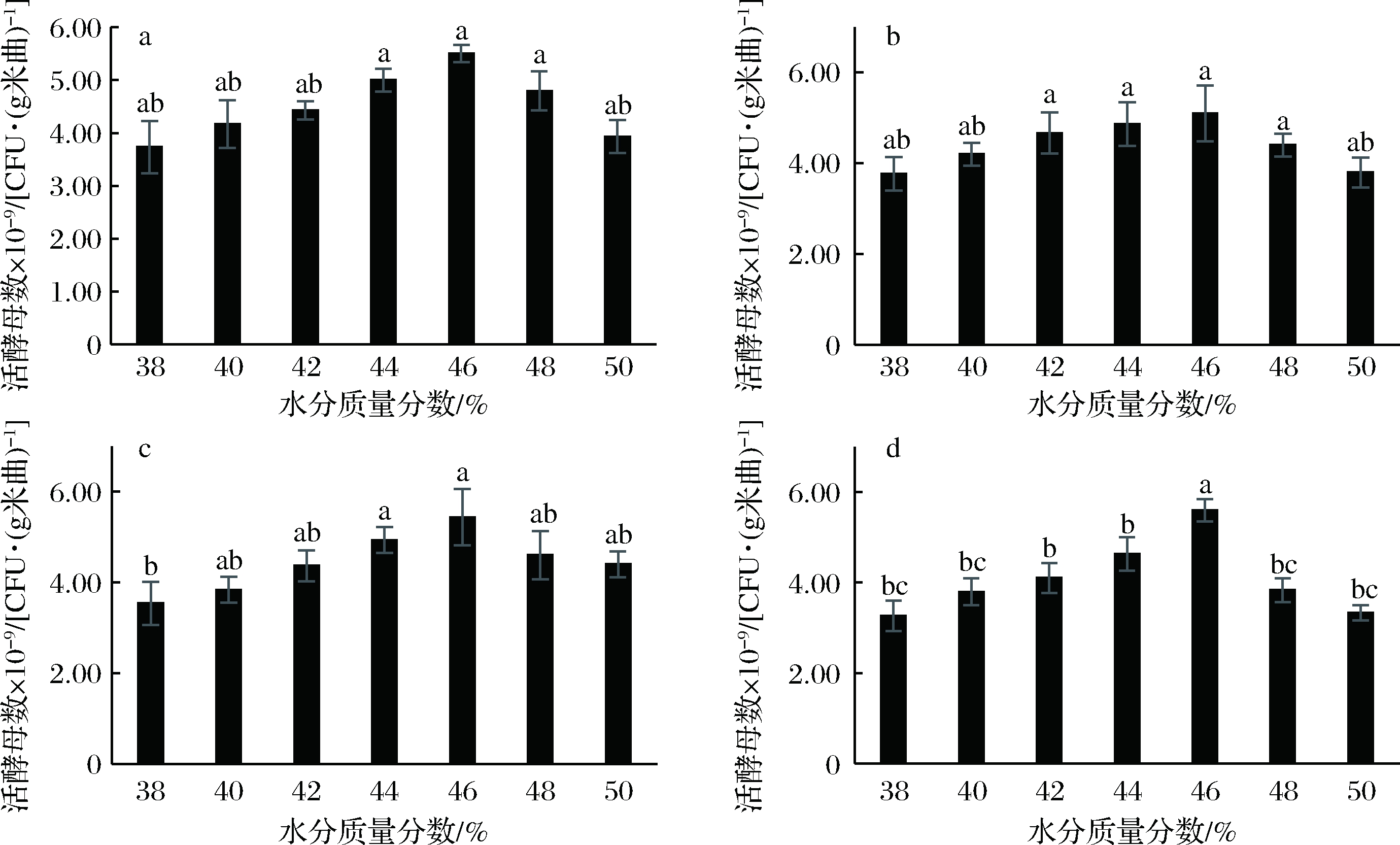
a-Y2;b-Y2;c-Y3;d-Y4
图7 含水量对4种米曲中酵母菌活菌数的影响
Fig.7 Effect of water contents on the viable counts of yeast in four kind of rice Qus
注:图中不同小写字母代表差异显著(P<0.05)(下同)

a-Y1;b-Y2;c-Y3;d-Y4
图8 制曲时间对4种酵母米曲中活菌数的影响
Fig.8 Effect of incubating time on the viable counts of yeast in four kind of rice Qus
2.4 酿酒试验
因酿酒过程为开放式操作,原料在操作过程中会网络部分空气中微生物,导致对照组能发酵产酒,且酒精度为16.5%vol。由表2可知,酿酒酵母Y3和Y4的酒精度显著高于异常威克汉逊酵母Y1和东方假丝酵母Y2菌株(P<0.05),且酿酒酵母Y3比Y4产酒效果更为显著(P<0.05)。米曲与糖化酶结合发酵生产的小曲高粱酒酒精度比直接使用糖化酶的酒精度变化显著(P<0.05),这说明4种不同酵母米曲具有较好的产酶与产酒效果,且4种酵母米曲的产酒能力依次为酿酒酵母Y3>酿酒酵母Y4>异常威克汉逊Y1>东方假丝酵母Y2。
表2 四种酵母米曲发酵高粱产酒情况 单位:%vol
Table 2 The Xiaoqu baijiu production of sorghum fermented by four kinds of rice Qus

实验组(0.4%米曲+0.6%糖化酶)对照组(1%糖化酶)26.25±1.48c(Y1)24.00±3.67c(Y2)16.50±1.06d38.85±1.51a(Y3)33.93±2.31b(Y4)
注:表中相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)
3 结论
从中高温大曲中共分离出4株酵母菌(Y1、Y2、Y3和Y4),经形态学和分子生物学鉴定,确定Y1为异常威克汉逊酵母,Y2为假丝酵母,Y3和Y4酿酒酵母。4株酵母制得的米曲在含水质量分数为46%的条件下下培养7 d,酵母活菌数可达109CFU/g米曲。通过酿酒试验发现,4种酵母米曲的产酒能力依次为酿酒酵母Y3>酿酒酵母Y4>异常威克汉逊酵母Y1>东方假丝酵母Y2。在报道中[30-32],异常威克汉逊酵母和东方假丝酵母在白酒发酵中具有产香功能,而从本试验可看出,这2株酵母具有一定的产酒能力,因此可对其功能进行进一步研究,以期为改善小曲酒的质量与产量提供理论基础。大曲中存在着纷繁且复杂的微生物,认识与开发这些功能微生物,并将其运用在小曲酒的生产过程中,可为创新小曲酒工艺,提高小曲酒质量提供新思路与新方法。
[1] 泸州老窖集团有限责任公司.泸型酒技艺大全[M].北京:中国轻工业出版社,2011:154-167.
[2] WEI Z, CHANGQING Z, HUIBO L. Diversity and function of microbial community in chinese strong-flavor Baijiu ecosystem: A review[J]. Frontiers in Microbiology, 2018, 9:671.
[3] 罗惠波,杨晓东,杨跃寰,等.浓香型大曲中可培养真菌的分离鉴定与系统发育学分析[J].现代食品科技,2013,29(9):2 047-2 052.
[4] 吴树坤,谢军,卫春会,等.四川不同地区浓香型大曲微生物群落结构比较[J].食品科学,2019,40(14):144-152.
[5] XIONG X, HU Y, YAN N, et al. PCR-DGGE analysis of the microbial communities in three Different Chinese “Baiyunbian” liquor fermentation starters[J]. Journal of Microbiology and Biotechnology, 2014, 24(8):1 088-1 095.
[6] 徐军,罗惠波,崔德宝,等. 大曲中酵母菌的分离及其鉴定[J].酿酒,2008,35(3):95-97.
[7] 吴赫川,马莹莹,杨建刚,等.川法小曲白酒发展现状及其瓶颈问题分析[J].安徽农业科学,2014,42(33):11 850-11 853;11 856.
[8] 张杰,程伟,彭兵,等.小曲清香型白酒研究概述[J].酿酒科技,2017(9):91-95.
[9] 池彬,周火玲,蔡雄.多菌种大小曲在监粮荞酒生产工艺的研究与运用[J].酿酒科技,2018(8):101-107.
[10] 程伟,张杰,潘天全,等. 安琪生香活性干酵母在固态小曲清香型白酒酿造生产中的应用[J]. 酿酒科技, 2018(7):83-88;91.
[11] 夏玙,谢军,黄丹,等.异常威克汉逊酵母的麸曲制作工艺优化[J].食品研究与开发,2018,39(22):118-123.
[12] LIPTHAY J R D, ENZINGER C, JOHNSEN K, et al. Impact of DNA extraction method on bacterial community composition measured by denaturing gradient gel electrophoresis[J]. Soil Biology & Biochemistry, 2004, 36(10):1 607-1 614.
[13] 巴尼特J A,佩恩R W,亚罗D,等. 酵母菌的特征与鉴定手册[M].青岛:中国海洋大学出版社,1991:414-430.
[14] ABOUL-MAATY A F, ORABY A S. Extraction of high-quality genomic DNA from different plant orders applying a modified CTAB-based method[J]. Bulletin of the National Research Centre, 2019:41(1):25.
[15] 卢鑫,张会彦,亢春雨,等.马克思克鲁维酵母DNA提取方法的比较[J].食品科技,2009,34(4):31-33;37.
[16] 唐巧玲,付鹏飞,王旭静,等.一种简便高效的酵母基因组提取方法[J].生物技术进展,2012,2(4):293-296.
[17] 刘波,谢邦祥,周天银.小曲白酒生产实用技术[M].成都:四川科学技术出版社,2009:30-35.
[18] 宗绪岩.小曲白酒生产技术[M].北京:化学工业出版社,2019:44-57.
[19] 杨立刚,李莉华,林丽凤,等.南京菊花脑部分成分分析及挥发油的提取研究[J].现代食品科技,2010, 26(2):212-214;211.
[20] 沈萍,陈向东.微生物学实验(第四版)[M].北京:高等教育出版社,2007:204-214.
[21] 国家卫生和计划生育委员会.GB 5009.225-2016食品安全国家标准 酒中乙醇浓度的测定[S].北京:中国标准出版社,2016:3-4.
[22] 李静心,王艳丽,何宏魁,等.基于高通量测序技术解析高温大曲和中高温大曲的真菌群落结构[J].食品与发酵工业,2018,44(12):52-59.
[23] R ESCRIBANO,L GONZ LEZ-ARENZANA,J PORTU,et al. Wine aromatic compound production and fermentative behaviour within different non- Saccharomyces species and clones[J]. Journal of Applied Microbiology,2018,124(6):1 521-1 523.
LEZ-ARENZANA,J PORTU,et al. Wine aromatic compound production and fermentative behaviour within different non- Saccharomyces species and clones[J]. Journal of Applied Microbiology,2018,124(6):1 521-1 523.
[24] ZHA M,SUN B,WU Y,et al. Improving flavor metabolism of, Saccharomyces cerevisiae, by mixed culture with, Wickerhamomyces anomalus, for Chinese Baijiu making[J]. Journal of Bioscience and Bioengineering, 2018,126(2):189-195.
[25] JIN Y, LI D, AI M, et al. Correlation between volatile profiles and microbial communities: A metabonomic approach to study Jiang-flavor liquor Daqu[J]. Food Research International, 2019,121:422-432.
[26] 孙俊良,李新华,梁新红,等.不同碳源对黑曲霉产糖化酶活力的影响[J].食品科学,2008,29(8):433-436.
[27] 李园园.米曲霉产淀粉酶和纤维素酶的初步研究[D].天津:天津科技大学,2012.
[28] 任鹿海,关其才,李学思,等.浓香型纯小麦中高温曲的生产技术及工艺参数[J].酿酒科技,1997(5):17-20.
[29] 李起斌.生料制曲与生料酿酒技术[J].中国酿造,2001(6):38-39.
[30] 王晓丹,庞博, 陈孟强,等.酱香白酒酒醅中产香酵母分离与鉴定[J].食品安全质量检测学报,2014(6):1 799-1 808.
[31] 徐丽萍.泸型大曲中产酯酵母的筛选鉴定及产酯条件优化[J].中国酿造,2016, 35(2):74-78.
[32] 黄慧芬.米香型白酒酿造产香酵母的筛选鉴定及其产酯规律研究[D].长沙:中南林业科技大学,2018.