暗褐网柄牛肝菌(Phlebopus portentosus)俗称 “黑牛肝菌”,隶属牛肝菌目(Boletales)小牛肝菌科(Boletinellaceae)脉柄牛肝菌属(Phlebopus)[1],在我国主要分布在云南、贵州、四川和西藏等地[2],暗褐网柄牛肝菌子实体较大,口感脆嫩,味道鲜美,富含多种氨基酸、糖类、脂肪、萜类、甾类和维生素等成分,经常食用可增强机体免疫力、改善机体微循环[3]。兰茂(明朝)所著《滇南本草》对牛肝菌的药用价值也有记载,称其有“主治清热解烦,样血和平”功效[4],牛肝菌既有很好的食用价值,也有多种药用功效,经济价值高。
牛肝菌一般属外生菌根菌,人工栽培难以获得,但因暗褐网柄牛肝菌的营养方式兼具腐生和共生特点,已能实现人工栽培。目前国内外对暗褐网柄牛肝菌的报道主要集中在栽培技术及营养成分的研究上,如KUMLA等混合高粱、雨树锯末、真菌宿主溶液成功获得了人工栽培子实体[5],刘静等已成功实现了暗褐网柄牛肝菌的人工和半人工栽培,在凤凰木、咖啡、茶树和荔枝树下栽培均获得了成功,在云南西双版纳已实现了一定规模的人工种植。暗褐网柄牛肝菌极高的经济价值,促使研究优良菌株的筛选、菌株交配系、仿生栽培、菌株发生地的特点和土壤分析方面的报道较多[6-9]。随着暗褐网柄牛肝菌人工栽培技术取得的进展,已形成研究牛肝菌的模式种,如曹旸等进行了全基因组测序[10],并采用简单重复重复序列(simple sequence repeat,SSR)标记技术对暗褐网柄牛肝菌的5个多肽位点开发了标记,构建了相应的SSR指纹图谱[11]。牛肝菌含多种生物活性成分,具有多种生理功能[12],如赵云霞等研究指出,黑牛肝菌多糖能有效提高超氧化物歧化酶(superoxide dismutase,SOD)活性,降低丙二醛含量,对急性酒精损伤小鼠的心脏和脾脏有一定保护作用[13],真菌多糖是活性的物质基础,但对于暗褐网柄牛肝菌(黑牛肝)多糖的结构特征研究还未见报道,本研究对暗褐网柄牛肝菌的多糖进行了分离纯化和结构表征,为暗褐网柄牛肝菌的多糖活性物质研究提供了参考。
1 材料与方法
1.1 材料与试剂
暗褐网柄牛肝菌(Phlebopus portentosus)新鲜菌体,9月份采集于贵州兴义,命名为XY9-2。
DEAE-纤维素52、Sephadex G-100,上海瑞永生物科技公司;717阴离子柱、Dextran、葡萄糖、鼠李糖、岩藻糖、半乳糖、阿拉伯糖、甘露糖(均为分析纯),索莱宝试剂公司;三氟乙酸、H2SO4、氯仿、正丁醇、无水乙醇等其他试剂(均为分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
旋转蒸发仪RE52-2型,上海亚荣生化仪器公司;Bio-Rad PCR扩增仪、凝胶成像仪,美国伯乐公司;安捷伦1200高效液相色谱仪、自动进样器、G1352A RID检测器、7890A-5975C 气相色谱-质谱联用仪、DB-5色谱柱和质谱检测器,安捷伦科技有限公司;真空冷冻干燥机LGJ-10,北京松源华兴科技有限公司;VERTEX 70傅里叶变换显微红外/拉曼光谱仪,德国Bruker公司;ThermoScientific Multiskan FC酶标仪,美国赛默飞公司。
1.3 实验方法
1.3.1 DNA提取和ITS鉴定
采集的牛肝菌取菌盖和菌柄无菌连接处,液氮研磨,提取总DNA[14],真菌ITS1和ITS4通用引物扩增ITS序列,电泳检测后送上海生工测序。
1.3.2 粗多糖的提取和纯化
新鲜子实体250 g按1∶1质量比加ddH2O匀浆,沸水煮60 min,过滤后重复1次,合并2次滤液[15]。经热水浸提后的滤液按体积比4∶1加入氯化717阴离子柱,50 ℃、180 r/min振荡,保持4 h脱色,脱色后按Sevag法脱蛋白;将脱色、脱蛋白后的粗糖提取液100 mL过DEAE-52纤维柱,分别用ddH2O和不同浓度NaCl(0.05、0.1、0.2和0.3 mol/L)洗脱柱子(流速2 mL/min),用蒽酮-硫酸法检测多糖浓度并收集管中多糖溶液,在紫外620 nm处检测并绘制洗脱曲线;收集主要洗脱峰装入3 500 MW透析袋,用ddH2O脱盐(4 ℃透析48 h);透析后用Sephadex G-100柱子进一步纯化(ddH2O洗脱),多糖溶液经低温冷冻干燥得到精制多糖。
1.3.3 暗褐网柄牛肝菌多糖红外光谱
取1 mg暗褐网柄牛肝菌精制多糖,常规压片后进行红外扫描,扫描范围为4 000~400 cm-1。
1.3.4 暗褐网柄牛肝菌多糖分子质量
1.3.4.1 标准曲线的绘制
分别称取适量的Dextran标准品,将其配制成质量浓度3 g/L的对照品溶液,逐一进行HPLC检测,根据标准糖分子质量的保留时间(retention time,RT)绘制标准曲线,得出回归方程。
1.3.4.2 样品色谱条件
准确称取一定量的样品,用ddH2O配制成1 g/L 的溶液,Millipore 0.45 μm水系滤膜过滤,进样检测。TSKgel@G5000PWXL凝胶色谱柱,柱温20 ℃,0.002 mol/L NaH2PO4为流动相,流速0.6 mL/min。
1.3.5 暗褐网柄牛肝菌多糖单糖成分及摩尔比
1.3.5.1 多糖水解及柱前衍化
取10 mg多糖样品于梨形瓶中,加入2 mL 2 mol/L H2SO4,充入N2并在油浴锅里100 ℃水解8 h,水解结束后用0.3 mol/L NaOH中和至中性,离心取上清液200 μL,依次加入100 μL 0.5 mol/L PMP甲醇溶液和100 μL 0.3 mol/L NaOH,70 ℃水浴60 min,冷却后加入100 μL 0.3 mol/L 的HCl,混匀后加入1 mL CCl3萃取,离心取上清。重复3次,过0.22 μm水相滤膜备用。标准品同法处理。
1.3.5.2 色谱条件
流动相为0.05 mol/L V(磷酸盐)∶V(乙腈)=82 ∶12),流速为1.0 mL/min,检测波长为250 nm,柱温为30 ℃。
1.3.6 暗褐网柄牛肝菌多糖甲基化
1.3.6.1 甲基化及解聚
取2 mg多糖样品置于梨型瓶中,加入1 mL DMSO,溶解后加入0.6 mL 0.375 mol/L的NaOH-DMSO悬液,冰浴、缓慢滴加碘甲烷1 mL,混匀后加入3 mL水振荡终止反应。加入3 mL氯仿萃取,离心取下层有机相,向氯仿相加入少量无水Na2SO4,充分混合以除去残留的水分,过0.45 μm有机滤膜,收集滤液后用N2吹干。将已完全甲基化的样品溶于3 mL 90%的甲酸溶液中,密塞,100 ℃解聚3 h,向反应瓶中加入3 mL甲醇,40 ℃下减压浓缩蒸干,解聚完成。
1.3.6.2 水解及乙酰化
加入3 mL 2 mol/L三氟乙酸,120 ℃下水解4 h,冷却至室温,加入0.5 mL甲醇于40 ℃下减压旋干,彻底去除三氟乙酸。干燥后的样品加入1 mL浓度为1.6 mol/L盐酸羟胺溶液(盐酸羟胺溶于吡啶中),密闭且充分振荡,置于90 ℃真空干燥箱中氧化30 min。冷却至室温,加入0.2 mL 1-甲基咪唑和1 mL乙酸酐充分振荡混合均匀。密闭,置于90 ℃真空干燥箱中反应30 min,冷却至室温形成乙酰化的衍生物。加入1 mL的三氯甲烷和1 mL的水,混匀后静置数分钟待分层,去除上层水相,得到的氯仿层加入适量无水Na2SO4去除水分,过0.45 μm的有机系滤膜,置于进样瓶中进行气相色谱分析。
1.3.7 暗褐网柄牛肝菌多糖核磁共振
称取5 mg多糖样品溶于0.8 mL D2O中,并测定氢谱。
1.3.8 暗褐网柄牛肝菌多糖扫描电镜镜像
取少量真空干燥的暗褐网柄牛肝菌多糖样品固定在样品架上,真空镀金,使样品处于导电状态,10 kV电压下进行电镜扫描。
2 结果与分析
2.1 子实体鉴定
新鲜子实体菌盖肥厚,直径可达4.5~26.0 cm;菌柄粗壮,基部膨大(4.2~9.1)cm×(3.3~6.0)cm,参照《中国真菌志》第22卷《牛肝菌科I》进行形态学鉴定[16];图1为基于ITS序列比对结果,在NCBI上Blast N显示XY9-2与暗褐网柄牛肝菌HQ687223有100%同源性,经过形态学和分子生物学鉴定,该野生子实体为暗褐网柄牛肝菌(Phlebopus portentosus)。

图1 基于ITS序列构建的NJ系统发育树
Fig.1 NJ Phylogenetic tree based on ITS sequence
2.2 暗褐网柄牛肝菌多糖的分离纯化
如图2所示,粗多糖过DEAE-纤维素柱,不同浓度NaCl洗脱后得到3个组分,收集较多的组分I经透析袋(3 500 Mw)透析后冻干,用ddH2O复溶后过葡聚糖G-100凝胶柱纯化,ddH2O洗脱后根据洗脱曲线收集均一组分冻干,得到精制多糖AHP,如图3所示。
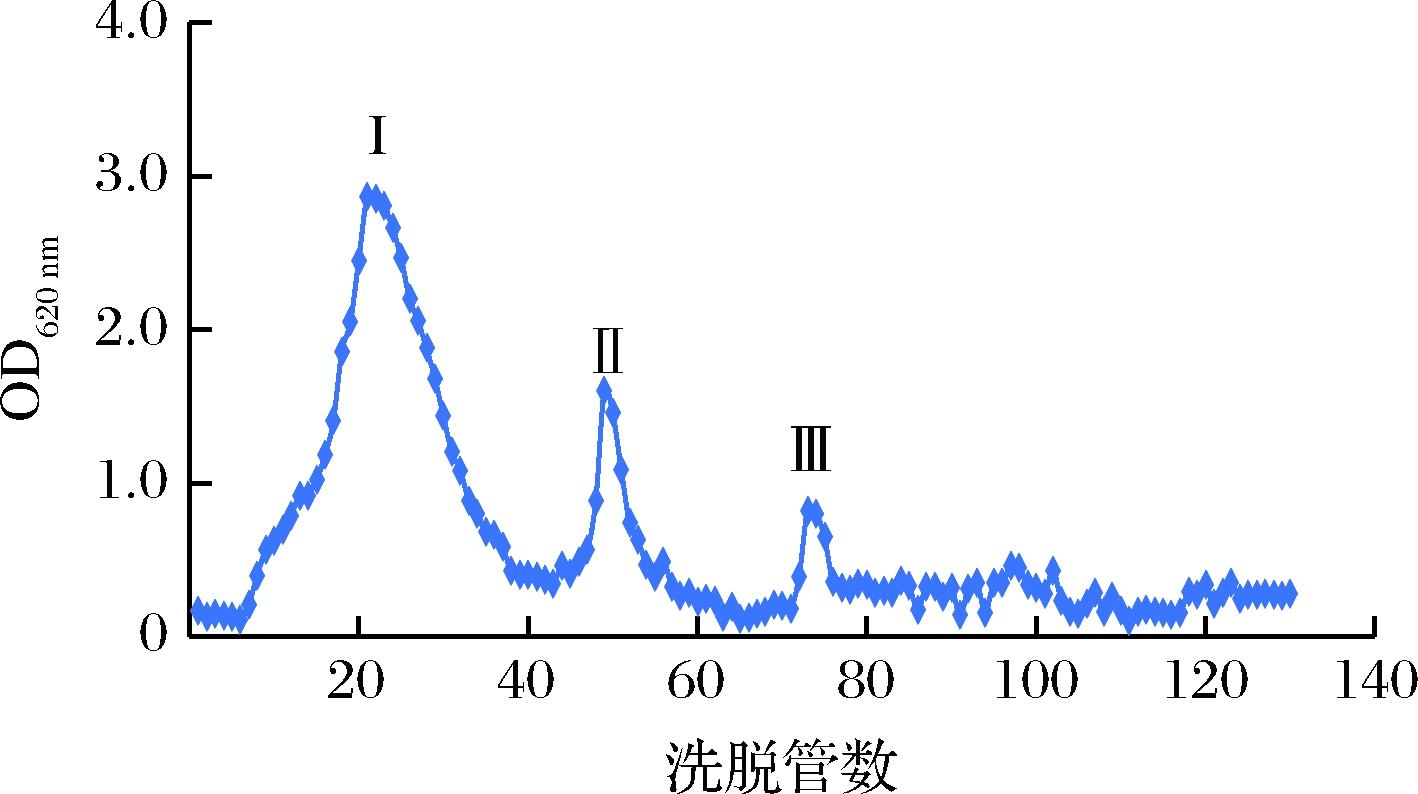
图2 AHP的DEAE-纤维素离子交换柱层析洗脱曲线
Fig.2 Elution curve of AHP with DEAE-cellulose ion exchange column chromatography
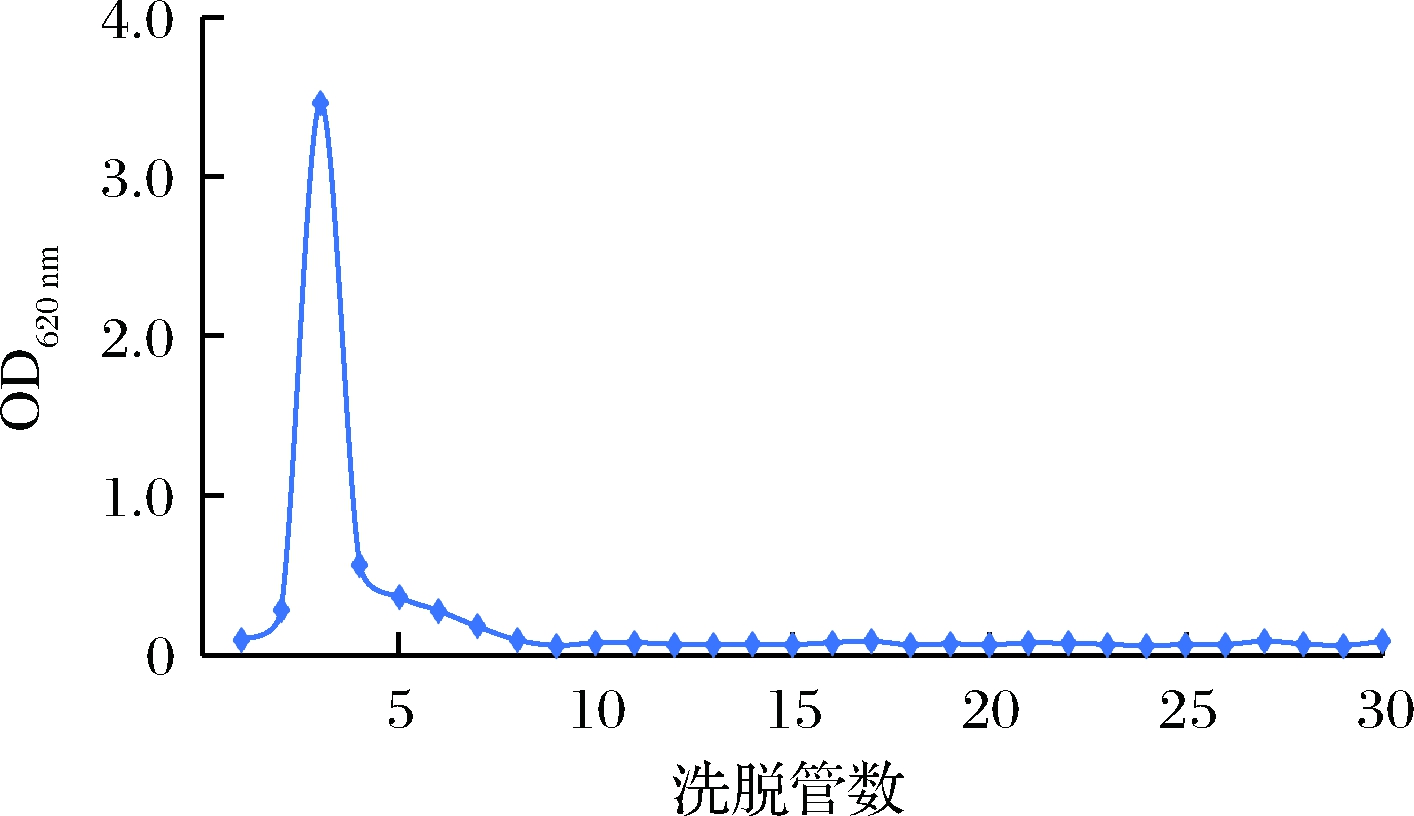
图3 AHP过凝胶柱G-100
Fig.3 Elution curve of AHP with G-100 exchange column chromatography
2.3 红外光谱分析
如图4所示,暗褐网柄牛肝菌多糖具有明显的多糖特征吸收峰,3 409.58 cm-1处较宽的峰是—OH伸缩振动峰,2 923.60 cm-1是糖C—H伸缩振动峰,1 650.79 cm-1是酰胺羰基键,1 461.64 cm-1是C—H变角振动峰,1 246.52 cm-1为非对称的硫酸酯(S=O)伸缩振动特征峰,在1 138.66、1 064.76和1 038.07 cm-13处吸收峰是糖环上的C—O—C和C—O—H伸缩振动峰,表明存在D-吡喃环,964.15 cm-1是D-吡喃环非对称环伸缩振动峰,816.30 cm-1是甘露糖吸收峰,762.36 cm-1是D-吡喃环对称环伸缩振动峰[17-19]。红外分析暗褐网柄牛肝菌多糖AHP为吡喃糖,糖苷键类型为α构型。
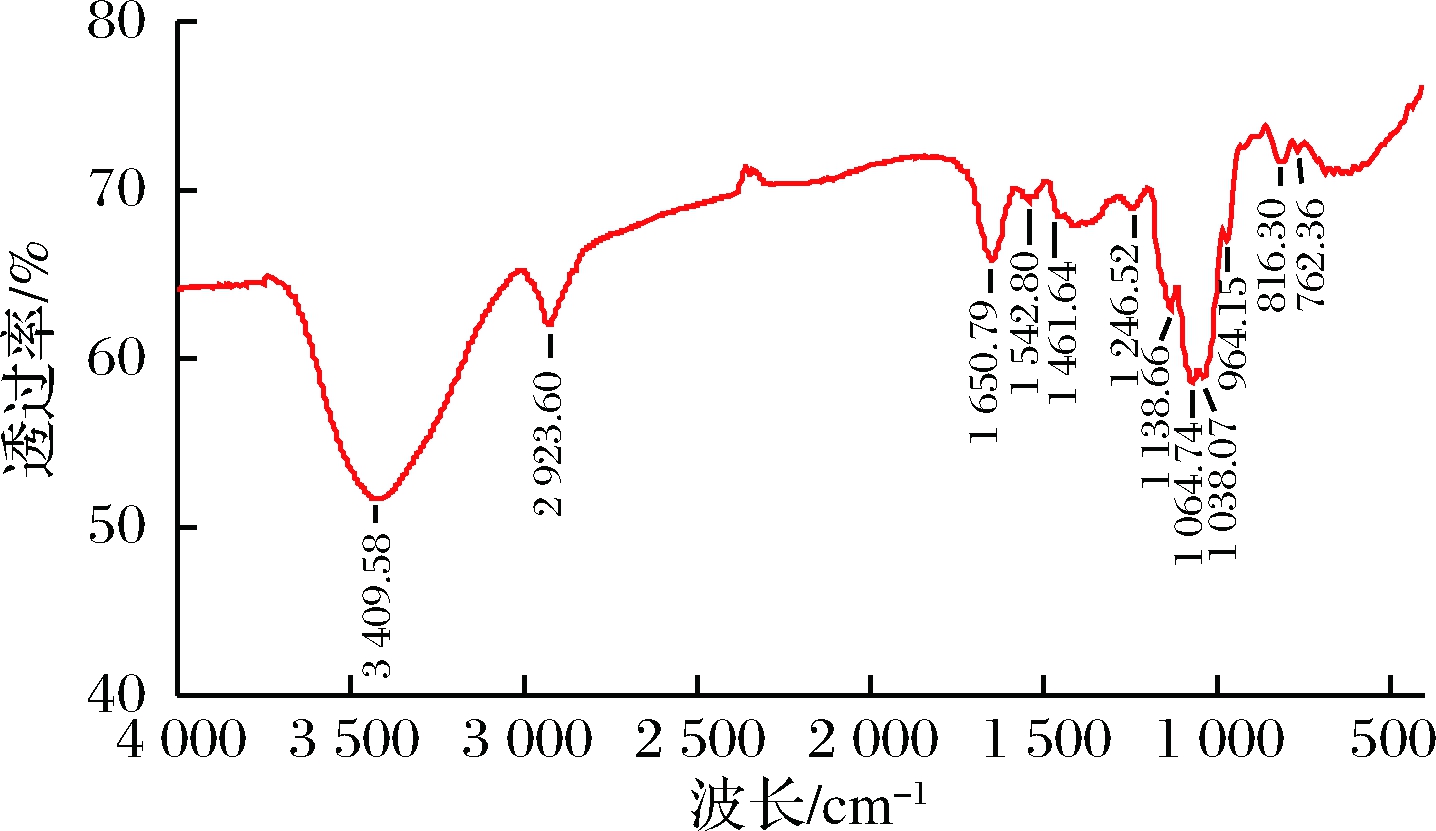
图4 AHP红外图谱
Fig.4 Infrared spectroscopy of AHP
2.4 核磁光谱氢谱
核磁共振氢谱(1H nuclear magnetic resonance spectra,1H-NMR)主要用于表征糖苷键的构型[20],如图5所示,C1质子化学位移位于δ 4.8~5.2 ppm,说明暗褐网柄牛肝菌含α型吡喃己糖,与红外结果相符。在δ 1.25 ppm处为C—6位脱氧糖的甲基质子信号峰。δ 3.5~4.25 ppm多个密集信号峰为不同糖残基非异头质子的亚甲基和次甲基上的质子共振峰交互重叠产生,表明暗褐网柄牛肝菌多糖结构复杂。
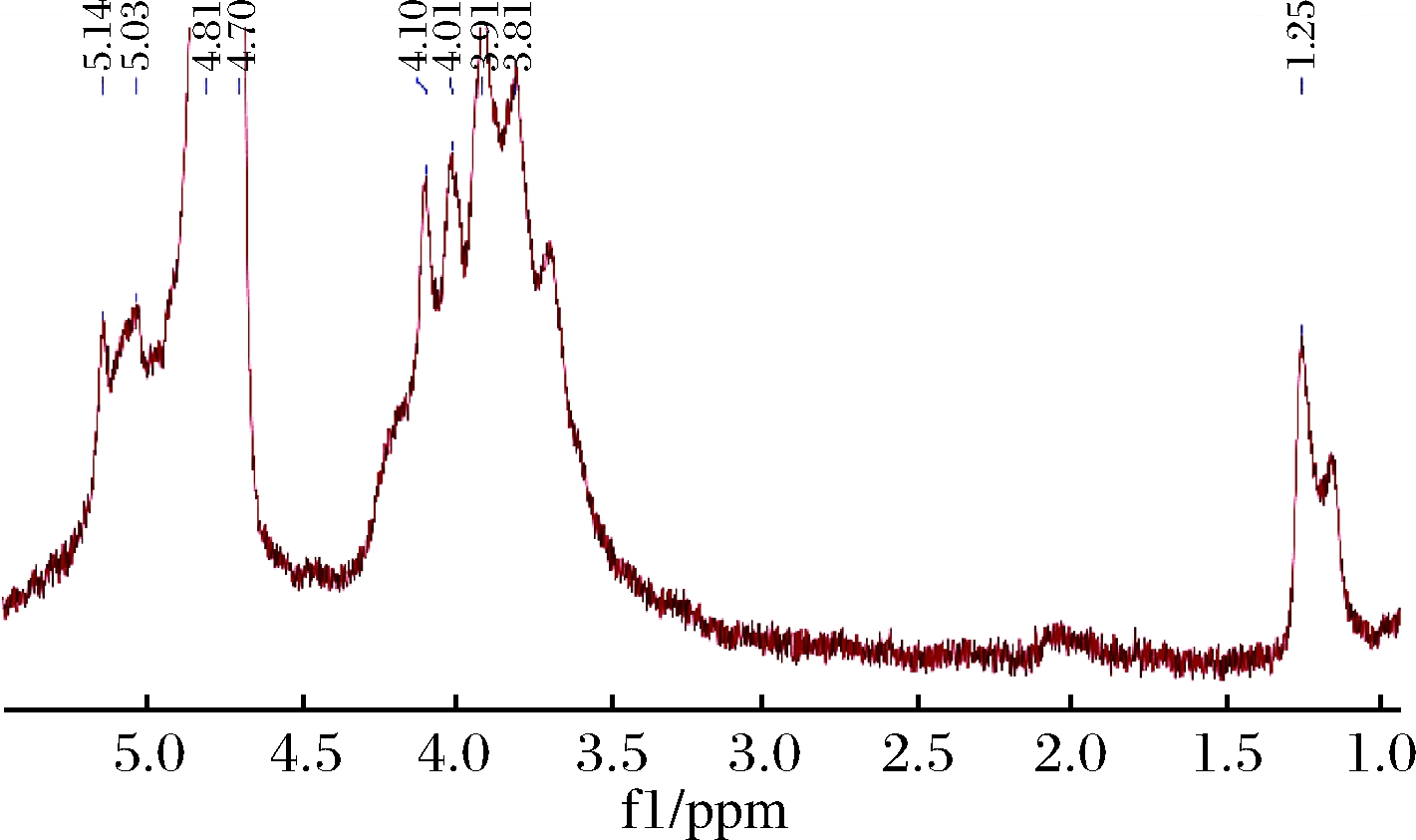
图5 AHP的1H-NMR图谱
Fig.5 1H-NMR spectroscopy of AHP
2.5 单糖组成
将多糖酸水解并衍生化后,在相同的高效液相色谱条件下进行单糖与混合单糖标准品比较,结果如图6所示,暗褐网柄牛肝菌多糖由甘露糖、鼠李糖、葡萄糖、半乳糖、岩藻糖组成,单糖摩尔比为1.54∶0.07∶0.25∶1.72∶0.96,甘露糖和半乳糖含量较多,与前面红外分析一致。
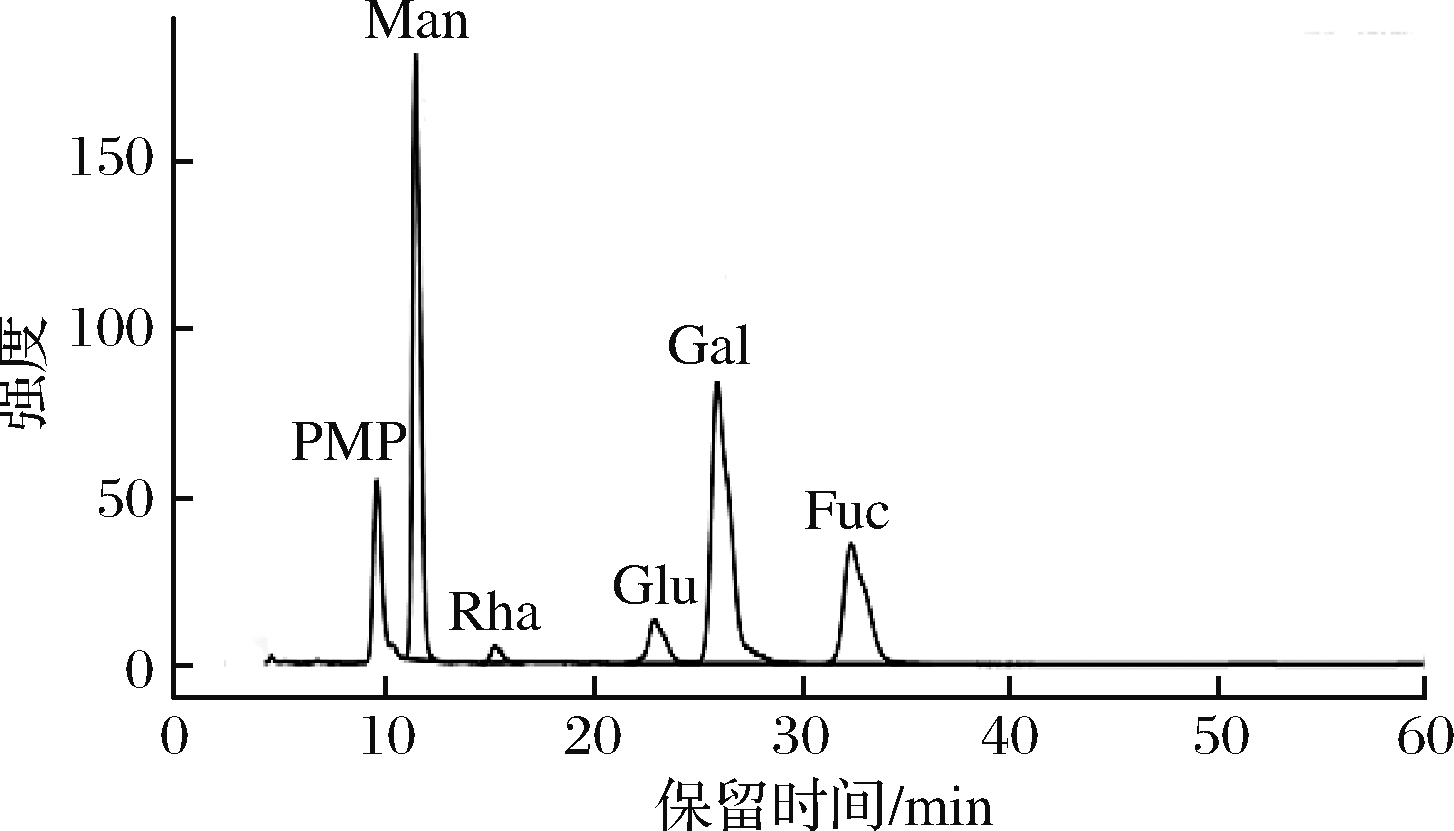
图6 AHP的高效液相水解色谱图
Fig.6 HPLC analysis of AHP polysaccharide hydrolysate
2.6 多糖纯度及分子质量测定
如图7所示,高效凝胶渗透色谱(high performance gel-permeationchromatography,HPGPC)检测暗褐网柄牛肝菌多糖呈单一狭窄对称峰,表明多糖AHP为均一组分,依据标准曲线得到回归方程:lgMw=-0.411x+10.414,R2=0.997 5,在保留时间为14.86 min时,分子质量为2.03×104Da。
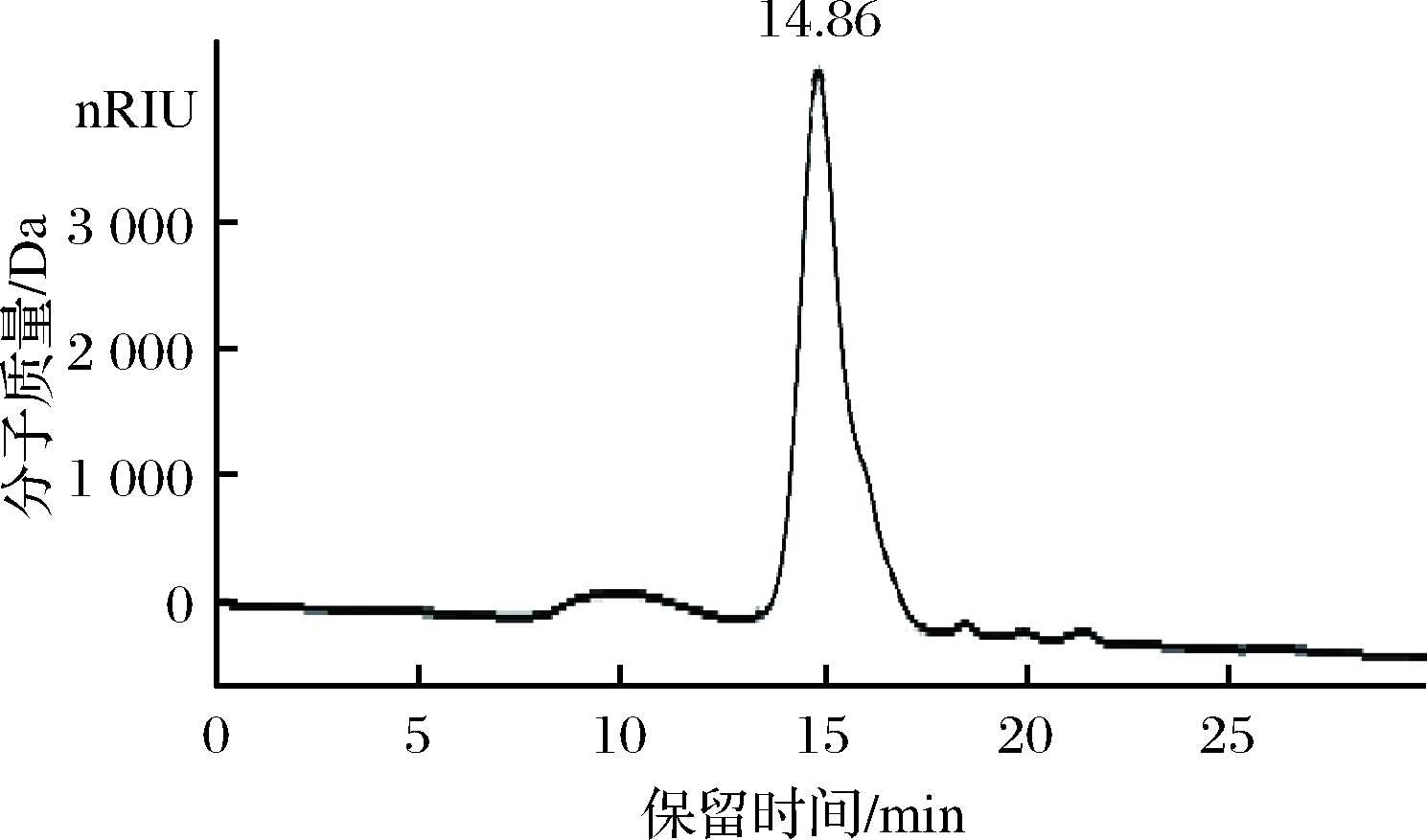
图7 AHP纯度及HPGPC图
Fig.7 Distribution of purity and HPGPC of AHP
2.7 多糖甲基化分析
气相色谱-质谱联用仪(gas chrmatography mass spectrometry,GC-MS)对甲基化的AHP糖苷键进行分析,结果如表1所示,AHP是杂多糖,存在9种连接方式:葡萄糖是→1,3)- Glcp连接,含量占20.56%;半乳糖主要是→1,6)- Galp,含量占32.71%;半乳糖还存在→1)- Galp,→1,3)- Galp残基,占所有残基的14.01%,其中→1)- Galp为非还原性末端基;其他岩藻糖和鼠李糖含量低,主要是→1,6)-Fucp和→1,3)- Rhap;甘露糖存在→1,2)- Manp,→1,6)- Manp和→2,4)- Manp 3种残基,占所有残基的27.68%;以上结果表明主链键型是1,3-或1,6-连接的多糖,单糖组成与前面HPGPC单糖组成分析一致。
表1 暗褐网柄牛肝菌多糖甲基化实验结果
Table 1 Methylation analysis data of P. portentosus polysaccharide
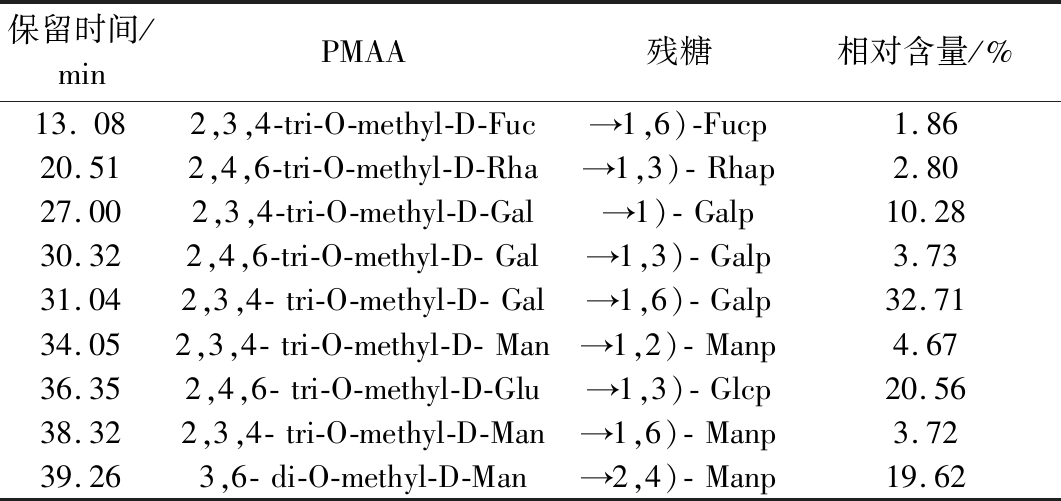
保留时间/minPMAA残糖相对含量/%13.082,3,4-tri-O-methyl-D-Fuc→1,6)-Fucp1.8620.512,4,6-tri-O-methyl-D-Rha→1,3)-Rhap2.8027.002,3,4-tri-O-methyl-D-Gal→1)-Galp10.2830.322,4,6-tri-O-methyl-D-Gal→1,3)-Galp3.7331.042,3,4-tri-O-methyl-D-Gal→1,6)-Galp32.7134.052,3,4-tri-O-methyl-D-Man→1,2)-Manp4.6736.352,4,6-tri-O-methyl-D-Glu→1,3)-Glcp20.5638.322,3,4-tri-O-methyl-D-Man→1,6)-Manp3.7239.263,6-di-O-methyl-D-Man→2,4)-Manp19.62
2.8 扫描电镜分析
如图8所示,扫描电镜下观察到暗褐网柄牛肝菌多糖AHP以疏松多孔的网格状为主,间隙分布有球状和少量丝状结构,在500倍电镜下,可见大面积具长链的多分枝结构,分子间交叉相连,说明暗褐网柄牛肝菌多糖的分子质量较大;在2 000倍电镜下可见网状结构边缘是光滑、平整的,说明分子间有相互作用力,能形成紧密而稳定的结构。
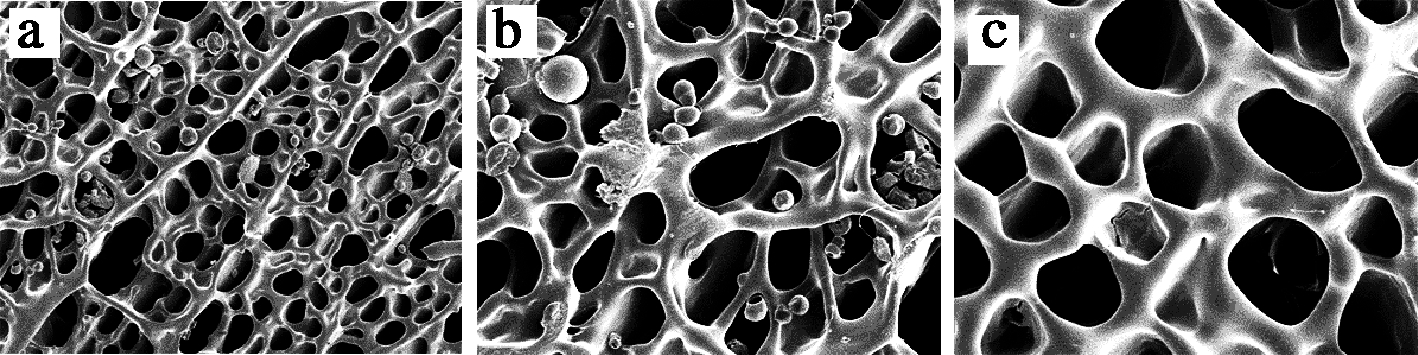
a-500放大倍率;b-1 000放大倍率;c-2 000放大倍率
图8 暗褐网柄牛肝菌多糖AHP的SEM图像
Fig.8 SEM images of AHP polysaccharide
3 结论
从暗褐网柄牛肝菌中分离到的多糖AHP,色泽乳白,质地较轻、能溶于水。精制多糖AHP的分子质量为2.03×104 Da,分子质量较大对保证多糖的生理活性具有重要作用,水解后单糖组成为甘露糖、鼠李糖、葡萄糖、半乳糖和岩藻糖,单糖摩尔比为1.54∶0.07∶0.25∶1.72∶0.96,真菌提取的多糖甘露糖含量相对较多,说明甘露糖对维持真菌多糖大分子结构有重要作用[21-33]。甲基化表明AHP主链结构复杂,键型有→1,6)- Galp半乳聚糖,占32.71%;→1,3)- Glcp葡聚糖占20.56%,→2,4)- Manp甘露聚糖占19.62%,此外还有→1,3)鼠李糖,→1,6)-岩藻糖和部分→1)、→1,3)半乳糖和少量→1,2)、→2,4)甘露糖形成的糖苷键,多糖中多位点连接在扫描电镜下显示出交错而又致密的结构。本研究对暗褐网柄牛肝菌多糖进行了分离纯化和结构表征,为进一步研究暗褐网柄牛肝菌多糖的活性奠定了理论基础,也可为真菌多糖的衍生化研究提供依据。
[1] 李泰辉,宋斌.中国牛肝菌已知种类[J].贵州科学,2003,21(1-2):78- 83.
[2] 胡生华,朱志钢,李文佳,等.暗褐网柄牛肝菌研究进展[J].食用菌,2018,40(1):6-8.
[3] 王林,马青云,黄圣卓,等.牛肝菌化学成分及其生物活性的研究进展[J].热带生物学报,2017,8(1):127-132.
[4] 兰茂.滇南本草[M].昆明:云南人民出版社,1959.
[5] JATURONG KUMLA, BOONSOM BUSSABAN, NAKARIN SUWANNARACH, et al. Basidiome formation of an edible wild, putatively ectomycorrhizal fungus, Phlebopus portentosus without host plant[J]. Mycologia, 2012, 104(3):597-603.
[6] 刘静,何明霞,王文兵,等.暗褐网柄牛肝菌仿生栽培研究[J].西南农业学报,2017,30(5):1 176-1 182.
[7] 何明霞,许欣景,高锋,等.暗褐网柄牛肝菌优良菌株的筛选[J].食用菌学报,2017,24(1):33-38.
[8] 曹旸,方艺伟,高锋,等.暗褐网柄牛肝菌交配系统研究[J].北方园艺,2016(24):133-135.
[9] 刘静,高锋,张春霞,等.云南暗褐网柄牛肝菌发生地的特点及土壤分析[J].北方园艺,2018(7):139-146.
[10] CAO Y, ZHANG Y, YU Z F, et al. Genome sequence of Phlebopus portentosus strain PP33, a cultivated bolete[J]. Genome Announcements, 2015, 3(2):326.
[11] 曹旸,何明霞,高锋,等.基于SSR标记的暗褐网柄牛肝菌遗传多样性分析[J].北方园艺,2017(8):111-114.
[12] 郭磊,华燕,王军民.牛肝菌生物活性成分研究进展[J].食品研究与开发,2019,40(19):220-224.
[13] 赵云霞,陶明煊,郭永月,等.黑牛肝菌多糖多酒精性损伤小鼠心脏及脾脏抗氧化作用的研究[J].南京师范大学学报,2014,37(1):133-136.
[14] 何山文,雷琼,马立安.2种提取野生蕈菌DNA方法的比较及其应用[J].长江大学学报(自科版),2018,15(6):43-47.
[15] 伍燕,申利群,朱华.假芝菌丝体多糖ARP的纯化、结构及抗氧化活性[J].食品与发酵工业,2019,45(9):214-219.
[16] 臧穆.中国真菌志·第二十二卷·牛肝菌科(I)[M].北京:科学出版社,2012:158-159.
[17] 邸维,张英春,易华西,等.乳酸菌胞外多糖结构解析的研究方法[J].分析化学,2018,46(6):875-882.
[18] 张化朋,张静,南征,等.杏鲍菇多糖WPP2的结构表征及抗肿瘤活性[J].高等学校化学学报,2013,34(10):2 327-2 333.
[19] 范三红,贾槐旺,张锦华,等.羊肚菌多糖纯化、结构分析及抗氧化活性[J].食品与发酵工业,2020,46(3):256-262.
[20] 刘玉红,王凤山.核磁共振波谱法在多糖结构分析中的应用[J].食品与药品,2007,9(8):39-43.
[21] 田有秋,贾金霞,束旭,等.淡红侧耳子实体多糖的分离纯化及结构探析[J].食品与发酵工业,2018,44(12):66-72.
[22] 阮家耀,王星丽,瞿亮,等.杏鲍菇子实体多糖的分离纯化及结构研究[J].食品与发酵工业,2014,40(4):77-81.
[23] 葛梦蝶,代安然,杨崇婧,等.虎奶菇菌丝体细胞壁成分分析及多糖结构表征[J/OL].食品与发酵工业,http://kns.cnki.net/kcms/detail/11.1802.TS.20200120.1513.024.html.