果酒的自然发酵是一个多菌种共同作用的复杂过程[1]。酵母菌在该过程中发挥着至关重要的作用,根据其发酵性能的差异,可将酵母菌分为酿酒酵母(Saccharomyces cerevisiae)和非酿酒酵母(non-Saccharomyces yeast)两大类[2]。酿酒酵母发酵活性强,酒精代谢旺盛,主要进行酒精发酵[3]。非酿酒酵母可合成多种酶,如蛋白酶、果胶酶、糖苷酶、纤维素酶等,并作用于果汁中相关底物,促进风味物质的释放,在很大程度上影响果酒的色泽、风味以及复杂度[4]。常见的非酿酒酵母有假丝酵母属 (Candida)[5]、毕赤酵母属 (Pichia)[6]、有孢汉逊酵母属(Hanseniaspora)[7]、克鲁维酵母属 (Kluyveromyces)[8]、梅奇酵母属 (Metschnikowia)[9]等。因此,将在非酿酒酵母与酿酒酵母进行混菌发酵果酒,有利于改善果酒品质,增加果酒风味物质的复杂性。CLEMENTE-JIMENEZ等的研究结果发现,在美极梅奇酵母 (Metschnikowia pulcherrima)与酿酒酵母共培养时,二者具有协同作用,有助于包括脂肪酸、酯和萜烯醇等多种芳香化合物的产生[10]。ANFANG将酿酒酵母和克鲁维毕赤酵母(Pichia kluyveri)进行混合发酵时发现,二者按照1∶9的比例接种时,提高了长相思酿造葡萄酒中3-巯基己基乙酸盐的浓度[11]。此外,某些季也蒙毕赤酵母(Pichi aguillermondii) 菌株具有羟基肉桂酸脱羧酶活性较强,可促进乙烯基苯酚类吡喃花青素的合成,有助于葡萄酒颜色稳定性的保持[12]。尽管近年来,国内在非酿酒酵母领域研究发展较为迅速,但目前对非酿酒酵母研究主要集中在葡萄酒领域,在其他果酒酿造中的了解还十分有限。
刺梨(Rosa roxburghii),蔷薇科、蔷薇属植物,广泛分布于我国西南地区,其果实营养价值具有丰富的应用价值和药用价值[13]。贵州省将刺梨作为本省重点发展的特色产业之一,近年来发展迅速,2018年全省种植面积达1 465 km2,生产总值达31.61亿元。此外,贵州龙里刺梨还成为国家地理标志产品,受到国家层次的保护。但刺梨鲜果生食口感不佳,将其发酵生产为刺梨果酒是一种比较好的选择,既保持了刺梨中丰富的营养成分,又带动了产业发展[14]。但目前对刺梨果酒酿造酵母方面的研究还比较少,缺乏优质刺梨发酵果酒专用酵母。生产上多采用葡萄酒酿酒酵母进行发酵刺梨果酒。该类酵母发酵性能较好,但产香能力不足[15]。因此,本研究采用传统的微生物分离技术,并结合嗅闻法,从贵州刺梨上选育出1株产香浓郁的非酿酒酵母,分析了其生理特性,将其与商业化酿酒酵母进行混菌发酵,探讨其对刺梨果酒风味的影响。
1 材料与方法
1.1 材料与试剂
新鲜贵农5号刺梨,采自贵州省黔南布依族苗族自治州龙里县;YPD、WL培养基、赖氨酸固体培养基,贵州博奥瑞杰生物科技有限公司;对硝基苯基-β-D吡喃葡萄糖苷(p-nitrophenyl-β-D-glucopyranoside, p-NPG),中国上海源叶生物公司;ZYMAFLORE X16(简称X16)酿酒酵母,法国LAFFORT公司;其余试剂均为国产分析纯,贵州博奥瑞杰生物科技有限公司。
1.2 仪器与设备
UH5300紫外分光光度计,日本日立公司; 雷磁PHSJ-3F pH仪,上海仪电科学仪器股份有限公司,CKX41倒置显微镜,日本OLYMPUS公司;SZM体视显微镜,中国宁波舜禹仪器有限公司;SA402B电子舌味觉系统,日本INSENT公司;Bio-rad T100TMPCR仪,美国伯乐公司;TQ8040NX气相质谱联用仪,日本岛津仪器有限公司。
1.3 实验方法
1.3.1 菌株分离与鉴定
称取100 g新鲜成熟刺梨捣碎,放入250 mL无菌锥形瓶中,密封28 ℃进行自然发酵。分别于发酵第1、 3、 5天取样,梯度稀释法涂布于YPD固体平板上,28 ℃,培养48 h。然后继续挑取每个平板上的单克隆,划线于YPD固体平板上,直至为纯的单克隆为止。
挑取YPD固体平板上纯的单克隆菌株,草酸铵结晶紫简单染色,然后置于显微镜观察细胞形态和生殖方式观察。挑取YPD固体平板上单克隆菌株划线于赖氨酸培养基上,28 ℃培养3 d,观察其生长情况。选YPD固体平板上纯的单克隆菌株划线于WL固体培养基上28 ℃,培养5 d,观察菌落颜色和形态。
PCR法扩增菌体26S rDNA D1/D2区域,PCR反应体系为2×Taq PCR Master Mix 25 μL,10 μmol/L NL1引物和NL4引物各2 μL,菌液2 μL,补水至反应总体积25 μL。反应结束后取5 μL PCR产物琼脂糖凝胶电泳检测。PCR产物送生工生物工程(上海)股份有限公司进行测序,测序结果在NCBI上进行BLAST同源序列搜索比对。
1.3.2 菌株生长曲线
F119菌株以106CFU/mL接种于YPD液体培养基,28 ℃、180 r/min条件下培养,每隔4 h取样,以YPD液体培养基作为空白对照,在600 nm处测定菌悬液OD值,平行重复3次,共取样40 h。根据时间和OD600 nm值绘制生长曲线。
1.3.3 菌株耐受性测定
糖耐受性:将菌株F119以106CFU/mL浓度接种于葡萄糖质量浓度分别为100、150、200、250、300 g/L的YPD液体培养基中,28 ℃、180 r/min条件下培养34 h,在600 nm处测定菌悬液OD值,平行重复3次。
酒精耐受性:将菌株F119以106CFU/mL接种于酒精体积分数分别为3%、6%、9%、12%、15%的YPD液体培养基, 28 ℃、180 r/min条件下培养34 h,在600 nm处测定菌悬液OD值,平行重复3次。
SO2耐受性:将菌株F119以106CFU/mL接种于SO2质量浓度分别为50、 100、 150、 200、 300 mg/L的YPD液体培养基中。28 ℃、180 r/min条件下培养34 h,在600 nm波长处测定菌悬液OD值,平行重复3次。
酸耐性[16]:将菌株F119以106CFU/mL接种于含柠檬酸酸度分别为1.5%、2.0%、2.5%、3.0%的YPD液体培养基,28 ℃、180 r/min条件下培养34 h,在600 nm处测定菌悬液OD值,平行重复3次。
1.3.4 硫化氢产生能力
取10 μL 106CFU/mL的F119菌液滴加在亚硫酸铋培养基表面上的滤纸片,待液体完全吸收后,28 ℃倒置培养5 d,观察滤纸片变色情况。菌株产硫化氢能力由高到低,显色情况分别为显棕黑色、棕色、墨绿色、淡墨绿色及不显色。
1.3.5 产β-葡萄糖苷酶能力
参考侯晓瑞等研究方法采用p-NPG法分析菌株产β-葡萄糖苷酶能力[17]。F119菌株以106 CFU/mL接种于YPD培养基中,28 ℃,200 r/min培养72 h,取1 mL发酵液于离心管中,4 ℃、8 000 r/min离心10 min,取上清液作为粗酶液。取0.1 mL粗酶液与0.2 mL 35 mmol/L p-NPG混匀,40 ℃保温30 min,加入2 mL 1 mol/L Na2CO3终止反应,于400 nm波长处测定吸光度。酶活力单位(U)定义为pH 5.0、50 ℃条件下,1 min水解p-NPG 产生1 μmol 对硝基苯酚(p-nitrophenol,p-NP)所需酶量。
1.3.6 刺梨果酒理化指标检测
将菌株F119和酿酒酵母X16种子液以1∶1混合接种于刺梨汁中,菌株终浓度为108 CFU/mL, X16单独发酵作为对照,每个样本3个平行重复。25 ℃恒温静置培养,直至发酵结束。发酵结束后, 4 ℃、3 000 r/min离心5 min去残渣,上清液用于后续分析。
采用蒽酮法测定刺梨果酒中总糖含量。乙酸乙酯配置15 mg/mL蒽酮溶液,0.2 mg/mL葡萄糖标准液。分别取葡萄糖标准液0、0.2、0.4、0.6、0.8、1.0 mL于试管中,稀释至2 mL,蒽酮试剂0.5 mL,冷水浴中加入浓H2SO4 5 mL,摇匀。迅速放入水浴锅中,80 ℃下水浴15 min,取出后流动水冷却至室温,在620 nm处测定其吸光度。以糖含量为横坐标,吸光度为纵坐标,绘制标准曲线。采用GB/15038—2006 葡萄酒、果酒通用分析方法测定刺梨果酒糖含量,测定值带入标准曲线换算为样品中葡萄糖值,并对混合发酵刺梨果酒酒精度,总酸和挥发酸进行测定。
1.3.7 刺梨果酒感官特性测定
取发酵刺梨果酒样品80 mL,倒入电子舌专用烧杯中。根据仪器说明书步骤进行检测。试验采用清洗溶液和刺梨果酒样本交替检测序列进行,清洗溶液为专用电极清洗液。采样时间120 s,采样速度为1次/s,每个样品平行测定3次。
1.3.8 刺梨果酒挥发性香气特性测定
参考陈思奇等[18]、蒋宝等[19]方法分析刺梨果酒香气特性,取8 mL刺梨果酒,加入2.0 g NaCl,40 ℃水浴萃取刺梨果酒中挥发性香气物质。GC-MS分析条件为PEG.20 m弹性石英毛细管柱(30 m×250 μm×0.25 μm),氦气流量1 mL/min。进样口温度50 ℃,出样口温度235 ℃。离子源温度230 ℃;四极杆温度为150 ℃,调谐EMV 947V,质量扫描范围为30.00~500.00 amu。NIST 14.L标准谱库检索并匹配GC-MS采集得到的数据,进行定性分析。采用峰面积归一化法进行物质的定量分析。
1.4 数据分析
数据结果以平均值±标准差表示,采用SPSS 21.0进行数据单因素方差分析(ANOVA)检验差异显著性,P<0.05为差异有统计学意义。
2 结果与分析
2.1 非酿酒酵母的筛选与鉴定
赖氨酸培养基鉴定结果表明,刺梨自然发酵液中共分离得到80株非酿酒酵母菌。采用嗅闻法筛选出1株果香和酒香味较浓的酵母菌株,命名为F119。F119菌种在WL培养基上,菌落深绿色、边缘平整、光滑湿润(图1-A);在YPD培养基上菌落黄白色、有光泽、边缘整齐、凸起、表面湿润(图1-B);菌株显微形态为柠檬状,出芽繁殖。结合菌落形态特点与细胞形态特征,初步认为F119为1株刺梨来源的汉逊酵母属菌株(Hanseniaspora sp.)。

A-F119在WL培养基菌落形态;B-F119在YPD培养基菌落形态;C-F119的细胞形态(100×,bar=100 μm)
图1 刺梨葡萄汁有孢汉逊酵母F119菌落与细胞形态
Fig.1 Cellular and colonial morphologies of the F119 strain
PCR方法对F119 菌株26S rDNA D1/D2区域进行扩增,在约600 bp处扩增到1条特异性条带(图2)。扩增产物经测序和BLAST比对,发现与葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)同源性高达99.66%。因此,F119为1株来源于刺梨的葡萄汁有孢汉逊酵母。
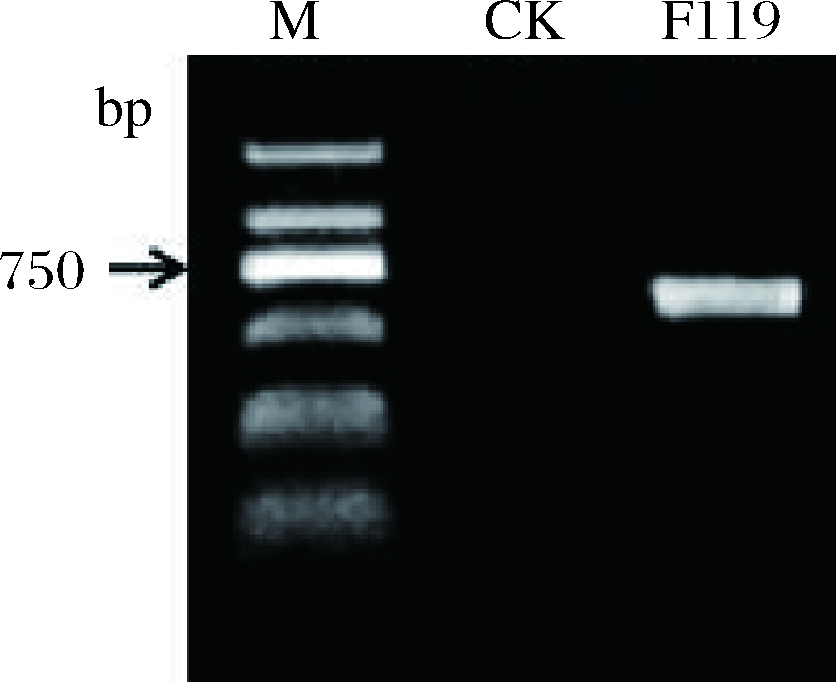
图2 F119菌株26S rDNA D1/D2区域PCR扩增结果
Fig.2 Amplification of 26S rDNA D1/D2 domain of F119 strain
2.2 非酿酒酵母F119生长曲线
非酿酒酵母菌株F119生长曲线如图3所示,基本上包括了延滞期、对数生长期、减速期和稳定期。其中前4 h 为延滞期,4~12 h为对数生长期,12~24 h为减速期,24 h后基本上达到稳定期。在减速期F119生长速率小于商业化的酿酒酵母X16,且减速期时间比X16长;在稳定期F119菌体浓度要低于X16。
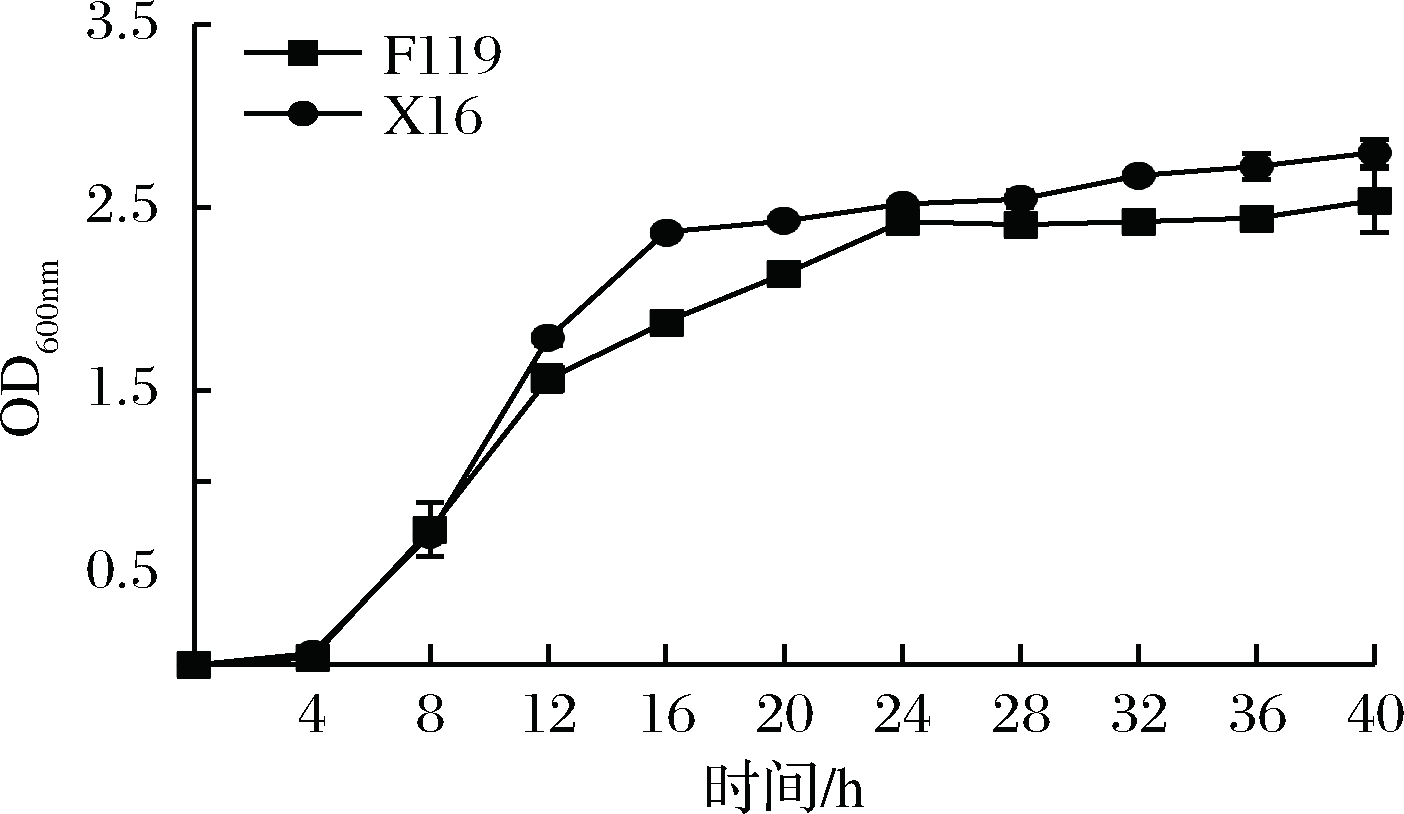
图3 非酿酒酵母F119生长曲线
Fig.3 Growth curve of non-Saccharomyces yeast F119 strain
2.3 非酿酒酵母F119生理特性分析
菌株F119葡萄糖耐受性结果如图4-A所示,F119可耐受0~300 g/L葡萄糖浓度,在此均可生长。从葡萄糖质量浓度250 g/L开始,菌体浓度略微降低。但0~300 g/L葡萄糖质量浓度范围内,F119菌体浓度均低于商业化酿酒酵母X16。
菌株F119柠檬酸耐受性结果如图4-B所示,菌株F119在酸度1%~3%均可生长,不受影响,且与商业化酿酒酵母X16之间无显著差异,表明非酿酒酵母F119菌株具有较强的柠檬酸耐受性。
菌株F119乙醇耐受性如图4-C所示,F119菌体浓度随着乙醇体积分数的增大而逐渐降低,在乙醇体积分数6%时生长显著受到抑制。在各乙醇体积分数处理下,F119菌株浓度均低于商业化酿酒酵母X16。
菌株F119 SO2耐受性结果如图4-D所示,F119菌株在SO2质量浓度0~300 mg/L均可生长,变化较小,与商业化酿酒酵母X16之间无显著区别,暗示F119可耐受300 mg/L SO2。
2.4 硫化氢产生能力
在酒类酿造中,菌体自溶分解可产生硫化氢。硫化氢具有臭鸡蛋味,对酒体风味具有不良影响。硫化氢产生能力一般是由菌体本身遗传背景决定的。菌株F119硫化氢产生能力如图5-A所示,滤纸片无色,表明F119不产生硫化氢。而对照组X16滤纸片为棕色,说明具有较强的硫化氢产生能力(图5-B)。因此,菌株F119产硫化氢产生能力要低于X16。
2.5 β-葡萄糖苷酶产生能力
以对硝基苯酚浓度为横坐标,400 nm下的吸光值为纵坐标,绘制标准曲线,其回归方程为:y=0.130 2x+0.022 6,R2=0.999 5,吸光值与对硝基苯酚浓度之间具有较好的线性关系。p-NPG测定结果发现,F119分泌β-葡萄糖苷酶能力较低,为(13.98±0.21)mU/mL(表1)。而对照组,商业酿酒酵母X16产β-葡萄糖苷酶量为(25.41±0.06)mU/mL,为F119产酶量的1.8倍。
2.6 非酿酒酵母F119对刺梨果酒品质的影响
2.6.1 对刺梨果酒常规理化指标的影响
以商业化酿酒酵母X16纯种发酵为对照,将非酿酒酵母F119与X16进行混合发酵刺梨果酒。刺梨果酒基本理化指标如表2所示,F119混合发酵刺梨果酒的pH值、乙醇体积分数、挥发酸与X16纯种发酵刺梨果酒相比,无显著区别;F119混合发酵刺梨果酒的总糖、总酸低于X16纯种发酵刺梨果酒。

A-葡萄糖质量浓度;B-酸度;C-乙醇体积分数;D-SO2质量浓度
图4 非酿酒酵母F119生理耐受性
Fig.4 Physiological tolerance of non-Saccharomyces yeast F119 strain
注:与X16组相比较,*表示差异显著(P<0.05);**表示差异极显著(P<0.01)
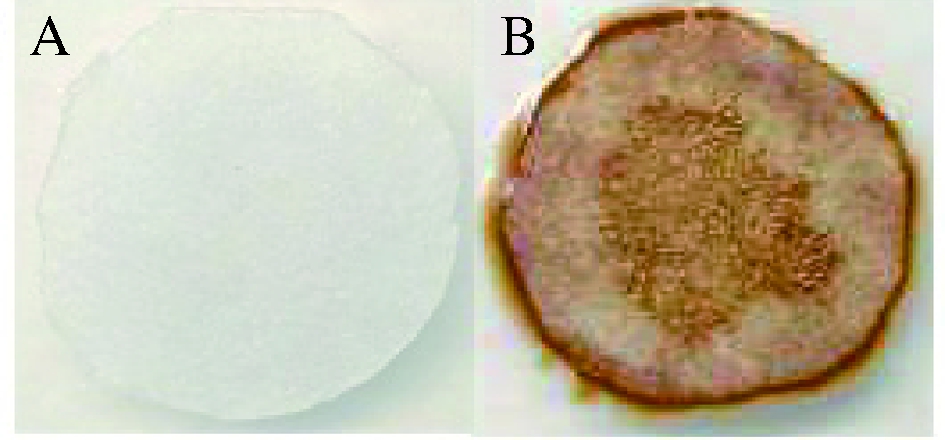
A-F119;B-X16
图5 F119硫化氢产生能力鉴定结果
Fig.5 Analysis of hydrogen sulfide production ability of F119 strain
表1 p-NPG显色法产β-葡萄糖苷酶能力测定
Table 1 Determination of β-glucosidase production by p-NPG chromogenic method

菌种编号产酶量/(mU·mL-1)F11913.98±0.21X1625.41±0.06
2.6.2 非酿酒酵母F119对刺梨果酒感官品评的影响
采用电子舌传感器,分析了非酿酒酵母F119对刺梨果酒感官品评的影响。结果表明,在酸味、苦味、涩味、丰富度、后味B、后味A、鲜味、咸味等滋味方面,非酿酒酵母F119、酿酒酵母X16混合发酵刺梨果酒与酿酒酵母X16纯种发酵刺梨果酒之间无显著区别(图6)。
表2 刺梨果酒的理化指标
Table 2 Physical and chemical indicators of R. roxburghii wine

菌种编号乙醇体积分数/%pH总酸/(g·L-1)总糖/(g·L-1)挥发酸/(g·L-1)F119+X1612.0±0.303.45±0.013.87±0.07∗5.51±0.48∗0.69±0.05X1611.3±0.503.41±0.014.22±0.067.71±0.390.72±0.02
注:*表示与X16组相比较差异显著(P<0.05)(下同)
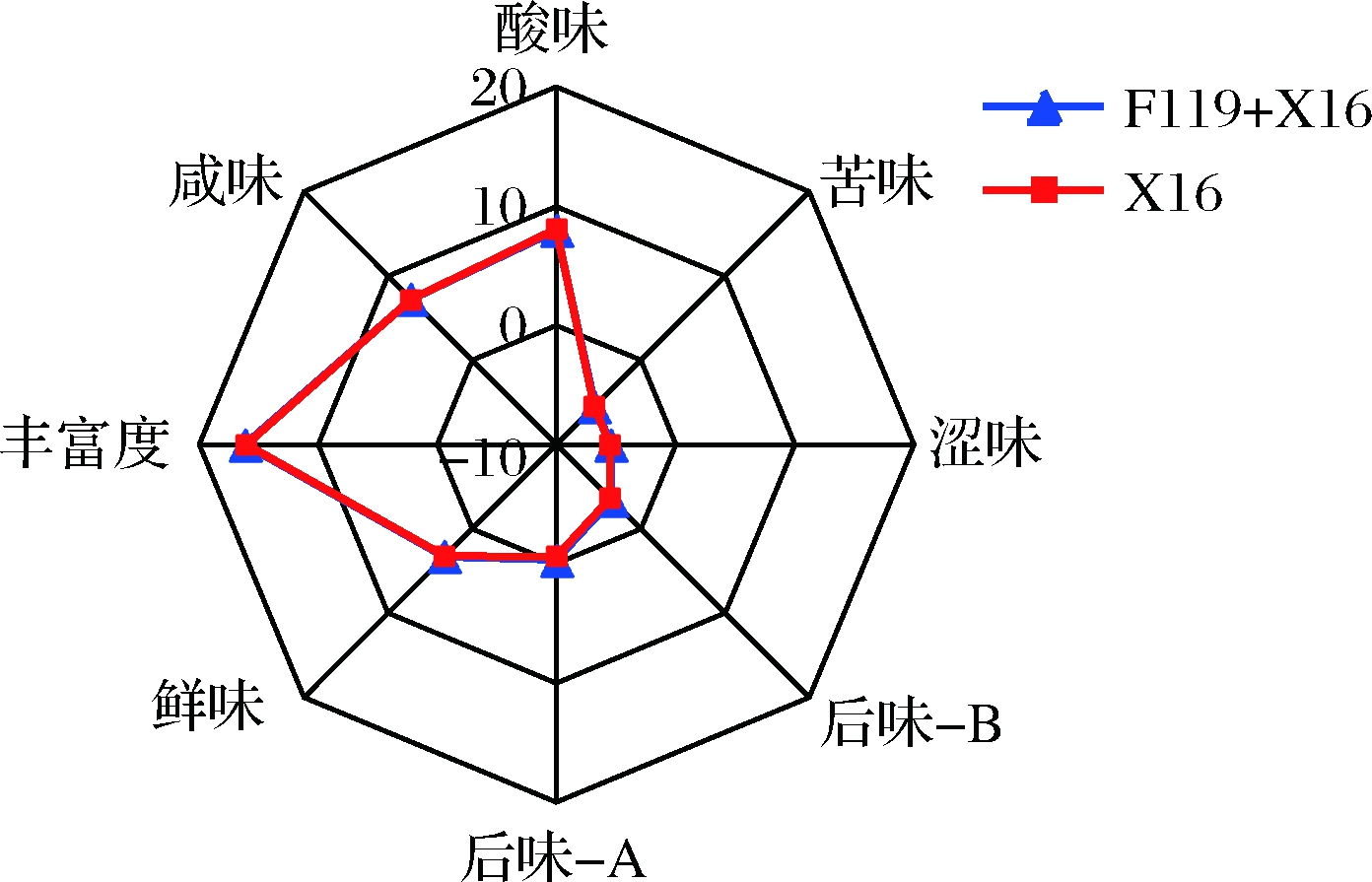
图6 刺梨果酒滋味属性雷达图
Fig.6 R. roxburghii wine taste attribute radar chart
2.6.3 非酿酒酵母F119对刺梨果酒香气物质的影响
为分析非酿酒酵母F119对刺梨果酒香气物质的影响,利用SPME-GC-MS技术测定非酿酒酵母F119与酿酒酵母X16混合发酵刺梨果酒(F119+X16)挥发性香气物质成分。结果如表3所示,F119混合发酵刺梨果酒中共检出40种挥发性物质成分,包括酸类4种、醇类8种、酯类17种、酮类4种、醚类2种、酚类1种、醛类1种以及烷烃类3种;对照组酿酒酵母X16纯种发酵刺梨果酒中也检测出了40种挥发性物质成分,包括酸类1种、醇类12种、酯类20种、酮类2种、醚类1种、酚类2种以及醛类2种,未检测到烷烃类。F119混合发酵减少了刺梨果酒中醇类、酯类、酚类、醛类物质的种类,增加了酸类、酮类、醚类以及烷烃类物质的种类。
尽管F119混合发酵增加了酸类物质的种类,但酸类物质的总量相比X16纯种发酵,发生了显著降低,表明F119混合发酵在一定程度起到了降酸的作用;在醇类物质方面,F119混合发酵既减少了发酵果酒中醇类物质的种类,也降低了醇类物质的总含量,高级醇的种类和含量均减少;F119混合发酵降低了酯类物质的种类,但酯类物质总量未减少;酮类、酚类、醛类物质在F119混合发酵果酒中含量均比X16纯种发酵低。
酯类物质是酒类中主要的呈香物质,具有花香和果香。2种刺梨发酵果酒中主要的酯类物质均为辛酸乙酯、乙酸异戊酯、己酸乙酯、癸酸乙酯、2-糠酸乙酯,其在F119混合发酵刺梨果酒酯类物质中比例分别为45.15%、17.00%、12.94%、8.67%和3.44%;(9Z,12Z,15Z)-9,12,15-三烯十八酸苄酯、7-氧代二环[3.3.1]壬烷-3-甲酸甲酯、N-正己基-2,6-二异丙基氨基甲酸苯酯为F119混合发酵刺梨果酒中所特有的香气物质,而异丁酸乙酯、戊酸乙酯、己酸甲酯、十一酸甲酯、丁二酸(环己-2-烯基)甲基异丁基酯、5-羟基-2′,4′-二叔丁基戊酸苯酯是酿酒酵母X16发酵刺梨果酒中所特有香气物质。
表3 刺梨果酒香气物质种类及含量
Table 3 The aroma substances and their contents in R. roxburghii wine
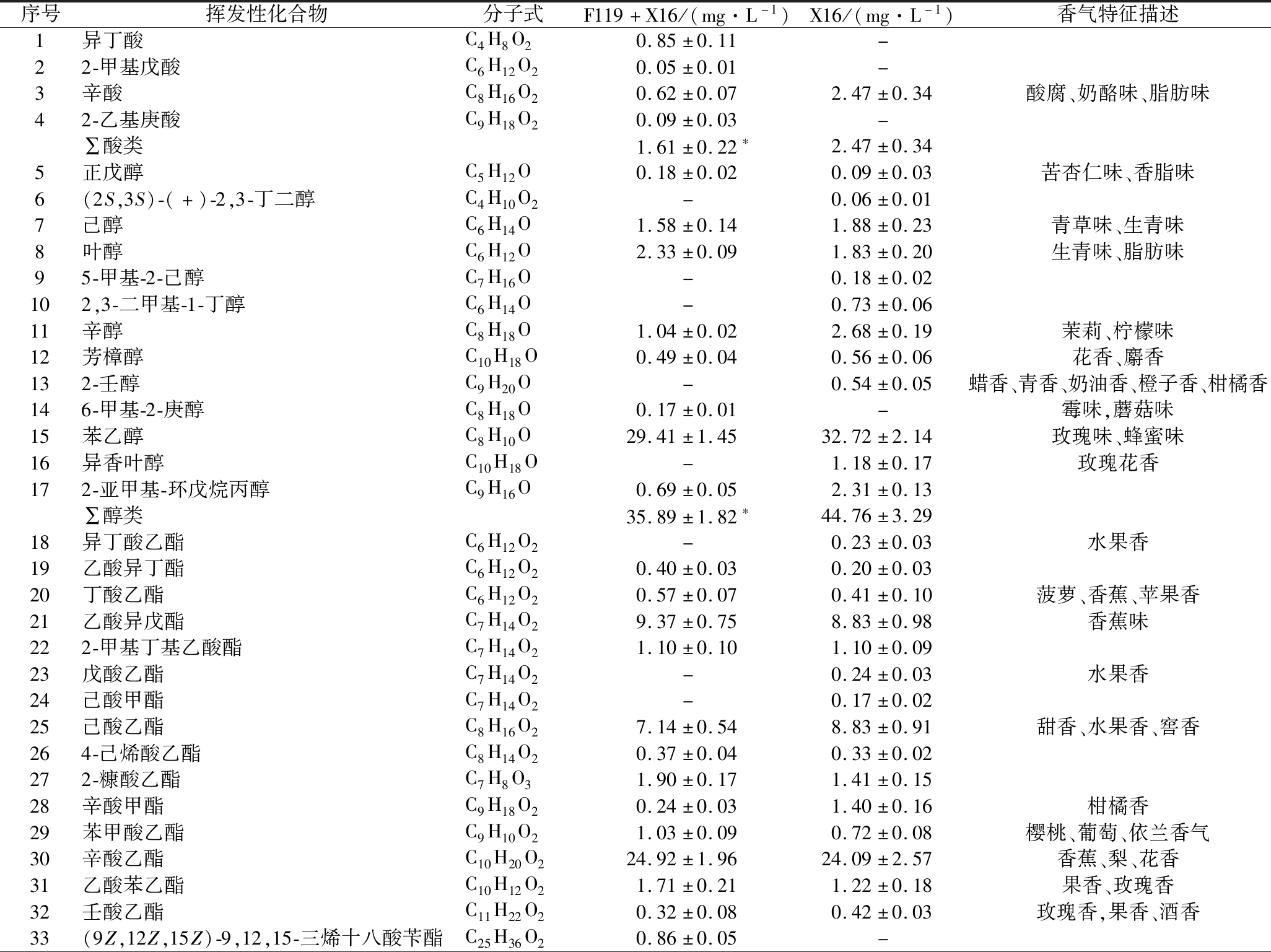
序号挥发性化合物分子式F119+X16/(mg·L-1)X16/(mg·L-1)香气特征描述1异丁酸C4H8O20.85±0.11-22-甲基戊酸C6H12O20.05±0.01-3辛酸C8H16O20.62±0.072.47±0.34酸腐、奶酪味、脂肪味42-乙基庚酸C9H18O20.09±0.03-∑酸类1.61±0.22∗2.47±0.345正戊醇C5H12O0.18±0.020.09±0.03苦杏仁味、香脂味6(2S,3S)-(+)-2,3-丁二醇C4H10O2-0.06±0.017己醇C6H14O1.58±0.141.88±0.23青草味、生青味8叶醇C6H12O2.33±0.091.83±0.20生青味、脂肪味95-甲基-2-己醇C7H16O-0.18±0.02102,3-二甲基-1-丁醇C6H14O-0.73±0.0611辛醇C8H18O1.04±0.022.68±0.19茉莉、柠檬味12芳樟醇C10H18O0.49±0.040.56±0.06花香、麝香132-壬醇C9H20O-0.54±0.05蜡香、青香、奶油香、橙子香、柑橘香146-甲基-2-庚醇C8H18O0.17±0.01-霉味,蘑菇味15苯乙醇C8H10O29.41±1.4532.72±2.14玫瑰味、蜂蜜味16异香叶醇C10H18O-1.18±0.17玫瑰花香172-亚甲基-环戊烷丙醇C9H16O0.69±0.052.31±0.13∑醇类35.89±1.82∗44.76±3.2918异丁酸乙酯C6H12O2-0.23±0.03水果香19乙酸异丁酯C6H12O20.40±0.030.20±0.0320丁酸乙酯C6H12O20.57±0.070.41±0.10菠萝、香蕉、苹果香21乙酸异戊酯C7H14O29.37±0.758.83±0.98香蕉味222-甲基丁基乙酸酯C7H14O21.10±0.101.10±0.0923戊酸乙酯C7H14O2-0.24±0.03水果香24己酸甲酯C7H14O2-0.17±0.0225己酸乙酯C8H16O27.14±0.548.83±0.91甜香、水果香、窖香264-己烯酸乙酯C8H14O20.37±0.040.33±0.02272-糠酸乙酯C7H8O31.90±0.171.41±0.1528辛酸甲酯C9H18O20.24±0.031.40±0.16柑橘香29苯甲酸乙酯C9H10O21.03±0.090.72±0.08樱桃、葡萄、依兰香气30辛酸乙酯C10H20O224.92±1.9624.09±2.57香蕉、梨、花香31乙酸苯乙酯C10H12O21.71±0.211.22±0.18果香、玫瑰香32壬酸乙酯C11H22O20.32±0.080.42±0.03玫瑰香,果香、酒香33(9Z,12Z,15Z)-9,12,15-三烯十八酸苄酯C25H36O20.86±0.05-
续表3
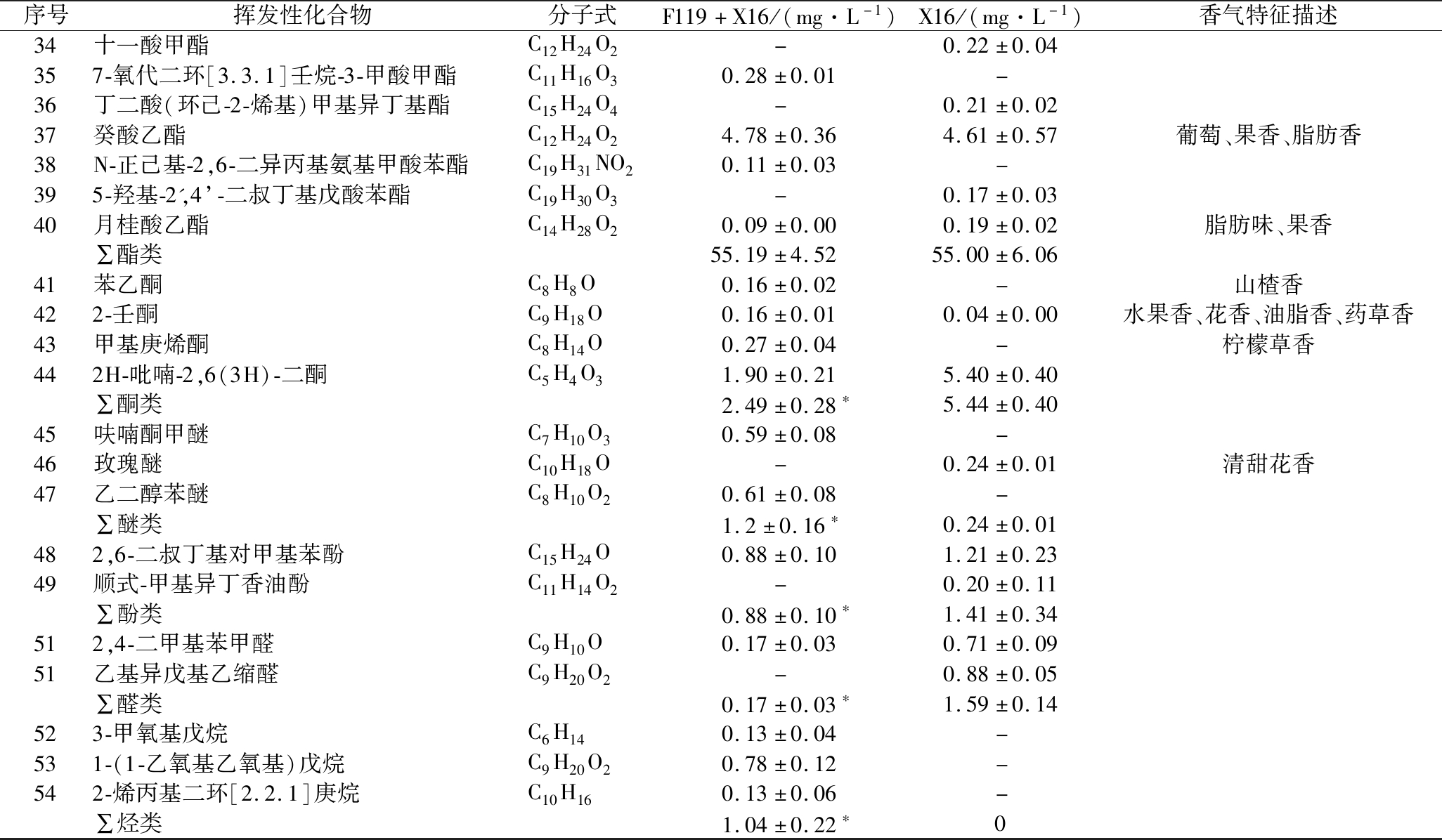
序号挥发性化合物分子式F119+X16/(mg·L-1)X16/(mg·L-1)香气特征描述34十一酸甲酯C12H24O2-0.22±0.04357-氧代二环[3.3.1]壬烷-3-甲酸甲酯C11H16O30.28±0.01-36丁二酸(环己-2-烯基)甲基异丁基酯C15H24O4-0.21±0.0237癸酸乙酯C12H24O24.78±0.364.61±0.57葡萄、果香、脂肪香38N-正己基-2,6-二异丙基氨基甲酸苯酯C19H31NO20.11±0.03-395-羟基-2',4’-二叔丁基戊酸苯酯C19H30O3-0.17±0.0340月桂酸乙酯C14H28O20.09±0.000.19±0.02脂肪味、果香∑酯类55.19±4.5255.00±6.0641苯乙酮C8H8O0.16±0.02-山楂香422-壬酮C9H18O0.16±0.010.04±0.00水果香、花香、油脂香、药草香43甲基庚烯酮C8H14O0.27±0.04-柠檬草香442H-吡喃-2,6(3H)-二酮C5H4O31.90±0.215.40±0.40∑酮类2.49±0.28∗5.44±0.4045呋喃酮甲醚C7H10O30.59±0.08-46玫瑰醚C10H18O-0.24±0.01清甜花香47乙二醇苯醚C8H10O20.61±0.08-∑醚类1.2±0.16∗0.24±0.01482,6-二叔丁基对甲基苯酚C15H24O0.88±0.101.21±0.2349顺式-甲基异丁香油酚C11H14O2-0.20±0.11∑酚类0.88±0.10∗1.41±0.34512,4-二甲基苯甲醛C9H10O0.17±0.030.71±0.0951乙基异戊基乙缩醛C9H20O2-0.88±0.05∑醛类0.17±0.03∗1.59±0.14523-甲氧基戊烷C6H140.13±0.04-531-(1-乙氧基乙氧基)戊烷C9H20O20.78±0.12-542-烯丙基二环[2.2.1]庚烷C10H160.13±0.06-∑烃类 1.04±0.22∗0
注,-表示无
风味活性值(odour activity value,OAV)可评价某种挥发性化合物对酒体香气的贡献度,OAV>1时,该化合物对酒体香气有突出的贡献度,反之OAV<1表明该化合物对酒体贡献度不突出。刺梨发酵果酒中主要的挥发性化合物的OAV如表4所示。在F119混合发酵刺梨果酒中OAV>1的成分有13种,OAV<1的有3种。其中正辛醇在F119混合发酵刺梨果酒中OAV<1,在X16纯种发酵果酒中OAV>1。
表4 刺梨果酒香气成份OAV
Table 4 The OAV of aroma substances in R. roxburghii wine
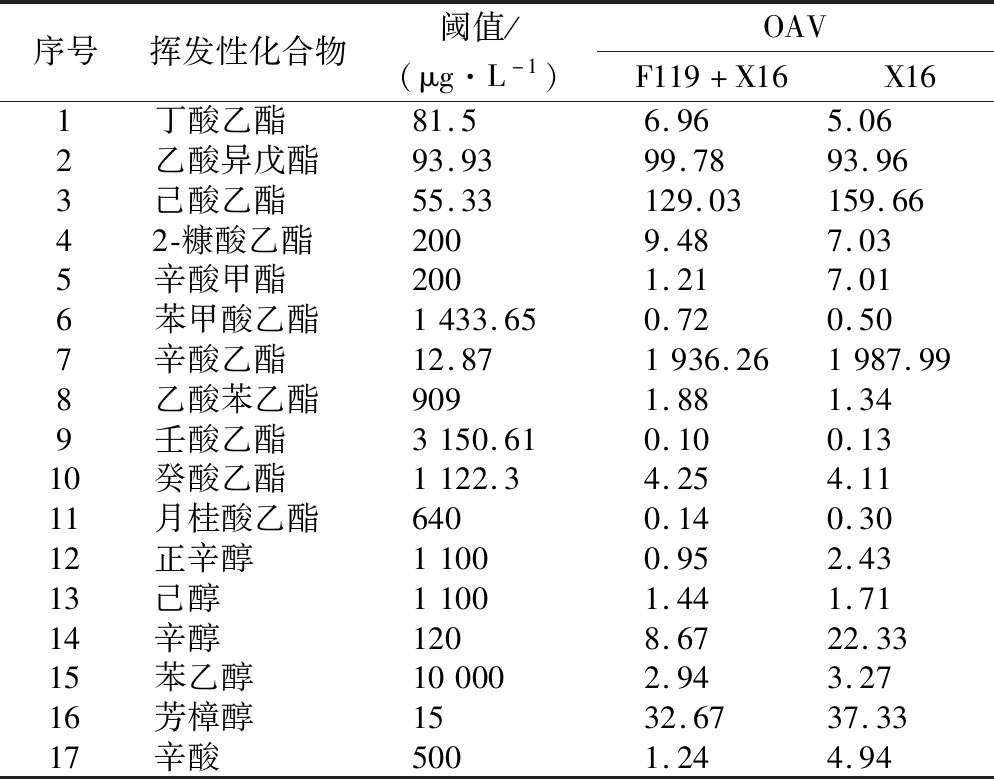
序号挥发性化合物阈值/(μg·L-1)OAVF119+X16X161丁酸乙酯81.56.965.062乙酸异戊酯93.9399.7893.963己酸乙酯55.33129.03159.6642-糠酸乙酯2009.487.035辛酸甲酯2001.217.016苯甲酸乙酯1433.650.720.507辛酸乙酯12.871936.261987.998乙酸苯乙酯9091.881.349壬酸乙酯3150.610.100.1310癸酸乙酯1122.34.254.1111月桂酸乙酯6400.140.3012正辛醇11000.952.4313己醇11001.441.7114辛醇1208.6722.3315苯乙醇100002.943.2716芳樟醇1532.6737.3317辛酸5001.244.94
3 讨论
由于刺梨果实本身酸、涩特性,一般以加工产品形式出售。作为贵州省主打特色产业之一,刺梨种植规模增速较快,但其加工产业发展还较为滞后,且服务于加工产业的基础研究还比较薄弱。如对刺梨酵母研究还比较少,加工刺梨果酒的优质酵母还比较缺乏。刺梨果实上天然存在着大量的野生酵母酵母菌,其中不乏一些优质的种属,因此从中分离优质酵母是可行的[20]。本研究采用自然发酵法对刺梨果实上非酿酒酵母进行了分离,赖氨酸培养基共鉴定出80株非酿酒酵母。嗅闻法从中发现1株产香较为浓郁菌株F119,对其进行了深入分析。生理耐受性结果发现,该菌株对葡萄糖、柠檬酸和SO2均具有一定的耐受性,且不产硫化氢。因此,对酿酒环境具有较好的耐受性。但该菌株与商业化的酿酒酵母X16相比,在乙醇耐受性,产β-葡萄糖苷酶量以及菌体生长速率等方面还有些差距。但目前微生物育种技术已发展较为成熟,可以此菌株为出发菌株,进行诱变育种,原生质体融合育种、杂交育种等技术进行相关改造,使其酿酒特性更优。
TRISTEZZA等在黑曼罗(Negroamaro)葡萄酿造过程中,将葡萄汁有孢汉逊酵母菌株ITEM8795和酿酒酵母ITEM6920以共接种和顺序接种形式作为混合发酵剂[21]。结果表明,混合发酵可降低酒体中挥发酸含量,调节酒体感官特性,包括降低醇类挥发性物质的含量,增加醛酮类物质的含量。本研究中形态学与分子生物学结果表明,F119菌株为1株来源于刺梨的葡萄汁有孢汉逊酵母,将其与酿酒酵母X16以共接种的形式混合发酵刺梨果汁,可增加发酵果酒中挥发性酸性物质的种类,降低挥发性酸性物质和总酸的含量。降低醇类物质的种类和含量,增加酮类物质的种类,增加醚类和烃类物质的种类和含量。与TRISTEZZA等[21]研究结果较为相似。
混合发酵果酒中酯类物质的种类较酿酒酵母单独发酵的少,可能与F119产β-葡萄糖苷酶能力较低相关。包括β-葡萄糖苷酶在内的糖苷酶可水解含糖苷键类的风味前体物质,促进挥发性风味物质的释放[22-23]。但本研究仅分析了F119中β-葡萄糖苷酶含量,其他糖苷酶如α-L-阿拉伯呋喃糖苷酶[24]、α-L-吡喃鼠李糖苷酶[25]、β-D-木糖苷酶[26]活性还未知。对风味物质产生机理还需做进一步的研究。
综上,本研究系统分析了刺梨来源的葡萄汁有孢汉逊酵母F119酿酒特性,并以此与酿酒酵母进行了混合发酵,分析了其对刺梨果酒品质的影响。结果表明,该菌株具有一定的酿酒环境耐受性,且不产硫化氢,混合发酵可调节刺梨果酒风味物质的种类和含量,因此具有一定的应用潜能。但还需要放大进行工业化的中试实验,进一步评价该菌株特性。
[1] HU L, WANG J, JI X, et al. Selection of non-Saccharomyces yeasts for orange wine fermentation based on their enological traits and volatile compounds formation[J]. Journal of Food science and Technology, 2018, 55(10): 4 001-4 012.
[2] ALONSO-DEL-REAL J, LAIR N-PERIS M, BARRIO E, et al. Effect of temperature on the prevalence of Saccharomyces non cerevisiae species against a S. cerevisiae wine strain in wine fermentation: competition, physiological fitness, and influence in final wine composition[J]. Frontiers in Microbiology, 2017, 8: 150.
N-PERIS M, BARRIO E, et al. Effect of temperature on the prevalence of Saccharomyces non cerevisiae species against a S. cerevisiae wine strain in wine fermentation: competition, physiological fitness, and influence in final wine composition[J]. Frontiers in Microbiology, 2017, 8: 150.
[3] WANG C, MAS A, ESTEVE-ZARZOSO B. The interaction between Saccharomyces cerevisiae and non-Saccharomyces yeast during alcoholic fermentation is species and strain specific[J]. Frontiers in Microbiology, 2016, 7: 502.
[4] P REZ-TORRADO R, BARRIO E, QUEROL A. Alternative yeasts for winemaking: Saccharomyces non-cerevisiae and its hybrids[J]. Critical Reviews in Food Science and Nutrition, 2018, 58(11): 1 780-1 790.
REZ-TORRADO R, BARRIO E, QUEROL A. Alternative yeasts for winemaking: Saccharomyces non-cerevisiae and its hybrids[J]. Critical Reviews in Food Science and Nutrition, 2018, 58(11): 1 780-1 790.
[5] BALLESTER-TOM S L, PRIETO J A, GIL J V, et al. The Antarctic yeast Candida sake: Understanding cold metabolism impact on wine[J]. International Journal of Food Microbiology, 2017, 245: 59-65.
S L, PRIETO J A, GIL J V, et al. The Antarctic yeast Candida sake: Understanding cold metabolism impact on wine[J]. International Journal of Food Microbiology, 2017, 245: 59-65.
[6] KONG C L, LI A H, SU J, et al. Flavor modification of dry red wine from Chinese spine grape by mixed fermentation with Pichia fermentans and S. cerevisiae[J]. LWT, 2019, 109: 83-92.
[7] LLEIX J, MART
J, MART N V, PORTILLO M C, et al. Comparison of fermentation and wines produced by inoculation of Hanseniaspora vineae and Saccharomyces cerevisiae[J]. Frontiers in Microbiology, 2016, 7: 338.
N V, PORTILLO M C, et al. Comparison of fermentation and wines produced by inoculation of Hanseniaspora vineae and Saccharomyces cerevisiae[J]. Frontiers in Microbiology, 2016, 7: 338.
[8] CHEN D, YAP Z Y, LIU S Q. Evaluation of the performance of Torulaspora delbrueckii, Williopsis saturnus, and Kluyveromyces lactis in lychee wine fermentation[J]. International Journal of Food Microbiology, 2015, 206: 45-50.
[9] VARELA C, SENGLER F, SOLOMON M, et al. Volatile flavour profile of reduced alcohol wines fermented with the non-conventional yeast species Metschnikowia pulcherrima and Saccharomyces uvarum[J]. Food Chemistry, 2016, 209: 57-64.
[10] CLEMENTE-JIMENEZ J M, MINGORANCE-CAZORLA L, MART NEZ-RODR
NEZ-RODR GUEZ S, et al. Molecular characterization and oenological properties of wine yeasts isolated during spontaneous fermentation of six varieties of grape must[J]. Food Microbiology, 2004, 21(2): 149-155.
GUEZ S, et al. Molecular characterization and oenological properties of wine yeasts isolated during spontaneous fermentation of six varieties of grape must[J]. Food Microbiology, 2004, 21(2): 149-155.
[11] ANFANG N,BRAJKOVICH M,GODARD M R. Co-fermentation with Pichia kluyveri increases varietal thiol concentrations in Sauvignon Blanc[J]. Australian Journal of Grape and Wine Research 2009, 15(1):1-8.
[12] BENITO S, MORATA A, PALOMERO F, et al. Formation of vinylphenolic pyranoanthocyanins by Saccharomyces cerevisiae and Pichia guillermondii in red wines produced following different fermentation strategies[J]. Food Chemistry, 2011, 124(1): 15-23.
[13] 谢丹,刘晓燕,毕远林,等.基于高通量测序分析刺梨果渣自然发酵过程中细菌群落结构及多样性[J].食品工业科技,2019,40(22):110-114.
[14] 姚敏. 刺梨果酒技术研究[D].贵阳:贵州大学,2015.
[15] 贺红早,张玉武,刘盈盈,等.三种酵母对无籽刺梨果酒品质的影响[J].酿酒科技,2015(10):10-13.
[16] 张丹,韦广鑫,曾凡坤.贵州不同产地无籽刺梨的基本营养成分及香气物质比较[J].食品科学,2016,37(22):166-172.
[17] 侯晓瑞,王婧,杨学山,等.甘肃河西走廊葡萄酒产区高产β-葡萄糖苷酶酵母菌株筛选[J].食品科学,2014, 35(23):139-143.
[18] 陈思奇,孟满,杜勃峰,等.基于主成分分析与聚类分析综合评价不同菌种发酵刺梨果渣的香气品质[J].中国酿造,2019,38(6):152-159.
[19] 蒋宝,张振文.地形对黄土高原地区赤霞珠葡萄酒香气成分的影响[J].食品与发酵工业,2017,43(12):184-190.
[20] 黄国柱,黄一萍,唐玉芳.培养野生酵母酿制刺梨酒[J].食品科学,1990,11(9):48-51.
[21] TRISTEZZA M, TUFARIELLO M, CAPOZZI V, et al. The oenological potential of Hanseniaspora uvarum in simultaneous and sequential co-fermentation with Saccharomyces cerevisiae for industrial wine production[J]. Frontiers in Microbiology, 2016, 7: 670.
[22] HU K, QIN Y, TAO Y S, et al. Potential of glycosidase from non-Saccharomyces isolates for enhancement of wine aroma[J]. Journal of Food Science, 2016, 81(4): M935-M943.
[23] MAICAS S, MATEO J J. Microbial glycosidases for wine production[J]. Beverages, 2016, 2(3): 20.
[24] CHADHA B S, MONGA A, OBEROI H S. α-L-arabinofuranosidase from an efficient hemicellulolytic fungus Penicillium janthinellum capable of hydrolyzing wheat and rye arabinoxylan to arabinose[J]. Journal of Microbiology, Biotechnology & Food Sciences, 2017, 6(5): 1 132-1 139.
[25] KUMAR D, YADAV S, YADAVA S, et al. An alkali tolerant α-L-rhamnosidase from Fusarium moniliforme MTCC-2088 used in de-rhamnosylation of natural glycosides[J]. Bioorganic Chemistry, 2019, 84: 24-31.
[26] RODIONOVA N A, TAVOBILOV I M, BEZBORODOV A M. Beta-Xylosidase from Aspergillus niger 15: Purification and properties[J]. Journal of Applied Biochemistry, 1983, 5(4-5): 300-312.