钙转运蛋白Gdt1过表达对酿酒酵母蛋白酶A胞外分泌的影响
宋露露1,2,刘小航1,2,郭学武1,2,陈叶福1,2*,肖冬光1,2*
1(工业发酵微生物教育部重点实验室(天津科技大学),天津,300457)2(天津科技大学 生物工程学院,天津,300457)
摘 要 啤酒泡沫稳定性是评估啤酒质量的一个关键因素,发酵液中的蛋白酶A会影响啤酒的泡沫稳定性。通过过表达钙转运蛋白Gdt1促进蛋白酶A的液泡分选的方法,达到减弱酿酒酵母向细胞外分泌蛋白酶A的目的。以酿酒酵母菌株W303-1A为亲本菌株,通过同源重组依赖型DNA装配方法构建Gdt1过表达菌株,然后将Gdt1过表达菌株和亲本菌株在相同的低氮胁迫条件下进行发酵,测定其胞内外的蛋白酶A活力以及基本发酵性能。研究结果表明:发酵结束时,Gdt1过表达菌株的胞内蛋白酶A活力较亲本菌株提高了12.59%,胞外蛋白酶A活力较亲本菌株降低了18.81%;同时,过表达Gdt1没有影响菌株的基本发酵性能。研究揭示了一种有效的降低蛋白酶A的胞外分泌的方法,为筛选低蛋白酶A胞外分泌菌株提供了理论参考。
关键词 啤酒泡沫;蛋白酶A;Gdt1;液泡分选;胞外分泌
DOI:10.13995/j.cnki.11-1802/ts.023142
引用格式:宋露露,刘小航,郭学武,等.钙转运蛋白Gdt1过表达对酿酒酵母蛋白酶A胞外分泌的影响[J].食品与发酵工业,2020,46(9):10-17.SONG Lulu, LIU Xiaohang, GUO Xuewu, et al. Effect of Gdt1 overexpression on secretion of Saccharomyces cerevisiae proteinase A[J].Food and Fermentation Industries,2020,46(9):10-17.
Effect of Gdt1 overexpression on secretion of Saccharomyces cerevisiae proteinase A
SONG Lulu1,2, LIU Xiaohang1,2, GUO Xuewu1,2, CHEN Yefu1,2*,XIAO Dongguang1,2*
1(Key Laboratory of Industrial Fermentation Microbiology, Ministry of Education,Tianjin University of Science and Technology, Tianjin 300457, China) 2(College of Bioengineering, Tianjin University of Science and Technology, Tianjin 300457, China)
Abstract Beer foam stability, a key factor in assessing overall beer quality, is affected by proteinase A (PrA) in the fermentation broth. To weaken PrA excretion from Saccharomyces cerevisiae, the vacuolar sorting of PrA was strengthened by overexpression of Ca2+ transporter Gdt1. S. cerevisiae W303-1A was used as the parental strain, and Gdt1-overexpression strain was constructed by exploiting the in vivo homologous recombination-dependent DNA assembler. Fermentation experiments for the Gdt1-overexpression strain and the parental strain were performed under nitrogen-deficient condition, and PrA activity, and fermentation performance of the two strains were examined. Results showed that the intracellular PrA activities of the Gdt1-overexpression strain were increased by 12.59% and the extracellular PrA activities were decreased by 18.81% at the end of fermentation compared with those of the parental strain. Meanwhile, no obvious differences were found on the fermentation performance of the two strains. The research uncovers an effective method to decrease the extracellular secretion of S. cerevisiae PrA, which provides a theoretical reference for the screening of low-PrA-activity strains.
Key words beer foam;proteinase A (PrA);Gdt1;vacuolar sorting;extracellular secretion
第一作者:博士研究生(陈叶福教授和肖冬光教授为共同通讯作者,E-mail:yfchen@tust.edu.cn;xiao99@tust.edu.cn)
基金项目:国家自然科学基金项目(31271916)
收稿日期:2019-12-18,改回日期:2020-02-05
酿酒酵母蛋白酶A(saccharopepsin; EC 3.4.23.25)是一种定位于液泡的水解酶,在胞内蛋白的成熟、激活以及多倍体酵母生孢等生理生化过程中起着重要作用[1-3]。然而,在胁迫条件下,酵母细胞会分泌蛋白酶A到细胞外[4-6]。对于啤酒而言,酿酒酵母分泌到发酵液中的蛋白酶A会降解泡沫阳性蛋白-脂质转移蛋白LTP1,从而降低啤酒的泡沫稳定性,影响啤酒的感官质量[7-9]。因此,降低酿酒酵母细胞中蛋白酶A的外泌,可以有效地提高啤酒泡沫稳定性。
蛋白酶A由PEP4基因编码,PEP4基因经过转录和翻译后,在核糖体上合成前蛋白酶A原[2]。前蛋白酶A原经过内质网和高尔基体修饰后,形成了蛋白酶A原。蛋白酶A原在反面高尔基体网络结构(trans-Golgi network,TGN)中被液泡分选受体识别并结合,引导其转运到液泡内,最终蛋白酶A原在液泡中通过自我激活或者是蛋白酶B的作用下形成成熟的蛋白酶A[1,10]。酵母细胞中的液泡分选受体有多种,其中最典型的是液泡分选受体Vps10(I型跨膜受体蛋白)[11-13]。最初发现Vps10定位于晚期高尔基体腔室(the late Golgi compartment),能正确分选羧肽酶Y定位于液泡[13]。研究表明,通过提高Vps10的表达水平可以促进更多的蛋白酶A被分选到液泡中,从而降低了蛋白酶A的胞外分泌水平[14]。由此可知,加强蛋白酶A的液泡分选是减少蛋白酶A胞外分泌的一种有效方法。
KIENZLE和VON BLUME等[15]提出一条不同于受体介导的分选途径的新的分选途径,这条分选途径分选蛋白依靠的是TGN腔内Ca2+瞬时增加;哺乳动物细胞中TGN上的SPCA1(secretory pathway calcium ATPase 1)可以诱导更多的Ca2+流入TGN腔内,导致TGN腔内Ca2+瞬时增加,间接促进蛋白的分选。Pmr1是高尔基体膜上的钙转运蛋白,它是SPCA1的酵母同源物,也影响液泡蛋白的分选[16]。酵母细胞中缺失Pmr1后,原本定位于液泡的羧肽酶Y被分选到液泡的时间被延长,最终导致羧肽酶Y异常分泌到细胞外[16]。实验室前期已经研究表明,Pmr1缺失阻碍部分蛋白酶A被运输到液泡中,加强了蛋白酶A的胞外分泌;Pmr1过表达促进了蛋白酶A的液泡分选,降低蛋白酶A的胞外分泌水平[17]。除了Pmr1,还有另一个定位于高尔基体的Ca2+转运蛋白Gdt1(由GDT1基因编码),与Pmr1功能相同,参与调控高尔基体和细胞质中的钙离子水平[18-19]。推测,Gdt1可能也影响蛋白酶A的液泡分选,间接影响蛋白酶A的胞外分泌。基于以上结果,本研究以W303-1A为亲本菌株,将亲本菌株中的Gdt1进行过表达,以此来调控蛋白酶A的液泡分选,探究钙转运蛋白Gdt1对蛋白酶A胞外分泌的影响。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒
本研究所用的菌株和质粒归纳于表1。
表1 本研究所用菌株和质粒
Table 1 Strains and plasmids used in the this study

菌株或质粒相关特性来源菌株大肠杆菌(Escherichia coli)DH5αsupE44 ΔlacU169 (ϕ80 lacZΔM15) hsdR17 recAl endAl gyrA96 thi-1 relA购买于Stratagene酿酒酵母(Saccharomyces cerevisiae)W303-1AMATa ade2-1 trp1-1 leu2-3,112 his3-11,15 ura3-1 can1-100工业微生物教育部重点实验室(天津科技大学)保存W+PMR1MATa ade2-1 trp1-1 leu2-3,112 his3-11,15 ura3-1 can1-100, PMR1∶∶loxP-KanMX-loxP-PGK1P-PMR1-PGK1T工业微生物教育部重点实验室(天津科技大学)保存W+GDT1MATa ade2-1 trp1-1 leu2-3,112 his3-11,15 ura3-1 can1-100, GDT1∶∶loxP-KanMX-loxP-PGK1P-GDT1-PGK1T本研究质粒pUG6Apr, Kanr, loxP-KanMX-loxP工业微生物教育部重点实验室(天津科技大学)保存YEp-PApr, PGK1P-PGK1T工业微生物教育部重点实验室(天津科技大学)保存YEp-P-GDT1Apr, PGK1p-GDT1-PGK1t本研究
1.1.2 主要培养基
LB(Luria-Bertani)培养基(g/L):酵母浸粉 5,蛋白胨 10,NaCl 10,使用时添加氨苄青霉素使其最终质量浓度为0.1 g/L。
YEPD(yeast extract peptone dextrose)培养基(g/L):酵母浸粉 10,蛋白胨 20,葡萄糖 20。向其中添加G418使其最终质量浓度为0.8 g/L,用来筛选GDT1过表达菌株转化子。
配制以上LB和YEPD固体培养基时,添加20 g/L琼脂粉即可。
低氮麦芽汁培养基:粉碎的麦芽和水的混合物(料水比为1∶4)于65 ℃糖化至碘检完毕,时间大约为1 h左右;过滤后煮沸1 h:再次过滤后用糖度计调节表观糖度为5 °Brix,然后向其中添加葡萄糖调节其表观糖度为10 °Brix。
以上所有培养基的灭菌条件均为:115 ℃灭菌20 min。
1.1.3 主要试剂和酶
合成多肽(MOAc-Ala-Pro-Ala-Lys-Phe-Phe-Arg-Leu(Dnp)-NH2),委托南京莱昂生物科技有限公司合成;氨苄青霉素和遗传霉素(G418),购自北京鼎国昌盛生物技术有限责任公司;PCR纯化回收试剂盒、质粒小提试剂盒、酵母基因组DNA提取试剂盒,购自美国Omega公司。
限制性内切酶Bgl II、LA Taq和PrimerSTAR DNA聚合酶,购自大连TaKaRa公司;闪电克隆试剂盒,购自北京博奥龙免疫技术有限公司。
1.1.4 主要仪器和设备
垂直流超净工作台(ZHJH-C1115B)和摇床(ZWY-2102C),上海智城分析仪器制造有限公司;生化培养箱(LRH-250A),上海沪粤明科学仪器有限公司;紫外可见分光光度计(UV-1200),上海美谱达仪器有限公司;荧光分光光度计(RF-5301),日本岛津公司;StepOnePlus实时荧光定量PCR仪,美国ABI公司。
1.2 实验方法
1.2.1 引物设计
根据NCBI数据库(http: // www. ncbi. nlm. nih. gov/)中S. cerevisiae S288c菌株的基因组序列、质粒pUG6中的KanMX基因序列和质粒YEp-P的DNA序列,设计用于过表达GDT1基因的引物,见表2。
表2 用于过表达GDT1基因的引物a
Table 2 Primers used for GDT1 overexpression

引物引物序列 (5'→3')扩增引物GDT1-FCAAGATCGGAATTCCAGATCTATGGGAAATATGATAAAGAAGGGDT1-RGCAGATCCCTCGAGGAGATCTTCAATCCTGAGTTGTGAATGCTGDT1+A-FTTTCTAAATGGTTTGGAGAATCGTCGDT1+A-RCCTGCAGCGTACGAAGCTTCAGCTGTGAATACTCGATGGCCTCGTATTTGKan+GDT1-FCAAATACGAGGCCATCGAGTATTCACAGCTGAAGCTTCGTACGCTGCAGGKan+GDT1-RCAGTTTTGGATAGATCAGTTAGAGCATAGGCCACTAGTGGATCTGATATP+GDT1-FATATCAGATCCACTAGTGGCCTATGCTCTAACTGATCTATCCAAAACTGP+GDT1-RAGAAGAATACGGTTACAAACCATCTAACGAACGCAGAATTTTCGAGTTATGDT1+B-FATAACTCGAAAATTCTGCGTTCGTTAGATGGTTTGTAACCGTATTCTTCTGDT1+B-RCTTTCTTGTCTATGCAAATGAACAAT用于重组菌株验证(A+K)+GDT1-FGATGGTTTTGAGGGAGA(A+K)+GDT1-RTATGGGCTAAATGTACG(P+B)+GDT1-FCTCGAAAATTCTGCGTTC(P+B)+GDT1-RGGCTGTTGTCGTGCTACTKan+P-FATTTTATCCGTACTCCTGKan+P-RAGTCATCGACGTTATCTC用于测定mRNA水平GDT1RT-FAGCCGTTGCTTTTCTTTCGDT1RT-RTCAGCCATTTCCTCCTCAACUBC6-FGGACCTGCGGATACTCCTTACUBC6-RTAATCGTGTGTTGGGCTTGA
注:a下划线表示相邻两片段之间~50 bp的重叠序列,加粗碱基表示限制性酶切位点Bgl II
1.2.2 大肠杆菌(E.coli.DH5α)的转化
将经酶切线性化的质粒和PCR扩增获得的片段通过闪电克隆试剂盒进行连接。将连接产物转入到E.coli.DH5α感受态细胞中。通过质粒小提试剂盒提取质粒并且进行酶切验证。
1.2.3 酿酒酵母(W303-1A)的转化
通过醋酸锂(LiAc)转化法[20]将构建GDT1基因过表达菌株所需的片段转化入W303-1A中,通过含有G418抗性的YEPD平板筛选转化子,用酵母基因组DNA提取试剂盒提取转化子的基因组进行PCR验证。
1.2.4 啤酒发酵工艺
从斜面上挑取1环酿酒酵母菌株接入到装有5 mL 10 °P麦汁的玻璃试管中,30 ℃、180 r/min培养12 h;将试管中培养好的菌液倒入装有50 mL 10 °P麦汁的三角瓶中,16 ℃静置培养36~72 h至菌株达到对数期后期;以10%接种量接入到装有135 mL 10 °P麦汁发酵培养基的三角瓶中,16 ℃静置发酵,每隔24 h称重,当2 d之间的质量相差小于0.1 g,发酵结束。发酵期间取样,取样时间为0、1、3、5、7 d,测定生物量、碳源消耗、氮源消耗;当发酵结束后测定乙醇体积分数、剩余还原糖含量以及蛋白酶A的胞内外活力。
1.3 分析方法
1.3.1 GDT1基因的mRNA水平测定
采用实时荧光定量PCR(Real-time PCR)法[4]检测基因GDT1的相对表达量。
1.3.2 生物量的测定
采用比浊法测定生物量。发酵过程中取样,每次取1 mL菌液,12 000 r/min离心1 min,去上清液后用蒸馏水水洗2次,稀释菌液到合适的浓度。以蒸馏水为空白对照,600 nm下测定菌液的吸光值。以发酵时间为横坐标,吸光值为纵坐标,绘制生长曲线。
1.3.3 表观糖度的测定
采用手持糖度折光仪测定发酵过程中表观糖度的变化。
1.3.4 α-氨基氮含量的测定
采用茚三酮比色法测定发酵过程中α-氨基氮的含量变化[21]。
1.3.5 乙醇体积分数的测定
采用GB/T 4928—2008《啤酒分析方法》中的密度瓶法(标温20 ℃)测定。
1.3.6 还原糖的测定
采用斐林试剂法测定发酵结束时发酵液中还原糖的含量。
1.3.7 蛋白酶A活力的测定
采用KONDO等报道的荧光底物法[22]测定蛋白酶A活力。
在每支测样玻璃试管中分别加入1 370 μL蒸馏水、1 500 μL Na2HPO4-C6H8O7缓冲液和100 μL待测样品;在避光的条件下,向上述混合液中加入12 μL荧光底物,混匀后将试管放入37 ℃水浴锅中反应30 min;30 min后,取出测样玻璃试管并加入18 μL NaOH (0.5 mol/L)终止反应;用荧光分光光度计测定蛋白酶A的活力(测量时,设定分光光度计的参数为Ex=328 nm,Em=393 nm,狭缝宽度为1.5 nm)。
2 结果与讨论
2.1 钙转运蛋白Gdt1过表达菌株的构建
2.1.1 重组质粒YEp-P-GDT1的构建
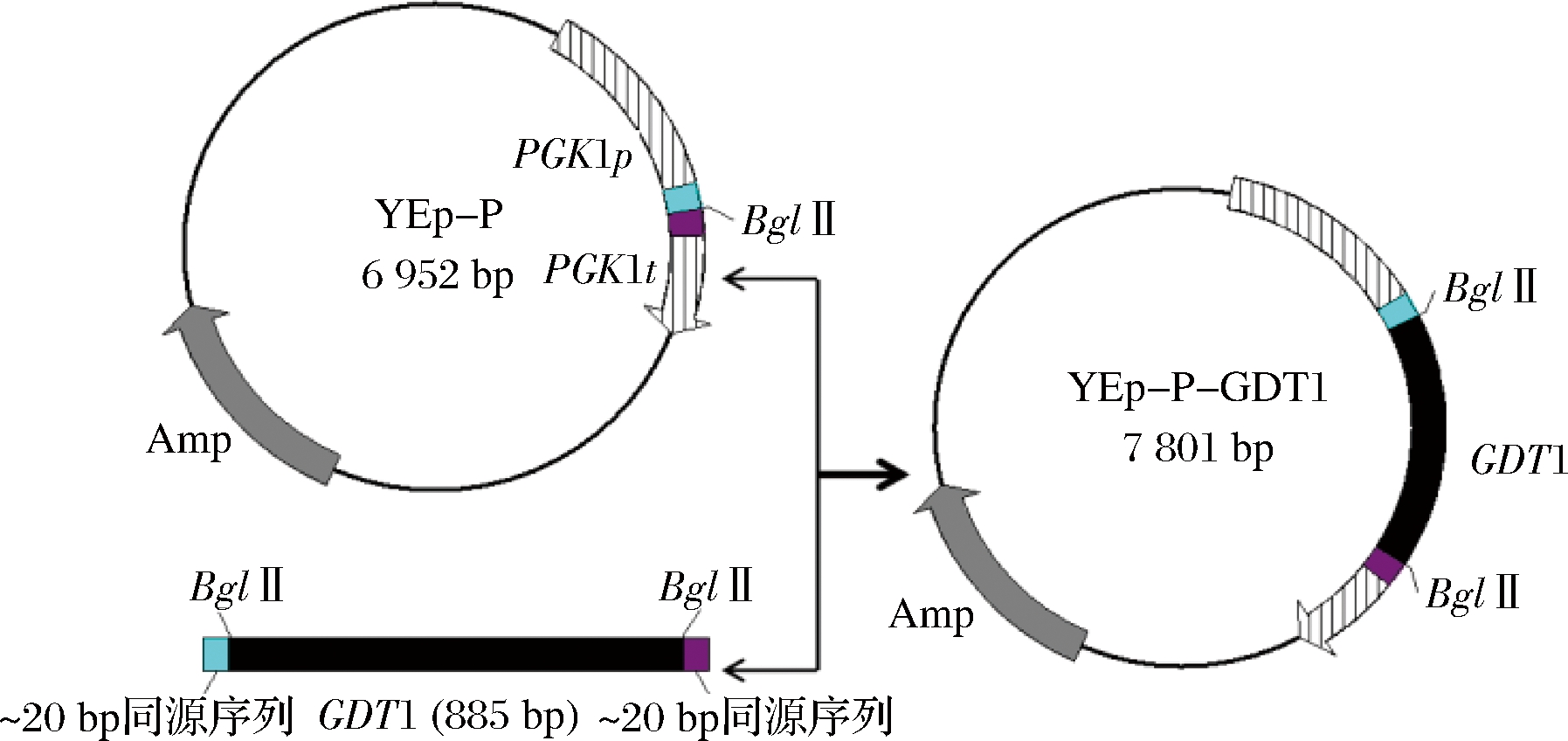
以亲本菌株的基因组为模板,用表2中的引物GDT1-F/GDT1-R扩增获得GDT1基因片段。限制性内切酶BglⅡ单酶切质粒YEp-P,使之线性化。用闪电克隆试剂盒将经BglⅡ酶切线性化的载体YEp-P与GDT1基因片段进行连接。然后将连接产物转入到E.coli DH5α感受态中进行扩增,构建质粒YEp-P-GDT1,构建过程如图1所示。
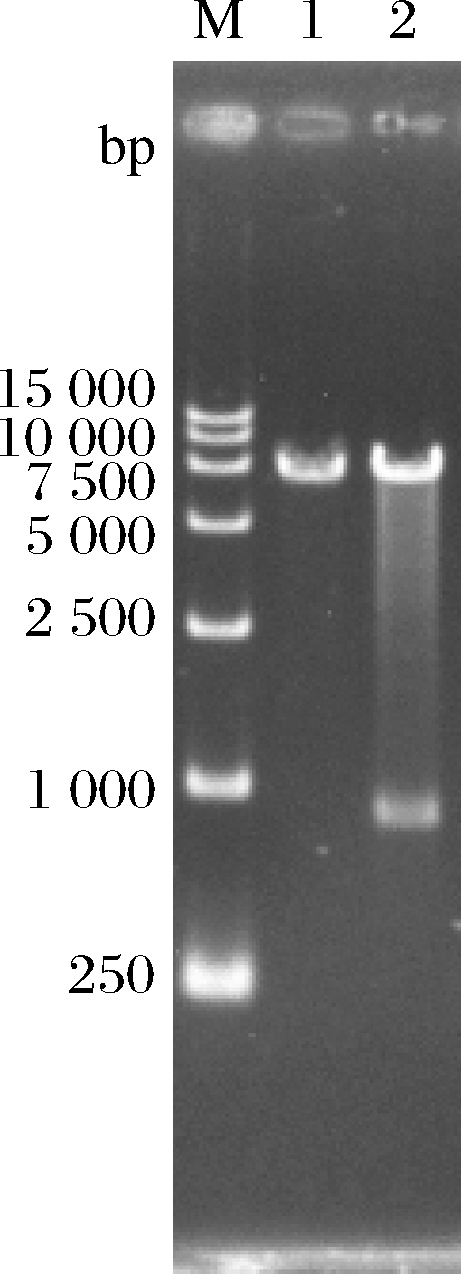
用限制性内切酶BglⅡ单酶切质粒YEp-P-GDT1,然后对酶切产物进行琼脂糖凝胶电泳,结果如图2所示。YEp-P-GDT1质粒经BglⅡ酶切后出现2条条带,大小分别与BglⅡ酶切线性化的质粒YEp-P大小(6 950 bp)以及与BglⅡ酶切的GDT1基因片段大小(853 bp)相同,表明质粒YEp-P-GDT1构建成功。
2.1.2 Gdt1过表达菌株转化子的获得及验证
过表达亲本菌株W303-1A中的GDT1基因用的是同源重组依赖型DNA组装法。
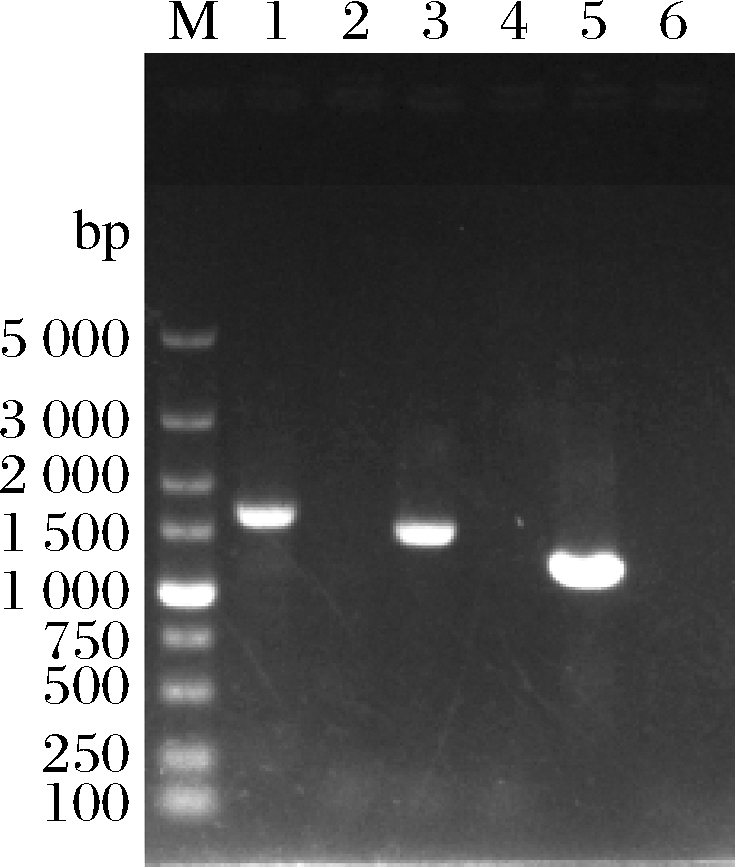
PCR扩增获得构建GDT1基因过表达菌株所需片段:GDT1+A(GDT1基因的上同源臂,以亲本菌株基因组为模板,用引物GDT1+A-F/GDT1+A-R扩增),Kan+GDT1(loxP-KanMX-loxP,以pUG6质粒为模板,用引物Kan+GDT1-F/Kan+GDT1-R扩增),P+GDT1(PGK1p-GDT1-PGK1t,以YEp-P-GDT1质粒为模板,用引物P+GDT1-F/P+GDT1-R扩增)和GDT1+B(GDT1基因的下同源臂,以亲本菌株基因组模板,用引物GDT1+B-F/GDT1+B-R扩增)。所得片段与预期大小一致(如图3),表明过表达GDT1基因所需片段正确。
将以上片段通过LiAc转化法转入到亲本菌株感受态中,经过G418抗性YPD平板筛选获得转化子,对转化子进行PCR验证,结果如图4所示。以过表达GDT1基因转化子的基因组为模板,(A+K)+GDT1-F/(A+K)+GDT1-R、Kan+P-F/Kan+P-R和(P+B)+GDT1-F/(P+B)+GDT1-R为引物分别扩增出1 642、1 493和1 201 bp大小的条带,与验证引物预期扩增的片段大小一致;将上述PCR扩增体系中的转化子基因组替换为亲本菌株基因组,扩增不到产物,说明GDT1基因过表达菌株构建成功,将其命名为W+GDT1。
2.1.3 Gdt1过表达菌株中GDT1基因转录水平的测定
测定菌株W+GDT1中Gdt1的相对表达水平来考察过表达GDT1基因对Gdt1蛋白表达量的影响(结果见图5)。过表达GDT1后,与亲本菌株相比,菌株W+GDT1中GDT1的相对表达水平提高了23.41倍。说明过表达GDT1基因的确提高了菌株中GDT1基因的转录水平。
2.2 钙转运蛋白Gdt1过表达对蛋白酶A胞外分泌的影响
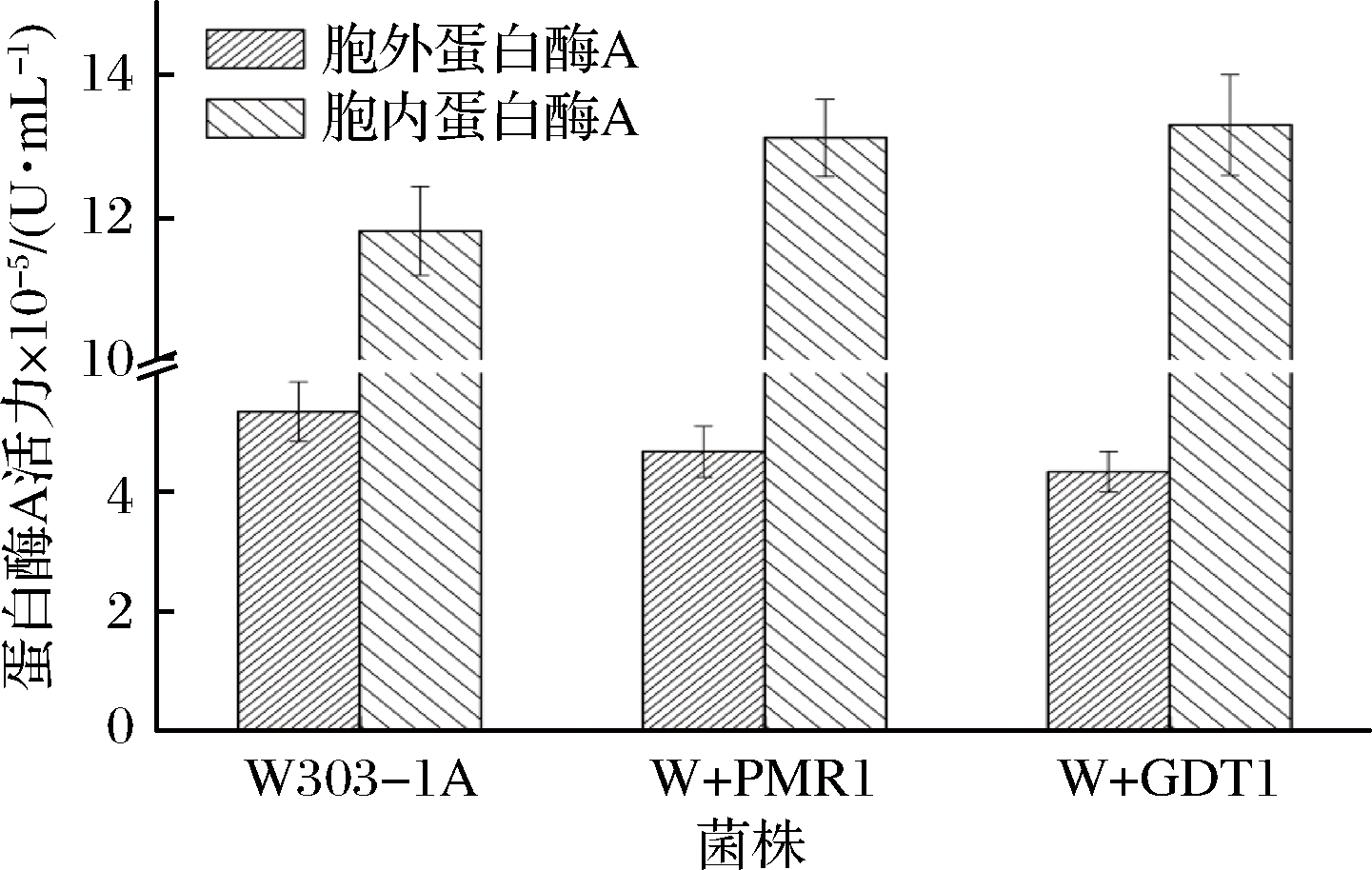
为了考察Gdt1是否也同Pmr1一样,在蛋白酶A的液泡分选过程中起相同的作用,将Gdt1过表达菌株W+GDT1、Pmr1过表达菌株W+PMR1以及亲本菌株W303-1A同时在低氮胁迫条件下进行发酵,然后测定了其胞内外蛋白酶A活力(结果见图6)。
图6显示,发酵结束时,菌株W+GDT1的胞内蛋白酶A的活力较亲本菌株提高了12.59%,胞外蛋白酶A活力较亲本菌株降低了18.81%;菌株W+PMR1的胞内蛋白酶A活力较亲本菌株提高了11.06%,胞外蛋白酶A活力较亲本菌株降低了12.42%。过表达Gdt1或者过表达Pmr1都提高了胞内蛋白酶A的酶活力,降低了胞外蛋白酶A的酶活力,说明过表达Gdt1可能如过表达Pmr1一样,促进蛋白酶A的液泡分选,致使更多的蛋白酶A被运输到液泡中,进而相应的外泌到细胞外的蛋白酶A量减少。与亲本菌株相比,过表达Gdt1后,可能单位时间内运输较多的Ca2+进入TGN腔内,缩短了TGN腔内Ca2+水平瞬时增加的时间,这可能是过表达Gdt1促进蛋白酶A的液泡分选,降低蛋白酶A的胞外分泌的原因之一。研究表明,Gdt1在液泡蛋白羧肽酶Y糖基化过程中有重要的作用,羧肽酶Y的异常糖基化可能降低其被分选到液泡的效率[23-24]。过表达GDT1基因后,细胞内Gdt1蛋白表达量提高,可能促进了蛋白酶A前体物质的糖基化过程的快速完成,进而提高分选其到液泡的效率,从而更多的蛋白酶A被分选到液泡中,这可能是过表达Gdt1促进蛋白酶A的液泡分选,降低蛋白酶A的胞外分泌的另一个原因。
Pmr1在液泡蛋白酶(蛋白酶A和羧肽酶Y)的液泡分选过程中起作用[16-17]。如Pmr1一样,Gdt1也可能间接调控其他液泡蛋白酶(除蛋白酶A之外)的液泡分选,另2个典型的液泡蛋白酶是羧肽酶Y和蛋白酶B。羧肽酶Y编码基因和蛋白酶B编码基因经过转录和翻译后,形成各自的前体物质,前体物质经过内质网和高尔基体的修饰后,最终被分选到液泡中激活成为有活性的羧肽酶Y和蛋白酶B[25]。由此可知,在液泡中才存在有活性的羧肽酶Y和蛋白酶B,2种蛋白酶在液泡中才发挥其作用,在分选蛋白酶A原到液泡的过程中不会起作用。蛋白酶A原在液泡中经过蛋白酶B的特异蛋白水解作用或者自我激活作用,才形成具有活性的蛋白酶A[1,10]。若过表达Gdt1影响了蛋白酶B的液泡分选,引起液泡中有活性的蛋白酶B的含量发生变化,是否也会间接影响蛋白酶A的胞内外酶活力?过表达Gdt1可能会促进蛋白酶B的液泡分选,使更多的蛋白酶B被分选到液泡中,液泡中较多的蛋白酶B会加快液泡中的蛋白酶A原转变为具有活性的蛋白酶A;蛋白酶B在蛋白酶A的液泡分选过程中不起作用,分选到液泡中的蛋白酶A原的量不会因液泡中蛋白酶B量的增加而发生改变,因此液泡中蛋白酶B量的增加只是缩短了液泡中蛋白酶A原转变为有活性的蛋白酶A的时间,并不会影响液泡中最终的蛋白酶A的酶活力;分选到液泡中的蛋白酶A原的量没有改变,相对应的外泌到细胞外的蛋白酶A原的量也不会改变,细胞外的蛋白酶A原在自我激活的作用下转变为有活性的蛋白酶A[26],从而胞外蛋白酶A的酶活力也不会因液泡中蛋白酶B量的增加发生改变。显然,在过表达Gdt1影响蛋白酶B的液泡分选的情况下,液泡中蛋白酶A酶活力是由分选到液泡中的蛋白酶A原的量决定的,并不会受蛋白酶B的影响。
2.3 钙转运蛋白Gdt1过表达对菌株基本发酵性能的影响
2.3.1 对发酵过程中菌株的生长繁殖、碳源和氮源吸收能力的影响
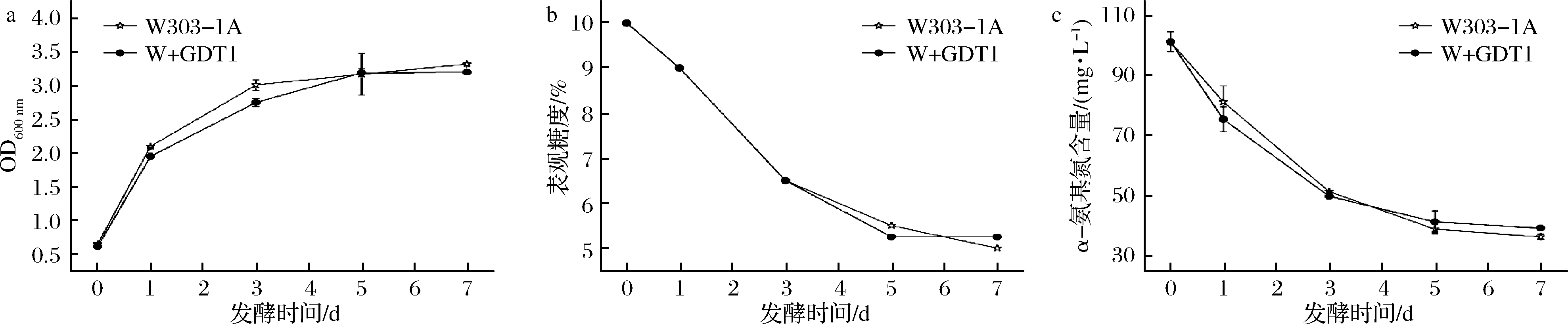
发酵期间各菌株的生物量、各菌株发酵液中的表观糖度以及α-氨基氮含量测定结果见图7。
由图7-a可知,菌株W+GDT1在发酵期间的生物量变化趋势和亲本菌株W303-1A相同:在第1天,菌体大量的繁殖,繁殖速度最快;从第2天到第5天菌体的繁殖速度逐渐缓慢,第6天到第7天,发酵液中菌体的浓度不变,即从第5天开始进入稳定期;菌株W+GDT1发酵期间相同的时间内产生的菌体量与亲本菌株基本相同。在酵母细胞中,过表达GDT1不会影响酵母细胞的生长繁殖。
由图7-b可知,菌株W+GDT1与亲本菌株W303-1A的耗糖曲线趋势基本上一致。结合各菌株发酵期间生物量的变化趋势图(图7-a)分析:前5 d,菌体大量生长繁殖,消耗大量的糖类合成菌体细胞成分和代谢产物的碳架;5 d之后,菌体生长繁殖速度逐渐变慢,最终生物量趋于恒定不变,耗糖的速度也逐渐变慢最后趋于平稳。由此可知,过表达Gdt1不会影响酵母细胞对碳源的吸收能力。
由图7-c可知,菌株W+GDT1和亲本菌株W303-1A对发酵液中α-氨基氮的利用情况曲线趋势大致相同。结合各菌株发酵期间生物量的变化趋势图(图7-a)分析:前5 d,由于菌体大量迅速的繁殖,菌体迅速吸收大量的氮源用于菌体自身生长所需,此时发酵液中α-氨基酸的含量下降的较快;5 d之后,菌体的繁殖速度逐渐变慢,最终在5 d之后发酵液中的菌浓趋于稳定不变,相应的菌体对发酵液中的α-氨基氮的利用速度逐渐缓慢,最后也趋于平稳。菌株W+GDT1在发酵的各个时期消耗的α-氨基氮的含量和亲本菌株W303-1A基本一致。过表达Gdt1的表达量不会影响酵母细胞对氮源的吸收能力。
2.3.2 对发酵结束时菌株发酵液中的乙醇体积分数和残糖含量的影响
发酵结束时,对菌种发酵液中的乙醇体积分数和残糖的含量进行了测定,测定结果见表3。发酵结束时菌株W+GDT1和亲本菌株发酵液中乙醇体积分数和残糖含量与亲本菌株W303-1A相比较没有显著性差异。过表达Gdt1不会影响酿酒酵母菌株的产乙醇能力。发酵结束时,各菌株发酵液中剩余的还原糖含量基本相同,这与图7-b显示的各菌株对碳源的吸收能力基本一致的结论相对应,即过表达Gdt1不会影响菌株的碳源吸收能力,因而发酵液中剩余还原糖的量也基本相同。
表3 菌株W+GDT1和W303-1A发酵液中乙醇体积分数
和残糖含量的比较
Table 3 Comparing of ethanol production and residual
reducing sugar content in the broth fermented with the
strains (W+GDT1 and W303-1A)

菌株乙醇体积分数/%残留还原糖含量/(g·L-1)W303-1A3.46±0.1723.25±0.35W+GDT13.53±0.0424.33±1.04
3 结论
蛋白酶A是酿酒酵母的一种液泡水解酶,在酿酒酵母细胞中起着不可替代的生理生化作用。在胁迫条件下,可以从酿酒酵母细胞中释放到发酵培养基中,影响啤酒的泡沫稳定性。本研究将钙转运蛋白Gdt1编码基因GDT1在组成型强启动子PGK1的调控下过量表达,探究了Gdt1过表达对蛋白酶A的胞外分泌的影响。与亲本菌株相比,Gdt1过表达菌株的胞内蛋白酶A活力提高了12.59%,胞外蛋白酶A活力降低了18.81%。确定了过表达Gdt1能提高蛋白酶A的液泡分选,并显著地降低了蛋白酶A的胞外分泌,为选育低蛋白酶A外泌的优良工业酿酒酵母以及改善啤酒泡沫稳定性提供了思路和参考。
参考文献
[1] PARR C L,KEATES R A B,BRYKSA B C,et al.The structure and function of Saccharomyces cerevisiae proteinase A[J].Yeast,2007,24(6):467-480.
[2] WOLFF A M,DIN N,PETERSEN J G.Vacuolar and extracellular maturation of Saccharomyces cerevisiae proteinase A[J].Yeast,1996,12(9):823-832.
[3] JONES E W.The synthesis and function of proteases in Saccharomyces: genetic approaches[J].Annual Review of Genetics,1984,18(1):233-270.
[4] LU J, DONG J, WU D,et al.Construction of recombinant industrial brewer’s yeast with lower diacetyl production and proteinase A activity[J].European Food Research and Technology,2010,235(5):951-961.
[5] MADDOX I S,HOUGH J S.Proteolytic enzymes of Saccharomyces carlsbergensis[J].The Biochemical Journal,1970,117(5):843-852.
[6] DREYER T,BIEDERMANN K,OTTESEN M.Yeast proteinase in beer[J].Carlsberg Reserach Communications,1983,48(3):249.
[7] HE G,WANG Z Y,LIU Z,et al.Relationship of proteinase activity,foam proteins,and head retention in unpasteurized beer[J].Journal of The American Society of Brewing Chemists,2006,64(1):33-38.
[8] WANG Z,HE G,LIU Z,et al.Purifcation of yeast proteinase A from fresh beer and its specifcity on foam proteins[J].International Journal of Food Science & Technology,2005,40(8):835-840.
[9] ZHANG H,RUAN H, LI W,et al.Construction of recombinant industrial S. cerevisiae strain with barley lipid-transfer protein 1 secretion capability and lower PrA activity[J].European Food Research and Technology,2011,233(4):707-716.
[10] WESTPHAL V,MARCUSSON E G,WINTHER J R,et al.Multiple pathways for vacuolar sorting of yeast proteinase A[J].The Journal of Biological Chemistry,1996,271(20):11 865-11 870.
[11] COOPER A A,STEVENS T H.Vps10p cycles between the late golgi and prevacuolar compartments in its function as the sorting receptor for multiple yeast vacuolar hydrolases[J].The Journal of Cell Biology,1996,133(3):529-541.
[12] JØRGENSEN M U,EMR S D,WINTHER J R.Ligand recognition and domain structure of Vps10p,a vacuolar protein sorting receptor in Saccharomyces cerevisiae[J].European Journal of Biochemistry,1999,260(2):461-469.
[13] MARCUSSON E G,HORAZDOVSKY B F,CEREGHINO J L,et al.The sorting receptor for yeast vacuolar carboxypeptidase Y is encoded by the VPS10 gene[J].Cell,1994,77(4):579-586.
[14] CHEN Y,SONG L,HAN Y,et al.Decreased proteinase A excretion by strengthening its vacuolar sorting and weakening its constitutive secretion in Saccharomyces cerevisiae[J].Journal of Industrial Microbiology & Biotechnology,2017,44(1):149-159.
[15] KIENZLE C,VON BLUME J.Secretory cargo sorting at the trans-Golgi network[J].Trends in Cell Biology,2014,24(10):584- 593.
[16] CURWIN A J,BLUME J V,MALHOTRA V,et al.Cofilin-mediated sorting and export of specific cargo from the Golgi apparatus in yeast[J].Molecular Biology of The Cell,2012,23(12):2 327-2 338.
[17] SONG L,CHEN Y,GUO Q,et al.Regulating the Golgi apparatus sorting of proteinase A to decrease its excretion in Saccharomyces cerevisiae[J].Journal of Industrial Microbiology & Biotechnology,2019,46(5):601-602.
[18] DEMAEGD D,FOULQUIER F,COLINET A S,et al.Newly characterized Golgi-localized family of proteins is involved in calcium and pH homeostasis in yeast and human cells[J].Proceedings of The National Academy of Sciences of The United States of America,2013,110(17):6 859-6 864.
[19] DEMAEGD D,COLINET A S,DESCHAMPS A,et al.Molecular evolution of a novel family of putative calcium transporters[J].PloS One,2014,9(6):e100851.
[20] GIETZ R D,WOODS R A.Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method[J].Methods in Enzymology,2002,350:87-96.
[21] 赵爱菊,马美范.茚三酮比色法测定酱油氨基氮含量中试验条件的探讨[J].齐鲁工业大学学报(自然科学版),1996,10(2):37-42.
[22] KONDO H,YOMO H,FURUKUBO S,et al.Advanced method for measuring proteinase A in beer and application to brewing[J].Journal of The Institute of Brewing,1999,105(5):293-300.
[23] COLINET A S,SENGOTTAIYAN P,DESCHAMPS A,et al.Yeast Gdt1 is a Golgi-localized calcium transporter required for stress-induced calcium signaling and protein glycosylation[J].Scientific Reports,2016,6:24 282.
[24] BONANGELINO C J,CHAVEZ E M,BONIFACINO J S.Genomic Screen for vacuolar protein sorting genes in Saccharomyces cerevisiae[J].Molecular Biology of The Cell,2002,13(7):2 486-2 501.
[25] VAN D H H B,KIELLAND-BRANDT M C,WINTHER J R.Review: biosynthesis and function of yeast vacuolar proteases[J].Yeast,1996,12(1):1-16.
[26] KONDO H,YOMO H,FURUKUBO S,et al.Advanced method for measuring proteinase A in beer and application to brewing[J].Journal of The Institute of Brewing,1999,105(5):293-300.