正红菇(Russula vinosa)属真菌界(Eumycetes)、担子菌门(Basidiomycota)、层菌纲(Hymenomycetes)、伞菌目(Agaricales)、红菇科(Russulaceae),分布于世界各地,尤其是温带地区。目前已知的红菇属真菌有750余种,我国就有150多种[1]。红菇味甘性温,含有大量生物活性成分,如红菇多糖、麦角甾醇、有机酸、酚类等[2],其子实体提取物在调节生长[3]、增强免疫力[4]、降血糖[5]、抗氧化[6]、抗肿瘤[7]等方面具有良好的功效。但红菇的菌丝不易分离,人工栽培难度较大,所以十分珍贵。
已有许多文献报道了红菇多糖的生物活性,如KHATUA等[8]证明了碱提红菇粗多糖具有较好的抗氧化活性;LIU等[7]发现水提红菇多糖能够增强HeLa和SiHa细胞的凋亡率。巨噬细胞常用作研究化合物免疫调节特性的重要细胞模型[9],当机体受到病理刺激或损伤时,巨噬细胞会产生大量的生物活性分子,包括NO和细胞因子[10]。但现有研究主要集中在单一提取方式所得红菇多糖的活性,关于分步提取红菇不同部位(菌盖和菌柄)多糖化学成分及活性之间差异的报道很少,因此不能确定表现出良好生物活性的红菇多糖有效成分获取方法。
本研究为了探讨分步提取正红菇不同部位多糖提取物的差异,将红菇子实体分为菌盖和菌柄,并依次采用热水浸提和碱液提取的方法,得到4种多糖提取物:菌盖多糖水提物(WCP)、菌盖多糖碱提物(ACP)、菌柄多糖水提物(WSP)和菌柄多糖碱提物(ASP)。采用高效体积排阻色谱串联多角度激光光散射仪(high performance size exclusion chromatography coupled with multiple angle laser light scattering, HPSEC-MALLS)和高效阴离子交换色谱(high performance anion exchange chromatography, HPAEC-PAD),分别测定了不同部位红菇多糖提取物的分子质量分布和单糖组成,并研究了4种多糖提取物对巨噬细胞RAW264.7免疫活性的影响,为正红菇资源的高效开发和高值化利用提供科学参考。
正红菇干品产自福建武夷山;小鼠巨噬细胞系RAW264.7,中国科学院上海生命科学研究院细胞资源中心。
10种单糖标准品:岩藻糖(Fuc)、葡萄糖(Glc)、阿拉伯糖(Ara)、鼠李糖(Rha)、甘露糖(Man)、果糖(Fru)、半乳糖(Gal)、核糖(Rib)、半乳糖醛酸(GalA)和葡萄糖醛酸(GlcA),美国Sigma 公司;一氧化氮(NO)检测试剂盒,碧云天生物技术研究所;DMEM培养基、胎牛血清(fetal bovine serum, FBS)、青霉素-链霉素双抗,维森特生物技术(南京)有限公司;小鼠TNF-α、IL-1β ELISA试剂盒,上海通蔚实业有限公司;脂多糖(lipopolysaccharides,LPS)、中性红等均为国产分析纯,国药集团化学试剂有限公司;试验用水均为去离子水。
Agilent 1260 型高效液相色谱仪,美国Agilent公司;HPSEC-MALLS 多角度激光光散射仪,美国WYATT公司;ICS-5000离子色谱仪,美国Thermo公司;SpectraMax i3x多功能酶标仪,美谷分子仪器(上海)有限公司;752型紫外可见分光光度计,上海光谱仪器有限公司。
1.3.1 红菇多糖提取物的制备
正红菇子实体菌盖、菌柄分开后,分别粉碎、过80目筛,得到2个部位的菌粉。菌粉加入体积分数80%乙醇过夜脱色、离心,沉淀于80 ℃水浴中搅拌提取3 h并重复提取1次,提取液分别旋蒸浓缩、透析、醇沉,离心后沉淀真空干燥得到WCP和WSP。水提后残渣继续采用0.5 mol/L NaOH/0.01 mol/L NaBH4溶液室温下提取12 h,提取液采用上述同样的方法处理,得到ACP和ASP。总糖含量采用苯酚-硫酸法[11]测定,蛋白质含量采用考马斯亮蓝法[12]测定,总酚含量采用福林酚法[13]测定,糖醛酸含量采用间羟基联苯显色法[14]测定,提取率按照公式(1)计算。
提取率![]()
(1)
式中:m1,真空干燥后所得多糖提取物的质量;m0,干燥菌粉的质量。
1.3.2 红菇多糖提取物的分子质量分布
采用高效体积排阻色谱串联DAWNHELEOS-II多角度激光光散射器、Optilab T-rEX示差折光检测器、G7114A紫外检测器和ViscoStar-II差压式黏度检测器,分析多糖的分子质量分布、固有黏度[η]和回旋半径Rg等参数[15]。色谱柱 OHpak SB-805HQ (8.0 mm×300 mm)和OHpak SB-803HQ (8.0 mm×300 mm)串联;流动相0.1 mol/L NaNO3;流速0.6 mL/min;柱温40 ℃;红菇多糖样品用流动相配制成1 mg/mL的溶液;进样体积100 μL;使用ASTRA 7.1.3软件进行数据的采集和分析。
1.3.3 单糖组成分析
采用Thermo ICS-5000高效阴离子交换色谱串联脉冲安培检测器(high performance anion exchange chromatography coupled with pulsed amperometric detector, HPAEC-PAD)分析样品的单糖组成,色谱柱 CarboPacTM PA20(3 mm×150 mm)。流动相A为超纯水,B为250 mmol/L的NaOH溶液,C为1 mol/L的NaOAc溶液,进行梯度洗脱,洗脱程序参照ZHANG等[16]并进行适当修改。
称取样品5 mg于具塞试管中,冰浴条件下加入0.5 mL浓H2SO4,室温反应30 min,缓慢加水将H2SO4稀释至2 mol/L,混匀后于100 ℃的油浴中水解2 h。取出迅速冷却,稀释50倍后,用0.22 μm微孔膜过滤并进样分析。10种单糖标准品在相同条件下进行定性和定量分析。
1.3.4 细胞培养与实验模型
使用小鼠巨噬细胞RAW264.7评估正红菇多糖提取物的免疫活性。RAW264.7培养在新鲜配制的DMEM完全培养基(含体积分数10% FBS、100 IU/mL青霉素和100 μg/mL链霉素)中,体积分数5% CO2,37 ℃。将对数生长期RAW264.7细胞密度调节至1×105个/mL,用于细胞增殖率、中性红吞噬能力、NO产生量以及细胞因子的测定。其中未加多糖干预(完全培养基)的为阴性对照组,含有系列浓度(10、50、100、200 μg/mL)多糖样品的作为实验组,1 μg/mL的脂多糖(lipopoly-saccharides, LPS)作为阳性对照,每组平行6~8次。
1.3.5 细胞增殖情况
取对数生长期的RAW264.7细胞悬浮液,以100 μL/孔接种到96孔板细胞培养板中,培养24 h,然后在细胞培养板的每个孔中加入20 μL质量浓度5 mg/mL的噻唑蓝3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide, MTT)溶液,继续孵育4 h,弃上清培养基,向每孔中加入150 μL二甲基亚砜(dimethyl sulfoxide, DMSO),低速摇匀10 min使蓝紫色结晶物完全溶解,使用酶标仪在570 nm波长处测定吸光度,细胞增殖率按照公式(2)计算[17]。
细胞增殖率![]()
(2)
式中:At,实验组(或阳性对照组)吸光度;Ac,阴性对照组吸光度。
1.3.6 Griess 法测定NO
采用一氧化氮检测试剂盒分析4种样品对RAW264.7细胞产生NO量的影响。取对数生长期的RAW264.7细胞悬浮液,以100 μL/孔接种到96孔板细胞培养板中,培养24 h后,取上清液50 μL于另一个96孔板中,室温下分别加入试剂盒中Griess试剂I和试剂II,轻轻混匀后,使用酶标仪在570 nm波长处测定吸光度。根据试剂盒中NaNO2标准品绘制标准曲线,并计算样品NO的含量。
1.3.7 中性红吞噬能力
取对数生长期的RAW264.7细胞悬浮液,以100 μL/孔接种到96孔板细胞培养板中,培养24 h后弃上清,加入质量分数0.01%中性红生理盐水溶液100 μL,培养4 h后弃上清,用PBS洗2遍,加入100 μL细胞裂解液[V(乙醇)∶V(冰醋酸)=1∶1],避光反应2 h,在酶标仪上测定540 nm处吸光度值[18],吸光度的大小直接反应巨噬细胞对中性红的吞噬能力。
1.3.8 细胞因子检测
采用ELISA试剂盒检测细胞培养液中IL-1β和TNF-α的含量[19]。取对数生长期的RAW264.7细胞悬浮液,以100 μL/孔接种到96孔板细胞培养板中,培养24 h 后取上清,往预先包被细胞因子捕获抗体的微孔中,依次加入标准品(或样品)、HRP标记的检测抗体,温育后加入底物3,3′,5,5′-四甲基联苯胺(tetramethyl-benzidine, TMB)显色,酶标仪在波长450 nm处测定吸光度,根据标准曲线计算样品中细胞因子的浓度。
1.3.9 数据统计与分析
除细胞实验外,其他实验平行测量3次。数据均采用均值±标准差表示。采用SPSS statistics 17.0软件进行单因素方差分析及多重比较分析,P<0.05为差异显著有统计学意义。
WCP、ACP、WSP和ASP主要是由中性糖组成,还含有一定量的蛋白质和少量酚类物质,具体结果见表1。
4种红菇多糖提取物的糖醛酸含量均较低,质量分数最高为3.02%,而蛋白质质量分数均在8%左右,但相同部位多糖碱提物的含量略高于水提物,这可能是由于碱性环境促进了蛋白质的溶出。红菇多糖水提物的提取率、总糖含量、总酚含量均高于对应部位的碱提物,其中WSP的提取率和总糖含量最高,质量分数分别是6.25%和75.17%;WCP总酚含量最高,质量分数为0.78%。综上,相同提取方式得到的菌盖与菌柄多糖提取物,其化学成分相似,但相同部位的水提物与碱提物的化学成分存在一定差异。
表1 不同部位红菇多糖的提取率和化学成分
Table 1 The extraction yield and chemical composition of different parts of Russula vinosa polysaccharides
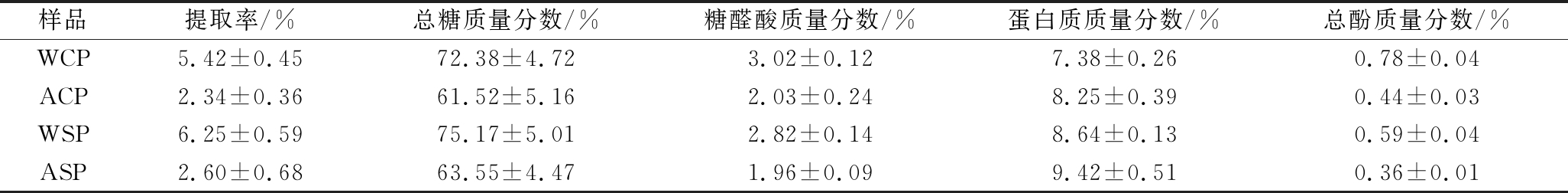
样品提取率/%总糖质量分数/%糖醛酸质量分数/%蛋白质质量分数/%总酚质量分数/%WCP5.42±0.4572.38±4.723.02±0.127.38±0.260.78±0.04ACP2.34±0.3661.52±5.162.03±0.248.25±0.390.44±0.03WSP6.25±0.5975.17±5.012.82±0.148.64±0.130.59±0.04ASP2.60±0.6863.55±4.471.96±0.099.42±0.510.36±0.01
HPSEC-MALLS可以得到高分子聚合物的绝对分子质量、分子质量分布等[15]。聚合物的散射光强度(light scattering, LS)取决于分子的尺寸和浓度;而示差折光(refractive index, RI)信号与样品浓度直接相关,两者串联可以表征多糖的回旋半径(radius of gyration, Rg)等分子尺寸参数。

a-光散射信号;b-示差折光信号;1-WCP;2-ACP;3-WSP;4-ASP
图1 四种红菇多糖提取物的HPSEC色谱图
Fig.1 HPSEC chromatogram of four Russula vinosapolysaccharide fractions
4种红菇多糖提取物的RI信号峰分布较宽,WCP与WSP出现多个色谱峰且峰型相似(图1-b),表明菌盖和菌柄中的水提物分子质量及其分布无显著性差异。红菇多糖水提物中存在多种分子质量分布的色谱峰,且水提物的多分散系数(Mw/Mn)略高于碱提物,表明水提物中多糖分子质量分布较宽。图1可以看出,4种样品中主要的大分子多糖分布相对集中,呈均一对称色谱峰,并且均在25.8 min前出峰,由此计算提取物中主要组分的分子质量、回旋半径(Rg)等参数(表2),结果表明:红菇多糖碱提物的重均分子质量(Mw)、数均分子质量(Mn)、固有黏度([η])和回旋半径(Rg)均小于对应部位的水提物,这可能是由于碱性环境促使大分子多糖发生降解,从而引起分子大小及理化性质的改变,这将导致其生物活性存在差异[20]。此外,WCP的主要组分还存在含量较低的大分子信号峰,推测其可能是由于多糖分子之间形成聚集体造成的[15]。
表2 不同部位红菇多糖主要组分的分子参数
Table 2 Molecular parameters of main components ofdifferent parts of Russula vinosa polysaccharides
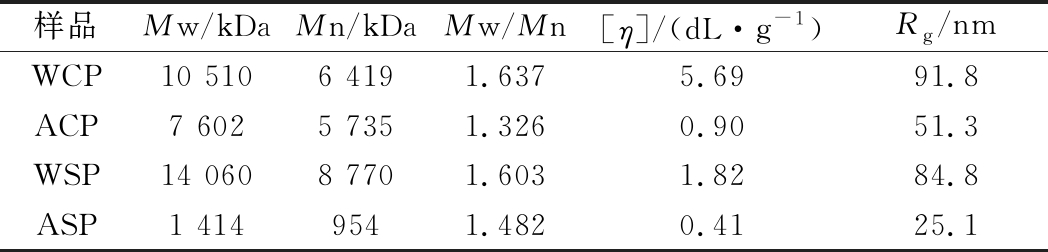
样品Mw/kDaMn/kDaMw/Mn[η]/(dL·g-1)Rg/nmWCP10 5106 4191.6375.6991.8ACP7 6025 7351.3260.9051.3WSP14 0608 7701.6031.8284.8ASP1 4149541.4820.4125.1
通过HPAEC-PAD分析,得到10种混合单糖标准品的色谱图如图2-a所示。相同条件下,测得WCP、ACP、WSP、ASP均主要由葡萄糖组成,含有少量半乳糖和甘露糖(图2-b)。
菌盖多糖水提物WCP的单糖组成为葡萄糖(质量分数78.4%)、半乳糖(质量分数17.5%)和甘露糖(质量分数8.3%),碱提物ACP具有相似的组分,但半乳糖质量分数降低至6.2%,甘露糖质量分数增加到9.6%;菌柄多糖提取物也具有同样的变化趋势(表3)。该结果表明,与水提物相比,对应部位红菇多糖碱提物其半乳糖含量降低、甘露糖含量升高,即不同提取方式得到多糖提取物的单糖组成种类相同,但比例具有显著差异,这些差异可能会影响多糖提取物的生物活性[20]。菌盖和菌柄部位的多糖组成相似,这表明红菇菌柄和菌盖部位多糖提取物的单糖组成无显著差异。
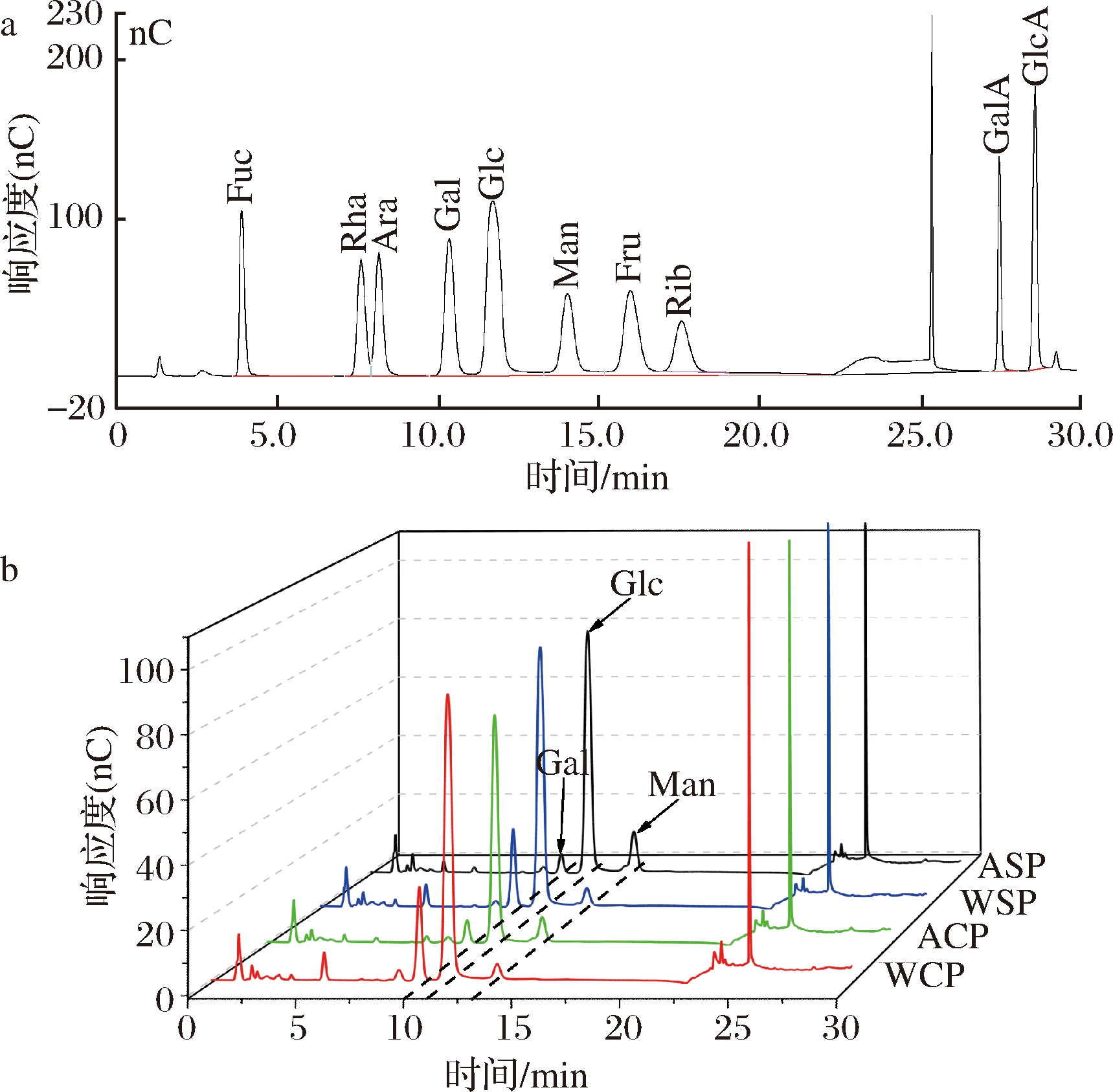
a-10种混合单糖标准品;b-红菇多糖提取物
图2 十种混合单糖标准品(a)以及红菇多糖提取物(b)的离子色谱图
Fig.2 The HPAEC chromatogram of 10 mixed monosacch-aride standards(a) and Russula vinosa polysaccharide extracts(b)
表3 不同部位红菇多糖提取物的单糖组成比较
Table 3 Comparison of monosaccharide compositions ofdifferent parts of Russula vinosa polysaccharides extracts
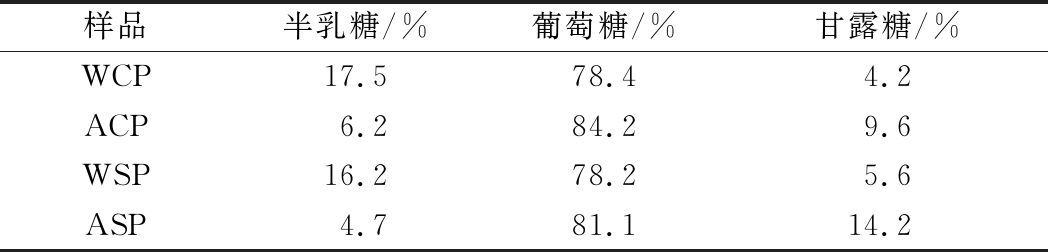
样品半乳糖/%葡萄糖/%甘露糖/%WCP17.578.44.2ACP6.284.29.6WSP16.278.25.6ASP4.781.114.2
采用MTT法测定了4种红菇多糖提取物对巨噬细胞活力的影响,结果见图3。

图3 不同部位红菇多糖提取物对RAW264.7细胞增殖率的影响
Fig.3 Effect of different parts of Russula vinosapolysaccharides extracts on the proliferation rate of RAW264.7 cells
WCP和WSP作用效果相似,均能显著促进RAW264.7细胞的增殖,且随着多糖浓度的增加呈现上升趋势,虽然WCP浓度达到200 μg/mL时,细胞增殖率表现出了轻微的下降,但水提物组巨噬细胞的增殖率普遍高于碱提物组。相比之下,尽管ACP和ASP对巨噬细胞的增殖没有明显剂量依赖性,但仍有轻微的增殖且2组增殖效果相似。总之,WCP、ACP、WSP和ASP的细胞增殖率均为正值,表明4种红菇多糖提取物对巨噬细胞RAW264.7的增殖具有一定的促进作用。
巨噬细胞释放NO量的多少,可以间接反映其发挥非特异性免疫的强弱[21]。由图4可知,不同部位红菇多糖提取物刺激RAW264.7细胞产生NO的量各不相同,但都表现出了一定的剂量依赖性。随着多糖浓度的增加,RAW264.7细胞产生NO的量呈上升趋势。其中,红菇多糖水提物WCP和WSP的效果较为显著,而碱提物ACP与ASP作用效果次之。以上结果表明,与红菇多糖碱提物相比,多糖水提物可以刺激巨噬细胞产生更多的NO,从而较好的发挥免疫效应;而相同提取方式下,红菇菌盖与菌柄多糖提取物对促进巨噬细胞释放NO的能力无显著差异。
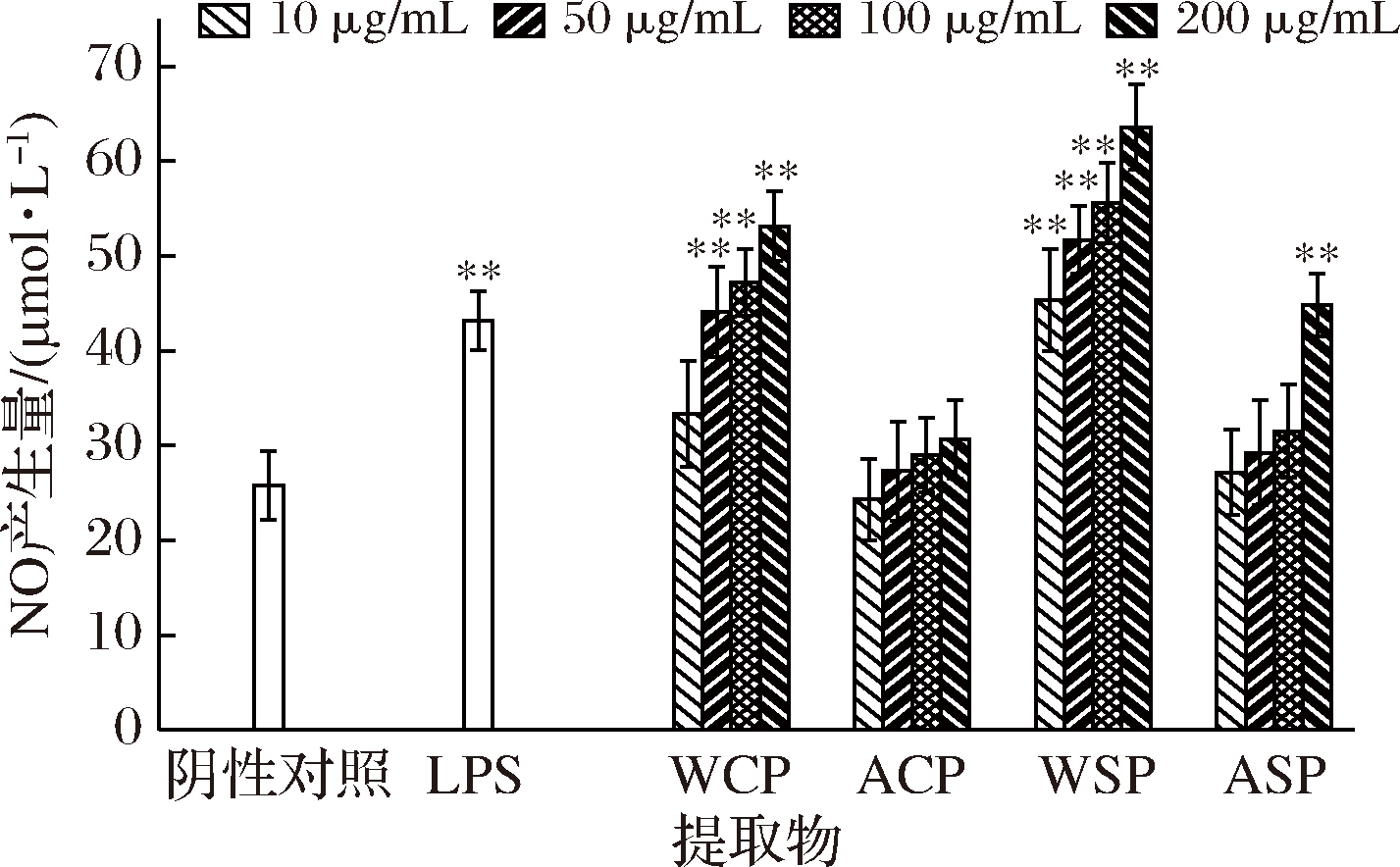
图4 不同部位红菇多糖提取物对RAW264.7细胞产生NO的影响
Fig.4 Effect of different parts of Russula vinosa polysacc-harides extracts on NO production in RAW264.7 cells
注:与阴性对照组相比,*,差异显著(P<0.05),**,差异极显著(P<0.01)(下同)
巨噬细胞的吞噬能力是反映细胞免疫活性的一个重要指标。从图5可以看出,不同部位红菇多糖提取物对RAW264.7细胞吞噬中性红能力的影响不同。与对照LPS相比,除ACP对中性红吞噬率无明显变化外,其余3种多糖提取物都能够促进RAW264.7细胞吞噬中性红,且都表现出一定的剂量依赖性;当样品质量浓度为200 μg/mL时,WCP、WSP和ASP均具有显著性影响。

图5 不同部位红菇多糖提取物对巨噬细胞吞噬中性红能力的影响
Fig.5 Effect of different parts of Russula vinosapolysaccharides extracts on macrophage phagocytosis indicated by neutral red assay
以上结果表明,除了ACP外,其他另外3种红菇多糖提取物均能增强RAW264.7细胞的吞噬能力,且作用效果相似。
细胞因子被诱导之后,会引发免疫系统的抗病反应,并有助于增强免疫反应[22]。与阴性对照组相比,4种红菇多糖提取物均能显著促进RAW264.7细胞分泌IL-1β(图6-b);除ASP外,其余3种多糖均能显著促进TNF-α的分泌量(图6-a)。与ACP和WSP相比,WCP对2种细胞因子的分泌量均有一定程度的提高,具有明显的剂量依赖性。与ASP相比,WSP能刺激RAW264.7细胞释放较多TNF-α和IL-1β;且随着WSP质量浓度的增加,TNF-α的分泌量逐渐增加,尽管IL-1β的量保持稳定,但均高于ASP组。此外,随着ASP质量浓度的增加, TNF-α的分泌量表现出小幅度下降趋势。综上,红菇多糖水提物比碱提物能更显著地促进巨噬细胞对TNF-α和IL-1β的分泌,且菌盖多糖略优于菌柄多糖。
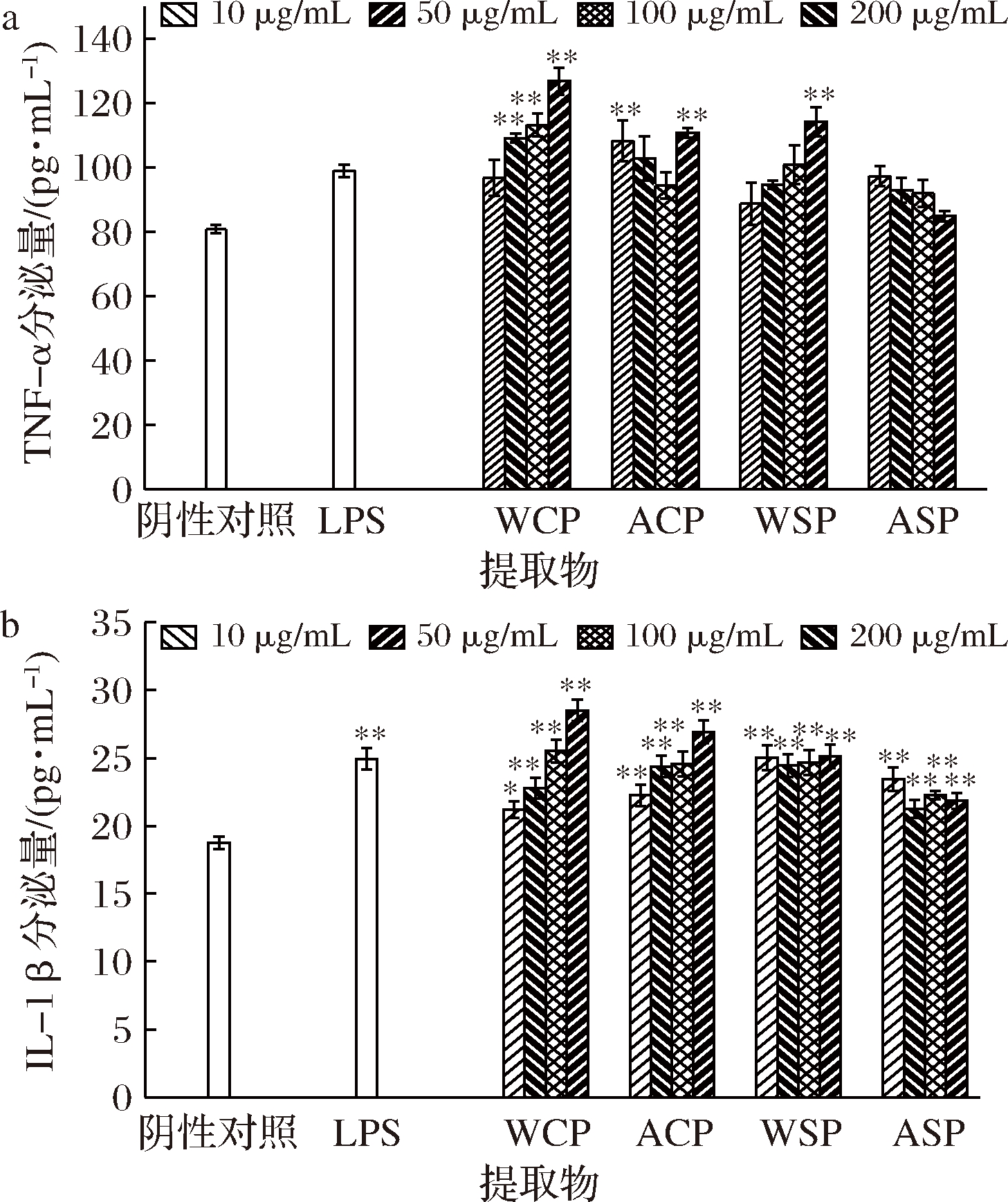
a-细胞因子TNF-α;b-细胞因子IL-1β
图6 不同部位红菇多糖提取物对RAW264.7细胞分泌细胞因子的影响
Fig.6 Effect of different parts of Russula vinosapolysaccharides extracts on cytokine secretion of RAW264.7 cells
本研究依次利用热水和碱液提取正红菇菌盖和菌柄多糖,得到WCP、WSP、ACP和ASP 4种多糖提取物。从化学组成和分子质量方面进行比较,在相同提取方式下,菌盖和菌柄多糖提取物的化学成分、分子质量、回转半径以及单糖组成等均无显著差异;而同一部位的水提物与碱提物,其总糖含量、分子质量、固有黏度、回转半径以及单糖组成等具有显著差异,从而推测正红菇多糖提取物的化学组成和结构特征与提取部位相关性小,而与提取方式相关性大。体外细胞免疫实验表明:一定质量浓度范围内,正红菇菌盖和菌柄部位的多糖水提物在促进巨噬细胞增殖、吞噬作用以及NO和细胞因子(如TNF-α和IL-1β)的释放量等方面,比对应的碱提物更具优势,推测其可能是由于正红菇多糖水提物与碱提物的化学组成和结构差异所致。本研究为红菇多糖进一步在食品和保健品工业中的应用提供理论参考,水提红菇多糖的结构鉴定及免疫活性机理可作为后续研究重点。
[1] 宋斌,李泰辉,吴兴亮,等.中国红菇属种类及其分布[J].菌物研究, 2007, 5(1):20-42.
[2] MAARISIT W, YAMAZAKI H, KANNO S I, et al. Protein tyrosine phosphatase 1B inhibitory properties of seco-cucurbitane triterpenes obtained from fruiting bodies of Russula lepida[J]. Journal of Natural Medicines, 2017, 71(1):334-337.
[3] MATSUZAKI N, WU J, KAWAIDE M, et al. Plant growth regulatory compounds from the mushroom Russula vinosa[J]. Mycoscience, 2016,57(6):404-407.
[4] 陈健,申超群,贺婷,等.正红菇多糖的抗癌和免疫调节活性研究[J].现代食品科技,2016,32(11):24-29.
[5] 陈旭健,张原琪.红菇多糖的提取及其降血糖,血脂作用研究[J].食品科学,2010, 31(9):255-258.
[6] 贺婷,颜盛繁,陈健.正红菇子实体多糖HAP-Ⅰ的结构和抗氧化活性评价[J].现代食品科技,2015,31(10):63-68.
[7] LIU Y, ZHANG JJ, MENG ZL. Purification, characterization and anti-tumor activities of polysaccharides extracted from wild Russula griseocarnosa[J]. International Journal of Biological Macromolecules, 2018, 109(1):1 054-1 060.
[8] KHATUA S, ACHARYA K. Alkaline extractive crude polysaccharide from Russula senecis possesses antioxidant potential and stimulates innate immunity response [J]. Journal of Pharmacy & Pharmacology, 2017, 69(12):1 817-1 828.
[9] ZHANG M, WANG G, LAI F, et al. Structural characterization and immunomodulatory activity of a novel polysaccharide from Lepidium meyenii[J]. Journal of Agricultural and Food Chemistry, 2016,64(9):1 921-1 931.
[10] LIU X, XIE J, JIA S, et al. Immunomodulatory effects of an acetylated, Cyclocarya paliurus, polysaccharide on murine macrophages RAW264.7 [J]. International Journal of Biological Macromolecules, 2017, 98:576-581.
[11] 张媛媛,张彬.苯酚-硫酸法与蒽酮-硫酸法测定绿茶茶多糖的比较研究[J]. 食品科学, 2016,37(4):158-163.
[12] 韩婷,史国华,李素哲,等.壳聚糖中蛋白质含量测定方法的研究[J]. 中国医疗器械杂志, 2016,40(2):122-124.
[13] 刘玉明,李珂娴,何颖,等.枇杷花水提液总酚含量的Folin-Ciocalteu法测定[J]. 时珍国医国药, 2017,28(4):76-78.
[14] 任珍芸,刘爱萍,陈晓航,等.改良间羟基联苯法用于测定肺炎球菌荚膜多糖中糖醛酸含量[J].中国新药杂志, 2018,27(6):644-649.
[15] ZHANG H, CHEN J, LI J, et al. Extraction and characterization of RG-I enriched pectic polysaccharides from Mandarin citrus peel[J]. Food Hydrocolloids, 2017,79:579-586.
[16] ZHANG H, NIE S P, YIN J Y, et al. Structural characterization of a heterogalactan purified from fruiting bodies of Ganoderma atrum[J]. Food Hydrocolloids, 2014, 36:339-347.
[17] CAI H L, HUANG X J, NIE S P, et al. Study on Dendrobium officinale O-acetyl-glucomannan (Dendronan®): Part III-Immunomodulatory activity in vitro[J]. Bioactive Carbohydrates and Dietary Fibre, 2015, 5(2):99-105.
[18] WANG M, ZHU P, ZHAO S, et al. Characterization, antioxidant activity and immunomodulatory activity of polysaccharides from the swollen culms of Zizania latifolia[J]. International Journal of Biological Macromolecules, 2017, 95:809-817.
[19] YU Q, NIE S P, LI W J, et al. Macrophage immunomodulatory activity of a purified polysaccharide isolated from Ganoderma atrum[J]. Phytotherapy Research, 2013, 27(2):186-191.
[20] ROSS K A, GODFREY D, FUKUMOTO L, et al. The chemical composition, antioxidant activity and α-glucosidase inhibitory activity of water-extractable polysaccharide conjugates from northern Manitoba lingonberry[J]. Cogent Food & Agriculture, 2015, 1:1-19.
[21] BAHRAMZADEH S, TABARSA M, YOU S G, et al. Purification, structural analysis and mechanism of murine macrophage cell activation by sulfated polysaccharides from Cystoseira indica[J]. Carbohydrate Polymers, 2018.201(1):261-270.
[22] WANG Y, TIAN Y, SHAO J, et al. Macrophage immunomodulatory activity of the polysaccharide isolated from Collybia radicata mushroom[J]. International Journal of Biological Macromolecules, 2017(108):300-306.