 N等[4]从金枪鱼和大比目鱼皮明胶中制备小分子蛋白质;SAMPATH KUMAR等[5]利用胃蛋白酶、胰蛋白酶和食糜蛋白酶从马鲛鱼和黄花鱼的皮肤中提取获得蛋白质水解肽。目前,国内关于利用蒸煮液制备活性蛋白肽的相关研究还鲜有报道。
N等[4]从金枪鱼和大比目鱼皮明胶中制备小分子蛋白质;SAMPATH KUMAR等[5]利用胃蛋白酶、胰蛋白酶和食糜蛋白酶从马鲛鱼和黄花鱼的皮肤中提取获得蛋白质水解肽。目前,国内关于利用蒸煮液制备活性蛋白肽的相关研究还鲜有报道。鳀鱼已经成为世界上捕捞量最大的小型鱼种,年产量达到9 000万t[1]。鳀鱼蒸煮液富含蛋白质、氨基酸、微量元素、牛磺酸等营养物质[2],但是目前这些蒸煮液大部分被直接排放,造成了一定程度的资源浪费和环境污染。
蛋白肽的分子质量位于大分子蛋白质和氨基酸之间,具有分子量小、易吸收、水溶性佳、稳定且安全等优点,广泛应用于食品、饲料及肥料中。WASSWA等[3]利用碱性蛋白酶制备草鱼皮蛋白肽;ALEM N等[4]从金枪鱼和大比目鱼皮明胶中制备小分子蛋白质;SAMPATH KUMAR等[5]利用胃蛋白酶、胰蛋白酶和食糜蛋白酶从马鲛鱼和黄花鱼的皮肤中提取获得蛋白质水解肽。目前,国内关于利用蒸煮液制备活性蛋白肽的相关研究还鲜有报道。
N等[4]从金枪鱼和大比目鱼皮明胶中制备小分子蛋白质;SAMPATH KUMAR等[5]利用胃蛋白酶、胰蛋白酶和食糜蛋白酶从马鲛鱼和黄花鱼的皮肤中提取获得蛋白质水解肽。目前,国内关于利用蒸煮液制备活性蛋白肽的相关研究还鲜有报道。
磁性交联酶聚集体(magnetic cross-linked enzyme aggregates)技术是一种相对较新的酶固定化方法,主要是将交联酶聚集体(cross-linked enzyme aggregates, CLEAs)附着在氨基功能化磁性纳米颗粒(magnetic nanoparticles,MNP)上[6]。将这种氨基官能化的磁铁矿纳米颗粒添加到具有低赖氨酸残余物含量的酶溶液中可以制备出高稳定性的CLEAs。此外,由于磁铁矿纳米颗粒的磁性,通过外部施加磁场能将CLEAs与其反应混合物分离,可实现蛋白酶的重复利用[7]。
本研究制备了磁性中性蛋白酶CLEAs和磁性碱性蛋白酶CLEAs,并以鳀鱼蒸煮液作为原料,利用固定化酶制备蛋白肽。在单因素试验的基础上运用中心组合设计法优化酶解工艺,并对酶解液蛋白肽的氨基酸组成、分子量分布和抗氧化活性进行分析,同时考察固定化酶的重复利用性。本研究可为促进鱼类资源高值化利用提供理论依据。
鳀鱼蒸煮液,福州海汇生物科技实业有限公司;碱性蛋白酶,北京索莱宝科技有限公司;中性蛋白酶,北京奥博星生物技术有限责任公司;乙腈、甲醇均为色谱纯,国药集团化学试剂有限公司;2,2-联苯基-1-苦基肼基,上海麦克林生化科技有限公司;FeSO4·7H2O,西陇化工股份有限公司;3-氨丙基三乙氧基硅烷(APTES),上海麦克林生化科技有限公司;三氟乙酸、三羟甲基氨基甲烷、盐酸、无水乙醇、正丙醇、NaOH、三氯乙酸、邻苯三酚、水杨酸等均为分析纯,国药集团化学试剂有限公司。
SP-756P紫外分光光度计,上海光谱仪器有限公司;Sartorius BS 210S电子天平,德国Sartorius公司;Biochrom30+全自动氨基酸分析仪,英国biochrom公司;LC-20AT高效液相色谱仪,日本岛津公司;ZNCL-TS智能磁力搅拌器,上海越众仪器设备有限公司;THZ-82恒温水浴振荡器,常州国华电器有限公司。
1.3.1 磁性CLEAs的制备和重复利用
MNP的制备和修饰参考AKHOND等[8]和BEDADE等[9]报道的方法。将1.33 g FeSO4·7H2O和2.59 g FeCl3·6H2O溶解在100 mL去离子水中,用氮气流除去氧气使其产生惰性条件。之后加入6.0 mL氨水(25%质量分数)搅拌30 min,收集沉淀物,用去离子水(3次)和乙醇(1次)洗涤,即得MNP。将1.38 g MNP悬浮在50 mL乙醇(50%体积分数)中,超声处理30 min后滴加5.55 mL APTES,并在1 000 r/min、50 ℃下回流3 h进行MNP修饰。然后在25 ℃条件下8 000 r/min离心10 min,收集沉淀物用去离子水(3次)和乙醇(1次)洗涤,即得修饰化的MNP,干燥备用。
磁性CLEAs的制备:称取5 mg中性蛋白酶和10 mg碱性蛋白酶,分别用1 mL磷酸缓冲液(pH分别为 7.5、10.5)溶解,加入5 mg修饰化的MNP,混匀。之后加入9 mL乙醇,置于4 ℃冰箱,待蛋白酶完全沉淀后加入体积分数0.2%戊二醛溶液,于4 ℃交联4 h。最后使用磁铁吸附磁性CLEAs,倒掉上清液,冻干备用。
磁性CLEAs的重复利用:待酶解反应结束后,利用磁铁将磁性CLEAs吸附,使其从反应体系中分离,随后使用磷酸缓冲液(pH为7.8)洗涤3次,以用于下一次酶解反应。
1.3.2 TCA-NSI测定
以三氯乙酸氮溶解指数(trichloroacetic acid-nitrogen soluble index,TCA-NSI)为酶解效率的评价指标,参考郑志强[10]报道的TCA方法,测定酶解液中多肽得率,按公式(1)计算:
(1)
式中:m0,15%TCA中可溶性氮质量,mg;m1,原料中总氮质量,mg。
可溶性氮质量的测定参照双缩脲法[11],总氮质量的测定参照GB 5009.5—2016的凯氏定氮法。
1.3.3 氨基酸组成测定和必需氨基酸指数(essential amino acid index, EAAI)的计算
参照国标GB/T 5009.124—2016《食品中氨基酸的测定》测定氨基酸组成。
EAAI计算如公式(2)所示[12]:
(2)
式中:aan,样品中必需氨基酸质量占总蛋白质量的比例;AAn,FAO/WHO参考标准中必需氨基酸质量占总蛋白质量的比例[13]。
1.3.4 酶解液分子质量分布
参照GB/T 22729—2008。
1.3.5 抗氧化活性研究
DPPH自由基清除率的测定参照王爽等[14]报道的方法;·OH的测定方法参照MORALES等[15]的方法;![]() 的测定参考林云等[16]的邻苯三酚自氧化法。
的测定参考林云等[16]的邻苯三酚自氧化法。
1.3.6 酶解工艺优化
1.3.6.1 酶解工艺单因素试验
酶解单因素试验的基本条件为:底物质量浓度100 g/L、温度54.5 ℃、酶解时间1 h、pH 8.2。在此基础上考察以下单因素的酶解效果:底物质量浓度(40、70、100、200、400 g/L)、酶质量浓度(0.5、1、2、3、4、5、6 g/L)、温度(24.5、34.5、44.5、54.5、64.5、74.5 ℃)、pH(5.2、6.2、7.2、8.2、9.2、10.2)、时间(5、15、30、45、60、90、120 min)、碱性蛋白酶和中性蛋白酶质量比例(4∶1、3∶1、2∶1、1∶1、1∶2、1∶3、1∶4)。每个因素梯度设置3次平行试验。
1.3.6.2 酶解工艺响应面试验
利用Design-Expert 8.0.6软件,根据Box-Benhnken中心组合的试验设计原理,将温度、pH、复合酶比例作为试验因素,以TCN-NSI为响应值,设计三因素三水平的分析试验(表1),考察固定化酶法制备鳀鱼蒸煮液蛋白肽的最佳工艺组合条件。
表1 中心组合试验自变量因素和水平
Table 1 Independent variables and their levels usedin the response surface design
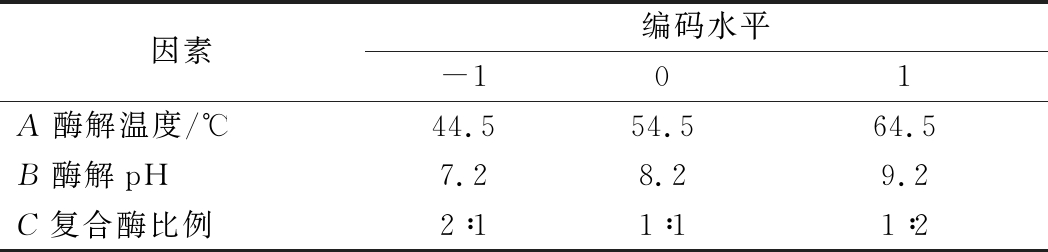
因素编码水平-101A酶解温度/℃44.554.564.5B酶解pH7.28.29.2C复合酶比例2∶11∶11∶2
1.3.7 数据分析
实验结果由平均值±SD 表示。采用IBM SPSS Statistics 24.0 软件分析数据之间的显著性,P<0.05说明数据之间具有显著性差异。
前期研究表明,利用游离态的碱性蛋白酶与中性蛋白酶酶解鳀鱼蒸煮液的效果最佳[17]。基于此,本研究进一步考察固定化碱性蛋白酶和中性蛋白酶对蒸煮液酶解效果的影响。从图1-a可知,当底物质量浓度一定时,酶添加量决定了酶与底物的反应速度[18],随着酶添加量的增加,TCA-NSI逐渐上升,但当酶添加量超过4 g/L时,TCA-NSI随之下降。

图1 不同因素对TCA-NSI的影响
Fig.1 Effect of different factors on TCA-NSI
从图1-b可知,随着温度的上升,TCA-NSI呈先上升后下降趋势,这可能是由于随着温度的上升,酶活力不断提高,水解速率加快,但温度太高可能会造成酶结构破坏。从图1-c可知,当底物质量浓度低于100 g/L时,TCA-NSI随底物质量浓度增加而上升,但当底物质量浓度超过100 g/L时,可能由于总氮增加量远大于多肽增加量[19],导致TCA-NSI下降。从图1-d可知,当酶解时间超过45 min时,水解过程基本可达稳定状态。从图1-e可知,随着pH提高,酶解效果呈先上升后缓慢下降趋势,这主要是由于酶反应需要最适pH,极端pH可能会使得蛋白酶变性,从而影响酶活力[20]。从图1-f可知,随着固定化中性蛋白酶比例的增加,TCA-NSI先上升后下降,当复合酶比例为1∶1时TCA-NSI达最大值。
2.2.1 响应面实验结果分析
利用Design-Expert 8.0.6将TCA-NSI值与各因素进行回归拟合,得到TCA-NSI对温度(A)、酶解pH(B)、复合酶比例(C)的最佳回归方程为:Y=76.38-1.24A-2.23B+0.87C-1.61AB-0.12AC-2.11BC-8.55A2-3.09B2-6.07C2,R2=0.985 6。
通过显著性检验和模型变异数分析,该模型能够较好预测TCA-NSI值(表2)。
表2 回归方程各项系数的显著性检验和变异数分析
Table 2 Significance test and analysis of variancecoefficients of regression equation
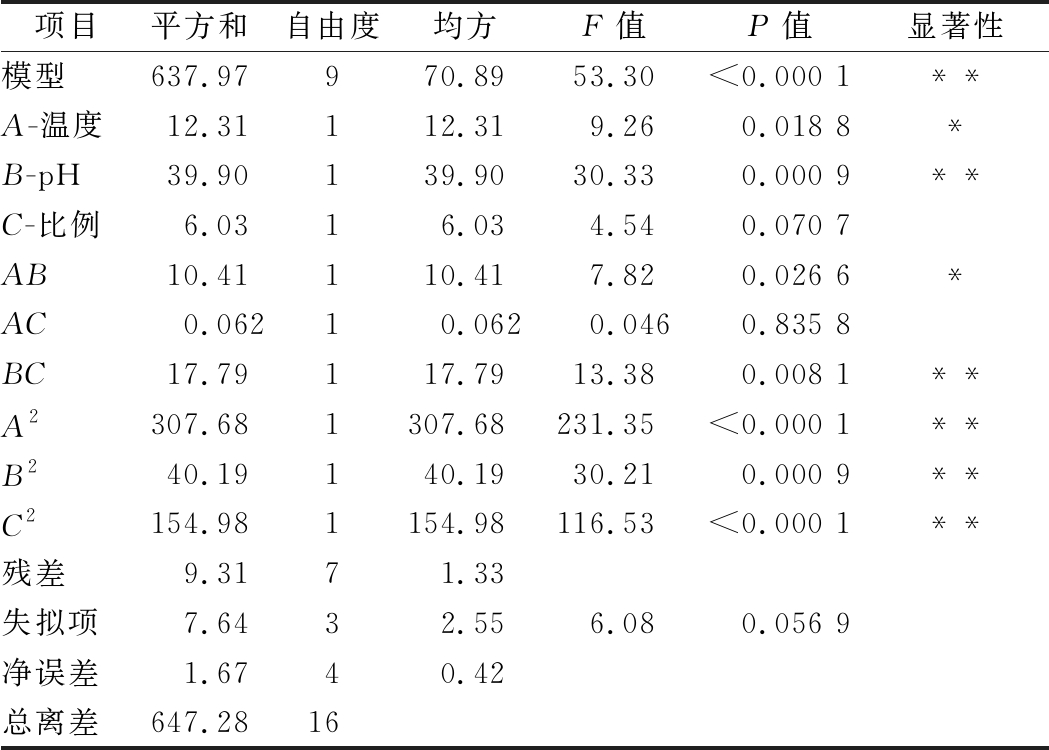
项目平方和自由度均方F值P值显著性模型637.97970.8953.30<0.000 1**A-温度12.31112.319.260.018 8*B-pH39.90139.9030.330.000 9**C-比例6.0316.034.540.070 7AB10.41110.417.820.026 6*AC0.06210.0620.0460.835 8BC17.79117.7913.380.008 1**A2307.681307.68231.35<0.000 1**B240.19140.1930.210.000 9**C2154.981154.98116.53<0.000 1**残差9.3171.33失拟项7.6432.556.080.056 9净误差1.6740.42总离差647.2816
注:*显著性差异,P<0.05;**极显著性差异,P<0.01
等高线形状反应各因素之间的交互是否显著,若等高线呈椭圆形则表明各因素之间交互显著,若呈圆形则表明各因素之间交互不显著[21-22]。由图2可知,这3组因素的交互作用强弱为:BC>AB>AC,这与表2显著性检验结果相一致。各因素对酶解效果的影响顺序为:pH>温度>复合酶比例。

图2 不同因素两两交互对TCA-NSI影响的响应面图
和等高线图
Fig.2 Response surface plots and contour plots of interactive effect of different factors on TCA-NSI
2.2.2 工艺条件确定及验证性实验
由Design-Expert软件得到的优化工艺条件为:温度54.14 ℃、pH 7.80、碱性蛋白酶与中性蛋白酶比例1.36∶1。为验证模型的可信度,以及考虑实际操作的方便性,将验证条件设计为:温度54.10 ℃、pH为7.80、复合酶比例1.5∶1,重复验证3次。结果显示,响应面预测得到的TCA-NSI为76.91%,而验证结果为77.27%,验证结果与预测值相近,表明所得回归模型能够较好预测酶解过程。
由表3可知,在酶解液蛋白肽的氨基酸组成中,人体必需氨基酸组成丰富,EAAI值为0.99。
据报道,EAAI值>0.95、0.86~0.95、0.75~0.86、≤0.75分别表示蛋白品质优、良好、可用、不足[23]。因此,所制备的鳀鱼蒸煮液蛋白肽具有较高的蛋白品质。此外,药效氨基酸(包括谷氨酸[25]、甘氨酸[26]、精氨酸[27])的质量分数为16.68%,高于郭鹏柳等[24]报道的海参内脏酶解产物中药效氨基酸的质量分数。综上可知,该酶解液具有较好的氨基酸组成和蛋白品质。
表3 酶解液蛋白肽氨基酸组成
Table 3 Amino acid composition of enzymatic hydrolysate
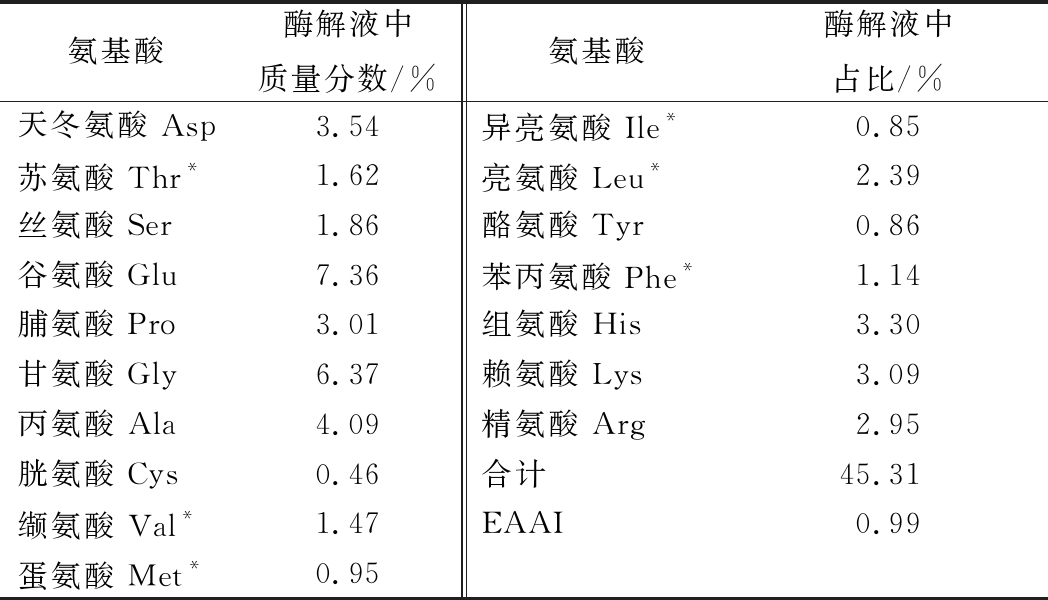
氨基酸酶解液中质量分数/%氨基酸酶解液中占比/%天冬氨酸 Asp3.54异亮氨酸 Ile*0.85苏氨酸 Thr*1.62亮氨酸 Leu*2.39丝氨酸 Ser1.86酪氨酸 Tyr0.86谷氨酸 Glu7.36苯丙氨酸 Phe*1.14脯氨酸 Pro3.01组氨酸 His3.30甘氨酸 Gly6.37赖氨酸 Lys3.09丙氨酸 Ala4.09精氨酸 Arg2.95胱氨酸 Cys0.46合计45.31缬氨酸 Val*1.47EAAI0.99蛋氨酸 Met*0.95
注:*表示必需氨基酸
由表4可知,经固定化酶酶解后酶解液中由10~40个氨基酸组成的中长肽链(相对分子质量在1 500~5 000 Da)占8.163%,由2~10个氨基酸组成的小肽链(相对分子质量在180~1 500 Da)占82.518%,而游离氨基酸占8.723%,该结果与游离中性蛋白酶及碱性蛋白酶的酶解结果相近[27]。因此,固定化酶可将蒸煮液中的大分子质量蛋白质水解成小分子多肽。
表4 蒸煮液及酶解液蛋白肽的分子质量分布
Table 4 Molecular weight distribution of enzymatichydrolysate and anchovy cooking liquid
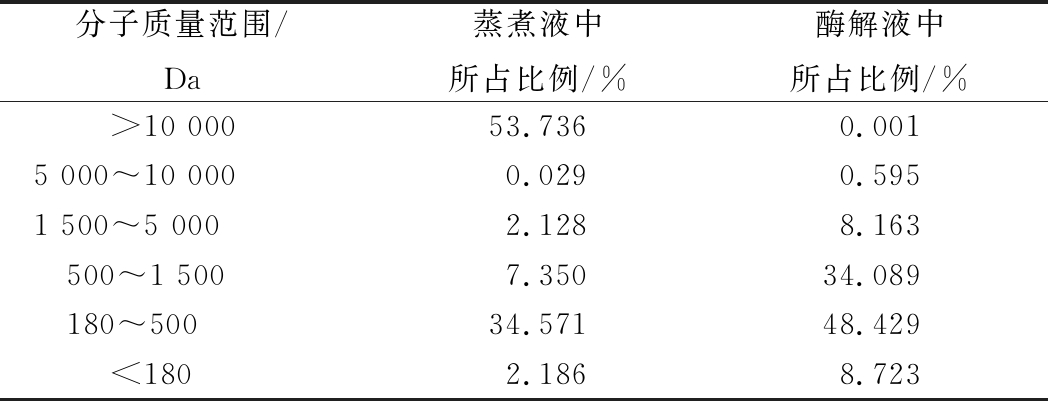
分子质量范围/Da蒸煮液中所占比例/%酶解液中所占比例/%>10 00053.7360.0015 000~10 0000.0290.5951 500~5 0002.1288.163500~1 5007.35034.089180~50034.57148.429<1802.1868.723
从图3可知,酶解液对DPPH自由基、·OH和![]() 的清除率呈现出一定的剂量依赖效应,其半抑制浓度(IC50)分别为1.35、1.14和2.77 g/L。相关研究表明,当IC50低于10 g/L时,则可说明其具有良好的抗氧化性[28]。说明所获得的酶解液蛋白肽具有较强的抗氧化性,且与游离酶酶解获得的水解液抗氧化性相近[17]。
的清除率呈现出一定的剂量依赖效应,其半抑制浓度(IC50)分别为1.35、1.14和2.77 g/L。相关研究表明,当IC50低于10 g/L时,则可说明其具有良好的抗氧化性[28]。说明所获得的酶解液蛋白肽具有较强的抗氧化性,且与游离酶酶解获得的水解液抗氧化性相近[17]。
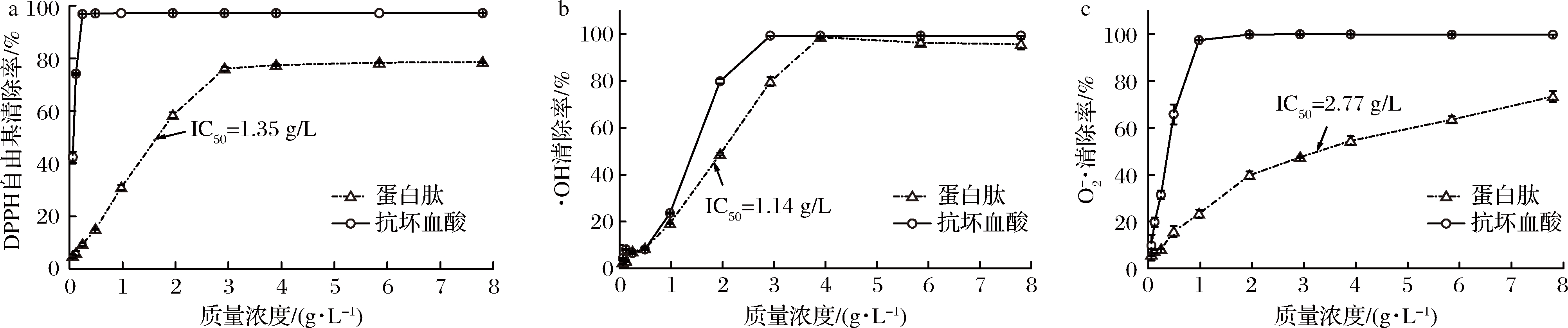
图3 不同质量浓度的蛋白肽和抗坏血酸对自由基清除率的影响
Fig.3 Effects of different concentrations of hydrolyzed peptides and ascorbic acid on free radical scavenging rate
磁性CLEAs通过外部磁场可与反应介质相分离,从而实现重复利用。由图4可知,固定化酶重复利用2次时TCN-NSI值未显著降低。当重复利用次数从2次增加至5次,TCA-NSI值从70.98%降低至35.09%,在重复利用5次时TCA-NSI值仍可保持首次使用时的48%。该结果表明,所制备的固定化酶具有较好的重复利用性。

图4 重复利用固定化酶对TCA-NSI的影响
Fig.4 Effect of reusing immobilized enzyme on TCA-NSI
本研究利用磁性酶交联聚集体技术制备固定化中性蛋白酶和碱性蛋白酶,优化了鳀鱼蒸煮液的固定化酶解条件,并对酶解产物进行性能表征。结果表明,在最佳酶解工艺条件下鳀鱼蒸煮液的多肽得率可达77.27%。酶解产物的EAAI值大于0.95,药效氨基酸及小分子多肽的质量分数较高,且具有较强的抗氧化性,可用于开发活性肽产品。此外,所制备的固定化酶可实现重复利用,在重复利用5次后仍具有较高的多肽得率,因此有利于降低生产成本。本研究结果可为实现低值鱼蒸煮液的高值化利用提供理论参考和实验依据。
[1] 张建友, 林龙, 王斌, 等. 鳀鱼蒸煮液膜浓缩工艺研究及风味物质分析[J]. 食品与发酵工业, 2013, 39(5): 72-77.
[2] 蒋定文. 鳀鱼的营养分析与评价[J]. 中国海洋药物杂质, 2010, 29(4): 50-55.
[3] WASSWA J, TANG J, GU X H, et al. Influence of the extent of enzymatic hydrolysis on the functional properties of protein hydrolysate from grass carp (Ctenopharyngodon idella) skin[J]. Food Chemistry, 2007, 104(4): 1 698-1 704.
[4] ALEM N A, GIMÉNEZ B, MONTERO P, et al. Antioxidant activity of several marine skin gelatins[J]. LWT-Food Science and Technology, 2011, 44(2): 407-413.
N A, GIMÉNEZ B, MONTERO P, et al. Antioxidant activity of several marine skin gelatins[J]. LWT-Food Science and Technology, 2011, 44(2): 407-413.
[5] SAMPATH KUMAR N S, NAZEER R A, JAIGANESH R. Purification and identification of antioxidant peptides from the skin protein hydrolysate of two marine fishes, horse mackerel (Magalaspis cordyla) and croaker (Otolithes ruber)[J]. Amino Acids, 2012, 42(5): 1 641-1 649.
[6] PANWAR D, KAIRA G S, KAPOOR M. Cross-linked enzyme aggregates (CLEAs) and magnetic nanocomposite grafted CLEAs of GH26 endo-β-1,4-mannanase: Improved activity, stability and reusability[J]. International Journal of Biological Macromolecules, 2017, 105(1): 1 289-1 299.
[7] TALEKAR S, GHODAKE V, GHOTAGE T, et al. Novel magnetic cross-linked enzyme aggregates (magnetic CLEAs) of alpha amylase[J]. Bioresource Technology, 2012, 123: 542-547.
[8] AKHOND M, PASHANGEH K, KARBALAEI-HEIDARI H R, et al. Efficient immobilization of porcine pancreatic alpha-amylase on amino-functionalized magnetite nanoparticles: Characterization and stability evaluation of the immobilized enzyme[J]. Applied Biochemistry and Biotechnology, 2016, 180(5): 954-968.
[9] BEDADE D K, MULEY A B, SINGHAL R S. Magnetic cross-linked enzyme aggregates of acrylamidase from Cupriavidus oxalaticus ICTDB921 for biodegradation of acrylamide from industrial waste water[J]. Bioresource Technology, 2019, 272: 137-145.
[10] 郑志强. 不同蛋白酶对小麦蛋白酶解物抗氧化活性的影响[J]. 食品科学, 2017, 38(7): 161-166.
[11] 潘风光, 侯力箫, 王莹, 等. 双酶水解鸡副产物制备蛋白胨工艺的优化[J]. 中国食品学报, 2019, 19(8): 1-9.
[12] SUI Y X, MUYS M, VAN DE WAAL D B, et al. Enhancement of co-production of nutritional protein and carotenoids in Dunaliella salina using a two-phase cultivation assisted by nitrogen level and light intensity[J]. Bioresource Technology, 2019, 287: 121 398.
[13] WHO/FAO/UNU Expert Consultation. Protein and amino acid requirements in human nutrition introduction[M]. Geneva: World Health Organization Press, 2007.
[14] 王爽, 张高帆, 陈欣悦. 小球藻蛋白的制备及其水解肽的抗氧化研究[J]. 中国食品学报, 2017, 17(2): 92-100.
[15] MORALES F J, JIMENEZ P S. Maillard reaction products as related to colour and fluorescence[J]. Food Chemistry, 2001, 72: 119-125.
[16] 林云,林娟,许鑫琦. 鲭鱼罐头蒸煮液蛋白酶解产物的生物活性分析[J]. 福州大学学报(自然科学版), 2018, 46(4): 580-585.
[17] 林煌华, 谢友坪, 马瑞娟, 等. 复合酶制备鳀鱼蒸煮液水解肽及其抗氧化活性研究[J/OL]. 食品工业科技: 1-12 [2020-03-25]. http://kns.cnki.net/kcms/detail/11.1759.ts.20191119.0938.008.html.
[18] 王秋萍, 余新威, 童晓倩, 等. 固定化酶水解鱿鱼碎肉制备高F值寡肽的工艺优化[J]. 中国食品学报, 2017, 17(3): 113-119.
[19] 周燕芳, 郑荣彬. 酶解鳙鱼蛋白制备活性肽的研究[J]. 湖北农业科学, 2017, 56(1): 115-118.
[20] 李露园, 王升帆, 朱有贵. 酶法制备鲟鱼皮胶原蛋白多肽及其抗氧化活性研究[J]. 食品与发酵工业, 2019, 45(20): 138-143.
[21] 白婵, 饶丹华, 熊光权. 响应面法优化鲟鱼精蛋白肽的酶解提取[J]. 食品与发酵工业, 2018, 44(4): 180-185.
[22] 涂宗财, 唐平平, 郑婷婷. 响应面优化鱼鳔胶原肽制备工艺及其抗氧化活性研究[J]. 食品与发酵工业, 2017, 43(5): 160-166.
[23] KENT M, WELLADSEN H M, MANGOTT A, et al. Nutritional evaluation of Australian microalgae as potential human health supplements[J]. PloS One, 2015, 10(2): e0118985.
[24] 郭鹏柳, 李丽, 牟海津. 海参内脏酶解粉主要成分的分析[J]. 食品工业, 2018, 39(8): 309-312.
[25] 胡亚卓, 吕佩源. 谷氨酸受体在学习、记忆中的作用及其与血管性痴呆的关系[J]. 国际脑血管病杂志, 2006(8): 623-626.
[26] 唐俊春, 潘梦鲜, 刘瑞, 等. 甘氨酸通过抑制大鼠创伤性脑损伤后炎症反应来发挥神经保护作用[J]. 卒中与神经疾病, 2018, 25(4): 431-434.
[27] 陈德慰, 苏键, 刘小玲, 等. 广西北部湾3种贝类中主要呈味物质的测定及呈味作用评价[J]. 食品科学, 2012, 33(10): 165-168.
[28] 郑义, 邵颖, 陈安徽, 等. 益智仁总黄酮超声辅助提取工艺优化及其抗氧化活性[J]. 食品科学, 2014, 35(6): 44-49.