茶多酚(tea polyphenol,TP)具有多种生物和药理作用,如抗动脉粥样硬化、化学致癌物、抗肥胖、抗菌活性等[1]。此外,抗茶中的多酚成分可以预防炎症[2]。但是茶多酚在空气中容易被氧化,故长期作用受到限制。
微胶囊封装技术是一种将生物活性物质,如生物活性化合物、蛋白质、酶和细胞等嵌入到被膜的过程,从而隔离和保护它们免受物理和化学应力的影响[3],并使核心材料有针对性和可控的释放。海藻酸钠(sodium alginate, ALG)是从海洋褐藻中提取的一种线性阴离子多糖,是制备微胶囊最常用的天然高分子材料之一[4]。由于其形成凝胶的能力和良好的生物相容性,被广泛应用于食品和医药工业[5-6]。
肿瘤血管内栓塞疗法是用含有药物的微胶囊栓塞剂注入肿瘤组织的微动脉,通过微胶囊栓塞剂阻塞肿瘤细胞增殖需要的养分以及氧气,抑制肿瘤生长。同时,通过磁性微胶囊的药物靶向缓释技术,向癌靶区释放抗癌药物、杀伤癌细胞,毒副作用小,治疗效果显著,是一种治疗癌症的新方法[7]。目前,常用的抗癌药物(比如氟尿嘧啶)在治疗癌细胞的同时,对正常的组织产生伤害[8],因此茶多酚这类具有良好地抗癌功能的无毒或低毒药物具有良好的抗癌前景。
本研究的主要目的是评价高压静电法对海藻酸钠茶多酚磁性微胶囊(tea polyphenol magnetic microcapule, TPM)包覆率的影响。用透射电镜和激光粒度分析仪分析了TPM的形貌和粒度分布。采用差示扫描量热法(differential scanning calorimetry, DSC)和热重分析(thermo gravimetric analysis, TGA)对其理化性质、体外释放及抗氧化性能进行了分析。重要的是,TPM具有超顺磁性,使磁性微胶囊在磁场作用下产生良好的磁响应性,并且当磁场被移除时,不会出现微胶囊聚集的现象。此外,还研究了Box-Behnben响应曲面法(Box-Behnben design response surface method, BBD-RSM)法制备磁性微胶囊的最佳工艺条件。根据对包覆率的响应,利用BBD-RSM建立模型,为TPM的制备提供优化预测。
茶多酚(纯度≥98%,EGCG≥75%,儿茶素≥92%),安徽红星药业有限公司。ALG、CaCl2、壳聚糖,中国医药集团上海化学试剂公司;磁流体,西安瑞禧生物科技有限公司。其他所有化学品均为分析纯,购自上海阿拉丁生化科技有限公司。
高压静电微胶囊装置,上海理工大学,上海,中国;激光粒度分析仪,Mastersizer, Malvern, 英国;差示扫描量热仪,Netzsch DSC 3500 Sirius,德国;热重分析仪,Netzsch TG 209 F1 Libra,德国;透析管,北京瑞达恒辉科技发展有限公司,中国;振动样品磁强计,VSM,MicroSense,美国。
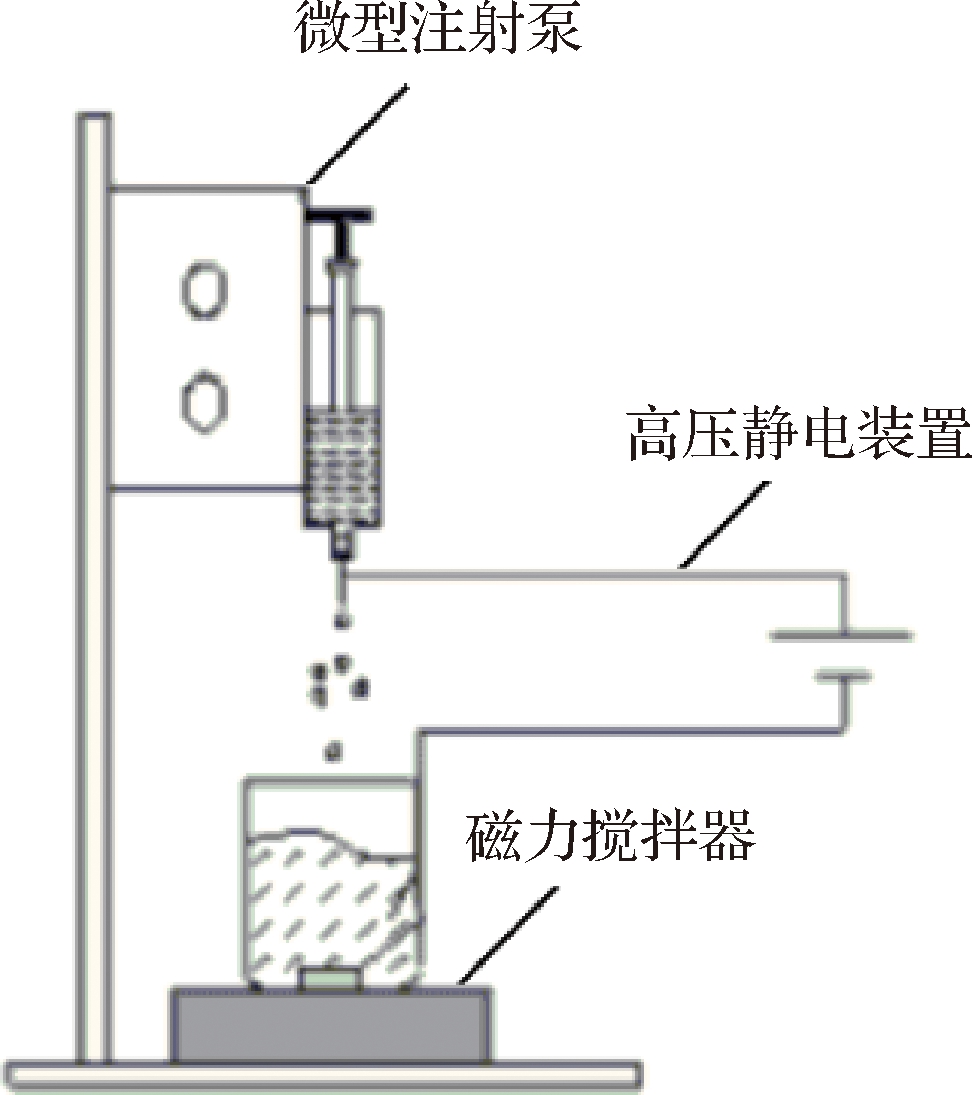
分别在蒸馏水中溶解制备TP、ALG、CaCl2溶液,质量浓度分别为1、10、30 g/L。然后,将TP溶液和CaCl2溶液混合[9-10]。如图1所示,将该混合溶液吸入微型注射泵内,采用高压静电微胶囊装置,正极连接注射泵,负极连接ALG溶液。通过静电吸附作用,将该混合溶液喷入磁力搅拌的ALG溶液中形成微胶囊。待交联反应后静置0.5 h后,用20 g/L的CaCl2溶液冲洗微胶囊并做固化,过滤清洗干燥,得到海藻酸钠茶多酚微胶囊[11]。

图1 高压静电微胶囊装置
Fig.1 High-voltage electrostatic apparatus for microcapsule preparation
磁性微胶囊由药物、骨架以及磁流体构成。磁流体通过化学合成法制造:将FeCl3、FeSO4以及过量的NaOH在恒温条件下,通过匀速搅拌形成超微氧化铁粒子[12]。骨架材料选择壳聚糖,因为壳聚糖具有生物相容性和生物可降解性。
将海藻酸钠茶多酚微胶囊加入壳聚糖溶液中,并加入等质量的磁流体,通过超声乳化20 min,并加入戊二醛进行固化静置1 h。将微球清洗、干燥,得到TPM。
1.4.1 透射电镜(transmission electron microscope, TEM)分析
采用透射电子显微镜对茶多酚磁性微胶囊进行了观察,在高真空模式下,工作加速电压为200 kV。
1.4.2 TPM粒径测定
肿瘤动脉栓塞要求微胶囊的粒径在400 μm范围内[13],通过用激光粒度分析仪对TPM的粒径进行分析。衍射和散射的光能角度的分布与被测样品的颗粒的粒度有关,通过特定角光能量的分析,可以得到样品的粒径分布。
1.4.3 DSC分析
选用差示扫描量热仪,对茶多酚和TPM进行差示扫描热分析,通过对差示扫描曲线的分析,来判断茶多酚和TPM性质的变化。称取2种样品各5 mg,扫描温度45~75 ℃。
1.4.4 热重分析
采用热重分析仪对茶多酚和TPM进行了热重测试。将对茶多酚和TPM从10 ℃加热至800 ℃。
1.4.5 抗氧化分析
DPPH是一种稳定的有机自由基,最大吸收峰在517 nm。当抗氧化剂存在时,DPPH溶液的颜色变浅,吸光度降低。将茶多酚和TPM溶液稀释成不同体积分数梯度,将2 mL DPPH溶液加入不同浓度2 mL样品溶液中,静置30 min后在517 nm处测吸光度。根据吸光度的变化,测定其抗氧化活性[14-15]。TPM对于DPPH自由基清除率为:
DPPH自由基清除率![]()
(1)
式中:AS,DPPH甲醇溶液在517 nm处的吸光度,L/(g·cm); ADPPH,DPPH测定液在517 nm处的吸光度,L/(g·cm)。
试验进行3次,取平均值。将TPM溶液稀释成不同的体积分数梯度,取2 mL DPPH溶液加入2 mL不同浓度的样品溶液,静置30 min,在517 nm处测定其吸光值。
1.4.6 体外缓释分析
根据中国药典对茶多酚的溶出度进行了测定。2.0 mg茶多酚和TPM置于透析管内,磷酸缓冲盐溶液(phosphate buffer saline, PBS)悬液(pH 6.8)。透析管置于(37±0.5)℃、100 r/min下容量为100 mL的释放介质的玻璃中。取不同时间间隔的释放液,加入等量的新鲜PBS。采用分光光度计测定茶多酚的释放速率[16]。
1.4.7 TPM包覆率定量分析
TPM溶于水中,快速离心6 000 r/min,离心15 min。取上清液,在544 nm处测定吸光度。然后根据TP的标准曲线计算出浓度值,计算出TPM的含量。TPM的包覆率(EE)为:
(2)
式中:EE,TPM的包覆率,%;ρm,上清液中TP的含量,mg/mL;ρ0,总溶液中TP的含量,mg/mL。
1.4.8 磁性能测试
采用振动样品磁强计测量纳米Fe3O4颗粒和TPM基本磁化曲线。
以ALG质量浓度(A)、电压 (B)、推进速度(C)为自变量,以包覆率(Y)为因变量,因素及水平见表1。
表1 自变量水平
Table 1 Levels of independent variables
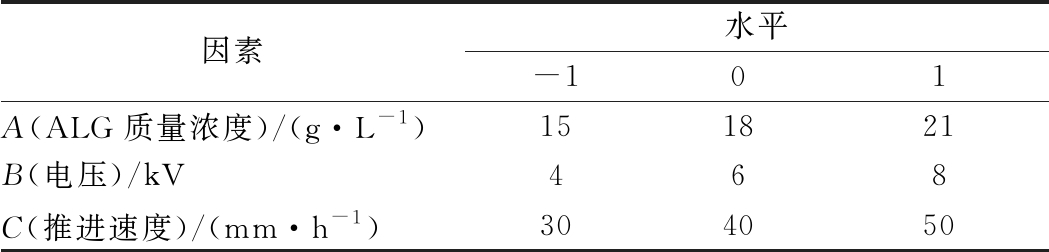
因素水平-101A(ALG质量浓度)/(g·L-1)151821B(电压)/kV468C(推进速度)/(mm·h-1)304050
2.1.1 TEM分析
由图2可知,制备出的TPM的分散均匀,粒径分布比较均匀,外观基本上都成球形[17]。直径<400 μm,粒径在400 μm范围以内,符合栓塞要求。

图2 海藻酸钠茶多酚磁性微胶囊投射电镜分析
Fig.2 Transmission electron microscope of TPM
2.1.2 TPM粒径分析
激光粒度仪是通过颗粒的衍射光或散射光的空间分布(散射谱)来分析颗粒大小的仪器。TPM粒径分布如图3所示。茶多酚海藻酸钠磁性微胶囊的平均直径是217.67 μm,符合栓塞要求,并且呈现出均匀的粒度分布[18]。
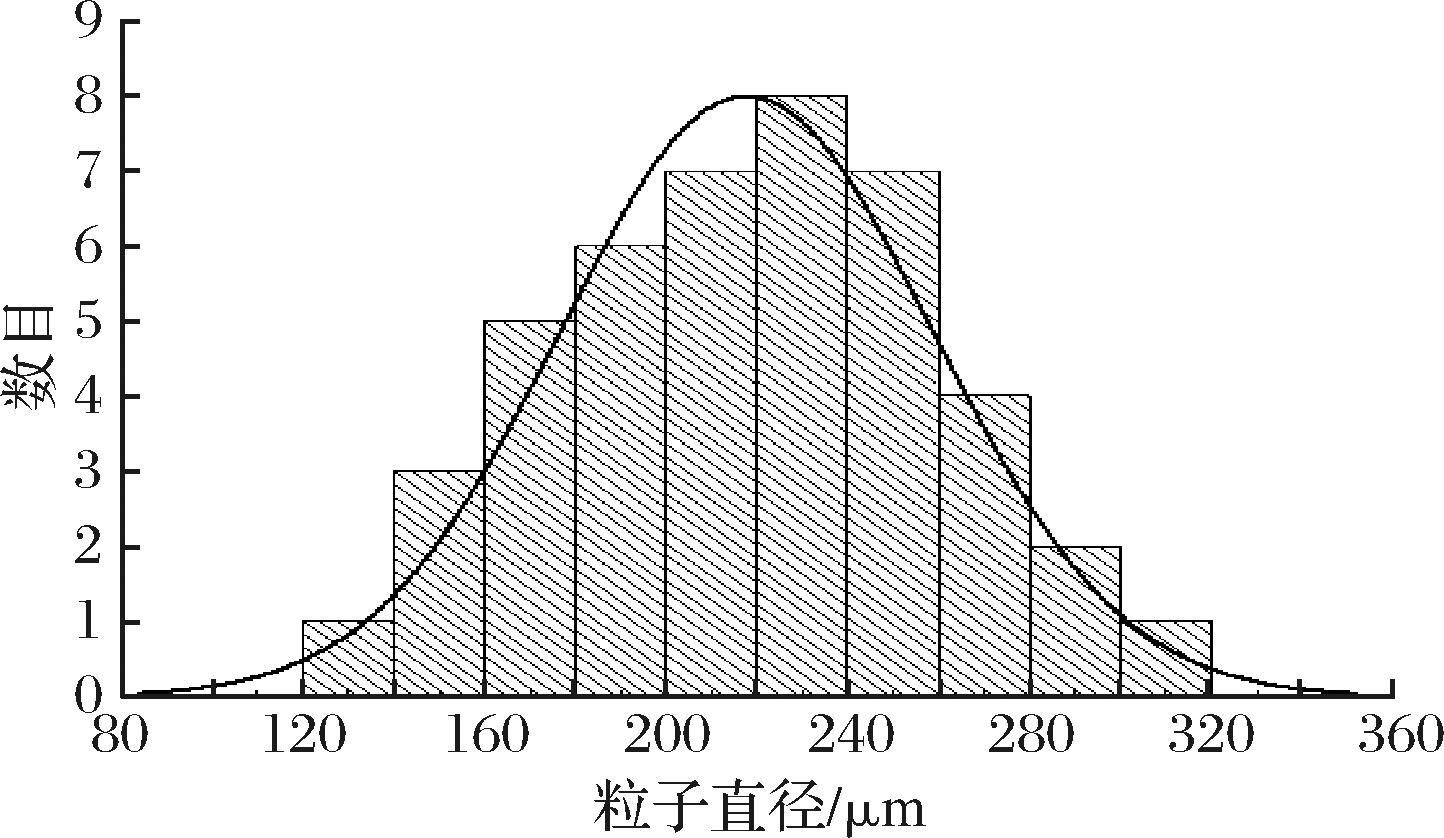
图3 茶多酚海藻酸钠磁性微胶囊粒径分布
Fig.3 Paitical size distribution of TPM
2.1.3 DSC分析
DSC是在受控温度下测量样品和参考物的功率差与温度差之间的关系。DSC分析是通过测量样品吸收或释放热量的变化来进行的。在扫描量热曲线上,Onset温度为基准线与热流变化率最大的点切线交点对应的温度。根据国际热分析和量热学协会,Onset温度代表熔点,通过对试样熔点的分析,可以判断TPM的性能与TP相比是否发生了变化[19]。
由图4可知,TP和TPM的相变峰相似。相变峰较宽,是由于样品的导热率比较小,因此在相变过程中,热传递较慢,样品的相变面推移也就较慢,这表现在DSC曲线上面,相变峰就较为平缓,相变峰的峰宽就比较大[20]。TP和TPM的Onset温度分别为55.30和55.11 ℃,表明熔点没有发生变化。也就是说,在制备TPM的过程中,茶多酚的性质没有发生变化。此外,由于微胶囊制备过程中添加了壁材,图4-b的Onset值略小于图4-a。
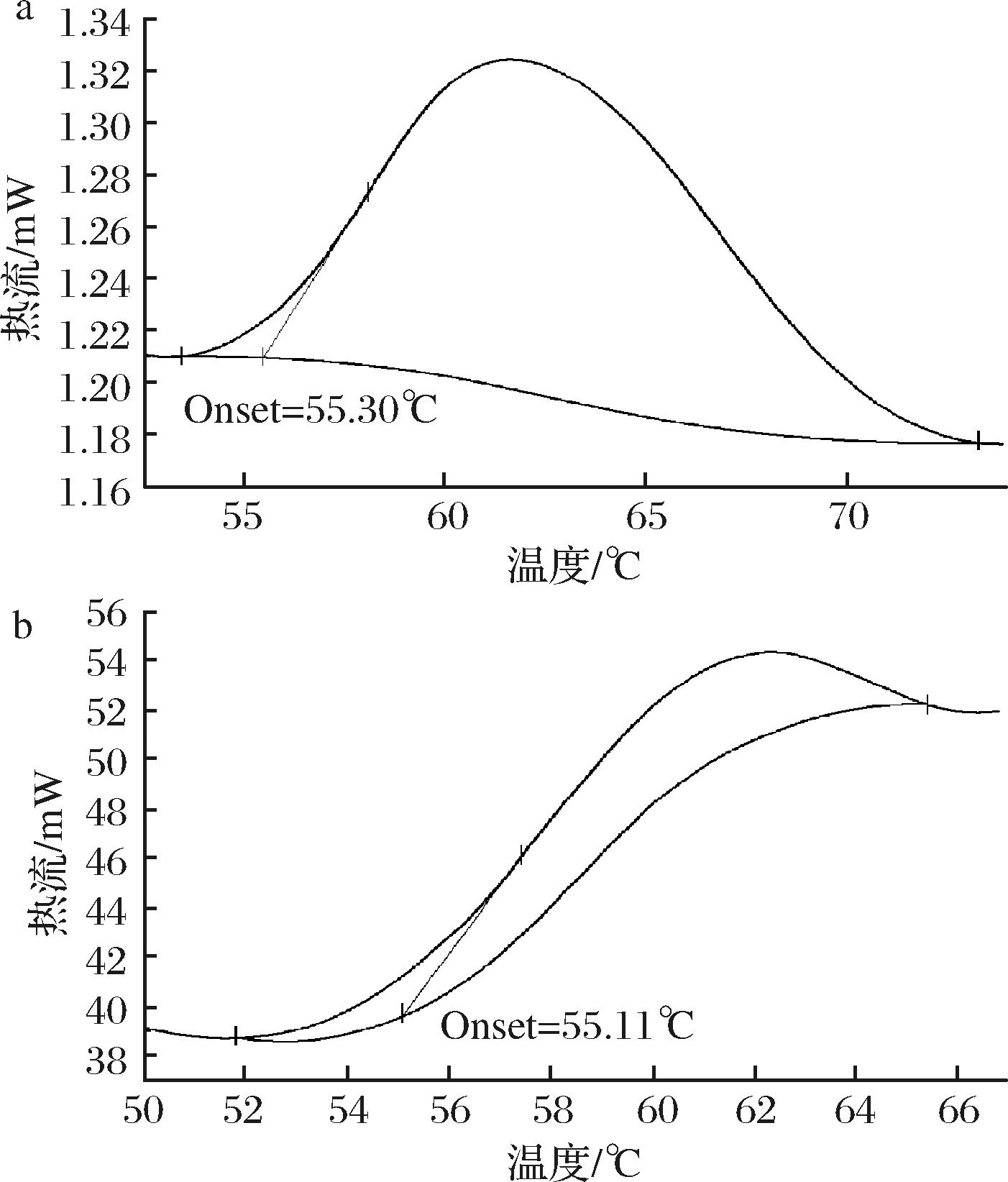
a- 茶多酚;b-海藻酸钠茶多酚磁性微胶囊
图4 茶多酚和海藻酸钠茶多酚磁性微胶囊DSC图
Fig.4 DSC of TP and TPM
2.1.4 TGA分析
TGA是通过测量受控温度下样品的质量与温度变化之间的关系来研究材料的热稳定性和组成。通过TGA研究了TPM与TP的热稳定性。
图5为TP和TPM的TGA。该TGA曲线可分为3个主要区域:第1个区域(50~150 ℃)主要与水分蒸发有关;第2个区域(200~400 ℃)由于多糖的热解分解,损失较大;第3阶段(400~700 ℃)为碳化阶段,残渣被缓慢地热解直到碳化,质量几乎没有变化[21]。由于聚合物基体之间的强交联作用导致微观结构稳定致密,将TP紧密包覆在TPM壳中,从而提高了TPM的热稳定性[22]。
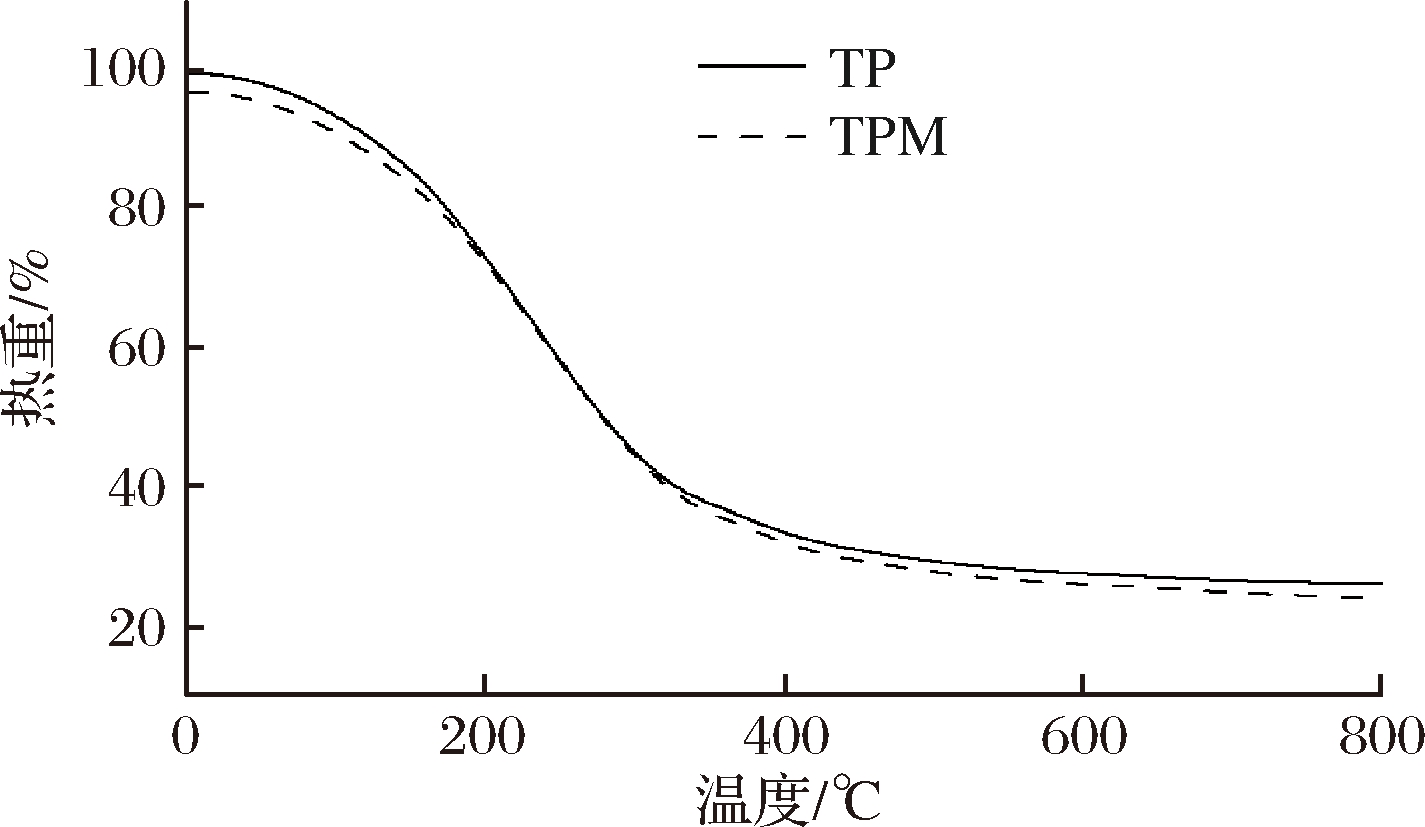
图5 茶多酚和海藻酸钠茶多酚磁性微胶囊热重图
Fig.5 TGA analysis of TP and TPM
2.1.5 抗氧化分析
TP和TPM的DPPH清除率如图6所示。由图6可知,TP对DPPH的清除率随体积分数的增加而逐渐增加,但当体积分数达到50%时,清除率的增加趋于平缓。同时,TPM对DPPH的清除率随体积分数的增加而逐渐增加,但当体积分数达到40%时,清除率的增加趋于平缓。在相同体积分数下,TPM对DPPH自由基的清除率接近于TP,这表明TPM具有良好的抗氧化性能。
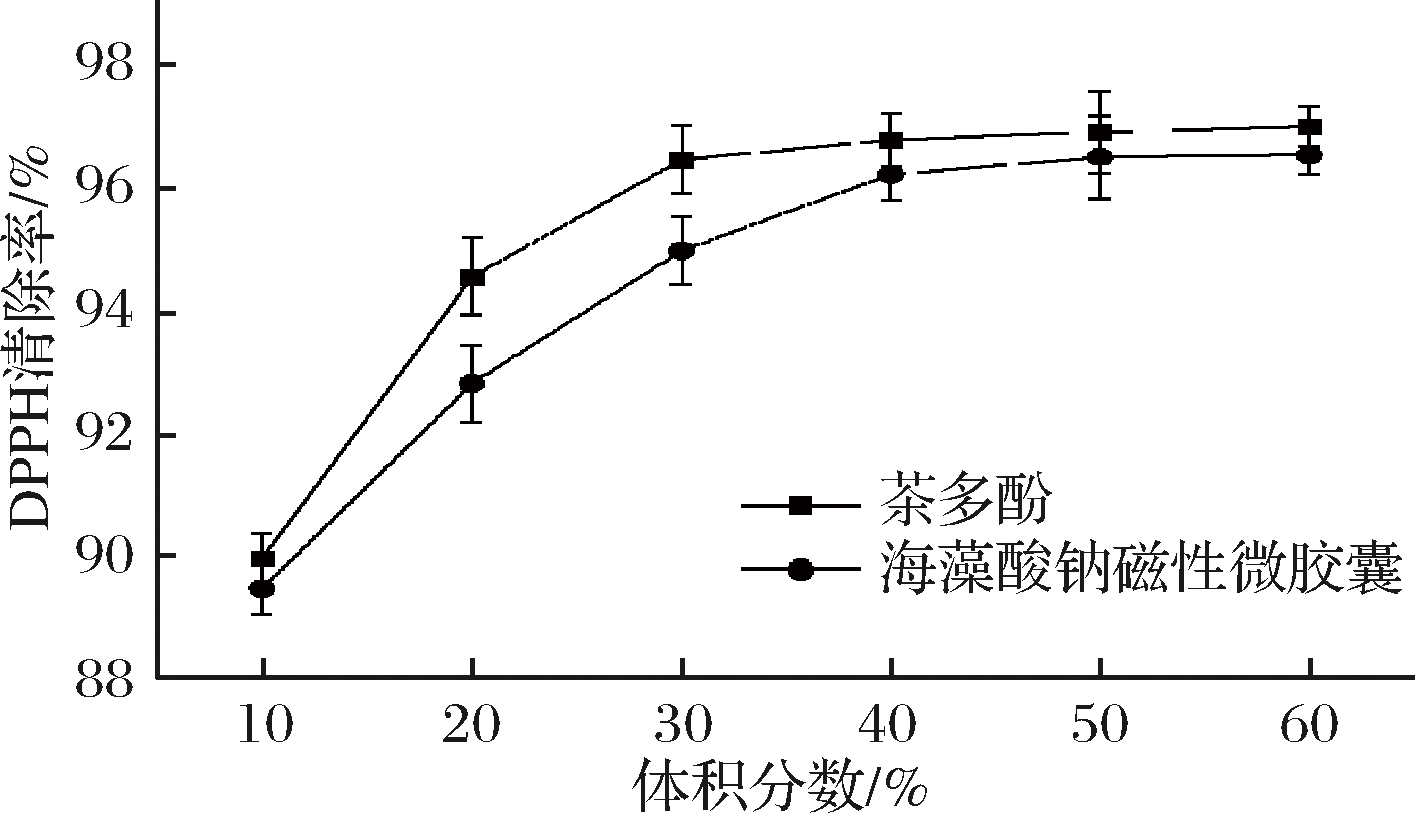
图6 茶多酚和海藻酸钠茶多酚磁性微胶囊DPPH清除率
Fig.6 DPPH radical-scavenging activities of TP and TPM
2.1.6 体外缓释分析
TP和TPM释放曲线如图7所示,TP呈现了快速释放,而TPM是持续的缓慢释放。在TPM中,20.6%的茶多酚在2 h被释放,8 h的释放率为47.3%,12 h的释放率为80.8%,2 h以后有79.4%的茶多酚缓慢释放,持续20 h以上。结果表明,TPM具有良好的控释释药前景。

图7 茶多酚和茶多酚海藻酸钠磁性微胶囊释放曲线
Fig.7 Release profile of TP and TPM
2.1.7 磁响应性表征
磁滞回线是表示强磁性物质磁滞现象的闭合磁化曲线。图8为纳米Fe3O4颗粒和TPM的磁滞回线,纳米Fe3O4颗粒和TPM的饱和磁化强度分别为62.7和27. 1 emu/g,从磁滞回线中可以看出,TPM的矫顽力基本上为0,表明TPM具有超顺磁性,足够使磁性微胶囊在磁场作用下产生良好的磁响应性[23]。这意味着这些磁性微胶囊可以被磁场吸引,当磁场被移除时,它们不会保留剩磁。这一特征使得磁性微胶囊在磁场去除后不会出现微胶囊聚集的现象,具有良好的磁响应性。
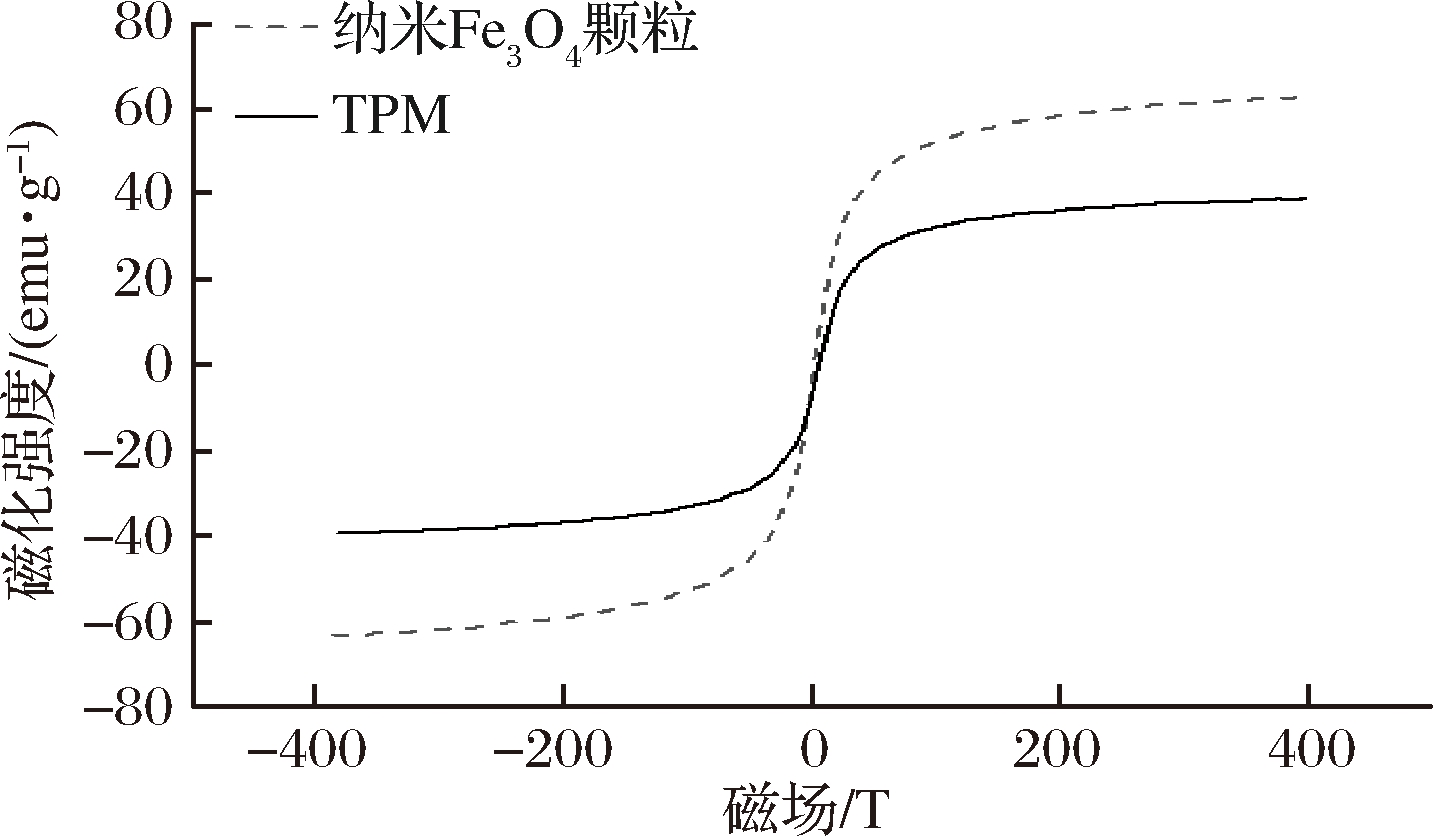
图8 纳米Fe3O4颗粒和TPM磁滞回线
Fig.8 Hysteresis loop of nanosized Fe3O4 particle and TPM
2.2.1 因变量与自变量关系的统计分析
采用响应面法对ALG质量浓度(A)、电压(B)、推进速度(C)3个自变量的浓度进行优化,使因变量包覆率(Y)达到最大。17项试验结果见表2。
根据数据拟合二次多项式,得到封装的多项式表达式如下:
Y=83.66+4.49A+9.03B-7.08C-1.54AB+2.48AC×3.34BC-9.55A2-8.44B2-9.59C2
(3)
式中:Y,包覆率,%; A,ALG质量浓度,g/L; B,电压,kV; C,推进速度,mm/h。
表2 BBD-RSM的设计与结果
Table 2 Design and results of BBD-RSM experiment

运行顺序因素响应A(ALG质量浓度)/(g·L-1)B(电压)/kVC(推进速度)/(mm·h-1)Y(包覆率)/%10.00-1.00-1.0063.3520.001.001.0061.2531.000.001.0064.7841.001.000.0080.2850.000.000.0084.426-1.000.00-1.0069.2371.00-1.000.0061.218-1.001.000.0073.2390.00-1.001.0053.98100.000.000.0086.32110.000.000.0082.0312-1.000.001.0052.01130.000.000.0083.51141.000.00-1.0072.0915-1.00-1.000.0047.99160.000.000.0082.03170.001.00-1.0083.98
采用ANOVA方法对二次多项式的拟合进行了评价。结果如表3所示。P<0.000 1,说明实验具有统计学意义。Lack of Fit的P为0.091 1(P>0.05),说明Lack of Fit不显著,说明该模型满足评价要求。Model的P<0.05表示模型具有显著性。
表3 二次响应面统计分析
Table 3 Statistics analysis of the quadratic response surface

方差源平方和df均方和F值P值显著性模型2 488.239276.4734.25<0.000 1显著A161.101161.1019.960.002 9B651.791651.7980.75<0.000 1C400.871400.8749.660.000 2AB9.5219.521.180.313 5AC24.55124.553.040.124 7BC44.62144.625.530.051 0A2383.891383.8947.560.000 2B2299.651299.6537.120.000 5C2386.911386.9147.930.000 2残差56.5078.07失拟43.52314.514.470.0911不显著纯误差12.9943.25总值2 544.7316Std.Dev.2.84R-Squared0.977 8Mean70.69Adj R-Squared0.949 2C.V/%4.02Pred R-Square0.718 4PRESS716.54Adeq Precision15.879
从表3可以看出,线性模型(A、B、C)、二次模型(A2、B2、C2)对拟合有重要意义。Pred R-Squared(0.977 8)和the Adj R-Squared(0.949 2) 的差值小于0.2表示拟合具有合理的一致性。利用 Adeq Precision评估信噪比,要求信噪比>4[24]。Adeq Precision(15.879)表明模型具有足够的信号。
预测和实际校验图(图9)表明点在对角线附近,说明模型拟合良好,实际值与预测值的关系一致。
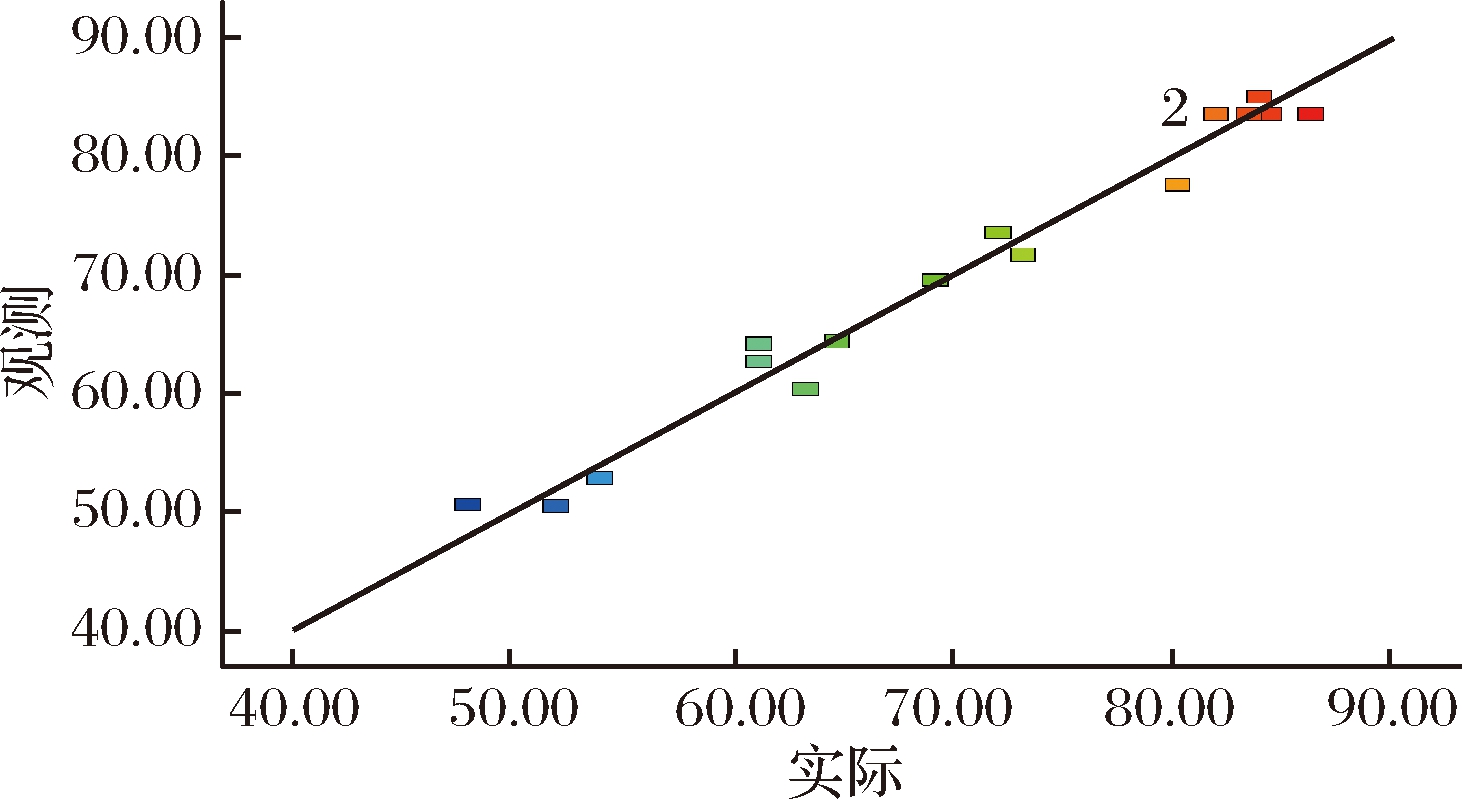
图9 预测和实际校验图
Fig.9 Predicted vs actual parity plot
2.2.2 响应面优化结果
根据统计结果,对工艺参数进行优化,得到TPM的最大包覆率。最佳配方为:ALG质量浓度18.36 g/L, 电压6.222 kV,推进速度80 mm/h。在此条件下,TPM的包覆率为87.836 2%。根据EE的数学模型,在EE>80%的范围内优化制备配方,得到43组计算参数。
2.3.1 优化后磁性微胶囊的抗氧化性分析
如图10所示,通过比较优化前后的磁性微胶囊,优化后的磁性微胶囊在不同体积分数的DPPH清除率均高于同体积分数的优化前的磁性微胶囊更接近茶多酚的DPPH清除率。而且,当体积分数达到30%时,优化后的磁性微胶囊的清除率已经接近平缓,这说明优化后的磁性微胶囊具有更好的抗氧化性。
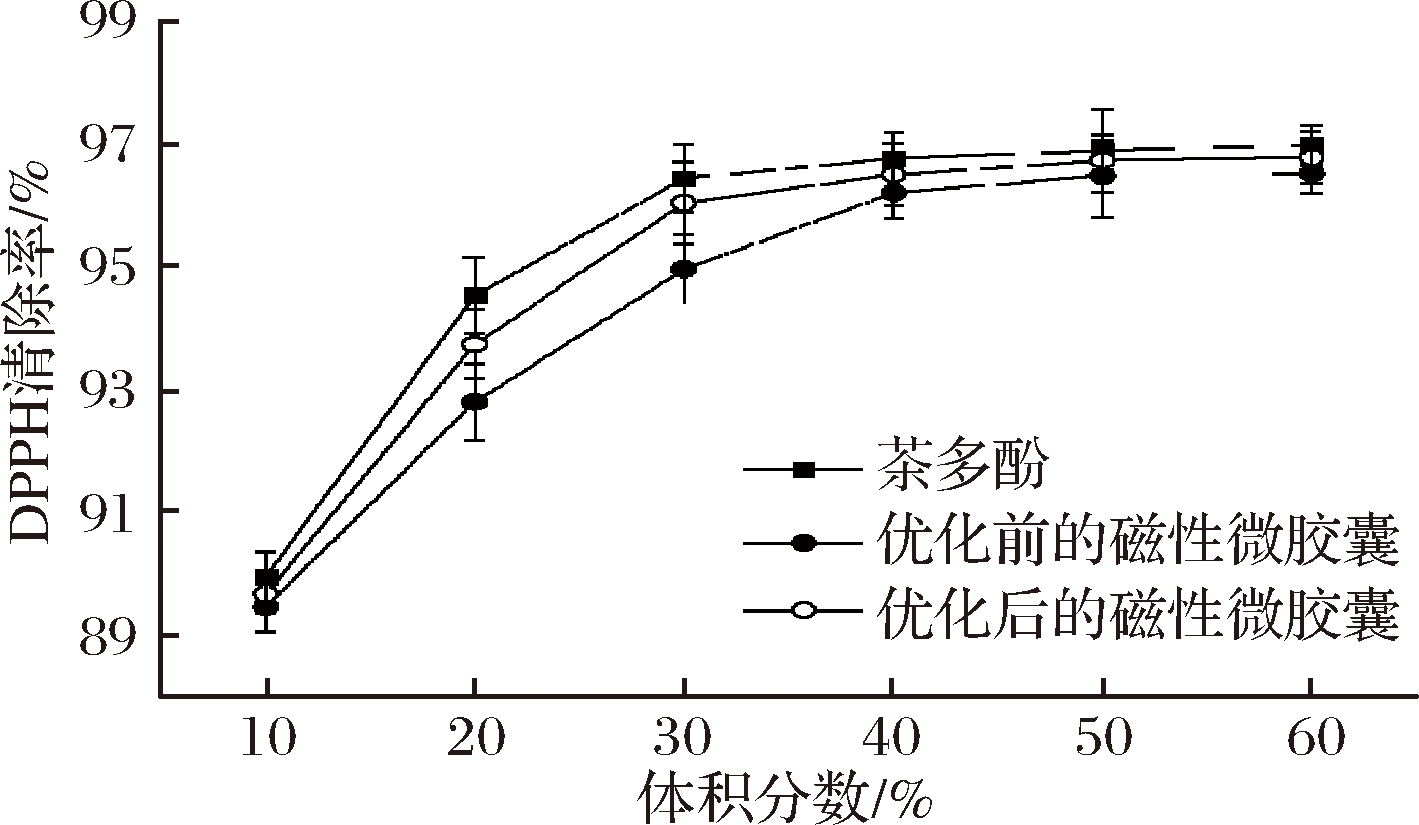
图10 优化前后的磁性微胶囊和茶多酚的DPPH清除率
Fig.10 DPPH radical-scavenging activities of optimized and non-optimaized TPM and TP
将优化前后的磁性微胶囊DPPH自由基清除率通过SPSS 25.0进行方差分析,得到表4。通过表4的分析可以看出,Levene方差等同性检验显著性为0.805>0.05,说明方差是齐的[27]。在t检验中,t<0.3为相关,0.4~0.7为中等相关,0.7以上为高相关。表4中t为0.402,在0.4~0.7之间,说明优化前后的磁性微胶囊的清除率为中等相关,且为正相关[27]。
表4 优化前后的磁性微胶囊DPPH清除率方差分析
Table 4 Analysis of variance of DPPH scavenging rate ofoptimized and non-optimaized TPM
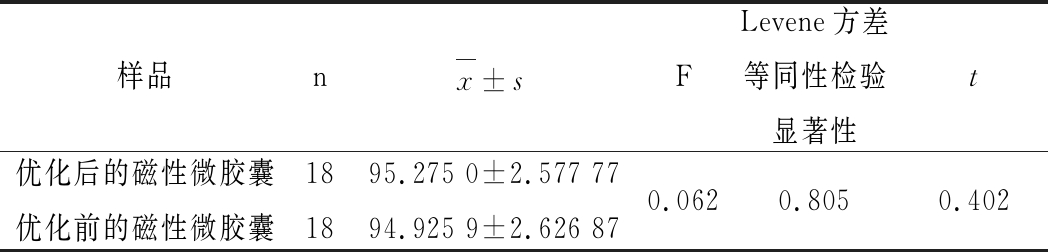
样品nx±sF Levene方差等同性检验显著性t优化后的磁性微胶囊优化前的磁性微胶囊181895.275 0±2.577 7794.925 9±2.626 870.0620.8050.402
2.3.2 优化后磁性微胶囊的缓释性分析
从图11可以看出,优化后的磁性微胶囊和优化前的磁性微胶囊都是缓慢释放的,并且相同时间下优化后比优化前的磁性微胶囊的累积释放率更低,这说明优化后的海藻酸钠和CaCl2有更好的交联反应,形成的微胶囊壳更加坚固[29]。优化后的磁性微胶囊在2 h的茶多酚释放率仅为15.6%,低于优化前的磁性微胶囊在2 h的茶多酚释放率(20.6%)。2 h后有84.4%的茶多酚是缓慢释放,持续释放20 h以上。
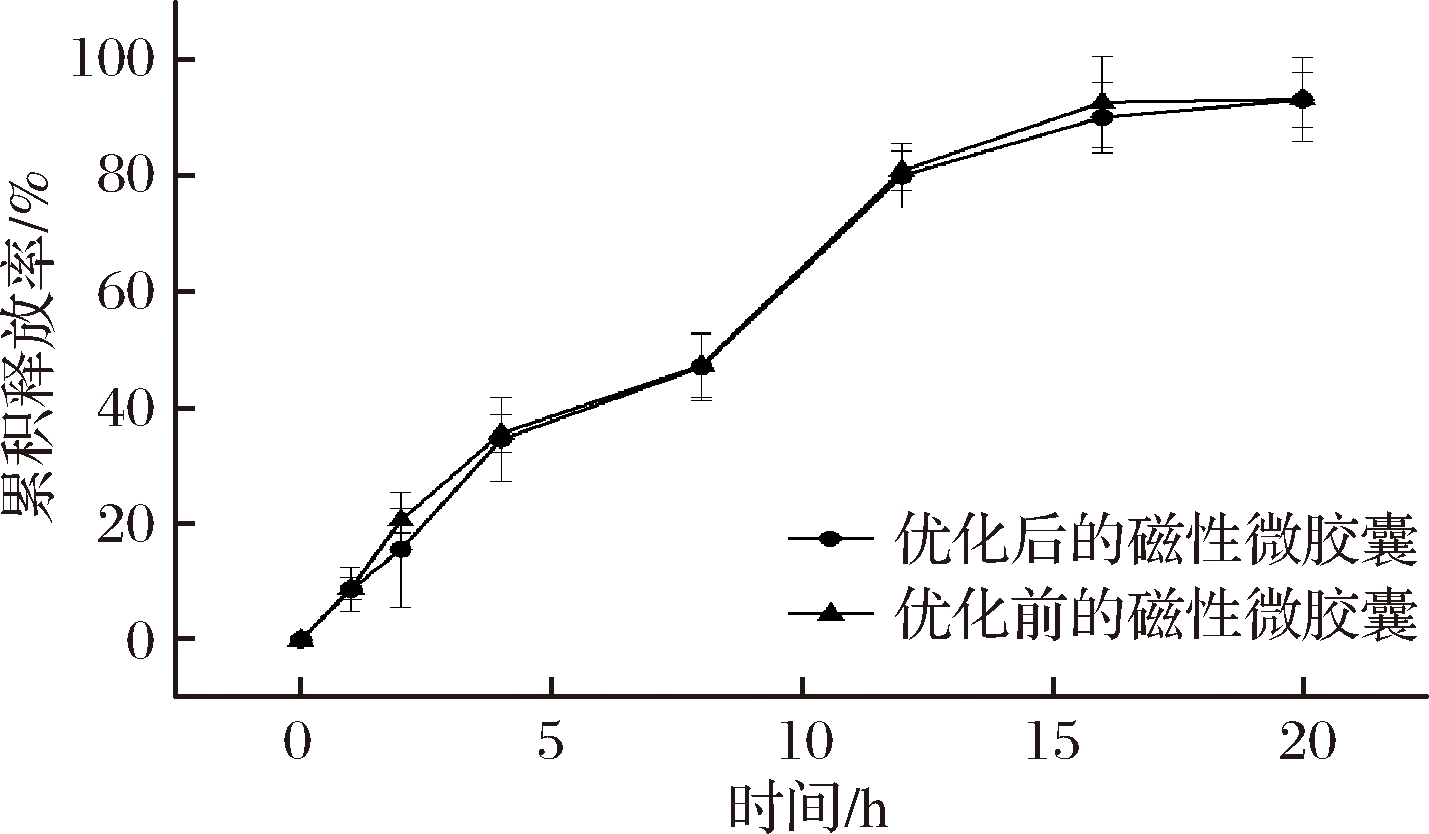
图11 优化前后的磁性微胶囊释放曲线
Fig.11 Release profile of optimized and non-optimaized TPM
将2条释放曲线进行线性拟合,得到优化前后的磁性微胶囊的释放拟合曲线,如图12所示。优化后的磁性微胶囊的斜率为4.81,而优化前的磁性微胶囊的斜率为4.89,说明优化后的磁性微胶囊的释放率低于优化前,这表明优化后的磁性微胶囊对于药物的缓释性能优于优化前的磁性微胶囊。

图12 优化前后的磁性微胶囊释放拟合曲线
Fig.12 Linear fitted curves of the release profile of optimized and non-optimaized TPM
茶多酚在抗癌方面具有多种生物和药理作用。但是,茶多酚在空气中很容易被氧化,故长期作用受到限制。利用响应面法优化了磁性微胶囊的配方。优化的配方为:海藻酸钠质量浓度为18.36 g/L,电压为6.222 kV,推进速度为80 mm/h。在此条件下,磁性微胶囊的包覆率为87.836 2%,平均尺寸为217.67 μm。茶多酚缓释持续20 h以上,优化后的磁性微胶囊相比于优化前,具有更好的缓释性和抗氧化性。
[1] YANG G. Inhibition of growth and induction of apoptosis in human cancer cell lines by tea polyphenols[J]. Carcinogenesis, 1998, 19(4):611-616.
[2] 刘学铭, 梁世中. 茶多酚的保健和药理作用及应用前景[J]. 食品与发酵工业, 1998(5):47-51.
[3] 马小明. 微胶囊技术及其在食品工业中的应用[J]. 食品与发酵工业, 1991(5):69-73.
[4] AUGST A D, KONG H J, MOONEY D J. Alginate Hydrogels as Biomaterials[J]. Macromolecular Bioscience, 2006, 6(8):623-633.
[5] GEORGE M, ABRAHAM T E. Polyionic hydrocolloids for the intestinal delivery of protein drugs: Alginate and chitosan-a review[J]. Journal of Controlled Release Official Journal of the Controlled Release Society, 2006, 114(1):1-14.
[6] L PEZ C
PEZ C RDOBA, ALEX, DELADINO L, MARTINO M. Effect of starch filler on calcium-alginate hydrogels loaded with yerba mate antioxidants[J]. Carbohydrate Polymers, 2013, 95(1):315-323.
RDOBA, ALEX, DELADINO L, MARTINO M. Effect of starch filler on calcium-alginate hydrogels loaded with yerba mate antioxidants[J]. Carbohydrate Polymers, 2013, 95(1):315-323.
[7] 王咏梅, 龚长源, 程永德. 海藻酸钠微球血管栓塞剂治疗子宫肌瘤二例[J]. 介入放射学杂志, 2004, 13(4):290-290.
[8] 于波涛, 张志荣, 曾仁杰,等. 肝靶向氟尿嘧啶类脂纳米粒的研究[J]. 药学学报, 2000, 35(9):700-705.
[9] DRAGET K I, KJERSTI STEINSVAG, EDVAR ONSOYEN, et al. Na- and K-alginate; effect on Ca2+-gelation[J]. Carbohydrate Polymers, 1998, 35(s 1-2):1-6.
[10] KRASAEKOOPT W, BHANDARI B, DEETH H. The influence of coating materials on some properties of alginate beads and survivability of microencapsulated probiotic bacteria[J]. International Dairy Journal, 2004, 14(8):737-743.
[11] 张武杰, 李保国, 张超, 等. 静电喷雾法制备海藻酸钙-羧甲基纤维素钠液芯微胶囊的工艺选优[J]. 上海理工大学学报, 2007, 29(4):349-352.
[12] 李琳琳, 陈东, 丁明慧,等. 磁性微胶囊的制备及其药物缓控释性能[J]. 物理化学学报, 2007, 23(12):1 969-1 973.
[13] FOURNIER C, MICH LE HAMON, HAMON M, et al. Preparation and preclinical evaluation of bioresorbable hydroxyethylstarch microspheres for transient arterial embolization[J]. International Journal of Pharmaceutics, 1994, 106(1):41-49.
LE HAMON, HAMON M, et al. Preparation and preclinical evaluation of bioresorbable hydroxyethylstarch microspheres for transient arterial embolization[J]. International Journal of Pharmaceutics, 1994, 106(1):41-49.
[14] 方敏, 宫智勇, 王耀峰. 玉米须乙醇提取物体外抗氧化活性研究[J]. 中国食物与营养, 2008(4):45-47.
[15] 旷英姿, 马全红, 郝小祯, 等. 茶多酚脂质体的制备研究[J]. 中国生化药物杂志, 2006, 27(1):28-31.
[16] HARRIS R, LECUMBERRI E, MATEOS-APARICIO I, et al. Chitosan nanoparticles and microspheres for the encapsulation of natural antioxidants extracted from Ilex paraguariensis[J]. Carbohydrate Polymers, 2011, 84(2):803-806.
[17] 高宝玉, 岳钦艳, 于慧,等. 利用透射电镜研究PACS的形态及絮凝机理[J]. 环境科学学报, 1998, 18(4):392-395.
[18] 李向东, 李娟. 粒径分析法研究稳定剂对含乳饮料稳定性的影响[J]. 食品科学, 2011, 32(13):58-61.
[19] 吴晓青, 魏俊富, 李嘉禄. 差示扫描量热法研究改性双马来酰亚胺的固化过程[J]. 复合材料学报, 1999, 16(2):34-38.
[20] 丁恩勇, 梁学海. 不同实验条件对DSC峰形的影响以及相变温度的确定[J]. 分析测试学报, 1993(5):50-54.
[21] 宋春财, 胡浩权, 朱盛维,等. 生物质秸秆热重分析及几种动力学模型结果比较[J]. 燃料化学学报, 2003, 31(4):311-316.
[22] 王春红, 李洪昌, 李锡伯, 等. 一种氯化钙交联的海藻酸钠纳米纤维支架材料及其制备方法:, CN105457094A[P].
[23] 李琳琳, 陈东, 丁明慧,等. 磁性微胶囊的制备及其药物缓控释性能[J]. 物理化学学报, 2007, 23(12):1 969-1 973.
[24] 刘军海, 黄宝旭, 蒋德超. 响应面分析法优化艾叶多糖提取工艺研究[J]. 食品科学, 2009, 30(2):114-118.
[25] 刘洋, 赵谋明, 杨宁,等. 响应面分析法优化仙人掌多糖提取工艺的研究[J]. 食品与机械, 2006, 22(6):42-44.
[26] 程琮, 范华. Levene方差齐性检验[J]. 中国卫生统计, 2005, 22(6):408;420.
[27] 范琳琳, 王红瑞, 宋乃琦, 等. 基于T检验的水文时间序列HHT分析方法及应用[J]. 系统工程理论与实践, 2015,35(5):1 324-1 331.
[29] 李志勇. 改性海藻酸钠凝胶的制备及性能研究[D]. 无锡:江南大学, 2008.