
核苷酸糖鸟嘌呤5′-二磷酸-β-L-岩藻糖(5′-diphospho-β-L-fucose, GDP-L-岩藻糖)是广泛存在于生物中的糖基供体和代谢中间体[1]。在真核生物中,它主要用作重要的糖基化供体和其他糖基化核苷酸的前体[2],参与血型的ABH抗原决定簇并介导细胞粘附和识别[3],是调节生命代谢不可或缺的物质。此外,GDP-L-岩藻糖是合成人乳寡糖的重要中间产物,为岩藻糖基化反应提供了岩藻糖基供体,并将活化的L-岩藻糖与内质网(endoplasmic reticulum, ER)和高尔基糖基化连接[4],也在人乳寡糖的合成中起重要作用。由于GDP-L-岩藻糖化学合成的复杂性和高昂的成本,通过基因工程构建代谢工程细菌生产GDP-L-岩藻糖是一种有效的方法。目前,GDP-L-岩藻糖的生物合成包括细菌、哺乳动物和植物中的从头途径和补救途径。
L-岩藻糖激酶/GDP-L-岩藻糖焦磷酸化酶(fucose pyrophosphorylase, FKP)是GDP-L-岩藻糖补救途径中的一种双功能酶,最初仅在哺乳动物细胞中发现[5]。随后,在水稻和拟南芥中也鉴定了FKP的存在[6-7]。COMSTOCK等[8]从脆弱拟杆菌中鉴定出第一个双功能酶FKP,该酶模拟哺乳动物的补救途径,利用外源底物L-岩藻糖、ATP和GTP酶法合成GDP-L-岩藻糖。使用FKP合成GDP-L-岩藻糖涉及2个独立的催化过程。首先,L-岩藻糖激酶催化L-岩藻糖生成岩藻糖-1-磷酸,并消耗ATP提供能量,然后在岩藻糖-1-P-鸟嘌呤转移酶和GTP的作用下,岩藻糖-1-磷酸合成GDP-L-岩藻糖[9-10]。简而言之,FKP可以通过1-磷酸岩藻糖中间体将岩藻糖转化为GDP-L-岩藻糖。这种转化在所有的拟杆菌中都是保守的,并且双功能酶FKP已被有效地用于体外合成和修饰糖底物和衍生物[11-12]。目前,FKP已成功引入大肠杆菌和酿酒酵母,并已证明FKP依赖的岩藻糖类似物可以有效地掺入细菌和真菌的多糖中[13-14]。这种双功能酶具有广泛的底物特异性,包括L-岩藻糖、D-阿拉伯糖、L-半乳糖和L-岩藻糖的化学修饰衍生物[11]。
鉴于FKP在岩藻糖基化多糖的生物合成中的重要性,本研究从脆弱拟杆菌(Bacteroides fragilis)的基因组DNA中克隆得到FKP的基因,在大肠杆菌中过表达,并对其酶学性质进行表征,为FKP的研究和应用奠定基础。
1.1.1 菌株与质粒
基因来源菌株脆弱拟杆菌(24309),中国工业微生物菌种保藏中心;E. coli DH5α 和 E. coli BL21(DE3)分别用于质粒的克隆扩增和重组酶的过量表达,生工生物工程(上海)有限公司;实验中使用的质粒载体pET-22b(+),Novagen公司。
1.1.2 培养基
基因工程菌 E. coli 的培养基使用LB培养基(g/L):酵母提取物5、胰蛋白胨10和NaCl 10。灭菌条件:121 ℃,20 min。
1.1.3 主要试剂
高保真DNA聚合酶、限制性内切酶、Solution I连接酶、DNA Marker,宝生物工程(大连)有限公司;L-岩藻糖和ATP,上海麦克林生化科技有限公司;岩藻糖-1-P和GDP-L-岩藻糖标准品,Sigma-Aldrich公司;琼脂糖、50×TAE缓冲液、核酸染料、GTP、感受态细胞制备试剂盒、细菌基因组DNA抽提试剂盒、DNA胶回收试剂盒等,生工生物工程(上海)有限公司;质粒抽提试剂盒,天根生化科技(北京)有限公司;引物合成和测序由天霖生物科技无锡有限公司完成。
1.2.1 FKP基因的克隆及重组质粒的构建
将基因来源菌株脆弱的拟杆菌(Bacteroides fragilis)在含有无纤溶酶原的绵羊血液的胰蛋白和大豆琼脂培养基中厌氧培养,挑取单菌落接种于种子培养液中,参照Ezup柱式基因抽提手册对基因组DNA进行提取。以B. fragilis 基因组为模板,引物序列为F(5′-CGCCATATGCAAAAACTATCTTTACCGC-3′)和R(5′-CCCTCGAGTGATCGTGATAC TTGGAATC-3′),PCR扩增程序为:98 ℃预变性30 s,95 ℃变性15 s,55 ℃退火30 s,72 ℃延伸2 min,72 ℃延伸5 min。将PCR合成的靶基因片段连接至C末端具有6-his标签的载体pET-22b(+),然后转化至大肠杆菌DH5α感受态细胞。通过筛选和测序转化体获得了携带FKP基因的重组表达载体。重组质粒命名为pET-22b(+)-FKP。
1.2.2 重组酶的诱导表达和纯化
将构建的重组质粒转化到大肠杆菌BL21(DE3)中进行表达。将重组菌株接种到4 mL LB培养基中,然后将种子溶液转移至含有氨苄青霉素(100 μg/mL)和IPTG(0.1 mmol/L)的LB液体培养基中,并在16 ℃下培养24 h。按照WANG等[15]所述的AsfTase方法,收集、破坏和纯化带有pET-22b(+)-FKP变异体的大肠杆菌BL21(DE3)细胞。用SDS测定重组FKP的分子质量和纯度。在SDS-PAGE实验中,凝胶组分为120 g/L分离凝胶和40 g/L浓缩凝胶。电泳后,将凝胶用考马斯亮蓝R-250染色,然后用5%(体积分数)乙醇和10%(体积分数)乙酸溶液脱色。
1.2.3 重组FKP酶活测定
通过检测L-岩藻糖转化为GDP-L-岩藻糖的含量来确定FKP的酶活性。在400 μL反应系统中,添加Mg2+(5 mmol/L),ATP(2.5 mmol/L),GTP(2.5 mmol/L)并溶解在含有底物L-岩藻糖(10 mmol/L)的缓冲液Tris-HCl(50 mmol/L,pH 7.5)中。将适当稀释的FKP纯酶溶液加入到反应体系中,并使反应溶液在45℃下反应10 min,最后煮沸10 min以终止酶反应。将反应液离心(10 000 r/min,2 min)后,提取上清液并通过0.22 μm微孔膜过滤,并使用HPLC测量GDP-L-岩藻糖,以计算FKP的酶活性。酶活性定义:在1 min内产生1 mol/L GDP-L-岩藻糖所需的酶量定义为1个酶活力单位(U)。
1.2.4 重组FKP酶学性质
金属离子对FKP的影响:由于在蛋白质纯化过程中已通过EDTA去除了酶溶液中的金属离子,因此纯化的酶溶液不含金属离子。在存在Mg2+、Cu2+、Mn2+、Co2+和Fe2+的情况下,研究了不同浓度的金属离子对FKP酶活性的影响。金属离子的浓度为0.02、0.5、2、5、8、12、15、18 mmol/L。以没有金属离子的酶溶液用作对照,其相对酶活性定义为100%。其他条件与上述相同。
最适pH:在pH 4.0~11.0下测量pH对FKP酶活性的影响。所有缓冲液浓度均为50 mmol/L,包括HAc-NaAc缓冲液(pH 4.0~6.0)、NaH2PO4-Na2HPO4缓冲液(pH 6.0~7.5)、Tris-HCl缓冲液(pH 7.0~9.0)和甘氨酸-NaOH缓冲液(pH 9.0~11.0)。除pH缓冲液外,反应系统的其他条件和检测方法与酶活性的测定一致。同时,最高酶活性对应的pH是FKP的最佳pH,并且将最佳pH下的相对酶活性定义为100%。
最适温度和温度稳定性:通过在25~70 ℃的温度范围内进行酶反应并测量产物生成量来确定FKP的最适温度。在最适pH条件下测定FKP在各种温度下的热稳定性。FKP分别在4、12、20、28、37、45 ℃孵育,每隔一段时间采样一次测定残留酶活性,初始酶活性为100%。
为了确定动力学参数,反应系统由稀释的FKP酶溶液,Mn2+(2 mmol/L),L-岩藻糖(0.25~12 mmol/L)和Tris-HCl缓冲液(50 mmol/L,pH 7.5)。在45 ℃下反应10 min后,通过沸水浴终止酶促反应,并测量合成的GDP-L-岩藻糖的量。用Lineweaver-Burk双重倒数法确定了FKP的米氏常数Km和最大反应速率Vmax,并计算出催化速度常数Kcat和催化效率Kcat/Km。没有酶溶液的体系用作空白对照。
1.2.5 GDP-L-岩藻糖的生物合成
在最佳条件下测定了GDP-L-岩藻糖的生物转化。转化溶液(30 mL)包含Tris-HCl缓冲液(50 mmol/L,pH 7.5)、10 mmol/L L-岩藻糖、10 mmol/L ATP、10 mmol/L GTP、300 mU/mL FKP和最终浓度为2 mmol/L的Mn2+。在pH 7.5和45 ℃的条件下,反应在酶反应器中进行12 h。通过HPLC分析产物和底物。
1.2.6 数据统计分析
实验数据结果采用Excel进行统计和分析。酶学性质、生物合成曲线用OringinPro 8进行绘制和分析。
通过PCR克隆成功地从脆弱拟杆菌(CICC 24309)分离了编码L-岩藻糖激酶/GDP-L-岩藻糖焦磷酸化酶基因的基因。该基因片段的总长度为2 850 bp,编码949个氨基酸残基。从GenBank(www.ncbi.nlm.nih.gov)下载了来自不同微生物的FKP序列,并与DNAMAN进行比对以鉴定保守的基因序列,结果见图1。


图1 不同来源双功能酶序列对比
Fig.1 Sequence comparison of bifunctional enzymes from different sources
来自不同来源的FKP的同源性在50%~80%之间。来源于Bacteroides fragilis的FKP氨基酸序列(蛋白ID RDT75264.1)与B. caccae(蛋白ID wp_122365145.1)同源性最高,为75.24%。与Alloprevotella sp. (蛋白 ID RKV80205.1)、Mangrovibacterium diazotrophicum (蛋白 ID WP_120275767.1)、Parabacteroides goldsteinii (蛋白 ID RLT85747.1)、Prevotella sp. (蛋白 ID WP_122374089.1) 和Parabacteroides merdae (protein ID WP_122131458.1)的同源性分别为57.84%、58.86%、70.13%、62.42%和70.69%。FKP的理论等电点(pI)和分子质量(Mw)通过ExPASy(www.expasy.org)计算得出,分别为5.74/105 666.93 Da。
为了鉴定FKP的性质,通过PCR扩增该酶(图2),并将其克隆到含有Nde I和Xho I限制性酶切位点的表达载体pET-22b(+)中。将重组质粒转化到大肠杆菌BL21(DE3)中进行表达。由于在质粒构建过程中添加了6个组氨酸标签,因此使用Ni2+螯合琼脂糖快速流动色谱柱纯化目标蛋白,纯化后酶的比酶活为(5.59±0.32) U/mg。通过SDS-PAGE分析IPTG诱导的大肠杆菌BL21(DE3)重组酶,并在106 kDa处显示出明显的蛋白带(图3),说明重组FKP被成功诱导表达。
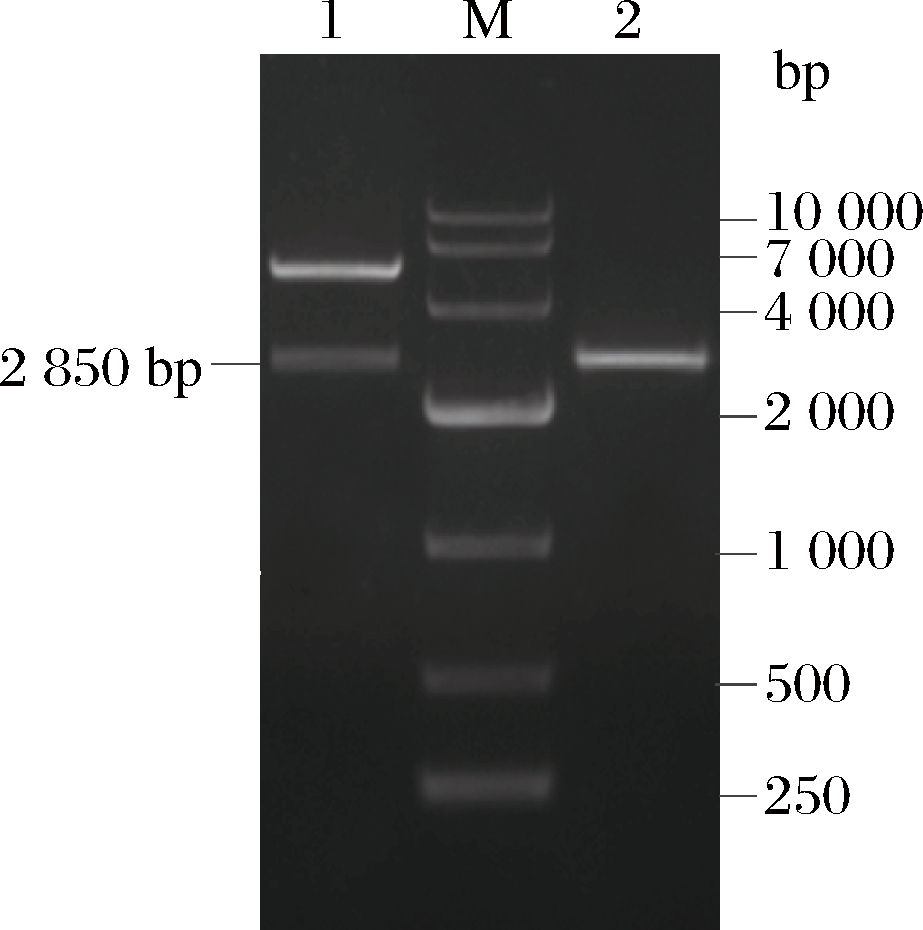
M-DNA Marker;1-双酶切;2-FKP基因全长2 850 bp
图2 核酸电泳分析
Fig.2 Nucleic acid electrophoresis analysis
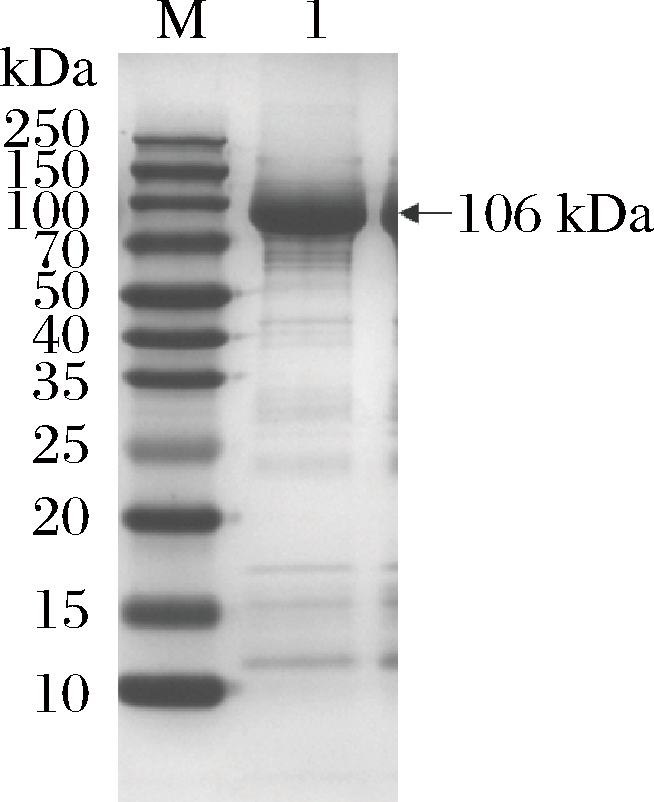
M-蛋白Marker;1-纯化FKP
图3 FKP重组蛋白SDS-PAGE分析
Fig.3 SDS-PAGE analysis of recombinant protein FKP
2.3.1 最适反应条件和热稳定性
在pH 4.5~9.0下研究了FKP的pH曲线(图4)和pH稳定性(图5)。当pH值为7.5时,FKP相对酶活性达到最大值,当pH范围为7.0~7.5和8.5~9.0时,FKP仍表现出80%以上的酶活性。

图4 FKP 的最适pH
Fig.4 The optimum pH of FKP
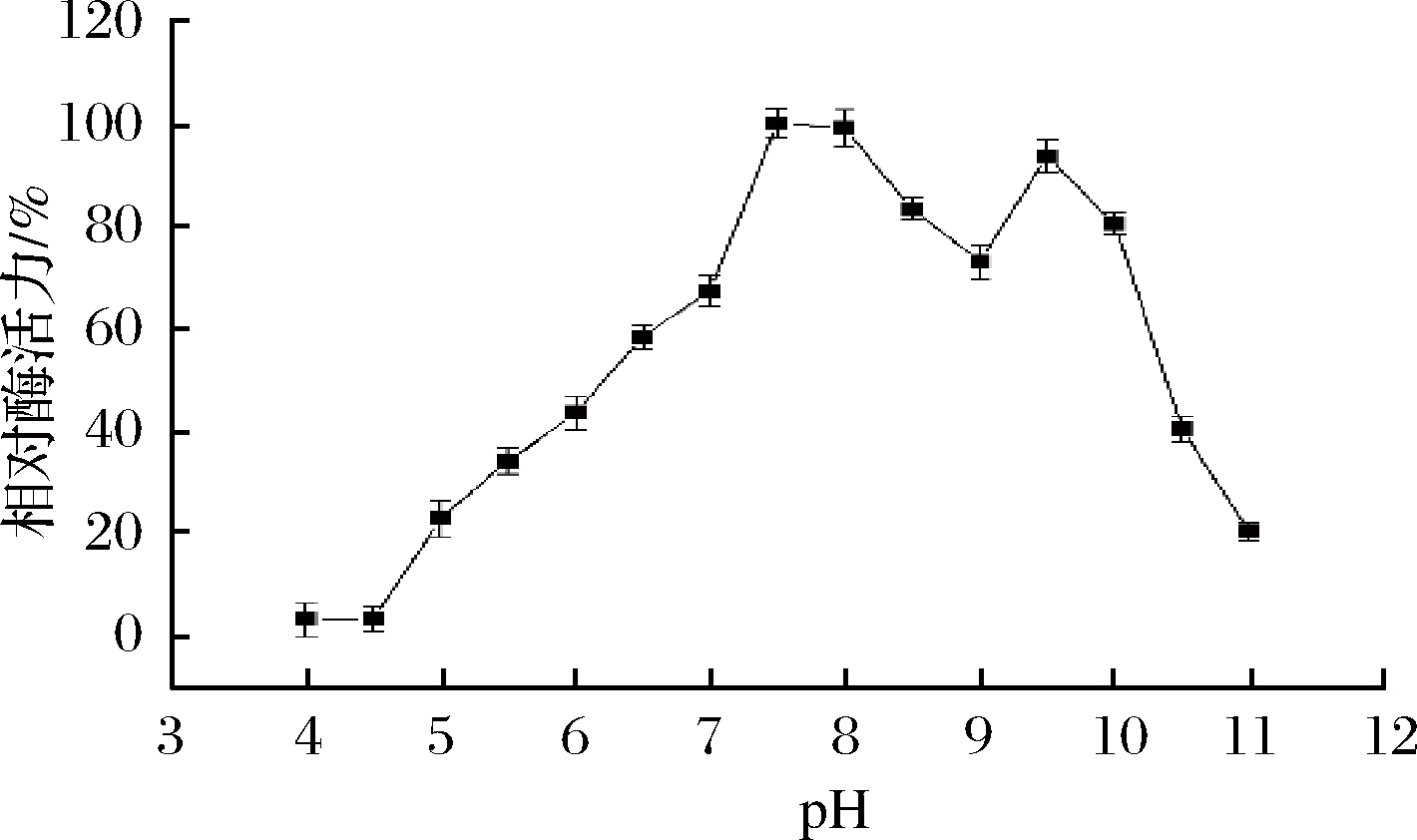
图5 重组FKP的pH稳定性
Fig.5 pH stability of recombinant FKP
从图6可以看出,FKP最适反应温度为45 ℃,在35~45 ℃温度范围内,可以保留80%以上酶活力。当温度>50 ℃,酶活力下降较为明显,说明随着温度增加,酶结构受到破坏而失活。热稳定性是影响酶利用价值的重要因素。在4、12、20、28、37、45 ℃下测量FKP的热稳定性。当酶在4和12 ℃下孵育3 h时,酶的初始活性保持在90%以上。FKP的活性分别在20、28、37和45 ℃的温度下暴露40、70、80、100 min后低于60%(图7)。
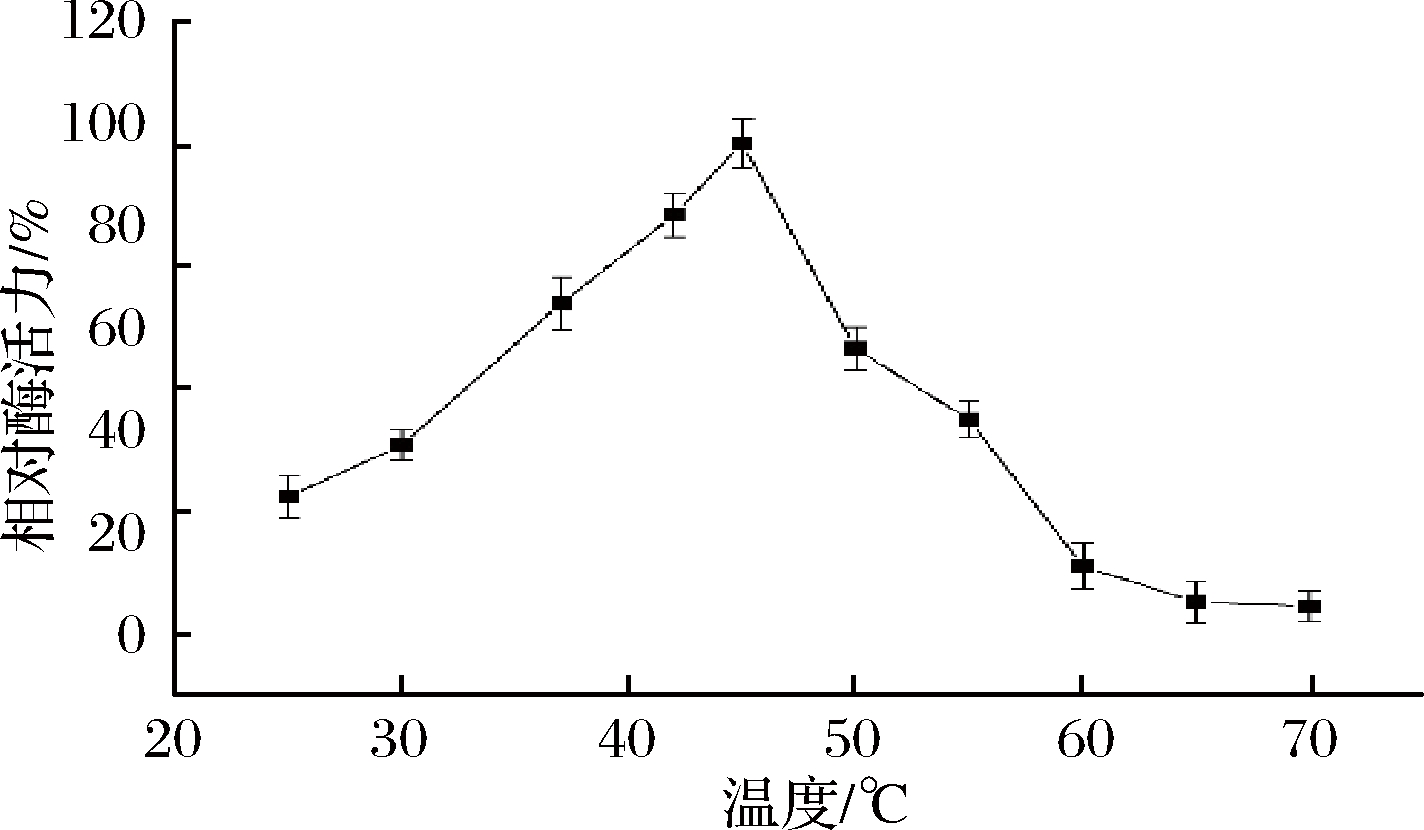
图6 FKP 的最适温度
Fig.6 The optimum temperature of FKP
2.3.2 金属离子对酶活力的影响
为了研究金属离子对FKP酶活性的影响,在pH 7.5条件下,测定了在不同二价金属离子存在下FKP的活性。FKP是一种典型的金属酶,需要金属离子来维持其稳定的自然状态。如图8所示,当Mg2+的浓度达到2 mmol/L时,Mg2+和Mn2+显着增加了FKP的活性,并且FKP表现出最高的酶活性。当Mg2+的浓度高于2 mmol/L时,酶活性随金属离子浓度的增加而降低。
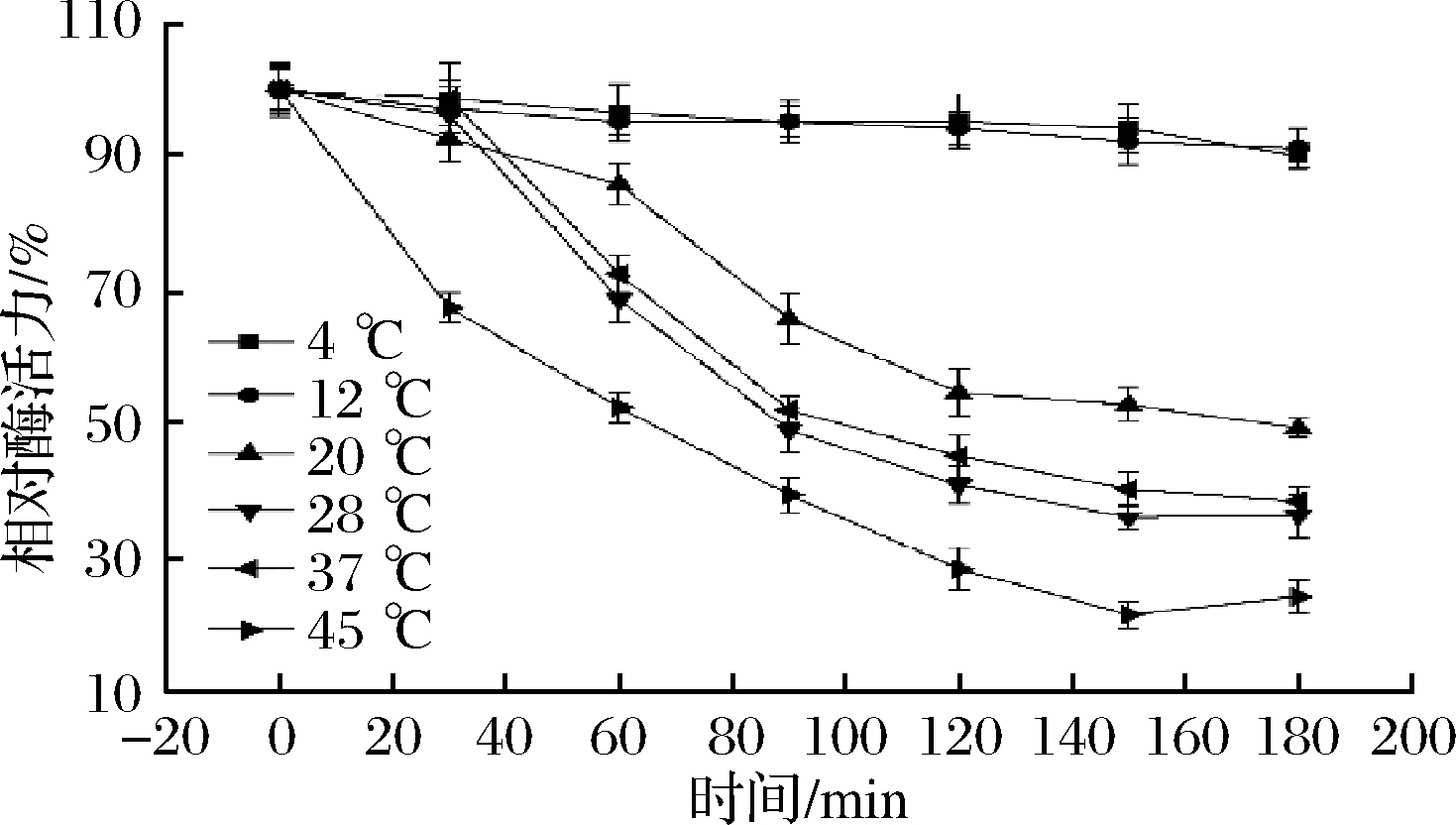
图7 重组FKP的热稳定性
Fig.7 Thermal stability of recombinant FKP
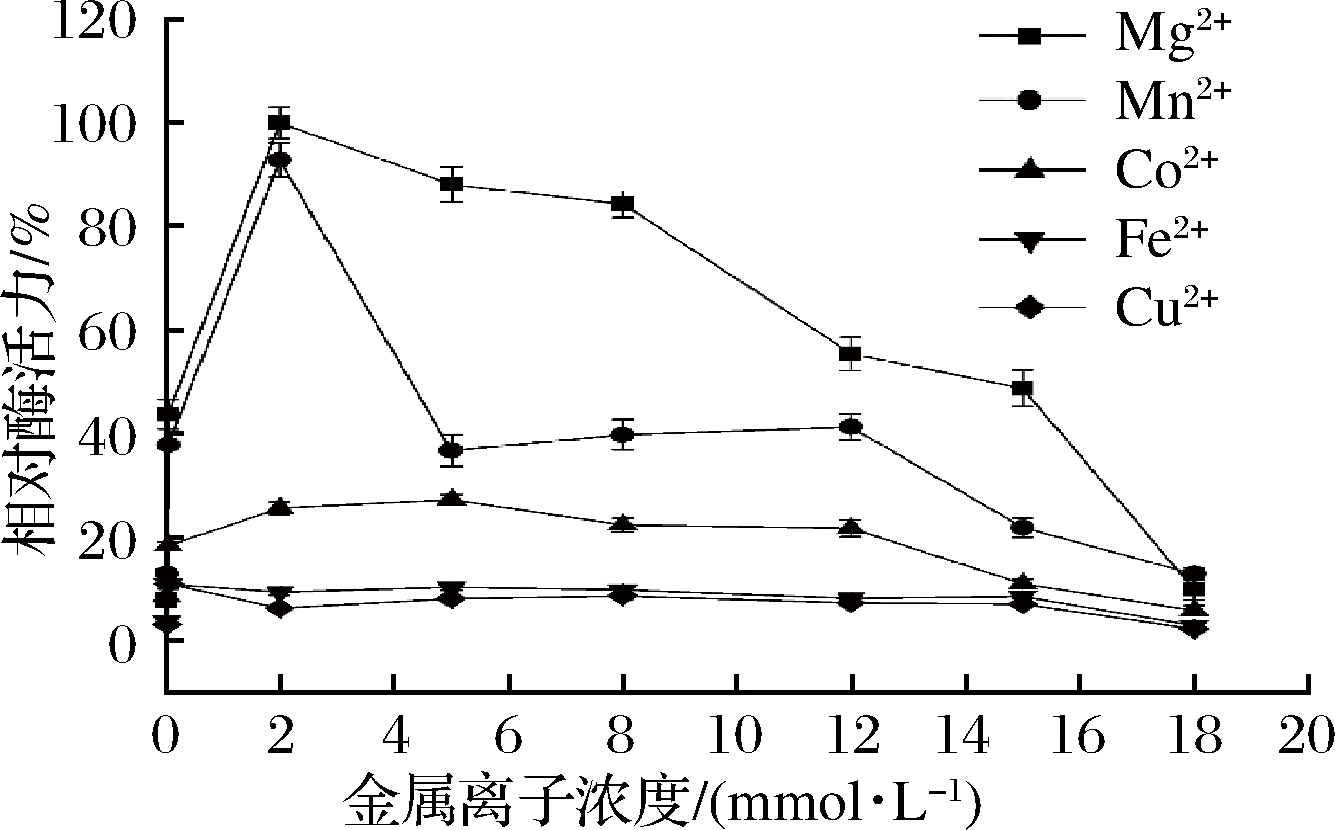
图8 金属离子对FKP酶活力的影响
Fig.8 Effect of metal ions on FKP enzyme activity
2.3.3 反应动力学常数
FKP的稳态动力学常数通过Lineweaver-Burk方法确定。在45 ℃ Tris-HCl缓冲液(50 mmol/L,pH 7.5)中,在不同底物浓度(0.5~20 mmol/L)下测定重组酶的动力学参数。L-岩藻糖与反应时间(0~10 min)呈线性关系,表明初始反应速率符合一阶反应模型。Km和Vmax分别为0.44 mmol/L和0.2 mmol/(min·mg)。以L-岩藻糖为底物的FKP的转化率(Kcat)和催化效率(Kcat / Km)分别为(31.49±2.5) s-1和(71.57±4.7) s-1/(mmol/L)。
2.3.4 GDP-L-岩藻糖的生物合成
在连续的L-岩藻糖激酶和GDP-L-岩藻糖焦磷酸化酶反应中,重组酶 FKP在以L-岩藻糖、ATP和GTP为起始底物的反应混合物中生产GDP-L-岩藻糖,如图9所示。在45 ℃下,反应最初1 h,GDP-L-岩藻糖产量迅速增加,1 h后增速变缓,11 h后GDP-L-岩藻糖产量达到最大值2.1 mmol/L。
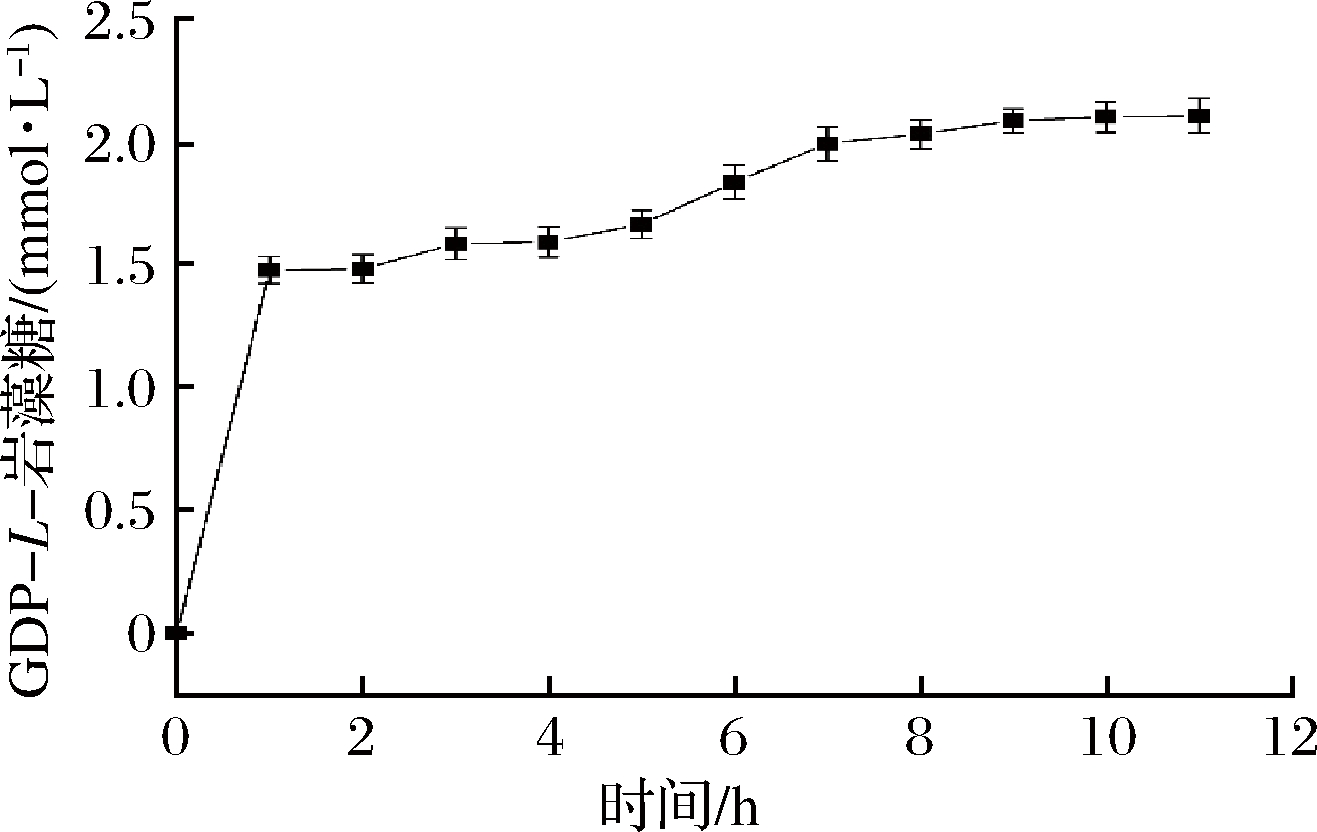
图9 不同时间下GDP-L-岩藻糖的生物合成
Fig.9 GDP-L-fucose biosynthesis at different times
岩藻糖是一种脱氧己糖,存在于多种生物中,参与哺乳动物N-和O-连接糖蛋白和糖脂的修饰[16-17],岩藻糖基化寡糖涉及真核生物的多种生物学和病理学过程,例如组织发育、血管生成、受精、细胞粘附、炎症和肿瘤转移[18]。岩藻糖基化寡糖由岩藻糖基转移酶构建,这就需要底物GDP-岩藻糖。哺乳动物细胞中GDP-岩藻糖合成的2个途径:GDP-甘露糖依赖性的从头途径和游离岩藻糖依赖性的补救途径。
本研究中,我们从B. fragilis中克隆得到双功能酶FKP的基因,并在E. coli BL21 (DE3) 中正确表达,以外源L-岩藻糖为底物,通过两步反应转化为GDP-岩藻糖。目前,对于FKP酶学性质研究较少,本文通过比较在不同条件下相对酶活力,得到FKP的最适温度为45 ℃,在35~45 ℃范围内能保留80%以上活性。KOTAKE等[7]研究了拟南芥中AtFKGP的酶学性质,对L-岩藻糖激酶和GDP-L-岩藻糖焦磷酸化酶的最适温度分别进行了测定,发现L-岩藻糖激酶的最佳温度为40 ℃,在50 ℃下酶活力损失超过99%。而GDP-L-岩藻糖焦磷酸化酶在30~45 ℃范围内酶活性最大。
本研究中FKP催化L-岩藻糖的最适pH为7.5,根据KOTAKE等[7]对AtFKGP的研究,L-岩藻糖激酶最大活性为pH 10.5,而GDP-L-岩藻糖焦磷酸化酶最大活性在pH 6.5~8.0的范围。基于上述结果,是由于FKP具有2个不同的L-岩藻糖激酶和GDP-L-岩藻糖焦磷酸化酶活性区域。这2种酶活性的特性不同,所以pH出现了2个峰值,但来自哺乳动物的L-岩藻糖激酶的最佳pH值约为8.0[10,19],并且因为高pH可能会使GDP-L-岩藻糖焦磷酸化酶活性受到抑制,所以将酶反应体系缓冲至pH 7.5用于酶活力的测定。酶的最佳pH受到活性位点残基的pKa,酶底物结合和酶表面电荷等各种因素的影响[20]。
金属离子是另一个影响FKP酶活性的重要因素。不管对于L-岩藻糖激酶还是GDP-L-岩藻糖焦磷酸化酶,二价阳离子在催化反应过程中都是必需的。对于L-岩藻糖激酶活性,Mn2+是比Mg2+更好的阳离子,但与Mg2+相比,它对GDP-L-岩藻糖焦磷酸化酶活性的影响很小,所以在酶反应体系中,通常使用Mg2+作为必需二价阳离子。
在GDP-L-岩藻糖的生物合成中,根据KOTAKE等[7]报道,拟南芥的AtFKGP在40 ℃下反应5 h产物生成量为400 nmol/mL。FKP的低性能可能是由于核苷酸或核苷酸糖抑制了岩藻糖激酶或焦磷酸化酶的活性。以前有报道通过GTP、ADP和GDP抑制猪的烟酰激酶[9-10,21]。因此,我们认为脆弱拟杆菌FKP的L-岩藻糖激酶活性也被GTP(GDP-L-岩藻糖焦磷酸化酶底物)和ADP(L-岩藻糖激酶产物)抑制,这为GDP-L-岩藻糖的生产奠定了基础。
从脆弱拟杆菌中克隆得到双功能酶FKP的基因,并成功在E. coli BL21 (DE3) 中进行过表达。使用镍离子亲和层析对重组酶分离纯化,对纯化后的FKP进行了酶学性质分析。重组酶的最适温度为45 ℃,在低温下具有良好的稳定性,最适pH为7.5,pH值稳定范围较宽。Mg2+和Mn2+对FKP的活性具有明显的激活作用,而Co2+、Fe2+、Cu2+起抑制作用。在一定底物浓度下,GDP-L-岩藻糖产量呈升高趋势,在转化11 h后GDP-L-岩藻糖达到最大值2.1 mmol/L。
[1] ZHAI Y,HAN D,PAN Y,et al.Enhancing GDP-fucose production in recombinant Escherichia coli by metabolic pathway engineering[J].Enzyme and Microbial Technology,2015,69:38-45.
[2] CHIN Y W,KIM J Y,LEE W H,et al.Enhanced production of 2′-fucosyllactose in engineered Escherichia coli BL21 star(DE3) by modulation of lactose metabolism and fucosyltransferase[J].Journal of Biotechnology,2015,210:107-115.
[3] SANZ S,BANDINI G,OSPINA D,et al.Biosynthesis of GDP-fucose and other sugar nucleotides in the blood stages of plasmodium falciparum[J].Journal of Biological Chemistry,2013,288(23):16 506-16 517.
[4] STURLA L,PUGLIELLI L,TONETTI M,et al.Impairment of the golgi GDP-l-Fucose transport and unresponsiveness to fucose replacement therapy in LAD II patients[J].Pediatric Research,2001,49(4):537-542.
[5] CHIN Y W,KIM J H,SEO N,et al.Metabolic engineering of Escherichia coli to produce 2′-fucosyllactose via salvage pathway of guanosine 5′-diphosphate (GDP)-L-fucose[J].Biotechnology and Bioengineering,2016,113(11):2 443-2 452.
[6] CHENG C,GU J,SU J,et al.Crystallization,preliminary X-ray crystallographic and cryo-electron microscopy analysis of a bifunctional enzyme fucokinase/L-fucose-1-P-guanylyltransferase from Bacteroides fragilis[J].Acta Crystallographica,2014,70(9):1 206-1 210.
[7] KOTAKE T,HOJO S,TAJIIMA N,et al.A bifunctional enzyme with L-Fucokinase and GDP-L-fucose pyrophosphorylase activities salvages free L-Fucose in Arabidopsis[J].Journal of Biological Chemistry,2008,283(13):8 125-8 135.
[8] COMSTOCK L E,COYNE M J,TZIANABOS A O,et al.Interstrain variation of the polysaccharide B biosynthesis locus of Bacteroides fragilis: characterization of the region from strain 638R[J].Journal of Bacteriology,1999,181(19):6 192-6 196.
[9] PASTUSZAK I,KETCHUM C,HERMANSON G,et al.GDP-L-fucose pyrophosphorylase: purification,cDNA cloning,and properties of the enzyme[J].Journal of Biological Chemistry,1998,273(46):30 165-30 174.
[10] PARK S H,PASTUSZAK I,DRAKE R,et al.Purification to apparent homogeneity and properties of pig kidney L-Fucose kinase[J].Journal of Biological Chemistry,1998,273(10):5 685-5 691.
[11] OHASHI H,WAHL C,OHASHI T,et al.Effective synthesis of guanosine 5’-diphospho-β-L-galactose using Bacterial L-Fucokinase/Guanosine 5’-diphosphate-L-fucose pyrophosphorylase[J].Advanced Synthesis & Catalysis,2017,359(23):4 229-4 234.
[12] WANG W,HU T,FRANTOM P A,et al.Chemoenzymatic synthesis of GDP-L-fucose and the Lewis X glycan derivatives[J].Proceedings of the National Academy of Sciences,2009,106(38):16 096-16 101.
[13] SORA Y,LIU Jingjing,JU Y E,et al.Production of a human milk oligosaccharide 2′-fucosyllactose by metabolically engineered Saccharomyces cerevisiae[J].Microbial Cell Factories,2018,17(1):101.
[14] LIU T W,ITO H,CHIBA Y,et al.Functional expression of L-fucokinase/guanosine 5’-diphosphate-L-fucose pyrophosphorylase from Bacteroides fragilis in Saccharomyces cerevisiae for the production of nucleotide sugars from exogenous monosaccharides[J].Glycobiology,2011,21(9):1 228-1 236.
[15] WANG X,YU S,ZHANG T,et al.Identification of a recombinant inulin fructotransferase (difructose dianhydride III forming) from Arthrobacter sp. 161MFSha2.1 with high specific activity and remarkable thermostability[J].Journal of Agricultural and Food Chemistry,2015,63(13):3 509-3 515.
[16] STAUDACHER E,ALTMANN F,WILSON I B H,et al.Fucose in N-glycans: from plant to man[J].Biochimica et Biophysica Acta,1999,1 473(1):230-236.
[17] VILLALOBOS J A,YI B R,WALLACE I S,et al.2-Fluoro-L-Fucose is a metabolically incorporated inhibitor of plant cell wall polysaccharide fucosylation[J].PLOS ONE,2015,10(9):e0139091.
[18] WEICHERT S,JENNEWEIN S,HUFNER,et al.Bioengineered 2′-fucosyllactose and 3-fucosyllactose inhibit the adhesion of Pseudomonas aeruginosa and enteric pathogens to human intestinal and respiratory cell lines[J].Nutrition Research,2013,33(10):831-838.
[19] ISHIHARA H,HEATH E C.The metabolism of L-Fucose[J].Journal of Biological Chemistry,1968,237(8):2 423-2 426.
[20] GALLEGO P,PLANELL R,BENACH J,et al.Structural characterization of the enzymes composing the arginine deiminase pathway in mycoplasma penetrans[J].PLOS ONE, 2012, 7(10):e47886.
[21] KILKER R D,SHUEY D K,SERIF G S.Isolation and properties of porcine thyroid fucokinase[J].BBA-Enzymology,1979,570(2):271-283.