表1 氨基酸标准曲线配制表
Table 1 Amino acid standard curve preparation table
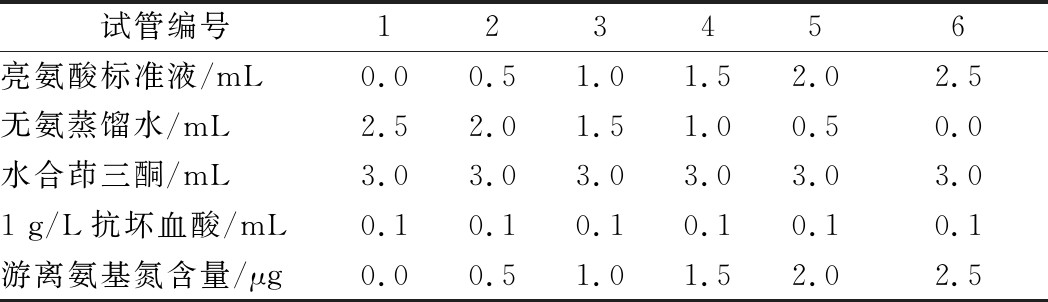
试管编号123456亮氨酸标准液/mL0.00.51.01.52.02.5无氨蒸馏水/mL2.52.01.51.00.50.0水合茚三酮/mL3.03.03.03.03.03.01 g/L抗坏血酸/mL0.10.10.10.10.10.1游离氨基氮含量/μg0.00.51.01.52.02.5
臭鳜鱼是我国传统发酵食品之一,以自然发酵的制作方式赋予臭鳜鱼独特风味,深受人们喜爱。目前,臭鳜鱼制作多以手工作坊加工为主,经食盐腌制后置于自然环境发酵而成[1-2]。臭鳜鱼现有制作工艺受不同区域、腌渍方式及自然环境的影响,不同批次产品存在品质差异大,风味组成稳定性差,安全性低等问题[3-4],这主要是由于发酵过程中产生的微生物菌群不可控,导致鱼肉蛋白的降解程度有差异,直接影响风味物质组成。鱼肉经发酵过程中微生物酶作用降解为小分子肽、游离氨基酸等风味物质,这些物质是贡献滋味的核心成分,其中游离氨基酸的含量和种类直接影响臭鳜鱼的鲜味[5-6]。同时,臭鳜鱼发酵过程中产生腐败致病菌及生物胺等有害物质,是造成臭鳜鱼制品安全品质低的主要原因[3, 7]。文献报道,发酵食品风味组成较为复杂与其菌群结构相关[8-11]。为进一步探究臭鳜鱼中菌株与风味间的相互作用,有学者采用传统微生物培养方法分离菌株,如杨培周等[12]在发酵8 d的臭鳜鱼中分离出以蜡样芽孢杆菌和苏云金芽孢杆菌为主的微生物;李燕[7]对臭鳜鱼发酵过程中微生物进行分离,发现菌群丰富多样且随发酵时间的延长而递减。臭鳜鱼中的微生物菌株与发酵风味的形成息息相关,经菌株发酵后游离氨基酸的组成直接影响臭鳜鱼的鲜味。同时,对分离菌株的特性进一步探讨,罗靓芷等[13]筛选并鉴定得到臭鳜鱼中4株优良乳酸菌,进行了耐盐性、发酵性和生长特性研究。但针对产氨基酸风味菌株筛选及加工特性评价的研究较少。本研究分离筛选自然发酵臭鳜鱼中氨基酸产生菌,对筛选菌株进行鉴定并评价其加工特性,为进一步提高臭鳜鱼的安全品质提供理论依据。
1.1.1 分离菌株的样品来源
臭鳜鱼,徽府源食品有限公司,冰藏(-10~-20 ℃)运送至实验室保藏待用。
1.1.2 主要试剂及培养基
Si 60 F254薄层层析硅胶板,上海默克化工技术有限公司;L-天冬氨酸、L-谷氨酸等17种标准品(纯度>99%),北京鼎国生物技术有限责任公司;茚三酮、异丙醇、甲酸等化学试剂(AR级),国药集团化学试剂有限公司;MRS肉汤培养基(MRS)、营养肉汤培养基(NB)、LB肉汤培养基(LB)、无氮培养基(NCM),青岛高科园海博生物技术有限公司。
氨基酸对照液配制:准确称取0.001 g L-天冬氨酸、L-谷氨酸等17种标准品溶于1 mL体积分数10%异丙醇溶液,即得质量浓度为1 g/L的氨基酸对照液。
氨基酸标准液配制:准确称取亮氨酸23.4 mg,以体积分数10%异丙醇溶解定容至50 mL,为标准液,将标准液50倍稀释即为工作液(游离氨基氮量为1 μg/mL)。
水合茚三酮配制:准确称取0.6 g茚三酮,依次加入15 mL 正丙醇、30 mL 正丁醇、60 mL 乙二醇及9 mL pH 4.54的醋酸盐缓冲液混匀,储存在棕色瓶中,4 ℃保存。
质量浓度1 g/L抗坏血酸配制:准确称取0.01 g抗坏血酸,加水溶解并定容至10 mL。
1.1.3 主要仪器与设备
TL-18M高速冷冻离心机,上海市离心机械研究所;Infinite M200 Pro NanoQuant酶标仪,瑞士帝肯(Tecan)公司;2720 PCR扩增仪,3730XL测序仪,美国应用生物系统(ABI)公司;Mini Pro 300V Power Supply电泳仪,美国major science公司;Sub System 70电泳槽,美国Labnet公司。
1.2.1 细菌分离
无菌操作下,将少量臭鳜鱼鱼肉剪碎,准确称取25.0 g放置于225 mL无菌生理盐水中摇匀。选取3个连续的稀释梯度液,移取0.1 mL涂布于NB固体培养基中,置于37 ℃培养箱中培养48 h,挑取形状不同的单菌落,经多次划线纯化,所得纯菌株于NB斜面培养基进行划线,37 ℃静置培养48 h,置于4 ℃保藏[14]。
1.2.2 氨基酸产生菌株初筛
分离菌株传代培养:采用无菌操作挑取斜面培养基上的菌落接种于NB液体培养基,37 ℃静置培养24~48 h,然后各菌株按照2%接菌量接种于NB液体培养基,完成2代培养。
将菌株活化后的菌液以2%接种量接种于NCM液体培养基中,37 ℃静置培养24 h,重复上述操作传代培养后菌液于9 000 r/min离心10 min,取菌株上清液待测[15]。采用薄层层析法(thin-layer chromatograph,TLC)对菌株上清液中氨基酸组成进行定性分析。
1.2.3 氨基酸产生菌株复筛
将菌株活化后的菌液以接种量2%接种于NCM液体培养基中,37 ℃静置培养24 h,传代培养2次后菌液于9 000 r/min离心10 min,取菌株上清液待测[15]。采用茚三酮比色法对菌株上清液中游离氨基氮总量进行定量分析。
测定方法参照文献[16]进行改良。取各菌株上清液1.0 mL分别加入一组具塞刻度试管中,加入无氨蒸馏水1.5 mL、3 mL水合茚三酮和0.1 mL抗坏血酸,密封试管口,于涡旋振荡器混匀,在沸水浴中加热15 min,冷却后加体积分数60%乙醇定容至20 mL,测定反应后溶液的OD 570 nm值,代入标准曲线回归方程,计算游离氨基氮总量(μg/mL),测定均重复3次。
1.2.4 16S rRNA序列分析鉴定菌株
将复筛获得的菌株进行活化培养,传代2次后于12 000 r/min离心30 s,收集菌体。PCR扩增引物:正向引物27 F:5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物:1492 R:5′-CTACGGCTACCTTGTTACGA-3′。引物的合成和PCR产物的测序委托上海桑尼生物科技有限公司完成。扩增条件:95 ℃预变性5 min;95 ℃变性30 s;58 ℃退火30 s;72 ℃延伸1 min 30 s;35个循环后,72 ℃延伸7 min。将所得基因序列于NCBI BLAST系统中进行比对,使用Clustal X和MEGA 7.0软件采用Neighbor-Joining(NJ)法构建系统进化树,提交序列信息至GenBank获取基因登录号。
1.2.5 菌株耐盐性试验
菌株耐盐性试验参照文献[17]进行改良。将获得菌株于37 ℃培养24 h,以1%的接种量分别接种至含4、6、8、10 g/100 mL NaCl的MRS液体培养基中,未添加NaCl的MRS液体培养基作空白对照,培养36 h后测定菌液OD 600 nm值,测定均重复3次。
1.2.6 菌株氨基酸脱羧酶试验
参照文献[18-19]并进行改良。将获得的菌株于37 ℃培养24 h,以1%接种量分别接种至含10 g/L精氨酸、赖氨酸、鸟氨酸及酪氨酸的MRS液体培养基中(含0.6 g/L溴甲酚紫作为指示剂),不添加氨基酸的液体培养基作为对照,37 ℃培养3 d后,与对照相比,观察氨基酸脱羧酶培养基的颜色变化,判定菌株的脱羧酶活性。
1.2.7 菌株抑菌试验
通过牛津杯法[20]测定菌株抑菌活性。将获得的菌株接入MRS液体培养基中,于37 ℃培养24 h后在9 000 r/min离心10 min,获得上清液,于4 ℃保存备用。选择沙门氏菌(Salmonella)、金黄色葡萄球菌(Staphylococcus aureus)和大肠杆菌(Escherichia coli)作为指示菌株,依次接种至NB、MRS及LB液体培养基,于37 ℃活化培养24 h,各取100 μL菌液于相应固体培养基上涂布,插入无菌牛津杯,注入200 μL菌株上清液,等体积注入空白MRS液体培养基作对照,于37 ℃培养12 h后测量抑菌圈的直径。试验测定均重复3次。
1.2.8 氨基酸测定方法
1.2.8.1 氨基酸的定性测定
以质量浓度1 g/L的氨基酸标准液为对照,使用毛细管点样,点样间距1 cm,点样量2 μL,点样后用吹风机吹干,展开剂:V(异丙醇)∶V(甲酸)∶V(水)=40∶2∶10;显色剂:5.0 g/L茚三酮。展开结束置于85 ℃干燥箱中显色5 min。
1.2.8.2 氨基酸的定量测定
取1组具塞刻度试管,按表1依次加入试剂后密封试管口,于涡旋振荡器混匀,在沸水浴中加热15 min,冷却后加体积分数60%乙醇定容至20 mL,测定溶液OD 570 nm值,对应亮氨酸浓度绘制标准曲线。试验测定均重复3次。
表1 氨基酸标准曲线配制表
Table 1 Amino acid standard curve preparation table

试管编号123456亮氨酸标准液/mL0.00.51.01.52.02.5无氨蒸馏水/mL2.52.01.51.00.50.0水合茚三酮/mL3.03.03.03.03.03.01 g/L抗坏血酸/mL0.10.10.10.10.10.1游离氨基氮含量/μg0.00.51.01.52.02.5
使用Excel软件进行数据统计,采用SPSS 22.0软件进行显著性分析,采用GraphPad Prism 5.0软件进行绘图,MEGA 7.0软件绘制系统进化树。
TLC常被用于氨基酸成分的定性分析,简便、快速、灵敏度高[21-22],可依据不同极性的物质在层析板上展开条带的差异进行定性分析,展开剂的选择对条带展开效果的影响较大[23]。本研究采用V(异丙醇)∶V(甲酸)∶V(水)=40∶2∶10混合溶液作为展开剂,层析板上条带显色情况如图1。
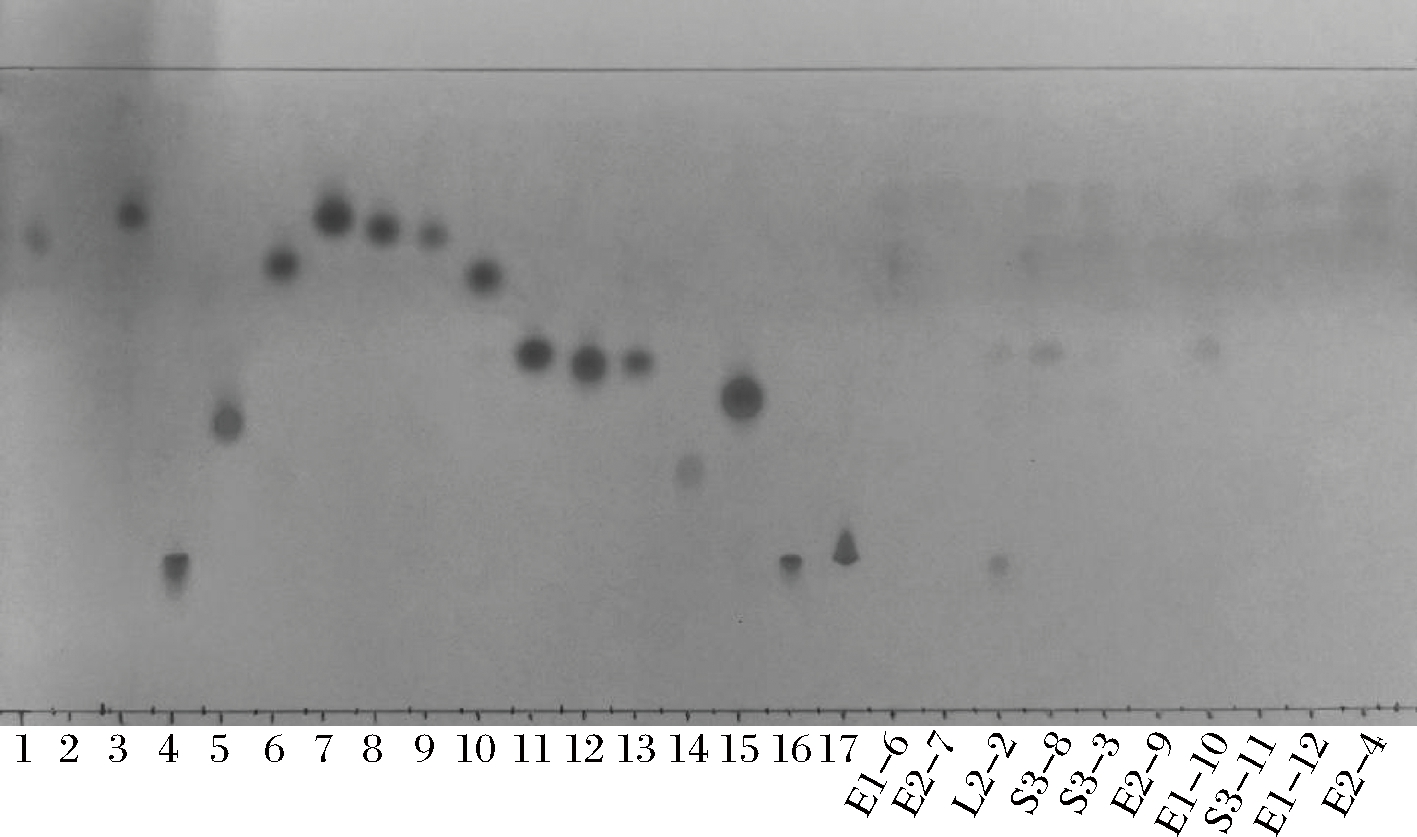
1-17依次表示:L-酪氨酸(Tyr)、L-甘氨酸(Gly)、L-色氨酸(Trp)、L-组氨酸(His)、L-脯氨酸(Pro)、L-甲硫氨酸(Met)、L-亮氨酸(Leu)、L-异亮氨酸(Ile)、L-苯丙氨酸(Phe)、L-缬氨酸(Val)、L-丙氨酸(Ala)、L-苏氨酸(Thr)、L-谷氨酸(Glu)、L-天冬氨酸(Asp)、L-丝氨酸
(Ser)、L-赖氨酸(Lys)、L-精氨酸(Arg) 图1 分离菌株上清液中氨基酸组成
Fig.1 Amino acid composition in isolated strains supernatant
除L-甘氨酸(Gly)外,16种氨基酸标准品展开效果较好,条带显色清晰,说明展开剂选择适宜;菌株上清液中明显展开1 ~ 3种氨基酸,说明该展开剂能够有效定性菌株上清液中氨基酸成分,其中E1-6、L2-2、S3-3、S3-8、E1-10和E2-4菌株上清液中呈现条带个数≥2,表明这几株菌的氨基酸组成更丰富。氨基酸标准品及各菌株显色条带的比移值(retention factor value, Rf)如表2所示。
表2 氨基酸标准品及分离菌株上清液中氨基酸的Rf值
Table 2 Rf values of amino acid standards and amino acids of isolated strains supernatant
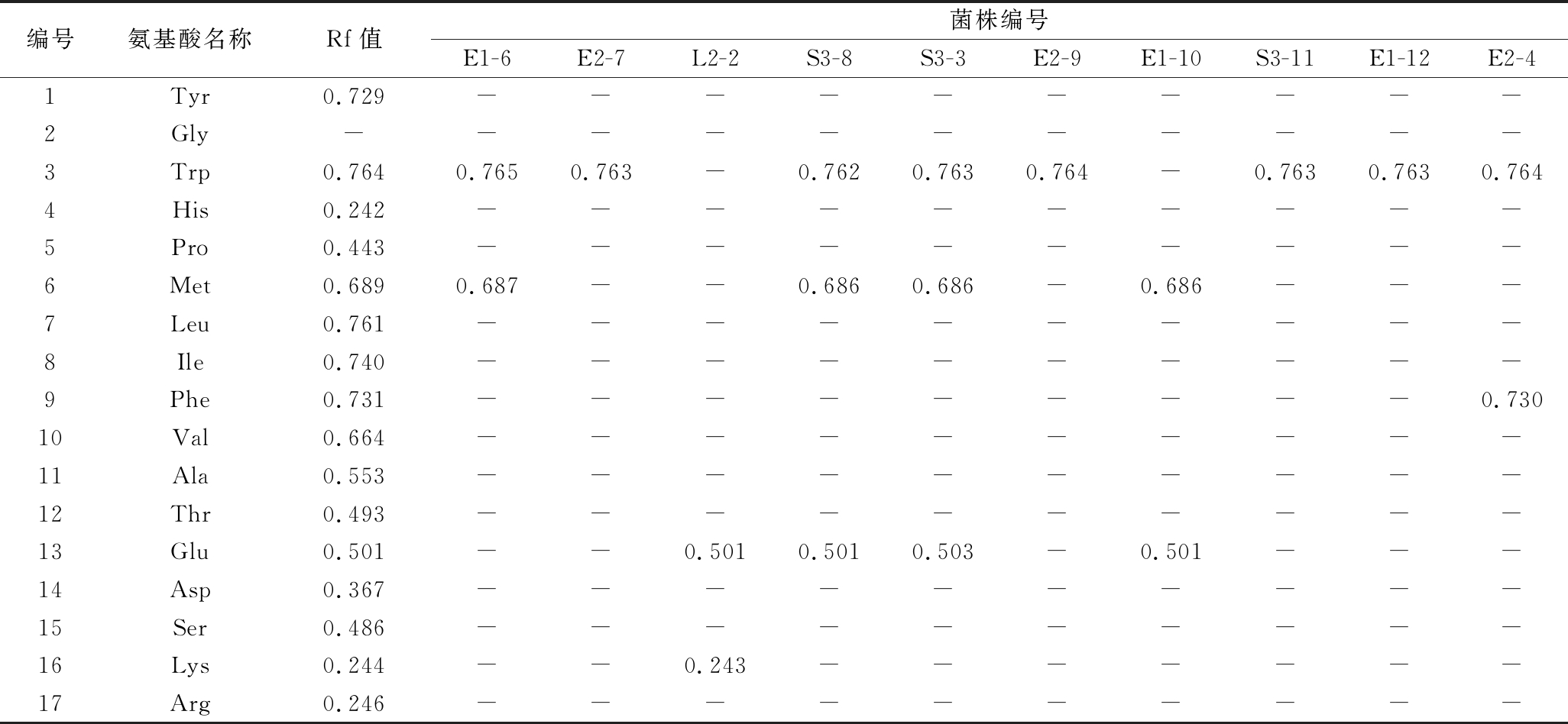
编号氨基酸名称Rf值菌株编号E1-6E2-7L2-2S3-8S3-3E2-9E1-10S3-11E1-12E2-41Tyr0.729----------2Gly-----------3Trp0.7640.7650.763-0.7620.7630.764-0.7630.7630.7644His0.242----------5Pro0.443----------6Met0.6890.687--0.6860.686-0.686---7Leu0.761----------8Ile0.740----------9Phe0.731---------0.73010Val0.664----------11Ala0.553----------12Thr0.493----------13Glu0.501--0.5010.5010.503-0.501---14Asp0.367----------15Ser0.486----------16Lys0.244--0.243-------17Arg0.246----------
注:“-”表示菌株上清液中不含该种氨基酸
2.2.1 氨基酸标准曲线
依照1.2.8.2方法,测定不同浓度亮氨酸标准液在反应后的OD570 nm值,绘制得到标准曲线,回归方程为:y=0.0532 x+0.001 2,R2=0.996 4。
2.2.2 菌株上清液中游离氨基氮总量的测定
采用茚三酮比色法测定菌株上清液中的游离氨基氮总量,该方法成本低、重复性好[16, 24],测得反应后溶液的OD 570 nm值,根据2.2.1中氨基酸标准曲线计算各菌株上清液中游离氨基氮总量,结果如图2所示。
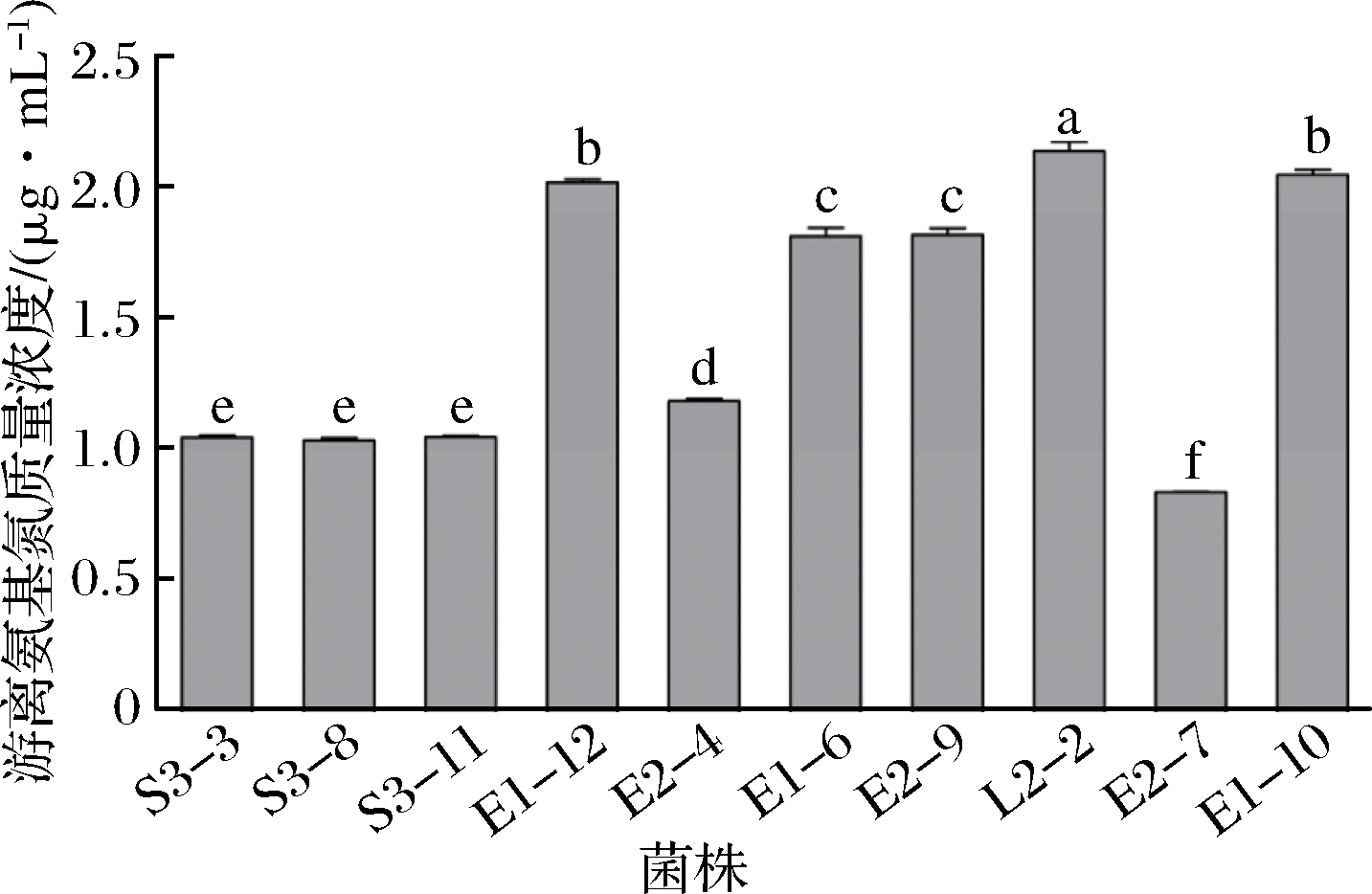
图2 分离菌株上清液中游离氨基氮含量
Fig.2 Free amino nitrogen content in isolated strains supernatant
注:不同小写字母表示具有显著性差异(P<0.05)(下同)
菌株L2-2上清液中氨基氮总量显著高于其他菌株(P<0.05);菌株E1-10和E1-12上清液中氨基氮总量次之(P<0.05),均显著高于其他菌株,这与TLC结果一致,说明该方法虽不能明确区分菌株上清液中含有氨基酸的种类,但能够快速准确对其氨基酸成分进行定量分析,有效提高了菌株筛选的效率[16, 24]。由此选择菌株L2-2进行下一步加工特性试验。
对菌株L2-2的基因序列进行PCR扩增,扩增得到的片段约1 500 bp,回收该菌株的PCR扩增产物上机测序,并获得该菌株的序列文件。测序获得菌株的序列通过BLAST进行同源性比对,提取相似度≥99%以上的相关比对序列及模式菌株序列,采用MEGA 7.0软件中NJ法构建系统发育树。如图3所示,菌株L2-2与清酒乳杆菌模式菌株(Lactobacillus sakei subsp. sakei strain ATCC 15521 176)聚类在一起,与清酒乳杆菌(L. sakei)同源性达到99%。因此,菌株L2-2鉴定为清酒乳杆菌;在GenBank提交序列信息获得基因登录ID号MK592808.2。
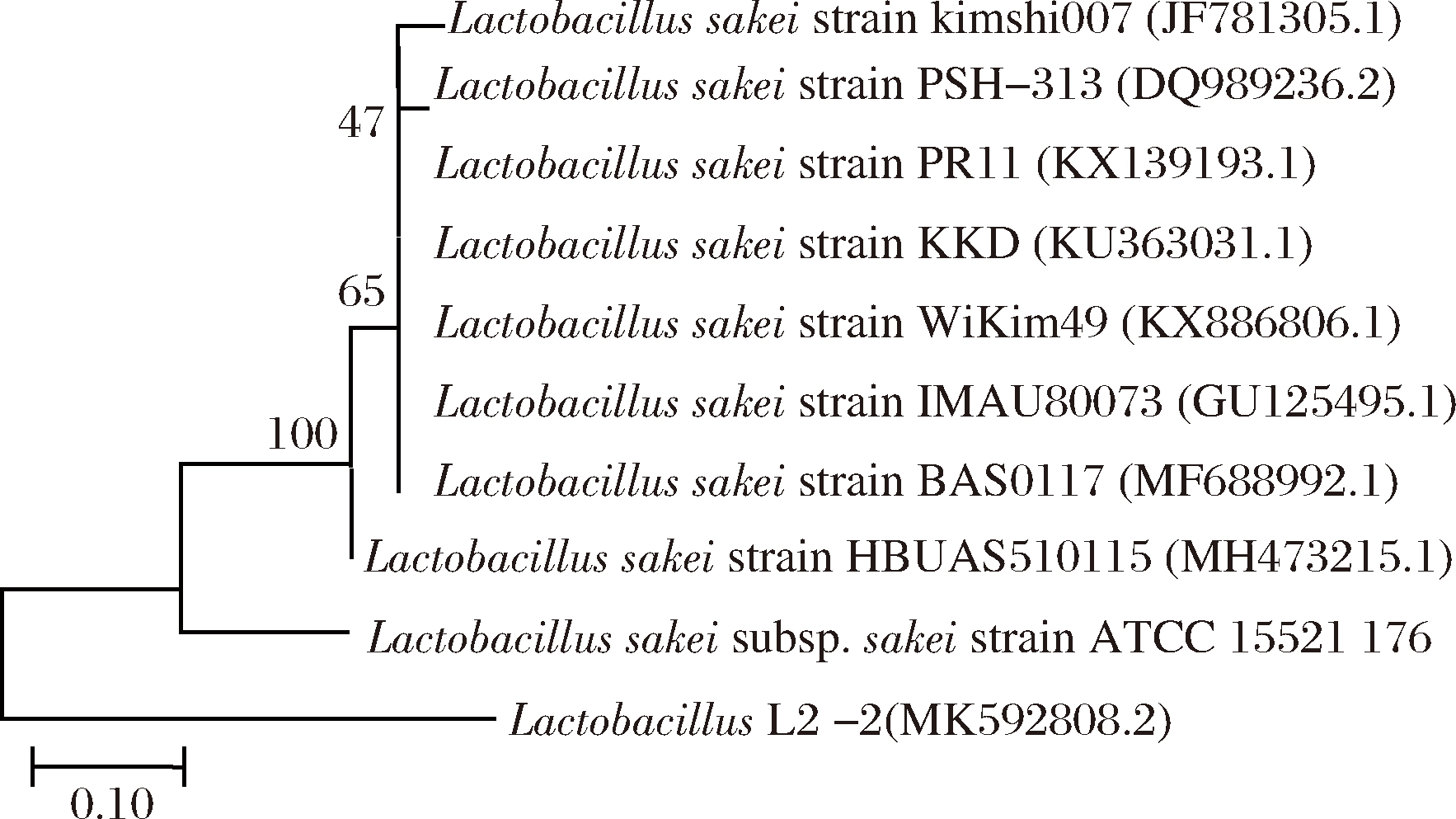
图3 L2-2菌株16S rRNA系统发育树
Fig.3 16S rRNA phylogenetic tree of L2-2 strain
传统臭鳜鱼制品的需盐量通常为4%~5%(质量分数),不同的盐浓度对发酵过程中鱼肉蛋白降解程度有差异,并影响其氨基酸风味品质[25]。为确保菌株在鱼肉发酵过程中发挥作用,考察菌株的耐盐性是评价其是否适应加工工艺的指标之一[26]。如图4所示,菌株L2-2的生长与NaCl质量浓度成反比,与正常生长菌株L2-2相比,NaCl质量浓度为4~8 g/100 mL时,其生长活力显著降低(P<0.05);当NaCl质量浓度大于8 g/100 mL,菌株L2-2生长抑制趋于稳定(P>0.05)。BEGANOVIC等[27]对筛选到的菌株进行4%~6% NaCl的耐盐试验,指出优良菌株的OD600 nm值在0.4~0.6之间。本研究中,菌株L2-2在质量浓度为4 g/100 mL的NaCl下,生长活力保持较好,OD 600 nm为(0.64±0.05),符合优良耐盐菌株的标准[27],表明该菌株能够适宜臭鳜鱼加工需盐量且维持较好活力。

图4 菌株L2-2在不同NaCl浓度中的生长活力
Fig.4 The growth activity of L2-2 strain in different sodium chloride concentration
研究表明游离氨基酸在发酵过程中易被微生物产生的特定脱羧酶脱羧形成生物胺,而氨基酸脱羧酶呈阴性的菌株则能够大大降低发酵制品中生物胺的含量,提高产品的安全性[28]。为确保臭鳜鱼制品的安全食用性,对菌株L2-2的氨基酸脱羧酶的活性进行评价。
如表3所示,菌株L2-2精氨酸脱羧酶呈阳性,表明L2-2可能利用精氨酸脱羧产生鲱精胺,作为形成多胺的中间产物之一;其酪氨酸、赖氨酸、鸟氨酸脱羧酶活性均呈阴性,表明其水解酪氨酸,脱羧赖氨酸产生酪胺、尸胺及直接利用鸟氨酸,分解形成腐胺的可能性较低。由此看出,L2-2菌株通过自身产生氨基酸脱羧酶并形成生物胺的可能性较小。
表3 L2-2菌株的氨基酸脱羧酶活性
Table 3 Amino acid decarboxylase activity of L2-2 strain

氨基酸脱羧酶试验培养基颜色试验结果精氨酸脱羧酶紫色+赖氨酸脱羧酶黄色-鸟氨酸脱羧酶黄色-酪氨酸脱羧酶黄色-
注:“+”表示反应结果呈阳性,“-”表示反应结果呈阴性
臭鳜鱼的制作是经自然环境发酵,存在产生腐败致病菌的风险,评价获得菌株的抑菌特性是确保菌株安全应用于臭鳜鱼加工制作的重要指标之一。菌株L2-2属于乳酸菌,在生长过程中产生的一些细菌素能够抑制腐败菌及致病菌[29]。
挑选发酵食品中常用于抑菌试验的食源性致病菌,且能作为革兰氏阳性菌和革兰氏阴性菌的代表菌株[13],分别为Salmonella、E. coli和S. aureus。由表4可知,菌株L2-2对E. coli及S. aureus具有一定抑制作用,抑菌圈直径分别为8.13和7.58 mm,显著高于其对Salmonella的抑制作用(P<0.05)。这与前人等[30-31]研究报道相一致,可以确保菌株L2-2在臭鳜鱼发酵过程中使用的安全性。
表4 L2-2菌株的抑菌活性
Table 4 Antibacterial activity of L2-2 strain

菌株编号抑菌圈直径/mm沙门氏菌大肠杆菌金黄色葡萄球菌L2-25.15±0.35b8.13±0.35a7.58±0.99a
注:不同小写字母表示具有显著性差异(P<0.05)
本研究采用传统微生物培养技术从臭鳜鱼中分离得到10株细菌,经复筛得到1株产游离氨基氮总量最高的菌株L2-2,经16S rRNA序列分析鉴定为清酒乳杆菌,具有良好特性,能够适应传统发酵臭鳜鱼制品现有生产环境条件。此研究为传统臭鳜鱼制品风味菌株的筛选,及解决自然发酵臭鳜鱼制品安全性提供了理论依据。
[1] 李春萍.臭鳜鱼发酵中营养和风味变化的研究[D].杭州:浙江工商大学,2013.
[2] 吴晓伟,郭爱平.传统徽菜臭鳜鱼的创新与传承保护[J].美食研究,2016,33(1):50-53.
[3] 吴永祥,俞昌浩,王婷婷,等.传统发酵臭鳜鱼的研究概述[J].食品与发酵工业,2019,45(19):299-306.
[4] 周迎芹,鄢嫣,殷俊峰,等.发酵方式对黄山臭鳜鱼菌群组成及挥发性物质的影响[J].肉类研究,2019,33(10):36-43.
[5] 王蔚新.酸鱼发酵过程中蛋白质降解及其风味形成机制研究[D].无锡:江南大学,2017.
[6] 苗晓丹,刘源,仇春泱,等.呈味肽构效关系研究进展[J].食品工业科技,2014,35(6):357-363.
[7] 李燕.黄山臭鳜鱼发酵过程中微生物多样性的研究[D].杭州:浙江工商大学,2014.
[8] WU R,YU M L,LIU X Y,et al.Changes in flavour and microbial diversity during natural fermentation of suan-cai, a traditional food made in Northeast China[J].International Journal of Food Microbiology,2015,211:23-31.
[9] 高江婧,任聪,刘国英,等.浓香型白酒酒醅风味物质和微生物菌群结构随发酵时间的变化规律[J].食品与发酵工业,2019,45(20):1-6.
[10] XIAO S Y,XIONG T,PENG Z,et al.Correlation between microbiota and flavours in fermentation of Chinese Sichuan Paocai[J].Food Research International,2018,114:123-132.
[11] 洪家丽,李秋艺,潘雨阳,等.红曲黄酒传统酿造过程挥发性风味组分及微生物菌群多样性分析[J].食品科学,2019,40(12):137-144.
[12] 杨培周,钱静,姜绍通,等.臭鳜鱼的质构特性、特征气味及发酵微生物的分离鉴定[J].现代食品科技,2014,30(4):55-62.
[13] 罗靓芷,武俊瑞,刘佳艺,等.臭鳜鱼中优良乳酸菌的分离筛选与鉴定[J].食品与发酵工业,2013,39(10):132-136.
[14] DEVI K R,DEKA M,JEYARAM K.Bacterial dynamics during yearlong spontaneous fermentation for production of Ngari,a dry fermented fish product of Northeast India[J].International Journal of Food Microbiology,2015,199:62-71.
[15] 杜丹,解修超,邓百万,等.谢村黄酒酒曲微生物多样性分析及产γ-氨基丁酸能力的初步研究[J].食品与发酵工业,2019,45(19):144-150.
[16] 曾志恒,曾辉,程翊,等.双孢蘑菇发酵液氨基氮含量测定方法的研究[J].食用菌,2019,41(5):77-80.
[17] AMMOR S,DUFOUR E,ZAGOREC M,et al.Characterization and selection of Lactobacillus sakei strains isolated from traditional dry sausage for their potential use as starter cultures[J].Food Microbiology,2006,22(6):529-538.
[18] NIETO-ARRIBAS P,POVEDA J M,SESENA S,et al.Technological characterization of Lactobacillus isolates from traditional Manchego cheese for potential use as adjunct starter cultrules[J].Food Control,2009,20(12):1 092-1 098.
[19] 曾雪峰,夏文水.湘西传统酸鱼中乳酸菌的分离及特性研究[J].食品与发酵工业,2012,38(12):40-44.
[20] 佘之蕴,黄宝莹,刘海卿,等.牛津杯法测定食品添加剂对五种益生菌的抑菌活力[J].食品工业,2016,37(1):171-174.
[21] 刘世军,张雪原,唐志书,等.大枣中氨基酸类成分的薄层色谱分析[J].生物资源,2018,40(5):466-470.
[22] 陆冰真,翟永兴.薄层层析法在食品分析中的应用[M].北京:北京大学出版社,1991,64-74.
[23] 陆正清.薄层层析法测定调味品中氨基酸含量综述[J].中国调味品,2005(7):42-47.
[24] 刘长姣,杨越越,王妮,等.茚三酮比色法测定秋葵中氨基酸含量条件的优化[J].中国食品添加剂,2018(1):187-193.
[25] 李成龙,袁军,刘淑贞,等.米粉及食盐添加量对发酵酸肉蛋白质降解及γ-氨基丁酸形成的影响[J].食品科学,2015,36(13):202-206.
[26] 褚福娟,孔保华,黄永.发酵肉制品常见乳酸菌的发酵性能研究[J].肉类研究,2009,23(6):16-20.
[27] BEGANOVIC J,KOS B,LEBOS PAVUNC A,et al.Traditionally produced sauerkraut as source of autochthonous functional starter cultures[J].Microbiological Research,2014,169(7-8):623-632.
[28] 翟磊,凌空,宋振,等.哈萨克传统发酵食品中乳酸菌的分离鉴定及代谢特性研究[J].食品与发酵工业,2017,43(7):122-127.
[29] AMMOR M S,MAYO B.Selection criteria for lactic acid bacteria to be used as functional starter cultures in dry sausage production: An update[J].Meat Science,2007.76(1):138-146.
[30] 何煜波.香肠发酵乳杆菌的基本特性[J].肉类工业,2002(6):22-26.
[31] SCHILLINGER U,LUCKE F K.Antibacterial activity of Lactobacillus sake isolated from meat[J].Applied and Environmental Microbiology,1989,55(8):1 901-1 906.