柑橘是我国南方的第一大宗水果,其中柚类是柑橘属中比较耐贮藏的种类。井冈蜜柚是江西省吉安市地理标志品种,2015年井冈蜜柚种植面积达到 23 000 hm2,投产面积1 666.7 hm2,总产2万t,产值达1.2亿元[1]。金兰柚(Citrus maxima (Burm.) Merr. cv. Jinlan Pomelo)属于井冈蜜柚晚熟系列品种,由于果实发育期较短,成熟期集中,鲜果销售压力巨大,生产上常通过适当贮藏来调节市场供给。研究表明,适宜的采收成熟度,因为果实发育充分,新陈代谢速率减弱,抗性物质有效积累,可以有效地降低果实的失重率和腐烂率[2-3],且适时采收的园艺产品在采收初期及贮藏期都表现出更好色泽[4-6]。李宏祥等[7-8]研究了不同采收成熟度的其他2种井冈蜜柚——桃溪蜜柚和金沙柚的贮藏特性,发现其腐烂率、失重率、色泽、风味、抗氧化性能等均表现出明显的差异,总体应当根据鲜食、短期贮藏或长期贮藏等目的选择合适的采收成熟度[7]。
评价贮藏品质的指标多种多样,利用主成分分析法(principle components analysis, PCA)可有效将评价指标降维,从而更加直观有效地提供数据参考。李俭等[9]通过PCA分析了南康不同柚子品种的果实外观和内在风味品质指标;牟红梅等[10]通过PCA对27种西洋梨的果实品质进行分析;林媚等[11]也通过PCA方法对浙江12个柑橘品种进行综合分析,从符合普通消费习惯和适合推广角度对12种柑橘进行了排名。
本试验以生产上常用的成熟度,盛花后158 d(成熟度Ⅰ)的金兰柚果实为对照,比较了盛花后173 d(成熟度Ⅱ)和188 d(成熟度Ⅲ)采收的金兰柚,在常温连续贮藏150 d内果实失重率、腐烂率、果皮色泽、总糖、总有机酸、可溶性糖和有机酸组分及含量等感官品质指标,以及总酚、DPPH清除率和铁离子还原/抗氧化能力(ferric reducing ability of plasma, FRAR)等抗氧化指标,并通过PCA综合评价了3个成熟度的果实品质,期望获得适宜的采收成熟度与上市期的最佳组合,为指导生产上市提供数据参考。
3个成熟度的金兰柚果实分别采于盛花后158 d(成熟度Ⅰ)、173 d(成熟度Ⅱ)和188 d(成熟度Ⅲ),采自江西省吉安市安福县张家冬兴果园(北纬27°38′55.22″,东经114°56′55.87″)。
福林酚(纯度97%),上海蓝季科技发展有限公司;没食子酸(纯度99%),天津市大茂化学试剂厂。糖标准品试剂:蔗糖(纯度99.5%)、葡萄糖(纯度99.5%)和果糖(纯度99%),上海阿拉丁生化科技股份有限公司;酸标准品试剂:草酸(99.99%)、酒石酸(纯度99%)、奎尼酸(纯度98%)、苹果酸(纯度98%)、抗坏血酸(纯度99.99%)和柠檬酸(纯度99.5%),上海阿拉丁生化科技股份有限公司。
LC-20A 高效液相色谱仪,日本岛津公司;MINOLTA CR-400 D65光源色差仪,日本柯尼卡美能达公司;Ball Mills MM 400研磨机,德国莱驰公司;UNIVERSAL 320R高速冷冻离心机,德国赫提驰科学仪器公司;UV-2600紫外分光光度计,日本岛津公司;KQ-500B超声波清洗器,昆山市超声仪器有限公司;DK-S28电热恒温水浴锅,上海精宏实验设备有限公司;JM-B6002电子天平,余姚市纪铭称重校验设备有限公司。
1.2.1 样品处理
挑选大小、成熟度一致,无病虫害的果实于当天运回实验室。在充分散失田间热后,清洗、晾干,用聚乙烯薄膜保鲜袋(0.05 mm, 25 cm×35 cm)单果包装,通风库室温(8~10 ℃)贮藏。试验样品每30 d采集一次。每次取12个大小均匀、健康的果实,平均分为3组,测定果实色差指数后,取果皮、果肉用液氮速冻,放置-80 ℃冰箱保存,随后进行果实品质相关生理生化指标检测。
1.2.2 果皮色差指数测定
采用色差仪分别对12个果实表面赤道部位对角4个方向测定果皮的L*、a*、b*、c*、H0值。L*表示亮度,值越大则样品表面越光亮;a*表示红绿色差,正值为红色,负值为绿色,绝对值越大,红色或绿色越深;b*表示黄蓝色差,正值为黄色,负值为蓝色,绝对值越大,黄色或蓝色越深。c*值为色饱和度,表示颜色的彩度,其值越大,颜色越纯。Ho表示色调角,当a*>0,b*>0时,Ho=tan-1(b*/ a*);当a*<0,b*>0时,Ho=180°+tan-1(b*/a*)。当Ho值在0°~90°时随着角度增大,颜色依次从紫红色(0°)、红色(22.5°)、橙红色(45°)、橙黄色(67.5°)到黄色(90°)渐变;Ho值在90°~180°时,颜色依次从黄绿色 (90°)、绿色 (135°) 到蓝绿色 (180°) 渐变。CCI表示着色指数,CCI>0为红色,CCI<0为蓝绿色,按公式(1)计算
(1)
1.2.3 失重率和腐烂率测定
随机选取33个果实,定期测单果重,计算失重率,重复3次。按公式(2)计算失重率,
失重率![]()
(2)
定期统计腐烂果个数,按公式(3)计算腐烂率,
腐烂率![]()
(3)
1.2.4 总糖和可滴定酸的测定
分别采用曹建康等[12]的蒽酮比色法和酸碱滴定法测定,结果以mg/g表示。
1.2.5 果实糖酸组分的提取与测定
果实糖、酸组分提取与测定参照胡志群等[13]和CHEN等[14]的方法。取4 g左右果肉样品,加入体积分数80%乙醇,35 ℃水浴20 min,室温下1 000 r/min离心15 min,重复提取3次,最后合并取上清液于25 mL容量瓶,并用体积分数80%乙醇定容至刻度线。取1 mL提取液于1.5 mL离心管经旋转蒸干,加入1 mL经过滤抽气的超纯水溶解,之后用直径13 mm,孔径0.44、0.22 μm的水系滤头过滤,其中用孔径0.22 μm过滤的滤液用于有机酸酸的测定,孔径为0.44 μm过滤的滤液用于可溶性糖的测定。
糖组分测定的色谱条件为: 色谱柱Waters Spherisorb® 5 μm NH2 4.6×250 mm Analytical Column;柱温30 ℃;流动相为V(乙腈)∶V(水)=85∶15;检测池温度35 ℃;流速0.8 mL/min; 进样量10 μL;RID示差检测器检测。使用外标法进行定量分析。
酸组分测定的色谱条件为:色谱柱YMC-PacK ODS-AQ (250×4.6 mml.D. S-5 μm, 12 nm);柱温30 ℃;流动相0.01 mol/L硫酸(pH=2.6),流速0.5 mL/min;进样量10 μL;二极管阵列检测器检测。使用外标法进行定量分析。
1.2.6 总酚提取和测定
总酚提取参照文献[15]的方法;总酚含量测定参照FOLIN-CIOCALTEU比色法测定方法略有改动[16]。分别取250 μL各部位提取液于10 mL离心管中,加入超纯水750 μL,摇匀,再加1.0 mL福林酚试剂,充分振荡,暗处放置5 min,加入1 mL 50 g/L Na2CO3溶液,充分混合后,室温放置60 min,于765 nm处测吸光值。
1.2.7 DPPH自由基清除测定
提取参照BRAND-WILLIAMS等[17]的方法,测定参照YAMAGUCHI等[18]的方法。
1.2.8 FRAP测定
提取方法同1.2.6,测定方法参照BENZIE[19]等的方法。
所有数据采用Excel进行统计处理,用SPSS 20.0统计软件对数据进行单因素方差分析显著性及主成分分析;采用Graphpad prism 8.0作图。
2.1.1 果实失重率和腐烂率的变化差异
采收成熟度不同的金兰柚果实,在常温贮藏150 d的过程中贮藏特性差异较为明显。每隔30 d定期检测果实的失重率和腐烂率,结果如图1所示。贮藏过程中3个采收期果实失重率均逐渐增加,但失重增加速率差异显著(图1-a),成熟度Ⅰ果实失重率最高,在贮藏150 d时达到最大值4.53%;成熟度Ⅱ果实失重率其次,贮藏终点时达3.45%;而成熟度Ⅲ果实失重率最低,贮藏150 d后失重率仅为2.78%。说明随着成熟度增加,果实失水失鲜程度逐渐降低,金兰柚适当晚采有利于果实保持水分及减少贮藏物质的消耗。
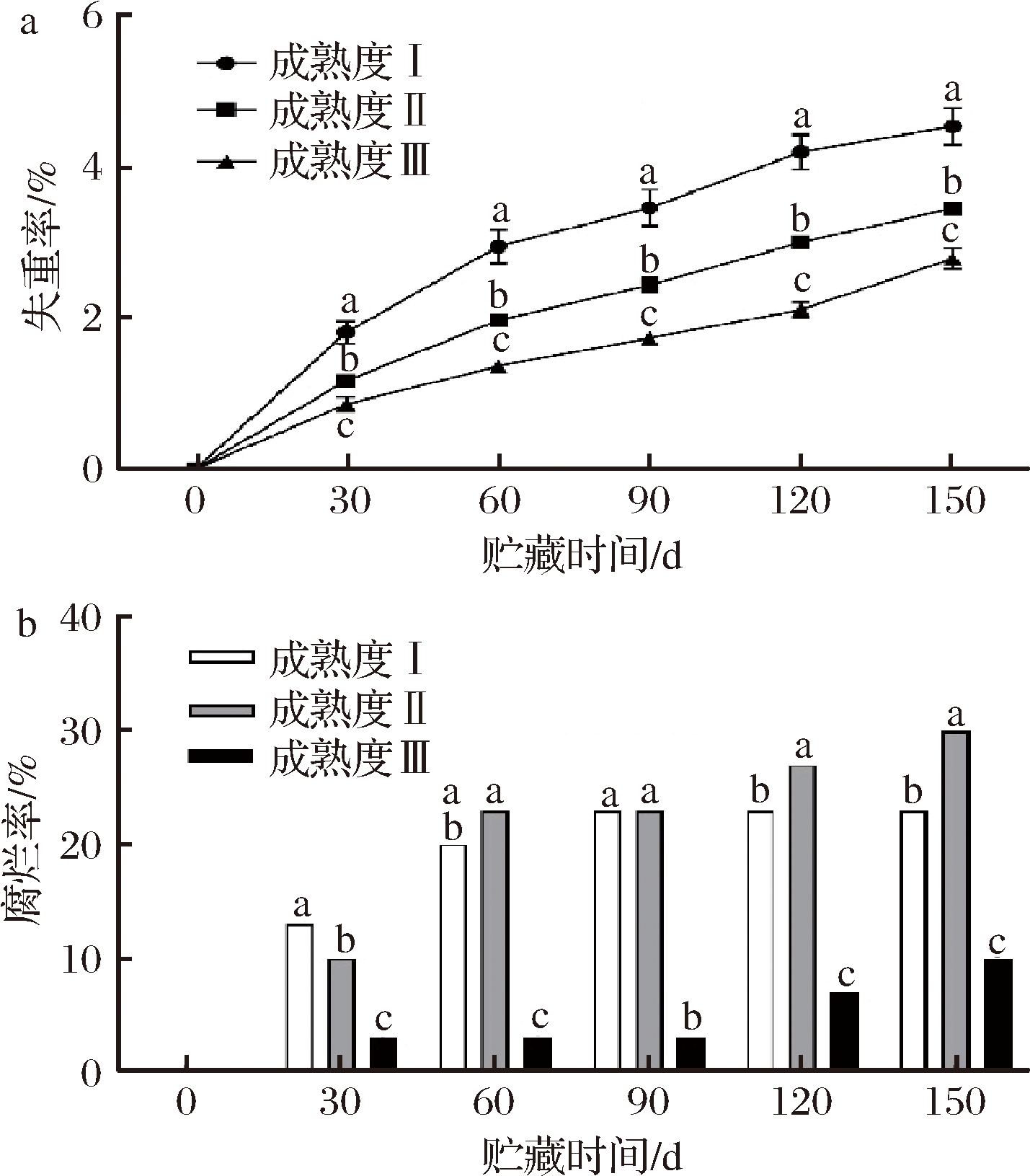
图1 不同成熟度金兰柚常温贮藏中果实失重率(a)、腐烂率(b) Fig.1 Weight loss rate (a) and decay rate (b) of Jinlan pomelo fruits with different maturities during storage at ambient temperature
注:折线图上不同小写字母表示同一贮藏时期各成熟度间
差异显著(P<0.05)(下同)
如图1-b所示,果实腐烂率与成熟度间无明显相关性。成熟度III的果实腐烂率最低,且在整个贮藏期均显著低于成熟度Ⅰ和Ⅱ,至贮藏150 d时仅为10%;成熟度Ⅱ果实腐烂率在贮藏30 d内显著低于成熟度Ⅰ,但在60~150 d内腐烂率最高或与成熟度Ⅰ腐烂率持平;成熟度Ⅰ腐烂率总体介于成熟度Ⅱ和III之间。在150 d时成熟度Ⅰ和Ⅱ的腐烂率分别为23%和30%。说明成熟Ⅲ较成熟度Ⅰ和Ⅱ的抗病性强,更耐采后腐烂。
2.1.2 果实着色的变化
金兰柚果实常温贮藏期间着色变化结果见图2。果实着色总体差异不大,3个采收成熟度都是由黄绿色转为浅黄色和黄色,成熟度Ⅰ转黄色最慢,60 d完全转黄;而成熟度Ⅱ、Ⅲ在30 d完全转黄。在60~90 d成熟度Ⅰ、Ⅲ着色整体观感上要好于成熟度Ⅱ,表现在果皮表面颜色更加鲜艳明亮,果实表面更加偏向黄色。
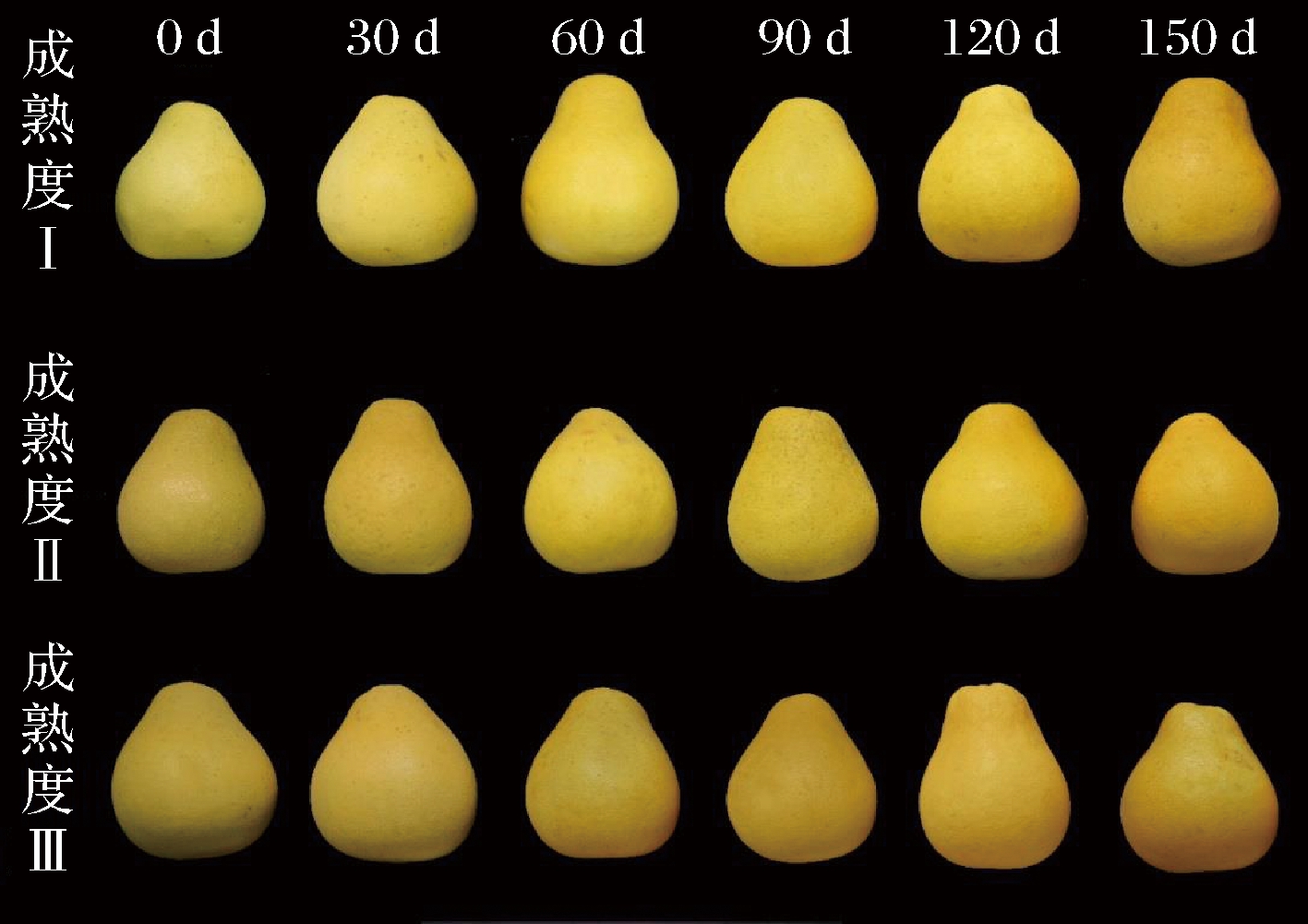
图2 不同成熟度金兰柚常温贮藏期间果皮着色情况
Fig.2 Peel color of Jinlan pomelo with different maturities during storage under ambient temperature condition
为了更精确衡量果实的着色情况,用色差计定期检测果实色差指数,结果如表1所示。
表1 不同成熟度金兰柚果实常温贮藏期间色差指数
Table 1 Citrus color index of Jinlan pomelo with different maturities during storage under ambient temperature condition
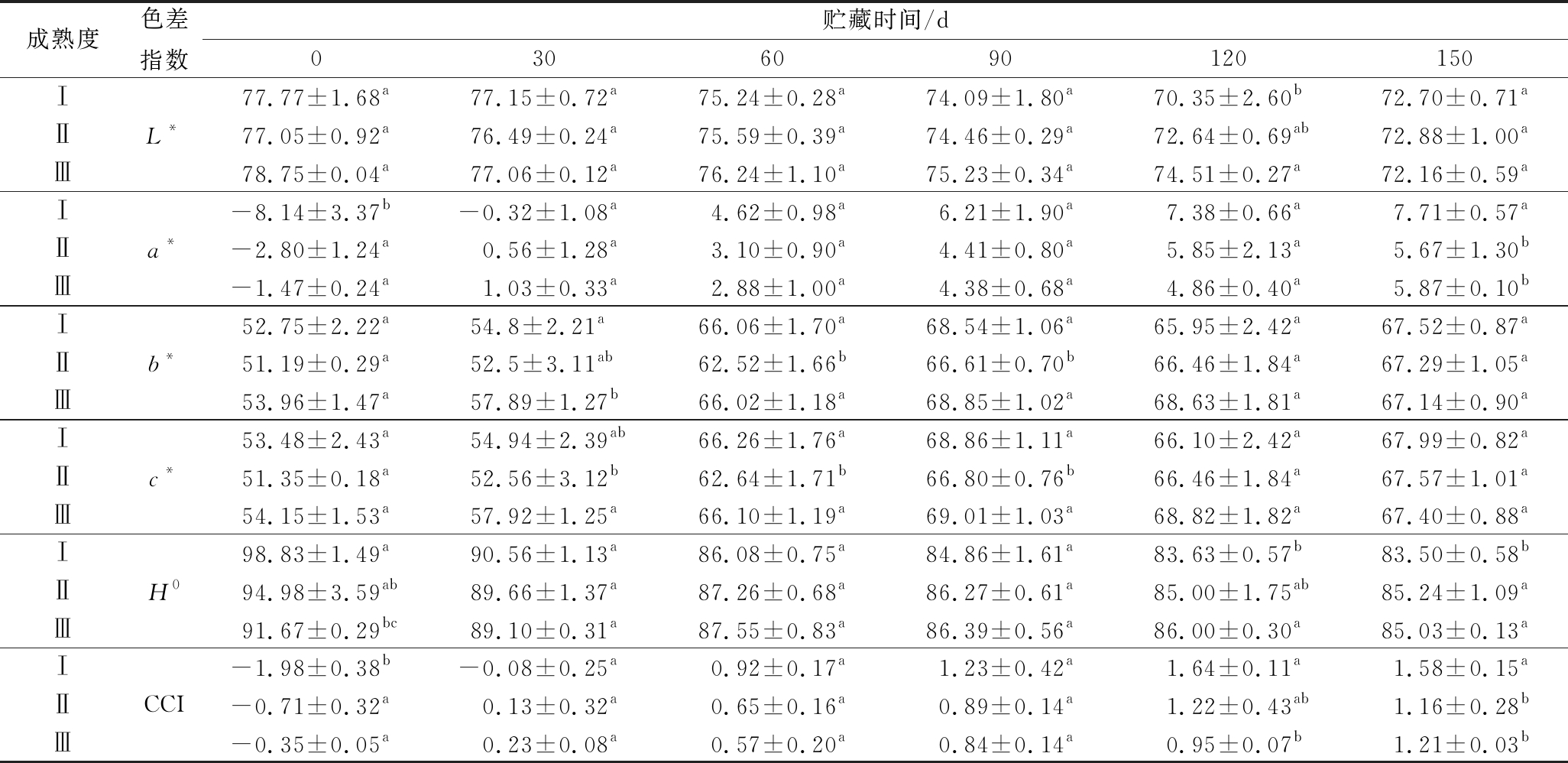
成熟度色差指数贮藏时间/d0306090120150Ⅰ77.77±1.68a77.15±0.72a75.24±0.28a74.09±1.80a70.35±2.60b72.70±0.71aⅡL*77.05±0.92a76.49±0.24a75.59±0.39a74.46±0.29a72.64±0.69ab72.88±1.00aⅢ78.75±0.04a77.06±0.12a76.24±1.10a75.23±0.34a74.51±0.27a72.16±0.59aⅠ-8.14±3.37b-0.32±1.08a4.62±0.98a6.21±1.90a7.38±0.66a7.71±0.57aⅡa*-2.80±1.24a0.56±1.28a3.10±0.90a4.41±0.80a5.85±2.13a5.67±1.30bⅢ-1.47±0.24a1.03±0.33a2.88±1.00a4.38±0.68a4.86±0.40a5.87±0.10bⅠ52.75±2.22a54.8±2.21a66.06±1.70a68.54±1.06a65.95±2.42a67.52±0.87aⅡb*51.19±0.29a52.5±3.11ab62.52±1.66b66.61±0.70b66.46±1.84a67.29±1.05aⅢ53.96±1.47a57.89±1.27b66.02±1.18a68.85±1.02a68.63±1.81a67.14±0.90aⅠ53.48±2.43a54.94±2.39ab66.26±1.76a68.86±1.11a66.10±2.42a67.99±0.82aⅡc*51.35±0.18a52.56±3.12b62.64±1.71b66.80±0.76b66.46±1.84a67.57±1.01aⅢ54.15±1.53a57.92±1.25a66.10±1.19a69.01±1.03a68.82±1.82a67.40±0.88aⅠ98.83±1.49a90.56±1.13a86.08±0.75a84.86±1.61a83.63±0.57b83.50±0.58bⅡH094.98±3.59ab89.66±1.37a87.26±0.68a86.27±0.61a85.00±1.75ab85.24±1.09aⅢ91.67±0.29bc89.10±0.31a87.55±0.83a86.39±0.56a86.00±0.30a85.03±0.13aⅠ-1.98±0.38b-0.08±0.25a0.92±0.17a1.23±0.42a1.64±0.11a1.58±0.15aⅡCCI-0.71±0.32a0.13±0.32a0.65±0.16a0.89±0.14a1.22±0.43ab1.16±0.28bⅢ-0.35±0.05a0.23±0.08a0.57±0.20a0.84±0.14a0.95±0.07b1.21±0.03b
注:不同小写字母表示同一列数据存在显著差异P<0.05(下同)
随着贮藏时间的延长L*值(亮度)一直减小,其中成熟度Ⅲ L*值在60~120 d内大于成熟度Ⅰ和Ⅱ,且在贮藏120 d时显著大于成熟度Ⅰ,与肉眼观测结果一致。贮藏过程中金兰柚a*值逐渐增大,并由负转正,这说明果实在贮藏中逐渐褪绿。贮藏0 d成熟度Ⅱ、Ⅲ的a*值显著高于成熟度Ⅰ,成熟度Ⅰ在60 d完成褪绿,成熟度Ⅱ、Ⅲ金兰柚于30 d褪绿。成熟度Ⅰ和Ⅲ b*值先增加后下降,且都在第90天达到最大值[(68.54±1.06)和(68.85±1.02)];成熟度Ⅱ b*值一直呈上升趋势,在150 d达到最大值(67.29±1.05)。贮藏60~90 d成熟度Ⅰ、Ⅲ b*值大于成熟度Ⅱ。说明成熟度Ⅰ、Ⅲ着色较成熟度Ⅱ更黄。3个成熟度金兰柚c*均逐渐增大,贮藏30~120 d成熟度Ⅰ、Ⅲ c*大于成熟度Ⅱ;3个成熟度H0值在贮藏中均呈下降的趋势,30 d后3个成熟度金兰柚H0值低于90°,果实由黄绿色转为黄色;60~150 d成熟度Ⅲ H0值最高,且在120~150 d成熟Ⅲ H0值显著大于成熟度Ⅰ,说明成熟度Ⅲ较成熟度Ⅰ和Ⅱ更黄。3个成熟度CCI由负值转向正值,说明果实色泽由蓝绿色慢慢转向红色;成熟度Ⅲ 120~150 d CCI值最小,且显著小于成熟度Ⅰ。金兰柚CCI值贮藏过程中逐渐增大,表明金兰柚贮藏后果实着色程度持续变好。
2.2.1 果实总糖、总有机酸含量和糖酸比的变化
糖酸含量及糖酸比共同决定了柑橘类果实的风味品质。3个成熟度的金兰柚果实常温贮藏过程中糖酸含量和糖酸比的变化检测结果如图3所示,总糖含量在整个贮藏期整体呈现下降趋势,且都在5.60%~7.30%。且成熟度Ⅱ总糖含量最低。在30~150 d成熟度Ⅲ总糖含量显著高于成熟度Ⅱ,且在60~90 d 3个成熟度总糖含量有显著差异,表现为:成熟度Ⅲ>成熟度Ⅰ>成熟度Ⅱ。金兰柚果实总有机酸含量表现为成熟度Ⅱ>成熟度Ⅰ>成熟度Ⅲ,整个贮藏期总有机酸含量都在0.38%~0.77%。如图3-b所示,在贮藏30~120 d,成熟度Ⅰ和Ⅱ的总有机酸含量显著高于成熟度Ⅲ;在150 d后成熟度Ⅱ的有机酸含量显著高于成熟度Ⅰ和Ⅲ。3个成熟度的金兰柚糖酸比在7.50~15.76。其中成熟度Ⅱ糖酸比最低。在0 d成熟度Ⅰ、Ⅲ的糖酸比显著高于成熟度Ⅱ,在贮藏30~120 d成熟度Ⅲ糖酸比均显著高于成熟度Ⅰ、Ⅱ,且基本维持在12左右,如图3-c所示。这说明成熟度Ⅲ金兰柚有较好的甜味口感。
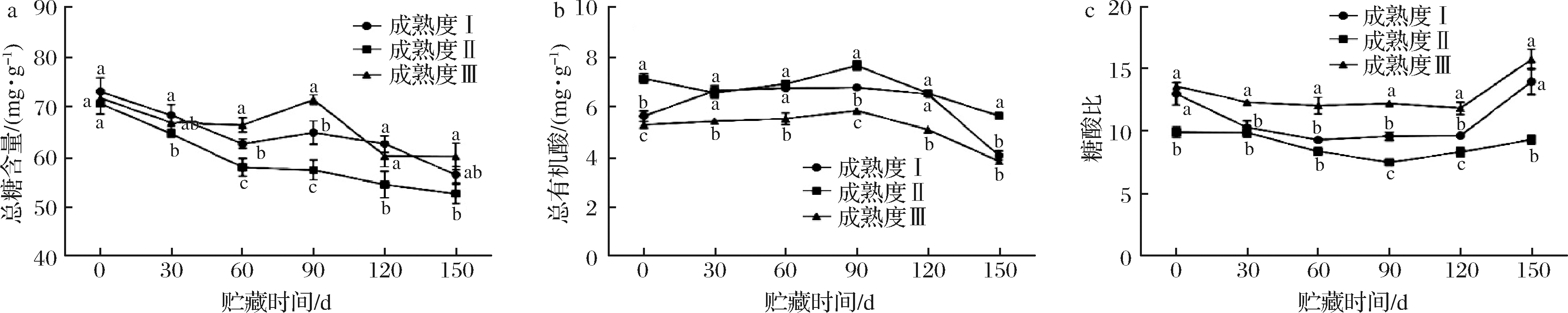
图3 不同成熟度金兰柚常温贮藏时果实总糖(a)、总有机酸含量(b)和糖酸比(c) Fig.3 Total sugar content (a), total organic acid content (b) and ratio of sugar/acid (c) of Jinlan pomelo fruits with
different maturities during storage under ambient temperature condition
2.2.2 果实糖组分的变化
贮藏过程中糖类物质相互转化,为了进一步了解不同采收期的金兰柚果肉中主要糖组分变化差异,本实验利用HPLC连续检测了果实常温贮藏150 d过程中3种可溶性糖含量的变化,包括蔗糖、葡萄糖和果糖,结果如图4所示。金兰柚可溶性糖主要以蔗糖为主,其质量分数最高达到42.60 mg/g,贮藏过程中呈现先下降后升高的趋势,贮藏90~150 d成熟度Ⅰ、Ⅲ蔗糖含量显著高于成熟度Ⅱ,在60~90 d成熟度Ⅲ蔗糖含量显著高于成熟度Ⅰ、Ⅱ(图4-a)。在贮藏60~150 d金兰柚单糖(果糖和葡萄糖)都呈显著的下降趋势,而双糖(蔗糖)含量则呈上升趋势,在贮藏60~120 d金兰柚果糖含量成熟度Ⅰ高于成熟度Ⅱ、Ⅲ,葡萄糖含量0~60 d 3个成熟度整体无明显差异,90~150 d成熟度Ⅲ高于成熟度Ⅰ、Ⅱ(图4-b和图4-c)。
2.2.3 果实酸组分的变化
为了进一步了解不同采收期的金兰柚果肉中主要酸组分变化差异,本实验利用HPLC连续检测了金兰柚果实常温贮藏150 d过程中的5种有机酸含量的变化,包括柠檬酸、苹果酸、草酸、奎尼酸和酒石酸,结果如图5所示。
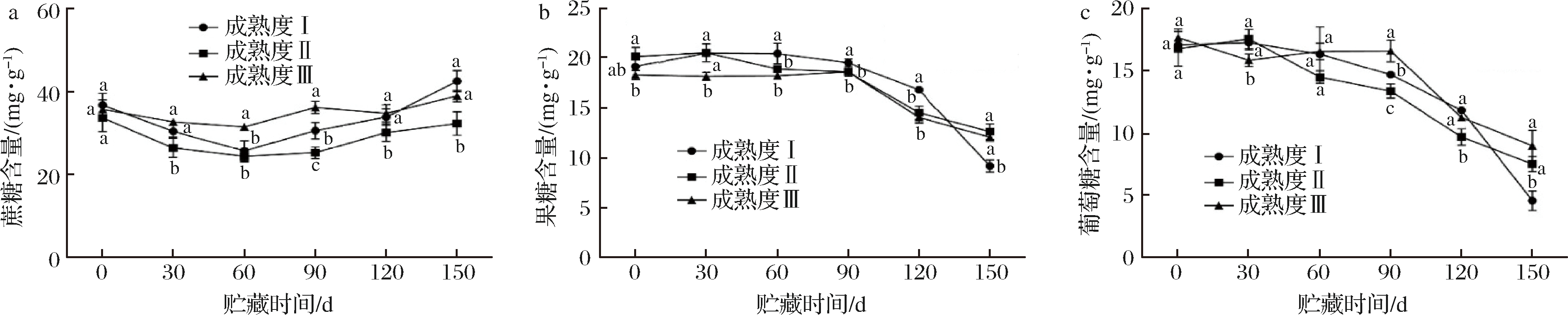
图4 不同成熟度金兰柚室温贮藏中果实蔗糖(a)、果糖(b)、葡萄糖(c)含量
Fig.4 Sucrose (a), fructose (b) and glucose (c) content of Jinlan pomelo with different maturities during storage
under ambient temperature condition

图5 不同成熟度金兰柚室温贮藏中果实柠檬酸(a)、奎尼酸(b)、苹果酸(c)、酒石酸(d)和草酸(e)含量
Fig.5 Citric acid (a), quinic acid (b), malic acid(c),tartaric acid(d) and oxalic acid(e) content of Jinlan pomelo fruits
with different maturities during storage under ambient temperature condition
金兰柚有机酸中以柠檬酸为主,其质量分数最高达到4.78 mg/g,最低为1.83 mg/g(图5-a),而其他有机酸含量均低于1.00 mg/g。成熟度Ⅰ中奎尼酸含量显著高于成熟度Ⅱ、Ⅲ,采收初期成熟度Ⅰ奎尼酸质量分数高达0.76 mg/g(图5-b)。苹果酸成熟度Ⅱ最高,呈现先升后降的趋势,且采收初期显著高于成熟度Ⅰ、Ⅲ;成熟度Ⅰ、Ⅲ苹果酸含量在贮藏期整体表现为上升趋势(图5-c)。酒石酸含量采收初期成熟度Ⅱ显著高于成熟度Ⅰ、Ⅲ,与苹果酸相似(图5-d)。成熟度Ⅲ中草酸含量显著低于成熟度Ⅰ、Ⅱ(图5-e)。总体而言,成熟度Ⅱ果实5种有机酸含量较高,成熟度Ⅲ果实5种有机酸含量最低。
2.3.1 果实总酚、抗坏血酸含量和DPPH自由基清除率、FRAP的变化
果实的氧化逆境是导致果实衰老的重要因素,抗氧化能力的强弱影响果实贮藏性,本实验进一步比较了3个采收成熟度的果实贮藏过程中抗氧化物质含量和自由基清除力的差异,如图6所示。
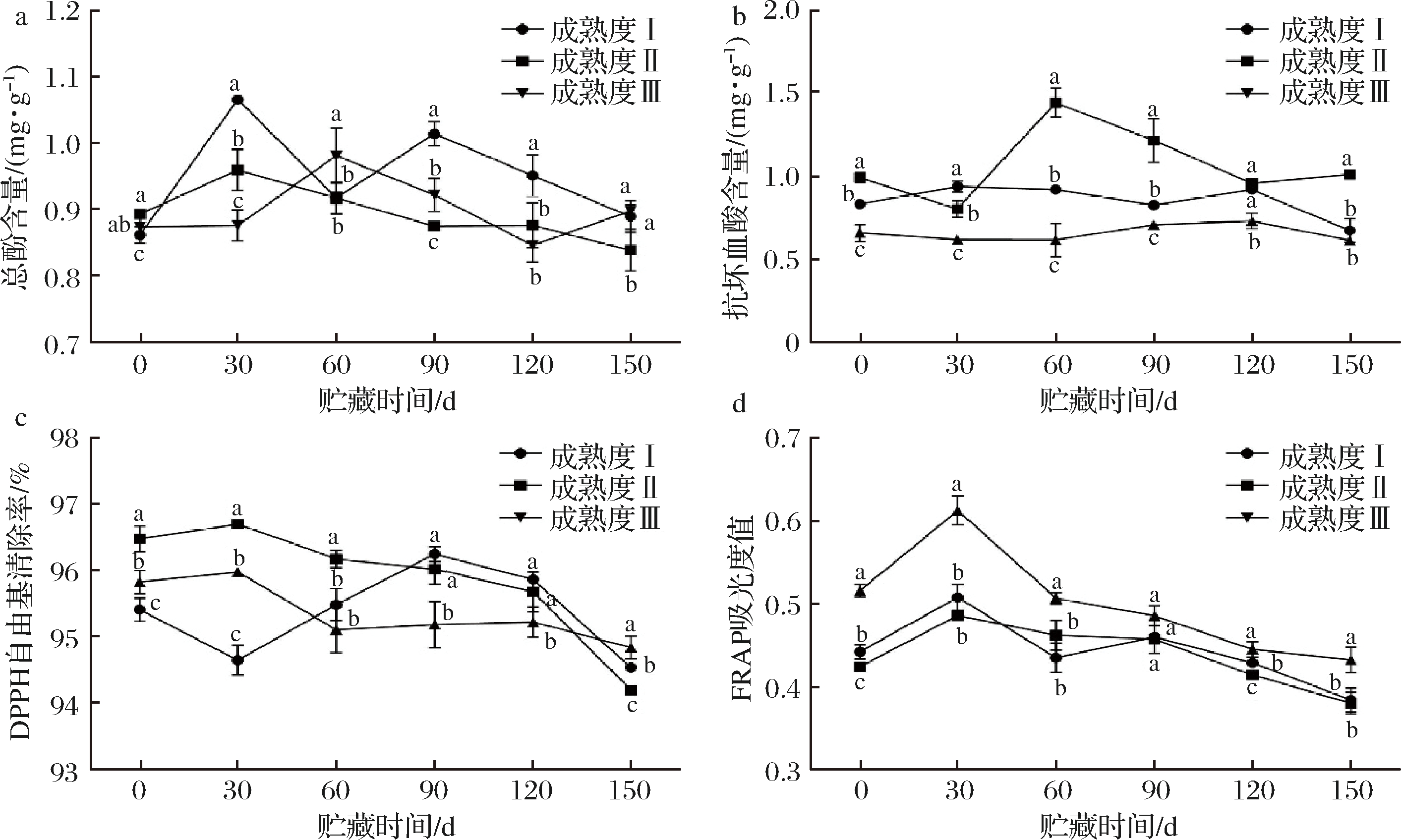
图6 不同成熟度金沙柚常温贮藏期间果肉总酚(a)、抗坏血酸含量(b)和DPPH自由基清除率(c)和FRAP(d) Fig.6 Contents of total phenol (a), ascorbic acid(b) and DPPH free radical scavenging rate (c), FRAP (d) of Jinlan pomelo
with different maturities during storage under ambient temperature condition
在贮藏30、90、120 d后,成熟度Ⅰ总酚含量显著高于成熟度Ⅱ和Ⅲ(见图6-a)。在0、60、90和150 d,成熟度Ⅱ抗坏血酸含量显著高于成熟度Ⅰ、Ⅲ,并且成熟度Ⅲ抗坏血酸含量在整个贮藏期都处于较低水平(图6-b)。贮藏前60 d成熟度Ⅱ DPPH自由基清除率显著大于成熟度Ⅰ、Ⅲ,贮藏90~120 d成熟度Ⅰ、Ⅱ大于成熟度Ⅲ(图6-c)。成熟度Ⅲ FRAP值在整个贮藏期都显著高于成熟度Ⅰ、Ⅱ,且在30 d达到最高(图6-d)。
为进一步明确不同成熟度对金兰柚贮藏品质及其风味的影响,利用SPSS 20.0对前文获得的18个有统计差异的数据指标进行主成分分析。如表2所示,经PCA提取的前4个主成分,其特征值均大于1,累计方差贡献率为86.825%,基本概括反映了所有变量的初始信息。因此,选用前4个主成分作为数据分析的有效成分。
表2 主成分的特征值和贡献率
Table 2 Eigenvalue of the principal components and theircontribution and cumulative contribution
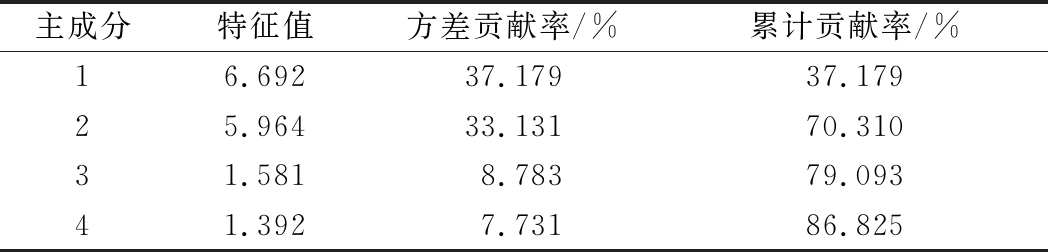
主成分特征值方差贡献率/%累计贡献率/%16.69237.17937.17925.96433.13170.31031.5818.78379.09341.3927.73186.825
由18个指标的载荷系数及特征值计算得到18个因子的特征向量(表3)。以特征向量为系数构建4个主成分的线性方程。
表3 主成分的载荷矩阵和特征向量
Table 3 Principal loading matrix and component eigenvectors

指标名称主成分1主成分2主成分3主成分4载荷系数特征向量载荷系数特征向量载荷系数特征向量载荷系数特征向量失重率0.3920.1520.7700.315-0.404-0.3220.1460.124腐烂率0.0390.0150.9240.378-0.270-0.2140.1060.090CCI值-0.382-0.148-0.663-0.2710.4860.3870.2850.242总酚0.3950.1530.0970.0400.6580.523-0.342-0.290DPPH清除率0.7070.2730.0300.012-0.246-0.1960.4120.349FRAP0.3230.1250.6730.2760.3300.2630.3260.276总糖0.3410.1320.8430.345-0.124-0.099-0.216-0.183果糖0.9180.3550.3600.1470.0840.067-0.040-0.034葡萄糖0.7520.2910.6390.2620.0510.0400.0150.013蔗糖-0.794-0.3070.3190.131-0.257-0.204-0.262-0.222总酸-0.927-0.3580.3420.1400.0320.0250.0110.009草酸-0.847-0.3270.3590.1470.0680.0540.2460.209酒石酸-0.084-0.0320.6630.2710.4890.3890.2340.199奎尼酸-0.379-0.146-0.255-0.104-0.139-0.1110.7750.657苹果酸-0.246-0.0950.8420.3450.3500.2780.0750.063抗坏血酸0.5580.216-0.607-0.248-0.132-0.105-0.027-0.023柠檬酸0.9330.360-0.135-0.0550.0960.0760.1990.168糖酸化-0.713-0.2760.6470.265-0.0440.076-0.080-0.068
将前4个主成分的方差贡献率(表2)作为系数代入,得到综合得分评价方程为:Y=0.371 79Y1+0.331 31Y2+0.087 83Y3+0.077 31Y4。将不同成熟度果实贮藏期的品质指标测定值标准化后代入到上述方程,计算不同采收期金兰柚在每个贮藏周期的综合得分Y,Y值越大代表综合品质越高,如图7所示。

图7 不同成熟度金兰柚在常温贮藏期间品质综合得分
Fig.7 The comprehensive quality scores of Jinlan pomelo with different maturities during storage under ambient temperature condition
3个成熟度的综合得分均随贮藏时间增加呈先增加达到最大值后下降趋势。成熟度Ⅰ贮藏期综合得分整体偏低,除30~90 d外,其他贮藏期综合得分都为负值。成熟度Ⅱ在30 d即达到最大值(1.93),并在贮藏60 d内均可保持较高的得分。而成熟度Ⅲ综合得分在整个贮藏期均明显高于成熟度Ⅰ和Ⅱ,说明成熟度Ⅲ的总体品质及耐贮性均优于其他2个采收期;此外,成熟度Ⅲ金兰柚综合得分在60 d达到最大值2.92,随后逐渐下降,直至贮藏90 d综合得分均大于0,说明成熟度Ⅲ果实可以长期贮藏达90 d左右,且在贮藏60 d前后出库上市品质最优。
适宜的采收成熟度有利于保持贮藏过程中果实的良好外观品质[7-8, 20-22]。不同采收成熟度的金兰柚失重率和腐烂率差异显著,在贮藏150 d内,盛花后188 d的金兰柚失重率和腐烂率最低,更耐贮藏。盛花后188 d,有较好果实表皮亮度;盛花后178、188 d比盛花后153 d更早褪绿,且果实色泽较好。
柑橘类果实的风味主要由糖酸含量及比例决定[23],其可溶性糖主要为蔗糖、葡萄糖和果糖,有机酸主要是柠檬酸和苹果酸及其他少量的奎尼酸、草酸、琥珀酸、丙二酸、富马酸等[24]。成熟的金兰柚可溶性糖以蔗糖为主,其含量在贮藏过程中先下降后上升,而果糖和蔗糖含量在贮藏90 d后急剧下降;有机酸以柠檬酸为主,盛花后188 d柠檬酸含量最低,且糖酸比约为12,显著高于其他2个成熟度。盛花后188 d的金兰柚风味最好。
采后贮藏过程中产生和积累过多的活性氧是诱导果实衰老的重要原因,果实成熟度、贮藏周期与抗氧化性表现出较强的相关性。抗坏血酸[25]、酚类物质可以有效地清除果实的自由基,提高果实的抗氧化性。较高的DPPH自由基清除率、和铁离子还原力对果实贮藏有着积极的作用[7, 26]。盛花后173和188 d的金兰柚总酚、抗坏血酸、DPPH自由基清除率及FRAP均显著高于盛花后158 d的果实,这2种成熟度的金兰柚,抗氧化性更强,更耐贮藏。
利用PCA综合分析18个指标发现,3个成熟度的果实在贮藏过程中的得分均先升后降,说明井冈蜜柚贮藏品质先优化后劣变,生产上需要将果实储存一段时间才能达到最佳食用品质。
综上所述,盛花后188 d金兰柚耐贮性、风味品质均表现最佳且有较强的抗氧化性。因此,推荐盛花后188 d为金兰柚最适采收成熟度,且贮藏60 d左右出库品质最优。
[1] 赵晓东, 戴祥生, 黄小英, 等.加快吉安市井冈蜜柚产业发展的思考与建议[J].中国果业信息,2017,34(2):14-15;19.
[2] 刘瑞莲, 张鸣飞, 许让伟, 等.采收时期对贮藏期温州蜜柑果实失水率的影响[J].浙江柑橘,2019,36(3):7-11.
[3] 陈楚英, 刘善军, 简火仔, 等.不同采收期对‘新余蜜桔’采后生理特性和耐贮性的影响[J].中国农学通报,2019,35(27):58-64.
[4] 阚超楠, 刘善军, 陈明, 等.不同采收期对‘翠冠’梨常温货架期果实色泽和质地的影响[J].江西农业大学学报,2018,40(1):49-55.
[5] 韦强, 黄漫青, 刘畅, 等. 采收成熟度对红色甜椒贮藏品质的影响[J]. 食品工业科技, 2015, 36(16):355-358;363.
[6] 周姣, 吴颖峰, 余伟, 等.新疆巴仁杏采收与贮运技术研究[J].食品研究与开发,2019,40(12):109-115.
[7] 李宏祥, 马巧利, 林雄, 等. PCA综合分析采收成熟度对金沙柚贮藏品质的影响[J].食品工业科技,2019(18):255-262;272.
[8] 李宏祥, 马巧利, 林雄, 等.采收成熟度对桃溪蜜柚贮藏品质及抗氧化性的影响[J].食品与发酵工业,2019,45(13):191-198.
[9] 李俭,周小娟,钟灶发,等.南康不同柚子品种果实品质分析[J].安徽农业科学,2019,47(14):216-219.
[10] 牟红梅,于强,李庆余,等.基于主成分分析的烟台地区西洋梨果实品质综合评价[J].果树学报,2019,36(8):1 084-1 092.
[11] 林媚,吴韶辉.浙江省12个柑橘品种果实品质分析与评价[J].浙江农业科学,2019,60(6):963-966.
[12] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社, 2007.
[13] 胡志群, 王惠聪, 胡桂兵.高效液相色谱测定荔枝果肉中的糖、酸和维生素C[J]. 果树学报,2005,22(5): 582-585.
[14] CHEN M, JIANG Q, YIN X R, et al.Effect of hot air treatment on organic acid and sugar-metabolism in Ponkan (Citrus reticulata) fruit [J]. Scientia Horticulturae,2012,147(4): 118-125.
[15] 张昭.中国地方柚果实酚类物质含量及其抗氧化活性分析[D].重庆:西南大学, 2015.
[16] 杜丹丹,李建科.Folin-Ciocalteu比色法测定石榴皮多酚含量条件的优化[J].西北农林科技大学学报(自然科学版),2011,39(5):190-196.
[17] BRAND-WILLIAMS W, CUVELIER M E, BERSET C. Use of a free radical method to evaluate antioxidant activity [J]. LWT-Food Science and Technology, 1995, 28(1): 25-30.
[18] YAMAGUCHI T, TAKAMURA H, MATOBA T, et al. HPLC method for evaluation of the free radical scavenging activity of foods by using 1,1-diphenyl-2-picrylhydrazyl [J]. Bioscience Biotechnology and Biochemistry, 1998, 62(6): 1 201-1 204.
[19] BENZIE I F, STRAIN J J. The ferric reducing ability of plasma (FRAP) as a measure of "antioxidant power": the FRAP assay [J].Analytical Biochemistry, 1996, 239(1): 70-76.
[20] 吴宝玉.不同采收期和贮藏方式的瓯柑品质变化研究[D].北京:中国农业科学院,2014.
[21] MARTIN L B B, ROSE J K C. There's more than one way to skin a fruit: formation and functions of fruit cuticles[J]. Journal of Experimental Botany, 2014, 65(16): 4639-4651.
[22] HE Y, HAN J, LIU R, et al. Integrated transcriptomic and metabolomic analyses of a wax deficient citrus mutant exhibiting jasmonic acid-mediated defense against fungal pathogens[J]. Horticulture Research, 2018, 5(1): 43.
[23] WU J X,XU Z L,ZHANG Y J,et al. An integrative analysis of the transcriptome and proteome of the pulp of a spontaneous late-ripening sweet orange mutant and its wild type improves our understanding of fruit ripening in citrus[J].Journal of Experimental Botany,2014,65(6): 1 651-1 671.
[24] 邓秀新, 彭抒昂. 柑橘学[M]. 北京: 中国农业出版社,2013.
[25] 倪伟, 盖瑞, 于文章,等.不同授粉组合对苹果果实ASA含量及抗氧化协同酶、糖酸组分动态变化的影响[J].果树学报,2017,34(6):670-681.
[26] 孟德梅, 奚志嫒, 张亚璇, 等.两种采收期香菇营养品质和抗氧化能力比较[J].中国食品学报,2018,18(4):228-234.