表1 试验研究用苹果品种
Table 1 Apple cultivars used in this study
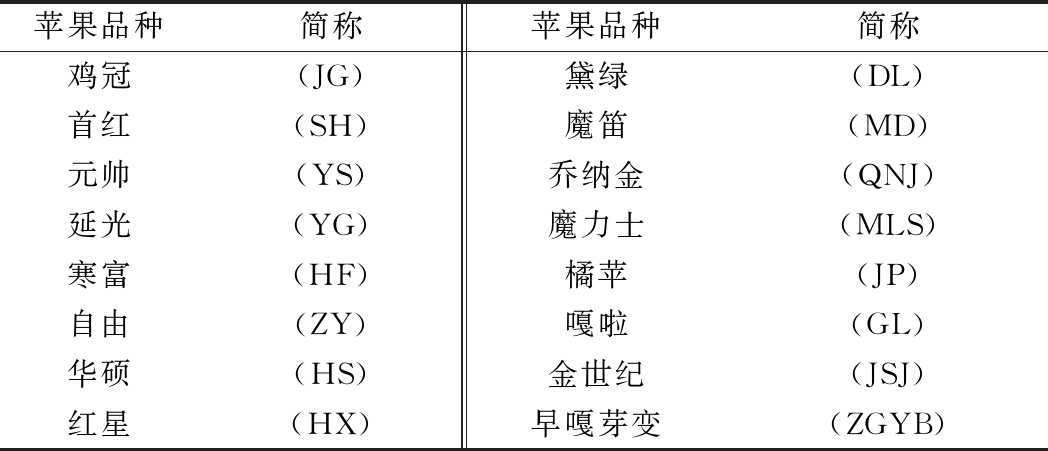
苹果品种简称苹果品种简称鸡冠(JG)黛绿(DL)首红(SH)魔笛(MD)元帅(YS)乔纳金(QNJ)延光(YG)魔力士(MLS)寒富(HF)橘苹(JP)自由(ZY)嘎啦(GL)华硕(HS)金世纪(JSJ)红星(HX)早嘎芽变(ZGYB)
中国的苹果产量居世界首位,苹果汁是其重要的加工制品之一,按照工艺不同可分为浓缩还原汁和非浓缩还原汁(包括鲜榨汁)两大类[1]。鲜榨苹果汁(fresh apple juice,FAJ)是由新鲜苹果直接压榨后灭菌制成的果汁,因其果汁口感还有营养价值接近鲜果而成为一种健康饮品和消费趋势,有巨大的市场需求和高昂的售价[2]。
目前,全球每年消耗超过1 600万t的果汁,鲜榨苹果汁的优势使它成为掺假的目标,市场中存在用浓缩汁加水复原(from concentrate,FC)代替鲜榨苹果汁或是在鲜榨苹果汁中掺入FC果汁进行销售的现象[3],因此,鲜榨苹果汁的真实性一直是政府机构关注的问题。同时消费者对食品的安全性和真实性的要求越来越高,为了确保公平的市场竞争并促进国际贸易,保障消费者的利益,急需开发一种能够检测鲜榨苹果汁真实性的技术。
但苹果汁真空浓缩过程中化学成分变化不大,传统物理和化学分析方法以及果汁的糖度、酸度、可溶性固形物、pH值等指标的对比也不能够轻易地区分鲜榨苹果汁与浓缩复原汁[4]。而近10年来稳定同位素技术已发展成为解决食品掺假问题的一个强有力的手段[5],某些同位素分析方法已经获得了美国分析化学师协会(Association of Official Agricultural Chemists, AOAC)及欧盟标准化委员会(Comité Européen de Normalisation, CEN)的认可(如ENV 12141 和 ENV 12142)[6-7]。同位素(isotope)指的是具有相同质子数和不同中子数的一类元素的总称,可以分为稳定性同位素和放射性同位素。稳定同位素分析法是一种对掺假果汁进行快速、准确鉴别的有效方法,鉴别果汁真实性经常用到的同位素是碳同位素、氢同位素和氧同位素[8-9]。许多研究[10-12]发现,果汁经过水分蒸发达到浓缩的目的,并会富集δD 和δ18O,在浓缩汁中加水还原后制成的果汁中δD 和δ18O 低于原来的果汁,并且这种果汁中δD 和δ18O与加水量呈负相关性关系;因此可以运用稳定氢氧同位素鉴别鲜榨苹果汁与浓缩复原果汁。此外δ13C值的应用研究表明[13-15],不同来源的多种糖组分其δ13C 值有一定的范围,且碳同位素比值不同,差值在 1‰以上就属于明显差别,所以利用δ13C 值可以判别鲜榨苹果汁中外源糖掺假的问题。
目前稳定同位素比率分析在我国食品科学领域应用较多,但在苹果鲜榨汁鉴伪上应用较少,除了牛丽影等[4]的研究还没有其他报道。本文以多个品种苹果为原料,在制备鲜榨汁、浓缩汁和掺假苹果汁的基础上,采用同位素比率质谱法(isotope ratio mass spectrometry,IRMS)对不同品种苹果鲜榨汁和掺假苹果汁的δD、δ18O、δ13C值进行了分析,通过同时使用水的δD,δ18O和外源糖中的δ13C来识别鲜榨苹果汁的掺假问题。本研究旨在建立一种通过IRMS识别鲜榨苹果汁的快速方法,从而为鲜榨苹果汁的可追溯性和真实性提供解决方案,对促进我国果汁出口也具有重要意义。
不同品种的苹果(表1),中国陕西白水现代苹果产业协同创新研究所;汇源苹果汁、荣士苹果汁,华润万家超市;其他果糖、葡萄糖和二糖、寡糖等均为分析纯,西安晶博生物科技有限公司。水取自西安长安区的自来水,经处理后符合国家标准(GB 5749-2006 生活饮用水卫生标准)。标准平均海洋水(standard mean ocean water,SMOW)的同位素丰度比值为 D/H=(155.76±0.10)×10-6;δ18O/δ16O=(2 005.20±0.43)×10-6。
表1 试验研究用苹果品种
Table 1 Apple cultivars used in this study

苹果品种简称苹果品种简称鸡冠(JG)黛绿(DL)首红(SH)魔笛(MD)元帅(YS)乔纳金(QNJ)延光(YG)魔力士(MLS)寒富(HF)橘苹(JP)自由(ZY)嘎啦(GL)华硕(HS)金世纪(JSJ)红星(HX)早嘎芽变(ZGYB)
WF-A2000榨汁机,浙江永康市伟丰电器厂;SC-3610高速离心机,安徽中科中佳科学仪器有限公司;N-1100旋转蒸发仪,上海爱朗仪器有限公司;微蒸馏装置,实验室自行安装[4];DLT-100 LGR液态水同位素分析仪,美国Los Gatos Research公司;HPLC-co-IRMS高效液相色谱仪、同位素比率质谱联用仪,美国Thermo Fisher Scientific公司。
1.3.1 FAJ的制备
每个品种取3~4个新鲜苹果来制备FAJ。将清洗、去核的苹果投入家用榨汁机中榨汁,然后将其灌装入25 mL具塞试管中,在90 ℃下灭菌1 min,将果汁样品在-20 ℃下冷冻保存,进行同位素分析时于室温下解冻使用。
1.3.2 掺假苹果汁(adulterated apple juice,AAJ)的制备
市售掺假果汁常用的方法是在果汁中添加水、糖和酸来冒充,为进行对比分析,实验制备了2种掺假果汁。第1种是添加外源水的掺假果汁,即将鲜榨苹果汁在65 ℃下真空浓缩至70 °Brix,然后加水将其稀释至鲜榨苹果汁的浓度(°Brix),巴氏灭菌后制成FC苹果汁。将FAJ和FC苹果汁以体积比0∶10、2∶8、4∶6、6∶4和8∶2、10∶0的比例混合,制成掺假程度为100%、80%、60%、40%和20%、0%的掺假果汁,以检查同位素方法的适用性并减少苹果品种的影响,定量确定外源水百分比的δD值。第2种是添加的外源糖的掺假果汁,即将质量分数0.1%,0.5%和2.5%的蔗糖添加到鲜榨苹果汁中并加水调节其浓度(°Brix)与鲜榨苹果汁相同,制成掺假果汁。
1.3.3 C、H和O同位素比(δ13C,δD和δ18O)的检测分析
1.3.3.1 δD、δ18O的分析
自然界中重同位素与轻同位素的比值(分馏系数)很小,所以对于水中的H、O同位素组成一般采用相对于 SMOW的千分差表示,当 δD 和 δ18O 为正值时, 表示样品与SMOW相比富集了 D 和18O;当 δD 和 δ18O 为负值时,表明样品中的2种同位素比SMOW标准中的亏缺。δD 和 δ18O 的测定分别按照 ENV 12141(1997)与 ENV 12142(1997)方法和相关文献[10-12]进行。
微蒸馏法制备样品:将 20 mL苹果汁样品放入50 mL蒸馏瓶中,并使用电加热套加热,温度控制在120 ℃;来自蒸馏瓶的蒸汽通过冷凝器冷凝并收集在试管中,试管被放置在装有少量液氮的保温杯中。当蒸馏瓶中苹果汁的残留量为2 mL时,停止加热,取出试管并在-80 ℃的冰箱中快速密封保存,25 ℃解冻后用于进样分析。
同位素分析:δD和δ18O的测量是在液态水同位素分析仪进行,该仪器是根据离轴积分腔输出光谱原理设计以用于分析样品中的同位素比。微蒸馏样品通过0.45 μm过滤器过滤后进样分析。氢同位素比(D/H)以千分之一(‰)表示,18O/16O的测量重复性标准偏差为<0.2‰,D/H的测量误差为<0.6‰。所有样品均在相同的实验条件下测量。通过相对于标准平均海水的千分之一(‰)计算出试验样品δD和δ18O的同位素比,如公式(1)所示,其准确度分别为0.5‰和0.15‰[16]。
(1)
其中:R样品,水样品中D/H或18O/16O的比率;RSMOW,标准水样品(SMOW)D/H或18O/16O的比率。
1.3.3.2 δ13C的分析
样品准备:5种鲜榨苹果汁,3种掺有白砂糖的实验室自制掺假苹果汁,2种市售苹果汁(commercial apple juice,CAJ)的样品,将每个样品稀释30倍并过滤至2 mL小瓶中。
同位素分析[13,17]:δ13C的同位素分析在同位素比率质谱联用的高效液相色谱仪(HPLC-co-IRMS)上进行;色谱柱: Rezex RCM-Monosaccharide Ca2+(7.8 mm×300 mm);柱温80 ℃;流动相水;流速350 μL/min;氧化剂1.1 mol/L过二硫酸钠溶液和0.3 mol/L H3PO4;流速50 μL/min;氧化反应温度99.9 ℃;进样体积9、25 μL,分别用于果糖、葡萄糖和二糖、寡糖、有机酸的测定计算。电子轰击离子源(EI):He压力为400 kPa;CO2压力为50 kPa;离子源电压3.06 kV;真空度0.18 mPa。
通过Isolate 3.0软件分析和计算样品的δ13C值。δ13C值是根据国际标准物质Vienna pee dee belemnite standard(VPDB)计算得到,如公式(2)所示:
(2)
式中:R样品为样品的13C和12C同位素比,RVPDB=0.011 237 2;HPLC-co-IRMS的检出限为0.7%。当某物质的百分比小于0.7%时,视为该物质未检出。
所有样品均重复3次,所有图表均使用Graph Pad Prism 5完成,采用SPSS 18.0进行统计分析。表中的数据显示为平均值±标准偏差,且使用单因素方差分析分析图中的数据,并使用相对标准偏差(relative standard deviation, RSD)<2%来分离均值。
2.1.1 FAJ和AAJ水中δ18O的特征
图1-a表示不同品种苹果汁水的δ18O值随掺假度的变化。

a-不同品种苹果汁中水的δ18O值随掺假度的变化;b-不同品种FAJ和100% AAJ中水的δ18O值
图1 FAJ和AAJ中水的δ18O值的特征
Fig.1 Characteristic of δ18O in the water of FAJ and AAJ
注:**表示AAJ与FAJ相比差异极显著(P<0.05)(下同)
图1-b是不同品种苹果的鲜苹果汁和100%掺假苹果汁中水的δ18O值。
由图1可知,FAJ和AAJ之间的δ18O值存在明显区别(P<0.05),即掺假果汁的δ18O值均低于鲜榨果汁。FAJ中水的δ18O值在-4.54‰(JP)和-7.62‰(JG)之间,超过了西安当地水的δ18O值(-11.09‰)。此外,试验所用不同品种苹果的FAJ中水的δ18O值都高于欧洲(罗马尼亚苹果)果汁[18]。分析认为由于地理环境不同,影响了鲜榨苹果汁的同位素比率[19]。图1可以看出,随着掺假程度的增高,δ18O值也依次降低,但AAJ的δ18O值随掺假程度的变化规律需深入研究。
2.1.2 FAJ和AAJ中水的δD特征
外源水对δD值的影响见图2。不同品种不同掺假程度苹果汁中水的δD值变化见图2-a,图2-b是不同品种苹果的FAJ和100% AAJ中水的δD值。


a-不同品种苹果汁中水的δD值随掺假程度的变化;b-不同品种FAJ和100% AAJ中水的δD值
图2 FAJ和AAJ中水的δD值的特征
Fig.2 Characteristic of δD in the water of FAJ and AAJ
从图2可知,所有FAJ中水的δD值均高于AAJ(P<0.05),并且不同品种之间也存在差异。苹果果实的δD通过蒸腾作用得以富集,其值高于地表水;但日照时间和降雨会影响不同苹果品种的δD富集。由于气候和地理环境的影响,不同品种苹果的同位素值表现出一定的波动性,无法达到预期的效果。试验得到的不同品种的δD值反映出FAJ和AAJ之间的一般特征,反映了果汁产品的“真实情况”,因为通常实验室不是单从一个品种中获取果汁来进行市场控制,而是以最终生成的果汁样品进行分析。
由图2可知,随着掺假程度的不断加深,δD值也发生变化。但是,大量AAJ样品的δD值高于自来水(FAJ:-45.90‰~-59.00‰; AAJ:-50.70‰~-82.90‰;自来水:-65.52‰),与预期结果不符。
分析检测结果显示δD值呈波动变化,所以用δ18O和δD值单一来判断掺假程度存在一定难度,仅能判断是否掺假,不能确定其掺假的量。所以需要在此基础上对在不同掺假程度下δ18O与δD值的相关性进一步探讨。
2.1.3 果汁中水的δ18O与δD值的相关性
尽管在不同时间和空间获得的水的同位素组成有很大变化,但δD和δ18O之间呈规律性变化,并且通常呈线性相关。CRAIG等[20]首次发现北美大气降水的δD和δ18O组成呈线性关系,根据这些实验数据,CRAIG将大气降水线性方程拟合为公式(3),即著名的克雷格全球降水线(Graig′s meteoric water line, global meteoricwater line of Graig, GMWL)。
δD=8δ18O+10
(3)
克雷格大气降水方程使用标准平均海水作为世界上大多数地区的标准线,本试验利用GMWL的特性来探讨添加外源水的AAJ和FAJ中水的δD和δ18O关系,6组掺假果汁的分析结果如图3所示。
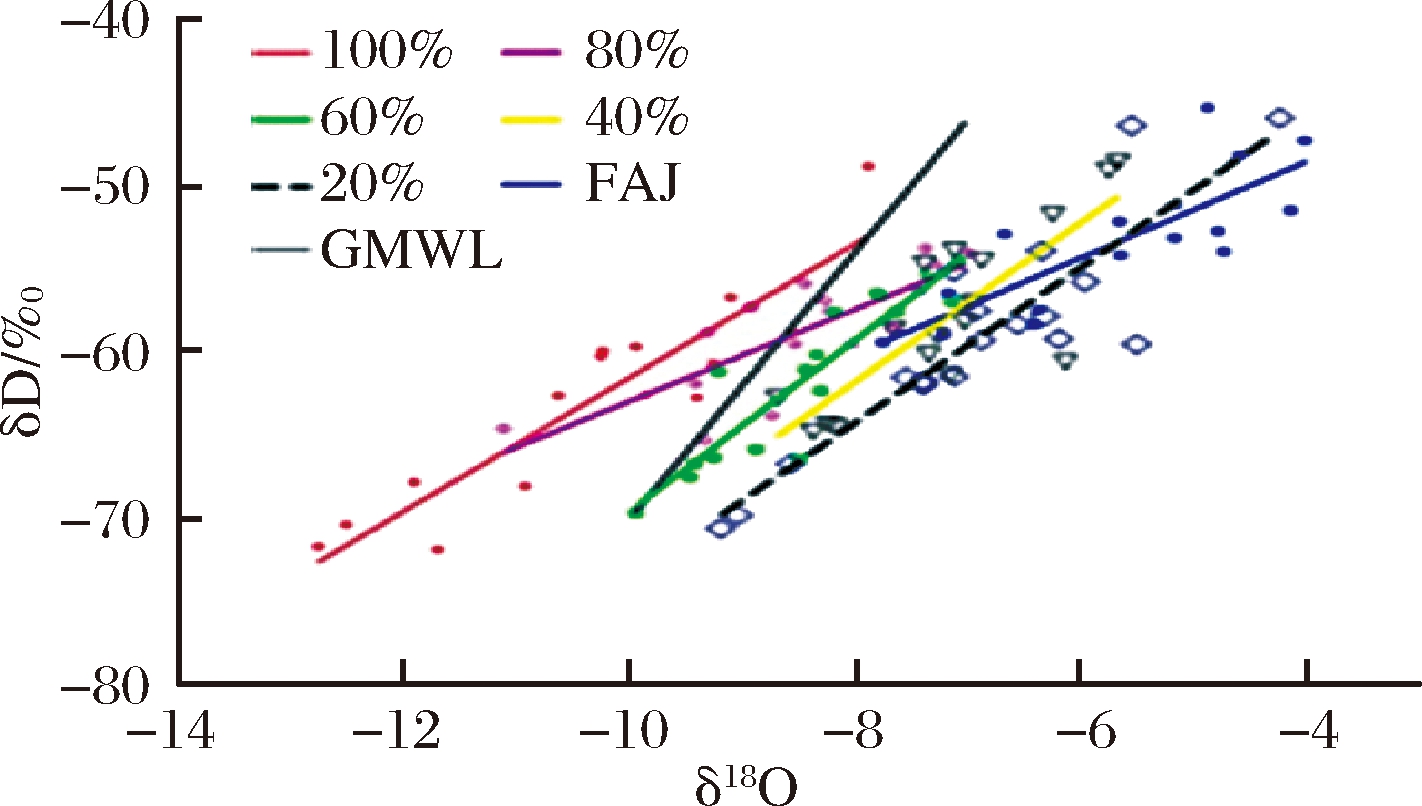
图3 不同品种苹果汁中水的δD与δ18O的线性关系
Fig.3 Linear relationship of δ18O and δD between different juice from different cultivars of apple
注:图例为FAJ比例
由图3可知,AAJ(0%FAJ含量、20%FAJ含量、40%FAJ含量)的价值点高于GMWL(线性方程:y=8x+10)[21]。不同掺假比例的点均匀分布在掺假程度为100%和0%的回归线之间,并显示规律性,从图3可知,掺假率分别为100%、80%、60%、40%、20%、0%(FAJ)的AAJ具有统计学意义的氢氧同位素线性关系见表2。图3说明掺假率不同的AAJ苹果汁中水的δD和δ18O之间存在显著相关性,且苹果汁的δD和δ18O值均显示出随掺假程度的增加而降低的趋势,当外源水的添加量最大(即100%AAJ),δD和δ18O值达到最低值。这与BONTEMPO等[22]和OGRINC等[23]的发现相似,δD和δ18O值在基于IRMS的外来水掺假认证过程中起关键作用。
表2 不同果汁中水的δD与δ18O 值的方程拟合
Table 2 Fitting of equations for δ18O and δD in FAJ
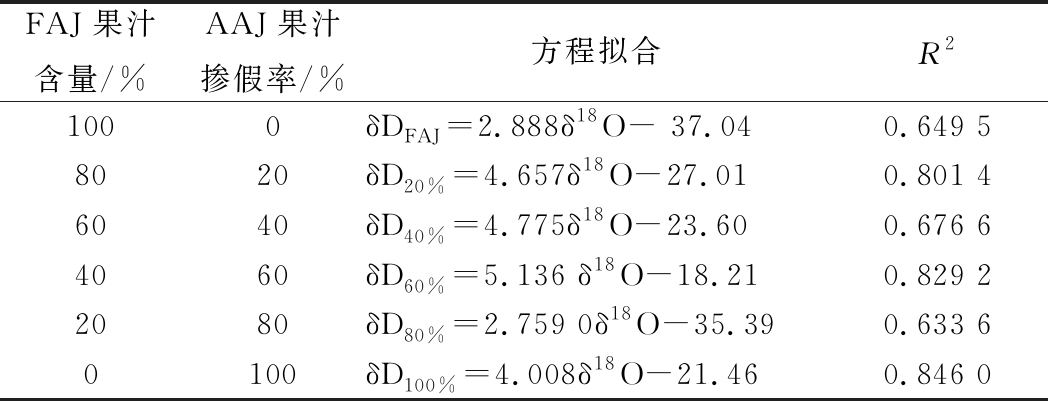
FAJ果汁含量/%AAJ果汁掺假率/%方程拟合R21000δDFAJ=2.888δ18O- 37.040.649 58020δD20%=4.657δ18O-27.010.801 46040δD40%=4.775δ18O-23.600.676 64060δD60%=5.136 δ18O-18.210.829 22080δD80%=2.759 0δ18O-35.390.633 60100δD100%=4.008δ18O-21.460.846 0
FAJ和100%AAJ的δD与δ18O 值分布范围之间出现明显的差异性(图4),进一步说明了FAJ、AAJ(即FC苹果汁)的氢氧同位素δ18O和δD具有显著区别,能够有效鉴别FAJ、AAJ。这与钟其顶等[8]对橙汁的NFC与FC果汁的研究结果相似。
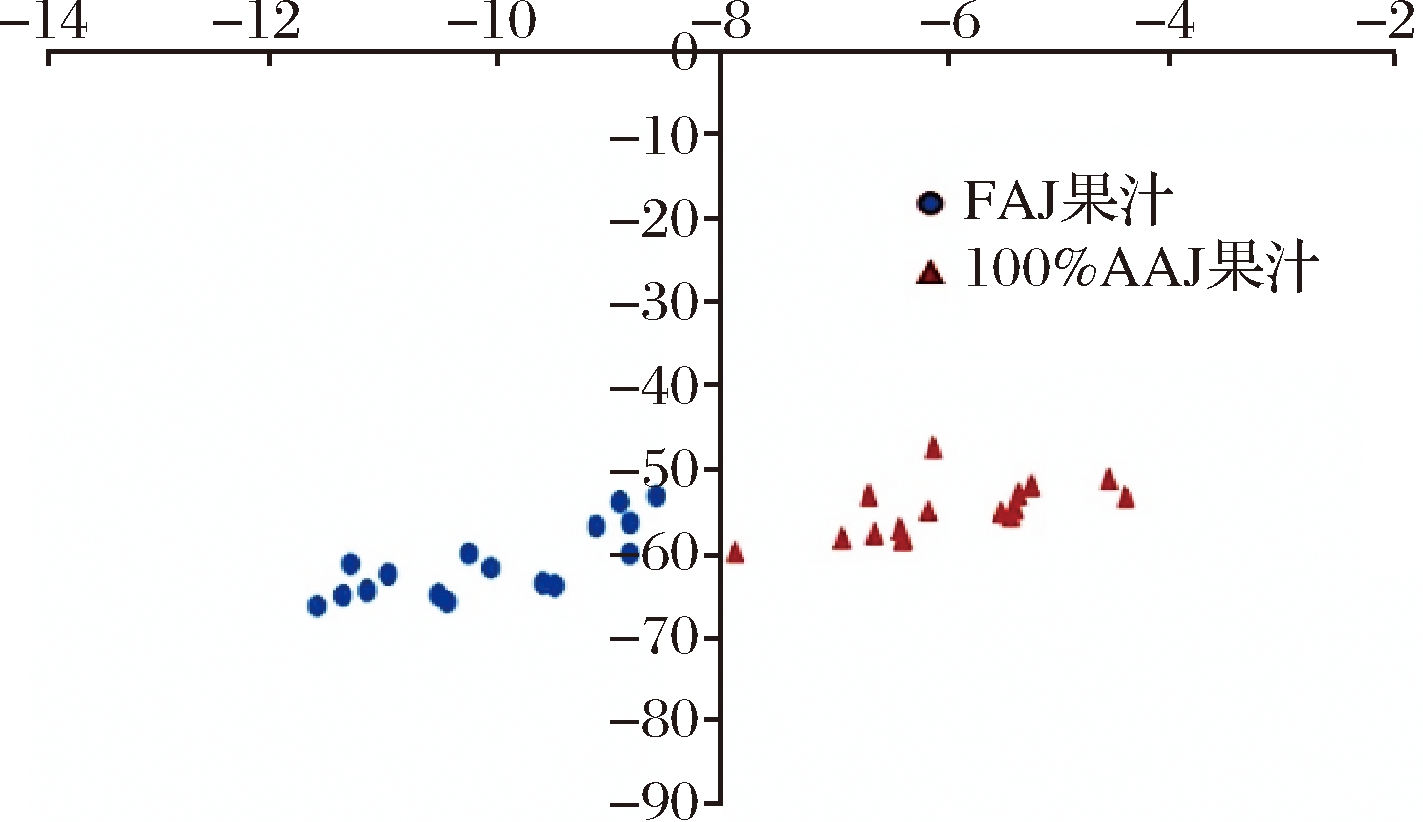
图4 不同品种苹果FAJ与100%AAJ中水的δD与δ18O分布
Fig.4 Distribution of δD and δ18O in water of FAJ and 100% AAJ from different apple cultivars
2.2.1 实验室自制FAJ中糖类的δ13C特征
通过HPLC-IRMS测定实验室自制5个苹果品种的FAJ中果糖、葡萄糖和二糖、寡糖的δ13C值,并通过面积归一法计算各成分的含量,其典型的LC-IRMS图谱如图5所示,结果见表3。
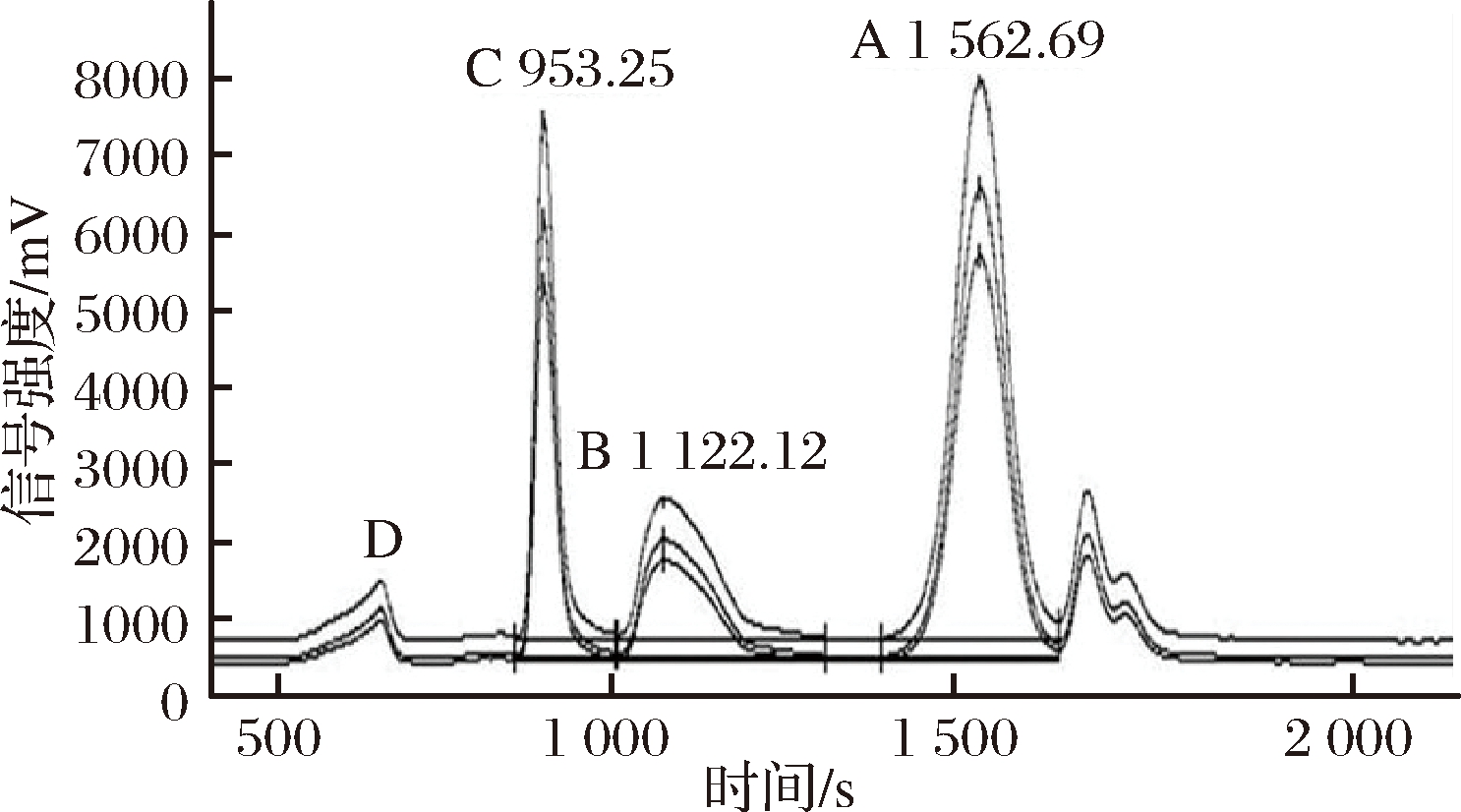
A-果糖;B-葡萄糖;C-二糖;D-寡糖(下同) 图5 鲜榨苹果汁FAJ中糖类的LC-IRMS色谱图
Fig.5 LC-IRMS chromatogram of saccharides in FAJ
从图5可知,在相应的保留时间671.37 s处(D)可以发现寡糖峰,而通过面积归一化法计算的寡糖含量小于检测限的0.7%。因此,认为未检测到寡糖。表3显示了FAJ中果糖,葡萄糖和二糖的δ13C值范围(果糖-25.64‰~-26.83‰,葡萄糖-25.01‰~-26.36‰,二糖-22.41‰~-23.24‰),此外,分别计算出了果糖、葡萄糖和二糖的百分比范围为48.84%~52.39%,14.34%~28.85%,10.47%~18.78%。,这意味着一旦苹果汁中的δ13C值和各成分的含量百分比不在这些范围内,就可以认为存在掺假。
表3 FAJ中果糖,葡萄糖和二糖各组分的δ13C值和占总糖百分比
Table 3 δ13 C value and percentage of the fructose, glucose and disaccharide in FAJ
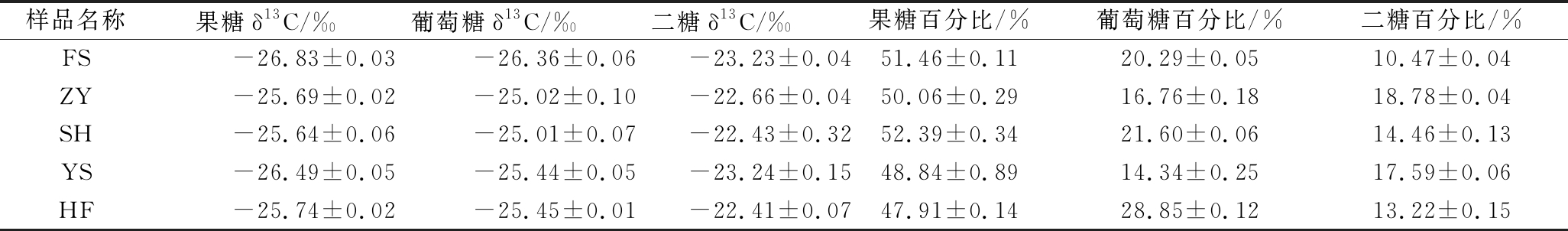
样品名称果糖δ13C/‰葡萄糖δ13C/‰二糖δ13C/‰果糖百分比/%葡萄糖百分比/%二糖百分比/%FS-26.83±0.03-26.36±0.06-23.23±0.0451.46±0.1120.29±0.0510.47±0.04ZY-25.69±0.02-25.02±0.10-22.66±0.0450.06±0.2916.76±0.1818.78±0.04SH-25.64±0.06-25.01±0.07-22.43±0.3252.39±0.3421.60±0.0614.46±0.13YS-26.49±0.05-25.44±0.05-23.24±0.1548.84±0.8914.34±0.2517.59±0.06HF-25.74±0.02-25.45±0.01-22.41±0.0747.91±0.1428.85±0.1213.22±0.15
2.2.2 实验室制备的AAJ中糖类的δ13C特征
为了验证2.2.1实验数据的可靠性,使用LC-IRMS确定实验室自制的AAJ中的δ13C值和各成分的百分比,LC-IRMS图谱如图6所示,结果见表4。
从图6可知,寡糖的相应保留时间为670.42 s,但使用面积归一化法计算出的寡糖含量也低于0.7%的检出限,仍认为寡糖未被检测到。
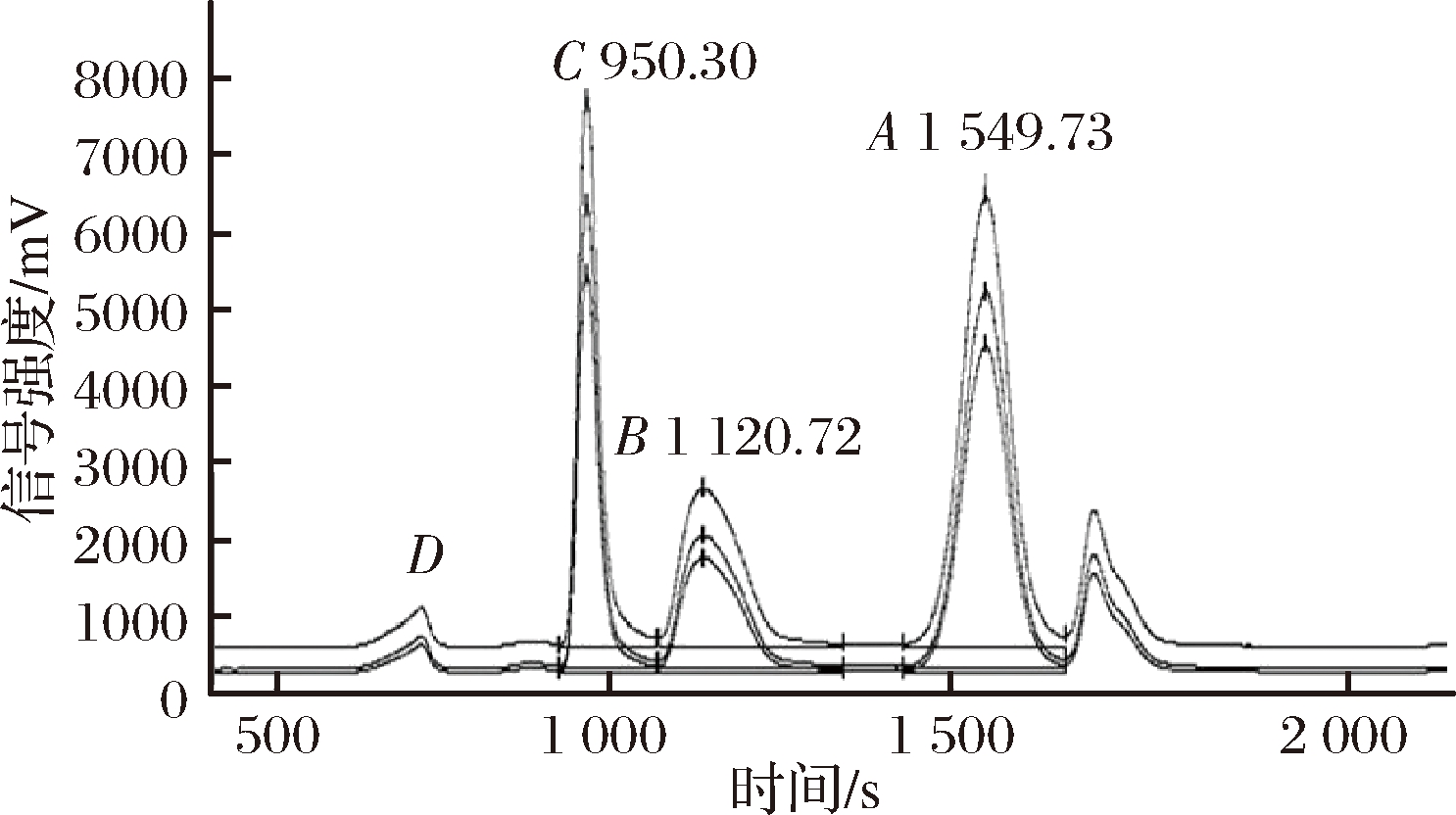
图6 掺假苹果汁中糖类的LC-IRMS色谱图
Fig.6 LC-IRMS chromatogram of saccharides in AAJ
表4 AAJ中果糖,葡萄糖和二糖各组分的δ13C值和占总糖百分比
Table 4 δ13C value and percentage of the fructose, glucose and disaccharide in AAJ

样品名称果糖δ13C/‰葡萄糖δ13C/‰二糖δ13C/‰果糖百分比/%葡萄糖百分比/%二糖百分比/%AAJ-1-25.80±0.03-25.26±0.03-21.26±0.0352.85±0.0421.70±0.1010.59±0.04AAJ-2-25.83±0.06-25.33±0.04-19.59±0.0549.75±0.0720.37±0.0512.82±0.09AAJ-3-24.91±0.03-22.33±0.03-15.94±0.0944.37±0.2119.36±0.1423.19±0.05
注: AAJ-1,AAJ-2,AAJ-3分别代表掺假苹果汁中的外源糖质量分数为0.1%、0.5%、2.5%
从表4可知,外源糖质量分数为0.1%、0.5%、2.5%的AAJ中二糖的δ13C的值(-15.94‰~-21.26‰)和外源糖含量仅2.5%的AAJ中二糖成分百分比(23.19%)不在FAJ的范围内(表3),这进一步证实了该方法的可靠性。
2.2.3 市售苹果汁(CAJ)中糖类的δ13C特征
为判别上述结论的正确性,从超市购买了不同品牌的商业苹果汁饮料,然后检测分析其δ13C值和各成分的含量,结果见图7和表5。从表5可以看出,CAJ-1样品中的果糖、葡萄糖和二糖δ13C值分别为-19.95‰、-15.66‰和-14.59‰、不在FAJ的δ13C范围内(表3),在每种成分占总糖的百分比中,果糖仅为44.69%,葡萄糖为33.00%,综上认为不符合FAJ的特性。该市售果汁样品是AAJ。CAJ-2样品的果糖和葡萄糖δ13C值分别为-26.12%、-25.34%,其结果在FAJ范围内,可认为该样品是纯苹果汁。
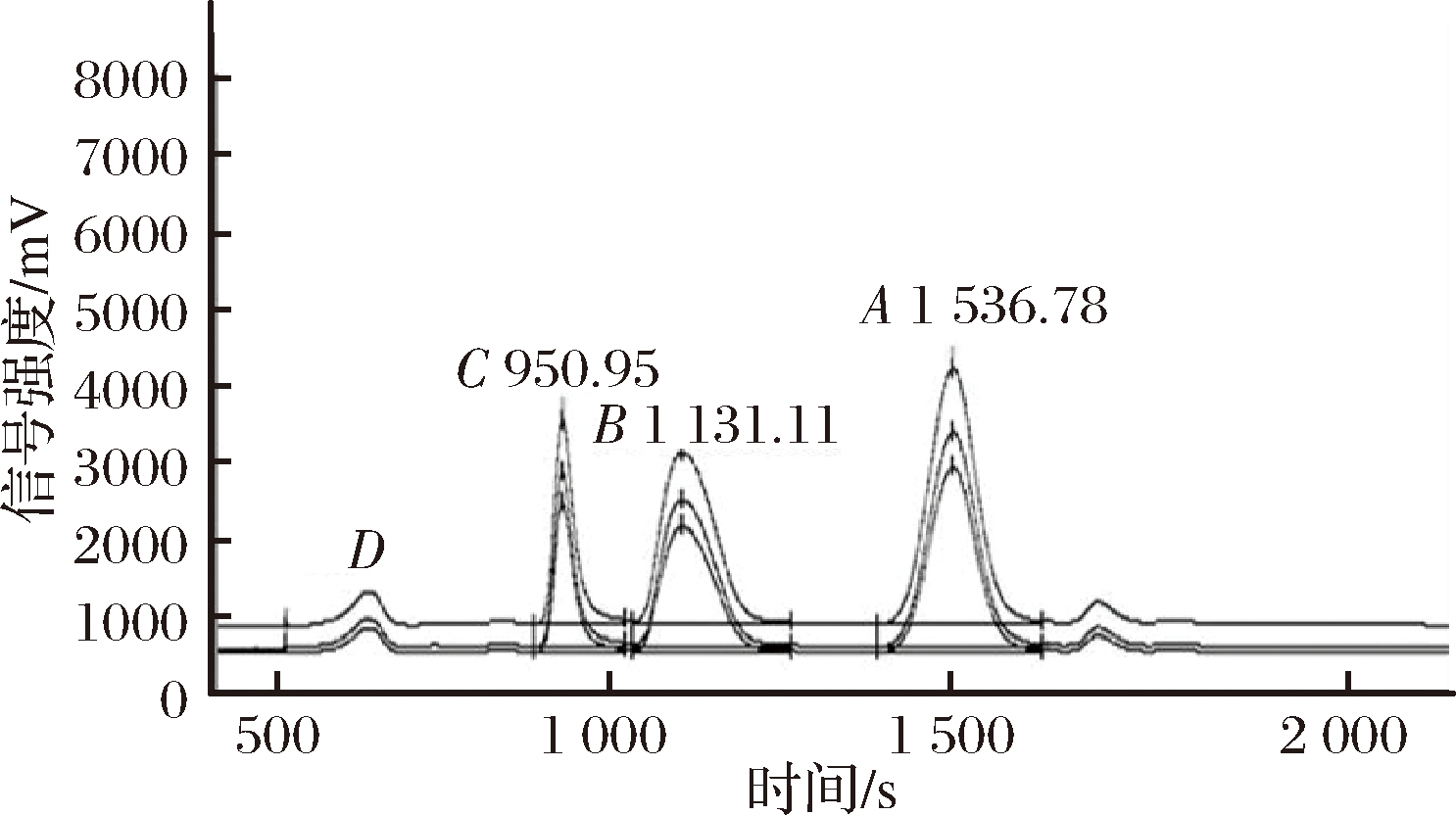
图7 商业苹果汁中糖类的LC-IRMS色谱图
Fig.7 LC-IRMS chromatogram of saccharides in commercial apple juice
所以LC-IRMS可以快速地区分真正的鲜榨苹果汁,可作为一种简单有效的方法来鉴定鲜榨苹果汁[24]。
因为鲜榨苹果汁和产糖作物(例如玉米和甘蔗)的δ13C值之差是由于“ C3”或“ C4”型的不同代谢引起的[20]。δ13C与掺假程度的相关性部分符合ROSSMANN等[25]提出的内部参考方法。试验用LC-IRMS测定纯鲜苹果汁中果糖、葡萄糖和二糖的δ13C值,通过面积归一化法计算各成分的百分比,然后通过实验室用掺有白砂糖(C4型糖)的自制果汁进行验证,发现掺假果汁数据与纯果汁数据之间存在一定的差异。LC-IRMS可以大大提高苹果汁的鉴伪检测水平,但对于果汁中特定掺假糖浆的类型,尚无深入研究,这将是后续工作的重点。
表5 商业苹果汁(CAJ)中糖类的δ13C值和占总糖质量百分比
Table 5 δ13C value and percentage of sugar components in commercial apple juice (CAJ)

样品名称果糖δ13C/‰葡萄糖δ13C/‰二糖δ13C/‰果糖百分比/%葡萄糖百分比/%二糖百分比/%CAJ-1-19.95±0.06-15.66±0.05-14.59±0.0744.69±0.2433.00±0.0515.56±0.13CAJ-2-26.12±0.16-25.34±0.11ND61.69±0.5420.71±0.37ND
注:ND表示未检出
试验研究表明,鲜榨苹果汁中水的 δ18O 和 δD 值显著高于掺假苹果汁,掺假果汁中水的δD与δ18O值呈线性关系,且随外源水含量增加而降低;鲜榨苹果汁中糖分的δ13C值有比较确定的范围和比例,且鲜榨与掺假苹果汁的δ18O、 δD和法对所有大曲高光谱数据进行灰度共生矩阵参数δ13C值存在统计学差异。本研究所探讨的δD,δ18O和δ13C同位素比鉴定鲜榨苹果汁掺假程度的分析方法,克服了传统鉴别方法不准确、操作复杂的问题,值得建立数据库进行深入研究。
[1] 邓红, 雷佳蕾, 杨天歌, 等. 超高压和高温短时杀菌对NFC苹果汁贮藏期品质的影响[J].中国农业科学, 2019, 52(21): 3 903-3 923.
[2] 孙学义, 孙振国. NFC果汁:产地初加工的果蔬既营养又健康[J]. 农产品加工, 2014(5): 14-15.
[3] 张淼, 李燮昕, 贾洪锋, 等. 我国果汁掺假检测技术研究现状[J]. 食品研究与开发, 2016, 37(5):205-208.
[4] 牛丽影, 胡小松, 赵镭, 等. 稳定同位素比率质谱法在NFC 与FC 果汁鉴别上的应用初探[J]. 中国食品学报, 2009, 9(4):192-197.
[5] 孔祥辉. 稳定同位素技术为食品真实性提供保障[J]. 质量与认证, 2017(11):80-81.
[6] DIN V ENV 12141-1997,Fruit and vegetable juices - Determination of the stable oxygen isotope ratio(18O/16O)of water from fruit juices - Method using isotope ratio mass spectrometry[S].
[7] DIN V ENV 12142-1997,Fruit and vegetable juices - Determination of the stable hydrogen isotope ratio (2H / 1H) of water from fruit juices -Method using isotope ratio mass spectrometry[S].
[8] 钟其顶, 王道兵, 熊正河. 稳定氢氧同位素鉴别非还原(NFC)橙汁真实性应用初探[J]. 饮料工业, 2011, 14(12):6.
[9] 李鑫, 陈小珍, 蒋鑫, 等. 元素分析-同位素比率质谱在橙汁掺假鉴别中的应用[J]. 食品工业, 2013, 34(7): 218-220.
[10] MAGDAS D A, VEDEANU N S, PUSCAS R. The use of stable isotopes ratios for authentication of fruit juices[J]. Chemical Papers, 2012,66(2):152-155.
[11] BONONI M, QUAGLIA G, TATEO F. Preliminary LC-IRMS characterization of italian pure lemon juices and evaluation of commercial juices distributed in the italian market[J]. Food Analytical Methods, 2016,9(10):1-8.
[12] JURAJ J, MILAN S. Application of capillary isotachophoresis for fruit juice authentication[J]. Journal of Chromatography A, 2001, 916:185-189.
[13] 李学民, 曹彦忠, 贾光群, 等. 液相色谱-同位素质谱法测定蜂蜜中糖组分δ13C值[J]. 中国蜂业, 2012(63):79-82.
[14] GUYON F, AUBERGER P, GAILLARD L, et al. B.(13)C/(12)C isotope ratios of organic acids, glucose and fructose determined by HPLC-co-IRMS for lemon juices authenticity[J]. Food Chemistry, 2014, 146(3):36-40.
[15] 张政权, 黄冬梅, 孟宪菁, 等. 同位素比率质谱法在农产品产地溯源中的研究进展[J]. 农产品质量与安全, 2019(2): 13-17.
[16] ERIC J, RÉGIS G, MÉLINDA R, et al. Improved detection of added water in orange juice by simultaneous determination of the oxygen-18/oxygen-16 isotope ratios of water and ethanol derived from sugars[J]. Journal of Agricultural and Food Chemistry, 2003, 51(18): 5 202-5 207.
[17] STERNBERG L, KEELEY J E. Hydrogen, oxygen, and carbon isotope ratios of cellulose from submerged aquatic crassulacean acid metabolism and non-crassulacean acid metabolism plants[J]. Plant Physiology, 1984, 76(1):68-70.
[18] MAGDAS D A, PUSCAS R. Stable isotopes determination in some Romanian fruit juices[J]. Isotopes Environ Health Stud, 2011, 47(3):372-378.
[19] BIZJAK B K, ELER K, MAZEJ D, et al. Isotopic and elemental characterisation of Slovenian apple juice according to geographical origin: Preliminary results[J]. Food Chemistry, 2016, 203:86-94.
[20] CRAIG H. Isotopic variations in meteoric waters[J]. Science, 1961, 133(3465):1 702-1 703.
[21] WANG J, FU B, LU N, et al. Seasonal variation in water uptake patterns of three plant species based on stable isotopes in the semi-arid Loess Plateau[J]. Sci Total Environ, 2017, 609:27-37.
[22] BONTEMPO L, CARUSO R, FIORILLO M, et al. Stable isotope ratios of H, C, N and O in Italian citrus juices[J]. Journal of Mass Spectrometry, 2014, 49(9):785-791.
[23] OGRINC N, BAT K, KOSIR I J, et al. Characterization of commercial slovenian and cypriot fruit juices using stable isotopes[J]. Journal of Agricultura and Food Chemistry, 2009, 57(15): 6 764-6 769.
[24] CAMIN F, DORDEVIC N, WEHRENS R, et al. Climatic and geographical dependence of the H, C and O stable isotope ratios of Italian wine[J]. Analytica Chimica Acta, 2015, 853(1): 384-390.
[25] ROSSMANN A, KOZIET J, MARTIN G J, et al. Determination of the carbon-13 content of sugars and pulp from fruit juices by isotope-ratio mass spectrometry (internal reference method): A European interlaboratory comparison[J]. Analytica Chimica Acta, 1997,340(1-3):21-29.