
苯乳酸(phenyllactic acid,PLA)是一种小分子化合物,具有广谱抗菌的性能,能够抑制某些革兰氏阳性菌和革兰氏阴性菌的生长[1-3],具有良好的溶解性,在食品中易于扩散,且在较宽pH范围内能够保持稳定[1],有望开发成一种新型的食品抗菌剂。苯乳酸存在于奶酪等乳制品[2]、发酵面团[3]和新西兰麦卢卡蜂蜜中[4]。可由乳酸菌[5]、白地霉[6]、丙酸杆菌[7]等合成,由于乳酸菌在食品工业中应用普遍且一般公认安全(generally recognized as safe,GRAS),其作为主要的苯乳酸合成菌株的研究越来越深入并广泛。苯乳酸能够随乳酸菌的发酵生成,近年来有研究显示,苯乳酸存在于四川泡菜[8]和韩国泡菜中[9]。
目前苯乳酸的检测方法主要有HPLC法[10-11]、UPLC-MS/MS法[9]、薄层层析法[12]和气相色谱法[13]。UPLC-MS/MS法设备昂贵,成本较高;气相色谱法检测灵敏,但发酵液需冻干后酯化,前处理复杂;HPLC法由于前处理简单,准确度高,应用较为广泛。有研究对比了前处理对HPLC法检测乳酸菌发酵液中苯乳酸的影响,发现样品通过固相萃取柱后回收率为63.2%,微滤后直接进样回收率为98.7%,乳酸菌发酵液不适于使用固相萃取柱[14]。以上这些方法主要针对于测定乳酸菌纯菌发酵液中的苯乳酸[10,12-14],而目前对测定食品中苯乳酸含量的研究较少,因发酵食品多为混合菌种发酵[15-16],成分较多。有研究表明,泡辣椒在发酵过程共产生7类,56种化合物[17];江米酒中被发现含有乙酸、柠檬酸、琥珀酸、乳酸、苹果酸和乌头酸6种有机酸[18];王娟娟等[19]利用HPLC法在210 nm波长下检出酸菜含有草酸、苹果酸、乳酸、乙酸4种有机酸,其中乳酸和乙酸在5~7 min出峰,出峰时间间隔不到1 min,前处理步骤需要进行8 h的离子交换。HPLC法测定苯乳酸的检测波长为210 nm[14],如采用传统HPLC法测定发酵食品中的苯乳酸,可能会有前处理繁琐、目标峰与杂质峰相连等问题,影响目标峰的辨认,造成定量误差大。
近年来,在线2D-HPLC法越来越多的应用于复杂体系分析,因其能简化前处理步骤[20],改善基质效应[21],且复杂基质样品可直接进样。目标物质与杂质的分离程度对HPLC法检测至关重要,同时要求良好的灵敏度和重现性。二维色谱峰容量大、与杂质峰的分离程度更好、灵敏度高,能够提高分离效率,适用于成分较多的发酵食品[22]。2D-HPLC目前广泛应用于食品领域,有研究利用2D-HPLC检测奶粉中牛磺酸[23]和脂溶性维生素[24-25],发现目标峰与杂质分离彻底、前处理步骤少、抗干扰能力强,避免了食品中其他成分对目标峰造成干扰,检测灵敏,结果准确。
本实验拟建立一种在线2D-HPLC检测方法,用于检测发酵食品中的苯乳酸,并对市售的酸奶、东北酸菜、甜米酒、酱黄瓜和广式腊肠中苯乳酸的含量进行了测定,并利用UPLC-MS/MS对样品中的苯乳酸存在性进行验证。
PLA标准品(纯度>98%),上海子起生物科技有限公司;甲酸、三氟乙酸(trifluoroacetic acid, TFA)、乙腈、甲醇(色谱纯),美国Fisher公司;α-淀粉酶,上海普誉科贸有限公司;甜米酒、东北酸菜、广式腊肠、酸奶、酱黄瓜,上海麦德龙超市。
Agilent-1260高效液相色谱仪,配六通阀和柱温箱,1D-HPLC为Agilent-1260四元泵,可变波长检测器(Variable wavelength detector,VWD),2D-HPLC为二元泵,二极管阵列检测器(Diode array detector,DAD),美国Agilent公司;ACQUITY H-CLASS 超高液相色谱仪、ACQUITY UPLC Xevo TQ-XS三重四极杆质谱仪,美国Waters公司;SY-601恒温水浴锅,天津欧诺仪器仪表有限公司;SL-16超声波水浴锅,江苏盛蓝仪器制造有限公司。
1.3.1 标准溶液的配制
准确称取0.01 g PLA 标准品于100 mL容量瓶中,制成100 mg/L的PLA标准储备液,避光4 ℃储存。准确吸取标准储备液稀释至0.40、0.80、2.00、4.00、10.00 mg/L的标准工作液。
1.3.2 样品前处理
称取粉碎均质后的东北酸菜和酱黄瓜各1 g,超纯水定容至5 mL,10 000 r/min离心2 min,0.22 μm微滤后进样。
称取5 g酸奶加入20 mL水涡旋后,甲醇定容至50 mL,10 000 r/min离心2 min,取离心上清液0.22 μm微滤后进样。
称取粉碎均质后的甜米酒5 g和1 g α-淀粉酶共同加入5 mL 超纯水中酶解并稀释,60 ℃下水浴30 min,冷却后定容至20 mL,9 000 r/min离心2 min,取离心上清液,0.22 μm微滤后进样。
称取粉碎后的广式腊肠5 g加入20 mL水中,后超声处理,用甲醇定容至50 mL,10 000 r/min离心2 min,取离心上清液,0.22 μm微滤后进样。
1.3.3 色谱条件
第一维色谱柱:Dikma Diamonsil Plus C18色谱柱(100 mm×4.6 mm,5 μm);流动相:V(0.1%甲酸水溶液)∶V(甲醇)=65∶35,流速1.0 mL/min;第二维色谱柱:Agilent Poroshell C8色谱柱(100 mm×4.6 mm,2.7 μm),流动相:V(0.05%TFA)∶V(乙腈)=87∶13,流速1.0 mL/min,检测波长:210 nm;进样体积:20 μL,柱温:30 ℃。阀切换时间:0.00 min (位置1~6),4.70 min (位置1~2),20.00 min(位置1~6)。
使用一维色谱柱对样品分离,苯乳酸即将通过一维色谱柱时,捕获柱开始截取与苯乳酸有关的部分,将苯乳酸切换至二维色谱柱,二维色谱柱继续对样品分析,此时捕获柱和一维色谱柱进行平衡清洗。
1.3.4 UPLC-MS/MS色谱和质谱条件
色谱条件:色谱柱:ACQUITY UPLC BEH C18色谱柱(2.1×50 mm,1.7 μm);流动相A为体积分数0.1%甲酸水溶液,流动相B为乙腈,梯度洗脱,洗脱程序0~1 min 90%A,1~6 min A由90%线性变化至10%,6~8 min 保持10%A,8~10 min由10%线性变化至90%;流速:0.3 mL/min。
质谱分析条件:毛细管电压:3.0 kV;离子源:电喷雾离子源(electrospray ionization,ESI),负离子检测模式;检测方式:质谱多反应监测(multiple reaction monitoring,MRM);锥孔电压:26 V;脱溶剂温度:400 ℃;脱溶剂气流量:793~800 L/h;锥孔气流量:148~150 L/h;雾化气压力:630~700 kPa;碰撞气流量:0.14 mL/min;定量离子对:165>147(m/z);碰撞能量:15 eV。
2.1 一维色谱阀切换时间的确定
在一维条件下将苯乳酸标准品连续进样,确定苯乳酸标准品的出峰时间在5.0 min。选用高效的C18色谱柱作为一维色谱的分离柱,能够压缩缝宽,更好地分离目标峰和杂质峰,缩短阀切换时间窗口,减少一维色谱中杂质进入二维色谱[24]。样品在第一维色谱柱上进行富集和分离,4.7 min切换六通阀,将苯乳酸切换到第二维色谱条件进行分析定量,使苯乳酸与杂质分开。苯乳酸切换到第二维色谱柱分析时,对第一维色谱柱进行冲洗和平衡,保护色谱柱的性能,由图1得知,苯乳酸出峰时间为11.0 min。

图1 苯乳酸标准品2D-HPLC色谱图
Fig.1 2D-HPLC graph of PLA standard
由图2-a发现,酱黄瓜离心后经0.22 μm微滤进样,流动相V(0.05%TFA)∶V(乙腈)=75∶25,C18色谱柱(4.6×250 mm,5 μm)为固定相进行1D-HPLC分析发现[14],目标峰与杂质峰相连,且基线不平稳,导致苯乳酸的定性定量不准确,而样品中杂质过多易对色谱柱造成损耗。
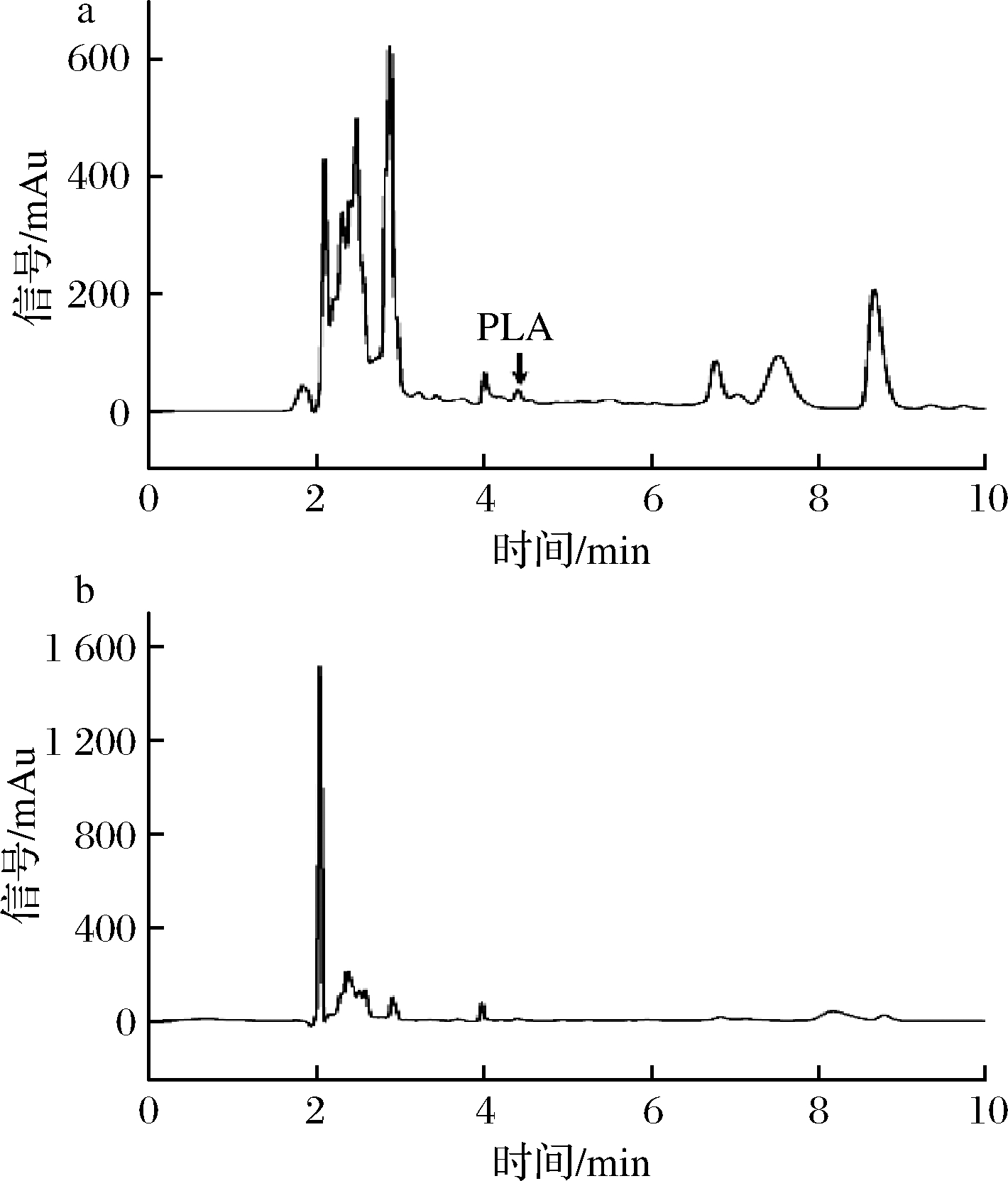
a-酱黄瓜;b-酸奶
图2 样品1D-HPLC色谱图
Fig.2 1D-HPLC graphs of samples
由图2-b可知,酸奶在1D-HPLC条件下没有检出苯乳酸。研究表明,植物乳杆菌有合成苯乳酸的能力[2,3,8],而样品酸奶中含有植物乳杆菌,故推测酸奶中含有苯乳酸。相同样品在2D-HPLC色谱条件下检出含有苯乳酸(图3-c),表明2D-HPLC方法灵敏度,目标峰分离程度好。
苯乳酸在食品中易于扩散,前处理不当会导致检测效率低和回收率低等问题。发酵食品中成分较为复杂[17-19],2D-HPLC法测定苯乳酸降低了食品中杂质成分的干扰、防止了色谱柱污染、延长色谱柱寿命、灵敏度更高。由图3可知,样品在2D-HPLC色谱条件下出峰稳定、无杂质干扰,相比1D-HPLC更能满足检测需求。
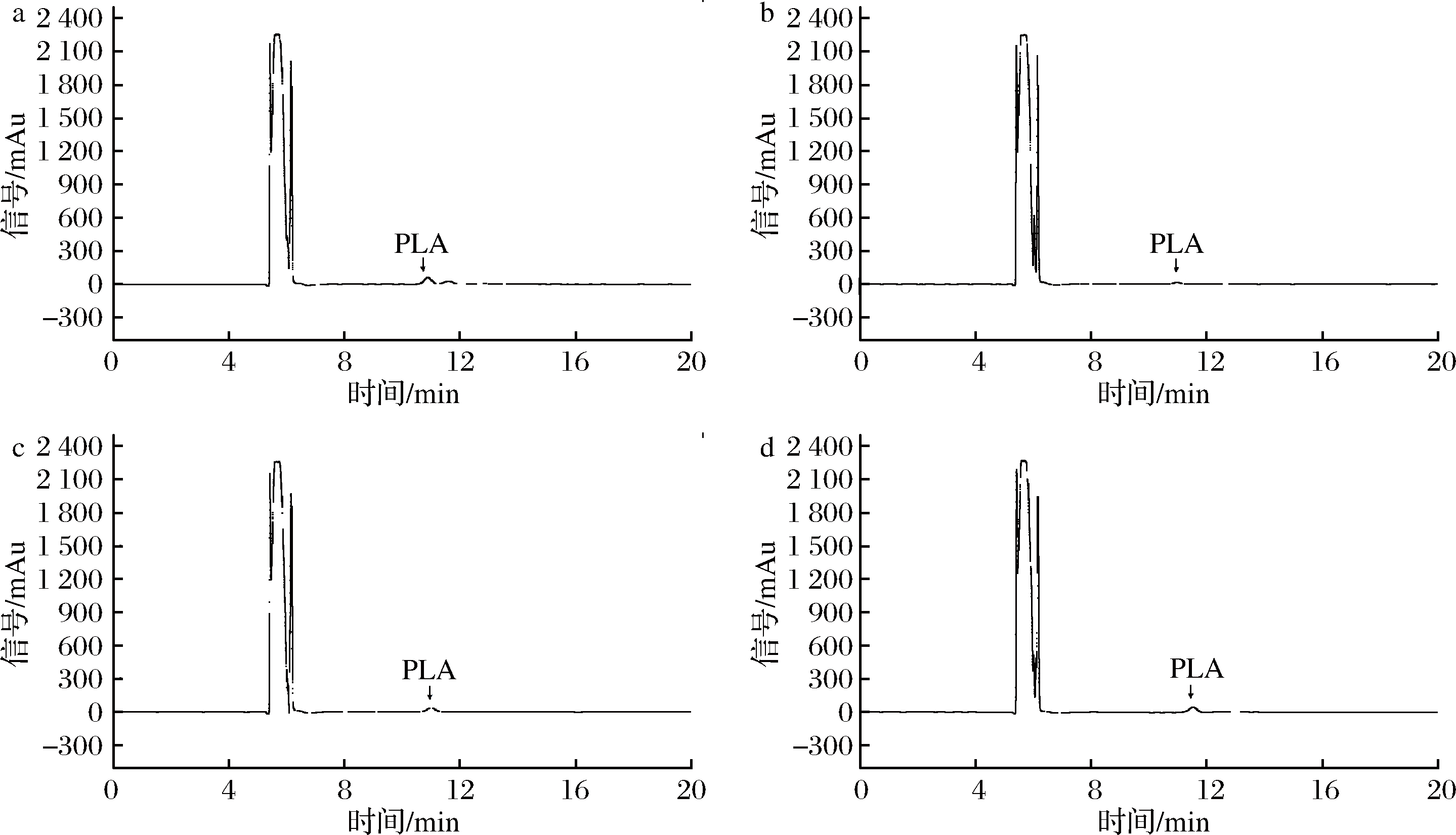
a-酱黄瓜;b-东北酸菜;c-酸奶;d-甜米酒
图3 四种发酵食品中苯乳酸2D-HPLC色谱图
Fig.3 2D-HPLC chromatograms of PLA in four fermented products
苯乳酸在210和258 nm吸收波长下均能出峰[26],2D-HPLC法检测苯乳酸时在210 nm下出峰,但在258 nm吸收波长下无色谱峰出现,为验证使用2D-HPLC法时,210 nm处色谱峰为苯乳酸目标峰,本实验采用UPLC-MS/MS进行样品的验证。由图4可知,酱黄瓜、东北酸菜、酸奶和米酒中有苯乳酸存在,验证了2D-HPLC法在210 nm下色谱峰为苯乳酸目标峰。
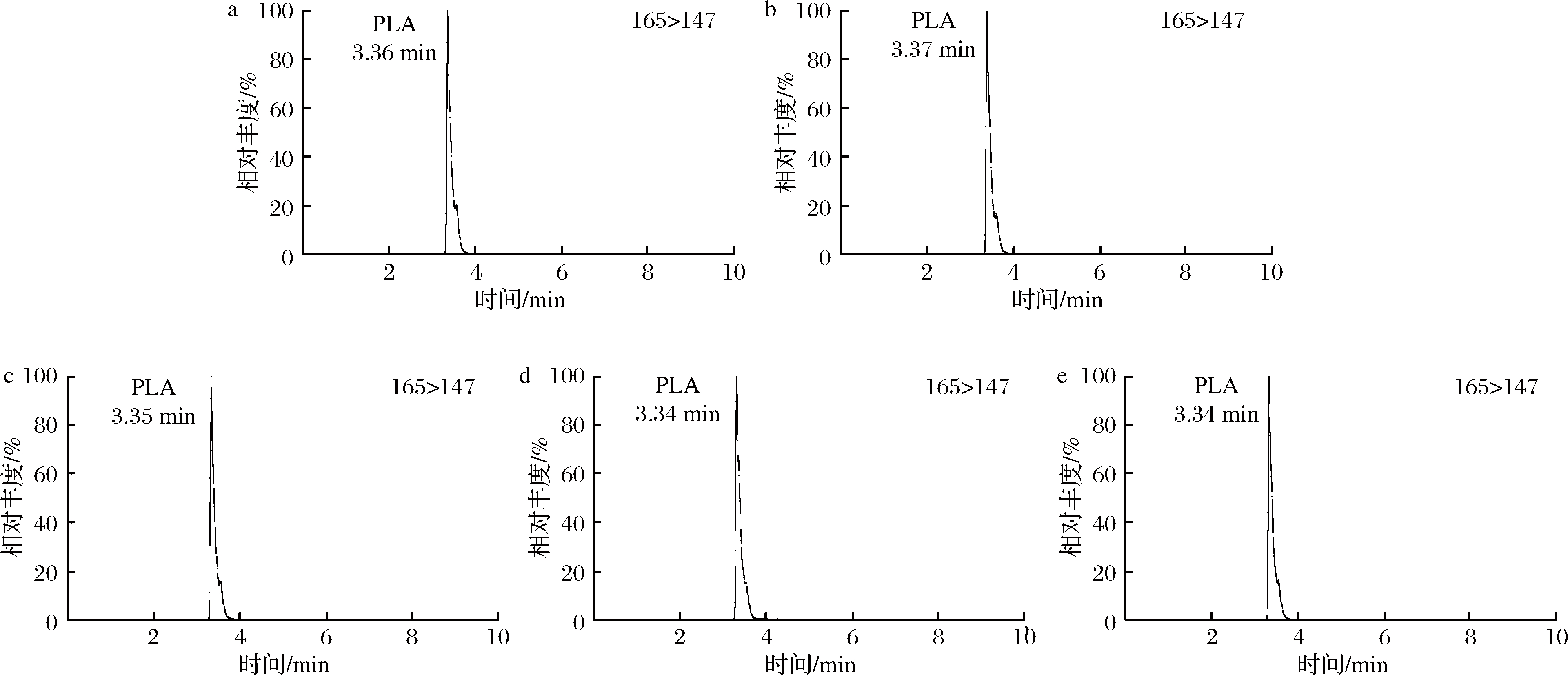
a-苯乳酸标准溶液;b-酱黄瓜;c-酸菜;d-酸奶;e-甜米酒
图4 四种发酵食品多反应监测色谱图
Fig.5 MRM chromatograms of four fermented products
本实验采用外标法对苯乳酸进行定量检测,通过分析5种浓度(0.40、0.80、2.00、4.00和10.00 mg/L)的标准品溶液,以标准品浓度为x轴,以峰面积为y轴,计算回归方程和系数。检出限定义为信噪比(RSN)为3时对应的质量浓度,定量限定义为RSN为10时对应的质量浓度。在1.3.3的色谱条件下,仪器平衡1 h后,仪器基线噪声为0.80 mAu。
标准溶液浓度对应峰面积见表1,回归方程y=290.29x+7.59且r>0.999 9,该方法在0.40~10.00 mg/L内有良好的线性。使用0.40 mg/L的标准溶液测定检出限和定量限,分别为0.16和0.52 mg/L,表明该方法灵敏度高,能够满足检测需要。
表1 线性回归方程、检出限和定量限
Table 1 Regression equation, LOD and LOQ of PLA reference solution

标准溶液质量浓度/(mg·L-1)峰面积/mAu线性方程r检出限/(mg·L-1)定量限/(mg·L-1)0.40115.77±0.280.80236.42±0.352.00592.60±0.274.001 193.40±0.1810.002 900.30±0.20y=290.29x+7.590.999 90.16±0.000 140.52±0.000 47
对酱黄瓜、东北酸菜、酸奶、甜米酒、腊肠加标测定回收率,分别向样品中分别加入低、中、高3个水平的苯乳酸标准品(即加入折合质量浓度为0.40、0.80和2.00 mg/L的标准品),按照1.3.3的条件进行2D-HPLC分析考察方法的回收率,每组6个平行。同时测定5种发酵食品中苯乳酸的含量,得出本方法回收率在91.79%~107.37%,RSD<15%,符合国家标准[27]。
由表2知,酱黄瓜、东北酸菜、酸奶、甜米酒能够检出苯乳酸,腊肠中未能检出苯乳酸。经测定东北酸菜和酸奶中苯乳酸含量分别为5.50和1.57 mg/L,市售东北酸菜和酸奶配料表中标识添加植物乳杆菌,未标识添加苯乳酸,苯检出的乳酸可能由乳酸菌发酵合成。酱黄瓜苯乳酸含量为8.01 mg/L,酱黄瓜无乳酸菌和苯乳酸添加标识,可能在腌制的无氧环境下有乳酸菌参与发酵,代谢生成苯乳酸。甜米酒中苯乳酸含量为9.08 mg/L,配料表中未标识添加乳酸菌和苯乳酸,但研究表明米酒中含有乳酸菌[28-29],检出的苯乳酸可能是由米酒中乳酸菌合成。广式腊肠中未检出苯乳酸,可能由于乳酸菌在广式腊肠中生长代谢更趋向于降解亚硝酸盐,有研究表明,乳酸菌通过合成酸类物质促进亚硝酸盐的降解[27]。
表2 样品中的苯乳酸含量和回收率实验
Table 2 PLA concerntration in five samples and recovery test

样品对照检出浓度质量/(mg·L-1)加标水平/(mg·L-1)加标样品检出质量浓度/(mg·L-1)回收率/%RSD/%0.401.45±0.04898.72±0.0545.47酸菜5.50±0.0680.801.92±0.033102.83±0.0424.042.003.25±0.040107.37±0.0201.870.401.84±0.01597.24±0.0383.94酱黄瓜8.01±0.000 910.802.22±0.04596.50±0.0565.792.003.64±0.055101.56±0.0252.470.400.55±0.017100.01±0.0323.25酸奶1.57±0.0110.800.98±0.027103.27±0.0343.252.002.17±0.13100.74±0.0636.300.402.67±0.01599.77±0.0393.96甜米酒9.08±0.00740.803.01±0.003 591.79±0.004 40.482.004.31±0.045101.58±0.022.190.400.39±0.006 197.15±0.0151.56广式腊肠—0.800.73±0.05691.11±0.077.712.001.98±0.09199.19±0.0464.59
制备6份2.00 mg/L标准溶液,在1.3.3所述色谱仪条件下,在日内和日间(24 h后)分别进样,测定并计算峰面积平均值和RSD。
重复性以RSD表示,表3结果显示该方法日内和日间重复性较好,RSD分别为0.60%和0.94%,能够满足检测要求。
表3 仪器精密度和重复性实验
Table 3 Repeatability test of the PLA reference solution

测定次数日内日间测定质量浓度/(mg·L-1)测定峰面积/mAuRSD/%测定质量浓度/(mg·L-1)测定峰面积/mAuRSD/%12.01589.622.03596.5222.02592.922.00588.7032.03591.172.04600.1342.03595.432.03597.5252.02594.462.01592.0662.04600.121.99585.76平均值2.02±0.01594.95±3.600.602.02±0.02593.45±5.550.94
本实验建立了一种2D-HPLC检测发酵食品中苯乳酸的方法,该方法相比传统1D-HPLC法灵敏度高,目标峰与杂质峰分离彻底。利用本方法测定5种发酵食品的加标回收率为91.79%~107.37%,检出限和定量限分别为0.16和0.52 mg/L,能够满足检测需求,同时本实验利用UPLC-MS/MS法进一步验证了样品中苯乳酸的存在性。本方法前处理步骤简单,适当稀释沉淀蛋白后即可进样;检测效率高、重复性好、结果准确,减少了杂质带来的影响;能够快速简便地检测出食品中的苯乳酸,适用于大批量样品的检测。
本实验利用2D-HPLC法测定出东北酸菜、酱黄瓜、甜米酒和酸奶中含有苯乳酸,其中甜米酒和酱黄瓜中的苯乳酸含量较高。苯乳酸的存在与微生物生长相关,筛选甜米酒和酱黄瓜中的苯乳酸合成菌有待进一步研究。在后续研究中可通过调整流动相洗脱方式,一次性检出多种组分。本方法也为2D-HPLC法测定发酵食品中其他组分提供参考和理论依据。
[1] DIEULEVEUX V,LEMARINIER S,GUÉGUEN M.Antimicrobial spectrum and target site of D-3-phenyllactic acid[J]. International Journal of Food Microbiology,1998,40(3):177-183.
[2] DIEULEVEUX V,GUÉGUEN M.Antimicrobial effects of D-3-phenyllactic acid on Listeria monocytogenes in TSB-YE medium, milk, and cheese [J].Journal of Food Protection,1998,61(10):1 281.
[3] LAVERMICOCCA P,VALERIO F,EVIDENTE A,et al.Purification and characterization of novel antifungal compounds from the sourdough Lactobacillus plantarum strain 21B.[J].Applied & Environmental Microbiology,2000,66(9):4 084-4 090.
[4] WILKINS A L,LU Y,MOLAN P C.Extractable organic substances from New Zealand unifloral manuka (Leptospermum. scoparium) honeys[J].Journal of Apicultural Research,1993,32(1):3-9.
[5] 李兴峰,江波,潘蓓蕾,等.产苯乳酸的乳酸菌分离筛选及菌种鉴定[J].食品与发酵工业,2007(2):1-4.
[6] DIEULEVEUX V,PYL D V D,CHATAUD J,et al.Purification and characterization of anti-Listeria compounds produced by Geotrichum candidum[J]. Applied and Environmental Microbiology, 1998, 64(2):800-803.
[7] THIERRY A,MAILLARD M B.Production of cheese flavor compounds derived from amino acid catabolism by Propionibacterium freudenreichii[J].Dairy Science & Technology,2002,82(1):17-32.
[8] LI X,NING Y,LIU D,et al.Metabolic mechanism of phenyllactic acid naturally occurring in Chinese pickles[J].Food Chemistry, 2015,186:265-270.
[9] JUNG S, HWANG H, LEE J.Effect of lactic acid bacteria on phenyllactic acid production in kimchi[J].Food Control,2019, 106:106 701.
[10] 黄国昌,熊大维,黄筱萍,等.高效液相色谱法检测发酵液中苯乳酸和苯丙氨酸含量的研究[J].江西科学,2016,34(5):614-618;702.
[11] GUAN J,GUAN Y X,YUN J,et al.Chromatographic separation of phenyllactic acid from crude broth using cryogels with dual functional groups[J].Journal of Chromatography A,2018,1 554:92-100.
[12] 沐万孟,周宏敏,刘凤丽,等.苯乳酸的快速检测研究[J].食品与发酵工业,2008,34(11):135-138.
[13] 王力,李向力,王法云,等.气相色谱法检测发酵液中苯乳酸含量的研究[J].食品科技, 2011,36(7):307-309.
[14] ARMAFORTE E,CARRI S,FERRI G,et al.High-performance liquid chromatography determination of phenyllactic acid in MRS broth[J].Journal of Chromatography A, 2006,1131(1-2):281-284.
[15] 付琳琳,曹郁生,李海星,等.应用PCR-DGGE技术分析泡菜中乳酸菌的多样性[J].食品与发酵工业,2005(12):103-105.
[16] 高秀芝,王小芬,李献梅,等.传统发酵豆酱与商品豆酱养分及微生物多样性比较[J].食品科学,2009,30(3):222-226.
[17] 欧阳晶,陶湘林,李梓铭,等.高盐辣椒发酵过程中主要成分及风味的变化[J].食品科学,2014,35(4):174-178.
[18] 张海波,张彦,陈少峰.江米酒中有机酸分析[J].食品科技,2007(7):203-205.
[19] 王娟娟,王顺喜,马微.直投式发酵剂生产酸菜及其风味物质的研究[J].食品科学,2008(4):82-86.
[20] 徐慧静,刘丽兰,刘莹,等.双三元高效液相色谱仪在线二维快速测定食品中维生素A、D、E方法的研究进展[J].中国标准化,2019(18):184-186.
[21] 萧伟斌,蹇阳,李桦.二维液相色谱在药物和毒物分析中的应用进展[J].分析化学,2014,42(12):1 851-1 858.
[22] DUGO P,CACCIOLA F,KUMM T,et al.Comprehensive multidimensional liquid chromatography: Theory and applications[J].Journal of Chromatography A,2008,1184(1-2):353-368.
[23] 郑国建,沈 鸣,林毅侃,等.二维液相色谱法检测婴幼儿奶粉中的牛磺酸[J].中国乳品工业,2019,47(4):53-55;59.
鸣,林毅侃,等.二维液相色谱法检测婴幼儿奶粉中的牛磺酸[J].中国乳品工业,2019,47(4):53-55;59.
[24] 叶佳明,王京,叶磊海,等.在线固相萃取-二维色谱快速测定配方奶粉、米粉中维生素D的含量[J/OL].食品与发酵工业:1-6.
[25] 张艳海,朱晓艳,曹国洲,等.在线二维柱切换-高效液相色谱法同时测定婴幼儿强化奶粉中维生素A、D3和E的含量[J].分析化学,2013,41(5):771-775.
[26] VALERIO F,LAVERMICOCCA P,PASCALE M,et al.Production of phenyllactic acid by lactic acid bacteria: an approach to the selection of strains contributing to food quality and preservation[J].FEMS Microbiology Letters,2004,233(2):289-295.
[27] GB/T 27404—2008 实验室质量控制规范 食品理化检测[S].北京:中国标准出版社,2008.
[28] 向凡舒,邓风,魏冰倩,等.不同来源酒曲酿制米酒中乳酸菌的分离与鉴定[J].中国酿造,2019,38(5):67-72.
[29] 杨小丽,高航,徐宝钗,等.孝感米酒中乳酸菌的分离及其对黄酒品质的影响[J].食品工业科技,2018, 39(18):93-98.
[30] 张庆芳,迟乃玉,郑燕,等.乳酸菌降解亚硝酸盐机理的研究[J].食品与发酵工业,2002,28(8):27-31.