过表达乙酰-CoA相关基因提高出芽短梗霉liamocins合成能力
郑鹏1,2,张孟娟1,2,黄思瑶1,2,康新玥1,2,陈叶福1,2*
1(天津科技大学 生物工程学院,天津,300457) 2(工业发酵微生物教育部重点实验室(天津科技大学),天津,300457)
摘 要 为提高出芽短梗霉liamocins合成能力,分别过表达了出芽短梗霉P30的乙酰-CoA合成相关基因,包括乙酰-CoA合酶编码基因(ACS1)、ATP-依赖性柠檬酸裂解酶编码基因(ACL)、苹果酸酶编码基因(ME)、丙酮酸羧化酶编码基因(PYC1)。重组菌株的liamocins产量分别提高了8.19%、93.74%、13.49%和17.12%,其中过表达ACL的提升效果最为明显,但该基因的转录水平仅提高了0.94倍,这说明ACL为出芽短梗霉 P30合成liamocins的关键基因,liamocins合成的能力或许受ACL转录水平的限制。结果表明,强化乙酰-CoA合成可以提高liamocins产量,而其中的ACL基因对其合成至关重要。研究为解决liamocins合成过程中碳代谢流前体不足问题提供了解决思路。
关键词 liamocins;乙酰-CoA;ATP-依赖性柠檬酸裂解酶;出芽短梗霉;代谢工程
DOI:10.13995/j.cnki.11-1802/ts.023234
引用格式:111郑鹏,张孟娟,黄思瑶,等.过表达乙酰-CoA相关基因提高出芽短梗霉liamocins合成能力[J].食品与发酵工业,2020,46(9):25-30.ZHENG Peng, ZHANG Mengjuan, HUANG Siyao, et al. Overexpression of acetyl-CoA synthase and relative enzymes enhanced liamocins synthesis in Aureobasidium pullulans[J].Food and Fermentation Industries,2020,46(9):25-30.
Overexpression of acetyl-CoA synthase and relative enzymes enhanced
liamocins synthesis in Aureobasidium pullulans
ZHENG Peng1,2, ZHANG Mengjuan1,2, HUANG Siyao1,2,KANG Xinyue1,2, CHEN Yefu1,2*
1(College of Bioengineering, Tianjin University of Science and Technology, Tianjin 300457,China) 2(Key Laboratory of Industrial Fermentation Microbiology, Ministry of Education, Tianjin University of Science and Technology,Tianjin 300457, China)
Abstract To improve liamocins synthesis in Aureobasidium pullulans, acetyl-CoA synthase encoded by ACS1, ATP-dependent citrate lyase (ACL), malate enzyme (ME) and pyruvate carboxylase (PYC1) were overexpressed in Aureobasidium pullulans P30. After overexpression of ACS1, ACL, ME and PYC1, the yield of liamocins increased by 8.19%, 93.74%, 13.49% and 17.12%, respectively. Among them, overexpression of ACL achieved the highest liamocins production (19.44 g/L), even if its transcription level only increased by 94%, indicating that ACL is the key enzyme in liamocins synthesis. Elevation of the ACL transcription level may help for further improving the liamocins' production. The results indicated that acetyl-CoA synthesis pathway was important for liamocins production. The findings in this study provide a new way for enhancing the synthesis of liamocins by providing sufficient precursors.
Key words liamocins; acetyl-CoA; ATP-citrate lyase; Aureobasidium pullulans; metabolic engineering
第一作者:硕士研究生(陈叶福教授为通讯作者,E-mail:yfchen@tust.edu.cn)
基金项目:工业微生物优良菌种选育与发酵技术公共服务平台(17PTGCCX00190)
收稿日期:2020-01-01,改回日期:2020-02-10
出芽短梗霉为类酵母真菌,由于产生黑色素所以被称为黑酵母[1],具有相当重要的生物技术意义、良好的抗环境压力能力,越来越受到医学方面的关注。出芽短梗霉因生长环境的不同而具有5种形态:酵母状细胞、芽孢子、肿胀孢子、菌丝状细胞和厚垣孢子[2]。出芽短梗霉因可以生产多种胞外酶[3-4]、单细胞蛋白、铁载体[5]、短梗霉素、普鲁兰糖[6]、聚苹果酸[7]和重油[8]等多种产物而闻名,并且能应用于生物防治[9]。其中普鲁兰糖是由其合成的一种胞外多糖,它由麦芽三糖以α-(1→6)糖苷键反复连接而成,特殊的化学结构赋予普鲁兰糖优良的性质,它黏度大、水溶性极强,在化工、食品、医药等行业应用广泛,可作为增稠剂,也能用于生产可被微生物降解的薄膜,还可作为低卡路里食品直接食用[10]。
Liamocins的生产首先由RUINEN等[11]报道,通过20号和272号出芽短梗霉生产。liamocins这个词是PRICE等[12]在确定了这个新化合物家族的详细结构后首次使用的。liamocins由一个部分乙酰化的多元醇头基团和1~5个3,5-二羟基癸酸酯基尾组成,在第1个3,5-二羟基癸酸中有可能会有3-O-乙酰化的现象。而多元醇头基团的结构和培养基中所用糖的种类无关,主要与菌种[13]和培养基中多元醇种类相关[14]。
Liamocins具有多种商业应用价值,它是比水密度大的油,所以之前一直被称为重油,颜色多为浅黄、深绿、深棕色;表面张力介于27~31.5 mN/m[8],可作为商业用表面活性剂使用。多篇报道显示,liamocins对某些癌细胞具有抗增殖作用[15-16];具有较强的选择性抗菌能力,对链球菌属有特异性,为出芽短梗霉的一个普遍特性[17];此外,即使受到加热影响仍能保持抗菌活性[13]。
Liamocins的完全合成途径至今尚不清楚。在同位素标记的[U-13C]葡萄糖上培养Aureobasidium pullulans NRRL 50380,使用MALDI-TOFMS分析liamocins,在甘露醇部分发现了13C标记,但是在3,5-二羟基癸酸部分并没有发现[12]。这一信息表明,liamocins的生物合成是相当复杂的。TANG等[18]通过在A. melanogenum 9-1中过表达高产聚苹果酸菌株Aureobasidium sp. P6的PYC1基因,通过提高柠檬酸的产量来提高liamocins的产量,并推测柠檬酸和乙酰-CoA为liamocins的重要前体物质。值得注意的是,在过表达PYC1的同时,ACL和ME基因的转录水平都有不同程度的提高。
本实验以出芽短梗霉P30为研究对象,通过代谢工程改造出芽短梗霉,过表达乙酰-CoA合酶、ATP-依赖性柠檬酸裂解酶、苹果酸酶和丙酮酸羧化酶基因,使胞质乙酰-CoA含量提高,从而来达到高产liamocins的目的。
1 材料和方法
1.1 材料
1.1.1 菌株、质粒和引物
Aureobasidium pullulans P30(后文简称P30)由本实验室保藏于-80 ℃冰箱,质粒pUC-AHPT和pUC-GB由本实验室构建保藏,实验所用引物由苏州金唯智生物科技有限公司合成,如表1所示。
表1 本研究所用引物
Table 1 Primers used in this study

引物引物序列 (5'→3')FA-UTCGGCATCTATTTTGAGATGCTGHPGKp-DGAGAGGTTACCTAAGTGAGGCAATGTCTTCCCTTTCACTAGGTCGHPGKp-UCTGTCCGACCTAGTGAAAGGGAAGACATTGCCTCACTTAGGTAACCFB-DTAGTAAGGCACAGTCAAAGCPpACS-DGCTTGACATCTCCGTCAGACATTGTGACTGAATCGAGTGTGTCACS1-UGTCTGACACACTCGATTCAGTCACAATGTCTGACGGAGATGTCAAGCACS1-DGCTTGGTCATACGCACATCAGAGATCTTCTTGCTGGCGTGCACAACACSGt-UGTTGTGCACGCCAGCAAGAAGATCTCTGATGTGCGTATGACCAAGCPpACL-DGAGGATCGACTTTGCGGACATTGTGACTGAATCGAGTGTGTCACL-UGTCTGACACACTCGATTCAGTCACAATGTCCGCAAAGTCGATCCTCACL-DGCTTGGTCATACGCACATCAGAGATATGCACCGAACTCCTTGATGTCACLGt-UGACATCAAGGAGTTCGGTGCATATCTCTGATGTGCGTATGACCAAGCPpME-DGCAATTGATGCTGAGGAAGACATTGTGACTGAATCGAGTGTGTCME-UGTCTGACACACTCGATTCAGTCACAATGTCTTCCTCAGCATCAATTGCME-DCTTGGTCATACGCACATCAGAGATAAAGCCTGGAGAGGTGGGAAGCGAGMEGt-UCTCGCTTCCCACCTCTCCAGGCTTTATCTCTGATGTGCGTATGACCAAGCPpPYC-DGAGCTTCAAGGTCCGACATTGTGACTGAATCGAGTGTGTCPYC1-UGTCTGACACACTCGATTCAGTCACAATGTCGGACCTTGAAGCTCPYC1-DGCTTGGTCATACGCACATCAGAGATATTTGACGATCTTGCAAATAAGGTCPYCGt-UGACCTTATTTGCAAGATCGTCAAATATCTCTGATGTGCGTATGACCAAGC
1.1.2 培养基
YEPD培养基(g/L):酵母浸粉10.0,葡萄糖20.0,蛋白胨20.0,固体YEPD培养基加入2.0 g/L的琼脂粉。HCS培养基(g/L):葡萄糖10.0,酵母浸粉3.0,牛肉膏1.0,蛋白胨10.0,麦芽浸粉3.0,HCl调至pH 5.7,固体HCS培养基加入2.0 g/L琼脂粉。HCS双层培养基:上层为固体HCS培养基,下层固体HCS培养基添加潮霉素B溶液,使终质量浓度为150.0 mg/L。种子培养基(g/L):木糖20.0,酵母浸粉1.0,K2HPO4 4.0,(NH4)2SO4 0.8,MgSO4 0.2,NaCl 4.0,用HCl调pH至6.0。发酵培养基(g/L):木糖50.0,酵母浸粉2.0,KNO3 0.8,NaCl 2.0,K2HPO4 5.0,MgSO4 0.3,用HCl调pH至5.5。
1.1.3 酶和试剂
DNA marker、Taq DNA聚合酶、dNTP、Primer Star GXL聚合酶、RNA提取试剂盒和反转录试剂盒,TaKaRa中国大连公司;胶回收试剂盒、片段回收试剂盒和质粒提取试剂盒,OMEGE公司;潮霉素B,上海索宝生物科技有限公司。
1.2 仪器与设备
电穿孔仪,美国BTX公司;凝胶成像仪,美国SYN gENE公司;分光光度计,天津普瑞斯公司。
1.3 实验方法
1.3.1 重组菌株的构建
重组菌株的构建采用GUO等[19]的同源重组依赖性DNA装配方法。因普鲁兰糖和liamocins均含有大量碳元素,可能存在碳流竞争的关系,所以以编码普鲁兰糖合成酶基因(PUL1)为整合位点,使碳流更多地流向liamocins的合成。因此,在PUL1位点整合过表达ACS1、ACL、ME、PYC1基因。
1.3.2 培养方法
菌株活化:从甘油管中取10 μL菌液接入装有5 mL YEPD试管中,28 ℃,200 r/min,培养24 h。
种子培养:从活化的菌液中,取1 mL菌液接入到50 mL/250 mL锥形瓶种子培养基中,28 ℃,200 r/min,培养24 h。
发酵培养:将培养好的种子液3 mL接入到50 mL/250 mL锥形瓶发酵培养基中,28 ℃,240 r/min,培养7 d。
1.3.3 重组菌株生长性能测定
从甘油管中取10 μL P30接种于YEPD液体培养基进行活化,于28 ℃,200 r/min的摇床中培养24 h。取已灭菌的装液量为50 mL YEPD液体培养基的250 mL三角瓶,加入50 μL活化的菌液,于28 ℃,200 r/min的摇床中培养。每隔4 h取0.5 mL菌悬液,在12 000 r/min的转速下离心1 min,弃上清液,再用蒸馏水洗涤2次菌体,最后加入2 mL蒸馏水混匀。以蒸馏水为对照,用紫外分光光度计测定OD600值。以时间为横坐标,OD值为纵坐标,绘制出生长曲线。
1.3.4 发酵产物的分析方法
生物量、木糖和胞外普鲁兰糖的测定:根据杨金龙等[20]的方法进行测定。发酵液中liamocins含量测定:根据GUO[19]的方法测定。
1.3.5 mRNA水平的测定
本实验中所有P30总RNA的提取和反转录所用的试剂盒均由TaKaRa公司提供,操作方法严格按照试剂盒说明书进行。mRNA的水平采用Bio-Rad QX200微滴式数字PCR系统的染料法进行测定。
2 结果和分析
2.1 重组菌株的构建
将上同源臂、下同源臂、潮霉素B抗性、磷酸甘油酸激酶(phosphoglycerate kinase, PGK)启动子、3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAP)终止子和目的基因按照1.3.1方法,转入P30中,得到疑似转化子,并进行PCR验证,得到对应重组菌株。PCR验证结果如图1所示。M泳道为DNA marker,1和3泳道为阴性对照,2,4泳道为以重组菌株基因组为模板所得验证片段,片段大小均符合预期。说明分别过表达ACS1,ACL,ME,PYC1所得到的重组菌株PEACS1、PEACL、PEME、PEPYC1构建成功。对构建成功的过表达菌株进行保藏以便后续研究。
2.2 生长性能测定
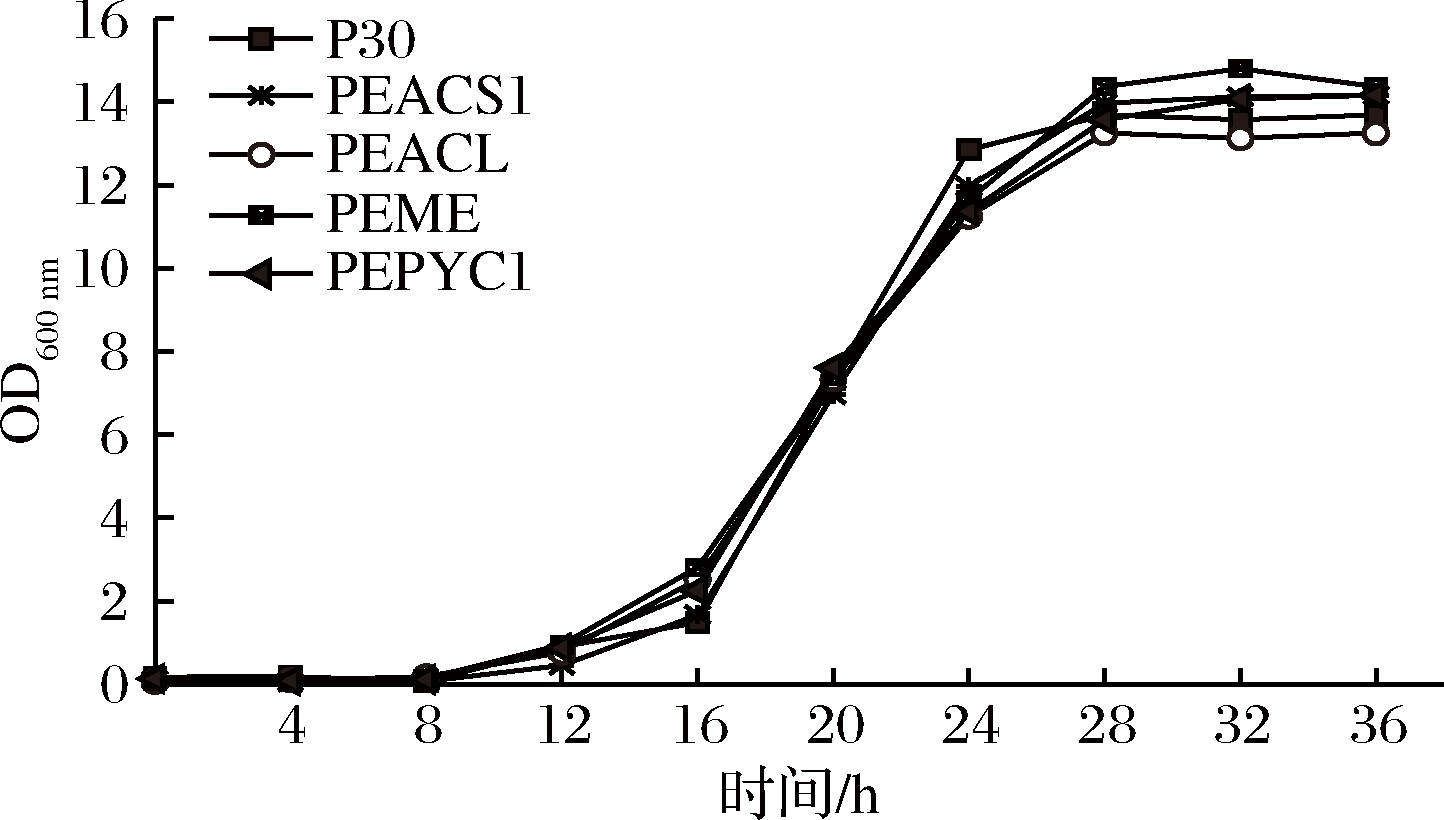
将4株改造菌与出发菌株P30分别按照1.3.3方法进行培养,测定生长曲线,如图2所示。4株重组菌生长趋势与出发菌基本一致,说明过表达ACS1、ACL、ME和PYC1基因对菌株的生长性能无明显影响。
2.3 木糖利用能力测定
在发酵培养基中对重组菌株和出发菌株发酵,每24 h测定发酵液中木糖剩余量和生物量,如图3所示。图3-a中重组菌株木糖消耗曲线同出发菌株P30基本一致,发酵7 d后发酵液中无木糖残留,说明重组菌的木糖利用能力没有受影响。图3-b中重组菌株总体增长趋势与出发菌株P30较为一致,但在发酵培养基中培养结束后,PEACL的生物量比出发菌低了19.83%,而在测定生长曲线时,显示PEACL的生长未受到影响。或许是因为大量的底物转化为乙酰-CoA从而增强了liamocins合成的同时,导致菌体生长所需营养供应减弱。
2.4 重组菌株发酵性能的探究
将重组菌株与原始菌株P30在发酵培养基中发酵,待发酵结束后测定菌体干重、普鲁兰糖和liamocins产量,如图4所示。
重组菌株的普鲁兰糖产量均低于P30,PEACS1、PEACL、PEME、PEPYC1的普鲁兰糖产量分别降低了12.29%、11.90%、9.37%、13.37%。liamocins的产量较出发株均有所提升,PEACS1、PEACL、PEME、PEPYC1的产量分别比P30高了8.19%、93.74%、13.49%、17.12%。普鲁兰糖的产量略有降低,可能因为一部分碳代谢流向了liamocins的合成。PYC1催化丙酮酸到草酰乙酸的转化,然后在苹果酸脱氢酶的催化下将产生的草酰乙酸还原为苹果酸。当一分子苹果酸通过线粒体柠檬酸转运蛋白(citrate transporter, CTP)进入线粒体,同时一分子柠檬酸通过CTP转移到细胞质中。线粒体中的苹果酸被转化为草酰乙酸,其通过三羧酸循环进一步与乙酰-CoA缩合,产生柠檬酸。细胞质中的柠檬酸在ACL的催化下,随后转化为乙酰-CoA和草酰乙酸。TANG等[18]在高产liamocins菌株A. melanogenum 9-1中异源表达高产聚苹果酸菌株Aureobasidium sp. P6的PYC1基因,能明显提高liamocins产量,但本实验过表达P30的PYC1后,liamocins产量没有达到预期效果,还需要进一步研究,找出原因。产油酵母可以积累超过其生物量20%的油脂[21],而其中关键酶为ACL,可催化柠檬酸转化为乙酰-CoA和草酰乙酸,前者为脂肪酸和liamocins合成的重要前体。本研究也说明过表达ACL可以大幅度提升liamocins的合成。在过表达ACL后,虽然liamocins的产量提升非常明显,但是生物量和普鲁兰糖的量却有了较为明显的降低,或许是由于该基因的过表达,扰动了菌体本身的代谢流,使底物更多流向liamocins合成。ME的过表达并没有使liamocins的产量明显提升,或许是因为大量的苹果酸转化为丙酮酸,柠檬酸和苹果酸线粒体穿梭中的苹果酸供应不足,从线粒体内转运到细胞质中的乙酰-CoA合成的前体物质柠檬酸减少。ACS可催化乙酸生成乙酰-CoA,而本实验过表达ACS1后liamocins产量提升幅度并不是很大,或许是因为出芽短梗霉中ACS并不是合成乙酰-CoA的关键酶。周丹凤[22]采用菌株ZUST-GS,利用75.17 g/L的木糖发酵,得到8.41 g/L的liamocins,转化率为0.11 g/g。LEATHERS等[23]使用菌株A. pullulans NRRL 50384利用120 g/L的蔗糖发酵,得到22 g/L的liamocins,转化率为0.18 g/g。TANG等[18]使用菌株A. melanogenum M39,利用140 g/L的葡萄糖发酵,得到35.3 g/L的liamocins,转化率为0.25 g/g。以上分别为出芽短梗霉以木糖、蔗糖、葡萄糖为主要碳源发酵产liamocins的最大产量及liamocins转化率。PEACL利用50 g/L木糖发酵,得到19.44 g/L的liamocins,转化率为0.38 g/g。虽然NRRL 50384和M39的liamocins产量高于PEACL,但转化率均较低,PEACL的liamocins的产量和转化率均优于ZUST-GS。
2.5 过表达基因转录水平测定
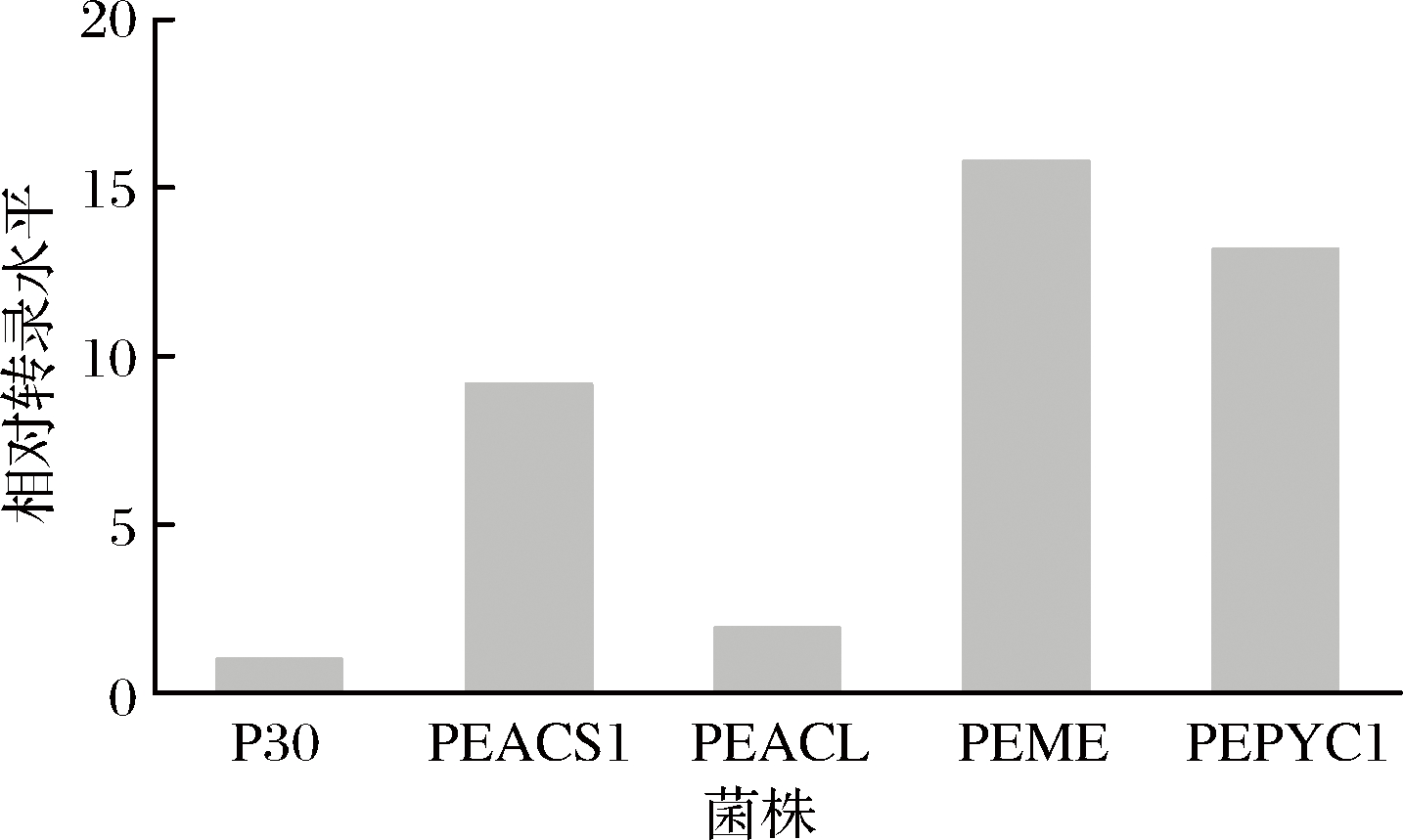
分别提取出发菌株和重组菌株的RNA,并选取3-磷酸-甘油醛脱氢酶基因(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)作为内参进行微滴式数字PCR反应。分别对每株重组菌株对应基因的转录水平进行定量分析,如图5所示。重组菌株的相应基因的转录水平都有所升高,进一步验证了所有过表达菌株均构建成功,但结果显示,各个基因的转录水平提高程度不尽相同。过表达ACS1、ACL、ME、PYC1基因菌株的转录水平分别提高了8.16、0.94、14.78和12.17倍。值得注意的是,虽然PEACL对应基因的转录水平提高较低,但从发酵结果来看,其liamocins产量的提升幅度非常高,远大于过表达其他基因的菌株,这表明出发株P30的liamocins合成或许受到ACL的转录水平限制,而ACL为P30合成liamocins的关键酶。
3 结论
本研究分别过表达乙酰-CoA合成相关基因ACS1、ACL、ME、PYC1,成功构建了重组菌株PEACS1、PEACL、PEME和PEPYC1。结果发现,重组菌株的liamocins产量都有不同程度的提高,效果最明显的是过表达ACL,虽然该基因过表达后其转录水平提升幅度不大,但liamocins产量提高了93.74%,这说明过表达该基因能明显地促进liamocins合成,并且该基因为P30合成liamocins的关键基因,其合成liamocins的能力或许受ACL转录水平的限制。以上结果说明,强化乙酰-CoA合成可以提高liamocins产量,而其中的ACL基因对出芽短梗霉liamocins的合成至关重要。
参考文献
[1] DE H G S. Evolution of black yeasts: possible adaptation to the human host [J]. Antonie Van Leeuwenhoek, 1993, 63(2): 105-109.
[2] 常帆,薛文娇,安超,等.出芽短梗霉及其生物产品研究进展[J].保鲜与加工,2013,13(4):48-56.
[3] LEITE R S R, GOMES E, DA SILVA R. Characterization and comparison of thermostability of purified β-glucosidases from a mesophilic Aureobasidium pullulans and a thermophilic Thermoascus aurantiacus[J]. Process Biochemistry, 2007, 42(7): 1 101-1 106.
[4] LEATHERS T D. Color Variants of Aureobasidium pullulans overproduce xylanase with extremely high specific activity [J]. Applied and Environmental Microbiology, 1986, 52(5): 1 026-1 030.
[5] WANG W L, CHI Z M, CHI Z, et al. Siderophore production by the marine-derived Aureobasidium pullulans and its antimicrobial activity [J]. Bioresour Technol, 2009, 100(9): 2 639-2 641.
[6] SUTHERLAND I W. Novel and established applications of microbial polysaccharides [J]. Trends in Biotechnology, 1998, 16(1): 41-46.
[7] CHENG C, ZHOU Y, LIN M, et al. Polymalic acid fermentation by Aureobasidium pullulans for malic acid production from soybean hull and soy molasses: Fermentation kinetics and economic analysis [J]. Bioresour Technol, 2017, 223: 166-174.
[8] MANITCHOTPISIT P, PRICE N P, LEATHERS T D, et al. Heavy oils produced by Aureobasidium pullulans [J]. Biotechnology Letters, 2011, 33(6): 1 151-1 157.
[9] MOUNIR R, DURIEUX A, BODO E, et al. Production, formulation and antagonistic activity of the biocontrol like-yeast Aureobasidium pullulans against Penicillium expansum[J]. Biotechnology Letters, 2007, 29(4): 553-559.
[10] 郭建,黄思瑶,郑鹏,等.载脂蛋白基因apo和gltP对普鲁兰多糖合成的影响[J].天津科技大学学报,2019,34(2):12-18.
[11] RUINEN J, DEINEMA M H. Composition and properties of the extracellular lipids of yeast species from the phyllosphere [J]. Antonie Van Leeuwenhoek, 1964, 30: 377-384.
[12] PRICE N P, MANITCHOTPISIT P, VERMILLION K E, et al. Structural characterization of novel extracellular liamocinss (mannitol oils) produced by Aureobasidium pullulans strain NRRL 50380 [J]. Carbohydr Res, 2013, 370: 24-32.
[13] BISCHOFF. Novel oils having antibacterial activity: United States, US 2017/0050916 Al [P]. 2017-02-23.
[14] PRICE N P, BISCHOFF K M, LEATHERS T D, et al. Polyols, not sugars, determine the structural diversity of anti-streptococcal liamocinss produced by Aureobasidium pullulans strain NRRL 50380 [J]. The Journal of Antibiotics, 2017, 70(2): 136-141.
[15] ISODA H, KITAMOTO D, SHINMOTO H, et al. Microbial extracellular glycolipid induction of differentiation and inhibition of the protein kinase C activity of human promyelocytic leukemia cell line HL60 [J]. Biosci Biotechnol Biochem, 1997, 61(4): 609-614.
[16] ISODA H, NAKAHARA T. Antiproliferative effect of polyol lipids, 3,5-dihydroxydecanoyl and 5-hydroxy-2-decenoyl esters of arabitol and mannitol on lung cancer cell line A549 [J]. Journal of Fermentation and Bioengineering, 1997, 84(5): 403-406.
[17] BISCHOFF K M, LEATHERS T D, PRICE N P, et al. Liamocins oil from Aureobasidium pullulans has antibacterial activity with specificity for species of Streptococcus[J]. The Journal of Antibiotics, 2015, 68(10): 642-645.
[18] TANG R R, CHI Z, JIANG H, et al. Overexpression of a pyruvate carboxylase gene enhances extracellular liamocins and intracellular lipid biosynthesis by Aureobasidium melanogenum M39 [J]. Process Biochemistry, 2018, 69: 64-74.
[19] GUO J, WANG Y, LI B, et al. Development of a one-step gene knock-out and knock-in method for metabolic engineering of Aureobasidium pullulans [J]. Journal of Biotechnology, 2017, 251: 145-150.
[20] 杨金龙,陈叶福,郭建,等.双波长分光光度法快速测定利用木糖生产普鲁兰多糖发酵液中的多糖产量与残余木糖量[J].分析实验室,2016,35(2),224-227.
[21] VENKITASUBRAMANIAN P, DANIELS L, ROSAZZA J P. Reduction of carboxylic acids by Nocardia aldehyde oxidoreductase requires a phosphopantetheinylated enzyme [J]. The Journal of Biological Chemistry, 2007, 282(1): 478-485.
[22] 周丹凤.出芽短梗霉发酵产liamocins的研究[D].浙江:浙江科技学院,2019.
[23] LEATHERS, TIMOTHY D, SKORY, CHRISTOPHER D, et al. Medium optimization for production of anti-streptococcal liamocinss by Aureobasidium pullulans [J]. Biocatalysis and Agricultural Biotechnology, 2018, 13: 53-57.