葡萄糖氧化酶(glucose oxidase,EC1.1.3.4 GOD)是一种黄素蛋白(flavoprotein),能够以分子氧为电子受体,将β-D-葡萄糖催化氧化成葡萄糖酸内酯与过氧化氢(H2O2)[1-3]。葡萄糖氧化酶具有催化效率高、无毒副作用、高度专一性等特点,并能将葡萄糖氧化成葡萄糖酸而起到去除葡萄糖、脱氧、杀菌等效果[4],因而被广泛地应用于医药生产[5-6]、食品加工[7-10]、饲料添加[11-12]等方面。
目前测定葡萄糖氧化酶的方法主要有滴定法、电化学法和分光光度法[13-16]。滴定法试剂成本低,但反应体系较大,操作繁琐,灵敏度低,结果误差较大[16]。电化学法易受溶液中溶氧以及电化学活性物质的干扰,检测结果不稳定[13]。分光光度法常用的供体有邻联茴香胺、4-氨基安替比啉酚类化合物等,存在显色物质不稳定,标准曲线重复性差,测定值偏低等问题[14]。目前最被广泛接受的检测方法是邻联茴香胺-辣根过氧化物酶偶联的分光光度法(双酶法),但邻联茴香胺存在致癌风险,且辣根过氧化物酶价格较贵,导致检测成本较高。
本方法借鉴了过氧化氢酶含量检测方法[17]以及碘-淀粉体系显色原理[18-21],以β-D-葡萄糖为底物,利用葡萄糖氧化酶特异性催化作用,生成中间产物过氧化氢;过氧化氢可与钼酸铵、KI反应生成单质碘;单质碘在酸性条件下与可溶性淀粉反应生成蓝色物质,该蓝色物质在一定浓度范围内,颜色深浅与酶活力呈正相关,从而建立一种新的葡萄糖氧化酶活性测定方法——碘-淀粉分光光度法。并与目前酶制剂企业采用较多的双酶法进行了比较研究。
Metash UV系列紫外可见分光光度计,上海元析仪器有限公司;HH-601超级恒温水浴锅,金坛市天竟实验仪器厂;Eppendorf移液器、Eppendorf Centrifuge5424R离心机,艾本德中国有限公司;Mettler ME204E分析天平、Mettler FiveEasy Plus pH计,梅特勒-托利多仪器(上海)有限公司;Vortex-5涡旋混合仪,其林贝尔仪器制造有限公司。
葡萄糖(Sigma);可溶性淀粉(湖州展望药业有限公司);邻联茴香胺(ACROS);辣根过氧化物酶(Vetec V900603-100MG);H2SO4(体积分数95%~98%)。
除特殊说明外,本文所用的试剂均为分析纯,水均为符合GB/T 6682—2008中规定的二级水。
1.2.1 乙酸-乙酸钠缓冲液(0.2 mol/L)
准确称取无水乙酸钠13.90 g,溶于900 mL去离子水中,搅拌至完全溶解,加入乙酸调节pH至5.50,用去离子水定容至1 L。
1.2.2 KI溶液(100 g/L)
准确称取10.000 g KI,溶于80 mL 乙酸-乙酸钠缓冲液中(1.2.1),搅拌至完全溶解,用乙酸-乙酸钠缓冲液定容至100 mL。避光存储,现配现用。
1.2.3 葡萄糖溶液(180 g/L)
准确称取18.000 g葡萄糖,溶于80 mL水中,搅拌至完全溶解,用水定容至100 mL。
1.2.4 钼酸铵溶液(100 g/L)
准确称取10.000 g四水合钼酸铵,溶于80 mL水中,搅拌至完全溶解,用水定容至100 mL。
1.2.5 可溶性淀粉溶液(20 g/L)[22]
准确称取2.000 g(精确至0.001 g)可溶性淀粉(以绝干计)于烧杯中,用少量水调成浆状物,边搅拌边缓慢加入70 mL沸水中,然后用水分次冲洗装淀粉的烧杯,洗液倒入其中,搅拌加热至完全透明,冷却定容至100 mL。溶液现配现用。
1.2.6 柠檬酸溶液(1 mol/L)
准确称取一水合柠檬酸21.014 g,溶于80 mL水中,搅拌至完全溶解,用水定容至100 mL。
1.2.7 邻联茴香胺溶液(10 g/L)
称取0.100 g邻联茴香胺,加入10 mL甲醇充分溶解,有效期3 d。使用时取1 mL加入到120 mL乙酸-乙酸钠缓冲液(0.1 mol/L,pH 5.50)中,混匀备用,现配现用。
1.2.8 辣根过氧化物酶溶液(0.3 g/L)
准确称取辣根过氧化物酶3 mg,溶于10 mL水中。
1.2.9 H2SO4溶液(200 g/L)
准确称取200.0 g H2SO4液体,缓慢倒入水中,边倒边搅拌,冷却至室温,用水定容至1 L。
2.1.1 碘-淀粉分光光度法
(1)标准曲线的制作
对市售体积分数30%过氧化氢溶液进行标定后,用水稀释配制成质量浓度(ρ)分别为0、10、20、30、40、50、60 μg/mL(n=7)的过氧化氢标准液。取洁净试管7支,依次编号0~6。在试管中依次加入2.5 mL KI溶液、0.3 mL葡萄糖溶液、0.1 mL钼酸铵溶液、0.1 mL淀粉溶液以及0.1 mL上述不同质量浓度过氧化氢标准溶液,混匀后加入2 mL柠檬酸溶液。在570 nm处用1 cm光径比色皿比色,以0号管为对照,记录不同质量浓度过氧化氢标准液对应的吸光值。以显色体系中过氧化氢终质量浓度(ρ/51)为横坐标,对应吸光值为纵坐标绘制标准曲线。
(2)样品的测定
取洁净试管若干,在试管中依次加入2.5 mL KI溶液、0.3 mL葡萄糖溶液、0.1 mL 钼酸铵溶液、0.1 mL 淀粉溶液,混匀置于37℃水浴中预热3 min,间隔加入0.1 mL样品稀释液,准确计时反应3 min。加入2 mL柠檬酸溶液结束反应。分光光度计570 nm可见光下使用1 cm光径比色皿比色。空白管以0.1 mL缓冲液或热失活的酶液代替。
酶活性定义:在37 ℃、pH 5.50条件下,每分钟从0.1 mol/L 的β-D-葡萄糖溶液体系中释放出1 μmol 过氧化氢,即为1个葡萄糖氧化酶活力单位(U)。
酶活力按公式(1)计算:
酶活力![]()
(1)
式中:酶活力单位为 U/g或U/mL;ΔA,样品吸光值与空白吸光值的差值;K,H2O2标准曲线斜率;b,H2O2标准曲线截距;3,酶促反应时间,min;34,H2O2质量浓度,g/L;5.1,反应体系总体积,mL;0.1,加样量体积,mL;N,试样总稀释倍数。
2.1.2 双酶法
取洁净试管若干,在试管中依次加入2.5 mL邻联茴香胺溶液,0.3 mL 葡萄糖溶液,0.1 mL 辣根过氧化物酶溶液,混匀置于37℃水浴中预热3 min,间隔加入0.1 mL样品稀释液,准确计时反应3 min,加入2 mL H2SO4溶液终止反应。分光光度计460 nm可见光下使用1 cm光径比色皿比色。
酶活力按公式(2)计算:
酶活力![]()
(2)
式中:葡萄糖氧化酶的活性单位为U/g或U/mL;ΔA,样品吸光值与样品空白吸光值的差值;5,反应体系总体积,mL;3,反应时间,min;0.1,加样量体积,mL;m,样品质量或体积,g或mL;F,体积稀释倍数(试样总稀释倍数N=F/m);11.3,消光系数,mL/(μmol·cm)。
市售葡萄糖氧化酶固体样品1个,实验室摇瓶发酵液体样品1个以及市售葡萄糖氧化酶液体样品1个,编号为S1、S2、S3。
葡萄糖氧化酶固体样品首先需要预处理,即用乙酸-乙酸钠缓冲液(1.2.1)称取质量稀释50倍,磁力搅拌器涡旋10 min,10 000 r/min条件下离心5 min,取上清液进行后续体积稀释,完成后编号备用。液体酶制剂直接用乙酸-乙酸钠缓冲液进行体积稀释,完成后编号备用。
3.1.1 碘-淀粉分光光度法标准曲线的绘制
按照2.1.1方法绘制碘-淀粉标准曲线,得到标准曲线方程Y=0.789 3X-0.047 9,r=0.999 7。其中X为显色体系中过氧化氢终浓度,Y为对应吸光值,r为相关系数。
3.1.2 碘-淀粉分光光度法测定供试样品
碘-淀粉分光光度法检测样品S1、S2和S3的酶活力结果依次为6 753、2 986、10 842 U/mL;体系吸光值有效范围在0.1~0.6。葡萄糖氧化酶浓度控制在0.1~0.5 U/mL时,检测平行性良好,相对酶活力检测偏差在5%以内,结果如表1、表2和表3所示。
3.2.1 两种方法检测结果比较
碘-淀粉分光光度法酶活力测定值显著高于双酶法。分析表1、表2和表3可知,碘-淀粉分光光度法的检测值约为双酶法的2~3倍。比较2组方法对同一组样品的检测结果,可以看出碘-淀粉分光光度法更容易检出样品中的葡萄糖氧化酶成分。
3.2.2 两种方法吸光值有效范围比较
将同一份样品进行梯度稀释,得到梯度酶浓度稀释液。在酶促反应体系中,随着酶浓度增大,酶活计算结果呈降低趋势。呈现该趋势的主要原因是随着酶活力增大,底物对于酶活力不再绝对过量,反应对准一级反应动力学有所偏离[16]。分析表1~表3,碘-淀粉分光光度法在检测固体样品S1、发酵液样品S2以及液体成品S3时,酶促反应体系与H2O2响应曲线在0.1~0.6的吸光值区间匹配良好,酶活力检测结果相对偏差5%以内;双酶法在吸光值0.1~0.2附近检测结果良好,酶活力计算结果相对偏差10%以内。对于成分组成不同的样品,吸光值范围略有波动。
表1 两种方法同时检测固体样品S1的数据比较
Table 1 Comparison of two methods for simultaneousdetermination of solid sample S1
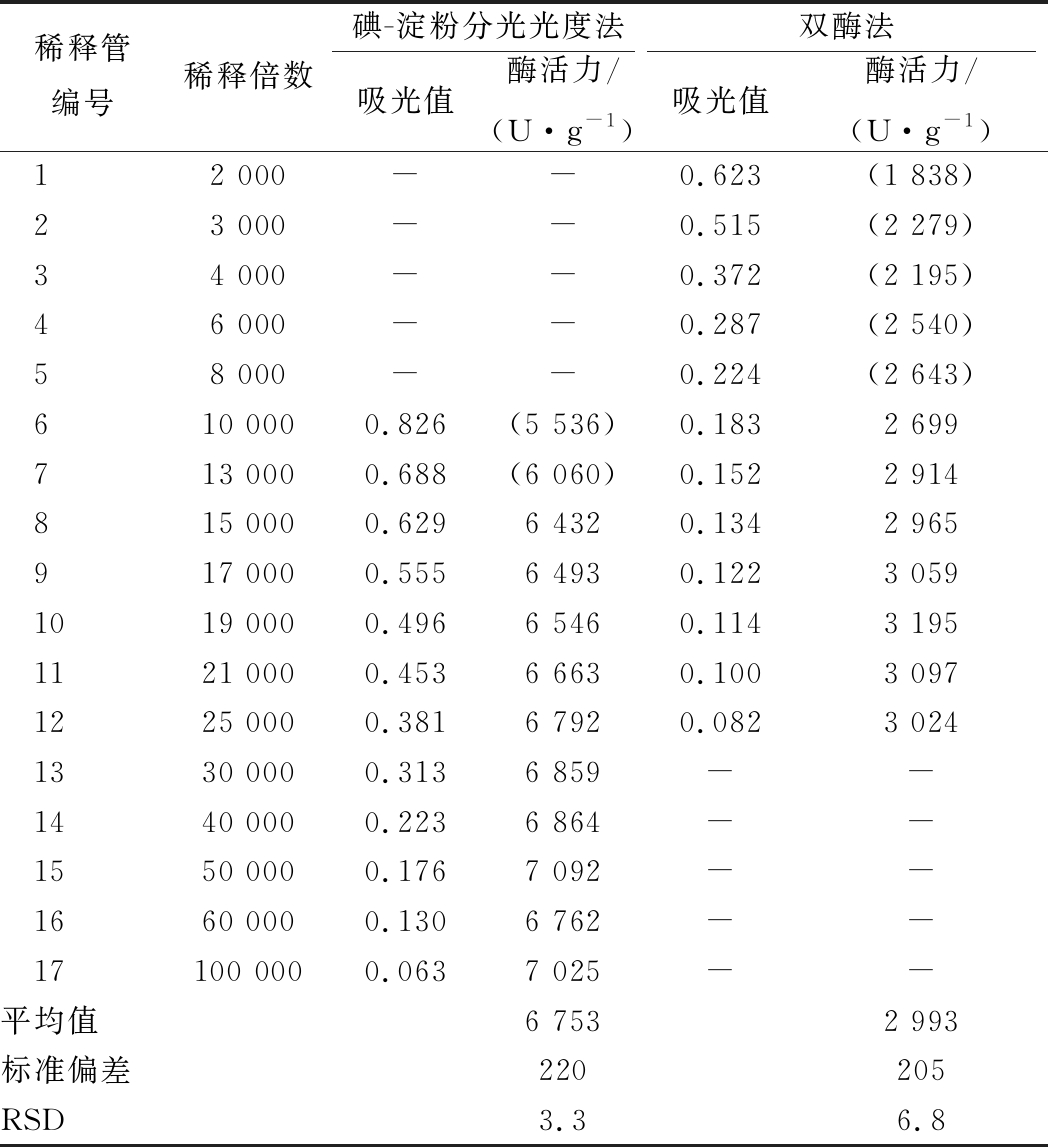
稀释管编号稀释倍数碘-淀粉分光光度法双酶法吸光值酶活力/(U·g-1)吸光值酶活力/(U·g-1)12 000--0.623(1 838)23 000--0.515(2 279)34 000--0.372(2 195)46 000--0.287(2 540)58 000--0.224(2 643)610 0000.826(5 536)0.1832 699713 0000.688(6 060)0.1522 914815 0000.6296 4320.1342 965917 0000.5556 4930.1223 0591019 0000.4966 5460.1143 1951121 0000.4536 6630.1003 0971225 0000.3816 7920.0823 0241330 0000.3136 859--1440 0000.2236 864--1550 0000.1767 092--1660 0000.1306 762--17100 0000.0637 025--平均值6 7532 993标准偏差220205RSD3.36.8
注:碘-淀粉分光光度法酶活力计算结果相对偏差超出5%时,数据加括号以示区别。双酶法酶活力计算结果相对偏差超出10%时,数据加括号以示区别,加括号数据不纳入表格参数计算;“-”:超出分光光度计仪器可信区间(0.1~0.8),未计入检测数据(下同)
3.2.3 两种方法显色灵敏度比较
以表2发酵液检测结果为例,2种方法同时测定编号为9 ~ 12对应的酶梯度稀释液时,碘-淀粉分光光度法随着稀释倍数增大,吸光值由0.857递减至0.468,而双酶法从0.190递减至0.100。比较吸光值递减程度可知,碘-淀粉分光光度法的显色灵敏度高于双酶法。
综合表1~表3,碘-淀粉分光光度法酶活力计算结果的变异系数RSD均低于双酶法,说明碘-淀粉分光光度法的检测精确度高于双酶法。碘-淀粉分光光度法的最小检测限远低于双酶法,更有利于研发阶段对基因改造后酶蛋白微量表达菌株的筛选工作。
表2 两种方法同时检测摇瓶发酵液体样品S2的数据比较
Table 2 Comparison of two methods for simultaneousdetection of liquid sample S2 in shaking flaskfermentation
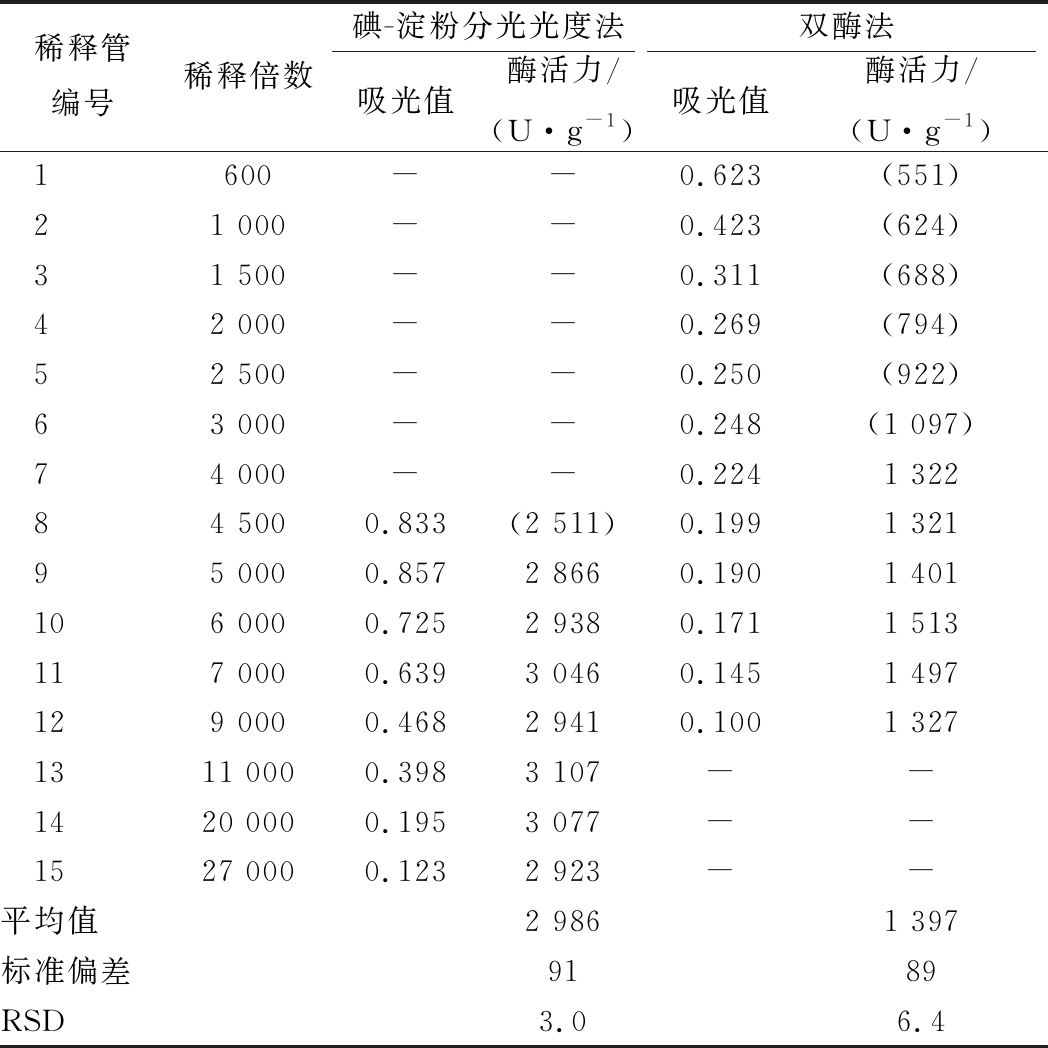
稀释管编号稀释倍数碘-淀粉分光光度法双酶法吸光值酶活力/(U·g-1)吸光值酶活力/(U·g-1)1600--0.623(551)21 000--0.423(624)31 500--0.311(688)42 000--0.269(794)52 500--0.250(922)63 000--0.248(1 097)74 000--0.2241 32284 5000.833(2 511)0.1991 32195 0000.8572 8660.1901 401106 0000.7252 9380.1711 513117 0000.6393 0460.1451 497129 0000.4682 9410.1001 3271311 0000.3983 107--1420 0000.1953 077--1527 0000.1232 923--平均值2 9861 397标准偏差9189RSD 3.0 6.4
表3 两种方法同时检测液体样品S3的数据比较
Table 3 Comparison of two methods for simultaneousdetection of liquid sample S3

稀释管编号稀释倍数碘-淀粉分光光度法双酶法吸光值酶活力/(U·g-1)吸光值酶活力/(U·g-1)12 000--0.612(1 805)24 000--0.437(2 578)36 000--0.310(2 743)48 000--0.252(2 973)510 000--0.213(3 142)612 000--0.1893 345714 000--0.1743 593816 0000.816(8 756)0.1593 752918 0000.795(9 611)0.1453 8501020 0000.725(9 792)0.1293 8051125 0000.61410 4820.1063 9091230 0000.51310 659--1440 0000.38110 868--1560 0000.24311 057--16100 0000.12811 143--平均值10 8423 709标准偏差274208RSD2.55.6
实验中发现,双酶法的检测受辣根过氧化物酶影响较大,不同厂家和批号的辣根过氧化物酶,其检测结果和检测稳定性差异明显;碘-淀粉分光光度法检测误差与淀粉的选取有一定关系,本文实验选取湖州展望药业有限公司生产的酶制剂检测专用可溶性淀粉,配制过程中煮沸时间定为2~3 min,独立重复实验(n≥3)结果平行性良好。
本文利用碘-淀粉显色体系建立了一种新的分光光度法检测葡萄糖氧化酶活力,体系吸光值有效范围在0.1~0.6附近。反应体系在葡萄糖氧化酶浓度为0.1~0.5 U/mL范围时,检测平行性良好,独立重复实验酶活力计算结果相对偏差在5%以内。碘-淀粉分光光度法所用试剂均为常见试剂,检测通量较高,检测精度满足需求,检测成本较低,通过反复验证,酶活力反应体系实用可靠。
[1] HATZINIKOLAOU D G, MACRIS B J. Factors regulating production of glucose oxidase by Aspergillus niger [J]. Enzyme Microb Tech, 1995, 17(6): 530-534.
[2] PLUSCHKELL S, HELLMUTH K, RINAS U. Kinetics of glucose oxidase excretion by recombinant Aspergillus niger [J]. Biotechnol Bioeng, 1996, 51(2): 215-220.
[3] HATZINIKOLAOU D G, HANSEN O C, MACRIS B J, et al. A new glucose oxidase from Aspergillus niger: Characterization and regulation studies of enzyme and gene [J]. Appl Microbiol Biot, 1996, 46(4): 371-381.
[4] 李蓉, 张庆芳, 迟乃玉. 微生物葡萄糖氧化酶的研究进展[J]. 中国酿造, 2018, 37(3): 1-5.
[5] 廖兆民, 蔡俊, 林建国. 微生物葡萄糖氧化酶的研究进展[J]. 食品与发酵工业, 2018, 44(7): 308-315.
[6] 郭贺楠, 杨勇智, 董冰, 等. 葡萄糖氧化酶研究进展[J]. 中国畜牧杂志, 2018, 54(4): 10-14.
[7] 刘颖, 陈雄, 廖蓓, 等. 工业酒精发酵污染菌的分离及新型抑菌剂的应用[J]. 食品与发酵工业, 2017, 43(8): 46-52.
[8] 黎芳, 刘佳, 王冉冉, 等. 葡萄糖氧化酶对全麦面团及全麦馒头品质改良的影响[J]. 食品工业科技, 2019, 40(14): 78-82;88.
[9] 刘春莹, 胡善松, 张庆芳, 等. 海洋低温葡萄糖氧化酶细菌选育及其酶学性质研究[J].食品与发酵工业,2019,45(13):52-58.
[10] DUBEY M K, ZEHRA A, AAMIR M, et al. Improvement strategies, cost effective production, and protential applications of fungal glucose oxidase(GOD): Current updates [J]. Frontiers in Microbiology, 2017, 8(8): 89-90.
[11] SISAK C, CSANADI Z, RONAY E, et al. Elimination of glucose in egg using immobilized glucose oxidase [J]. Enzyme and Microbial Technology, 2016, 39(5): 1 002-1 007.
[12] 郑伟萍, 王洪军, 张民, 等. 葡萄糖氧化酶和过氧化氢酶对肉鸡生长性能及养分代谢率的影响[J]. 饲料工业, 2019, 40(4): 35-39.
[13] 高立云. 一种快速葡萄糖氧化酶活性测定方法与应用效果研究[D]. 泰安:齐鲁工业大学, 2017.
[14] 任婷月, 周万里, 张利群, 等. 一种检测葡萄糖氧化酶活力的新方法[J]. 食品与发酵工业, 2015, 41(1): 212-215.
[15] 肖志明, 樊霞, 马东霞. 葡萄糖氧化酶的应用和检测方法研究进展[J]. 中国畜牧杂志, 2014, 50(18): 76-81.
[16] 李丕武, 刘瑜, 李瑞瑞,等. 两种葡萄糖氧化酶活力测定方法的比较[J]. 食品工业科技, 2013, (12): 71-75;80.
[17] QB/T 4614—2013, 工业用过氧化氢酶制剂[S]. 北京: 中国轻工业出版社, 2013.
[18] 董娜, 张爱菊, 张小林. 基于碘化钾-淀粉显色光度法测定过氧化氢酶活性[J]. 中国食品添加剂, 2019, 30(8): 150-153.
[19] 王宁丽, 魏鉴腾, 祝潇, 等. 基于碘-淀粉显色的α-淀粉酶抑制剂筛选方法研究及应用[J]. 中国海洋药物, 2017, 36(5): 75-78.
[20] 梁奇峰, 黄琼. 碘化钾-淀粉体系分光光度法测定食品中亚硝酸钠含量[J]. 化学试剂, 2016, 38(7): 649-652.
[21] 梁奇峰, 王东阳, 刘莉莉. 碘-淀粉体系褪色光度法测定蜂蜜中葡萄糖的含量[J]. 食品工业, 2014, 35(7): 275-277.
[22] GB/T 24401—2009, α—淀粉酶制剂[S]. 北京: 中国标准出版社, 2009.