2001年,世界卫生组织将益生菌定义为“当摄入足够的数量,给宿主带来健康益处的活微生物”[1]。双歧杆菌属是具有益生菌特征的主要种属之一,临床研究证明双歧杆菌是最有益的肠道微生物[2-3]。短双歧杆菌是益生菌产品中常用的双歧杆菌之一,它具有预防和治疗儿科疾病,增强免疫,改善皮肤,预防肥胖等多种益生功能[4-6]。
为了增强益生菌的长期稳定性,必须将其保存在水分大量减少的干燥状态。因此,制备益生菌菌粉是首选方法,其干燥方式包括喷雾干燥、冷冻干燥、真空干燥和流化床干燥[7]。其中真空冷冻干燥,也称作冷冻干燥,是将物料冻结到共晶点温度以下,在低压状态下,通过升华除去物料中水分的一种干燥方法[8],是近几十年来最方便,应用最广泛,可提高益生菌贮存稳定性的除水方法之一。与其他干燥方法相比,真空冷冻干燥技术的优点更为突出:低温操作使各种成分的活性丧失少;菌种的形态得以保持;复水性好,能较快还原成干燥前的鲜活状态;脱水彻底,易于保藏与运输,销售方便[9]。目前,双歧杆菌菌粉的制备主要采用真空冷冻干燥法。但是,双歧杆菌在冻干过程中仍可能受到多种损伤,如机械损伤、溶质损伤、膜损伤、蛋白质变性(包括酶变性)和DNA损伤等,加入保护剂是降低冻干对菌株损伤的最佳策略之一[7,10-13]。目前文献中报道的双歧杆菌冻干保护剂主要有糖类、蛋白类和其他类小分子物质,比较常见的保护剂为蔗糖、海藻糖、甘露醇、脱脂乳粉、抗坏血酸、微量元素等[4,7]。由于双歧杆菌的耐受能力较差,现有的冻干保护剂效果都不好,冻干保护机理尚不明确。因此本文针对短双歧杆菌所适用的冻干保护剂进行系统的分析及优化,进而为双歧杆菌的冻干保护提供思路。
目前双歧杆菌的工业化生产效率较低,且真空冷冻干燥是一个高能耗的过程。因此,如何降低能耗,提高每次冻干的产量是工业化生产中面临的极大挑战。针对这种挑战,在冻干前提高样品的浓度,可以减小冻干体积,提高单位冻干面积的产量,即高密度冻干,从而降低工作能耗。但是,如何在保证冻干存活率的条件下提高样品的浓度,是实现双歧杆菌高密度冻干的难点。本研究在实验所得的短双歧杆菌最佳冻干保护配方的基础上,优化冻干前样品的干物质配比及质量分数,进而获得最佳的高密度冻干方案,实现降低能耗的目的。
1.1.1 菌株
短双歧杆菌CCFM 683(Bifidobacterium breve CCFM 683),由江南大学食品生物技术中心保藏。
1.1.2 试剂
MRS-L培养基:蛋白胨10 g,牛肉膏10 g,酵母浸粉5 g,葡萄糖20 g,乙酸钠5 g,吐温80 1 mL,K2HPO4 2.0 g,柠檬酸二铵2.0 g,MgSO4·7H2O 0.1 g,MnSO4·7H2O 0.05 g,半胱氨酸磷酸盐1 g,蒸馏水1 000 mL,pH 6.2~6.4,115 ℃灭菌20 min,原料均购自国药集团。
半胱氨酸磷酸盐缓冲液(Cys缓冲液):L-半胱氨酸磷酸盐0.5 g,KH2PO4 6.0 g,Na2HPO4 4.5 g,NaCl 4.0 g,吐温80 0.6 g,蒸馏水1 000 mL,pH 6.8~7.0,115 ℃灭菌20 min,原料均购自国药集团。
保护剂:海藻糖、蔗糖、棉子糖、水苏糖、山梨糖醇等试剂,均购自创赛生物科技有限公司。
AW500SG-7152厌氧工作站,英国依莱泰科公司;FE20 pH计,梅特勒-托利多仪器(上海)有限公司;EL3002电子天平,梅特勒-托利多仪器(上海)有限公司;MS-3-basic涡旋振荡器,德国IKA公司;MLS-3750高温高压灭菌锅,日本SANYO公司;ZHJH-C1115B超净工作台,上海智诚分析仪器制造有限公司;LYOBETA-5PS冻干机,西班牙Telstar公司;RC-BIOS10落地式离心机,赛默飞世尔公司。
1.3.1 菌株活化与培养
用接种环蘸取保菌管中的菌液在MRS-L平板上划线,37 ℃厌氧条件下培养48 h后,挑取单菌落至MRS-L液体试管中,置于37 ℃厌氧条件下培养18~22 h。将菌液以体积分数为5%的接种量连续活化3次后,获取菌株培养液用于试验。
1.3.2 短双歧杆菌的冻干
以体积分数为5%的接种量接菌至MRS-L培养基中,37 ℃厌氧条件下培养18~22 h后,8 000×g, 4 ℃,离心15 min,弃去上清液。将菌泥与无菌生理盐水以质量比1∶1混匀后,调节pH至6.5左右制得菌悬液,再将菌悬液与保护剂溶液以体积比2∶1混合,充分混匀后吸取1 mL分装至冻干瓶冻干。
冻干工艺:预冻,控制层板1 h内降温至-50 ℃,保持4 h;一次干燥,控制层板1.3 h升温至-30 ℃,保持30 h;二次干燥,控制层板1 h升温至25 ℃,保持20 h。
1.3.3 保护剂溶液的配制
1.3.3.1 单一保护剂溶液的配制
分别称取定量的糖(醇)类、蛋白类等各种保护剂,加入定量的水溶解,制得质量浓度为200 g/L的保护剂溶液。
1.3.3.2 复合保护剂溶液的配制
复合保护剂中各组分按比例复配,维持保护剂溶液的质量浓度恒为200 g/L。
(1)糖类复合保护剂溶液
保护剂A(2种保护剂质量比1∶1复配):将2种糖类复配且两者质量比为1∶1,即每种糖的质量浓度为100 g/L。
保护剂B(3种保护剂质量比1∶1∶1复配):将3种糖类复配且3者质量比为1∶1∶1,即每种糖的质量浓度为67 g/L。
(2)糖类复合蛋白类保护剂溶液
保护剂C(糖类与蛋白类质量比为1∶1):最优糖类保护剂100 g/L,蛋白类100 g/L。
保护剂D(糖类与蛋白类质量比为3∶1):最优糖类保护剂150 g/L,蛋白类50 g/L。
(3)最优复合保护剂复配其他小分子类保护剂
前面优化得到的最优复合保护剂分别添加MnSO4 10 g/L、MgSO4 20 g/L,抗坏血酸30 g/L,谷胱甘肽15 g/L,L-酪氨酸15 g/L,甜菜碱0.4 g/L,复合保护剂溶液的总质量浓度为200 g/L。
1.3.4 短双歧杆菌的高密度冻干
称取定量的菌泥置于烘箱中烘干,称量干燥后的物质质量,换算可得每克菌泥中的干物质含量。称取定量的菌泥与保护剂,按照菌泥干物质与保护剂1∶1、1∶1.2的质量比,分别配制质量分数为15%、20%、25%的样品,充分混匀后吸取1 mL分装至冻干瓶冻干,冻干工艺同1.3.2。
1.3.5 活菌计数[14-15]
1.3.5.1 冻干前活菌计数
吸取0.5 mL冻干前样品至4.5 mL Cys缓冲液中进行10倍稀释,重复以上步骤,稀释至合适梯度。吸取1 mL稀释后的样品于无菌平板中,倾注适量的MRS-L固体培养基混合均匀,每个稀释度做3个平行,待凝固后倒置于37 ℃厌氧条件下培养48 h。
1.3.5.2 冻干后活菌计数
在冻干后的样品中加入定量的无菌水,使其复水至冻干前的质量,活菌计数操作同冻干前。
1.3.6 冻干存活率的测定[16]
冻干存活率![]()
(1)
1.3.7 数据分析
每组实验做3个平行,使用SPSS Statistics 26.0数据统计软件对实验结果进行ANOVA判断(Tukey’s检验),P<0.05认为差异显著。
依据已有的文献报道,冻干保护剂按照渗透性分为可渗透类、半渗透类和不渗透类3种[9,17]:甘油等可渗透化合物使细胞膜更具可塑性,并与水结合,从而抑制过度脱水,防止细胞在冷冻过程中形成冰晶[18];小分子糖等半渗透化合物在冷冻前诱导细胞的质壁分离,并集中在细胞膜和细胞壁之间作为冰生长的缓冲层,与细胞膜磷脂和蛋白质极性基团形成氢键相互作用,代替极性基团周围失去的氢键结合水,为膜提供机械保护[19];大分子糖及蛋白质等不渗透化合物吸附在细胞表面,形成一个保护层,通过增加溶液黏度来抑制冰的生长速度,同时减少与氧的接触[9,20]。目前关于双歧杆菌冻干保护剂的文献多为少数几种保护剂之间的对比,没有系统地分析双歧杆菌冻干保护剂之间的差异。本试验将文献报道中常见的糖(醇)类、蛋白类保护剂按照不同的分子质量进行分类,以冻干后活菌数和存活率为依据,系统分析不同结构不同分子质量不同性质的保护剂对短双歧杆菌的冻干保护差异。
由表1可知,与空白对照组相比,除赤藓糖醇的冻干存活率为(1.27±0.57)%,其余保护剂的冻干存活率均有所提高。糖(醇)类保护剂的冻干存活率普遍高于蛋白类冻干保护剂,且结构大小低于三糖的小分子糖对短双歧杆菌的冻干保护效果较好。其中,棉子糖的冻干存活率最高,为(53.22±3.55)%,山梨糖醇的存活率仅次于棉子糖,冻干存活率为(46.13±5.55)%。
山梨糖醇被用作冻干保护剂的研究较多,其保护机理[20-22]主要有:(I)替代水并与膜磷脂中的磷酸基团相互作用;(II)提供高的渗透应力,高渗透胁迫诱导热休克蛋白基因表达,热休克蛋白可维持膜结合酶
表1 短双歧杆菌在不同种类保护剂中的冻干存活率
Table 1 The freeze-drying survival rate of
B.breve in different protectants

保护剂种类名称冻干后活菌数lg CFU/mL(x±SE)冻干存活率/%(x±SE)空白组10.38±0.13lm3.44±1.09l四碳糖赤藓糖醇9.92±0.22m1.27±0.57m五碳糖木糖11.36±0.06ef32.29±4.55cde鼠李糖11.44±0.02cd38.10±2.07bcd阿拉伯糖11.31±0.09fg28.92±5.67de六碳糖(醇)半乳糖11.45±0.02cd39.23±2.02bc甘露糖11.28±0.09g26.77±6.01e山梨糖11.46±0.08c40.43±7.47bc山梨糖醇11.52±0.05b46.13±5.55ab双糖(醇)海藻糖11.11±0.09h18.15±3.69f蔗糖11.39±0.05de34.73±3.28bcde麦芽糖醇11.27±0.07g26.38±4.33e三糖棉子糖11.58±0.03a53.22±3.55a四糖水苏糖11.09±0.02hi16.96±0.97fg低聚糖低聚果糖10.96±0.02hijk12.76±0.56ghi低聚木糖10.99±0.02hij13.59±0.66fgh低聚半乳糖10.94±0.05ijk12.06±1.44hi甘露低聚糖11.06±0.08hi16.02±2.88fgh多糖麦芽糊精10.98±0.05hij13.35±1.6fghi菊粉10.98±0.15hij13.83±5.26fghi抗性糊精10.85±0.08jk10.01±1.9ij蛋白类乳清蛋白10.71±0.02kl7.20±0.33k蛋白复合类脱脂乳10.77±0.06jkl8.34±1.24jk
注:同列不同小写字母表示差异显著(P<0.05)(下同)
和膜的完整性;(III)稳定蛋白质结构,形成山梨醇蛋白复合物;(IV) 抗氧化特性可防止脂质氧化。棉子糖作为三糖,含有多个羟基,在冻干过程中除去水后,棉子糖的羟基基团可以代替水分子,细胞膜的极性头通过氢键与棉子糖的羟基直接相互作用,从而减少菌体在冻干过程中受到的损伤[7]。另外,ACHMAD等[23]研究发现,短双歧杆菌在棉子糖上的生长要优于其他测试的可发酵糖。作为可被高效利用的三糖,棉子糖亦有可能在与菌体混合时被快速转运至胞内进行积累,在胞内、胞外同时保护菌体减少冻干损伤。综合讨论,山梨糖醇与棉子糖除了共同的保护机制外,还有其他不同的潜在提高冻干保护的机制,因此将二者进行复配,研究其对短双歧杆菌的冻干保护效果。
通过试验发现(图1),山梨糖醇与棉子糖复配后,相较于单一保护剂,冻干存活率有显著性提高。这说明山梨糖醇与棉子糖的保护机理确有不同之处。将山梨糖醇与棉子糖复配后作为冻干保护剂,2者可以从多方面保护短双歧杆菌,进一步提高单一保护剂的冻干保护效果。综合以上因素,我们将山梨糖醇和棉子糖作为与蛋白类复配的优势保护剂。
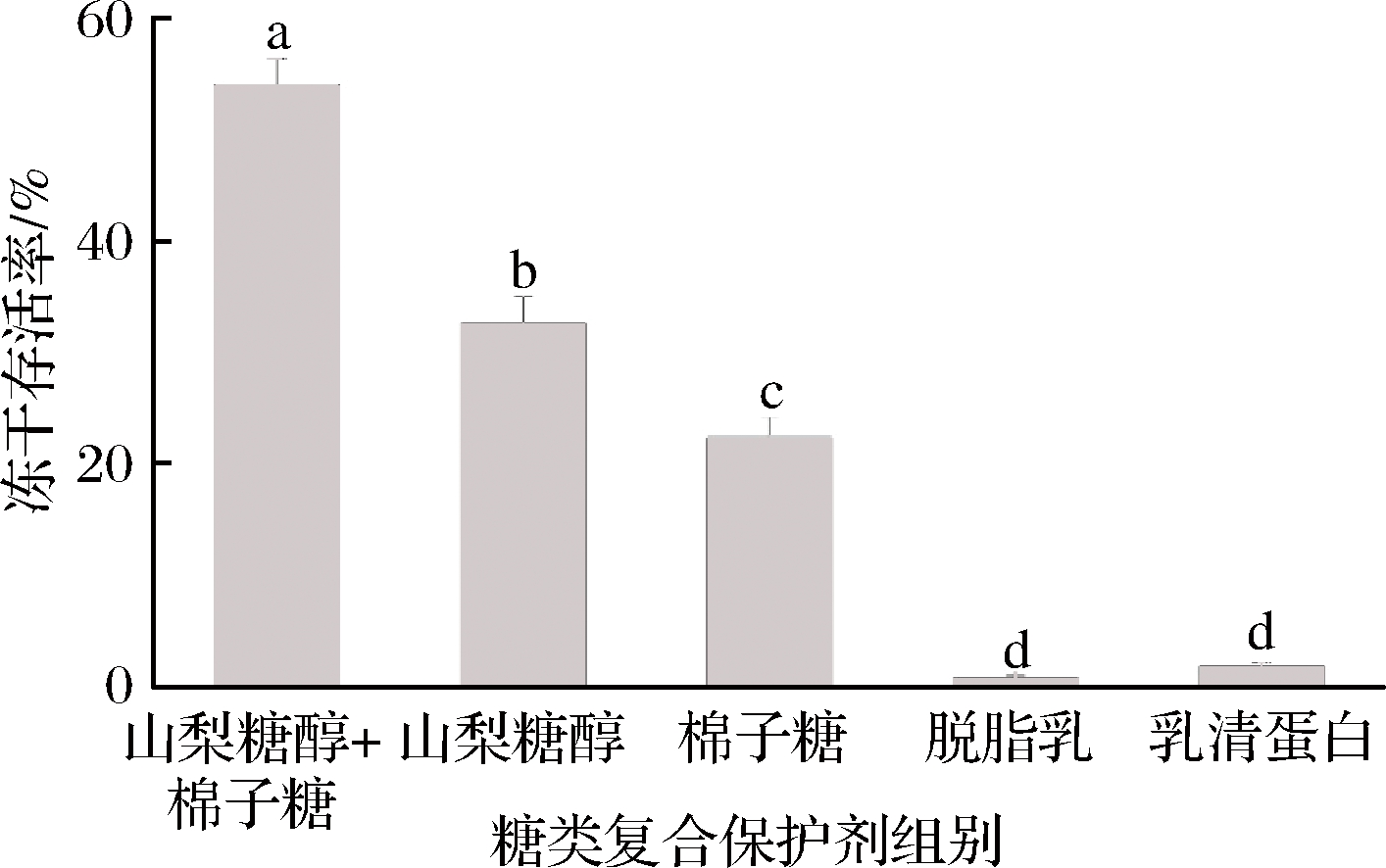
图1 短双歧杆菌在糖类复合保护剂中的冻干存活率
Fig.1 Freeze-drying survival rate of B. breve in carbohydrate compound protectant
注:不同小写字母表示差异显著(P<0.05)(下同)
蛋白质与糖类的不同性质会产生不同的保护特性。小分子糖作为一种半透膜化合物,可在细胞膜和细胞壁之间聚集。而蛋白质作为一种非渗透性化合物,主要吸附在细胞表面[20]。如脱脂乳,在细胞与蛋白之间的疏水相互作用过程中,在细胞表面形成一层保护层,从而保护细胞[24]。虽然蛋白类物质作为单一保护剂时,保护效果并不好(表1),但是基于其与糖类保护剂具有不同的保护机理,将糖类和蛋白类保护剂进行复配时,可能会从多方面保护双歧杆菌,从而提高菌株的存活率。同时,蛋白类保护剂不仅可以在冻干过程中为细胞提供保护层,还可以使冻干产品形成多孔结构,使复水更容易,更利于应用于生产当中[20]。因此,我们将糖类复合保护剂与蛋白类物质按照不同比例复配,考察糖类保护剂与蛋白类保护剂复配是否会提高对菌体的冻干保护效果。
由图2可知,添加蛋白并没有像预期的那样提高双歧杆菌的冻干保护效果,但少量添加蛋白类物质可确保糖类复合保护剂保护效果不会降低(4组和5组没有显著差异)。但是若只添加糖类保护剂,冻干后的样品质地较硬且不易粉碎成粉剂,而添加一定比例的蛋白可提高菌粉的疏松度,更利于冻干粉剂的成型。综合考虑,将糖类复合保护剂与胶原蛋白以质量比3∶1复配后的保护剂作为优势保护剂,进一步研究与其他小分子物质复配后对短双歧杆菌的冻干保护效果。

1-m(山梨糖醇+棉子糖)∶m(乳清蛋白)=1∶1;2-m(山梨糖醇+棉子糖)∶m(乳清蛋白)=3∶1;3-m(山梨糖醇+棉子糖)∶m(胶原蛋白)=1∶1;4-m(山梨糖醇+棉子糖)∶m(胶原蛋白)=3∶1;5-山
梨糖醇+棉子糖;6-胶原蛋白;7-乳清蛋白
图2 短双歧杆菌在复配蛋白类保护剂中的冻干存活率
Fig.2 Freeze-drying survival rate of B. breve in
the compound of protein protectants
除了糖(醇)类、蛋白类物质可提高菌株的冻干存活率外,也有其他小分子对菌株的冻干保护效果的报道。例如,抗坏血酸等抗氧化剂可能延缓膜磷脂的自氧化作用[25];甜菜碱可以在干燥过程中稳定蛋白质和细胞膜在渗透胁迫条件下造成的低水分活度[26];L-酪氨酸等氨基酸可以进入细胞内,起到胞内缓冲作用[20];谷胱甘肽能够保护菌株在冷冻胁迫过程中的细胞完整性和平滑度并提高细胞膜不饱和脂肪酸成分的比例[27];MnSO4作为缓冲盐,能够渗透到细胞内部从而调节菌体内部理化平衡,同时可与其他保护剂产生联合作用[28]。因此,我们将这几种小分子物质与前期确定的复合保护剂进行复配,进一步验证这些物质是否会优化已有配方的冻干保护效果。
由图3可知,这些小分子物质并没有像文献中报道的那样显示出提高复合保护剂的冻干保护效果。相较于不添加小分子物质的对照组,除了加入MnSO4和MgSO4的保护剂组别冻干存活率有所降低,其他组别的冻干存活率与对照组没有显著差别。说明这些物质在短双歧杆菌的冻干过程中并无明显保护效果。
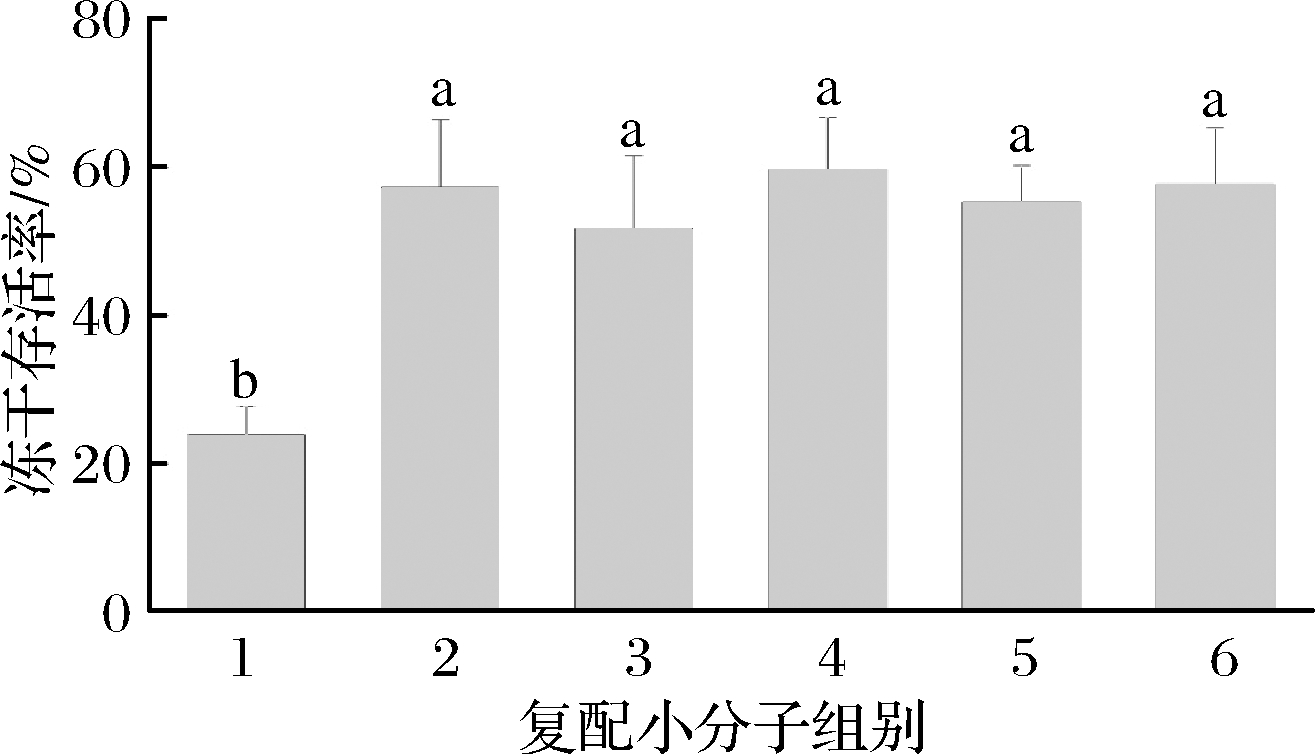
1-复合保护剂+硫酸锰+硫酸镁;2-复合保护剂+抗坏血酸;3-复合保护剂+谷胱甘肽;4-复合保护剂+L-酪氨酸;5-复合保护剂+甜菜碱;6-复合保护剂
图3 短双歧杆菌在复配其他小分子中的冻干存活率
Fig.3 Freeze-drying survival rate of B. breve in the compound of other small molecules
随着人们对双歧杆菌功能的深入了解,双歧杆菌已经具有越来越多的商业价值。如何提高产量、降低能耗便是众多企业的关注焦点。目前的研究多为从菌株高密度培养进行探究,鲜有从样品浓度方面探究如何降低生产成本。菌泥与保护剂的配比、冻干样品的干物质含量是实现高密度冻干的关键因素。因此,本试验设定了几组不同的干物质比例与质量分数,研究不同方案的冻干效果。
由表2可见,菌泥干物质与保护剂的质量比为1∶1.2,样品干物质总质量分数为25%时,短双歧杆菌的冻干存活率最高。这说明,当保护剂比菌泥干物质多时,每个活菌体被保护剂保护的程度更高。该种方案下,保护剂由山梨糖醇、棉子糖与胶原蛋白以质量比3∶3∶2组成。相较于目前工厂常用的15%~20%的干物质质量分数,该方案提高了每次冻干机运行的产量,降低了同生产量的能耗。短双歧杆菌的冻干存活率接近80%,冻干粉活菌数高达16 100亿,即(1.61±0.27)×1012 CFU/g。
表2 短双歧杆菌在高密度冻干中的存活率
Table 2 High density freeze-drying survival rate of
B. breve
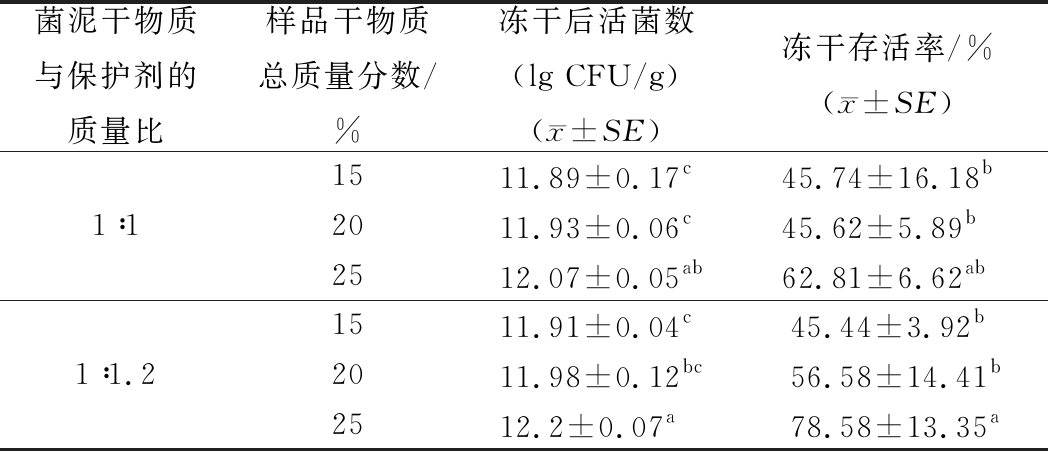
菌泥干物质与保护剂的质量比样品干物质总质量分数/%冻干后活菌数(lg CFU/g)(x±SE)冻干存活率/%(x±SE)1∶11511.89±0.17c45.74±16.18b2011.93±0.06c45.62±5.89b2512.07±0.05ab62.81±6.62ab1∶1.21511.91±0.04c45.44±3.92b2011.98±0.12bc56.58±14.41b2512.2±0.07a78.58±13.35a
(1)糖(醇)类保护剂的冻干存活率普遍高于蛋白类保护剂,三糖及以下的小分子糖对短双歧杆菌的冻干保护效果较好,棉子糖和山梨糖醇的冻干保护效果最好。
(2)棉子糖与山梨糖醇复配后会进一步提高单一保护剂的冻干保护效果。
(3)添加蛋白类物质不会增强糖类物质对短双歧杆菌的冻干保护效果,但适量添加可提高菌粉的疏松度。
(4)复合保护剂中添加MgSO4、MnSO4、谷胱甘肽、抗坏血酸、L-酪氨酸、甜菜碱不会显著提升保护剂对短双歧杆菌的冻干保护效果。
(5)保护剂由山梨糖醇、棉子糖与胶原蛋白以质量比3∶3∶2组成,菌泥干物质与保护剂的质量比为1∶1.2,样品干物质总质量分数为25%时,短双歧杆菌的冻干存活率接近80%,冻干粉活菌数高达 16 100亿,即(1.61±0.27)×1012 CFU/g。
[1] BASHOLLI-SALIHU M,MUELLER M,SALAR-BEHZADI S,et al.Effect of lyoprotectants on β-glucosidase activity and viability of Bifidobacterium infantis after freeze-drying and storage in milk and low pH juices[J].LWT-Food Science and Technology,2014,57(1):276-282.
[2] CHEN H,TIAN M,CHEN L,et al.Optimization of composite cryoprotectant for freeze-drying Bifidobacterium bifidum BB01 by response surface methodology[J].Artificial Cells Nanomedicine and Biotechnology,2019,47(1):1 559-1 569.
[3] 李德斌,赵敏.双歧杆菌冻干菌粉制备过程中保护剂的研究[J].中国乳品工业,2011,39(11):32-34.
[4] BOZZI CIONCI N,BAFFONI L,GAGGIA F,et al.Therapeutic microbiology:the role of Bifidobacterium breve as food supplement for the prevention/treatment of paediatric diseases[J].Nutrients,2018,10(11):1 723-1 750.
[5] YASUI H,OHWAKI M.Enhancement of immune response in peyer’s patch cells cultured with Bifidobacterium breve[J].Journal of Dairy Science,1991,74(4):1 187-1 195.
[6] MITSUYOSHI K,NORIE M,CHIAKI K,et al.Consecutive intake of fermented milk containing Bifidobacterium breve strain yakult and galacto-oligosaccharides benefits skin condition in healthy adult women[J].Bioscience of Microbiota,Food and Health,2013,32(1):33-39.
[7] BROECKX G,VANDENHEUVEL D,CLAES I J,et al.Drying techniques of probiotic bacteria as an important step towards the development of novel pharmabiotics[J].International Journal of Pharmaceutics,2016,505(1-2):303-318.
[8] 乔晓玲,闫祝炜,张原飞,等.食品真空冷冻干燥技术研究进展[J].食品科学,2008,29(5):469-474.
[9] 胡曼.两歧双歧杆菌培养及冻干保护剂的研究[D].西安:陕西科技大学,2012.
[10] 李宝坤.乳酸杆菌冷冻干燥生理损伤机制及保护策略的研究[D].无锡:江南大学,2011.
[11] CHIU Y H,OU C C,FU H C,et al.Abelmoschus esculentus(L.) Moench polysaccharide enhances the resistance of Bifidobacterium longum MYL16 to freeze-drying and artificially digestive processes[J].Journal of Functional Foods,2014,11:172-177.
[12] HUANG S,VIGNOLLES M L,CHEN X D,et al.Spray drying of probiotics and other food-grade bacteria:A review[J].Trends in Food Science & Technology,2017,63:1-17.
[13] ARCHACKA M,BIALAS W,DEMBCZYNSKI R,et al.Method of preservation and type of protective agent strongly influence probiotic properties of Lactococcus lactis:A complete process of probiotic preparation manufacture and use[J].Food Chemistry,2019,274:733-742.
[14] CELIK O F,O′SULLIVAN D J.Factors influencing the stability of freeze-dried stress-resilient and stress-sensitive strains of bifidobacteria[J]. Journal of Dairy Scnce,2013,96(6):3 506-3 516.
[15] 张帆,赵敏,李来酉,等.双歧杆菌冻干菌粉制备工艺的研究[J].食品科学,2010,31(15):221-224.
[16] DIANAWATI D,MISHRA V,SHAH N P.Survival of Bifidobacterium longum 1941 microencapsulated with proteins and sugars after freezing and freeze drying[J].Food Research International,2013,51(2):503-509.
[17] YANG C,ZHU X,FAN D,et al.Optimizing the chemical compositions of protective agents for freeze-drying Bifidobacterium longum BIOMA 5920[J].Chinese Journal of Chemical Engineering,2012,20(5):930-936.
[18] MENG X C,STANTON C,FITZGERALD G F,et al.Anhydrobiotics:The challenges of drying probiotic cultures[J].Food Chemistry,2008,106(4):1 406-1 416.
[19] 张玉华,孟一,凌沛学,等.海藻糖和透明质酸对冻干双歧杆菌细胞的保护作用[J].食品科学,2010,31(7):236-241.
[20] CARVALHO A S,SILVA J,HO P,et al.Relevant factors for the preparation of freeze-dried lactic acid bacteria[J].International Dairy Journal,2004,14(10):835-847.
[21] SANTIVARANGKNA C,KULOZIK U,KIENBERGER H,et al.Changes in membrane fatty acids of Lactobacillus helveticus during vacuum drying with sorbitol[J]. Letters in Applied Microbiology,2009,49(4):516-521.
[22] CARVALHO A S,SILVA J,HO P,et al.Protective effect of sorbitol and monosodium glutamate during storage of freeze-dried lactic acid bacteria[J]. Dairy Science & Technology,2003,83(3):203-210.
[23] DINOTO A,SUKSOMCHEEP A,ISHIZUKA S,et al.Modulation of rat cecal microbiota by administration of raffinose and encapsulated Bifidobacterium breve[J].Applied and Environmental Microbiology,2006,72(1):784-792.
[24] KHEM S,SMALL D M,MAY B K.The behaviour of whey protein isolate in protecting Lactobacillus plantarum[J].Food Chemistry,2016,190:717-723.
[25] KURTMANN L,CARLSEN C U,RISBO J,et al.Storage stability of freeze-dried Lactobacillus acidophilus (La-5) in relation to water activity and presence of oxygen and ascorbate[J].Cryobiology,2009,58(2):175-180.
[26] 陈合,张建华,秦涛,等.山梨醇、甘露醇及甜菜碱等对两歧双歧杆菌冻干的影响[J].食品科技,2014,39(1):19-23.
[27] 张娟.谷胱甘肽对乳酸菌胁迫抗性的调控机制研究[D].无锡:江南大学,2008.
[28] 陈俊亮,张慧芸,等.乳酸乳球菌乳脂亚种冷冻干燥保护剂优化及其贮藏稳定性[J].食品科学,2014, 35(11):109-114.