表1 灵芝孢子粉低聚糖分子质量分布及基本成分
Table 1 Molecular weight distribution and basiccomponents of GLS oligosaccharides

样品得率/%分子质量分布/Da含量/%总糖蛋白质酚类UGLS-O1.28±0.5350990478±21.2±0.20.6±0.1BGLS-O1.54±0.2751494583±30.8±0.10.9±0.2
灵芝(Ganoderma lucidum)为多孔菌科真菌,广泛分布于日本、韩国、中国等地区,又被称为林中灵、仙草等[1-2],为我国传统名贵滋补品[3]。灵芝可以防治心血管、神经性、免疫性和癌症等疾病[4-5]。灵芝孢子粉是灵芝的生殖细胞,其孢子内几乎含有灵芝的所有营养及活性物质,如糖类、甾醇类、萜类和微量元素等[6],其中多糖类物质是主要活性成分之一。
正常人体内存在着大量寄生菌群,主要在肠道中定植,与宿主形成共生关系,并在新陈代谢和免疫系统中起重要作用[7]。人体肠道内微生物包括有益菌、有害菌和中性菌[8],其中有益菌的益生作用主要是通过直接或者间接调整宿主肠道微生物的组成,激活宿主内源性微生物群或免疫系统的活性来实现[9]。低聚糖作为一种新型的功能性糖源已被广泛用于保健品、饮料等食品领域,其不能被胃酸降解,但可以作为益生元被肠道中有益菌群利用,产生短链脂肪酸从而调节肠道环境[10]。胡丽萍[11]通过羧甲基化改性获得羧甲基灵芝孢子粉,再经酶降解获得羧甲基灵芝孢子低聚糖,研究发现其能促进双歧杆菌的增殖。但此法需要化学改性及酶法降解,食用安全性及制备成本较高。因此,有必要对灵芝孢子粉,尤其是其多糖提取时的低聚糖副产物进行直接回收利用。
本文以灵芝孢子粉为原料,以常规水提-醇沉工艺提取副产物中的灵芝孢子粉低聚糖,采用肠道微生态体外发酵模型,探究灵芝孢子粉低聚糖对肠道菌群的影响,并通过代谢产物中短链脂肪酸与产气的变化、灵芝孢子粉低聚糖的利用情况以及菌群结构变化,进一步阐述灵芝孢子粉低聚糖对于肠道菌群的调节功能。
未破壁灵芝孢子粉、破壁灵芝孢子粉,均由浙江寿仙谷医药股份有限公司提供。
主要试剂:乙酸、丙酸、丁酸、戊酸、巴豆酸标准品、3,5-二羟基甲苯,阿拉丁生化科技股份有限公司;正丁醇、甲酸、偏磷酸、K2HPO4、蛋白胨等试剂均为分析纯,国药集团化学试剂有限公司;AB-8大孔树脂、100~500 Da透析袋,上海源叶生物科技有限公司;Q328520 DNA抽提试剂盒,赛默飞世尔科技(中国)有限公司;Takara Ex Taq,宝日医生物技术(北京)有限公司。
HALO-F100自动粪便分析处理仪,苏州海路生物技术有限公司;GC2010气相色谱仪,日本Shimadzu 公司;2695凝胶色谱仪,美国沃特世公司;多成分气体测定仪,杭州海路医疗科技有限公司;XS105分析天平,瑞士Mettler-Toledo公司;580BR10905 PCR仪,美国伯乐公司;HE-120电泳仪,上海天能科技有限公司;-80 ℃冰箱,美国Thermo公司。
1.3.1 灵芝孢子粉低聚糖的制备
分别取200 g未破壁(U-GLS)、破壁灵芝孢子粉(B-GLS)→加入体积分数为95%乙醇浸泡24 h→5 000 r/min离心,取沉淀物→室温风干→加入1∶15(质量比)蒸馏水95 ℃浸提3次,每次3 h→离心取上清液→旋转蒸发浓缩→加入无水乙醇使乙醇终体积分数为80%→静置12 h→8 000 r/min,4 ℃离心得灵芝孢子粉多糖提取物,取上清液→旋转蒸发浓缩→过AB-8大孔树脂脱除色素等杂质→蒸馏水洗脱液100~500 Da透析袋透析48 h→透析袋中料液经旋转蒸发浓缩→冷冻干燥48 h→灵芝孢子粉低聚糖(UGLS-O、BGLS-O)[12]。
1.3.2 分子质量及成分含量测定
采用凝胶渗透色谱(gel permeation chromatography, GPC)法测定UGLS-O和BGLS-O 的相对分子质量。用一系列聚乙二醇标准物校准分子质量,通过将保留时间与标准曲线进行比较来确定样品的分子质量。流动相为0.1 mol/L的KNO3水溶液,凝胶柱为WATERS Ultrahydrogel 500 column (7.8 mm×300 mm)、WATERS Ultrahydrogel 250 column (7.8 mm×300 mm)和WATERS Ultrahydrogel 120 column (7.8 mm×300 mm)串联合用,流速为1.0 mL/min,Agilent 1260示差检测器,柱温为40 ℃。
利用苯酚-硫酸法[13]、考马斯亮蓝[14]、福林酚法[15]分别测定总糖、蛋白质、酚类含量。
1.3.3 体外发酵实验
1.3.3.1 培养基配制
YCFA基础培养基:KH2PO4 0.45 g/L,K2HPO4 0.45 g/L,NaCl 0.05 g/L,CaCl·2H2O 0.064 g/L,MgSO4·7H2O 0.09 g/L,胰蛋白胨10 g/L,酵母提取物2.5 g/L,L-半胱氨酸1 g/L,血红素2 mL/L,维生素Ⅰ200 μL /L。
实验培养基:分别以UGLS-O和BGLS-O为唯一碳源(8 g/L)加入到基础培养基中,空白培养基中不加糖源。调节pH至6.5,在厌氧条件下,以5 mL为单位分别加入到10 mL发酵瓶中。高压灭菌,配制成UGLS-O培养基、BGLS-O培养基、空白培养基备用。
1.3.3.2 人体粪便液的批量发酵
称取0.8 g健康成人粪便(5男5女,年龄20~30岁,要求至少3个月内未服用过抗生素;粪便常温下密封保存,在2 h内进行发酵实验),置于自动粪便处理机中,加入8 mL PBS缓冲液,配制成100 g/L的粪便稀释液。取500 μL悬浮液分别接种于空白培养基、UGLS-O培养基和BGLS-O培养基中,摇匀后在37 ℃恒温培养箱中培养24 h,在0、24 h时分别取样1 mL进行相关检测分析。
1.3.4 薄层层析法检测低聚糖的利用情况
(1)展开剂:V(水)∶V(正丁醇)∶V(甲酸)=1∶4∶5配制,然后混合均匀。
(2)显色剂:900 mg 3,5-二羟基甲苯(地衣酚)溶于25 mL水中,然后加入375 mL乙醇,在冰浴条件下缓缓加入50 mL浓H2SO4。
吸取0.2 μL各时间点(0、24 h)的粪便发酵样品点样于硅胶板上,倾斜放置于层析缸中,待展开剂到达硅胶板顶端时,取出吹干,然后放入显色剂中浸润,然后拿出吹干,放入烘箱中显色[15]。
1.3.5 短链脂肪酸(short-chain fatty acids,SCFA)测定
根据吴琴琴[16]的方法配制巴豆酸-偏磷酸溶液。对发酵0、24 h时留存的样品进行离心,取上清液,并加入巴豆酸-偏磷酸溶液酸化反应24 h。离心后吸取上清液过0.22 μm水相滤膜。
采用气相色谱(GC)法,根据标准品的保留时间及峰面积的测定样品中短链脂肪酸的总量及各组分含量[17]。毛细管柱:DB-FFAP,30 m×0.53 mm×0.5 μm,进样量为1.0 μL [18]。
1.3.6 气压测定与气体分析
粪便稀释液接入培养基后进行排气,使其气压与大气压等同。发酵24 h后,利用自动气体分析仪测定发酵瓶内气压值(kPa)与各气体含量[19]。
1.3.7 发酵液中菌群结构变化分析
取等量发酵液离心后弃去上清液,沉淀保存在-80 ℃冰箱中。利用DNA抽提试剂盒对样本DNA进行提取,之后再利用琼脂糖凝胶电泳检测DNA的纯度和浓度。然后取适量的样品于离心管中,用无菌水稀释样品至 1 ng/μL,以稀释后的基因组DNA为模板,根据测序区域的选择,使用带Barcode 的特异引物、Ex Taq高保真酶进行PCR扩增及测序。然后构建文库,选取合格的文库进行制备和测序,得到的数据进行相应的生物信息分析[16]。
每组数据平行测定3次,以平均值±偏差(Mean±SD)表示,使用SPSS 19.0进行方差和显著性分析,利用GraphPad prism 8进行软件绘图。
由表1可知,UGLS-O、BGLS-O的得率分别为(1.28±0.53)%、(1.54±0.27)%。UGLS-O、BGLS-O分别由2个组分构成,分子质量分别为509、904 Da和514、945 Da。主要成分分析见表1。结果表明,利用此制备方法可获得纯度高达80%的灵芝孢子粉低聚糖。
表1 灵芝孢子粉低聚糖分子质量分布及基本成分
Table 1 Molecular weight distribution and basiccomponents of GLS oligosaccharides

样品得率/%分子质量分布/Da含量/%总糖蛋白质酚类UGLS-O1.28±0.5350990478±21.2±0.20.6±0.1BGLS-O1.54±0.2751494583±30.8±0.10.9±0.2
注:产率![]()
本实验通过肠道微生物体外发酵模型研究健康人体的肠道微生物对UGLS-O和BGLS-O的发酵性能。利用TLC快速直观地观察灵芝孢子粉低聚糖(UGLS-O、BGLS-O)被肠道菌群的利用情况。
首先对2种低聚糖的组成成分进行分析,由图1可知,UGLS-O和BGLS-O在TLC板上呈现2个点,表明其含有2个不同的寡糖组分。从10位志愿者利用降解UGLS-O和BGLS-O的情况来看,不同性别个体之间存在较大差异,且相同性别个体间也存在较大差异。对于女性志愿者,发酵24 h后,利用TLC未能检测到w5号样本发酵产物中的寡糖,说明其能很好地降解灵芝孢子粉低聚糖,而其他女性样本的发酵产物中存在少量未降解组分。对于男性志愿者,发酵24 h后,m4号和m5号样本的发酵产物中存在极少量较大组分的寡糖,而其他男性样本发酵产物中均未检测到寡糖。以上结果说明肠道菌群能够很好地利用灵芝孢子粉低聚糖(UGLS-O、BGLS-O),但其受个体差异影响较大,男性相对女性具有更强的灵芝孢子粉寡糖利用能力。
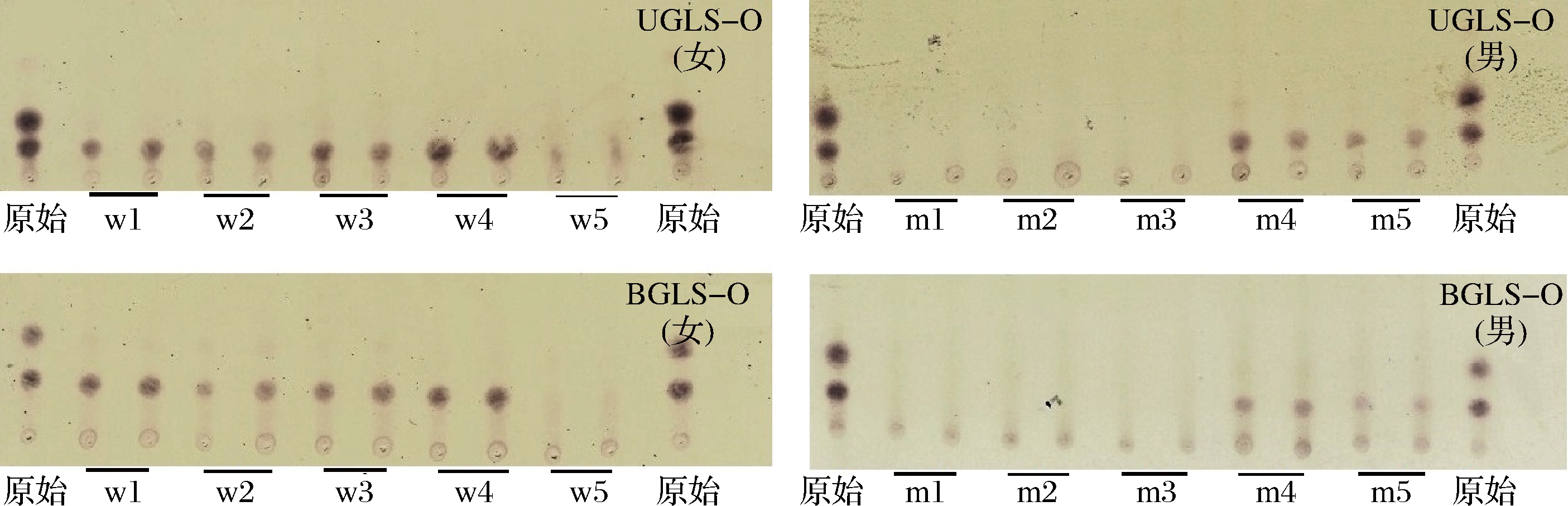
图1 十位志愿者肠道微生物对UGLS-O和BGLS-O的利用及降解情况TLC分析
Fig.1 UGLS-O and BGLS-O utilization and degradation patterns of 10 human (5 man, 5 woman) fecal microbiome analyzed by TLC
短链脂肪酸是肠道微生物主要的代谢产物,主要因厌氧微生物发酵难消化碳水化合物而产生。它们可被肠道黏膜有效吸收利用,可作为基因表达的调节剂和被特定受体识别的信号分子,从而对宿主产生重要影响[20]。已有研究表明它与人类某些病理状况(如炎症肠病和肠易激综合症)和细胞免疫发育之间存在直接联系,且碳水化合物底物的不同,发酵产生的短链脂肪酸的比例和生理作用也不同[16]。其中乙酸、丙酸、丁酸是肠道菌群发酵的主要短链脂肪酸代谢产物。
通过气相色谱分析粪便样品与发酵液中短链脂肪酸含量。以性别为单元进行分析,由图2-A可知,不同性别的粪便原样中,男女之间短链脂肪酸总含量存在显著性差异。

a-男女之间短链脂肪酸总含量差异;b-性别个体之间同种短链脂肪酸差异
图2 发酵前粪便中的短链脂肪酸含量
Fig.2 The SCFA concentrations in the feces before fermentation
注:*P<0.05,**P<0.01(下同)
对粪便原样中不同种类短链脂肪酸含量进行分析,由图2-B可知,对于同一种短链脂肪酸,不同性别个体间存在显著性差异。
比较不同性别的粪便样本在不同培养基中发酵后的短链脂肪酸含量,由图3-A可知,与空白对照组相比,添加不同种类低聚糖的培养基经体外发酵后短链脂肪酸总含量均得到了不同程度的提高,且男士相对女士具有较大的增长。对不同种类脂肪酸含量进行分析,由图3-B可知,乙酸是发酵的主要代谢产物,可作为合成胆固醇的重要底物。与空白对照相比,发酵24 h后,不同培养基乙酸含量均显著升高,其中男性高于女性样本。体外实验表明,丙酸含量的增加能够抑制胆固醇的合成,抑制癌细胞增长。由图3-C可知,与空白对照相比,发酵24 h后,UGLS-O和BGLS-O均能显著提高丙酸含量,但不同性别个体之间无明显差异。丁酸是肠上皮细胞的主要能量来源,由图3-D可知,与空白对照组相比,UGLS-O和BGLS-O在发酵24 h后均能增加丁酸含量。
以上结果表明,UGLS-O和BGLS-O与其他已报道的具有益生效果的低聚糖,如低聚果糖、低聚半乳糖等[21]一样,均能够增加SCFA产量,从而改善肠道菌群,促进有益菌增长,减少致癌物的产生。
肠道菌群在代谢蛋白质、碳水化合物产生SCFA的同时,也会产生CO2、H2、CH4、H2S等气体,它是肠道微生物代谢活动的副产物[22]。这些气体可直接或间接影响肠道状态,并影响人体健康,如适量气体有利于粪便膨胀以及排泄,但过多的气体则会引起腹胀等疾病,所以肠道气体可作为评估胃肠功能和许多受胃肠功能影响的疾病治疗效果的标志物[23]。

图3 粪便微生物在含不同培养基中发酵后短链脂肪酸含量
Fig.3 The SCFA productions of fecal microorganisms after different media fermentation
由图4可知,与空白对照组相比,体外发酵24 h后,UGLS-O和BGLS-O的气压值均稍有增加,但各培养基之间的气压值却无显著变化。因此UGLS-O和BGLS-O提取物对发酵过程中的产气量影响较小,不会引起腹胀等。
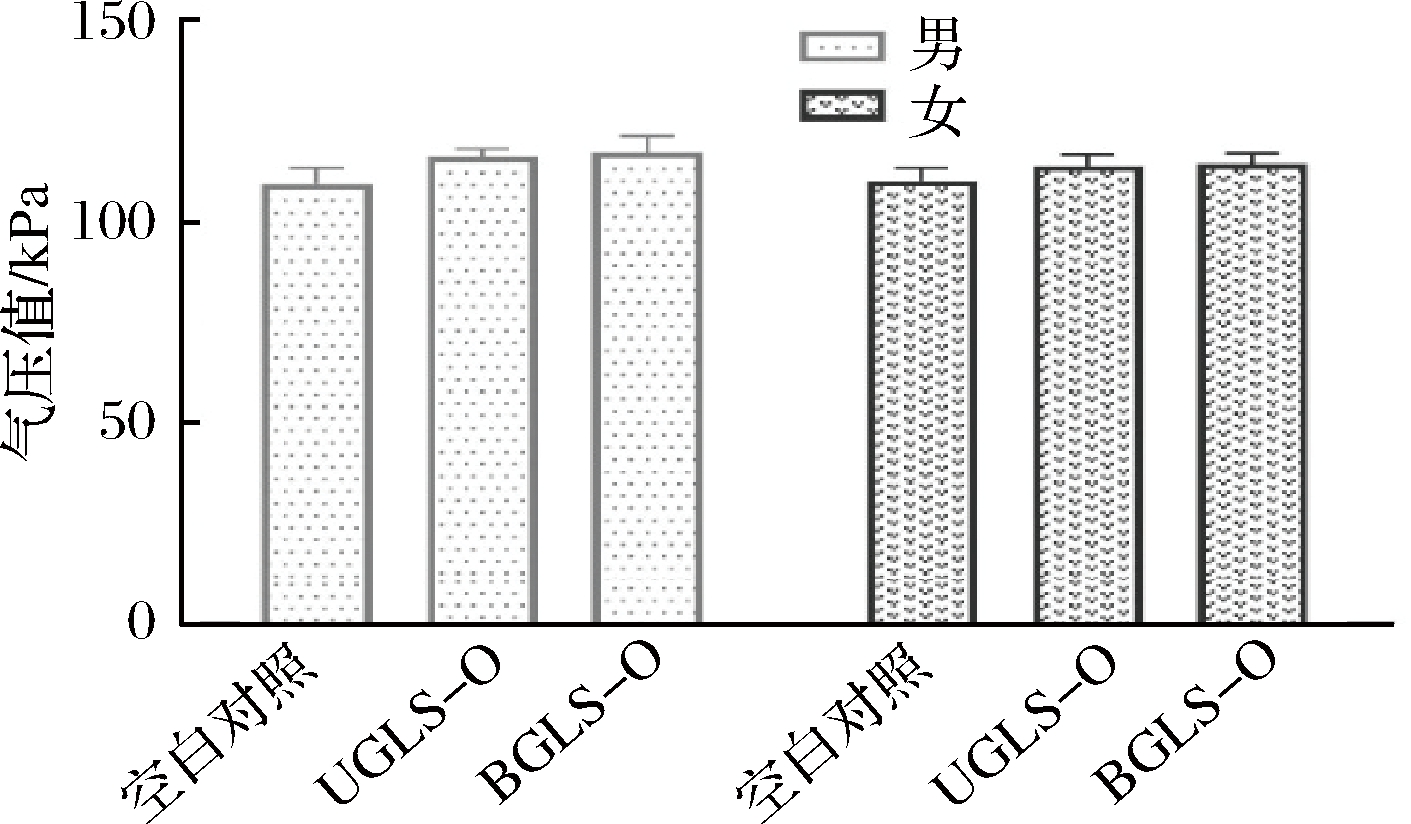
图4 体外发酵24 h肠道菌群产气气压值
Fig.4 Pressure value after 24 h of in vitro fermentation
2.5.1 稀释曲线
不同培养基发酵液中微生物稀释性曲线见图5,图5中1条曲线代表1个样本,横坐标为随机抽样的深度(即抽样的序列数),纵坐标为指数数值。从图5中可以看出各个样品的稀释曲线随着抽样序列数的增加而趋于平坦,此结果说明测序深度足够大,可以反映出样本中绝大多数微生物的多样性信息[24]。
A-稀释曲线图;B-Shannon曲线图
图5 测序深度图
Fig.5 Sequencing depth
2.5.2 发酵液中肠道菌群构成
选取相对丰度前15的细菌,进行属水平相对丰度的比较(图6)。由图6可知,发酵24 h后,与空白对照相比,添加灵芝孢子粉低聚糖的实验组中普雷沃菌属(Prevotella)、粪栖杆菌属(Faecalibacterium)、双歧杆菌属(Bifidobacterium)、乳酸杆菌属(Lactobacillus)等有益菌的相对丰度更高,而大肠杆菌属(Escherichia_shigella)的相对丰度有所降低。研究表明普雷沃菌属(Prevotella)丰度的增加可以改善人体的糖代谢机能,并且提升糖原的储存能力[25]。粪栖杆菌属(Faecalibacterium)在结肠中会产生丁酸和CO2,这对IBD和抑制肥胖均有潜在益处[26-27]。双歧杆菌属(Bifidobacterium)和乳酸杆菌属(Lactobacillus)是肠道细菌中典型的厌氧益生菌,研究表明以其为代表的益生菌可降低胆固醇、抗肿瘤、延缓衰老、抗菌消炎、抑制致病菌粘附、通便等活性[28]。
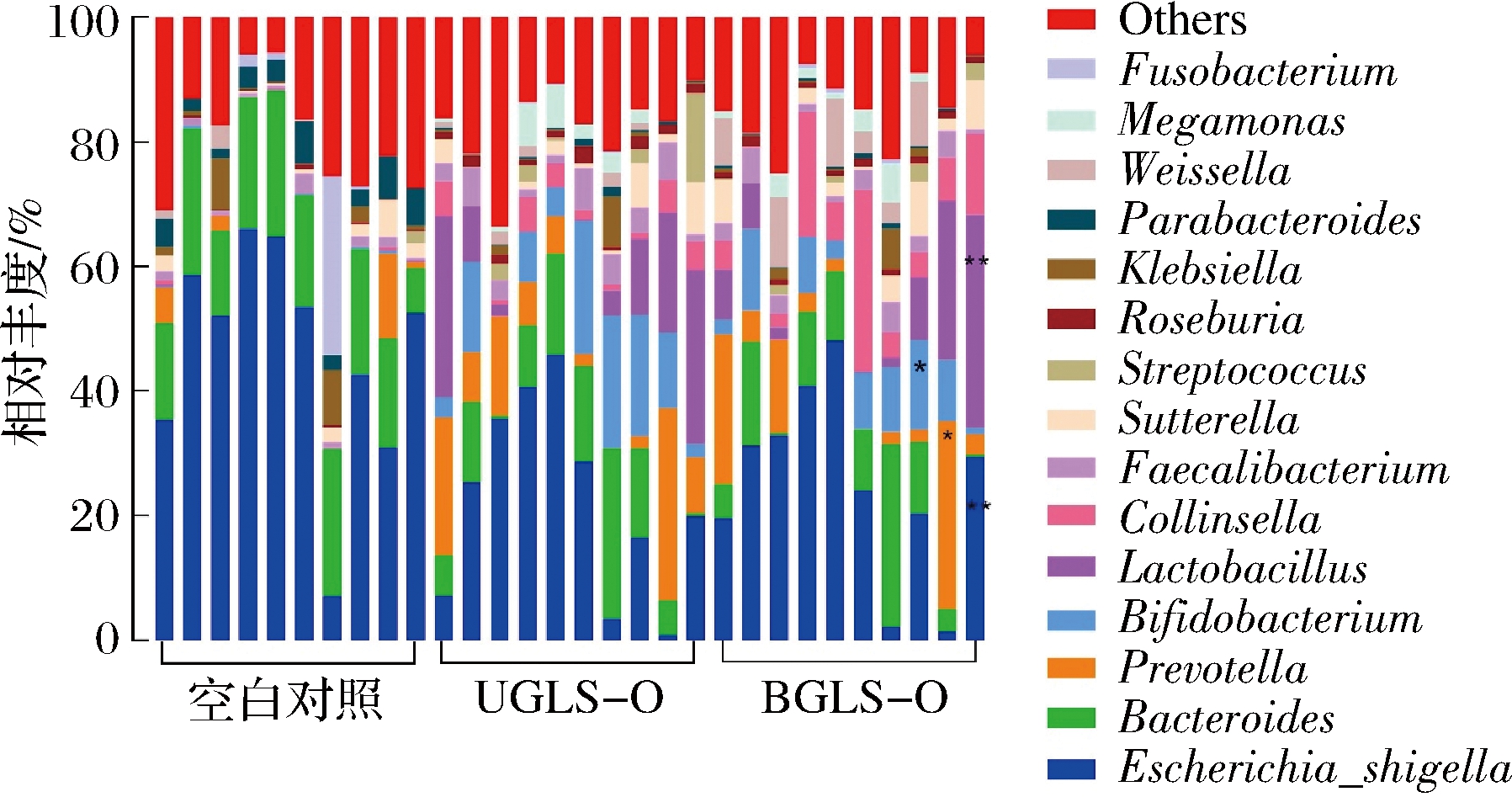
图6 肠道微生物群落属水平柱形图
Fig.6 Gut microbiologic community bar chart on genus level
对水提醇沉法提取破壁和未破壁灵芝孢子粉多糖时的上清液副产物进行低聚糖回收利用,经AB-8大孔树脂除杂和100~500 Da透析袋透析,获得了纯度约为80%的2种灵芝孢子粉低聚糖。通过体外发酵实验研究了2种低聚糖对肠道菌群的影响,发现肠道菌群能够有效利用灵芝孢子粉低聚糖。此外,与空白对照相比,添加灵芝孢子粉低聚糖能提高肠道菌群短链脂肪酸产量,并产生少量气体,从而促进肠道蠕动。体外发酵显示,灵芝孢子粉低聚糖不仅能够提高双歧杆菌、乳酸杆菌等有益菌的相对丰度,而且抑制大肠杆菌属丰度。相关研究成果可为灵芝孢子粉多糖提取副产物的综合利用及其低聚糖益生元的研究和产品开发提供依据。
[1] BENZIE I F F, WACHTEL-GALOR S. Herbal medicine: biomolecular and clinical aspects[M]. CRC Press,2011.
[2] 唐柳,张志军,魏雪生,等.灵芝孢子粉药理作用研究进展[J].天津农业科学,2011,17(3):25-28.
[3] 王颖,魏佳韵,吴思佳,等.灵芝多糖结构特征及药理作用的研究进展[J].中药,2019,41(3):627-635.
[4] 张天柱,赵婉君,吴国梁,等.灵芝孢子粉抗抑郁作用机制研究[J].时珍国医国药,2015,26(1):16-18.
[5] BOH B. Ganoderma lucidum: a potential for biotechnological production of anti-cancer and immunomodulatory drugs[J]. Recent Patents on Anti-cancer Drug Discovery,2013,8(3):255-287.
[6] YUE G G L,FUNG K P,LEUNG P C,et al. Comparative studies on the immunomodulatory and antitumor activities of the different parts of fruiting body of Ganoderma lucidum and Ganoderma spores[J]. Phytotherapy Research: An International Journal Devoted to Pharmacological and Toxicological Evaluation of Natural Product Derivatives,2008,22(10):1 282-1 291.
[7] LI S,LI M,YUE H,et al. Structural elucidation of a pectic polysaccharide from Fructus Mori and its bioactivity on intestinal bacteria strains[J].Carbohydrate Polymers,2018,186:168-175.
[8] TURNBAUGH P J, HAMADY M, YATSUNENKO T, et al. A core gut microbiome in obese and lean twins[J]. Nature,2009,457(7 228):480-484.
[9] AZMI A F M N, MUSTAFA S, HASHIM D M, et al. Prebiotic activity of polysaccharides extracted from Gigantochloa levis (Buluh beting) shoots[J]. Molecules,2012,17(2):1 635-1 651.
[10] 王向红,吉爽爽,桑亚新,等.金丝小枣低聚糖的制备及其对双歧杆菌体外促生长的研究[J].中国食品学报.2012,12(9):28-33.
[11] 胡丽萍.灵芝孢子低聚糖的制备及其改性研究[D].广州:华南理工大学,2011.
[12] 渠婷.金钗石斛低聚糖的分离、结构鉴定及其功能性研究[D].无锡:江南大学,2017.
[13] DUBOIS M,GILLES K A,HAMILTON J K,et al. Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350-356.
[14] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1-2):248-254.
[15] LI X, HU Q, JIANG S, et al. Flos Chrysanthemi Indici protects against hydroxyl-induced damages to DNA and MSCs via antioxidant mechanism[J]. Journal of Saudi Chemical Society,2015,19(4): 454-460.
[16] 吴琴琴.体外发酵模型检测食品营养组分对健康人与IBS-D病人肠道菌群的影响[D].金华:浙江师范大学,2018.
[17] FERIA-GERVASIO D, DENIS S, ALRIC M, et al. In vitro maintenance of a human proximal colon microbiota using the continuous fermentation system P-ECSIM[J]. Applied Microbiology and Biotechnology,2011,91(5):1 425-1 433.
[18] 郑志昌,陈映彤,郭娟娟,等.莲子低聚糖各单体体外益生效果研究[J].中国食品学报, 2019,19(7):56-63.
[19] 王增林,孙雪丽,刘桃桃,等.利用体外产气法研究饲粮中性洗涤纤维/淀粉对瘤胃甲烷产量的影响[J].动物营养学报,2019,31(7):3 251-3 259.
[20] MORRISON D J, PRESTON T. Formation of short chain fatty acids by the gut microbiota and their impact on human metabolism[J]. Gut Microbes,2016,7(3):189-200.
[21] 梁玉,赵鹏昊,尚佳萃,等.一月龄婴儿粪便菌群对五种非消化糖的体外发酵作用[J].食品工业科技,2019,40(21):72-77.
[22] OU J Z,YAO C K, ROTBART A, et al. Human intestinal gas measurement systems: in vitro fermentation and gas capsules[J]. Trends in Biotechnology,2015,33(4):208-213.
[23] CARBONERO F, BENEFIEL A C, GASKINS H R. Contributions of the microbial hydrogen economy to colonic homeostasis[J]. Nature Reviews Gastroenterology & Hepatology,2012,9(9):504.
[24] 张俊楠.体外发酵法研究铁皮石斛多糖对人肠道菌群的影响[D].厦门:厦门大学,2018.
[25] KOVATCHEVA-DATCHARY P, NILSSON A, AKRAMI R, et al. Dietary fiber-induced improvement in glucose metabolism is associated with increased abundance of Prevotella[J]. Cell Metabolism,2015,22(6):971-982.
[26] LA FATA G, RASTALL R, LACROIX C, et al. Recent development of prebiotic research-statement from an expert workshop[J]. Nutrients,2017,9(12):1376.
[27] HEALEY G, MURPHY R, BUTTS C, et al. Habitual dietary fibre intake influences gut microbiota response to an inulin-type fructan prebiotic: a randomised, double-blind, placebo-controlled, cross-over, human intervention study[J]. British Journal of Nutrition, 2018,119(2):176-189.
[28] YANG J, MART NEZ I, WALTER J, et al. In vitro characterization of the impact of selected dietary fibers on fecal microbiota composition and short chain fatty acid production[J]. Anaerobe,2013,23:74-81.
NEZ I, WALTER J, et al. In vitro characterization of the impact of selected dietary fibers on fecal microbiota composition and short chain fatty acid production[J]. Anaerobe,2013,23:74-81.