基于蔗糖利用能力对豆乳发酵菌株的筛选及其应用
赵羽,陆林,刘小鸣*,崔树茂,唐鑫,陈卫,赵建新
(江南大学 食品学院,江苏 无锡,214122)
摘 要 探究嗜热链球菌和乳酸乳球菌蔗糖利用能力的差异性对豆乳发酵菌株筛选的影响,并对菌株发酵豆乳样品的挥发性风味物质进行了分析。通过对12株实验菌株的蔗糖利用能力进行评价,测定菌株在以蔗糖为单一碳源环境下的生长、产酸情况,挑选菌株进行豆乳发酵特性评价,并运用GC-MS对发酵样品进行挥发性风味物质分析,了解不同菌株的蔗糖利用的差异及对豆乳发酵的影响。结果表明,不同实验菌株蔗糖利用能力具有显著差异,乳酸乳球菌实验菌株蔗糖利用能力显著优于嗜热链球菌;乳酸乳球菌DYNDL21-2可在豆乳发酵6 h后达到发酵终点,并代谢掉豆乳体系中65.38%的蔗糖(达1.766 g/L);发酵豆乳终点样品中己醛含量显著降低,有的菌株最高可生成198.49 μg/L奶香味物质2,3-丁二酮,及492.19 μg/L果香味物质3-甲基丁醇。菌株DYNDL21-2、HeNa-28-3-GMM和15G5的蔗糖利用能力良好,可快速发酵大豆豆乳,并使发酵豆乳风味得到显著改善,具有良好应用潜力。
关键词 发酵大豆豆乳;蔗糖;嗜热链球菌;乳酸乳球菌;风味
DOI:10.13995/j.cnki.11-1802/ts.023339
引用格式:赵羽,陆林,刘小鸣,等.基于蔗糖利用能力对豆乳发酵菌株的筛选及其应用[J].食品与发酵工业,2020,46(9):43-49.ZHAO Yu, LU Lin, LIU Xiaoming, et al. Screening of lactic acid bacteria for soymilk fermentation based on sucrose utilization ability[J].Food and Fermentation Industries,2020,46(9):43-49.
Screening of lactic acid bacteria for soymilk fermentation based on sucrose utilization ability
ZHAO Yu, LU Lin, LIU Xiaoming*, CUI Shumao, TANG Xin,CHEN Wei, ZHAO Jianxin
(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
Abstract The effects of sucrose utilization capacity on the screening of soymilk fermented strains in Streptococcus thermophilus and Lactococcus lactis were investigated, and the volatile profile of the fermented soymilk samples was analyzed. To analyze the sugar utilization ability of 12 strains, the growth and acid production of the selected strains were determined in sucrose-MRS broth where sucrose was the sole carbon source. The characteristics of the fermented soymilk samples were evaluated and volatile flavor substances were analyzed by GC-MS to understand the differences of sucrose utilization between strains and the effects on soymilk fermentation. The results showed that the sucrose utilization capacity of different experimental strains was significantly different, and the selected L. lactis strains generally showed higher sucrose utilization ability than the selected S. thermophilus strains. DYNDL21-2, a strain with good sucrose utilization ability, could ferment the soymilk and reach a pH below 4.7 within 6 h, and metabolized 65.38% sucrose (up to 1.766 g/L) in soymilk. Moreover, the content of hexanal in fermented soymilk samples was significantly reduced, with high concentrations of 2,3-butanedione (198.49 μg/L) and 3-methyl-butanol (492.19 μg/L) which contributed to creamy and fruity sensations. In summary, 3 strains with good sucrose utilization ability, DYNDL21-2, HeNa-28-3-GMM and 15G5, could rapidly ferment soymilk and significantly improved the volatile profile of the fermented soymilk.
Key words fermented soymilk; sucrose; Streptococcus thermophilus; Lactococcus lactis; volatile profile
第一作者:硕士研究生(刘小鸣教授为通讯作者,E-mail:liuxm@jiangnan.edu.cn)
基金项目:江苏省农业科学与技术创新基金(CX(17)1005)
收稿日期:2020-01-11,改回日期:2020-02-02
大豆豆乳是一种营养丰富的植物蛋白饮品,含有丰富的大豆蛋白和游离氨基酸[1],但是由于具有豆腥味,并且豆乳中的大豆低聚糖可被肠道菌群利用产气进而引起腹胀[2-3],所以豆乳饮品的接受度仍有待提高。
已有研究探讨了如何利用乳酸菌对大豆豆乳中的非结构性碳水化合物(包括蔗糖、棉子糖和水苏糖)进行发酵,改善豆乳的不良风味[4-5]。乳酸菌发酵大豆豆乳可生成乳酸、乙酸[6]等有机酸类物质,以及醛酮类[7]挥发性风味物质,促使发酵豆乳产品形成细腻的凝乳质地[8],并赋予其特殊奶香味、果香味等发酵香味[9-10],也可降低豆腥味的主要呈味物质己醛的含量[11-12]。目前已有从保加利亚乳杆菌、嗜热链球菌、干酪乳杆菌、植物乳杆菌及发酵乳杆菌等常见酸奶发酵菌株中[13-15]筛选大豆豆乳发酵菌株的报道,SINGH等[16]测定了植物乳杆菌、鼠李糖乳杆菌及瑞士乳杆菌在大豆豆乳发酵过程中蔗糖、棉子糖及水苏糖的消耗情况,发现实验菌株在豆乳发酵过程中优先利用蔗糖。
本课题组对实验室保藏的5株嗜热链球菌和7株乳酸乳球菌的蔗糖利用差异性进行探究,并测定菌株在豆乳发酵过程中的生长、产酸及蔗糖的消耗情况,结合发酵终点豆乳样品的挥发性风味物质检测,为更有效地筛选豆乳发酵菌株并进行良好应用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 实验试剂
胰蛋白胨、牛肉膏、葡萄糖、乙酸钠、酵母浸粉、MgSO4·7H2O、MnSO4·H2O、柠檬酸氢二铵、K2HPO4·3H2O、吐温-80、琼脂粉、NaCl、亚铁氰化钾、乙酸锌、溴甲酚紫、果糖、蔗糖、棉子糖、半乳糖,均为分析纯,国药集团化学试剂有限公司。大豆,产地东北,市售。
1.1.2 实验菌株
实验所使用的5株嗜热链球菌和7株乳酸乳球菌均由本实验室提供。菌株信息如表1所示。
1.2 仪器与设备
UV-1800紫外可见分光光度计,岛津仪器(苏州)有限公司;ST3100型pH计,奥豪斯仪器(常州)有限公司;Thermo Trace 1310型气相色谱-质谱联用仪,Thermo Fisher SCIENTIFIC;HWS-150型恒温恒湿培养箱,上海森信实验仪器有限公司;SW-CJ-1FD型超净工作台,苏州安泰空气技术有限公司;AW500SG型厌氧工作站,英国依莱泰科公司;5424 R型冷冻离心机,艾本德仪器有限公司;Waters1525液相色谱仪,美国Waters公司;MF-09多功能料理机,QG集团(英国)有限公司。
表1 实验菌株信息
Table 1 Information of strains used in this study

实验用菌株分离源Streptococcus thermophilus DQHXN7M2青海西宁酸奶Streptococcus thermophilus A6市售冠益乳酸奶Streptococcus thermophilus 15G-5四川若尔盖牧场牦牛酸奶Streptococcus thermophilus DYNDL7-5云南大理鲜扇Streptococcus thermophilus DYNDL13-4云南大理乳扇Lactococcus lactis DQHXN-NM38-14云南大理牛乳Lactococcus lactis DYNDL21-2四川泡菜Lactococcus lactis ZN8云南大理牛乳Lactococcus lactis DYNDL1-2海南罗驿村粪便Lactococcus lactis HeNa-28-3-GMM青海西宁曲拉Lactococcus lactis DQHXNQ05M30青海西宁酸奶Lactococcus lactis DYNDL66M43云南大理水牛乳
1.3 实验方法
1.3.1 培养基配制
MRS培养基配方参照WU等[17]的配方,蔗糖-MRS等改良培养基(sucrose-MRS broth)在MRS培养基配方的基础上,用蔗糖、棉子糖、果糖和半乳糖等量代替MRS培养基中的葡萄糖。无糖-MRS培养基的配方在MRS培养基基础上不添加葡萄糖。所有培养基在配制后需进行115 ℃高压灭菌20 min后待用。
1.3.2 菌株糖利用能力测定
取1.0 mL活化后的菌液于1.5 mL离心管中6 000 r/min离心3 min,弃去上清液,再加入1.0 mL PBS缓冲液洗涤2次,制成菌悬液。吸取200 μL添加溴甲酚紫指示剂的蔗糖-MRS、棉子糖-MRS、果糖-MRS及半乳糖-MRS液体培养基加入96孔板中,吸取2 μL菌悬液加入培养基中,30或37 ℃培养24 h,观察孔板中培养基颜色变化情况(其中乳酸乳球菌在30 ℃下培养,嗜热链球菌在37 ℃下培养,下文中皆分别采用此温度进行培养)。
1.3.3 菌株在蔗糖-MRS培养基中生长特性的测定
将活化3代后的菌液按照5×106 CFU/mL添加量接种到蔗糖-MRS培养基中,分别置于培养箱中恒温培养,每隔3 h取样,培养至15 h,测定样品的活菌数、OD600值及产酸情况。其中,根据前期实验确定菌株在MRS培养基中OD600值及活菌数的对应关系,取活化3代后的菌液测定OD600值,根据目的接种浓度计算得出菌液所需添加量。
1.3.4 大豆豆乳的制备
称取干大豆,每份100 g,分别加入1 L去离子水过夜浸泡。取浸泡后的大豆在沸水中热烫2 min,加入600 mL去离子水,60 ℃研磨6 min后煮沸5 min,稍冷却后用120目纱布过滤,并分装至蓝盖瓶中,105 ℃灭菌10 min,冷却至室温后放入4 ℃冰箱保存待用。
1.3.5 菌株在大豆豆乳中生长特性的测定
将活化3代后的菌液按照5×106 CFU/g添加量接种至大豆豆乳中,并置于30或37 ℃恒温发酵培养,每隔3 h取样,测定活菌数及产酸情况,直至豆乳凝乳(pH低于4.7)或发酵至15 h。每个取样点留取适量样品放置于-20 ℃冰箱保存。
1.3.6 豆乳中蔗糖含量的测定
参考HATI等[18]的方法并进行部分改良。称取2 g豆乳样品,加入1.5 mL超纯水稀释后于60 ℃孵育10 min,依次加入0.25 mL 0.5 mol/L亚铁氰化钾溶液,0.25 mL 0.5 mol/L乙酸锌溶液以及1.0 mL乙腈溶液,缓慢混合后在室温下静置4 h,以9 000 r/min转速离心8 min,取上清液经0.22 μm有机滤膜过滤,将过滤好的上清液在40 W功率下超声5 min,排除溶解的气泡,每个样品设2个平行。利用HPLC对糖消耗情况进行分析,色谱柱为Waters NH2,4.6 mm×250 mm,流动相为V(乙腈)∶V(水)=70∶30,柱温30 ℃,进样体积20 μL,流速为1 mL/min。
1.3.7 发酵豆乳挥发性风味物质测定
参考LI等[19]的方法并通过预实验改良。称取5 g发酵豆乳样品至20 mL萃取瓶中,依次加入1.0 g NaCl和2 μL 0.1 mg/mL的2-甲基-3-庚酮(内标)。采用固相微萃取方法提取发酵豆乳中的风味成分,萃取探头是涂抹厚度为85 μm的 CAR/PDMS,在50 ℃条件下萃取30 min,解吸5 min,进行GC-MS分析。色谱条件:色谱柱WAX;升温程序35 ℃保持3min,以6 ℃/min升至210 ℃,保持10 min;载气流速(He)1.5 mL/min,进样口温度240 ℃,分流比为10∶1。质谱条件:电子轰击离子源,电子能量70 eV;离子源温度240 ℃,质谱范围m/z 33~350 amu。
1.3.8 统计分析及数据处理
本文中所有图形均采用Origin Pro8软件绘制;采用Xcalibur及TraceFinder软件对豆乳中挥发性风味物质进行鉴定及定量(鉴定依据:在Fiehn.HP,MAINLIB,NISTDEMO及REPLIB质谱库中匹配因子>800,文库命中数>3,确认峰>3);采用 SPSS 22.0 统计分析软件进行数据处理和统计分析,数据间的比较采用Duncan模型进行显著性分析,显著性水平P<0.05。
2 结果与讨论
2.1 菌株对大豆豆乳碳水化合物利用能力的评价
实验菌株对大豆豆乳中2种主要碳水化合物(蔗糖和棉子糖)及2种代谢产生的碳水化合物(果糖和半乳糖)利用实验结果如表2所示。结果显示,嗜热链球菌与乳酸乳球菌均不利用棉子糖,对其余3种碳水化合物利用能力具有显著差异性。5株嗜热链球菌均不利用果糖,而7株乳酸乳球菌果糖利用能力较好,反应8 h内溴甲酚紫完全变色。5株嗜热链球菌中仅有15G-5、DYNDL7-5及DYNDL13-4三株菌株具有微弱半乳糖利用能力,24 h后溴甲酚紫微弱变色,7株乳酸乳球菌均可利用半乳糖,其中DYNDL21-2、DYNDL1-2、HeNa-28-3-GMM和DYNDL66M43四株菌株可快速利用半乳糖产酸,于8 h内使溴甲酚紫完全变色。
表2 实验菌株对大豆豆乳中碳水化合物的利用情况
Table 2 The utilization of carbohydrate in soymilk by
experimental strains

菌株棉子糖果糖半乳糖蔗糖DQHXN7M2----A6---+15G-5--+-++DYNDL7-5--+-++DYNDL13-4--+-++DQHXN-NM38-14+-++++DYNDL21-2-++++++ZN8-+++++DYNDL1-2-++++++HeNa-28-3-GMM-++++++DQHXNQ05M30-++++-DYNDL66M43-++++++
注:“++”,生长8 h即变色,“+”,生长24 h变色,“+-”,生长24 h微变色,“-”,生长24 h不变色;溴甲酚紫变色范围为5.2(黄色)~6.8(紫色)
实验菌株在蔗糖的利用能力间具有显著差异,除嗜热链球菌DQHXN7M2外,其余4株嗜热链球菌均可利用蔗糖,其中菌株A6蔗糖利用能力相对较差,于生长24 h后使溴甲酚紫变色。7株乳酸乳球菌实验菌株均具有蔗糖利用能力,其中菌株DQHXN-NM38-14和DQHXNQ05M30蔗糖代谢较慢,其余5株实验菌株均可在8 h内使溴甲酚紫变色。
综上所述,由于蔗糖为大豆豆乳中含量最高的非结构性碳水化合物,且2种实验菌株均具有良好蔗糖利用能力,因此根据上述实验结果,选择3株嗜热链球菌(15G-5、DYNDL7-5和DQHXN7M2)及4株乳酸乳球菌(ZN8、DYNDL21-2、HeNa-28-3-GMM和DQHXNQ05M30)在蔗糖-MRS培养基中进行以蔗糖为单一碳源的生长、产酸测定。
2.2 菌株在蔗糖-MRS中的生长特性评价
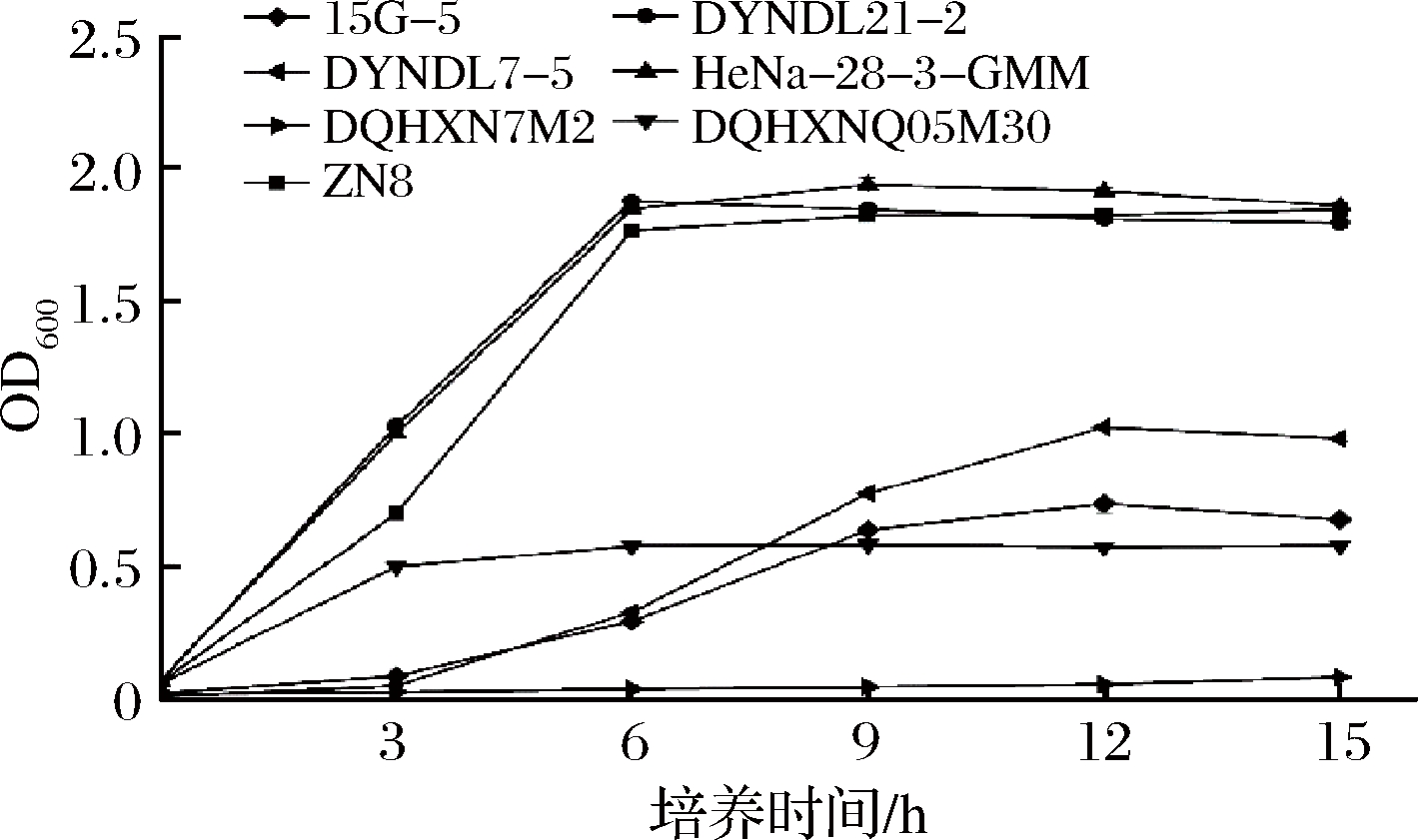
实验菌株在蔗糖-MRS中生长、产酸实验结果分别如图1和图2所示,菌株在蔗糖-MRS中的生长、产酸能力具有显著差异性,其中乳酸乳球菌蔗糖利用能力显著优于嗜热链球菌。
4株乳酸乳球菌中,ZN8、DYNDL21-2和HeNa-28-3-GMM三株菌株在蔗糖-MRS培养基中生长良好(见图1),无明显延滞期,3 h内已进入对数生长期,6 h后进入稳定期,同时OD600值可达到1.8左右;菌株DQHXNQ05M30蔗糖利用能力较差,仅在3h内有微弱生长,OD600值仅达到0.579,且后期再无增长。菌株在蔗糖-MRS培养基中的产酸情况(图2)与生长结果相对应,ZN8、DYNDL21-2和HeNa-28-3-GMM三菌株的pH值在接种3 h内就已经开始快速下降,并于6 h后趋于稳定,最终稳定期pH达到4.3以下。蔗糖利用能力较差菌株DQHXNQ05M30在生长期内pH无明显下降。
3株嗜热链球菌中,15G-5和DYNDL7-5在蔗糖-MRS培养基的生长相较乳酸乳球菌较为缓慢,于生长3 h后进入对数生长期,12 h后进入稳定期,OD600值分别为0.676与0.982。菌株在蔗糖-MRS培养基中的产酸情况也与生长趋势基本符合,3~9 h内pH快速下降,于12 h后进入稳定期pH值到达5.0以下。而菌株DQHXN7M2的蔗糖利用能力较差,生长与产酸数值随时间均无显著变化。
相较于嗜热链球菌实验菌株,乳酸乳球菌实验菌株在以蔗糖为唯一碳源下生长延滞期更短,对数生长期内的生长及产酸速率较快且终点pH较低,具有更强的蔗糖利用能力。根据菌株在蔗糖-MRS中的生长情况,分别选取3株乳酸乳球菌(DYNDL21-2、HeNa-28-3-GMM和DQHXNQ05M30)与2株嗜热链球菌(15G-5和DQHXN7M2)进行大豆豆乳发酵实验,进一步探究实验菌株发酵大豆豆乳的能力。
2.3 菌株在大豆豆乳中的发酵情况评价
实验菌株发酵豆乳凝乳情况如表3所示。乳酸乳球菌DYNDL21-2发酵6 h后凝乳,嗜热链球菌15G-5及乳酸乳球菌HeNa-28-3-GMM发酵6 h后微凝,发酵9 h后凝乳。蔗糖利用能力较差菌株DQHXNQ05M30和DQHXN7M2发酵12 h后仍未凝乳。
表3 菌株在大豆豆乳中的凝乳情况
Table 3 Curding time of different strains in soymilk

实验菌株发酵时间0 h3 h6 h9 h12 hDYNDL21-2--凝乳凝乳凝乳15G-5--微凝凝乳凝乳HeNa-28-3-GMM--微凝凝乳凝乳DQHXN7M2-----DQHXNQ05M30-----
注:“-”表示未凝乳
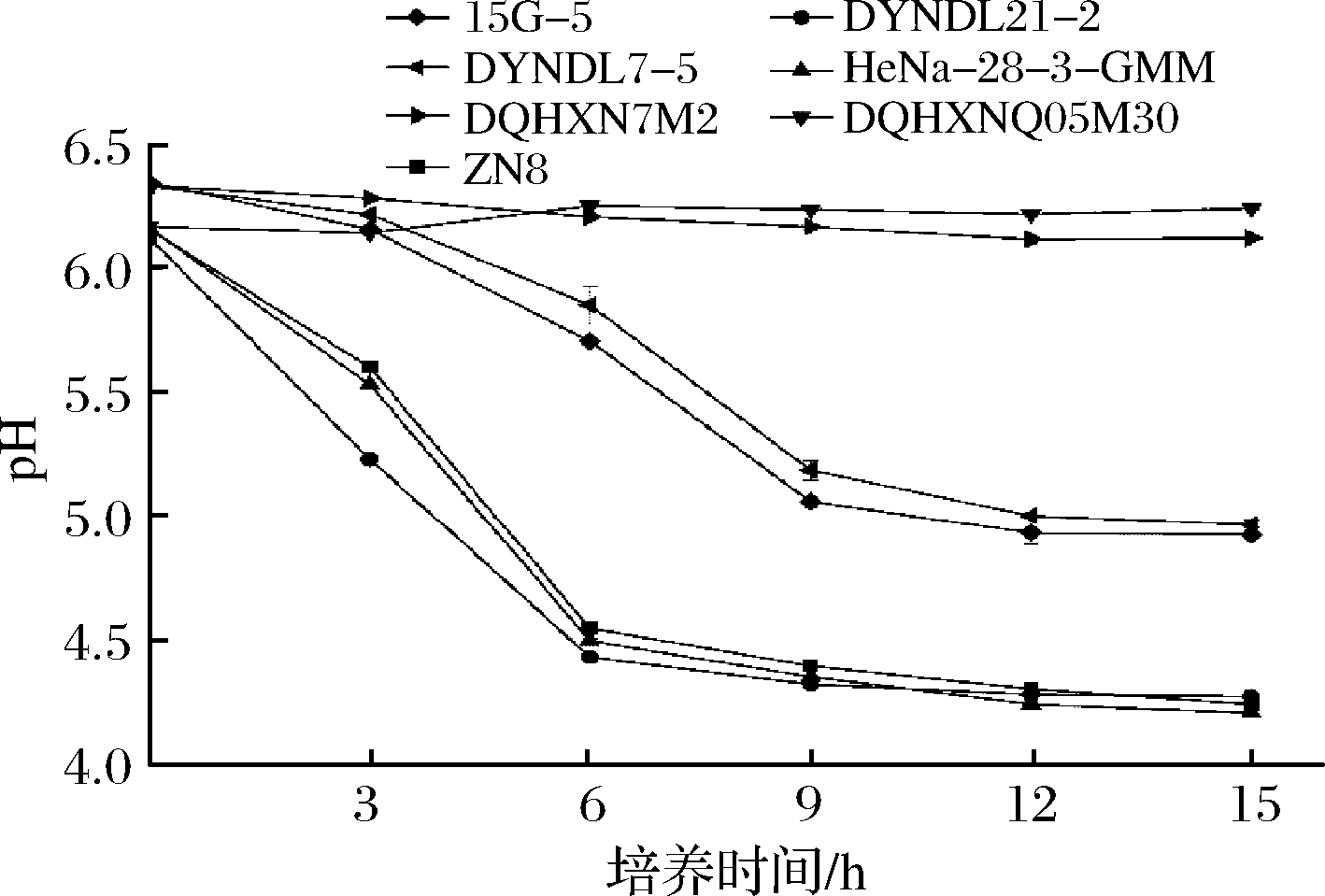
菌株发酵大豆豆乳过程中的生长情况如图3所示,不同菌株在大豆豆乳体系中生长情况差异显著,具有较好蔗糖利用能力的菌株15G-5、DYNDL21-2及HeNa-28-3-GMM在大豆豆乳中表现出较强的生长能力,发酵终点活菌数较初始接种量均增长2个数量级左右。而2株蔗糖利用能力较差菌株DQHXNQ05M30和DQHXN7M2则较初始接种量仅分别增长1.38与0.62个数量级,显著低于其他3株蔗糖利用能力良好的实验菌株,推测是由于菌株不良的蔗糖利用能力限制其在大豆豆乳中的生长。
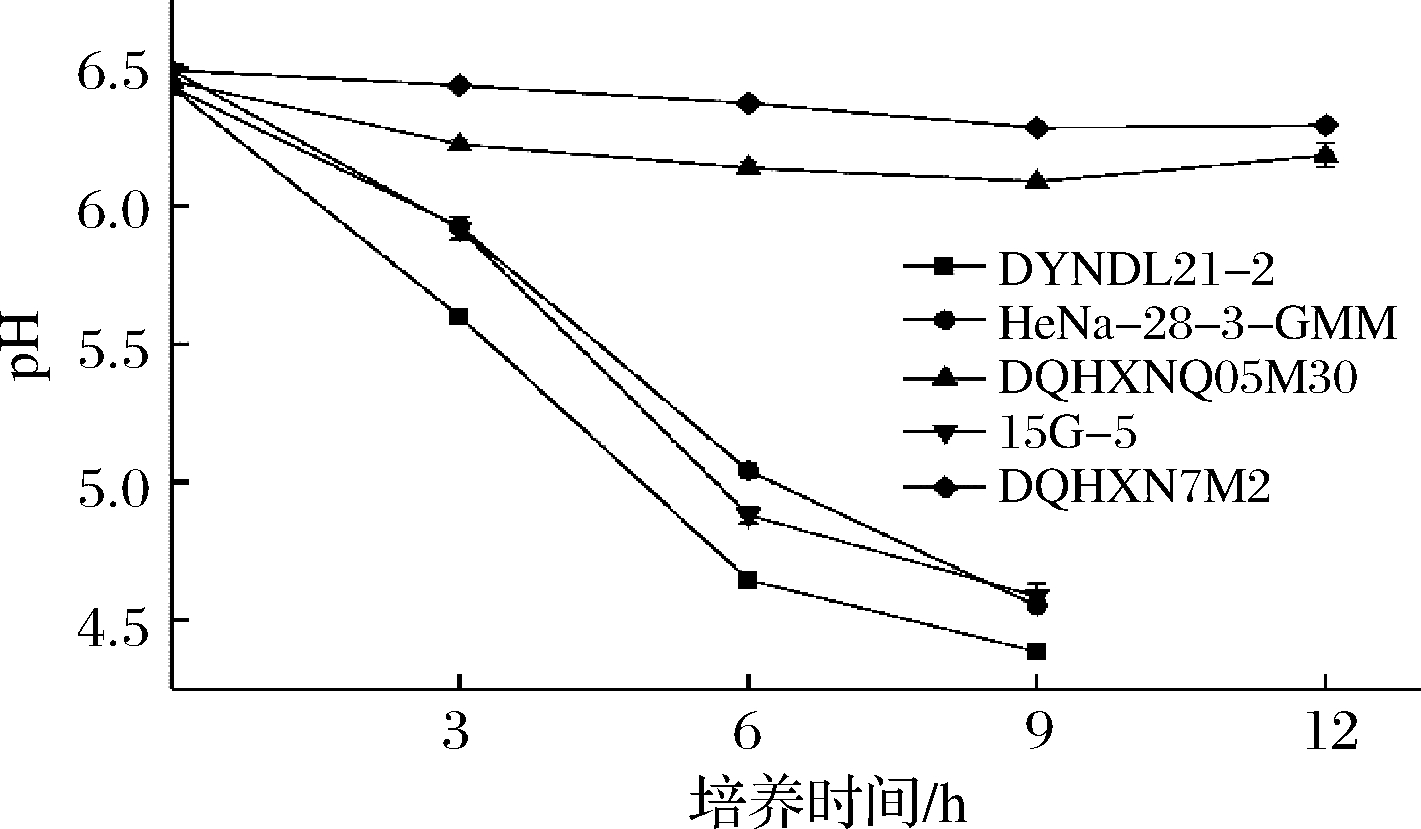
豆乳发酵过程中菌株产酸情况如图4所示。实验菌株在大豆豆乳中pH的变化趋势与在蔗糖-MRS培养基中相似,相较于蔗糖-MRS培养基中的产酸变化情况,嗜热链球菌15G-5在大豆豆乳中发酵3 h内的产酸速率较快,延滞期缩短,这可能是由于大豆豆乳中游离氨基酸含量较高,为嗜热链球菌前期生长提供了更为适宜的营养环境,生长及产酸更为迅速。乳酸乳球菌DYNDL21-2在大豆豆乳中的产酸速率最快,于发酵6 h后到达发酵终点(pH<4.7)完成凝乳。其余1株乳酸乳球菌HeNa-28-3-GMM和1株嗜热链球菌15G-5均在发酵9 h后达到发酵终点并完成凝乳,终点pH分别为4.55和4.59。2株蔗糖利用能力较差菌株在发酵12 h后仍未到达发酵终点,pH均在6.0以上。
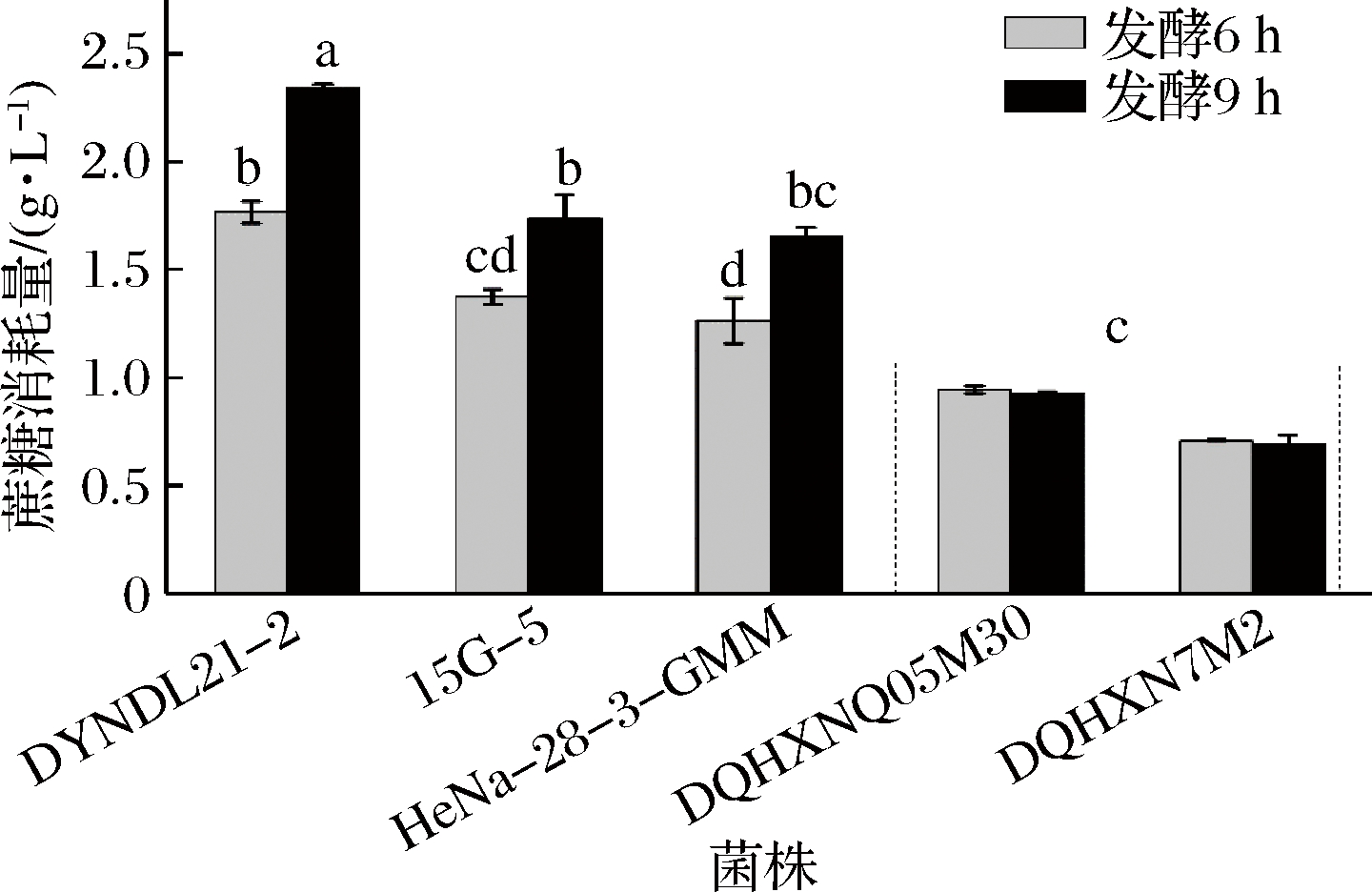
根据不同实验菌株在发酵大豆豆乳过程中体系内蔗糖的消耗量(图5)可以看出,乳酸乳球菌DYNDL21-2在发酵终点时(发酵6 h)消耗掉豆乳体系内1.766 g/L蔗糖,占豆乳中蔗糖含量的65.38%(未发酵大豆豆乳中蔗糖含量为2.701 g/L),显著高于其余2株实验菌株。在发酵9 h后,菌株HeNa-28-3-GMM和15G-5达到发酵终点,其蔗糖的消耗量分别达到1.650和1.740 g/L,均消耗掉体系内60%以上的蔗糖。而2株蔗糖利用能力较差菌株则仅消耗掉大豆豆乳体系内35%以下的蔗糖,显著低于实验菌株,与产酸情况一致,说明菌株的蔗糖利用能力对其在大豆豆乳中生长及产酸具有显著影响。
实验中3株实验菌株均可快速在大豆豆乳中产酸并实现凝乳,与前文中具有良好蔗糖代谢能力的菌株可快速发酵大豆豆乳凝乳的推测相一致,因此判断蔗糖利用能力可作为评价大豆豆乳发酵菌株的重要指标。
2.4 发酵豆乳挥发性风味物质测定
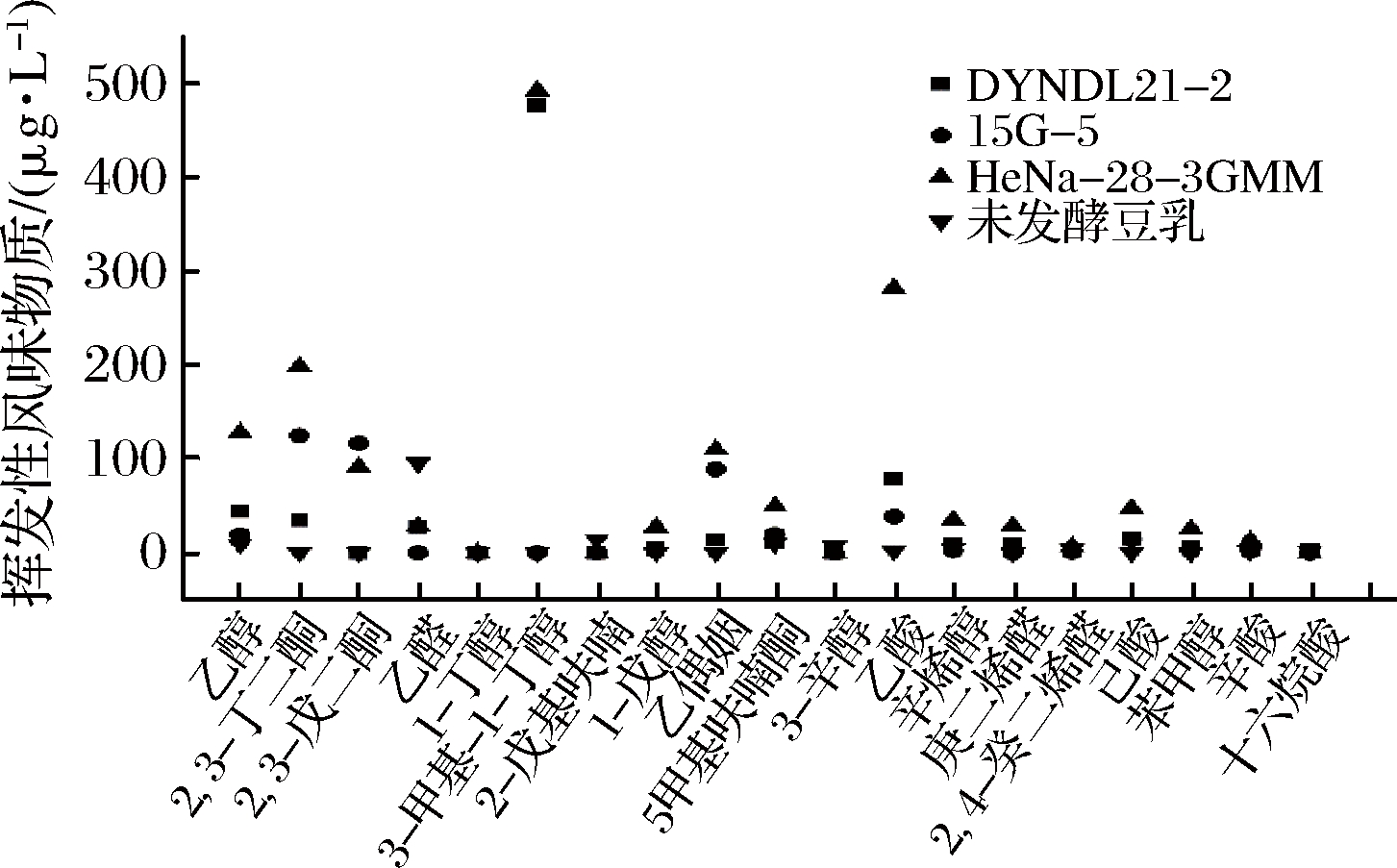
利用GC-MS对3株实验菌株发酵终点豆乳样品的挥发性风味物质进行分析,其结果如图6所示。根据相关研究可知[8],大豆豆乳中不良风味豆腥味的主要贡献物质为己醛,乳酸菌发酵可降低豆乳中豆腥味呈味物质的含量。由图6可以看出,未发酵豆乳中的己醛含量显著高于发酵后的大豆豆乳,3株实验菌株发酵终点豆乳样品中的己醛含量均显著下降,其中嗜热链球菌15G-5的发酵终点豆乳样品中己醛含量未检出。除去降低大豆豆乳中原本存在的不良气味贡献物质外,2,3-丁二酮、2,3-戊二酮以及乙偶姻等奶香味的主要贡献物质[20]经发酵后均有不同程度的产生,其中HeNa-28-3-GMM菌株发酵大豆豆乳终点样品中的2,3-丁二酮及乙偶姻的含量显著高于其他菌株,分别达到了198.49和109.93 μg/L,使得发酵后的大豆豆乳具有令人愉悦的奶香味。
此外,乳酸乳球菌DYNDL21-2和HeNa-28-3-GMM在发酵后还产生了较多的3-甲基丁醇,分别高达476.05和492.19 μg/L。醇类物质是一种重要的挥发性风味物质,在番茄、苹果和甜瓜果实等天然食品中,是其主要的风味物质[21]。乳酸菌发酵过程中的亮氨酸代谢与3-甲基丁醇的生成相关,且该物质在发酵乳中的含量与果香味呈正相关[22]。因此,3-甲基丁醇的生成对改善豆乳不良风味具有重要作用。
综合上述分析可知,实验菌株发酵后的大豆豆乳在风味方面得到了较大的改善与提高,主要通过菌株发酵降低大豆豆乳中不良风味物质的含量及生成优良风味物质2种途径。嗜热链球菌15G-5通过发酵显著降低大豆豆乳中豆腥味的呈味物质己醛及2-戊基呋喃的含量,发酵终点样品中该物质未检出,显著低于未发酵豆乳。乳酸乳球菌HeNa-28-3-GMM通过发酵显著提高大豆豆乳中2,3-丁二酮及乙偶姻的含量,发酵终点样品具有奶香味特征。同时,2株乳酸乳球菌实验菌株经发酵均产生较多3-甲基丁醇,为发酵终点样品赋予果香味特征。
3 结论
通过对5株嗜热链球菌和7株乳酸乳球菌在大豆豆乳发酵过程中4种主要碳水化合物的利用能力进行测定,确定2种菌株均具有蔗糖代谢能力,具有发酵大豆豆乳的潜力。对初筛得到的7株菌株在蔗糖-MRS中进行生长测定,发现不同菌株之间蔗糖代谢能力存在显著差异,其中乳酸乳球菌在蔗糖-MRS培养基中生长基本无延滞期,6 h后进入稳定期,而嗜热链球菌蔗糖代谢能力则相对滞后。选择对蔗糖利用能力优良的菌株进行大豆豆乳发酵,发现蔗糖利用能力强的菌株可在大豆豆乳中快速生长并于6~9 h内产酸凝乳,结合大豆豆乳发酵终点样品的挥发性风味物质检测结果,菌株发酵后豆乳中己醛含量显著下降,并产生以2,3-丁二酮为代表的奶香味物质和以3-甲基丁醇为代表的果香味物质,为发酵后豆乳增加特殊发酵香味,可进一步改良大豆豆乳自身的不良风味。
本文基于乳酸菌蔗糖利用能力对豆乳发酵菌株进行筛选,可高效获得具有较好发酵特性的豆乳发酵菌株,并赋予发酵豆乳良好风味,对发酵豆乳的生产与应用具有一定价值。但如何进一步代谢大豆豆乳中低聚糖,缓解豆乳饮用后胀气反应,仍需进一步研究。
参考文献
[1] ROSENTHAL A, DELIZA R, CABRAL L M C, et al. Effect of enzymatic treatment and filtration on sensory characteristics and physical stability of soymilk[J]. Food Control, 2003, 14(3):187-192.
[2] MIN S, YU Y, YOO S, et al. Effect of soybean varieties and growing locations on the flavor of soymilk[J]. Journal of Food Science, 2005, 70(1):1-11.
[3] GIRI S K, MANGARAJ S. Processing influences on composition and quality attributes of soymilk and its powder[J]. Food Engineering Reviews, 2012, 4(3):149-164.
[4] 王立红, 刘家亨, 马力, 等. 大豆碳水化合物结构功能的研究进展[J]. 大豆科学, 2015, 34(4):703-711.
[5] MITAL B K, et al. Growth of lactic acid bacteria in soy milks[J]. Journal of Food Science, 1974,39(5): 1 018-1 022.
[6] SCALABRINI P, ROSSI M, SPETTOLI P, et al. Charaterization of bifidobacterium strains for use in soymilk fermentation[J]. International Journal of Food Microbiology, 1998, 39(3):213-219.
[7] 马磊, 孙君明, 韩粉霞. 大豆豆奶风味品质研究进展[J]. 大豆科学, 2012,31(3):478-482.
[8] MILLS S, ORLA O'SULLIVAN, HILL C, et al. The changing face of dairy starter culture research: From genomics to economics[J]. International Journal of Dairy Technology, 2010, 63(2):149-170.
[9] CAVANAGH D, FITZGERALD G F, MCAULIFFE O. From field to fermentation: The origins of Lactococcus lactis and its domestication to the dairy environment[J]. Food Microbiology, 2015, 47C:45-61.
[10] SHI X D, LI J Y, et al. Flavor characteristic analysis of soymilk prepared by different soybean cultivars and establishment of evaluation method of soybean cultivars suitable for soymilk processing[J]. Food Chemistry, 2015, 185:422-429.
[11] CHAMPAGNE C P, GREEN-JOHNSON J, RAYMOND Y, et al. Selection of probiotic bacteria for the fermentation of a soy beverage in combination with Streptococcus thermophilus[J]. Food Research International, 2009, 42(5-6):612-621.
[12] MURTI T W, BOUILLANNE C, MICH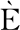 LE L, et al. Bacterial growth and volatile compounds in yoghurt mil ype products from soymilk containing Bifidobacterium ssp.[J]. Journal of Food Science, 2006, 58(1):153-157.
LE L, et al. Bacterial growth and volatile compounds in yoghurt mil ype products from soymilk containing Bifidobacterium ssp.[J]. Journal of Food Science, 2006, 58(1):153-157.
[13] VONG W C, LIU S Q. The effects of carbohydrase, probiotic Lactobacillus paracasei and yeast Lindnera saturnus on the composition of a novel okara (soybean residue) functional beverage[J]. Lebensmittel-Wissenschaft und-Technologie / Food Science and Technology, 2019, 100:196-204.
[14] WANG J, GUO Z, ZHANG Q, et al. Fermentation characteristics and transit tolerance of probiotic Lactobacillus casei Zhang in soymilk and bovine milk during storage[J]. Journal of Dairy Science, 2009, 92(6):2 468-2 476.
[15] WANG Y C, YU R C, YANG H Y, et al. Sugar and acid contents in soymilk fermented with lactic acid bacteria alone or simultaneously with bifidobacteria[J]. Food Microbiology (London), 2003, 20(3):333-338.
[16] SINGH B P, VIJ S. α-Galactosidase activity and oligosaccharides reduction pattern of indigenous Lactobacilli during fermentation of soy milk[J]. Food Bioscience, 2018, 22: 32-37.
[17] WU Q, SHAH N. The potential of species-specific tagatose-6-phosphate (T6P) pathway in Lactobacillus casei group for galactose reduction in fermented dairy foods[J]. Food Microbiology, 2017, 62:178-187.
[18] HATI S, VIJ S, MANDAL S, et al. α-Galactosidase activity and oligosaccharides utilization by Lactobacilli during fermentation of soy milk[J]. Journal of Food Processing and Preservation, 2014, 38(3).
[19] LI C, LI W, CHEN X, et al. Microbiological, physicochemical and rheological properties of fermented soymilk produced with exopolysaccharide (EPS) producing lactic acid bacteria strains[J]. LWT - Food Science and Technology, 2014, 57(2):477-485.
[20] BESHKOVA D, SIMOVA E, FRENGOVA G, et al. Production of flavor compounds by yogurt starter cultures[J]. Journal of Industrial Microbiology and Biotechnology, 1998, 20(3-4):180-186.
[21] 乜兰春,孙建设,黄瑞虹. 果实香气形成及其影响因素[J]. 植物学通报, 2004, 21(5):631-637.
[22] ZEHRA GÜLER. Changes in salted yoghurt during storage[J]. International Journal of Food Science & Technology, 2007, 42(2):235-245.



 LE L, et al. Bacterial growth and volatile compounds in yoghurt mil ype products from soymilk containing
LE L, et al. Bacterial growth and volatile compounds in yoghurt mil ype products from soymilk containing