新疆风干肉是新疆游牧民族的特色肉制品之一,其中以塔城风干肉最为有名。风干肉又分为风干牛肉、风干马肉、风干羊肉[1]。新疆风干肉的制作主要在秋冬季节,以牛肉、马肉或羊肉为原料,进行切块、短时腌制,再经风干后熟制作而成,属于干腌发酵肉制品。风干肉风味独特,其挥发性风味物质主要来源于脂肪氧化、香辛料添加及氨基酸Strecker降解[2]。氨基酸的Strecker降解主要是使肉中蛋白质经过降解形成多肽、小肽、氨基酸和胺,蛋白质降解主要是由于肉中内源性的酶以及产蛋白酶微生物的催化[3]。
产蛋白酶乳酸菌所产的蛋白酶可以在肉制品发酵过程中对蛋白质进行降解,是肉制品风味形成的基础。TODOROV等[4]研究表明,乳酸菌通过引起pH降低来影响蛋白质降解,从而导致肌肉蛋白酶的活性增加。更重要的是,乳酸菌所产的蛋白酶吸收了由肌肉蛋白水解产生的肽,并将这些肽在细胞内分裂成氨基酸,转化为芳香成分。乳酸菌蛋白水解系统按其功能可分为3个部分:首先,细胞外蛋白酶作用于底物蛋白并将肉蛋白分解为肽;第二,肽酶水解肽;最终,分解产物穿过细胞质膜[5]肽是肉味物质的前体[6]。乳酸菌蛋白酶在发酵过程中促进了游离氨基酸和短肽浓度的增加[7-8],对发酵肉的成熟具有积极作用[9],而其代谢产物则促进了风味的形成[10]。周才琼等[11]对酸肉发酵过程中挥发性风味物质形成的研究得出结论,通过微生物生长繁殖分泌胞外酶,导致脂肪及蛋白质降解,产生与发酵风味形成有关的醛、酮、醇、酸等物质,并发生酯化反应,形成了酸肉的特有风味。ESSID等[12]从突尼斯传统咸肉中分离出具有良好抗菌性和耐酸性的乳酸菌,并且所分离的乳酸菌都具有良好的水解酪蛋白的能力。林伟涛等[13]从中式发酵香肠中分离筛选出具有当地特色的自然发酵香肠风味乳酸菌,它们都具有很好的产酸和产酶特性。SUN等[14]从哈尔滨干香肠中分离出1株乳酸菌产蛋白酶可以水解肌原纤维和肌浆蛋白,所产蛋白酶在pH 6和40 ℃下具有活性。有关新疆风干肉中分离乳酸菌的研究主要集中在乳酸脱氢酶、亚硝酸还原酶和酯酶的特性方面[1],对新疆传统风干肉中产蛋白酶乳酸菌对其品质影响的机制尚不明确。
本实验以新疆风干肉中高产蛋白酶乳酸菌为研究对象,系统研究了菌株产酶特性和蛋白酶性质,以期为风干肉的工业化生产提供理论数据。
1.1.1 实验原料
风干牛肉和风干马肉样品:购于新疆塔城、额敏、富蕴、托里地区。
1.1.2 培养基
MRS肉汤、MRS固体培养基:青岛海博生物技术有限公司;MRS脱脂乳固体培养基:在MRS固体培养基中加入体积分数为1%的脱脂乳。
1.1.3 试剂
福林试剂、无水Na2CO3、三氯乙酸、NaOH、浓HCl、H3PO4、乳酸、乳酸钠、冰乙酸、干酪素、L-酪氨酸、无水乙醇、EDTA等,均为国产分析纯;细菌DNA提取试剂盒,天根生化科技(北京)有限公司;2×Taq Master Mix (Dye Plus),南京诺唯赞生物科技有限公司;琼脂糖西班牙,Biowest公司。
22331型高速冷冻离心机,德国Eppendorf AG公司;HP1020凝胶成像系统,美国BIO-RAD伯乐公司;T100型PCR仪,美国BIO-RAD伯乐公司;CX23LEDRFS1C生物显微镜,奥林巴斯(广州)工业有限公司;LDZX-30KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;EONC酶标仪,美国伯腾仪器有限公司;水平电泳槽(小型),美国Bio-Rad公司;核酸测定仪,美国赛默飞世尔科技公司;UB-7型pH计,美国赛多利斯丹佛公司。
1.3.1 乳酸菌的筛选分离、纯化与鉴定
参考林伟涛等[13]的方法并作适当修改。在无菌条件下取10 g风干肉样品充分剪碎,放入灭菌后的90 mL生理盐水中,37 ℃、120 r/min培养24 h。吸取1mL菌液用生理盐水进行10倍梯度稀释,每次稀释均需用旋涡振荡器仪充分混匀并更换无菌枪头。分别吸取10-5~10-7梯度的稀释液200 μL稀释液均匀涂布于MRS培养基中,每个梯度做3个平行,于37 ℃恒温培养箱中培养48 h。挑取不同形态的菌落进行划线培养,重复划线多次,直至用显微镜观察至纯种,记录其菌落、细胞形态。挑选纯化好的菌株进行革兰氏染色以及H2O2实验,选择革兰氏染色呈阳性,H2O2实验呈阴性的乳酸菌用体积分数50%甘油/菌液(体积比为1∶1)于-80 ℃冰箱保存备用。
1.3.2 乳酸菌菌株生物学鉴定
1.3.2.1 乳酸菌DNA的提取
使用细菌基因组 DNA 提取试剂盒,北京天根生化科技限公司。按照说明书操作步骤提取样品中乳酸菌DNA。
1.3.2.2 16S rDNA测序鉴定
采用通用引物27f(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492r:(5’CTACGGCTACCTTGTTACGA-3’),预变性95 ℃ 5 min;变性94 ℃ 30 s,退火50 ℃ 30 s,延伸72 ℃ 4 min共35个循环;最后72 ℃延伸10 min[15]。PCR产物经 1.0%琼脂糖凝胶电泳检测后,送往上海生工生物科技有限公司进行测序,测序结果提交至 GenBank 数据库中进行序列同源性比对(BLAST),并用 MAGE 7.0 软件构建系统发育树。
1.3.3 产蛋白酶乳酸菌的筛选
1.3.3.1 产蛋白酶乳酸菌的初筛
将保藏好的菌株以4.0%的接种量接入MRS液体培养基,于37 ℃恒温培养箱中培养24 h后,在MRS固体培养基上进行多次划线至单菌落,挑单菌落到MRS液体培养基中于37 ℃恒温培养箱中培养24 h。参考SUN等[14]方法并作适当修改,采用牛津杯法初筛产蛋白酶高的菌株,配制好脱脂乳MRS固体培养基进行倒板,将灭好菌的牛津杯放在培养基上,吸取已活化好的乳酸菌10 μL加入牛津杯中,37 ℃恒温培养箱中培养24 h后观察并测量透明圈的直径。
1.3.3.2 产蛋白酶乳酸菌的复筛
参照张晓燕[16]的方法初筛,得到22株产透明圈大的菌株进行蛋白酶活力的测定。
1.3.3.3 粗酶液的提取
参照FARHIDIAN等[17]的方法分离粗蛋白酶,进行少量修改。菌液添加到干净的离心管中,然后在4 ℃下以 10 000 r/min 离心10 min。所获得的上清液是粗制的细胞外蛋白酶提取物,保存在4 ℃ 下直至后续使用(12 h内使用)。
1.3.3.4 蛋白酶活力的测定[16]
按照国标GB/T23527—2009规定的福林酚显色法(Folin)测酶活力。蛋白酶活性定义:在pH 7.0和40 ℃下,每分钟水解酪蛋白产生1 μg酪氨酸,定义为1个蛋白酶活力单位。同一个样品测3次,取平均值。
酶液适当稀释,取4支试管编号,1号为空白对照,分别加入1 mL酶液,立即加入0.4 mol/L TCA溶液2 mL,使酶失活。另3支试管中加入pH 7.0、质量浓度为20 g/L的酪蛋白溶液1 mL,充分振荡后,置于40 ℃恒温水浴中保温反应10 min后,取出加入0.4 mol/L TCA溶液2 mL,终止反应。同时在1号试管中加入20 g/L酪蛋白溶液1 mL,混匀后放入水浴中继续保温20 min,取出冷冻离心除去反应沉淀,取离心后滤液1 mL移入干净的4支新试管中,再加入0.4 mol/L Na2CO3溶液5 mL和稀释度为1∶2的Folin试剂1 mL,充分摇匀,保温显色20 min后,迅速冷却测定吸光值(OD680nm)。根据标准曲线,得到酪氨酸相当量。按公式(1)计算:
酶活力![]()
(1)
式中:K,标准曲线斜率的倒数;4,4 mL反应液取出 1 mL测定(即 4倍);n,酶液稀释的倍数;10,反应10 min。
1.3.4 乳酸菌生物学特性分析
1.3.4.1 菌株最适生长温度
参照桑鹏等[18]的方法并做适当修改。按4.0%的接种量接于MRS液体培养基中,置于不同的温度(25、30、37、40、50、55、60 ℃)下摇床培养 24 h,然后在波长600 nm 处测定各个温度下菌株生长的吸光度值,以确定菌株的最适生长温度。
1.3.4.2 pH对乳酸菌生长的影响
参考张大为等[19]的方法并作适当修改。用冰乙酸将MRS液体培养基的pH值分别调节为1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5,以pH为6.0的自然培养作为对照,每个梯度3个平行。向液体培养基中接种分离纯化的乳酸菌,放于 37 ℃的培养箱培养 24 h,测定600 nm处的吸光值。
1.3.4.3 乳酸菌耐盐能力的评价
参考张大为等[19]的方法并作适当修改。向质量浓度为10、20、30、40、50、 60和70 g/L的 MRS 液体培养基中接种分离纯化的乳酸菌,各留1支做空白试验,放于37 ℃培养箱培养24 h,在波长为600 nm处测量吸光值。
1.3.5 蛋白酶酶学性质的研究
1.3.5.1 温度对酶活力的影响[14]
以10 000 r/min,4 ℃,10 min提取粗酶液,分别在0~60 ℃条件下测定酶活力。
1.3.5.2 pH对酶活力的影响[14]
以10 000 r/min,4 ℃,10 min提取粗酶液,用不同缓冲液调整粗酶液的pH为0~11,在最适温度下测定酶活力。
1.3.5.3 金属离子和抑制剂对蛋白酶活性的影响
参照SUN等[14]的方法并作适当修改。金属离子和抑制剂对蛋白酶活性的影响的实验进行3次平行,3次重复。将浓度为1和10 mmol/L不同的金属离子(Na+、K+、Mg2+、Ca2+、Mn2+、Zn2+、Cu2+、Fe2+和Fe3+)和抑制剂EDTA溶解在 pH值为6.8的0.02 mol/L磷酸盐缓冲液中的20 g/L酪蛋白溶液中,以测定其对蛋白酶活性的影响。随后,将粗酶液与每种离子的氯化物盐溶液(1 mL)或蛋白酶抑制剂在37 ℃孵育30 min,然后对蛋白酶的活力进行测定。以没有添加任何金属离子或抑制剂的蛋白酶活性定义为 100%,作为对照。
使用Origin 2017作图,利用SPSS 25.0进行差异性分析;实验数据均进行3次平行3次重复,以平均值±标准偏差表示,利用 MEGA 7.0软件构建系统发育树。数据分析过程中,当P<0.05,具有显著性差异。
从样品中共分离得到161株纯培养物,经过革兰氏染色和过氧化氢酶生理生化实验,初步鉴定149株乳酸菌。通过16S rDNA基因检测分析,确定149株乳酸菌。其中优势菌种为粪肠球菌39株约占26%,乳酸乳球菌28株约占19%,格氏乳球菌22株约占15%,植物乳杆菌18株约占12%,其余分别为戊糖片球菌10株、耐久肠球菌9株、肠系膜明串珠菌8株、路德维希肠杆菌6株、发酵乳杆菌5株、副干酪乳杆菌3株、罗伊氏乳杆菌1株。
根据制作酪氨酸标准曲线的方法,得出酪氨酸标准曲线线性回归方程为y=0.005 2x-0.004 1,线性相关系数R2=0.999 2,表明线性关系良好。
在所筛选的乳杆菌中初筛出22株在脱脂乳MRS琼脂培养基中有明显透明圈的菌株,如图1所示。用福林酚法对初筛的22株菌株产蛋白酶活性进行定量,实验结果显示出5株产蛋白酶较高的菌株分别是乳酸乳球菌A-6、A-18,格氏乳球菌B-2,耐久肠球菌G-11,戊糖片球菌C-1。菌株产蛋白酶活力见表1。

a-空白;b-脱脂乳琼脂培养基;c-脱脂乳MRS培养基
图1 乳酸菌水解脱脂乳产生透明圈的情况
Fig.1 The transparent circles produced by the hydrolysis
of skim milk by lactic acid bacteria
表1 菌株产蛋白酶的酶活力
Table 1 Activity of protease produced by the strain
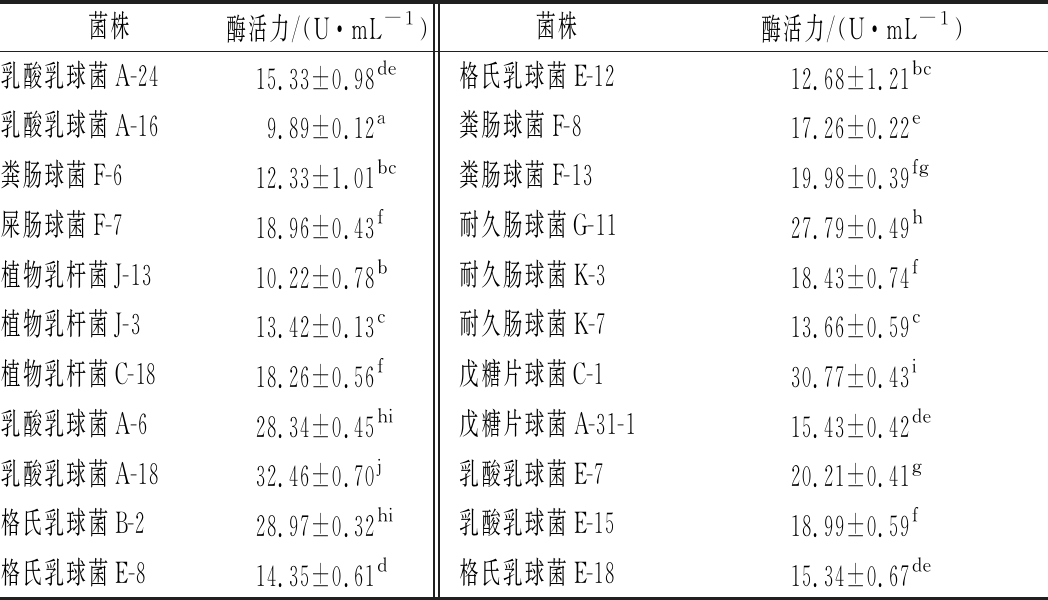
菌株酶活力/(U·mL-1)菌株酶活力/(U·mL-1)乳酸乳球菌A-2415.33±0.98de格氏乳球菌E-1212.68±1.21bc乳酸乳球菌A-169.89±0.12a粪肠球菌F-817.26±0.22e粪肠球菌F-612.33±1.01bc粪肠球菌F-1319.98±0.39fg屎肠球菌F-718.96±0.43f耐久肠球菌G-1127.79±0.49h植物乳杆菌J-1310.22±0.78b耐久肠球菌K-318.43±0.74f植物乳杆菌J-313.42±0.13c耐久肠球菌K-713.66±0.59c植物乳杆菌C-1818.26±0.56f戊糖片球菌C-130.77±0.43i乳酸乳球菌A-628.34±0.45hi戊糖片球菌A-31-115.43±0.42de乳酸乳球菌A-1832.46±0.70j乳酸乳球菌E-720.21±0.41g格氏乳球菌B-228.97±0.32hi乳酸乳球菌E-1518.99±0.59f格氏乳球菌E-814.35±0.61d格氏乳球菌E-1815.34±0.67de
注: 同一栏中不同字母表示有显著性差异(P<0.05)
2.3.1 菌株的最适生长温度
图2为温度对菌株的影响。从图2可知,5株菌在25~40 ℃,随着温度的上升生长量也迅速上升(P<0.05),乳酸菌在40 ℃,MRS液体培养基中,600 nm下的吸光值达到最大,说明5株菌的最适生长温度都为40 ℃左右。在40 ℃以后,菌株的生长量随着温度的升高逐渐下降,到45 ℃之后5株菌几乎都停止生长(P>0.05)。在整个考察范围内菌株A-18具有较好的生长活性。

图2 温度对菌株生长的影响
Fig.2 Effect of temperature on strain growth
2.3.2 pH对菌株生长的影响
乳酸菌的大量繁殖使得肉中pH降低[20],因此确定菌株的耐酸性十分重要。将5株菌株接种于不同pH的培养基中,培养24 h。从图3可以看出,5株菌中G-11的耐酸能力较弱,其余4株菌A-6、A-18、B-2、C-1都具有较好的耐酸能力,在pH值为3.0~3.5的范围内仍能生长,在pH值为1.5~2.5时菌株基本不生长。罗强等[21]在乳酸菌耐酸能力实验中对乳酸菌在pH 2.0条件下生长情况进行研究,发现pH 2.0时菌株存活率在70%,这可能是不同乳酸菌对酸的耐受性是不一致的。翟磊等[24]在乳酸菌耐酸能力实验中得出在pH低于2.0时菌株基本不生长,在pH值为3.0~3.5的范围内仍能生长。这与本实验研究结果相似。通过分析比较得到5株菌在整个pH值考察范围内,菌株A-18和菌株C-1的耐酸能力较强(P<0.05)。
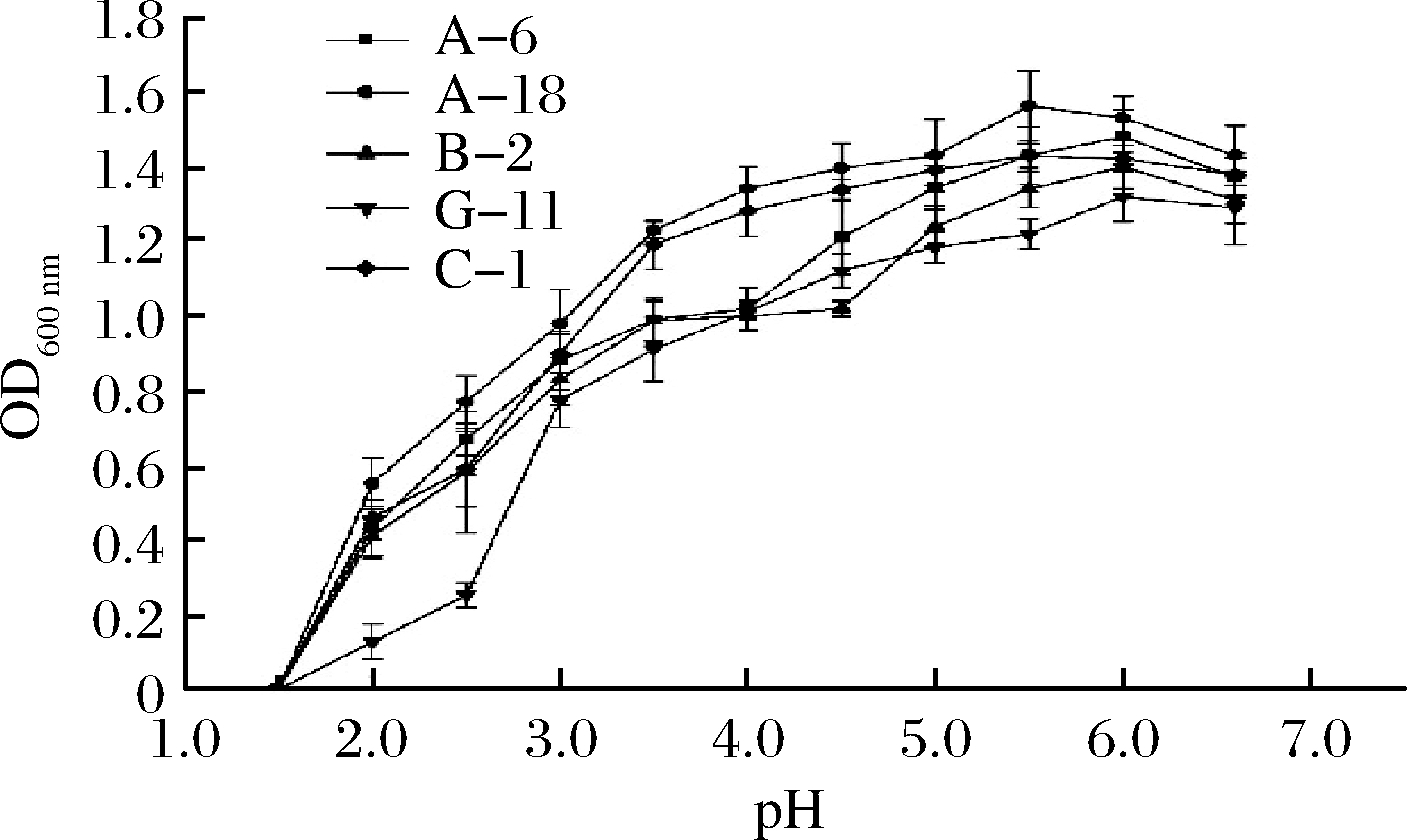
图3 不同pH值对菌株生长的影响
Fig.3 Influence of different pH values on strain growth
2.3.3 菌株耐盐能力
盐胁迫引起的渗透压变化会引起乳酸菌细胞结构损伤,导致细胞生理代谢活动紊乱甚至死亡,因此,乳酸菌在盐胁迫条件下生存、生长和代谢的能力在食品发酵过程中是非常重要的[23]。将5株菌分别接种于不同盐浓度的MRS液体培养基中,37 ℃培养24 h考察各菌株对不同盐浓度的耐受性,如图4所示。
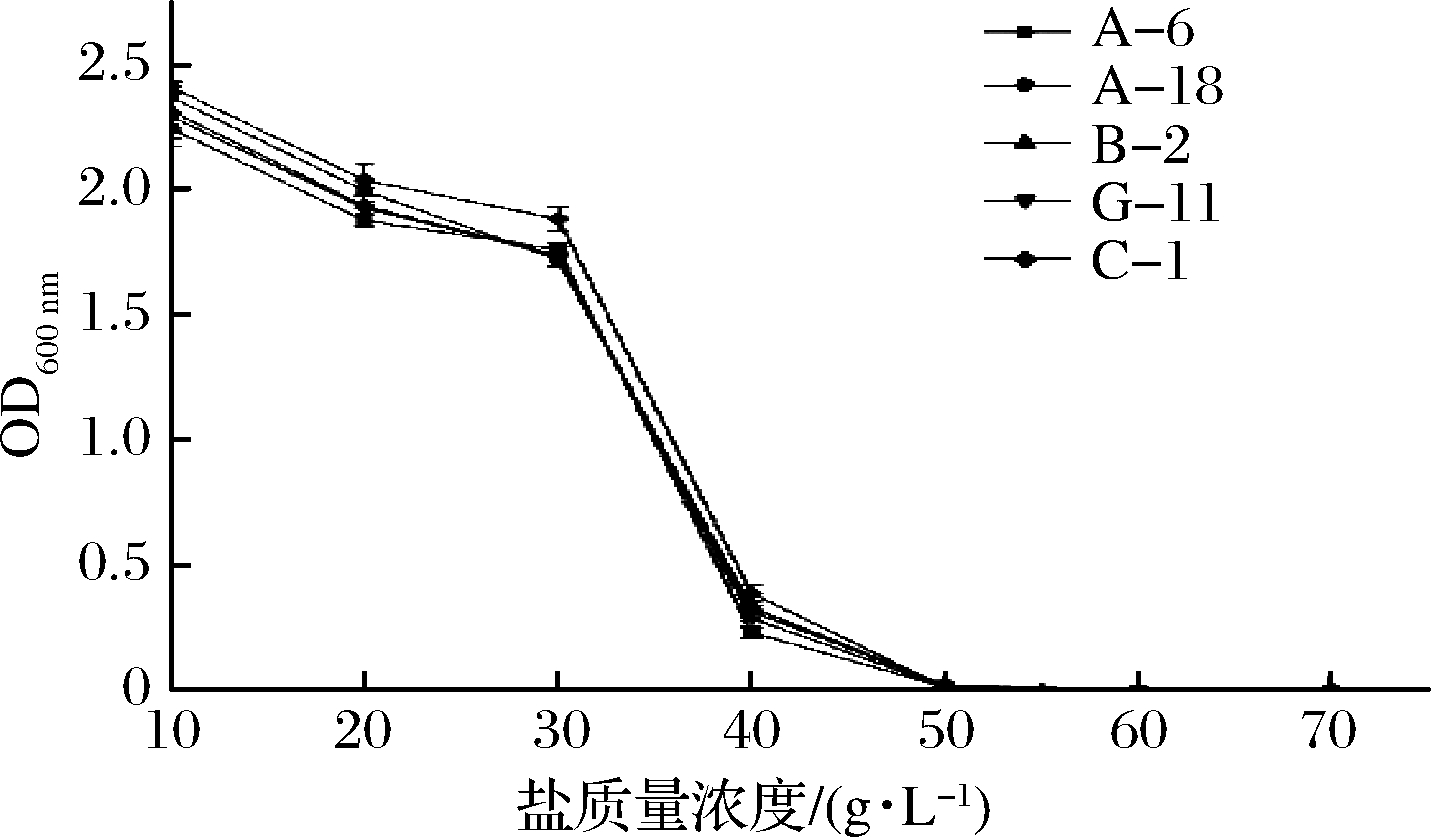
图4 不同盐浓度对菌株生长的影响
Fig.4 Effects of different salt concentrations on strain growth
5株菌随着盐质量浓度和发酵液渗透压的增加,生长逐步受到抑制,在盐质量浓度为10~30 g/L的范围内时,5株菌均生长良好,在30~40 g/L的范围内时,菌株生长受到了抑制。盐质量浓度在40 g/L以上时菌株停止生长(P<0.05)。张大为等[19]在乳酸菌耐盐能力实验中得出盐质量浓度在10~3 g/L之间,菌株均生长良好,盐质量浓度达到30~4 g/L时,菌体能够生长,但生长受到抑制。在整个盐浓度考察范围内,5株菌中,菌株C-1和菌株B-2的耐盐能力较优(P<0.05)。
2.4.1 温度对酶活力的影响
从图5所示,在4~10 ℃低温条件下,5株菌的蛋白酶活性均受到抑制,但是在低温范围内,蛋白酶仍具备一定的活性,但活性较低。在10~40 ℃的温度范围内,随着温度的升高,5株菌的酶活力都呈明显上升趋势(P<0.05),40 ℃时酶的活力达到最高,如图5所示。在40~60 ℃范围内,随着温度的升高,蛋白酶的活力逐渐下降。说明40 ℃为蛋白酶的反应活力最强。
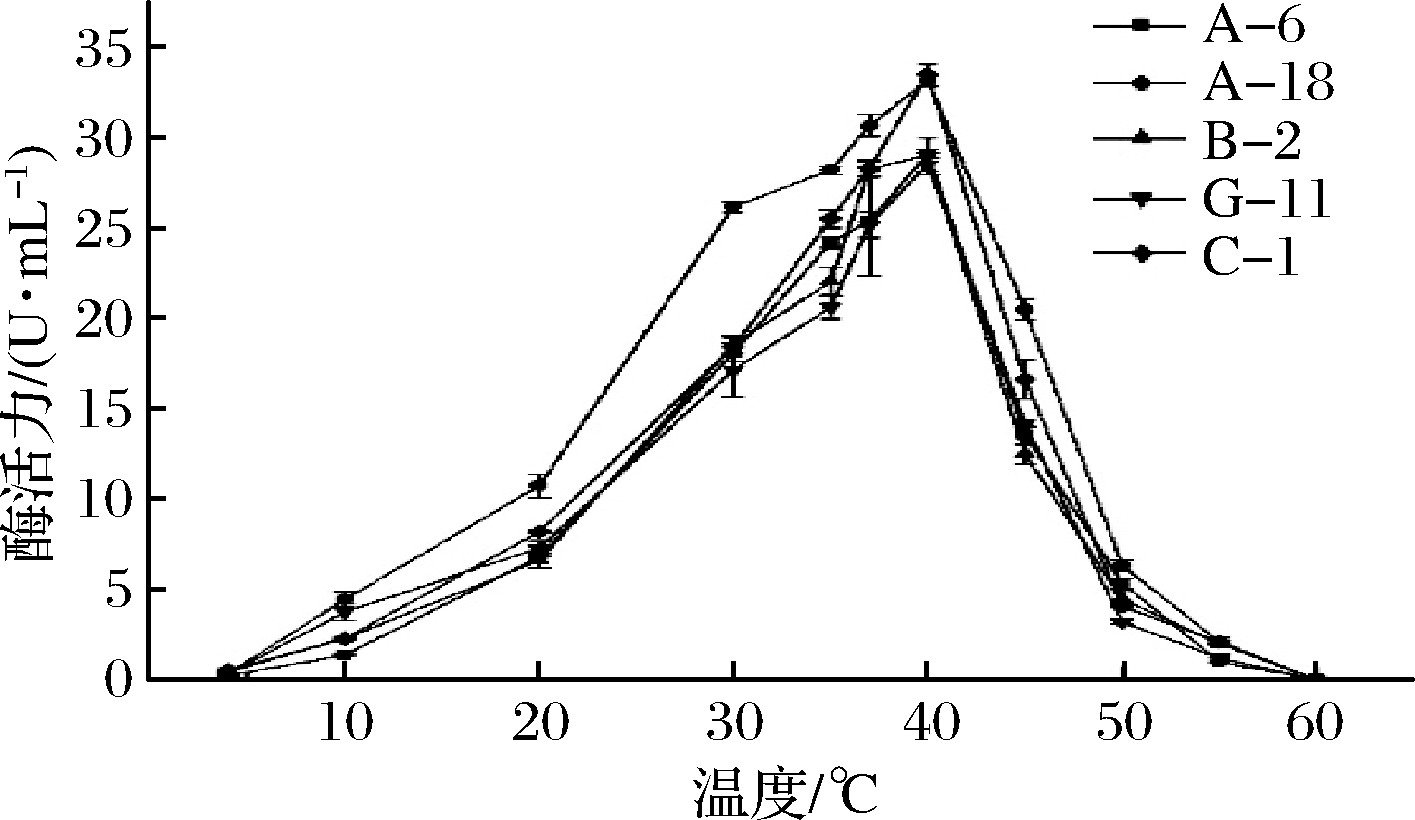
图5 温度对蛋白酶活性的影响
Fig.5 Effect of temperature on the activity of protease
2.4.2 蛋白酶的最适反应pH
培养基的初始pH会影响各种生长因子在细胞膜上的转运过程,这可能会对微生物蛋白酶的生产过程产生不利影响。如果微生物处于直接或间接影响微生物蛋白酶活性的最佳pH,则代谢效率将很高[24],如图6所示。
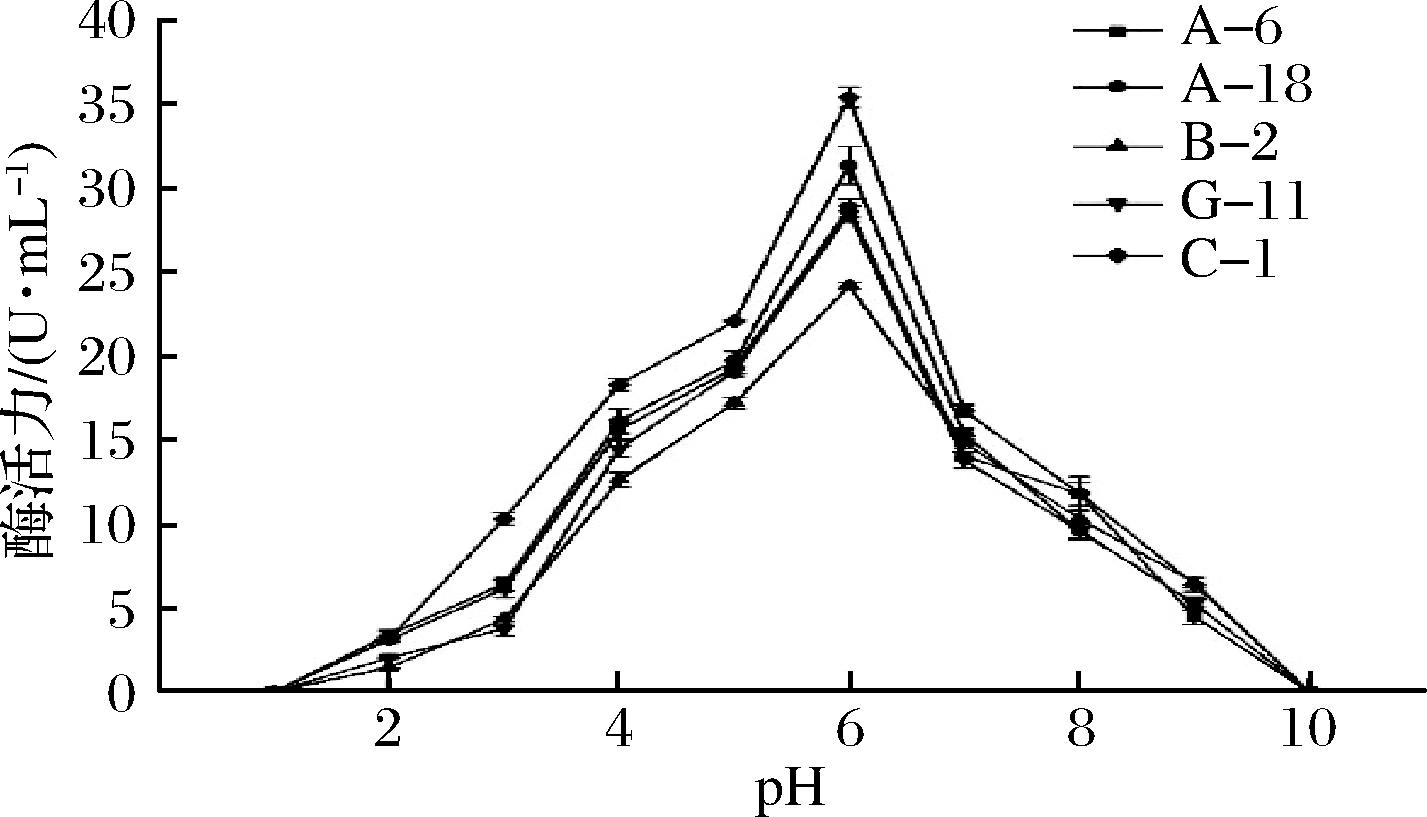
图6 pH对蛋白酶活性的影响
Fig.6 Effect of pH on protease activity of strain
在pH值为1~6的范围内,5株菌株的蛋白酶活力随着pH的上升均呈上升趋势(P<0.05),在pH值为6时蛋白酶活性最强。在pH值为6以上时,蛋白酶活力逐渐下降。说明这5株菌株蛋白酶最适反应pH值均为6,5株菌产生的蛋白酶为酸性蛋白酶。
pH是影响蛋白酶活性的重要指标之一[25]。蛋白酶活性在pH 范围内的稳定性对于发酵肉制品的质量至关重要,并且嫩度和风味前体也可以得到改善[26]。
2.4.3 金属离子和抑制剂对蛋白酶活性的影响
肉品加工过程中会使用含Na+、K+、Mg2+的盐,会影响乳酸菌的蛋白酶活性。金属离子可能是蛋白酶活性位点的一部分,并直接参与催化过程[28]。在离子浓度为1 mmol/L的条件下研究了各种金属离子对5株菌株蛋白酶相对活性的影响,如表2所示。在10 mmol/L的条件下研究了各种金属离子对5株菌株蛋白酶相对活性的影响,如表3所示。以没有添加金属离子的蛋白酶用作对照(100%)。
表2 1 mmol/L金属离子和抑制剂对5株菌株蛋白酶活性的影响
Table 2 Effect of 1 mmol/L metal ions and inhibitors on protease activity of five strains

组分A-16A-18B-2G-11C-1空白100a100ab100a100a100abNa+103.27±0.91a102.17±0.12a101.21±1.22a103.22±0.96a102.43±0.77aK+101.73±0.47a101.47±0.38a101.01±0.78a101.32±0.35a101.09±0.63aMg2+94.07±1.79cd98.27±0.45bc98.32±0.43bc97.83±1.21bc98.44±1.23bcCa2+96.83±1.11bc93.40±1.15cd92.12±0.97cd95.63±1.02d94.32±0.66cdMn2+82.23±0.31f82.30±1.10f81.30±0.32f83.43±0.62fg88.43±0.32deZn2+98.17±0.83bc98.43±0.31b97.43±0.67bc98.21±0.49bc98.93±0.33bcCu2+49.97±1.05i51.83±0.64i52.34±0.88i50.02±0.67i52.87±0.56hFe2+94.27±0.46cd92.53±0.59de95.46±1.03cd95.64±0.38cd93.43±1.02cdFe3+77.00±0.33g76.23±0.55g77.33±0.98g75.45±0.97h76.32±0.43gEDTA91.23±0.99de90.21±1.21de92.31±0.98de91.44±0.37de90.39±0.97de
注: 同一栏中不同字母表示有显著性差异(P<0.05)(下同)
表3 10 mmol/L金属离子和抑制剂对5株菌株蛋白酶活性的影响
Table 3 Effect of 10 mmol/L metal ions and inhibitors on protease activity of five strains
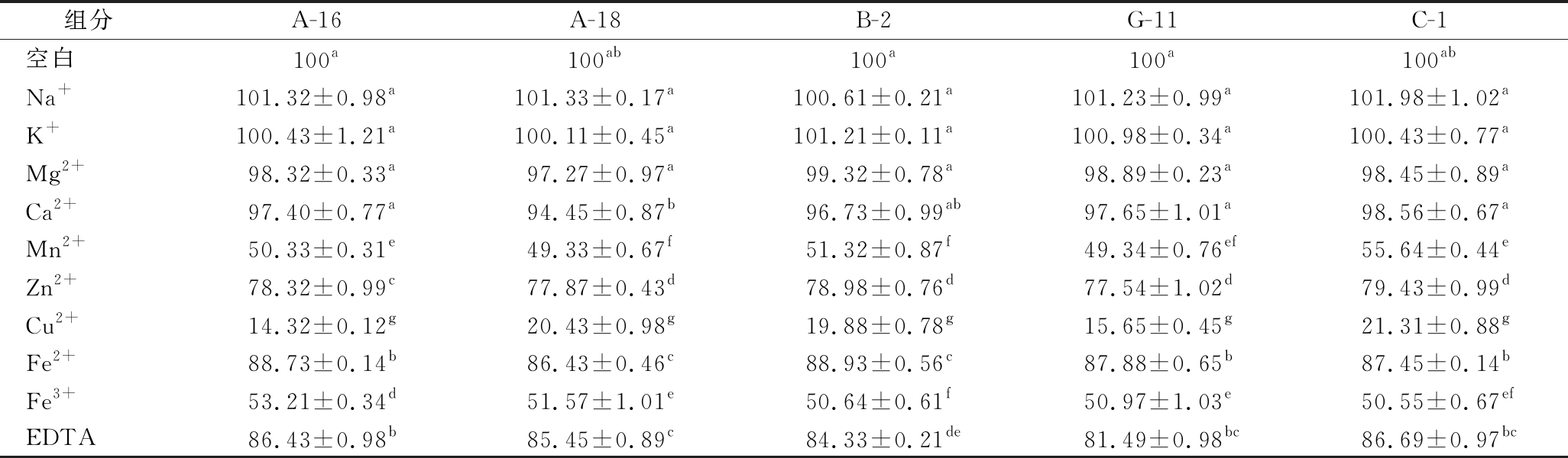
组分A-16A-18B-2G-11C-1空白100a100ab100a100a100abNa+101.32±0.98a101.33±0.17a100.61±0.21a101.23±0.99a101.98±1.02aK+100.43±1.21a100.11±0.45a101.21±0.11a100.98±0.34a100.43±0.77aMg2+98.32±0.33a97.27±0.97a99.32±0.78a98.89±0.23a98.45±0.89aCa2+97.40±0.77a94.45±0.87b96.73±0.99ab97.65±1.01a98.56±0.67aMn2+50.33±0.31e49.33±0.67f51.32±0.87f49.34±0.76ef55.64±0.44eZn2+78.32±0.99c77.87±0.43d78.98±0.76d77.54±1.02d79.43±0.99dCu2+14.32±0.12g20.43±0.98g19.88±0.78g15.65±0.45g21.31±0.88gFe2+88.73±0.14b86.43±0.46c88.93±0.56c87.88±0.65b87.45±0.14bFe3+53.21±0.34d51.57±1.01e50.64±0.61f50.97±1.03e50.55±0.67efEDTA86.43±0.98b85.45±0.89c84.33±0.21de81.49±0.98bc86.69±0.97bc
Na+和 K+在1和10 mmol/L 浓度下诱导5株菌株蛋白酶活性略有增加(P>0.05)。Mn2+、Cu2+和Fe3+对蛋白酶的活性有抑制作用。与对照相比,5株菌株在Cu 2+为1和10 mmol/L的条件下蛋白酶的相对活性抑制明显(P<0.05)。这可能是由于这些离子与5株菌的蛋白酶侧链基团之间的牢固结合,从而降低了蛋白酶与其底物之间的结合[29]。SUN等[14]研究表明Cu2+确实会显著降低蛋白酶的活性。EDTA在浓度为1和10 mmol/L时,对蛋白酶活性降低显著(P<0.05),这与YU等[30]报道类似。
本研究从新疆哈萨克族风干肉中分离出149株乳酸菌,通过表型鉴定及脱脂乳MRS琼脂培养基初筛出22株在脱脂乳MRS琼脂培养基中有明显透明圈的菌株,用福林酚法对初筛的22株菌株产蛋白酶活性进行定量,实验结果显示出5株产蛋白酶活力较高的菌株,5株菌株为:乳酸乳球菌A-6、A-18、格氏乳球菌B-2、耐久肠球菌G-11、戊糖片球菌C-1。
菌株生物学特性分析研究结果显示,所有菌株的最适生长温度为40 ℃,5株菌中菌株A-18具有较高的生长活性。菌株耐酸特性分析表示5株菌中株菌中G-11的耐酸能力较弱,其余4株菌A-6、A-18、B-2、C-1都具有较好的耐酸能力在pH值为3~3.5的条件下均能生长,整个pH考察范围内菌株A-18和菌株C-1的耐酸能力较强。菌株耐盐特性分析表示在盐浓度为10~30 g/L的范围内时,5株菌均生长良好,具有一定的耐盐能力,在整个盐浓度考察范围内,5株菌中,菌株C-1和菌株B-2的耐盐能力较优。
对蛋白酶酶学特性分析表示菌株产生的蛋白酶在40 ℃的反应活力最强并且5株菌所产的蛋白酶均为酸性蛋白酶。Na+和K+在1和10 mmol/L浓度下诱导蛋白酶活性略有增加(P>0.05)。Mn2+、Zn2+、Cu2+和Fe3+对蛋白酶的活性有抑制作用。相比较之下Cu 2+的存在对蛋白酶抑制作用明显(P>0.05)。
根据研究结果乳酸乳球菌A-18、戊糖片球菌C-11产蛋白酶含量较高,具有较好的耐酸耐盐特性,可作为潜在益生菌用于后续发酵肉制品品质控制的研究。
[1] 李宇辉,郭安民,刘成江,等.新疆风干肉中优势乳酸菌的分离及产酶特性分析[J].食品与发酵工业,2018,44(1):80-85.
[2] 沙坤.新疆风干牛肉质量特征及风味形成机制的研究[D].北京:中国农业科学院,2015.
[3] LOPEZ C M, BRU E, VIGNOLO G M, et al. Identification of small peptides arising from hydrolysis of meat proteins in dry fermented sausages[J]. Meat Science, 2015,104:20-29.
[4] TODOROV, STOJANOVSKI S, ILIEV I, et al. Technology and safety assessment for lactic acid bacteria isolated from traditional Bulgarian fermented meat product “lukanka”[J]. Brazilian Journal of Microbiology, 2017,48(3):567-586.
[5] GASSON M J. Progress and potential in the biotechnology of lactic acid bacteria[J]. FEMS Microbiology Reviews, 1993,12(1-3):3-19.
[6] LEGAKO J F, DINH T T, MILLER M F, et al. Effects of USDA beef quality grade and cooking on fatty acid composition of neutral and polar lipid fractions[J]. Meat Science, 2015, 100(100):246-255.
[7] CHAVES,SERIO,MAZZARRINO, et al. Control of household mycoflora in fermented sausages using phenolic fractions from olive mill wastewaters[J]. International Journal of Food Microbiology, 2015, 207:49-56.
[8] GALLEGOS J, ARCE C, JORDANO R, et al. Target identification of volatile metabolites to allow the differentiation of lactic acid bacteria by gas chromatography-ion mobility spectrometry[J]. Food Chemistry, 2016, 220:362-370.
[9] DEMASI T W,WARDLAW, et al. Nonprotein Nitrogen (NPN) and Free amino acid contents of dry, fermented and nonfermented sausages[J]. Meat Science,1990, 27(1):1-12.
[10] AMMOR,DUFOUR, ZAGOREC, et al. Characterization and selection of Lactobacillus sakei strains isolated from traditional dry sausage for their potential use as starter cultures[J]. Food Microbiology, 2005,22(6):529-538.
[11] 周才琼,代小容,杜木英.酸肉发酵过程中挥发性风味物质形成的研究[J]. 食品科学, 2010,31(7):98-104.
[12] ESSID I, MEDINI M, HASSOUNA M, et al. Technological and safety properties of Lactobacillus plantarum strains isolated from a Tunisian traditional salted meat[J]. Meat Science, 2009,81(1):203-208.
[13] 林伟涛,徐世明,刘蓉宏,等.中式发酵香肠菌种的分离筛选和初步鉴定[J].烟台大学学报(自然科学与工程版),2008(2):99-104.
[14] SUN F D,HU Y Y,KONG X Y, et al. Production, purification and biochemical characterization of the microbial protease produced by Lactobacillus fermentum R6 isolated from Harbin dry sausages[J]. Process Biochemistry,2019,10:20-29.
[15] 马燕,倪永清,卢士玲,等.新疆特色干酪中乳酸菌的分离鉴定[J]. 中国酿造, 2011, 30(8):38-40.
[16] 张晓燕.产低温蛋白酶菌株的筛选及酶学特性研究[D].新疆:新疆农业大学, 2014.
[17] FARHADIAN S, ASOODEH A,LAGZIAN M. Purification, biochemical characterization and structural modeling of a potential htrA-like serine protease from Bacillus subtilis DR8806[J]. Journal of Molecular Catalysis B: Enzymatic, 2015, 115:51-58.
[18] 桑鹏,王肇衿,陈贵元,等.耐热蛋白酶产生菌的筛选鉴定及其酶学性质研究[J].中国饲料,2019(23):41-45.
[19] 张大为,张洁,田永航.白贝自然发酵调味液中乳酸菌的分离鉴定及生物学特性的研究[J].现代食品科技,2019,35(11):76-82;292.
[20] 王俊钢,李宇辉,郭安民,等.新疆风干牛肉成熟过程中理化及微生物特性分析[J].食品与发酵工业,2016,42(10):129-133.
[21] 罗强,李幸洋,陈炼红,等.传统发酵泡菜中乳酸菌种群组成及优良菌株产酸耐酸特性分析[J/OL].食品科学:1-12[2020-01-10].
[22] 翟磊,凌空,宋振,等.哈萨克传统发酵食品中乳酸菌的分离鉴定及代谢特性研究[J].食品与发酵工业,2017,43(7):122-127.
[23] 林松洋,郝利民,刘鑫,等.乳酸菌耐盐分子机制研究进展[J].食品科学,2018,39(3):295-301.
[24] SINGH S K, TRIPATHI V R, JAIN R K, et al. An antibiotic, heavy metal resistant and halo tolerant Bacillus cereus SIU1 and its thermoalkaline protease[J]. Microbial Cell Factories, 2010, 9(1):59-63.
[25] SALIHI A, ASOODEH A, ALIABADIAN M, et al. Production and biochemical characterization of an alkaline protease from Aspergillus oryzae CH93[J]. International Journal of Biological Macromolecules,2017, 94:827-835.
[26] SUN Q, CHEN F, GENG F, et al. A novel aspartic protease from Rhizomucor miehei expressed in Pichia pastoris and its application on meat tenderization and preparation of turtle peptides[J]. Food Chemistry, 2017, 245:570-577.
[27] CASTILLO-YA EZA F J, PACHECO-AGUILAR R, GARCIA-CARRE
EZA F J, PACHECO-AGUILAR R, GARCIA-CARRE O F L, et al. Characterization of acidic proteolytic enzymes from Monterey sardine (Sardinopssagaxcaerulea) viscera[J].Food Chemistry,2004,85(3):343-350.
O F L, et al. Characterization of acidic proteolytic enzymes from Monterey sardine (Sardinopssagaxcaerulea) viscera[J].Food Chemistry,2004,85(3):343-350.
[28] VALLEE B L, ULMER D D. Biochemical effects of mercury, cadmium, and lead[J]. Annual Review of Biochemistry, 1972, 41(1):91-128.
[29] KRYSTALENIA V, AGGELIKI S, LEONIDAS G T. Purification and kinetics of two novel thermophilic extracellular proteases from Lactobacillus helveticus, from kefir with possible biotechnological interest[J]. Bioresource Technology, 2008, 99(13):5 804-5 813.
[30] YU, PIN, HUANG, et al. Purification and characterization of a H2O2-tolerant alkaline protease from Bacillus sp. ZJ1502, a newly isolated strain from fermented bean curd[J]. Food Chemistry, 2019,274: 510-517.