表1 梯度洗脱程序
Table 1 The gradient elution program for separation of
biogenic amines
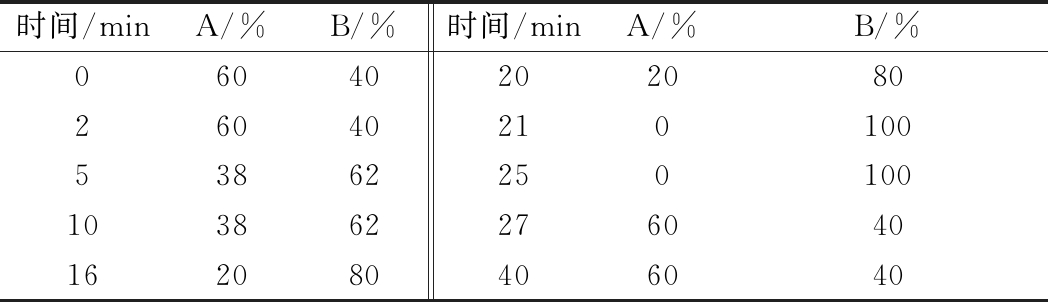
时间/minA/%B/%时间/minA/%B/%060402020802604021010053862250100103862276040162080406040
生物胺是一类含氮有机化合物,广泛存在于酱油、豆酱、香肠、鱼露、奶酪、黄酒等发酵食品中,在食品中主要有以下8种:腐胺、尸胺、亚精胺、精胺、色胺、苯乙胺、组胺和酪胺。生物胺通常是微生物利用前体氨基酸进行脱羧作用合成的[1-2],例如,尸胺、色胺、苯乙胺、组胺和酪胺分别由相应的前体氨基酸赖氨酸、色氨酸、苯丙氨酸、组氨酸和酪氨酸产生,腐胺是由鸟氨酸脱羧酶和胍丁胺脱氨酶产生[3],亚精胺和精胺是由腐胺经过胺合成酶产生,且两者可以相互转化[4]。人体,特别是那些由于药物治疗而导致胺氧化酶减少的人群,过量摄入生物胺会导致许多健康问题,如引发头痛、低血压、恶心、潮热、局部炎症、心悸、高血压和消化等问题[5-7]。
豆瓣酱,是以蚕豆、面粉、辣椒及盐水为主要原料发酵而成的传统豆类调味食品,为多菌种开放式酿造,有多种微生物参与[8-9],发酵过程中往往导致多种物质生成,其中包含一些有毒物质,如生物胺[10]。为了保障食品安全,需要控制生物胺的含量。目前主要的控制手段有辐照、气调包装、高静水压处理、添加食品添加剂和防腐剂等手段,但可能对人体有潜在危害[11-12]。近年来,安全环保的生物学方法越来越被消费者所接受,如在食品发酵过程中添加降解生物胺的菌株控制生物胺的含量[13-14]。
由于豆瓣酱发酵过程具有较高的盐含量,因此常见的微生物菌株无法生长。本课题组通过筛选得到既能适应豆酱生产环境又能高效降解生物胺的菌株,并研究其在不同环境因素下的降解特性。
豆瓣酱样品来自于安徽某酿造食品有限公司。
生物胺标准品:腐胺二盐酸盐、尸胺二盐酸盐、亚精胺、精胺、酪胺盐酸盐,美国Sigma公司;色胺、β-苯乙胺,瑞士Adamas Reagent公司;组胺二盐酸盐,加拿大Bio Basic公司。
前体氨基酸:鸟氨酸、赖氨酸、精氨酸、酪氨酸、色氨酸、苯丙氨酸、组氨酸,上海阿拉丁试剂有限公司。
试剂:色谱级乙腈,上海国药集团化学试剂有限公司;苯甲酰氯,上海阿拉丁试剂有限公司;细菌DNA提取试剂盒GK1072,上海捷瑞生物工程有限公司。
磷酸盐缓冲液(phosphate buffer solution,PBS):Na2HPO4·12H2O 5.02 g,NaH2PO4·2H2O 1.1 g,去离子水1 L,pH 7.02。
以生物胺为唯一氮源培养基 (biogenic amines as the sole nitrogen source, BAs):KH2PO4 2 g、柠檬酸铵2 g、NaCl 50 g、MgSO4·7H2O 0.4 g、MnSO4 0.03 g、FeSO4 0.04 g、硫胺素0.01 g、葡萄糖2 g、腐胺二盐酸盐100 mg、尸胺二盐酸盐100 mg、亚精胺100 mg、精胺100 mg、色胺100 mg、苯乙胺100 mg、组胺二盐酸盐100 mg,酪胺盐酸盐100 mg,去离子水1 L。
改良MRS培养基 (modified MRS, MMRS)[15]:大豆蛋白胨10 g,葡萄糖20 g,NaCl 50 g,乙酸钠5 g,柠檬酸氢二铵2 g,K2HPO4 2 g,MgSO4 0.58 g,MnSO4 0.25 g,吐温-80 1.0 mL,腐胺二盐酸盐100 mg,尸胺二盐酸盐100 mg,亚精胺100 mg,精胺100 mg,色胺 100 mg,苯乙胺100 mg,组胺二盐酸盐100 mg,酪胺盐酸盐100 mg,去离子水1 L。此培养基的改良之处是去除2种氮源牛肉膏和酵母粉,添加了生物胺为氮源,且添加NaCl与大豆蛋白胨适应豆酱的高盐及富含大豆蛋白的环境。
添加氨基酸的LB培养基 (LB+amino acids, LBA):蛋白胨10 g,酵母粉5 g,NaCl 50 g,鸟氨酸1 g,赖氨酸1 g,精氨酸1 g,色氨酸1 g,苯丙氨酸1 g,酪氨酸1 g,组氨酸1 g,去离子水1 L。
添加氨基酸的MRS培养基 (MRS+amino acids, MRSA):大豆蛋白胨10 g,牛肉膏10 g,葡萄糖20 g,NaCl 50 g,酵母粉5 g,乙酸钠5 g,柠檬酸氢二铵2 g,K2HPO4 2 g,吐温-80 1.0 mL,MgSO4 0.58 g,MnSO4 0.25 g,鸟氨酸1 g,赖氨酸1 g,精氨酸1 g,色氨酸1 g,苯丙氨酸1 g,酪氨酸1 g,组氨酸1 g,去离子水1 L。
SHZ-B型水浴恒温振荡器,上海博讯公司;Waters 2695高效液相色谱仪,美国Waters公司;氮吹仪,上海左乐仪器有限公司;Centrifuge 5804R型离心机,德国Eppendorf公司;Milli-Q Reference超纯水系统,美国Millipore公司;C18柱,Angilent, 4.6 mm×250 mm×5 μm。
1.3.1 生物胺降解菌株初筛
取5 g酱醅于100 mL锥形瓶中,加入50 mL生理盐水,于摇床上充分振荡混匀,取悬浮液梯度稀释至10-5,每个梯度取100 μL悬浮液于BAs固体培养基和MMRS固体培养基进行涂布,并于37℃培养箱培养,待菌落生长良好,方可分离。
1.3.2 生物胺降解菌株复筛
一级复筛:将从BAs固体培养基和MMRS固体培养基分离的单菌落分别于LB和MMRS液体培养基中进行活化,调节初始OD值,使其在含有100 mg/L生物胺的磷酸盐缓冲液(pH 7.02)中为0.8[16],并于37 ℃恒温培养箱中静置24 h。24 h后测定加入菌株的缓冲液中的生物胺含量,并与未添加菌株的缓冲液(空白组)相比测定生物胺的降解率。
此外,从BAs固体培养基和MMRS固体培养基分离的单菌落分别于LBA培养基和MRSA液体培养基中进行活化,并调节初始OD值使其分别在LBA和MRSA培养基中为0.1,并在37 ℃下放置24 h,测定生物胺产生量。优先选择对组胺酪胺降解率较高,生物胺产生量较少的菌株进行二级复筛。
二级复筛:使用LB和MMRS液体培养基对一级复筛菌株进行活化,并调节初始OD值,使其在含100 mg/L生物胺的MMRS培养基中为0.1[16],并于37 ℃培养箱中静置培养24 h。24 h后测定加入菌株的发酵液中的生物胺含量,并与未添加菌株的发酵液(空白组)相比,测定生物胺的降解率,选择降解生物胺种类多且降解率最高的菌株作为生物胺降解菌株。
1.3.3 生物胺降解率测定
含有菌株的缓冲液或发酵液经4 000×g 离心5 min得到上清液(发酵液的上清液需经等体积的60 g/L的三氯乙酸溶液处理),并通过0.22 μm滤膜过滤。取2 mL上清液于10 mL离心管中,相继加入1 mL 2 mol/L NaOH溶液和20 μL苯甲酰氯溶液,立即将离心管放入水浴恒温振荡器,30 ℃,200 r/min振荡20 min进行衍生反应。振荡结束后加入2 mL饱和NaCl溶液停止衍生化反应,再加入3 mL无水乙醚进行生物胺的萃取,使用涡旋振荡仪萃取1 min,小心吸取上清液置于5 mL离心管中,并通过氮吹仪吹干。加入1 mL乙腈溶解管中残留物,0.22 μm有机滤膜过滤后上机检测,然后利用高效液相色谱法测定生物胺含量,液相条件参照HWANG等人的研究[17-19]。条件如表1所示。
表1 梯度洗脱程序
Table 1 The gradient elution program for separation of
biogenic amines

时间/minA/%B/%时间/minA/%B/%060402020802604021010053862250100103862276040162080406040
注:A相是乙酸铵溶液(0.01 mol/L),B相是乙腈
样品组(含有菌株的缓冲液或发酵液)与空白组(不含菌株的缓冲液或发酵液)对比,测定生物胺的降解率。降解率按公式(1)计算:
(1)
式中:X,生物胺降解率,%; ρ1,不含菌株的样品生物胺质量浓度,mg/L; ρ2,接种菌株的样品生物胺质量浓度,mg/L。
1.3.4 生物胺降解菌株分子鉴定
使用DNA提取试剂盒(GK 1072,上海捷瑞生物工程有限公司)对生物胺降解菌株进行DNA的提取,并通过引物8F-GAGAGTTTGATCCTGGCTCAG和1492R-CTACGGCTACCTTGTTACGA对菌株的16S rDNA 序列进行PCR扩增,扩增体系为25 μL:12.5 μL ETaq DNA聚合酶,9.5 μL无菌水,上下游引物各1.0 μL,1.0 μL模板DNA。扩增程序如下:94 ℃预变性5 min, 进入以下循环:94 ℃变性60 s, 56 ℃退火60 s,72 ℃延伸90 s,34个循环,72 ℃延伸10 min。PCR产物经过提纯试剂盒纯化,进行测序,将得到的序列在NCBI上进行BLAST比对,确定菌株的种属。
1.3.5 生物胺降解菌株降解特性研究
探究乳酸片球菌在不同影响因素(温度、盐浓度、pH)下的降解特性以及生长情况[20]。将乳酸片球菌在MMRS培养基中37 ℃活化24 h,4 000×g离心5 min,将菌体悬浮于磷酸盐缓冲液中,菌液浓度约为8 lg CFU/mL,作为起始接种物。将其接种在不同条件下的MMRS培养基中,菌液浓度约为6 lg CFU/mL,并在37 ℃下放置24 h后测定生物胺降解率以及活菌数。活菌数可通过平板计数法,即将菌液稀释涂布于MMRS固体培养基,待生长48 h后即可计数。其中温度梯度设为20、25、30、35、40、45 ℃;盐的质量浓度梯度设为0、30、60、90、120、150、180 g/L;pH梯度设为4、5、6、7、8、9、10。
从BAs固体培养基中筛选得到25株菌株,由于该培养基以生物胺为唯一氮源,营养不丰富,导致平板上的菌落形态较为单一,且BAs液体培养基活化菌株生长较慢,故选取LB培养基用来活化BAs固体培养基筛选得到的菌株,命名为L-1~L-25。而MMRS固体培养基上菌落形态丰富,筛选得到45株菌株,命名为M-1~M-45。
将初筛菌株接种到含有生物胺的磷酸盐缓冲液中测定其在该环境下的生物胺降解率,并将初筛菌株放入含有前体氨基酸的培养基中,研究其生物胺生产能力。表2为菌株对8种生物胺的降解能力,图1为菌株对8种生物胺的降解能力的比较分析。由表2和图1可知,L开头的菌株对酪胺均具有较高的降解能力,最高可达41.2%。其中L-1、L-2、L-12、L-22、L-25、M-2、M-8、M-9、M-11、M-18、M-19、M-21、M-23、M-27、M-28、M-29、M-32、M-34、M-35、M-42、M-43和M-44对组胺和酪胺这2种毒性较强的生物胺均有较高的降解率,且最高分别可达到52.88%和45.33%。这些菌株可能具有较强的组胺氧化酶和酪胺氧化酶活性,可以降解更多的组胺与酪胺。
表2 缓冲液中不同菌株对8种生物胺降解能力的比较
Table 2 Comparison of biogenic amines degradation ability from different strains in buffer

菌株降解率/%腐胺尸胺亚精胺精胺色胺苯乙胺组胺酪胺L-113.13±0.448.29±0.6214.43±0.5616.1±0.802.10±0.135.08±0.1213.4±0.1936.55±0L-223.46±0.8218.99±1.0325.25±0.3127.93±0.14ND3.58±0.6621.79±0.8641.2±0.11L-317.49±1.5816.26±1.8917.64±1.4918.19±1.51ND1.01±0.065.28±0.0831.45±0.45L-47.96±1.61ND14.04±1.2717.54±0.97NDND8.48±0.3233.83±0.12L-56.2±1.3013.93±0.2111.33±1.842.87±1.55NDND16.77±2.4329.73±0.31L-610.38±0.568.3±0.7711.07±0.5013.7±0.600.49±0.334.80±0.395.68±0.7436.29±0.64L-7NDNDND0.47±0.111.71±0.203.41±0.06ND31.33±0.48L-81.54±0.28ND 4.85±0.4411.18±0.71ND2.67±0.3813.45±0.6034.72±0.16L-98.84±0.945.21±0.8411.01±0.8817.24±0.510.79±0.032.09±0.1215.6±0.1236.68±0.32L-1013.82±1.0410.78±0.152.83±0.99NDNDND8.87±0.4427.93±0.09L-119.68±0.317.39±0.31NDNDND0.76±0.3313.38±0.2536.49±0.83L-1215.71±1.125.17±0.848.48±0.151.16±0.16NDND25.94±1.1940.62±1.01L-1311.58±0.273.97±0.074.57±0.67NDNDND21.16±1.5337.69±1.3L-148.57±1.134.67±1.29NDNDNDND4.82±0.3134.2±0.12L-1517.31±0.2613.47±0.259.3±0.206.00±0.36NDND11.1±0.4238.3±0.29L-1615.98±0.0512.27±0.159.55±0.263.64±0.69NDND17.9±0.5730.92±0.49L-1716.40±0.179.48±1.886.22±2.36NDNDND ND33.91±0.47L-1815.23±1.039.77±0.67.22±1.393.02±1.52NDND11.65±0.1432.39±0.3L-1914.22±1.7812.16±2.211.06±2.04NDNDND 4.26±0.3831.13±0.34L-2017.37±1.0616.82±1.245.04±1.14ND NDND3.02±0.1931.47±0.21L-2113.23±0.0911.25±0.821.78±0.33NDNDND6.33±3.0727.1±1.95L-2211.95±1.635.94±1.841.71±2.31ND NDND19.96±2.0833.00±1.18L-2315.68±0.179.13±0.045.6±0.23NDNDND12.71±0.0137.33±0.47L-2412.59±0.525.5±0.725.29±0.453.68±0.33ND ND21.59±0.9235.57±0.37L-2519.75±0.8313.95±1.0913.24±1.075.94±1.22NDND19.72±0.4335.25±0.22M-117.57±1.897.63±0.029.93±3.347.49±3.70NDNDNDNDM-231.62±0.2710.42±0.6135.4±0.2233.76±0.312.26±0.33ND52.88±0.0745.33±0.49M-310.67±0.28.87±0.045.81±0.058.17±0.17NDND11.61±0.8317.08±0.45M-47.81±0.15ND3.12±0.046.73±0.0411.07±0.3ND16.01±1.1010.00±0.20M-50.69±0.436.41±0.1411.08±0.608.94±0.79NDND20.22±3.703.27±2.55M-68.81±1.38ND9.35±3.22NDNDND19.32±5.1814.75±2.02M-725.23±0.3010.76±0.344.18±0.292.87±0.32NDND30.24±1.4511.28±0.17M-834.96±0.30ND40.42±0.5134.42±0.50NDND20.35±1.7327.06±3.03M-921.37±0.1419.07±0.316.31±0.8517.41±1.4610.85±0.008.73±0.1915.85±0.3121.68±0.03M-101.83±0.158.69±0.35NDND5.99±0.2710.13±0.02ND4.34±0.46M-114.27±0.50NDND NDNDND19.89±0.1918.60±0.29M-1211.55±0.6613.42±0.53NDND2.64±0.116.5±0.10ND16.45±0.83M-135.79±0.498.07±0.89ND1.18±1.72ND13.61±1.457.23±2.217.02±0.88M-1414.38±1.471.90±1.665.35±1.532.39±1.81NDND2.98±0.8223.47±0.09M-1533.14±1.5015.25±0.2837.98±2.0838.34±1.920.75±0.53NDND3.26±3.68M-167.87±0.4311.56±0.33NDNDND6.46±0.04ND27.06±0.67M-1721.5±0.2523.85±0.3218.22±0.8015.79±1.214.2±0.023.20±0.1619.03±0.6222.41±0.29M-1812.98±1.1515.16±0.81NDND6.93±0.049.23±0.00ND33.31±1.19M-1927.59±0.1018.52±0.8926.89±0.5222.94±1.276.69±0.372.25±0.3443.40±1.7741.32±1.12M-2012.52±0.2610.28±0.814.11±0.194.49±0.25NDND22.48±0.24NDM-2120.41±0.4013.98±0.4817.48±0.8815.86±1.259.98±0.475.56±0.3351.42±0.0737.74±0.04M-2229.12±1.19ND31.56±2.1823.14±0.26NDNDNDNDM-2336.02±0.5817.24±0.1637.37±0.9933.22±1.081.61±0.07ND36.05±0.733.28±1.08M-249.68±0.637.41±0.06ND15.4±1.099.91±1.03ND0.36±0.3716.96±0.30
续表2

菌株降解率/%腐胺尸胺亚精胺精胺色胺苯乙胺组胺酪胺M-2522.19±8.5126.57±8.311.19±31.52NDNDNDND17.5±5.15M-2623.31±15.95ND21.91±24.52ND8.99±0.813.73±0.5234.33±6.07NDM-2715.03±0.037.31±0.028.32±0.021.96±0.130.86±0.040.04±0.0518.9±0.0524.45±0.07M-2813.78±0.318.44±0.256.81±0.176.41±0.288.93±0.364.32±0.1814.10±0.9814.04±0.55M-2922.29±1.73ND8.57±2.05NDNDND47.74±1.0243.18±0.66M-308.21±0.77ND26.64±0.8433.67±0.99NDNDNDNDM-3112.2±0.1910.52±0.15NDNDNDNDND8.65±0.10M-3217.82±0.1617.06±0.156.05±0.140.34±0.141.83±0.004.2±0.0016.05±0.6420.29±0.32M-332.34±0.144.82±0.10NDNDND 4.07±0.12ND2.69±0.21M-346.14±0.92ND1.23±0.98NDNDND19.31±0.0119.37±0.46M-355.87±1.18NDNDND ND ND 15.98±0.5919.22±0.87M-3625.57±0.08ND22.19±1.8611.44±2.88NDND28.03±2.6221.43±2.92M-3734.55±0.535.15±0.6144.92±0.5643.4±0.56NDNDNDNDM-3812.94±1.64ND15.42±2.628.9±3.28NDND23.06±1.151.54±1.92M-3910.36±1.015.73±0.705.12±0.683.55±0.680.82±0.125.65±0.02ND42.05±0.03M-4013.16±1.520.89±0.5615.73±1.7116.98±1.19NDND33.99±0.5523.79±0.22M-4114.54±1.7213.76±1.962.13±1.69ND1.08±0.332.11±0.427.97±1.0820.36±0.84M-4219.6±0.83ND20.18±1.7216.63±1.70NDND24.1±0.2515.31±1.14M-431.11±0.66ND NDND ND ND 35.83±0.952.39±2.03M-4416.98±0.2417.01±0.382.97±0.25ND5.9±0.365.88±0.2011.32±0.9318.29±0.26M-4523.39±1.4421.44±1.7311.37±1.483.08±1.47ND0.15±0.6425.11±1.1227.68±0.55
注:ND表示未检测到(下同)

图1 缓冲液中不同菌株对8种生物胺降解能力的比较
Fig.1 Comparison of biogenic amines degradation ability from different strains in buffer
由于某些具有生物胺降解能力的菌株可能含有氨基酸脱羧酶,将前体氨基酸转换生成生物胺[21],因此,进一步分析了菌株生产生物胺的能力。表3为菌株的生物胺生产能力,图2为菌株产生生物胺能力的比较分析。由表3和图2可知,菌株M-19、M-21、M-23对酪胺产生能力较强,最高可达到150.05 mg/L,这3株菌可能具有较高的酪氨酸脱羧酶活性。菌株M-32对8种生物胺均不具有产生能力。综合分析,菌株L-1、L-2、L-12、L-22、L-25、M-9、M-11、M-18、M-27、M-28、M-29、M-32、M-34、M-35、M-42、M-43和M-44对组胺和酪胺均有较高的降解率,且产生物胺能力较弱,于是选择这17株菌进行二级复筛。这17株菌株的胺氧化酶活性高于胺脱羧酶活性。
表3 不同菌株对8种生物胺产生能力的比较
Table 3 Comparison of biogenic amines producing ability from different strains
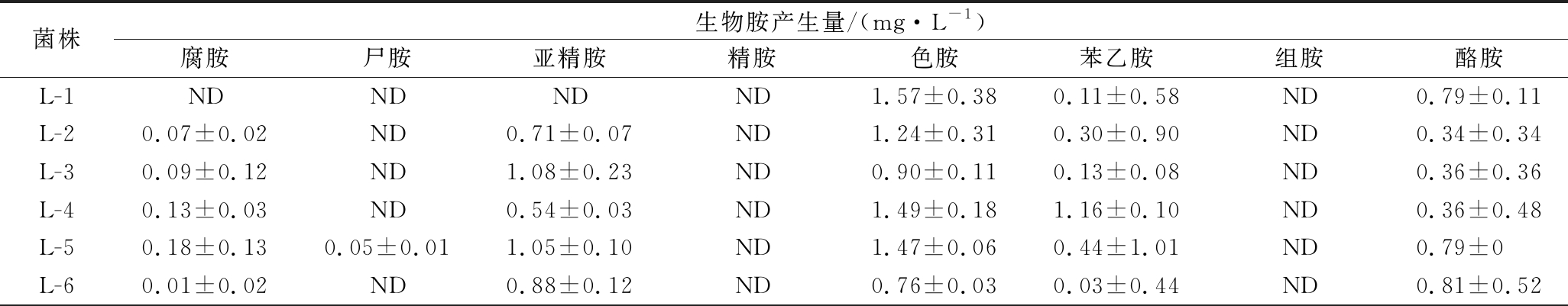
菌株生物胺产生量/(mg·L-1)腐胺尸胺亚精胺精胺色胺苯乙胺组胺酪胺L-1NDNDNDND1.57±0.380.11±0.58ND0.79±0.11L-20.07±0.02ND0.71±0.07ND1.24±0.310.30±0.90ND0.34±0.34L-30.09±0.12ND1.08±0.23ND0.90±0.110.13±0.08ND0.36±0.36L-40.13±0.03ND0.54±0.03ND1.49±0.181.16±0.10ND0.36±0.48L-50.18±0.130.05±0.011.05±0.10ND1.47±0.060.44±1.01ND0.79±0L-60.01±0.02ND0.88±0.12ND0.76±0.030.03±0.44ND0.81±0.52
续表3
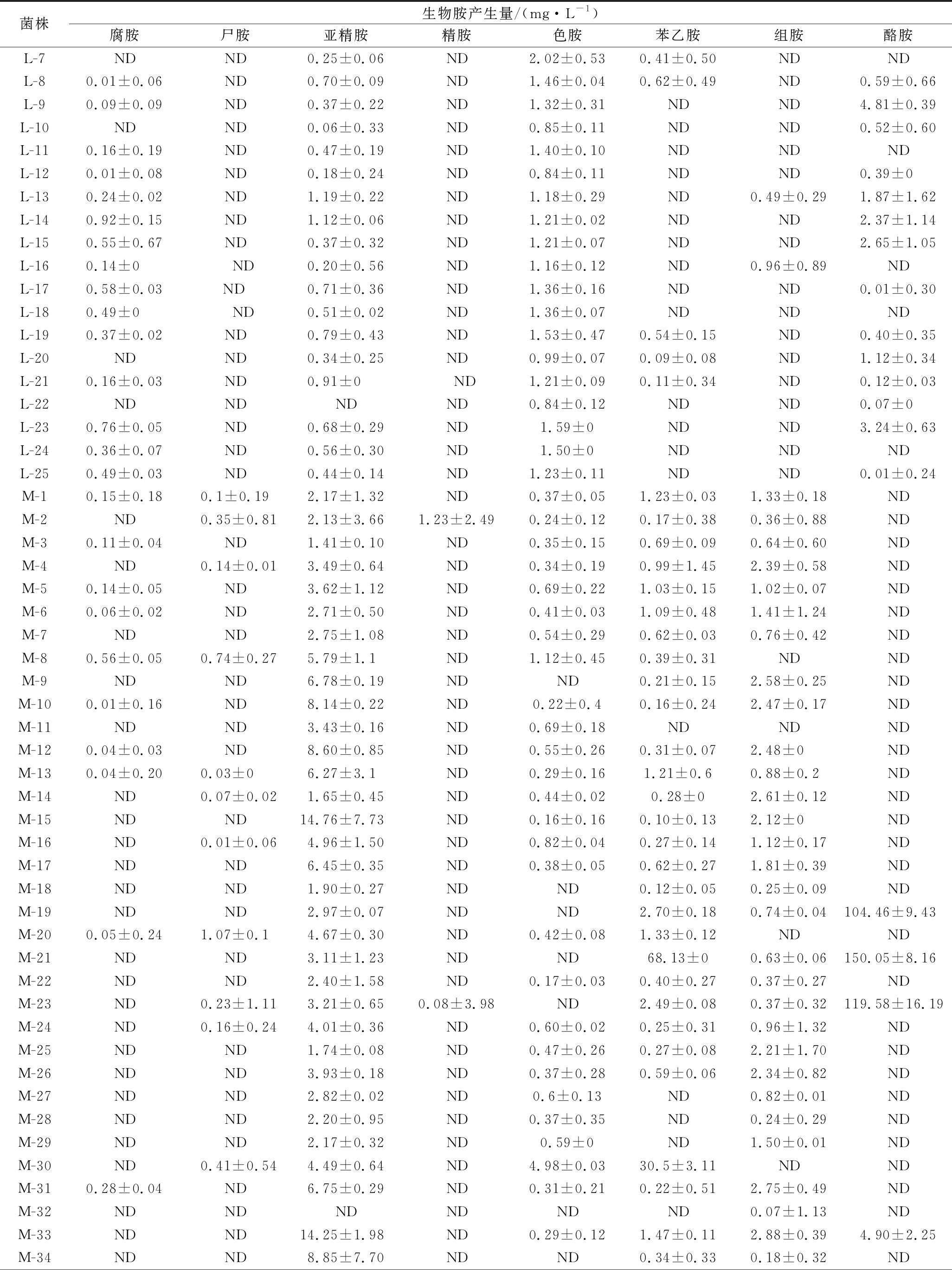
菌株生物胺产生量/(mg·L-1)腐胺尸胺亚精胺精胺色胺苯乙胺组胺酪胺L-7NDND0.25±0.06ND2.02±0.530.41±0.50NDNDL-80.01±0.06ND0.70±0.09ND1.46±0.040.62±0.49ND0.59±0.66L-90.09±0.09ND0.37±0.22ND1.32±0.31NDND4.81±0.39L-10NDND0.06±0.33ND0.85±0.11NDND0.52±0.60L-110.16±0.19ND0.47±0.19ND1.40±0.10NDNDNDL-120.01±0.08ND0.18±0.24ND0.84±0.11NDND0.39±0L-130.24±0.02ND1.19±0.22ND1.18±0.29ND0.49±0.291.87±1.62L-140.92±0.15ND1.12±0.06ND1.21±0.02NDND2.37±1.14L-150.55±0.67ND0.37±0.32ND1.21±0.07NDND2.65±1.05L-160.14±0ND0.20±0.56ND1.16±0.12ND0.96±0.89NDL-170.58±0.03ND0.71±0.36ND1.36±0.16NDND0.01±0.30L-180.49±0ND0.51±0.02ND1.36±0.07NDNDNDL-190.37±0.02ND0.79±0.43ND1.53±0.470.54±0.15ND0.40±0.35L-20NDND0.34±0.25ND0.99±0.070.09±0.08ND1.12±0.34L-210.16±0.03ND0.91±0ND1.21±0.090.11±0.34ND0.12±0.03L-22NDNDNDND0.84±0.12NDND0.07±0L-230.76±0.05ND0.68±0.29ND1.59±0NDND3.24±0.63L-240.36±0.07ND0.56±0.30ND1.50±0NDNDNDL-250.49±0.03ND0.44±0.14ND1.23±0.11NDND0.01±0.24M-10.15±0.180.1±0.192.17±1.32ND0.37±0.051.23±0.031.33±0.18NDM-2ND0.35±0.812.13±3.661.23±2.490.24±0.120.17±0.380.36±0.88NDM-30.11±0.04ND1.41±0.10ND0.35±0.150.69±0.090.64±0.60NDM-4ND0.14±0.013.49±0.64ND0.34±0.190.99±1.452.39±0.58NDM-50.14±0.05ND3.62±1.12ND0.69±0.221.03±0.151.02±0.07NDM-60.06±0.02ND2.71±0.50ND0.41±0.031.09±0.481.41±1.24NDM-7NDND2.75±1.08ND0.54±0.290.62±0.030.76±0.42NDM-80.56±0.050.74±0.275.79±1.1ND1.12±0.450.39±0.31NDNDM-9NDND6.78±0.19NDND0.21±0.152.58±0.25NDM-100.01±0.16ND8.14±0.22ND0.22±0.40.16±0.242.47±0.17NDM-11NDND3.43±0.16ND0.69±0.18NDNDNDM-120.04±0.03ND8.60±0.85ND0.55±0.260.31±0.072.48±0NDM-130.04±0.200.03±06.27±3.1ND0.29±0.161.21±0.60.88±0.2NDM-14ND0.07±0.021.65±0.45ND0.44±0.020.28±02.61±0.12NDM-15NDND14.76±7.73ND0.16±0.160.10±0.132.12±0NDM-16ND0.01±0.064.96±1.50ND0.82±0.040.27±0.141.12±0.17NDM-17NDND6.45±0.35ND0.38±0.050.62±0.271.81±0.39NDM-18NDND1.90±0.27NDND0.12±0.050.25±0.09NDM-19NDND2.97±0.07NDND2.70±0.180.74±0.04104.46±9.43M-200.05±0.241.07±0.14.67±0.30ND0.42±0.081.33±0.12NDNDM-21NDND3.11±1.23NDND68.13±00.63±0.06150.05±8.16M-22NDND2.40±1.58ND0.17±0.030.40±0.270.37±0.27NDM-23ND0.23±1.113.21±0.650.08±3.98ND2.49±0.080.37±0.32119.58±16.19M-24ND0.16±0.244.01±0.36ND0.60±0.020.25±0.310.96±1.32NDM-25NDND1.74±0.08ND0.47±0.260.27±0.082.21±1.70NDM-26NDND3.93±0.18ND0.37±0.280.59±0.062.34±0.82NDM-27NDND2.82±0.02ND0.6±0.13ND0.82±0.01NDM-28NDND2.20±0.95ND0.37±0.35ND0.24±0.29NDM-29NDND2.17±0.32ND0.59±0ND1.50±0.01NDM-30ND0.41±0.544.49±0.64ND4.98±0.0330.5±3.11NDNDM-310.28±0.04ND6.75±0.29ND0.31±0.210.22±0.512.75±0.49NDM-32NDNDNDNDNDND0.07±1.13NDM-33NDND14.25±1.98ND0.29±0.121.47±0.112.88±0.394.90±2.25M-34NDND8.85±7.70NDND0.34±0.330.18±0.32ND
续表3

菌株生物胺产生量/(mg·L-1)腐胺尸胺亚精胺精胺色胺苯乙胺组胺酪胺M-35NDND1.84±0.16ND0.23±0.04ND1.09±0.19NDM-36NDND3.82±1.00ND0.27±0.010.20±0.080.79±0.39NDM-37NDND6.36±8.850.4±0.530.06±0.280.67±0.612.27±0NDM-380.27±0.10NDNDND0.65±0.201.29±0.16NDNDM-39NDND2.04±2.15ND8.18±0.1640.50±2.830.98±0NDM-400.09±0.110.43±0.3211.43±2.031.09±0.440.26±0.150.44±0.062.35±1.19NDM-410.07±0.54ND8.92±7.43ND0.48±0.060.61±0.540.72±0.15NDM-42NDND2.96±2.60ND0.56±0.02ND1.04±0NDM-43NDND2.06±0.46ND0.70±0.30ND0.11±0.10NDM-44ND0.26±0.181.65±2.480.45±0.15ND0.19±0.03NDNDM-45ND0.02±0.124.39±2.300.02±0.27ND0.18±01.00±0.20ND
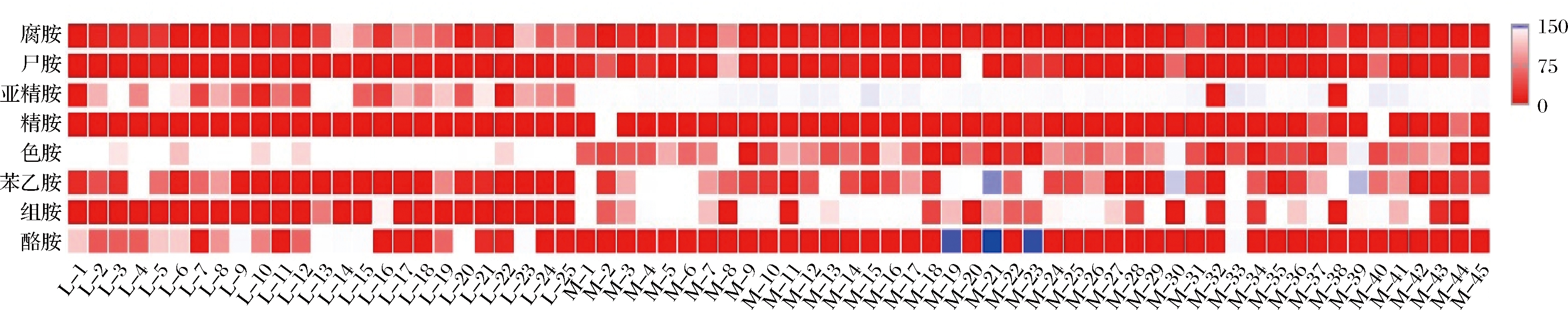
图2 不同菌株对8种生物胺产生能力的比较
Fig.2 Comparison of biogenic amines producing ability from different strains
由表4可知,菌株M-28与M-18对8种生物胺均能降解,对酪胺降解能力相差不大,其中M-28菌株对组胺降解能力更强,因此选择M-28作为最终的生物胺降解菌株,其在发酵液中对腐胺、尸胺、亚精胺、精胺、色胺、苯乙胺、组胺和酪胺的降解率分别为(11.32±0.61)%、(6.97±1.19)%、(2.10±0.80)%、(10.57±0.57)%、(3.68±0.17)%、(1.75±3.83)%、(42.18±4.25)%和(5.80±0.81)%。
研究结果表明,在磷酸盐缓冲液中生物胺降解率较高的菌株,在发酵液中降解率不一定高,如菌株M-29。可能由于磷酸盐缓冲液中无其他氮源,菌株只能被迫消耗生物胺。而在发酵液中,营养丰富,某些菌株可能优先利用其他氮源。所以经二级复筛后的菌株M-28是能够在营养充足的环境中优先利用生物胺的菌株,也更能有效地应用于环境复杂、营养丰富的酱中。
表4 发酵液中不同菌株对8种生物胺降解能力的比较
Table 4 Comparison of biogenic amines degradation ability from different strains in fermentation broth
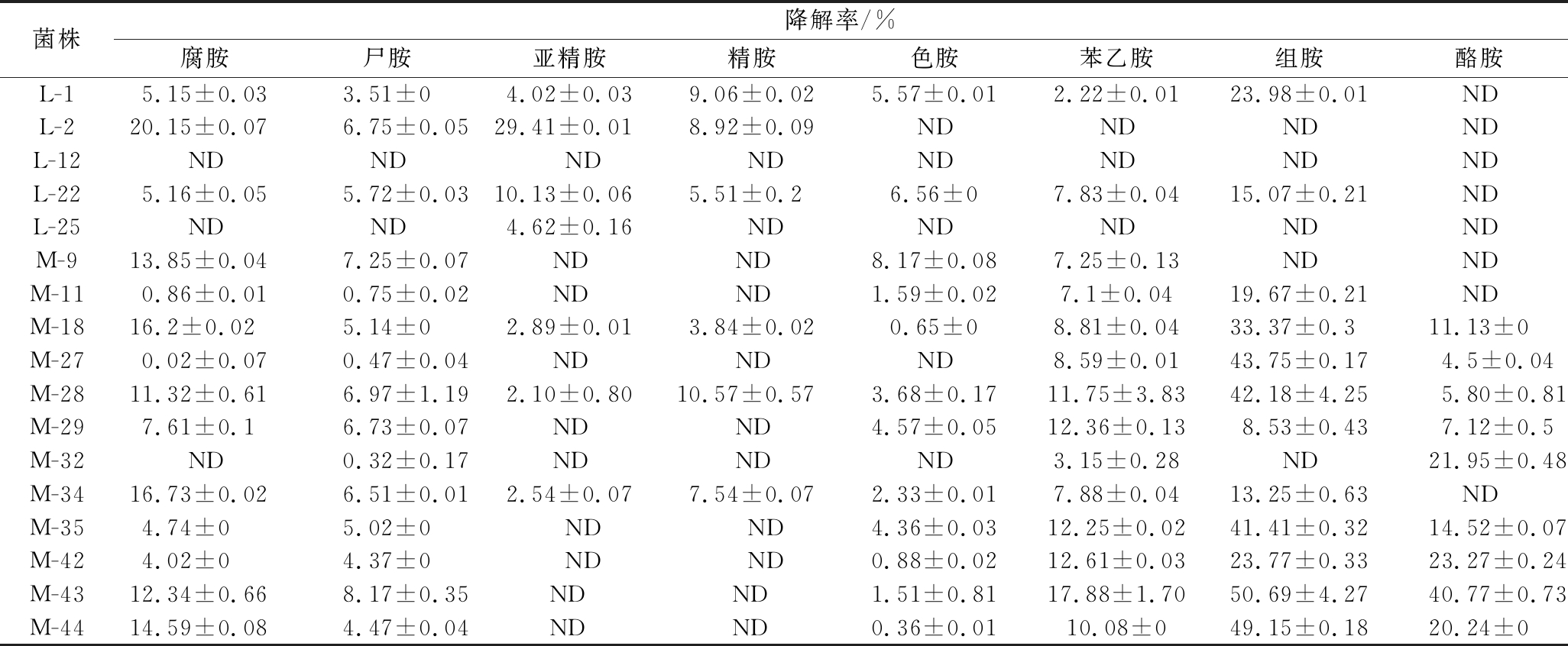
菌株降解率/%腐胺尸胺亚精胺精胺色胺苯乙胺组胺酪胺L-15.15±0.033.51±04.02±0.039.06±0.025.57±0.012.22±0.0123.98±0.01NDL-220.15±0.076.75±0.0529.41±0.018.92±0.09NDNDNDNDL-12NDNDNDNDNDNDNDNDL-225.16±0.055.72±0.0310.13±0.065.51±0.26.56±07.83±0.0415.07±0.21NDL-25NDND4.62±0.16NDNDNDNDNDM-913.85±0.047.25±0.07NDND8.17±0.087.25±0.13NDNDM-110.86±0.010.75±0.02NDND1.59±0.027.1±0.0419.67±0.21NDM-1816.2±0.025.14±02.89±0.013.84±0.020.65±08.81±0.0433.37±0.311.13±0M-270.02±0.070.47±0.04NDNDND8.59±0.0143.75±0.174.5±0.04M-2811.32±0.616.97±1.192.10±0.8010.57±0.573.68±0.1711.75±3.8342.18±4.255.80±0.81M-297.61±0.16.73±0.07NDND4.57±0.0512.36±0.138.53±0.437.12±0.5M-32ND0.32±0.17NDNDND3.15±0.28ND21.95±0.48M-3416.73±0.026.51±0.012.54±0.077.54±0.072.33±0.017.88±0.0413.25±0.63NDM-354.74±05.02±0NDND4.36±0.0312.25±0.0241.41±0.3214.52±0.07M-424.02±04.37±0NDND0.88±0.0212.61±0.0323.77±0.3323.27±0.24M-4312.34±0.668.17±0.35NDND1.51±0.8117.88±1.7050.69±4.2740.77±0.73M-4414.59±0.084.47±0.04NDND0.36±0.0110.08±049.15±0.1820.24±0
通过PCR方法获得M-28菌株的16S rDNA序列,并测序。测序结果经NCBI上的BLAST比对,可知M-28菌株与Pediococcus acidilactici strain ATCC 8042菌株(GenBank accession no. CP033438.1)相似度达到100%,因此认定其为乳酸片球菌(Pediococcus acidilactici)。有研究显示,韩国传统发酵豆制品中分离出的乳酸片球菌具有降解组胺和酪胺的作用,降解率分别为14.7%~23.7%和15.7%~25.9%[22],与该研究结果相比,本研究筛选出的乳酸片球菌M-28可以降解8种生物胺,且组胺降解率更高。
通过测定M-28乳酸片球菌在MRS培养基中24 h内的OD值,可得到乳酸片球菌M-28的生长曲线。由图3可知,乳酸片球菌从第4h开始进入对数生长期,大约到16 h时,生长趋于稳定。
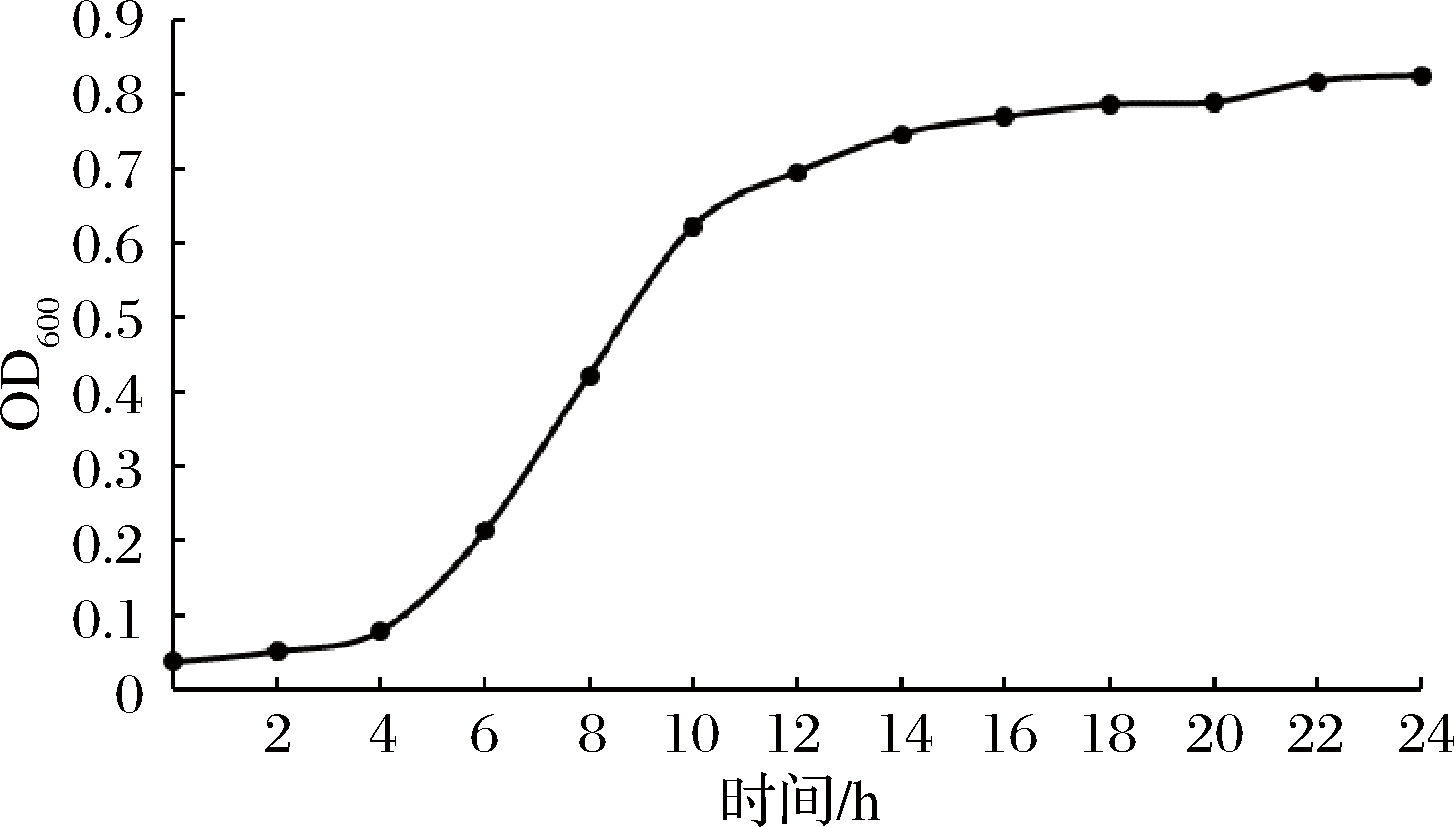
图3 乳酸片球菌生长曲线
Fig.3 Growth curve of P. acidilactici M-28
乳酸片球菌M-28在不同盐浓度、温度与pH条件下的组胺、酪胺降解率及活菌数如表5、表6和表7所示。
表5 不同盐含量下乳酸片球菌降解特性及生长情况分析
Table 5 Analysis on degradation characteristics and growth of P. lactis at different salt concentration

盐的质量浓度/(g·L-1)0306090120150180组胺降解率/%62.30±7.8489.01±0.7083.85±0.0860.25±5.4224.89±2.0723.99±2.1416.90±5.65酪胺降解率/%31.48±6.4125.24±5.4025.46±0.8317.53±6.4317.95±3.2914.36±3.006.30±3.79活菌数(lg CFU/mL)8.74±0.168.61±0.048.81±0.057.81±0.167.48±0.146.74±0.185.89±0.21
由表5可知,菌株盐的质量浓度为0~90 g/L时生长良好,对组胺和酪胺均有较高的降解率,最高分别可达到89.02% 和31.49%。当盐质量浓度>120 g/L时,降解率明显下降。可能由于菌株的生长受到了抑制,活菌数减少,与生物胺降解相关的胺氧化酶分泌较少,导致生物胺降解率低于低盐环境。
由表6可知,乳酸片球菌M-28在温度为30~40℃时,菌株生长较好且在30 ℃时对组胺和酪胺降解率最高,分别为65.51%和28.06%。而在温度为20或45 ℃时,菌株不适应相对低温或相对高温下的环境,活菌数降低,胺氧化酶数量减少,且菌株的生物胺氧化酶在低温时活性降低,在温度高时会失活,从而导致降解率较低。有研究证明组胺氧化酶活性在30 ℃时最高,在25 ℃时活性降低,在45 ℃时酶活力几乎为零[20]。
表6 不同温度下乳酸片球菌降解特性及生长情况分析
Table 6 Analysis on degradation characteristics and growth of P. lactis at different temperature

温度/℃202530354045组胺降解率/%13.48±2.8527.61±2.6565.51±4.2459.91±4.2651.91±7.0930.42±7.02酪胺降解率/%6.49±4.8217.94±4.9528.06±3.1222.94±2.1114.7±10.601.82±0.12活菌数(lg CFU/mL)4.95±0.217.61±0.138.81±0.078.74±0.018.58±0.145.65±0.22
由表7可知,乳酸片球菌M-28可耐受pH 4~9的环境,在该pH范围内均可生长。在pH 4~8时,均对组胺酪胺有一定的降解。当pH为6时,对组胺和酪胺降解率最高分别为62.73%和23.78%。而当pH 9~10时,降解受到抑制甚至无降解,由于菌株在碱性较高的环境下生长受到抑制,或者在碱性环境中生物胺氧化酶的酶活较低[20],从而无法有效发挥降解作用。
表7 不同pH下乳酸片球菌降解特性及生长情况分析
Table 7 Analysis on degradation characteristics and growth of P. lactis at different pH

pH值45678910组胺降解率/%28.68±0.2451.92±1.3562.73±4.0338.63±6.0119.12±9.292.34±3.310.58±0.82酪胺降解率/%7.63±9.7120.03±4.5823.78±6.5218.34±5.366.96±3.621.92±2.72ND活菌数(lg CFU/mL)6.57±0.028.57±0.038.66±0.028.60±0.018.23±0.127.45±0.025.65±0.07
本研究通过BAs固体培养基及改良MRS培养基初步筛选得到共70株菌株。经过复筛最终选择乳酸片球菌M-28作为生物胺降解菌株,其为革兰氏阳性菌,呈过氧化氢酶和氧化酶阴性,可产生D-或L-乳酸[23],常作为食品发酵中的益生菌。通过测定生长曲线可知,该菌在4~16 h属于对数生长期,生长较快。
研究发现,菌株的生长与降解特性具有一定的相关性。菌落数多,降解率相对较高。乳酸片球菌在温度30~40 ℃,盐的质量浓度为0~90 g/L,pH 5~8时菌落数约8 lg CFU/mL左右,对组胺或酪胺的降解率最高,达(89.01±0.7)%和(31.48±6.41)%。传统发酵食品如豆酱、酱油或腐乳中生物胺的存在可能令产品的质量下降,甚至引起消费者的各种过敏反应。豆酱的pH一般为5左右,盐含量约10%, 夏季发酵温度约为30 ℃。该菌株可适应豆酱的发酵环境,应用于豆酱发酵过程中的生物胺含量的控制,由于可耐150 g/L盐,对其他高盐发酵食品也具有良好的应用前景[2]。
[1] SPANO G,RUSSO P,LONVAUD-FUNEL A,et al.Biogenic amines in fermented foods[J].Eur J Clin Nutr,2010,64(3):S95-100.
[2] KIM K H,LEE S H,CHUN B H,et al.Tetragenococcus halophilus MJ4 as a starter culture for repressing biogenic amine (cadaverine) formation during saeu-jeot (salted shrimp) fermentation[J].Food Microbiol,2019,82:465-473.
[3] LUCAS P M,BLANCATO V S,CLAISSE O,et al.Agmatine deiminase pathway genes in Lactobacillus brevis are linked to the tyrosine decarboxylation operon in a putative acid resistance locus[J].Microbiology,2007,153(7):2 221-2 230.
[4] NANNELLI F,CLAISSE O,GINDREAU E,et al.Determination of lactic acid bacteria producing biogenic amines in wine by quantitative PCR methods[J].Lett Appl Microbiol,2008,47(6):594-599.
[5] AL B I,POOLE S,DEETH H C,et al.Biogenic amines in fish: roles in intoxication,spoilage,and nitrosamine formation-a review[J].Crit Rev Food Sci Nutr,2009,49(4):369-377.
[6] ANDERSON M C,HASAN F,MCCRODDEN J M.Monoamine oxidase inhibitors and the cheese effect[J].Neurochemical Research,1993,18(11):1 145-1 149.
[7] SHALABY A R.Significance of biogenic amines to food safety and human health[J].Food Research International,1996,29(7):675-690.
[8] 牛天娇,马莺.中国传统黄豆酱中微生物的发掘与利用[J].食品科学,2004(z1):213-216.
[9] LI Jia, GUAN Rongfan, WEI Ximing,et al.Detection of ten biogenic amines in Chinese commercial soybean paste by HPLC[J].International Journal of Food Properties,2018,21(1):1 344-1 350.
[10] SHUKLA S,PARK H K,KIM J K,et al.Determination of biogenic amines in Korean traditional fermented soybean paste(Doenjang)[J].Food Chem Toxicol,2010,48(5):1 191-1 195.
[11] NAILA A,FLINT S,FLETCHER G,et al. Control of biogenic amines in food-existing and emerging approaches[J].J Food Sci,2010,75(7):R139-R150.
[12] KIM J H,KIM D H,AHN H J,et al.Reduction of the biogenic amine contents in low salt-fermented soybean paste by gamma irradiation[J].Food Control,2005,16(1):43-49.
[13] EOM J S,SEO B Y,CHOI H S.Biogenic amine degradation by Bacillus species isolated from traditional fermented soybean food and detection of decarboxylase-related genes[J].J Microbiol Biotechnol,2015,25(9):1 519-1 527.
[14] LEE Y C,KUNG H F,HUANG Y L,et al.Reduction of biogenic amines during miso fermentation by Lactobacillus plantarum as a starter culture[J].J Food Prot,2016,79(9):1 556-1 561.
[15] MAN J C D,ROGOSA M,SHARPE M E.A medium for the Cultivation of Lactobacilli[J].Journal of Applied Bacteriology,1960,23(1):130-135.
[16] 姜维.一株耐盐性高效生物胺降解新菌的筛选、分类鉴定及应用研究[D]. 青岛:中国海洋大学,2014.
[17] HWANG D F,CHANG S H,SHIUA C Y,et al.High-performance liquid chromatographic determination of biogenic amines in fish implicated in food poisoning[J].Journal of chromatography B, Biomedical sciences and applications,1997,693(1):23-29.
[18] 栾光辉,刘春凤,李崎.不同啤酒生物胺含量的比较[J].食品与发酵工业,2013,39(1):176-180.
[19] 朱天傲,刘春凤,王金晶,等.国产酱类产品中的生物胺[J].食品与发酵工业,2017,43(10):220-227.
[20] KUNG H F,LEE Y C,HUANG Y L,et al.Degradation of Histamine by Lactobacillus plantarum isolated from Miso products[J].J Food Prot,2017,80(10):1 682-1 688.
[21] PARK Y K,LEE J H,MAH J H. Occurrence and reduction of biogenic amines in traditional Asian fermented soybean foods:A review[J].Food Chem,2019,278:1-9.
[22] OH H,RYU M,HEO J,et al.Characterization of biogenic amine-reducing Pediococcus pentosaceus isolated from traditionally fermented soybean products[J].The Korean Journal of Microbiology,2014,50(4):319-326.
[23] IRMLER S,BAVAN T,OBERLI A,et al.Catabolism of Serine by Pediococcus acidilactici and Pediococcus pentosaceus[J].Applied and Environmental Microbiology,2012,79(4):1 309-1 315.