酱醪源肠球菌的特性研究与安全性评价
区锡敏1,2,4,王阿利1,3,5,孙张乐1,魏梓晴1,詹紫瑶1,李影彤1,戴月如1,许嫚瑶1, 黄桂东1,2,4,钟先锋1,3,5*
1(佛山科学技术学院 食品科学与工程学院,广东 佛山,528231)2(广东省传统发酵食品工程技术研究中心,广东 佛山,528231) 3(广东省食品流通安全控制工程技术研究中心,广东 佛山,528231) 4(佛山市酿造工程技术研究中心,广东 佛山,528231) 5(佛山农业生物制造工程技术研究中心,广东 佛山,528231)
摘 要 肠球菌是发酵食品中常见的乳酸菌,部分肠球菌可作为发酵食品的潜在发酵剂。为了更好地了解从酱醪中分离得到的3株肠球菌的特性,研究了其生长曲线、产酸及抑菌能力等。通过毒力基因检测、氨基酸脱羧酶试验、吲哚试验、溶血试验、耐药性检测来评价其安全性。结果表明:肠球菌接种入酱醪12 h后进入稳定期,具有较好产酸能力,可抑制金黄色葡萄球菌的生长;肠球菌中未检出毒力基因;吲哚试验呈阴性;无溶血作用;对多种抗生素敏感。综上,3株肠球菌发酵特性较好且较为安全。
关键词 酱醪;发酵食品;肠球菌
DOI:10.13995/j.cnki.11-1802/ts.023214
引用格式:区锡敏,王阿利,孙张乐,等.酱醪源肠球菌的特性研究与安全性评价[J].食品与发酵工业,2020,46(9):83-88.OU Ximin, WANG Ali, SUN Zhangle, et al. Characteristic and safety assessment of Enterococcus sp. from soy sauce mash[J].Food and Fermentation Industries,2020,46(9):83-88.
Characteristic and safety assessment of Enterococcus sp. from soy sauce mash
OU Ximin1,2,4, WANG Ali1,3,5, SUN Zhangle1, WEI Ziqing1, ZHAN Ziyao1,LI Yingtong1,DAI Yueru1,XU Manyao1,HUANG Guidong1,2,4,ZHONG Xianfeng1,3,5*
1 (Department of Food Science and Engineering, Foshan University, Foshan 528231, China)
2(Guangdong Engineering Research Center for Traditional Fermented Food, Foshan 528231, China) 3(Guangdong Engineering Research Center for Safety Control of Food Circulation, Foshan 528231, China) 4(Foshan Engineering Research Center for Brewing Technology, Foshan 528231, China) 5(Foshan Engineering Research Center for Agricultural Biological Manufacturing, Foshan 528231, China)
Abstract Strains from genus of Enterococcus are common lactic acid bacteria existed in fermented foods and some of them can be used as potential starters. In order to better study three strains of Enterococcus sp. isolated from soy sauce previously, their biological properties such as growth curve, acid production, and bacteriostasis capacity were investigated. Meanwhile, PCR amplification of virulence genes, amino acids decarboxylases activity, indole test, hemolysis test, and antibiotics susceptibility test were used to assess the safety of these strains. The results showed that these three strains grew to a stable phase within 12 h and could produce acids quickly. All had an inhibitory effect on the growth of Staphylococcus aureus. In addition, these strains shown negative results on the tests of virulence factors, indole production and hemolysis activity. They were sensitive to several common antibiotics. Therefore, three isolated strains of Enterococcus sp. possessed good fermentation characteristics and safety.
Key words soy sauce mash; fermented food; Enterococcus
第一作者:硕士研究生(钟先锋教授为通讯作者, E-mail:zhongxf81@126.com)
基金项目:国家自然科学基金项目(31660459、31700056);广东省自然科学基金项目(2018A0303130 275);佛山科学技术学院研究生自由探索基金重点项目(2019ZYTS13)
收稿日期:2019-12-27,改回日期:2020-02-17
肠球菌是乳酸菌常见菌属之一,具有很强的生命力,能够在比较宽广的pH范围、温度、高/低渗透压条件下生长[1-2]。肠球菌存在于大多数发酵食品中,对发酵食品的成熟以及风味形成具有重要作用,如发酵乳制品[3]、肉制品[4]等。有学者[5-7]从白酒窖池、泡菜腌渍水、豆豉和腐乳中分离鉴定出肠球菌,研究发现它们具有较好的抑菌、降胆固醇、抗氧化等益生特性,并经安全性评价判断为安全。说明发酵食品来源的肠球菌类乳酸菌具有较好的益生特性而且相对安全,可作为发酵食品的潜在发酵剂。
近年的研究证实酱油中含有丰富的肠球菌资源[8-9]。SULAIMAN等[10]通过宏基因组测序技术对中国传统酱油微生物组成变化及代谢功能进行了研究,发现魏斯氏菌属、肠球菌属、乳球菌属等乳酸菌在酱油酿造中具有重要作用。但有关参与酱油酿造的肠球菌资源开发程度不高,目前也无酱油相关肠球菌分离筛选及其特性和安全性的系统性研究。
本实验室前期从酱醪中分离鉴定出3株肠球菌,且表现出较好的综合特性。为了更好地开发利用这些菌株,保证其使用的安全性,通过生长曲线、产酸、抑菌活性实验,探究该菌株的功能特性,通过毒力基因检测、氨基酸脱羧酶试验、吲哚试验、溶血试验和耐药性检测,了解该菌株是否具有安全性,以充分挖掘酱油酿造中肠球菌资源,为酱油中肠球菌资源开发提供理论基础。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
试验菌株:分离自酱醪的3株肠球菌,分别命名为E1、E2、E3。
MRS改良培养基、细菌基因组DNA提取试剂盒、靛基质试剂盒、氨基酸脱羧酶对照管、精氨酸脱羧酶生化管、赖氨酸脱羧酶生化管、鸟氨酸脱羧酶生化管、哥伦比亚血琼脂培养基,广东环凯微生物科技有限公司;肠球菌属毒力基因PCR引物,上海美吉生物医药科技有限公司;药敏纸片,杭州微生物试剂有限公司;粪肠球菌(Enterococcus faecalis CICC 10396),中国工业微生物菌种保藏管理中心;大肠杆菌(Escherichia coli ATCC 25922),上海鲁傲科技有限公司;金黄色葡萄球菌(Staphylococcus aureus ATCC 25923),南京茂捷微生物科技有限公司。
1.1.2 仪器与设备
EPOCH-2酶标仪,美国伯腾仪器有限公司;LRH-150恒温培养箱,上海一恒科学仪器有限公司;GR60DA全自动灭菌锅,致微(厦门)仪器有限公司; FE-28 pH计、ME104电子分析天平,梅特勒-托利多精密仪器公司;SW-CJ-1FD超净工作台,苏州安泰空气技术有限公司;SY-1220恒温水浴锅,美国精骐有限公司;ALLEGRA-64R台式高速冷冻离心机,美国贝克曼库尔特有限公司;FlexCycler2 PCR仪,德国耶拿分析仪器股份公司;DYY-7C凝胶电泳仪,北京六一生物科技有限公司。
1.2 实验方法
1.2.1 特性研究
1.2.1.1 肠球菌生长曲线的测定
根据文献[11],进行适当修改,将已鉴定的肠球菌菌株活化3代,调节OD600nm=0.6,以体积分数2%接种量接种于MRS液体培养基中,37 ℃培养0~24 h,每隔2 h使用酶标仪测定菌株OD600nm值。以OD600nm值为纵坐标,时间间隔为横坐标绘制不同菌株的生长曲线。
1.2.1.2 肠球菌产酸能力的测定
根据文献[12],适当修改如下:将已鉴定的肠球菌菌株活化3代,调节OD600nm=0.6,以体积分数2%接种量接种于含60 g/L NaCl的MRS液体培养基中,37 ℃培养24 h。以10 000 r/min离心5 min,收集上清液,使用pH计测定不同菌株的培养液pH值。
1.2.1.3 肠球菌抑菌能力的测定
根据文献[13],进行适当修改,使用双层琼脂扩散法。首先在灭菌平板中加入10 mL含有20 g/L水琼脂培养基,待水琼脂凝固后放入灭菌牛津杯,接着将20 mL LB琼脂培养基倒入水琼脂培养基上,隔夜凝固后使用指示菌涂布,用无菌镊子将牛津杯取出,在孔内加入180 μL试验菌株菌液,室温扩散4 h后在37 ℃条件下培养10~12 h。测量透明抑菌圈的直径,读数精准到0.01 mm。指示菌为大肠杆菌(ATCC 25922)与金黄色葡萄球菌(ATCC 25923)。
1.2.2 安全性验证
1.2.2.1 毒力基因PCR检测
根据文献[14],进行适当修改,使用细菌基因组DNA提取试剂盒提取试验菌株的DNA,采用PCR扩增技术对肠球菌属常见的6种毒力基因进行检测,以证明肠球菌的安全性[14]。已明确的6种毒力基因的引物序列信息见表1,以粪肠球菌(CICC 10396)为阳性对照。
表1 毒力基因的引物序列信息
Table 1 The primer sequences of virulence genes

基因引物序列(5'-3')产物大小/bpasa1F: GCACGCTATTACGAACTATGAR: TAAGAAAGAACATCACCACGA375cylAF: ACTCGGGGATTGATAGGCR: GCTGCTAAAGCTGCGCTT688efaAF: GACAGACCCTCACGAATAR: AGTTCATCATGCTGTAGTA705espF: AGATTTCATCTTTGATTCTTGGR: AATTGATTCTTTAGCATCTGG510gelEF: TATGACAATGCTTTTTGGGATR: AGATGCACCCGAAATAATATA213hylF: ACAGAAGAGCTGCAGGAAATGR: GACTGACGTCCAAGTTTCCAA276
反应体系:总反应体系为50 μL,3 μL对照样,上下游引物各1 μL(10 μmol/L),5 μL 10× Easy Taq Buffer,4 μL dNTPs(2.5 mmol/L),0.5 μL Easy Taq DNA聚合物,35.5 μL ddH2O。
扩增条件:预变性,95 ℃ 4 min;32个循环(变性:94 ℃ 30 s;退火:56/52 ℃ 1 min;延伸:72 ℃ 1 min);再延伸,72 ℃ 7 min;除efaA基因退火温度为52 ℃外,其余基因退火温度为56 ℃。
1.2.2.2 氨基酸脱羧酶试验
根据文献[7]并进行适当修改如下,将试验菌株接种于精氨酸、赖氨酸和鸟氨酸脱羧酶生化管中,并同时接种于氨基酸脱羧酶对照管中,用液体石蜡封口,于37 ℃培养24 h。赖氨酸、鸟氨酸脱羧酶试验管与对照管均变黄为阴性,试验管变黄绿色且对照管变黄为阳性;精氨酸脱羧酶试验管与对照管均变黄为阴性,试验管变蓝绿色且对照管变黄为阳性。大肠杆菌(ATCC 25922)为阳性对照菌株。
1.2.2.3 吲哚试验
根据文献[15]进行适当修改,试验菌株接种于蛋白胨水培养基中,37 ℃恒温培养48~72 h,向培养基中滴加5~8滴靛基质试剂,并轻摇试管观察颜色变化。若液面出现红色则为阳性结果,否则为阴性结果。大肠杆菌(ATCC 25922)为阳性对照菌株。未接种的蛋白胨水培养基为空白对照。
1.2.2.4 溶血试验
根据文献[15]进行适当修改,试验菌株划线接种于哥伦比亚血平板中,37 ℃培养24 h,观察菌落周围变化情况。若菌落周围形成透明圈则为β-溶血;若出现绿色圈,则为α-溶血;若无溶血环,则为无溶血。以金黄色葡萄球菌(ATCC 25923)为阳性参照菌株。
1.2.2.5 耐药性检测
根据文献[7]进行适当修改,使用药敏纸片扩散法进行药敏试验。使用的药敏纸片种类为青霉素、氨苄西林、四环素、红霉素、诺氟沙星和万古霉素等抗生素,共计6种。将活化好的试验菌株浓度调节至1.5×108菌数/mL(0.5个麦氏浓度),涂布接种于MRS培养基中,静置5 min后将相应药敏纸片贴在培养基上。于37 ℃培养箱中培养24 h,用游标卡尺精确测量并记录每个药敏纸片抑菌圈直径。以金黄色葡萄球菌(ATCC 25923)为对照菌株。
1.3 数据处理
数据统计与处理采用Excel 2013以及SPSS 17.0,绘图采用Origin 9.0。
2 结果与分析
2.1 特性研究
2.1.1 肠球菌生长曲线绘制
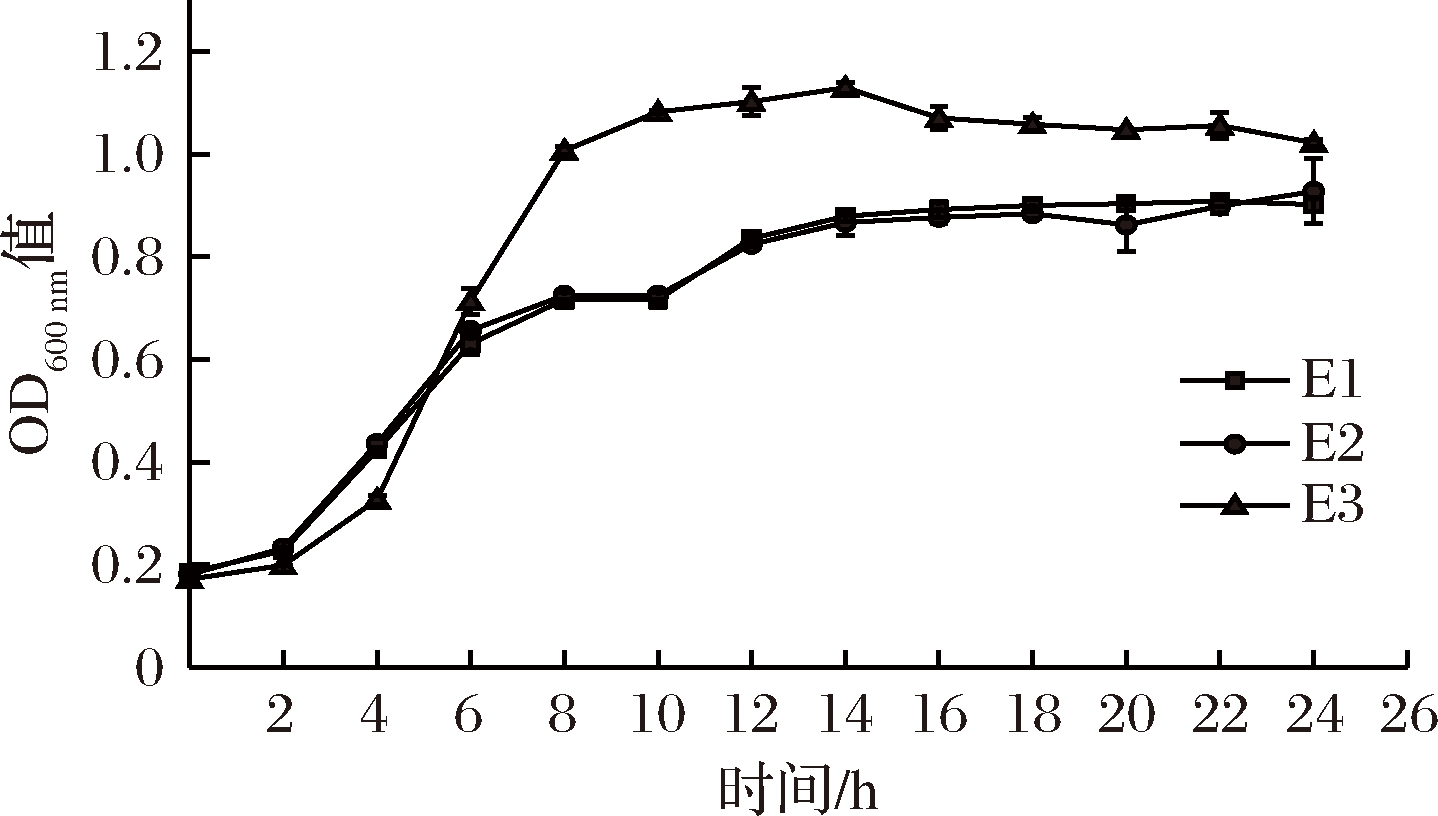
生长曲线的测定有助于了解菌株的生长及代谢情况,由图1可知,肠球菌在0~2 h期间,生长缓慢;2~8 h进入对数生长期;接种12 h后,生长速率减缓,进入了生长稳定期。其中肠球菌E1与E2的生长趋势总体相似,但肠球菌E3在接种6 h后OD600nm值高于另外2株,表明肠球菌E3的生长能力比肠球菌E1和E2强。本研究3株肠球菌的生长趋势与翟梦凯的研究结果一致[14]。
2.1.2 肠球菌产酸能力分析
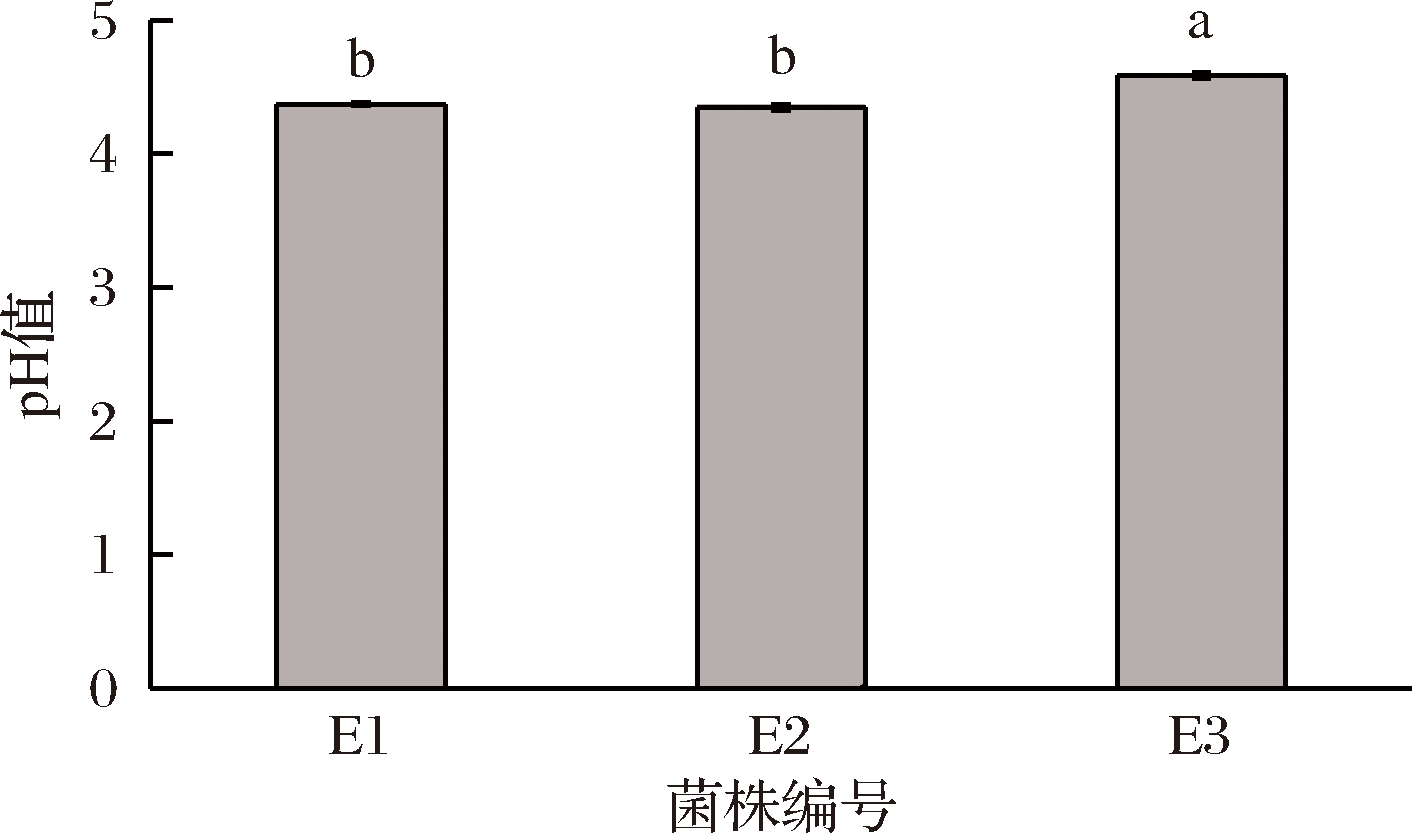
测定培养基体系pH有助于了解肠球菌的产酸能力。由图2可知,肠球菌在含盐MRS培养基上生长24 h后,培养液的pH在4.5左右,肠球菌E1与E2之间没有显著差异(P>0.05),但肠球菌E3略高于其他2株菌。结果表明,3株肠球菌具有较好的产酸能力;肠球菌E1与E2的产酸能力相近,且稍强于肠球菌E3。杨行等[16]对分离自传统发酵酸奶的30株肠球菌产酸能力进行了测定,结果表明,肠球菌产酸体系pH在4.0~5.8之间;王冉等[17]从四川冬菜及发酵液中分离到若干肠球菌,研究表明肠球菌产酸体系pH在培养24 h时大多为4.4左右。与其他来源的肠球菌相比,酱醪源肠球菌同样具有较好的产酸能力。
2.1.3 肠球菌抑菌能力分析
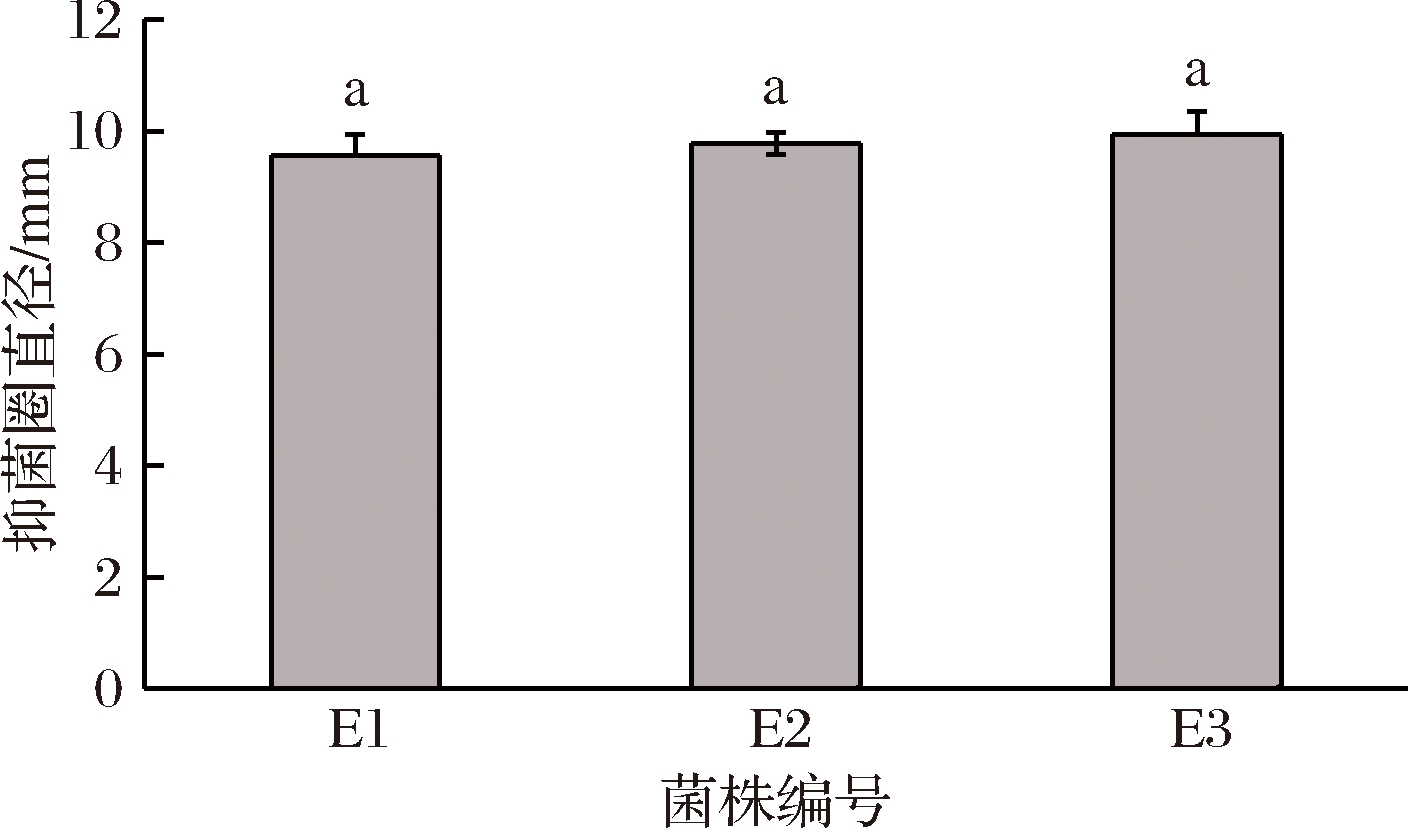
以大肠杆菌(ATCC 25922)和金黄色葡萄球菌(ATCC 25923)作为指示菌测定了肠球菌的抑菌活性。试验菌株对大肠杆菌无明显抑制作用,但能抑制金黄色葡萄球菌的生长,抑菌圈直径在9.50~10.00 mm(图3),3株菌的抑菌能力无显著差异(P>0.05)。郑伟[18]从健康动物粪便中分离的肠球菌对金黄色葡萄球菌无明显抑制作用;周佳[19]从高原奶渣中分离的肠球菌发酵上清液对金黄色葡萄球菌有微弱抑制作用;而翟梦凯[14]所报道的由鸡胆汁中分离的肠球菌对金黄色葡萄球菌的抑菌圈直径为13 mm,说明不同来源的肠球菌在抑菌能力上会有差异,酱醪源肠球菌抑菌能力有一定的优势。
2.2 安全性验证
2.2.1 相关毒力基因分析
肠球菌属的致病性与毒力基因密切相关[13]。采用PCR检测试验菌株的毒力基因,粪肠球菌(CICC 10396)作为阳性对照菌株,毒力基因检测结果如图4所示。3株试验菌株中没有检出肠球菌属常见的6种毒力基因(asa1、cylA、efaA、esp、gelE、hyl);而阳性对照菌株粪肠球菌检出了3种毒力基因efaA(705 bp)、esp(510 bp)、gelE(213 bp)。肠球菌属的毒力基因具有较多种类,以上6种毒力基因分别为聚合物质、溶血素、黏附素、表面蛋白、产胞外酶、透明质酸酶类毒力基因,各菌株含有的毒力基因之间会有一定差异[20]。以上结果表明试验菌株不含有这6种肠球菌属常见的毒力基因,相对安全。该结果与翟梦凯[14]研究结果基本一致。
2.2.2 生物胺与吲哚生成分析
通过氨基酸脱羧酶试验可以检测菌株分解氨基酸生成生物胺的能力。精氨酸、赖氨酸和鸟氨酸经氨基酸脱羧酶作用后分别形成精胺、尸胺和腐胺。过多生物胺类物质积累可引起呕吐、恶心、发烧等食物中毒的症状[21]。吲哚试验可检测试验菌株是否代谢产生色氨酸酶分解色氨酸生成吲哚[15]。色氨酸为人体必需氨基酸,其代谢失调时,会影响免疫及消化功能、引起神经系统功能障碍等[22]。
生物胺与吲哚生成结果如表2所示,阳性对照菌株大肠杆菌的精氨酸、赖氨酸、鸟氨酸脱羧酶试验以及吲哚试验都呈阳性,而肠球菌E1、E2、E3除精氨酸脱羧酶呈阳性外其他试验结果都呈阴性。菌株精氨酸脱羧酶结果为阳性,表明肠球菌可将精氨酸经精氨酸脱羧酶作用生成精胺。精胺为常见的生物胺,在生物体细胞中起到重要的作用[23],精胺没有明确危害健康的作用,但与氮结合会产生亚硝酸盐,也会加强组胺与酪胺的毒性[24]。据报道,食物中存在少量生物胺类物质对人体无明显影响[25]。谷静思[26]发现肠球菌产生物胺总量在20~40 mg/kg左右,考虑到实际生产中的应用,该含量远低于食品中生物胺总量建议摄入量1 000 mg/kg以下[27]。说明本研究肠球菌是相对安全的。
表2 生物胺与吲哚生成结果
Table 2 Test results of bioamine and indole production of
Enterococcus

菌株精氨酸脱羧酶赖氨酸脱羧酶鸟氨酸脱羧酶吲哚试验E1+---E2+---E3+---大肠杆菌++++
注:“+”表示反应呈阳性;“-”表示反应呈阴性
2.2.3 溶血作用分析
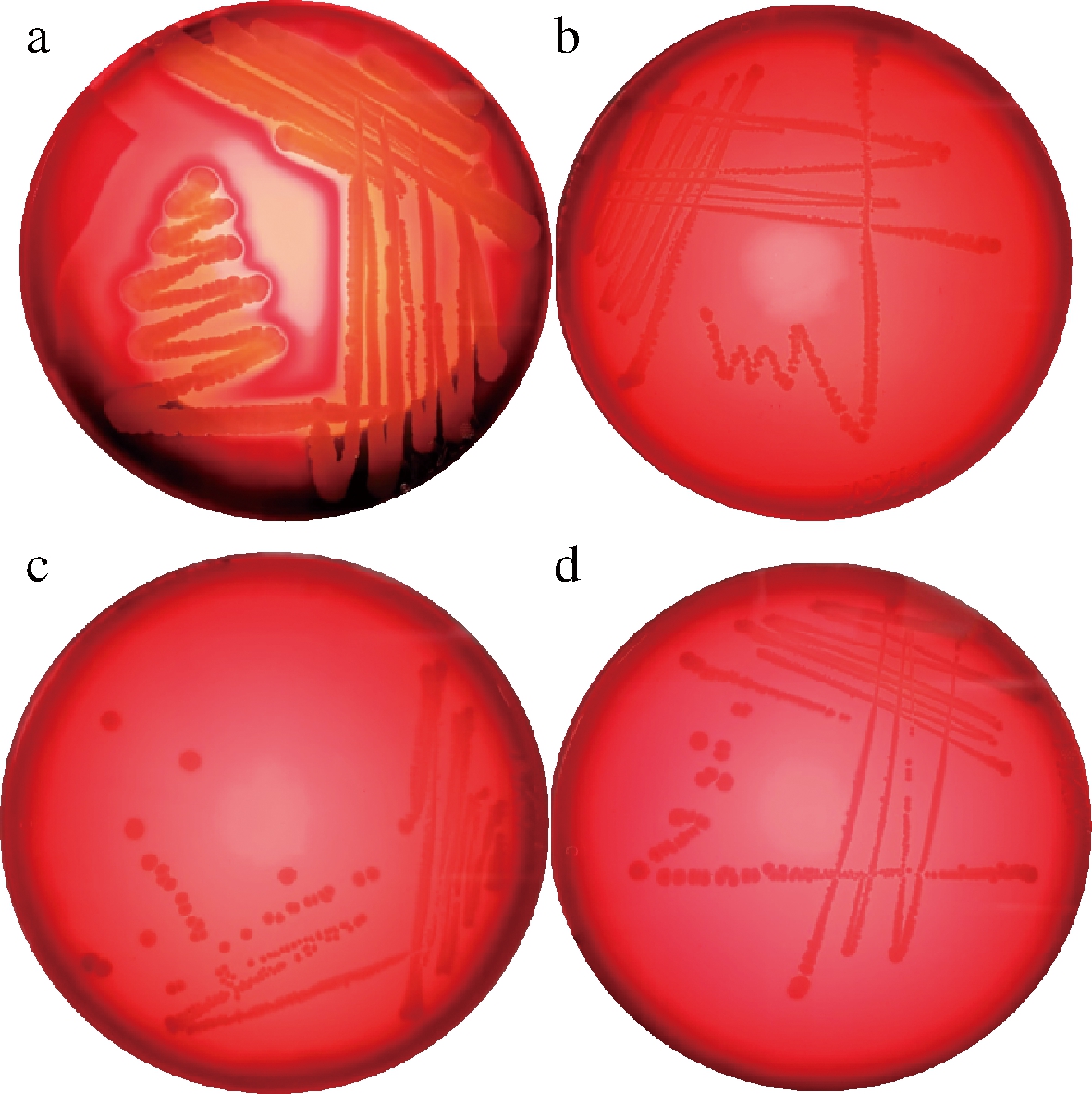
细菌的溶血作用在感染过程中起到重要致病作用[28],本研究溶血试验结果如图5所示。
经哥伦比亚血琼脂培养基37 ℃培养24 h后,阳性对照金黄色葡萄球菌菌落周围显示出透明圈,表现出β-溶血。肠球菌E1、E2、E3菌落周围既无透明圈也无绿色圈,属于没有毒性的γ-溶血,即不会产生溶血作用。结果表明,肠球菌E1、E2、E3在溶血作用方面是安全的,这与王梦姣等[29]的肠球菌溶血试验结果一致。
2.2.4 耐药性分析
抗生素耐药性检测是乳酸菌安全性评价较重要的内容,虽然有少部分学者认为乳酸菌具有一定的耐药性是有利的,因为当人类使用抗生素治疗疾病时不会把人体内的益生菌一同杀灭;但当乳酸菌具有潜在致病性,一旦成为致病原时,它们所具有的耐药性会给治疗带来麻烦[21],因此有必要对试验菌株进行耐药性分析。
试验菌株耐药性试验的抑菌圈直径见表3,参考表4中的解释标准进行结果判断。
由表3可知,金黄色葡萄球菌对6种抗生素敏感;肠球菌E1、E2对3种抗生素敏感(四环素、诺氟沙星、万古霉素),对3种抗生素耐药(青霉素、氨苄西林、红霉素);肠球菌E3对3种抗生素敏感(四环素、红霉素、万古霉素),2种抗生素耐药(青霉素、氨苄西林),1种抗生素中等耐药(诺氟沙星)。对不同菌株同一种抗生素耐药性进行方差分析发现,金黄色葡萄球菌与3株肠球菌对6种抗生素的耐药性有显著差异(P<0.05),3株肠球菌对青霉素、红霉素、诺氟沙星的耐药性呈显著差异(P<0.05),对其余3种抗生素的耐药性无显著差异(P>0.05)。
表3 菌株耐药性试验的抑菌圈直径及试验结果
Table 3 Antibacterial circle diameter and test results of Enterococcus on drug sensitivity
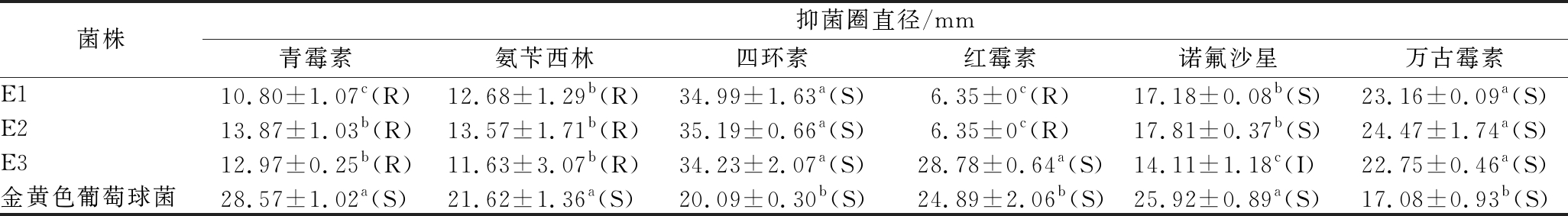
菌株抑菌圈直径/mm青霉素氨苄西林四环素红霉素诺氟沙星万古霉素E110.80±1.07c(R)12.68±1.29b(R)34.99±1.63a(S)6.35±0c (R)17.18±0.08b (S)23.16±0.09a (S)E213.87±1.03b (R)13.57±1.71b(R)35.19±0.66a (S)6.35±0c (R)17.81±0.37b (S)24.47±1.74a (S)E312.97±0.25b (R)11.63±3.07b(R)34.23±2.07a (S)28.78±0.64a(S)14.11±1.18c (I)22.75±0.46a (S)金黄色葡萄球菌28.57±1.02a(S)21.62±1.36a (S)20.09±0.30b (S)24.89±2.06b (S)25.92±0.89a (S)17.08±0.93b(S)
注:括号内字母为耐药性判断结果,S为敏感,I为中介,R为耐药;其中药敏纸片直径为6.35 mm
表4 抑菌圈直径解释标准
Table 4 Interpretive criteria of antibacterial circle
diameter on Enterococcus

药物每片含量抑菌圈直径/mmSIR青霉素10 U≥15/≤14氨苄西林10 μg≥17/≤16四环素30 μg≥1915~18≤14红霉素15 μg≥2314~22≤13诺氟沙星10 μg≥1713~16≤12万古霉素30 μg≥1715~16≤14
3 结论
本研究对分离自酱醪的3株肠球菌进行了特性研究以及安全性验证。相关结果表明:3株肠球菌具有较强的生长力,产酸能力较好且对金黄色葡萄球菌有一定的抑制作用。菌株安全性验证中未检出相关毒力基因,氨基酸脱羧酶试验与吲哚试验除精氨酸脱羧酶为阳性外其余酶均为阴性,无溶血作用,对多种抗生素敏感;系列安全性验证表明这3株肠球菌是相对安全的。后续将对其在酱油发酵的实际生产中发挥提升作用进行更深入研究,为开发酱油中肠球菌资源提供科学理论基础,为酱油酿造提供微生物资源。
参考文献
[1] FISHER K, PHILLIPS C. The ecology, epidemiology and virulence of Enterococcus[J]. Microbiology, 2009, 155(6): 1 749-1 757.
[2] FLAHAUT S, HARTKE A, GIARD J C, et al. Relationship between stress response towards bile salts, acid and heat treatment in Enterococcus faecalis[J]. Fems Microbiology Letters, 1996, 138(1): 49-54.
[3] MORENO M R F, SARANTINOPOULOS P, TSAKALIDOU E, et al. The role and application of enterococci in food and health[J]. International Journal of Food Microbiology, 2006, 106(1): 1-24.
[4] GIRAFFA G. Enterococcal bacteriocins: their potential as anti-Listeria factors in dairy technology[J]. Food Microbiology, 1995, 12(4): 291-299.
[5] 杨小慧. 白酒窖池中益生性乳酸菌的分离筛选及其胞外多糖生物活性研究[D]. 呼和浩特:内蒙古大学,2018.
[6] 曹佳璐. 传统四川泡菜盐水乳酸菌多样性的研究[D]. 北京:中国农业大学,2017.
[7] 南晓芳. 豆豉和腐乳中耐盐乳酸菌的筛选、鉴定及其功能特性研究[D]. 呼和浩特:内蒙古农业大学, 2016.
[8] 胡传旺. 酱油发酵过程微生物群落解析及功能研究[D]. 无锡:江南大学, 2017.
[9] 谢小保, 欧阳友生, 曾海燕, 等. 高盐稀醪酱油发酵原油中微生物区系研究[J]. 微生物学通报, 2007. 34(3): 504-507.
[10] SULAIMAN J, GAN H M, YIN W F, et al. Microbial succession and the functional potential during the fermentation of Chinese soy sauce brine[J]. Frontiers in Microbiology, 2014, 5(3): 556-564
[11] 黄桂东, 唐素婷, 程云辉, 等.酱油渣中乳酸乳球菌分离鉴定及对模拟胃肠环境的耐受性[J]. 食品与机械, 2019, 35(8): 15-19;26.
[12] 王雪艳. 西藏高海拔地区酸奶中乳酸菌分离鉴定及其产酸能力评价[D]. 拉萨:西藏大学, 2016.
[13] 柳青. 具有潜在益生特性乳酸菌的筛选鉴定及其特性研究[D]. 呼和浩特:内蒙古农业大学, 2018.
[14] 翟梦凯. 一株屎肠球菌的益生特性及安全性研究[D]. 泰安:山东农业大学, 2017.
[15] 孟丹, 王丽群, 谢国梁, 等. 一株乳酸乳球菌产γ-氨基丁酸能力及其安全性评价[J]. 中国酿造, 2017, 36(4): 72-77.
[16] 杨行, 王莉, 郭丽君, 等. 新疆喀什地区传统酸奶中乳酸菌的分离鉴定及产酸能力评价[J]. 食品与发酵工业,2020,46(2):102-107.
[17] 王冉, 尹曦, 李小林, 等. 四川冬菜及发酵液中产酸菌的多样性和群落结构[J]. 食品与发酵工业, 2013, 39(9): 1-6.
[18] 郑伟. 屎肠球菌KQ2.6抑菌活性及其安全性研究[D]. 杭州:杭州师范大学, 2016.
[19] 周佳. 肠球菌素SAU-2的纯化和特性研究[D]. 雅安:四川农业大学, 2011.
[20] 王彦杰, 侯强川, 李伟程, 等. 不同分离源粪肠球菌的毒力基因比较[J]. 微生物学通报, 2018, 45(12): 2 695-2 707.
[21] 张灼阳, 刘畅, 郭晓奎. 益生菌的安全性[J]. 微生物学报, 2008, 48(2): 257-261.
[22] 李剑欣, 张绪梅, 徐琪寿. 色氨酸的生理生化作用及其应用[J]. 氨基酸和生物资源, 2005, 27(3): 58-62.
[23] 王光强, 俞剑燊, 胡健, 等. 食品中生物胺的研究进展[J]. 食品科学, 2016, 37(1): 269-278.
[24] 孟甜. 乳酸菌产生物胺的鉴定及食品中生物胺的检测[D]. 无锡:江南大学, 2010.
[25] 谢辉, 魏琳, 肖艳云, 等.食品多胺含量及人类健康研究综述[J]. 农业与技术, 2015, 35(13): 1-2;10.
[26] 谷静思. 传统发酵臭豆腐中微生物菌相结构解析及其与生物胺形成的关系[D]. 杭州:浙江大学, 2018.
[27] 李雄波, 邓维琴, 万萍, 等. 豆瓣酱中生物胺研究进展[J]. 中国调味品, 2019, 44(3): 180-184.
[28] 马碧书, 马丽娜, 林旭瑷, 等. 细菌溶血素毒性和致病机制研究进展[J]. 中国人兽共患病学报, 2018, 34(2): 175-181.
[29] 王梦姣, 李少英, 李淑芬, 等.马奶及其制品中肠球菌属乳酸菌的安全性评价[J]. 食品科学, 2014, 35(17): 204-208.