镰刀菌(Fusarium spp.)是引起大麦、玉米等谷物赤霉病的主要菌株,并且会在侵染谷物的同时产生多种真菌毒素,如脱氧雪腐镰刀菌烯醇(deoxynivalenol, DON)及其衍生化物15-乙酰基脱氧雪腐镰刀菌烯醇(15-acetyl-deoxynivalenol, 15ADON)等[1]。在食品加工过程中,谷物中的真菌毒素难以完全去除,毒素因此残留在产品中,引起食品安全问题[2-4]。例如使用感染了镰刀菌的大麦制备啤酒麦芽时,虽然大部分毒素会在浸麦时被洗去,但大麦内部的镰刀菌会在大麦发芽期间大量繁殖并进一步产生DON等真菌毒素。含有真菌毒素的麦芽如果误用于啤酒生产,不仅影响啤酒产品的品质,也危害消费者的健康安全。目前常用喷洒化学杀菌剂的方法来降低谷物中真菌及真菌毒素的危害,但是化学杀菌剂的滥用又会造成严重的环境污染问题。因此,研究人员开发了许多相对安全的方法来代替化学杀菌剂[3, 5-6],例如辐射处理[7],加入白地霉[8]等有益微生物,但是辐射处理难以规模化,引入微生物也可能产生棒麦角碱等物质,造成二次污染,导致未能实现规模化应用。因此,开发新型的绿色有效的抗真菌剂是当前研究的重点。
精油(essential oils, EOs)是一种天然的杀菌剂,许多精油例如肉桂油[9]和百里香油[10]等被证明具有较好的广谱抗菌活性。此外,精油具有可生物降解性,高挥发性和低残留等特性,不会对生态环境产生负面影响,因此,可作为绿色抗真菌剂的重要来源之一[11]。目前关于精油抑制谷物中真菌毒素产生的研究大多采用熏蒸的方式,袁媛等[9]采用熏蒸的方法发现山苍子油和丁香油的主要成分(柠檬醛和丁香酚)对禾谷镰刀菌(Fusarium graminearum)具有较好的抑制效果,在1.5 mg/g的质量分数下对禾谷镰刀菌产DON的抑制率分别达到98.33%和95.64%。然而,精油通常不是水溶性的,这导致它在水溶性食品方面难以应用,一种较好的方法是将精油制备成乳液,以提高精油的水溶性和稳定性[12]。目前已经有很多关于精油乳液在食品防腐保鲜方面应用的研究[13],近年来研究人员也开始关注其在抑制镰刀菌产生真菌毒素方面的潜力。KALAGATUR等[14]将鲁沙香茅油包封入壳聚糖制备成纳米乳液,700 μg/g的乳液完全抑制禾谷镰刀菌产生玉米赤霉烯酮。但是精油乳液对镰刀菌及真菌毒素抑制作用的研究总体较少,精油作为抗真菌剂的应用需要更进一步的研究。
实验选择了国内常见的4种具有较好抑菌作用的精油:丁香油(clove oil)、肉桂油(cinnamon oil)、牛至油(origanum oil)和山苍子油(Litsea cubeba oil),以卵磷脂作为乳化剂,添加中链甘油三酯(medium chain triglycerides, MCT)作为奥氏熟化抑制剂来制备纳米乳液。通过研究乳液对菌丝生长的抑制、菌丝损伤及生物量的抑制评估其对禾谷镰刀菌的抑制作用,并通过检测禾谷镰刀菌在大麦培养基中产生的2种真菌毒素(DON和15ADON)的含量评估了纳米乳液对真菌毒素的抑制作用,以期为基于植物精油的新型抑菌防霉剂的开发提供理论支持。
1.1.1 菌株
禾谷镰刀菌(Fusarium graminearum)Fg-4为实验室保藏,分离自感染赤霉病的大麦。
1.1.2 培养基
PDA培养基:取200 g去皮土豆,加入1 000 mL蒸馏水,蒸煮约20~30 min,纱布过滤,滤液加入20 g葡萄糖,20 g琼脂,定容至1 000 mL,121 ℃灭菌20 min;绿豆培养基(mung bean agar, MBA):4%的绿豆加入蒸馏水,煮沸30 min,纱布过滤后加入2%的琼脂,定容后121 ℃灭菌20 min;羧甲基纤维素钠培养基:取15.0 g羧甲基纤维素钠(CMC-Na)用热水溶解,加入1.0 g KNO3、1.0 g NH4H2PO4、0.5 g MgSO4·7H2O和1.0 g酵母粉,定容至1 000 mL,121 ℃灭菌20 min;大麦培养基:称取80 g大麦在烧杯中浸泡过夜,吸干多余水分后121 ℃灭菌1 h。
1.1.3 试剂及仪器
卵磷脂(纯度≥80%)、肉桂油(纯度≥95%)和牛至油(纯度≥95%)、麦克林、山苍子油(纯度≥95%)、中链甘油三酯(纯度≥98%),上海源叶生物;丁香油(纯度≥85%)及其他试剂,国药集团,滤布Miracloth(孔径:22~25 μm),Millipore公司。
三重四级杆气质联用仪(TSQ8000),赛默飞世尔科技有限公司;高压均质机(PANDA PLUS 200C),GEA公司;纳米粒度及zeta电位分析仪(Nano-ZSE),英国马尔文;手持式匀浆机(T30K),上海班诺生物科技有限公司;高效液相色谱仪(Agilent 1260),美国安捷伦公司;扫描电子显微镜(Quanta 200),荷兰FEI公司。
1.2.1 纳米乳液的制备
乳化剂的制备:取1 g卵磷脂溶于91 g 10 mmol/L乙酸盐缓冲液(pH 3.0),冰浴搅拌溶解(2~3 h),使用双层滤布过滤。
纳米乳液的制备:92 g乳化剂溶液与8 g油相混合,混合体系100 g,使用手持式均质机在32 000 r/min下均质2 min,然后通过高压均质机,在压力100 MPa下以9 L/h的速度循环均质1 min。
1.2.2 粒径测量
参考WU等[15]的方法使用纳米粒度及zeta电位分析仪测量纳米乳液的平均粒径和粒径分布。
1.2.3 纳米乳液对禾谷镰刀菌菌丝生长的抑制作用
1.2.3.1 菌丝抑制率的测定
将乳液使用乙酸盐缓冲液分别稀释至0、1、2.5、5、10、20、30和40 mg/g(精油/乳液),取100 μL稀释后的乳液涂布于PDA平板,等量的乙酸盐缓冲液作为空白对照,取在PDA平板上活化4 d的禾谷镰刀菌,用打孔器打一直径6 mm的新鲜菌饼,接种于涂布乳液的平板,27℃培养4 d后测量菌丝直径,按公式(1)计算菌丝抑制率(mycelial growth inhibition, MGI):
(1)
1.2.3.2 扫描电子显微镜分析
参考WU等[16]的方法使用扫描电子显微镜(scanning electron microscope, SEM)观察纳米乳液对真菌菌丝体的破坏作用。
1.2.4 纳米乳液在产毒模型抑制真菌毒素积累
(1)孢子液制备
接种适量菌丝于PDA平板,27 ℃培养4 d,用打孔器在菌落外围打一块新鲜菌饼,接种于MBA平板中央,27 ℃培养7 d,用无菌小刀划碎MBA平板,取适量琼脂块接种于CMC培养基,30 ℃ 200 r/min培养2 d,菌液用无菌纱布过滤,滤液7 500 r/min离心5 min,弃去上清液,收集孢子溶于CMC培养基,用血球计数板计数,用CMC培养基将孢子液稀释至106个/mL用于产毒实验。
(2)产毒实验
取4 mL稀释好的孢子液加入80 g已灭菌的大麦培养基中,加入16 mL稀释后的乳液,同等体积的乙酸盐缓冲液作为空白对照,置于恒温恒湿箱内于95%的湿度下28 ℃产毒7 d。产毒结束后样品冷冻干燥,粉碎后用于真菌毒素及麦角固醇的测定。
1.2.5 真菌毒素含量测定
参考WAN等[17]的方法对大麦中的真菌毒素进行提取、净化及衍生化。
GC-MS分析:取2 μL衍生化的提取物,在300 ℃下以不分流模式进行;温度最初在150 ℃保持1 min,之后以10 ℃/min的速率上升至280 ℃,之后以30 ℃/min的速率上升至310 ℃,最后在310 ℃保持5 min;电子冲击能量调至-70 eV;以SIM的方式进行GC-MS分析,20 min开始检测离子碎片,20~21.5 min检测325.2与295.2,为DON的特征离子,21.5~22.6 min检测377.2与392.5,为15-ADON的特征离子,22.6~25 min检测237.2与271.9,为内标灭蚁灵(Mirex)的特征离子。
1.2.6 麦角固醇含量测定
麦角固醇的提取及测定方法参考滑慧娟[18]及DOHNAL等[19]的方法并稍作修改。
碱性钾醇溶液:取20 g KOH溶于50 mL甲醇和150 mL乙醇的混合醇溶液。
取250 mg粉碎的谷物于10 mL离心管,加入2 mL碱性钾醇溶液,70 ℃下皂化反应1 h;自然冷却至室温,加入0.5 mL蒸馏水及1 mL正己烷,涡旋5 s;4 000 r/min离心12 min,取上层正己烷于一个新离心管中;下层加入1 mL正己烷重复萃取2次;合并收集的正己烷层氮气吹干:样品复溶于400 μL无水乙醇,过0.22 μm有机系针头式滤器,待HPLC分析。
HPLC分析:色谱柱Agilent Eclipse XDB-C18,0.5 μm×4.6 mm×250 mm;流动相甲醇;流速:1 mL/min;柱温30 ℃;进样量20 μL;检测波长282 nm。
所有实验均至少测定3次,使用SPSS Statistics 25软件进行差异显著性分析,使用Origin 2017作图。
将4种植物精油以质量分数8%的比例与乳化剂溶液混合后,通过高速搅拌均质及高压均质的方法制得纳米乳液,4种乳液的粒径分布图如图1所示。其中丁香油乳液和山苍子油乳液呈现了较好的单峰分布,平均粒径分别为116.9和203.9 nm,肉桂油乳液和牛至油乳液的粒径为多峰分布,然而这种多峰分布是极不稳定的,在室温放置1 d后出现了油相的分层,这种现象被称为奥斯特瓦尔德熟化现象,即体系内小液滴增长为大液滴进而出现油相分离。

图1 四种精油纳米乳液的粒径分布图
Fig.1 Particle size distribution of four kinds of essential oil nanoemulsions
为了抑制奥斯特瓦尔德熟化现象,在油相中添加质量分数50%的中链甘油三酯(medium chain triglycerides, MCT)作为奥氏熟化抑制剂[17],即4 g精油与4 g MCT混合后再与92 g乳化剂溶液均质,分别得到肉桂油/MCT乳液和牛至油/MCT乳液。添加MCT后制备乳液的粒径分布图如图2所示。由图2可知,加入MCT后制备乳液的粒径呈单峰分布,制得的肉桂油/MCT乳液的平均粒径为168.5 nm,牛至油/MCT乳液平均粒径为206.0 nm。在室温贮藏过程中,乳液分散均匀,具有很好的稳定性。
为了使所得纳米乳液更好地在食品工业中应用,必须保证乳液在贮藏和使用过程中的稳定性。将丁香油乳液(clove oil emulsion, CE)、肉桂油/MCT乳液(cinnamon oil /MCT emulsion, CME)、牛至油/MCT乳液(origanum oil /MCT emulsion, OME)和山苍子油乳液(Litsea cubeba oil emulsion, LE)在室温储存21 d,测定乳液平均粒径和粒径分布的变化(图3)。
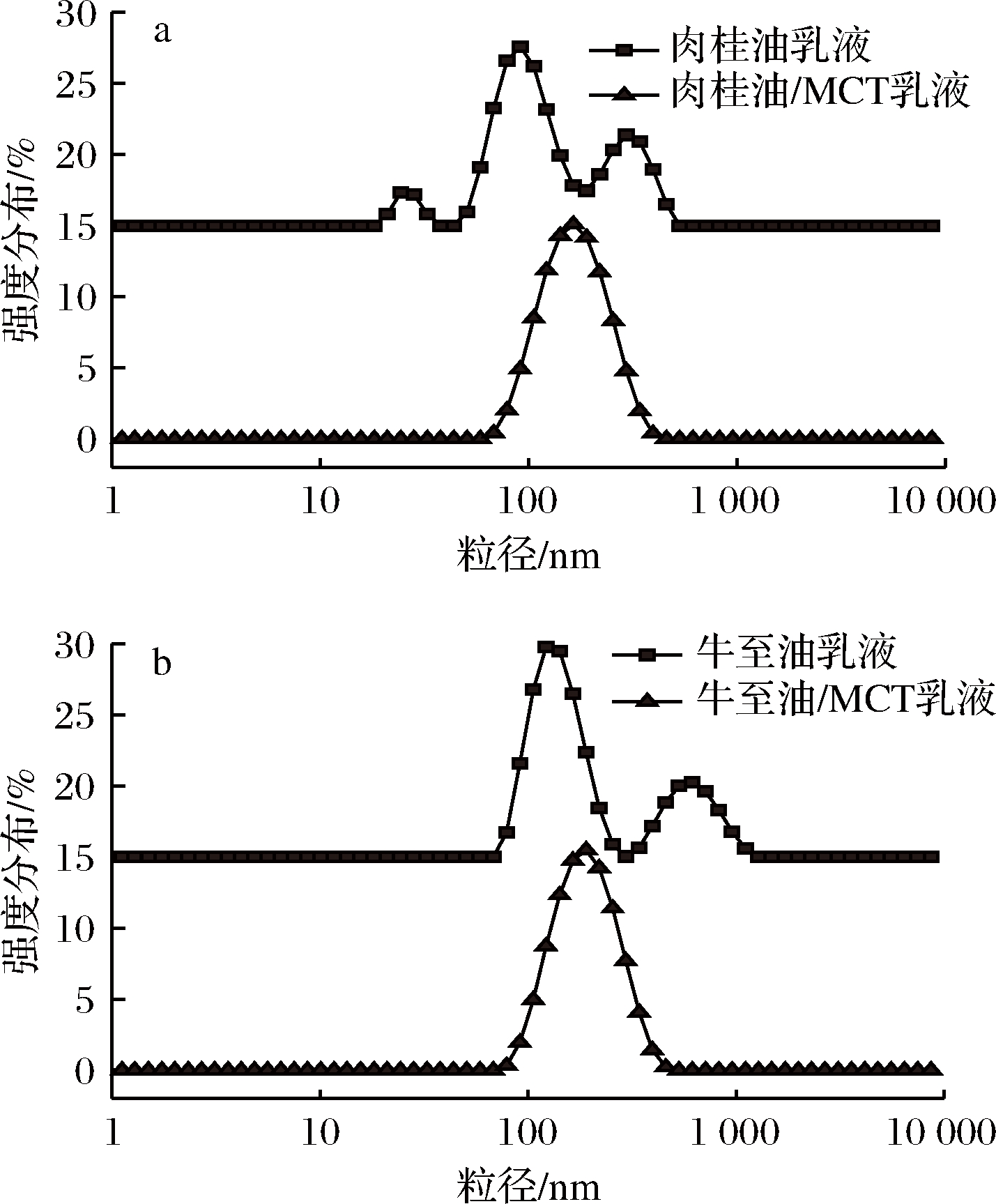
a-肉桂油组;b-牛至油组
图2 添加MCT对肉桂油乳液和牛至油乳液粒径分布的影响
Fig.2 Particle size distribution of cinnamon oil emulsion and oregano oil emulsion before and after adding MCT
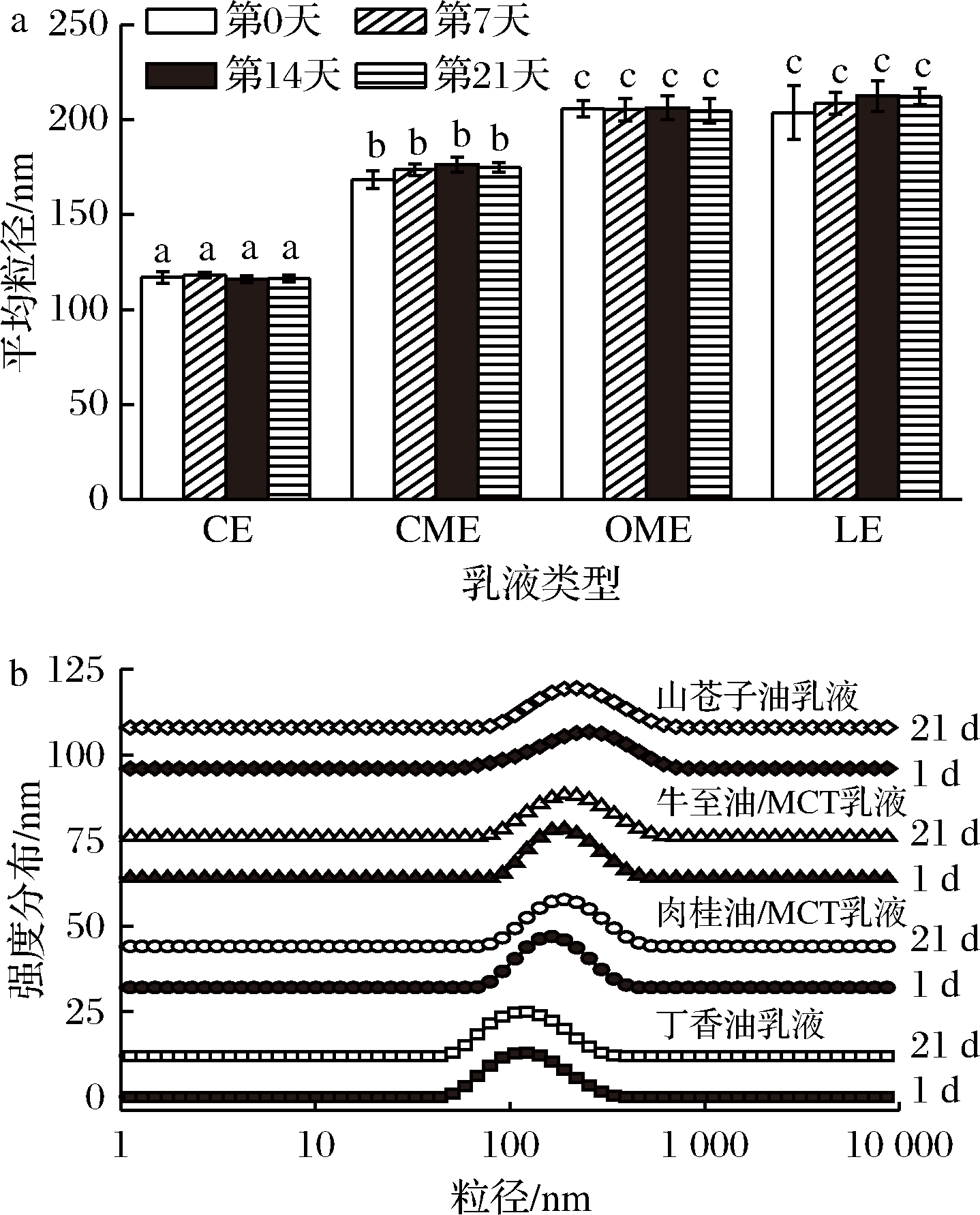
a-平均粒径变化;b-粒径分布变化;CE-丁香油乳液;CME-肉桂油/MCT乳液;OME-牛至油/MCT乳液;LE-山苍子油乳液(下同) 图3 四种乳液在室温下储存21 d后平均粒径大小和粒径分布的变化
Fig.3 Evolution of the mean particle diameter and particle size distribution of four emulsions after 21 days storage at room temperature
注:相同小写字母表示两者差异不显著,不同小写字母
表示两者之间差异显著(P<0.05)(下同)
如图3-a所示,4种乳液的平均粒径在21 d的储藏期内差异不显著,也未观察到油相分离或者絮凝的现象。将21 d后的乳液与新鲜制备的乳液的粒径分布进行对比(图3-b),2者的粒径分布没有明显差异,也没有出现大液滴的分布,表明本研究制备的4种纳米乳液具有较好的储存稳定性。
通过平板抑菌法评估4种乳液在不同浓度下对禾谷镰刀菌菌丝的抑制作用,不同浓度下乳液对禾谷镰刀菌的MGI如图4所示。4种乳液的MGI随着乳液质量分数的上升而不断增加,在20~40 mg/g的范围内,牛至油/MCT乳液对禾谷镰刀菌菌丝生长的抑制效果最为显著,其次是丁香油乳液和肉桂油/MCT乳液,山苍子油乳液的抑制效果最差,40 mg/g的丁香油乳液、肉桂油/MCT乳液、牛至油/MCT乳液和山苍子油乳液对禾谷镰刀菌的MGI分别为79.1%、66.2%、100.0%和25.8%。

图4 不同质量分数的4种乳液对禾谷镰刀菌菌丝生长的抑制作用
Fig.4 Influence of four emulsions in different concentrations on the mycelial growth inhibition in F. graminearum
使用扫描电子显微镜观察4种乳液对禾谷镰刀菌菌丝体的破坏作用。正常真菌菌丝体通常表面光滑均一,而受损伤的菌丝体由于细胞质内容物的流失,菌丝表面往往变粗糙并发生皱缩,甚至出现细胞膜的破损,从而会出现菌丝老化或死亡的现象[20]。如图5所示,对照组的单一菌丝体表面光滑饱满,粗细均匀,具有正常的形态。而使用4种纳米乳液处理的菌丝相比对照组均发生了变形,菌丝表面粗糙不平并发生致密皱缩和凸起,表明4种精油乳液均对禾谷镰刀菌菌丝体具有一定的抑制作用。
麦角固醇是一种真菌活性物质,是构成真菌细胞壁的主要成分,由于植物中不含有麦角固醇,因此可以通过麦角固醇含量来评估谷物中的真菌生物量[20]。将4种乳液使用乙酸盐缓冲液进行稀释,使其在大麦培养基中的质量分数为0.3 mg/g(精油/大麦,下同)和1.5 mg/g,2种质量分数下丁香油乳液、肉桂油/MCT乳液、牛至油/MCT乳液和山苍子油乳液在产毒模型中对麦角固醇的抑制情况如图6所示。其中高质量分数下的肉桂油/MCT乳液的抑制效果最为显著,其麦角固醇的抑制率可达98.9%,其次是丁香油乳液和牛至油/MCT乳液,山苍子油乳液对麦角固醇的抑制效果最差,1.5 mg/g的山苍子油乳液的抑制率仅为41.7%。
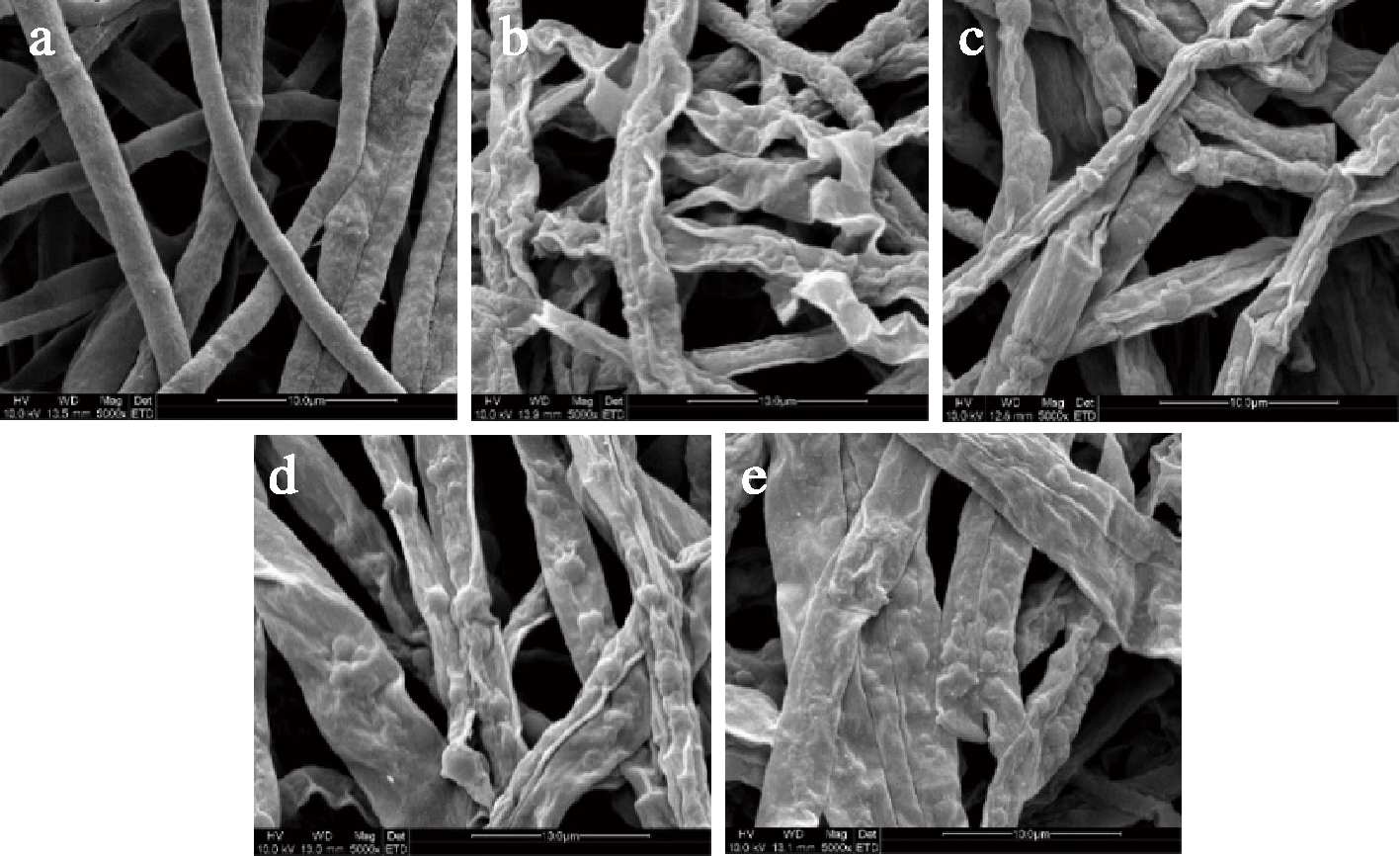
a-乙酸盐缓冲液处理后的菌丝;b-丁香油乳液处理后的菌丝;c-肉桂油/MCT乳液处理后的菌丝;d-牛至油/MCT乳液处理后的菌丝;e-山苍子油乳液处理后的菌丝
图5 扫描电子显微镜观察4种乳液和对照处理的禾谷镰刀菌菌丝
Fig.5 Scanning electron microscopic observation of mycelium of F. graminearum treated by four emulsions and control
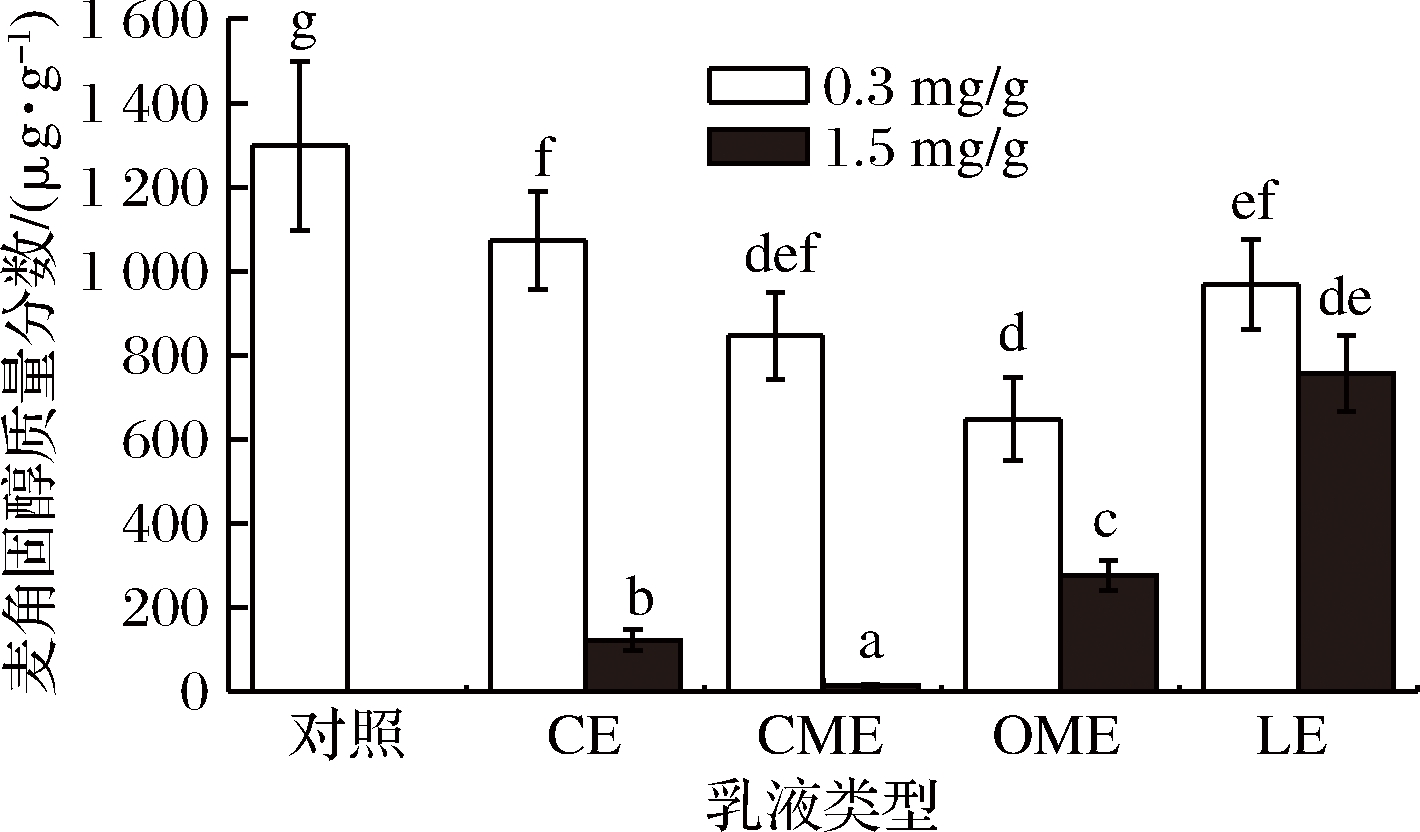
图6 两种质量分数下4种乳液对真菌麦角固醇的抑制作用
Fig.6 Inhibitory effects of four emulsions on fungal ergosterol at two concentrations
利用固相净化柱结合GC-MS的方法测定产毒实验中2种B型单端孢霉烯族毒素(DON和15ADON)的含量,2种质量分数下4种纳米乳液对禾谷镰刀菌产生DON及15ADON的抑制情况如图7所示。其中,肉桂油/MCT乳液抑制毒素产生的效果最好,在0.3 mg/g的质量分数下实现对DON和15DON的显著抑制,抑制率分别达98.8%和96.6%,丁香油乳液和牛至油/MCT乳液对2种毒素的抑制效果随着乳液质量分数的上升而增加,这也和乳液对麦角固醇表征的生物量的抑制情况相对应,证明丁香油和牛至油主要通过抑制真菌生长来降低毒素含量。在1.5 mg/g的质量分数下丁香油乳液对禾谷镰刀菌产生DON和15ADON的抑制率分别为98.8%和99.8%,1.5 mg/g的牛至油/MCT乳液对2种毒素的抑制率分别为93.9%和99.7%,基本实现对真菌毒素的完全抑制。
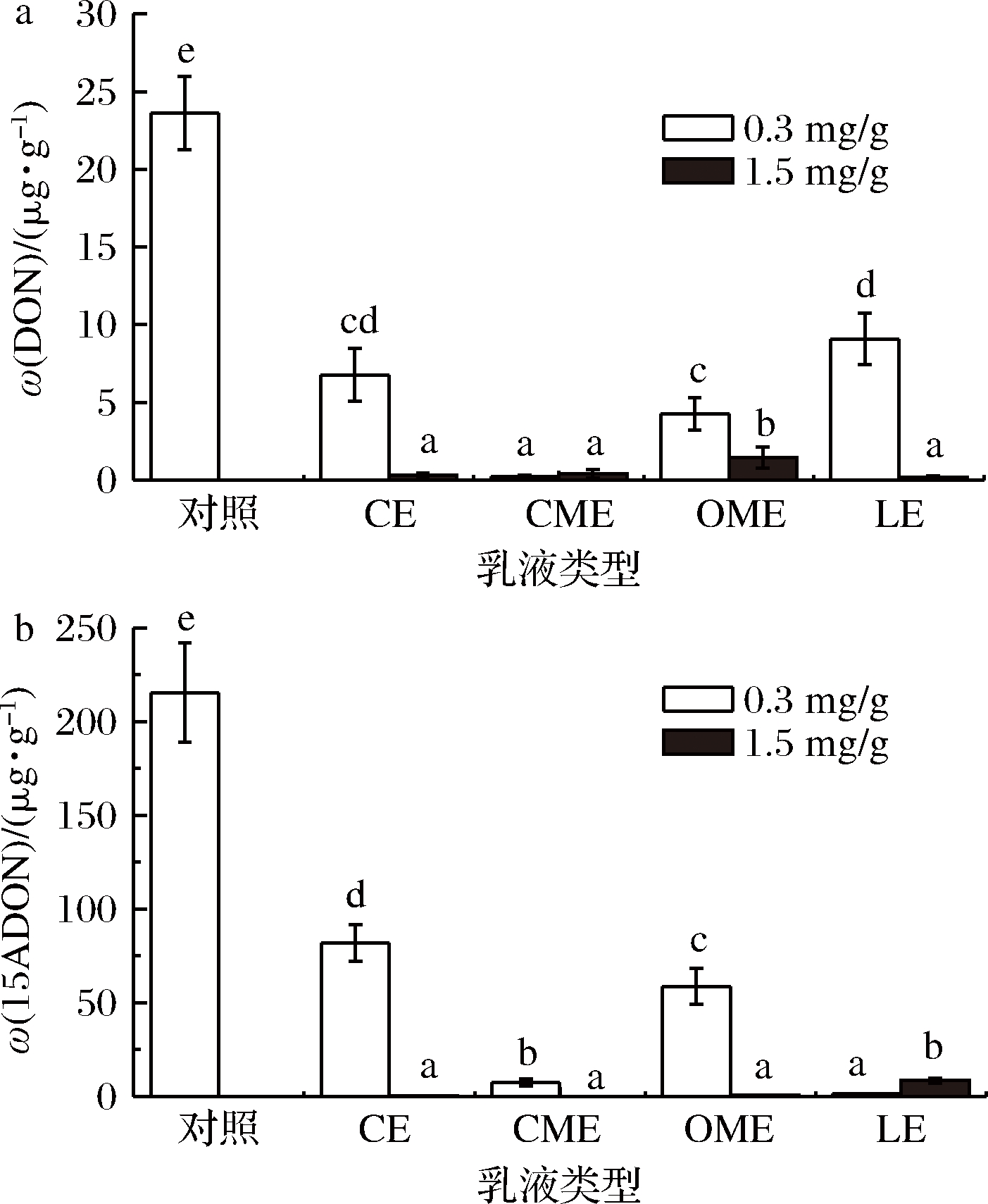
a-DON;b-15ADON
图7 两种质量分数下4种乳液对真菌毒素的抑制作用
Fig.7 Inhibitory effect of four emulsions on mycotoxins at two concentrations
另外,山苍子油乳液对禾谷镰刀菌生物量的抑制效果较差(图6),但其在0.3 mg/g质量分数下对15ADON产生的抑制率达99.4%,同其他3种精油乳液抑制效果相比较为显著,对DON的抑制率也处于较好的水平,达到61.6%;0.3 mg/g的肉桂油/MCT乳液对麦角固醇的抑制率仅为34.81%,却对2种毒素的抑制率高达99.2%和96.6%,说明精油可以不依靠抑制真菌生物量而抑制毒素的产生,这与FERREIRA等[21]和LIANG等[22]的研究类似。1.5 mg/g的山苍子油乳液对这2种毒素的抑制率分别为99.3%和96.1%,然而随着乳液质量分数从0.3 mg/g增加至1.5 mg/g,15ADON的含量从1.27 μg/g显著增加至8.37 μg/g,这可能是随着乳液质量分数的升高,山苍子油乳液对禾谷镰刀菌毒素的表达造成影响,通过降低分泌型酯酶的表达使得禾谷镰刀菌更多地产生15ADON而不是DON[23]。
本研究将丁香油、肉桂油、牛至油和山苍子油通过高速搅拌结合高压均质的方法分别制备成纳米乳液,乳液组分为质量分数为1%的卵磷脂、8%的油相(丁香油及山苍子油为纯精油,肉桂油和牛至油为精油与MCT 1∶1比例混合)及91%的去离子水,制得的乳液平均粒径分别为116.9、168.5、206.0和203.9 nm,经室温储存实验表明,4种乳液在21 d内均展现了较好的储存稳定性;对菌丝生长和麦角固醇抑制实验的结果表明,4种乳液对禾谷镰刀菌的生长具有不同程度的抑制作用,其中40 mg/g的肉桂油/MCT乳液对禾谷镰刀菌的MGI达66.2%,在1.5 mg/g的质量分数下对大麦培养基中麦角固醇的抑制率可达98.9%;精油乳液在大麦培养基中产毒实验结果表明,不同质量分数的4种乳液对禾谷镰刀菌产生真菌毒素(DON和15ADON)均具有较好的抑制作用。
大麦麦芽是啤酒酿造的主要原料,而大麦在田间收割和储藏期间以及麦芽制备过程中容易感染禾谷镰刀菌并产生DON及其衍生物等真菌毒素,这不仅影响大麦的品质和产量,也给啤酒行业带来食品安全风险[24]。因此,下一步将选择抑制真菌生长和毒素产生效果较好的精油乳液,研究其在啤酒麦芽制备过程中的应用工艺,从而降低麦芽和成品啤酒中真菌毒素的含量,提高成品啤酒的品质和食品安全。
[1] 杨术鹏.镰刀菌毒素及其隐蔽型形式的代谢研究[D].北京:中国农业大学,2016.
[2] VOSS K A,SNOOK M E.Stability of the mycotoxin deoxynivalenol (DON) during the production of flour-based foods and wheat flake cereal[J].Food Additives and Contaminants Part a-Chemistry Analysis Control Exposure & Risk Assessment,2010,27(12):1 694-1 700.
[3] 金昭.啤酒酿造过程中脱氧雪腐镰刀菌烯醇的初步研究[D].无锡:江南大学,2009.
[4] PASCARI X,RAMOS A J,MARIN S,et al.Mycotoxins and beer. Impact of beer production process on mycotoxin contamination. A review[J].Food Research International,2018,103:121-129.
[5] LUO Y,LIU X,LI J.Updating techniques on controlling mycotoxins - A review[J].Food Control,2018,89:123-132.
[6] TEMBA B A,SULTANBAWA Y,KRITICOS D J,et al.Tools for defusing a major global food and feed safety risk: nonbiological postharvest procedures to decontaminate mycotoxins in foods and feeds[J].Journal of Agricultural and Food Chemistry,2016,64(47):8 959-8 572.
[7] 王锋.黄曲霉毒素B1的辐射降解机理及产物结构特性分析[D].北京:中国农业科学院,2012.
[8] 罗炜, 宋春艳, 李彦林,等.抑制呕吐毒素生物合成的乳酸菌的筛选及鉴定[J].食品与发酵工业,2018,44(9):41-47.
[9] 袁媛.植物精油熏蒸控制玉米中真菌毒素的研究[D].北京:中国农业科学院,2013.
[10] 张珊珊.乳液模板—层层自组装百里香微胶囊制备、缓释和抑菌效果的研究[D].武汉:华中农业大学,2018.
[11] 李燕君, 孔维军, 李梦华,等.植物精油抑制真菌及真菌毒素的研究进展[J].中草药,2016,47(11):2 011-2 018.
[12] RAO J,CHEN B,MCCLEMENTS D J.Improving the efficacy of essential oils as antimicrobials in foods: mechanisms of action[J].Annual Review of Food Science and Technology,2019,10(1):365-387.
[13] 汤友军,鲁晓翔.植物精油稳定性的改善及其在食品中应用研究进展[J/OL].食品工业科技:1-10[2019-12-16].http://kns.cnki.net/kcms/detail/11.1759.TS.20191022.1025.009.html.
[14] KALAGATUR N K,GHOSH O S N,SUNDARARAJ N,et al.Antifungal activity of chitosan nanoparticles encapsulated with cymbopogon martinii Essential oil on plant pathogenic fungi Fusarium graminearum[J].Frontiers in Pharmacology,2018,9:610-623.
[15] WU D H,WAN J,LU J,et al.Chitosan coatings on lecithin stabilized emulsions inhibit mycotoxin production by Fusarium pathogens[J].Food Control,2018,92:276-285.
[16] WU D H,LU J,ZHONG S B,et al.Influence of nonionic and ionic surfactants on the antifungal and mycotoxin inhibitory efficacy of cinnamon oil nanoemulsions[J].Food & Function,2019,10(5):2 817-2 827.
[17] WAN J,ZHONG S,SCHWARZ P,et al.Influence of oil phase composition on the antifungal and mycotoxin inhibitory activity of clove oil nanoemulsions[J].Food & Function,2018,9(5):2 872-2 882.
[18] 滑慧娟.挥发性植物精油抑制赭曲霉生长及产毒的研究[D].北京:中国农业科学院,2015.
[19] DOHNAL V,JEZKOVA A,PAVLIKOVA L,et al. Fluctuation in the ergosterol and deoxynivalenol content in barley and malt during malting process[J].Analytical and Bioanalytical Chemistry,2010,397(1):109-114.
[20] 孙琦.肉桂醛对黄曲霉菌生长和产毒的影响机制研究[D].北京:中国农业科学院,2016.
[21] FERREIRA F M D, HIROOKA E Y, FERREIRA F D,et al. Effect of Zingiber officinale Roscoe essential oil in fungus control and deoxynivalenol production of Fusarium graminearum Schwabe in vitro[J]. Food Additives and Contaminants Part a-Chemistry Analysis Control Exposure & Risk Assessment,2018,35(11):2 168-2 174.
[22] LIANG D,XING F,SELVARAJ J N,et al.Inhibitory effect of cinnamaldehyde, citral, and eugenol on aflatoxin biosynthetic gene expression and aflatoxin B-1 biosynthesis in Aspergillus flavus[J].Journal of Food Science,2015,80(12):M2917-M2924.
[23] 范三红, 胡小平.小麦赤霉菌毒素合成机制及检测技术研究进展[J].麦类作物学报,2018,38(3):348-357.
[24] SCHWARZ P B.Fusarium head blight and deoxynivalenol in malting and brewing: successes and future challenges[J]. Tropical Plant Pathology,2017,42(3):153-164.