丙戊酸(valproic acid,VPA)是目前治疗癫痫最常用的药物之一[1],而肝毒性是其应用过程中最严重的并发症之一,一种类型是可逆性肝功能不全,另一种类型的肝损害是不可逆性的肝中毒甚至死亡[2-3],实验表明,孕期服用VPA的含量与胎儿致畸程度、认知及社交障碍正相关,并且对子代的免疫系统和肝脏功能也同样具有一定的影响[4]。结合RODIER等[5]在1996年首次通过大鼠子宫暴露VPA得到子代自闭症(autism spectrum disorder,ASD)大鼠,因其所得ASD大鼠与临床症状相似,孕期高浓度VPA干预已成为获取ASD模型动物的常用造模方法。
ASD患者常伴随胃肠道功能紊乱,与ASD严重程度呈正相关,多表现为肠漏、便秘、腹泻、食道反流、腹痛和胀气等症状[6]。当肠道微生态系统失衡,肠道黏膜屏障受损时,肠道微生物代谢产物包括内毒素、氨、吲哚、酚类、短链脂肪酸、假性神经递质前体、炎症介质等透过肠道屏障进入肠系膜淋巴组织,过度激活机体免疫系统,引起异常免疫反应,导致肝细胞凋亡、坏死。此外,来自肠道中的各种毒素需要由肝脏清除,同时肝脏还能清除肠源性细菌、真菌等,更加重了肝功能受损[7]。已有研究表明益生菌可以通过对肠道微生态系统的维护,降低内毒素和血氨等浓度,缓解肝脏的损伤,改善肝脏代谢功能[8]。
本研究通过孕期高浓度VPA暴露获得ASD大鼠,考察从断乳后到性成熟嗜酸乳杆菌La28干预对孕期VPA暴露引起的子代大鼠外周炎症和肝功能的作用,为筛选出更适合ASD患儿发育过程的益生菌提供参考。
1 材料与方法
1.1 实验材料
1.1.1 实验菌种及培养基
嗜酸乳杆菌(Lactobacillus acidophilus)La28来自于菌种保藏中心,菌株分离自健康人肠道。
Wistar大鼠(雄性5只,初始体质量280~290 g;雌性10只,初始体质量220~250 g),北京维通利华实验动物技术有限公司。本研究经江南大学实验动物伦理委员会批准(JN.NO.20180915S0601230[183]),并按照欧洲共同体关于实验动物的准则(Directive 98 2010/63/EU)进行操作。
培养基:MRS培养基+0.05% L-半胱氨酸盐酸盐。
1.1.2 主要试剂
IFN-γ、TNF-α、IL-1β、IL-6和IL-10 Elisa试剂盒,R&D Systems公司;利培酮,西安杨森制药有限公司;粪便提取试剂盒(FastDNA Spin Kit for Feces),MP Biomedicals, Santa Ana, CA;L-半胱氨酸盐酸盐,国药集团化学试剂有限公司。
1.1.3 主要仪器与设备
BS-480全自动生化分析仪,深圳迈瑞生物医疗电子股份有限公司;AW500SG大型厌氧工作站,英国Electrotek有限公司;SW-CJ-1CV 型微生物操作超净工作台,苏州安泰空气技术有限公司;大容量冷冻离心机,美国 Beckman公司;高速冷冻离心机,Eppendorf公司;UV-1800紫外可见分光光度合计,岛津仪器有限公司;高温高压灭菌锅,日本SANYO公司。
1.2 灌胃用菌制备
将冻存在保护剂内的嗜酸乳杆菌La28于液体培养基活化3次,活化后的菌液按体积分数为2%接种到液体培养基中,37 ℃条件下厌氧培养18 h,8 000×g离心20 min,以无菌生理盐水清洗菌体2遍后,用10%脱脂乳作为保护剂(采用倾注法测得菌落总数为109 CFU/mL),冻存在-80 ℃备用,灌胃前,6 000×g离心3 min,用生理盐水重悬。
1.3 动物实验
大鼠饲养于江南大学实验动物中心,室温(25±2) ℃,相对湿度50%~55%,光照时间12 h,黑暗时间12 h。适应1周后,于下午17∶00合笼,雌雄数量比例2∶1。第2天早上8∶00前对每只雌鼠进行阴道涂片检查,观察到精子则记录为妊娠第0.5天,雌鼠受孕后分笼饲养,分为实验组(n=5)和对照组(n=5)。孕期12.5 d,孕鼠腹腔注射600 mg/kg的VPA (用生理盐水配制丙戊酸钠溶液至质量浓度250 mg/mL) [9],而在对照组腹腔注射等量的生理盐水。实验组出生的雄性大鼠被分配到模型组,而对照组出生的雄性大鼠在出生后第21天被分配到健康组。从4周龄到8周龄,每天同一时间,嗜酸乳杆菌La28组(La28,n=5)灌胃菌液,模型组(VPA,n=5)和空白组(对照,n=5)灌胃等量生理盐水,药物对照组(MED,n=5)灌胃等量生理盐水配制的利培酮。8周龄的最后一天,乙醚麻醉,取血后处死,凝血后于1 500×g离心15 min,取血清,冻存在-80 ℃备用。
1.4 外周炎症评价
采用全自动生化分析仪检测3组血清中IgA、IgG、IgM和C-反应蛋白(C-reactive protein,CRP);用Elisa试剂盒检测IFN-γ、TNF-α、IL-1β、IL-6和IL-10。
1.5 肝功能评价
采用全自动生化分析仪检测3组血清中的谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)和γ-谷氨酰转移酶(gamma-glutamyl transferase,GGT)。
1.6 肠道菌群分析
VPA组大鼠(n=5)、对照组大鼠(n=5)、MED组(n=5)和La28组(n=5)大鼠在出生后第56天收集粪便样本,使用粪便DNA提取试剂盒提取DNA。利用Illumina MiSeq 平台对V3~V4区域进行扩增和测序[10]。
1.7 统计与分析
实验数据均以平均值±均值标准误差(mean±SD)表示。每个实验至少重复3次。采用One-Way ANOVA以及Fisher’s LSD检验进行数据统计分析,P<0.05时具有显著性差异。采用GraphPad Prism 7和R作图,在Glaxay平台进行LEfSe软件分析,设置LDA Score的默认筛选值为2。
2 结果与分析
2.1 孕鼠VPA暴露对子代的影响
孕期暴露的VPA可通过外周血循环和胎盘屏障均可直接进入子代体内,利用其神经毒性参与子代神经管闭合,从而引发先天性的神经系统发育性疾病,此外,还会引起子代唇裂或腭裂、先天性心脏病、肢体缺陷、泌尿生殖器缺陷及肝脏脂质代谢障碍等疾病[9]。如图1所示(对照和VPA组大鼠均为5日龄),孕期子宫暴露600 mg/kg VPA的子代大鼠出现了全部尾部畸形和部分手部畸形,尾部的畸形多表现为弯曲形状,且与健康组比较短,手部的畸形表现为缺指,表明VPA在孕鼠子宫中成功暴露[11]。此外,SCHNEIDER等[12]发现孕期VPA暴露所得的自闭雄性小鼠的行为表现与ASD患者的临床表现更为相似,因此本文选择雄性子代进一步实验。
2.2 嗜酸乳杆菌La28对孕期VPA暴露引起的子代大鼠外周炎症的作用
2.2.1 嗜酸乳杆菌La28对血清细胞因子的作用
细胞因子通过促炎和抗炎途径调节免疫反应。外周细胞因子可跨越血脑屏障参与中枢神经活动。外周和神经炎症在ASD进程中发挥重要作用,ASD患者外周促炎因子水平上调,抑炎因子水平下调,同时伴随着持续的神经炎症[13]。由图2可知,从断奶到性成熟期,孕期VPA暴露的子代大鼠血清中促炎因子IL-1β、IL-6、IFN-γ和TNF-α水平显著升高,抑炎因子IL-10水平显著下降。利培酮可以显著下调大鼠的血清中IL-1β和TNF-α水平,但对IFN-γ水平没有明显的下调作用,甚至MED组比VPA组稍高,此外,利培酮可以辅助下调IL-6水平,上调IL-10水平。嗜酸乳杆菌La28可显著下调大鼠血清中IL-6和TNF-α水平,同时IFN-γ和IL-1β水平均有所下降,IL-10水平上调,因此,嗜酸乳杆菌La28可以辅助降低促炎因子浓度上调抑炎因子水平,从而调节早期VPA暴露引起的血清促炎和抑炎因子水平的异常。已有研究明确益生菌在免疫调节中的作用,主要通过提高上皮细胞的完整性,调节上皮细胞分泌细胞因子提高免疫应答[14]。另外还可以辅助抑制NF-κB激活[15]和调节Toll样受体的表达[16],降低促炎细胞因子的表达。
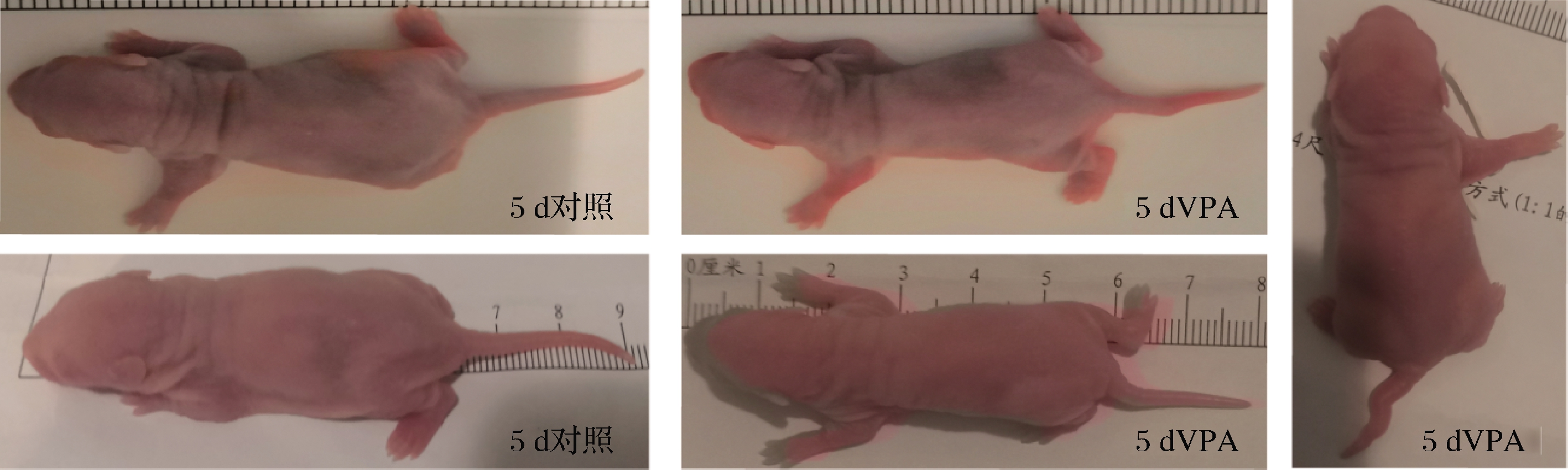
图1 VPA暴露对子代大鼠的致畸作用
Fig.1 The teratogenic effect on offspring rats by VPA exposure
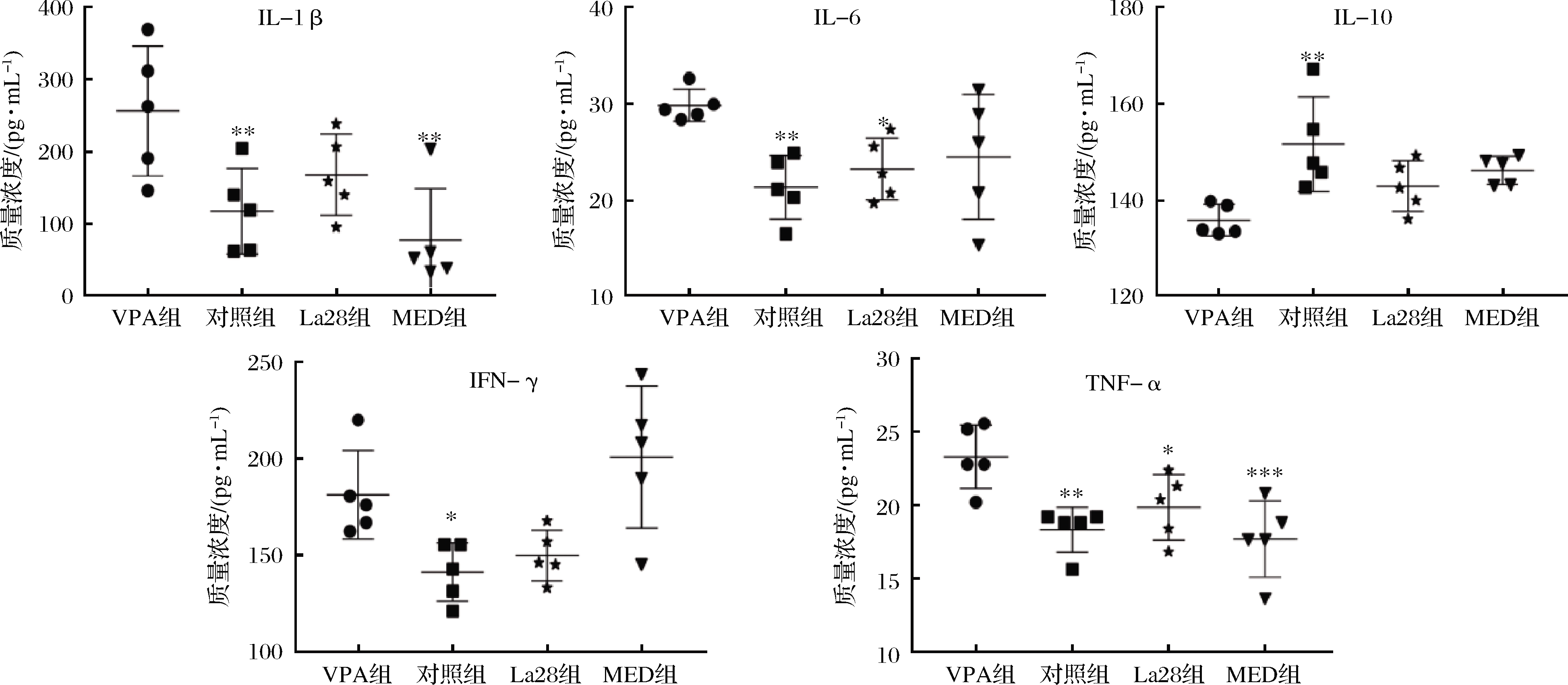
图2 嗜酸乳杆菌La28对血清细胞因子IL-1β、IL-6、IL-10、IFN-γ和TNF-α水平的影响
Fig.2 Effects of L.acidophilus La28 on the level of IL-1β,IL-6,IL-10,IFN-γ and TNF-α
2.2.2 嗜酸乳杆菌La28对血清CRP的作用
CRP是由肝脏合成的一种五聚体蛋白,是体内急性相反应标志物[17]。已有研究表明,外周血CRP水平升高与抑郁症、躁郁症、精神分裂症等神经系统类疾病有关[18-19]。此外,动物研究已经报道,外周血CRP水平反映的慢性炎症状态与小鼠的ASD样行为相关[20-21]。且已有报道益生菌可参与下调CRP水平[22],本研究中孕期VPA暴露的子代大鼠血清中CRP水平显著上调(图3)。利培酮可下调大鼠的血清CRP水平,从断奶到性成熟期灌胃嗜酸乳杆菌La28的大鼠血清中CRP水平下调,虽然MED组和嗜酸乳杆菌La28组均可下调CRP水平,但两组与VPA组均没有显著性差异,因此,嗜酸乳杆菌La28可以缓解早期VPA暴露引起的血清免疫因子CRP水平异常。
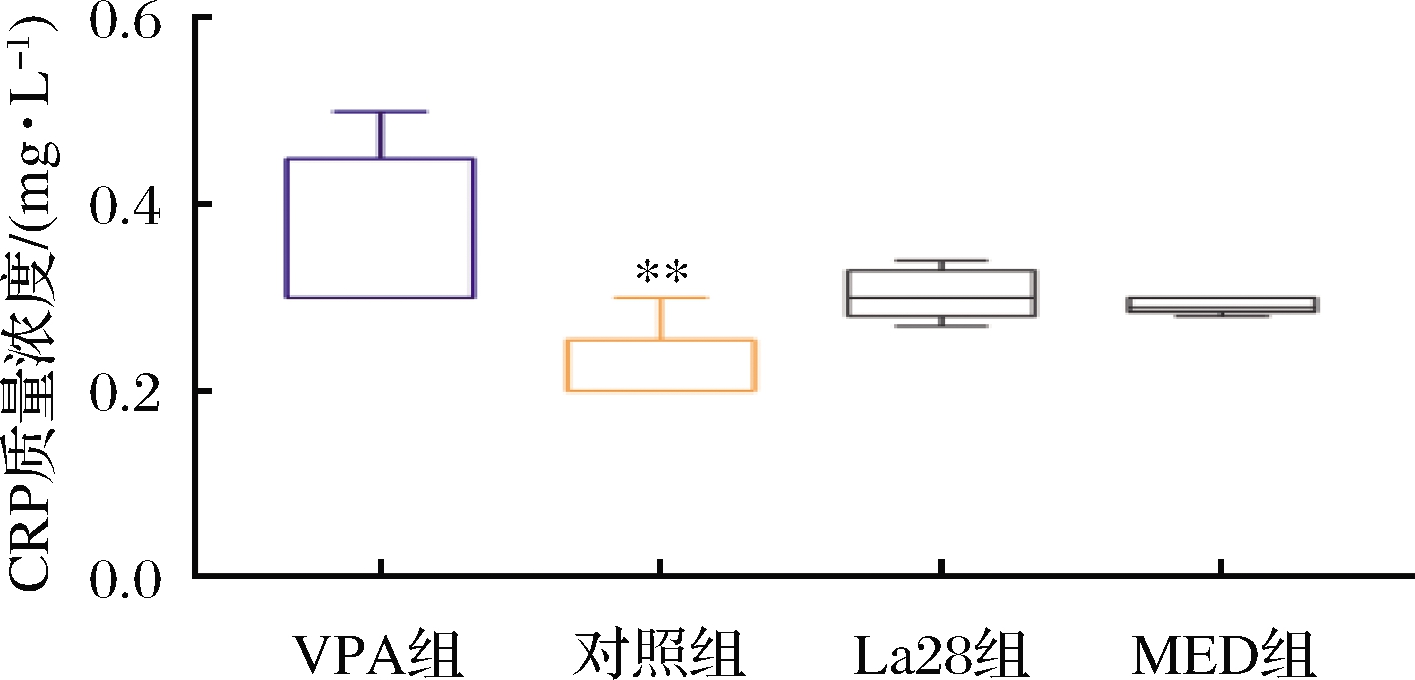
图3 嗜酸乳杆菌La28对血清CRP水平的影响
Fig.3 Effects of L.acidophilus La28 on the level of CRP
2.2.3 嗜酸乳杆菌La28对血清免疫球蛋白的作用
研究发现ASD患者的IgG亚型不全,IgA的血清含量低[23],其中血清型IgA存在于血清中,血清IgA具有某些IgG和IgM的免疫功能,特异性IgA能中和血液中的抗原,同时也出现替代性补体免疫系统[24]。
另外,有研究表明有些ASD患者的IgA含量极低,甚至几乎没有,而分泌型IgA具有保护肠壁的黏膜组织的功能,因而ASD患者的肠黏膜较容易受损[23],这与本实验结果一致。由图4可知,孕期VPA暴露的子代大鼠血清中IgG和IgA水平显著上调,IgM无显著性差异。利培酮可显著下调大鼠的血清IgG水平,对IgA和IgM没有明显调节作用。从断奶到性成熟,嗜酸乳杆菌La28的干预可下调大鼠血清中IgG水平,但与VPA组没有显著性差异,与MED组同样对IgA和IgM没有明显调节作用。嗜酸乳杆菌La28对早期VPA暴露引起的免疫球蛋白IgG水平异常有明显作用,且这与已有研究表明益生菌干预机体IgA的水平没有显著调控效果结果一致[25-26]。
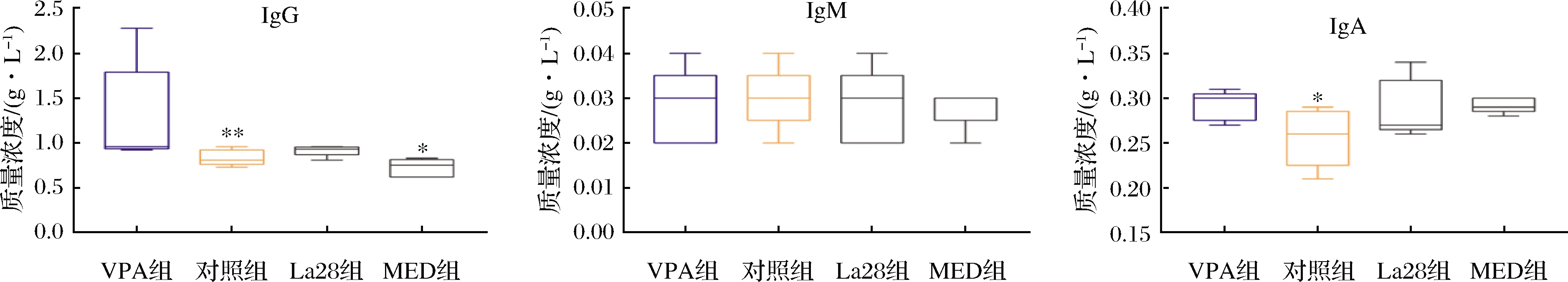
图4 嗜酸乳杆菌La28对血清IgG、IgM和IgA水平的影响
Fig.4 Effects of L.acidophilus La28 on the level of IgG,IgM and IgA
2.3 嗜酸乳杆菌La28孕期VPA暴露的子代大鼠肝功能的作用
如图5所示,孕期VPA暴露的子代大鼠ALT、AST、ALP和GGT水平显著上调。利培酮可下调大鼠ALT、AST、ALT和GGT水平,提升肝功能,从断奶到性成熟期,嗜酸乳杆菌La28的干预可下调大鼠ALT、AST、ALP和GGT水平,且可显著调节ALT和GGT水平。因此,嗜酸乳杆菌La28可以显著缓解早期VPA暴露引起的肝损伤。研究表明,益生菌主要通过改善肠道环境,调控肠道微生物组成结构和短链脂肪酸等代谢产物水平来维持肠道屏障功能,加强肠道的黏膜屏障作用,减少肠源性内毒性通过门静脉系统、内循环系统进入肝脏,进而改善肝脏病变程度[27-28]。
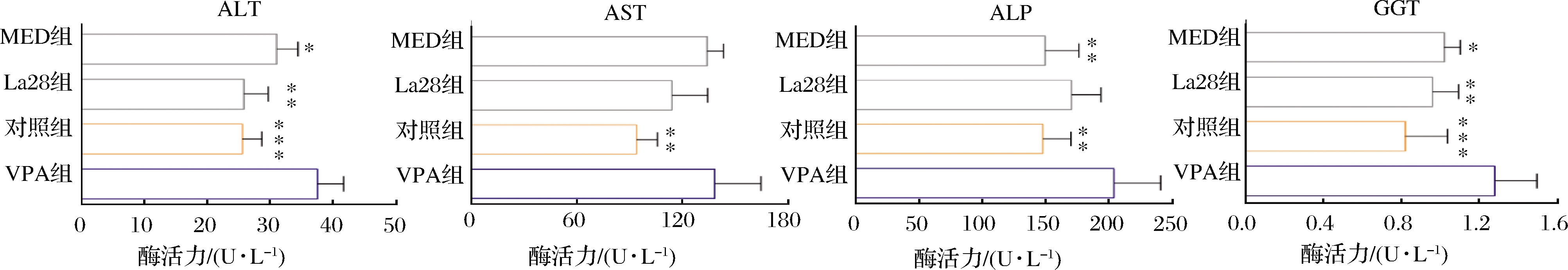
图5 嗜酸乳杆菌La28对ALP、ALT、AST和GGT水平的影响
Fig.5 Effects of L.acidophilus La28 on the level of ALP,ALT,AST and GGT
2.4 孕期VPA暴露的子代大鼠外周炎症和肝功能指标的相关性分析
已有研究表明,外周炎症和肝功能密切相关,来自肠道中的各种毒素通过门静脉系统作用于肝脏,引发炎症反应,导致肝功能受损[29-30]。因而,对本实验中的外周炎症指标和肝功能指标进行相关性分析(图6),发现IFN-γ、TNF-α、IL-1β、IL-6、CRP和IgG与肝功能指标均呈正相关,其中IL-6与ALT(r=0.700,P=0.024)、AST(r=0.702,P=0.024)、ALP(r=0.723,P=0.018)和GGT(r=0.790,P=0.007)4个指标都显著正相关,IL-1β与ALP(r=0.729,P=0.017)呈显著正相关。IL-10与ALT(r=-0.773,P=0.009)、AST(r=-0.745,P=0.013)和GGT(r=-0.705,P=0.023)4个指标都显著负相关。嗜酸乳杆菌La28可以显著降低外周IL-6的水平,同时也显著降低了ALT和GGT的表达水平,因而推测嗜酸乳杆菌La28可能是通过调节VPA大鼠肠道环境降低外周IL-6的水平从而达到改善肝功能效果。
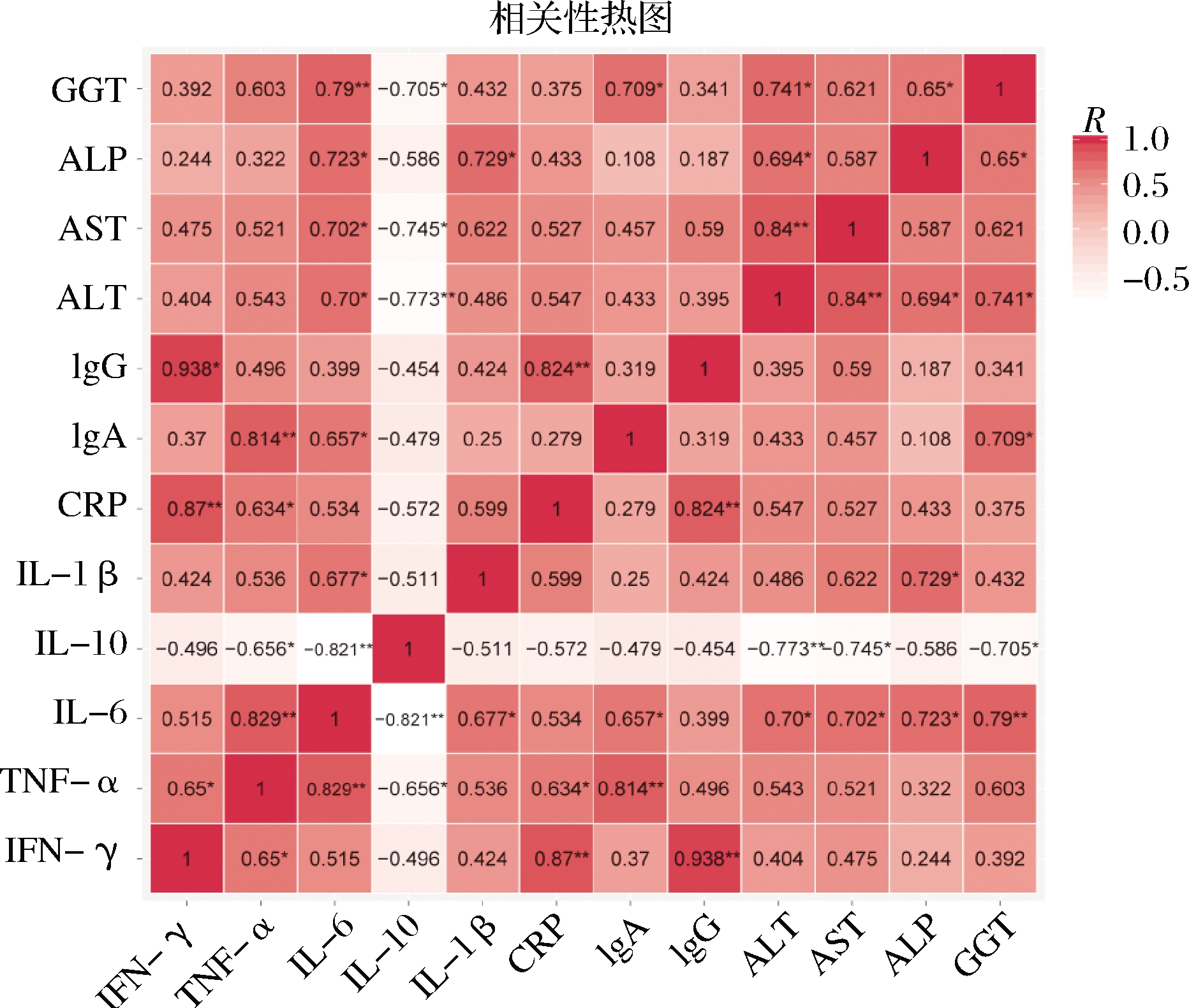
图6 外周炎症与肝功能指标相关性分析
Fig.6 Correlation analysis between peripheral inflammation and liver function indicators
2.5 嗜酸乳杆菌La28对孕期VPA暴露的子代大鼠神经炎症和肝功能的综合作用效果
利用主成分分析对上述所有指标进行综合分析,由图7可知,嗜酸乳杆菌La28对VPA暴露引起的子代大鼠的外周炎症和肝功能的综合缓解能力较好。
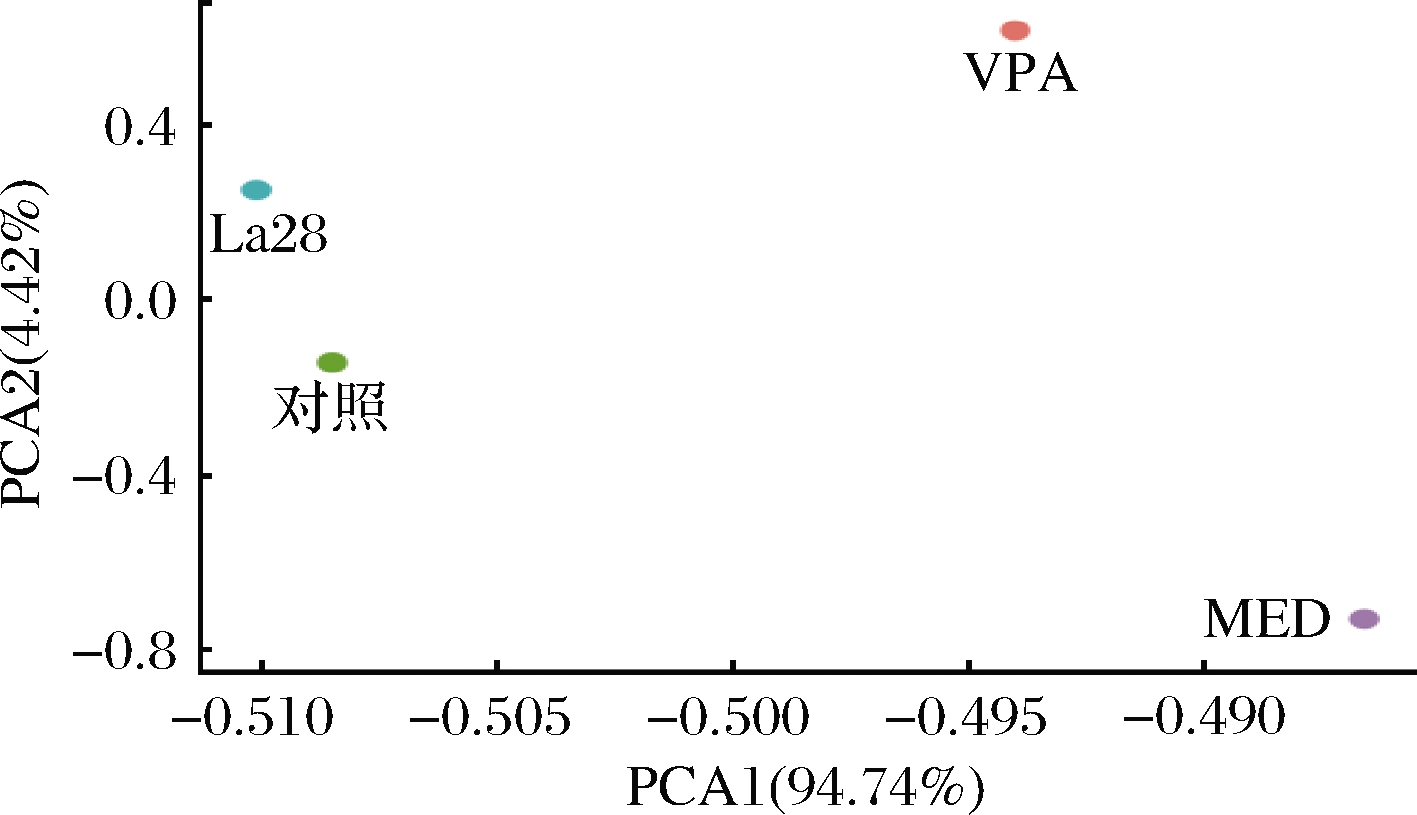
图7 外周炎症与肝功能指标综合主成分分析
Fig.7 Principal component analysis of peripheral inflammation and liver function indicators
2.6 嗜酸乳杆菌La28对VPA暴露的子代大鼠肠道菌群的影响
越来越多的证据表明肠道菌群失衡与ASD的严重程度有关[31],基于肠道菌群失调在ASD中的作用,利用益生菌将肠道菌群重塑为健康状态是近几年提出的作为ASD的潜在治疗方法。因此,基于16S rRNA扩增测序手段,进一步研究了嗜酸乳杆菌La28对孕期VPA暴露的子代大鼠的肠道微生物的影响。已有发现,在孤独症儿童的粪便样本中,厚壁菌门的丰度低于健康儿童,厚壁菌门与拟杆菌门比值(F/B)升高[32-33]。这与本实验研究结果一致,如图8-a所示,孕期VPA暴露的子代大鼠F/B显著上调,嗜酸乳杆菌La28和利培酮干预可以降低F/B水平,表明嗜酸乳杆菌La28菌群组成上能够发挥调节作用。利用LEfSe分析确定了各组的优势菌群(图8-b),在属水平上,孕期VPA暴露的子代大鼠的优势菌属为Roseburia;利培酮干预后优势菌属为Pseudomonas和Bifidobacterium;嗜酸乳杆菌La28干预后的优势菌属为Anaerostipes。进一步对各组肠道菌群的属水平进行分析,从图8-c可知,与孕期VPA暴露的子代大鼠的肠道菌群比,嗜酸乳杆菌La28可以显著提高Mucispirillum、Allobaculumhe、Desulfovibrio、Lactobacillus、Odoribacter和Bifidobacterium丰度(P<0.05),其中对照组与嗜酸乳杆菌La28组的Allobaculumhe丰度没有差异,且均高于VPA组和MED组,嗜酸乳杆菌La28组的Mucispirillum显著性高于其他3组。说明嗜酸乳杆菌La28通过上调Allobaculumhe和Mucispirillum的相对丰度,增加厚壁菌门丰度,降低拟杆菌门丰度来调节肠道菌群从而改善VPA暴露引起子代大鼠的神经炎症和肝功能。

a-厚壁菌门与拟杆菌门比值;b-属水平各组优势菌群;c-门水平和属水平丰度差异 g-属水平;p-门水平;f-科水平;o-目水平;k-界水平
图8 嗜酸乳杆菌La28对肠道菌群的影响
Fig.8 Effects of L.acidophilus La28 on gut microbiota
3 结论
经嗜酸乳杆菌La28干预后,对VPA暴露引起子代大鼠的神经炎症和肝功能具有有效的改善作用。其中,嗜酸乳杆菌La28对抑制促炎因子IL-6和TNF-α的表达和调节肝代谢酶ALT和 GGT的表达效果更佳,且在肠道菌群调节上效果更为显著,为筛选出更适合ASD患儿发育过程的益生菌提供一定参考。
[1] VAJDA F J E,O’BRIEN T J,GRAHAM J E,et al.Valproate-associated foetal malformations-rates of occurrence,risks in attempted avoidance[J].Acta Neurologica Scandinavica,2018,139 (1):42-48.
[2] ABDELKADER N F,ELYAMANY M,GAD A M,et al.Ellagic acid attenuates liver toxicity induced by valproic acid in rats[J].Journal of Pharmacological Sciences, 2020,143(1):23-29.
[3] BASSETT J T,RODRIGUEZ B,MULLIGAN L,et al.Acute liver failure in a military recruit treated with valproic acid and harboring a previously unrecognized polg-1 mutation[J].Epilepsy & behavior reports,2019,12:100 342.
[4] ZHAO G,GAO J Q,LIANG S,et al.Study of the serum levels of polyunsaturated fatty acids and the expression of related liver metabolic enzymes in a rat valproate-induced autism model[J].International Journal of Developmental Neuroscience,2015,44:14-21.
[5] RODIER P M,INGRAM J L,TISDALE B,et al.Embryological origin for autism:Developmental anomalies of the cranial nerve motor nuclei[J].the Journal of Comparative Neurology,1996,370(2):247-261.
[6] HOLINGUE C,NEWILL C,LEE L,et al.Gastrointestinal symptoms in autism spectrum disorder:A review of the literature on ascertainment and prevalence[J].Autism Research,2018,11(1):24-36.
[7] BRANISTE V,ALASMAKH M,KOWAL C,et al.The gut microbiota influences blood-brain barrier permeability in mice[J].Science Translational Medicine,2014,6(263).DOI:10.1126/scitranslmed.3 009 759.
[8] TRIPATHI A,DEBELIUS J W,BRENNER D A,et al.Publisher correction:The gut-liver axis and the intersection with the microbiome[J].Nature Reviews Gastroenterology & Hepatology,2018,15(7):785-785.
[9] TANOSHIMA M,KOBAYASHI T,TANOSHIMA R,et al.Risks of congenital malformations in offspring exposed to valproic acid in utero:A systematic review and cumulative meta-analysis[J].Clinical Pharmacology & Therapeutics,2015,98(4):417-441.
[10] YAN S,YANG B,ZHAO J C,et al.A ropy exopolysaccharide producing strain Bifidobacterium longum subsp.longum YS108R alleviates DSS-induced colitis by maintenance of the mucosal barrier and gut microbiota modulation[J].Food & Function,2019,10(3):1 595-1 608.
[11] FOLEY A G,GANNON S,ROMBACH-MULLAN N,et al.Class ihistone deacetylase inhibition ameliorates social cognition and cell adhesion molecule plasticity deficits in a rodent model of autism spectrum disorder[J].Neuropharmacology,2012,63(4):750-760.
[12] SCHNEIDER T,ROMAN A,AGNIESZKA B K,et al.Gender-specific behavioral and immunological alterations in an animal model of autism induced by prenatal exposure to valproic acid[J].Psychoneuroendocrinology,2008,33(6):728-740.
[13] DOENYAS C.Gut microbiota,inflammation,and probiotics on neural development in autism spectrum disorder[J].Neuroscience,2018,374:271-286.
[14] FERNANDES BS,STEINER J,BERNSTEIN H G,et al.C-reactive protein is increased in schizophrenia but is not altered by antipsychotics:Meta-analysis and implications[J].Molecular Psychiatry,2016,21(4):554-564.
[15] KEMGANG T S,KAPILA S,SHANMUGAM V P,et al.Cross-talk between probiotic lactobacilli and host immune system[J].Journal of Applied Microbiology,2014,117(2):303-319.
[16] RAISON C L,PIKALOV A,SIU C,et al.C-reactive protein and response to lurasidone in patients with bipolar depression[J].Brain Behavior and Immunity,2018,73:717-724.
[17] FELGER J C,HAROON E,PATEL T A,et al.What does plasma crp tell us about peripheral and central inflammation in depression?[J].Molecular Psychiatry,2020,25(6):1 301-1 311.
[18] CURRAIS A,FARROKHI C,DARGUSCH R,et al.Dietary glycemic index modulates the behavioral and biochemical abnormalities associated with autism spectrum disorder[J].Molecular Psychiatry,2016,21(3):426-436.
[19] GUPTA S,SAMRA D,AGRAWAL S.Adaptive and innate immune responses in autism:Rationale for therapeutic use of intravenous immunoglobulin[J].Journal of Clinical Immunology,2010,30:S90-S96.
[20] MILOSEVIC I,VUJOVIC A,BARAC A,et al.Gut-liver axis,gut microbiota,and its modulation in the management of liver diseases:A review of the literature[J].International Journal of Molecular Sciences,2019,20(2).DOI:10.3390/ijms20020395.
[21] BAJAJ J S.Alcohol,liver disease and the gut microbiota[J].Nature Reviews Gastroenterology & Hepatology,2019,16(4):235-246.
[22] CHAIDEZ V,HANSEN R L,HERTZ-PICCIOTTO I.Gastrointestinal problems in children with autism,developmental delays or typical development[J].Journal of Autism and Developmental Disorders,2014,44(5):1 117-1 127.
[23] LIU F T,LI J,WU F,et al.Altered composition and function of intestinal microbiota in autism spectrum disorders:A systematic review[J].Translational psychiatry,2019,9(1):43.
[24] SHAABAN S Y,EL G Y G,MEHANNA N S,et al.The role of probiotics in children with autism spectrum disorder:A prospective,open-label study[J].Nutritional Neuroscience,2018,21(9):676-681.
[25] ZHANG H,YE H C,JIN Z,ET AL.Prospective study of probiotic supplementation results in immune stimulation and improvement of upper respiratory infection rate[J].Synthetic and Systems Biotechnology,2018,3(2):113-120.
[26] SAPUTRO I D,PUTRA O N,PEBRIANTON H,et al.Effects of probiotic administration on IGA and IL-6 level in severe burn patients:A randomized trial[J].Annals of Burns and Fire Disasters,2019,32(1):70-76.
[27] MANCINI A,CAMPAGNA F,AMODIO P,et al.Gut:liver:brain axis:The microbial challenge in the hepatic encephalopathy[J].Food & Function,2018,9(3):1 373-1 388.
[28] YE J,LV L,WU W,et al.Butyrate protects mice against methionine-choline-deficient diet-induced non-alcoholic steatohepatitis by improving gut barrier function,attenuating inflammation and reducing endotoxin levels[J].Frontiers In microbiology,2018,9(21).DOI:10.3389/fmicb.2018.01967.
[29] MILOSEVIC I,VUJOVIC A,BARAC A,et al.Gut-Liver axis,gut microbiota,and its modulation in the management of liver diseases:A review of the literature[J].International Journal of Molecular Sciences,2019,20(2):395-399.
[30] ALCOHOL B J.Liver disease and the gut microbiota[J].Nature Reviews Gastroenterology & Hepatology,2019,16(4):235-246.
[31] CHAIDEZ V,HANSEN R L,HERTZ-PICCIOTTO I.Gastrointestinal problems in children with autism,developmental delays or typical development[J].Journal of Autism and Developmental Disorders,2014,44(5):1 117-1 127.
[32] LIU F,LI J,WU F,et al.Altered composition and function of intestinal microbiota in autism spectrum disorders:A systematic review[J].Translational Psychiatry,2019,9(1):43.
[33] SHAABAN S Y,GENDY Y G,MEHANNA N S,et al.The role of probiotics in children with autism spectrum disorder:A prospective,open-label study[J].Nutritional Neuroscience,2017,21(9):676-681.