氧化应激是导致机体衰老和与衰老相关疾病的根本原因,可能引起糖尿病、动脉粥样硬化、关节炎、高血脂、心脑血管疾病等多种疾病[1]。近年来,乳酸菌具有抗氧化作用的报道逐步增多,人们对乳酸菌抗氧化功能的认识也在不断深入。KULLISAAR等[2]发现了2株发酵乳杆菌(Lactobacillus fermentum)E-3、E-18,均能耐受H2O2且对羟自由基(·OH)有较强的清除能力。ZHAI等[3]评价了10株乳酸菌菌株的抗氧化活性,发现植物乳杆菌(Lactobacillus plantarum)CCFM 8661菌液表现出较最强的脂质过氧化抑制活性。
乳酸菌主要通过清除细胞及周围的活性氧自由基、螯合金属离子、缓解脂质过氧化、自身抗氧化防御系统调控、调节宿主细胞抗氧化防御系统、调节宿主细胞与抗氧化相关的信号通路等方式发挥抗氧化作用[4-6]。乳酸菌的自身抗氧化防御系统分为酶类系统与非酶类系统,可以通过乳酸菌体内存在的氧化还原调控系统发挥抗氧化作用[7-8]。
目前,国内外已有关于唾液乳杆菌体外抗氧化功能评价的研究,但是关于其抗氧化机制,尤其是结合全基因组序列信息,在分子层面对抗氧化机理的探究却鲜有报道。本研究全面评价了1株唾液乳杆菌M18-6的体外抗氧化功能,检测其无细胞上清液、菌悬液、细胞内容物的体外抗氧化指标,并从菌株基因组中挖掘11个与抗氧化相关蛋白的编码基因,在mRNA水平探讨菌株在H2O2氧化胁迫环境下的分子应答机制。
1 材料与方法
1.1 试验菌株
(1)试验菌株:唾液乳杆菌M18-6,保藏号为CGMCC 16199。
(2)参考菌株:鼠李糖乳酸杆菌 (Lactobacillis rhamnosus GG,LGG)ATCC 53103, 中国农业大学食品科学与营养工程学院保藏。
1.2 材料、试剂
超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(货号A001-1-2)、过氧化氢酶(catalase, CAT)试剂盒(货号A007-1-1)、谷胱甘肽过氧化物酶 (glutathione peroxidase,GSH-Px)试剂盒(货号A005-1-2)、总抗氧化能力(total antioxidant capacity,T-AOC)检测试剂盒(货号A015-2-1),南京建成生物工程研究所;PrimeScriptTM 1 st Strand cDNA Synthesis Kit试剂盒(货号6110A)、TB Green Premix Ex Taq Ⅱ 试剂盒(货号RR820A)、Recombinant DNase Ⅰ试剂盒(货号2270A),宝生物工程(大连)有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、邻二氮菲、FeSO4、H2O2、K3[Fe(CN)6]、FeCl3、亚油酸、三氯乙酸(trichloroacetic acid solution,TCA)、L-半胱氨酸、盐酸、抗坏血酸盐、硫代巴比妥酸(thiobarbituric acid,TBA)、2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT)、丁醇等均为国产分析纯。
1.3 体外抗氧化功能评价
1.3.1 样品制备
将菌株以体积分数为2%的接种量接种于MRS肉汤中,37 ℃恒温培养 12 h,传至3代备用。将活化好的菌液,4 ℃下5 000×g离心 10 min,收集上清液,经0.22 μm滤膜过滤所得滤液即为发酵上清液;菌体沉淀重悬于等体积无菌磷酸缓冲盐溶液(phosphate buffer saline,PBS)(pH 7.4,下同)中得到菌悬液;菌体沉淀用无菌PBS缓冲液洗涤3次,重悬于无菌 PBS 缓冲液中,调整细菌的浓度为1×109 CFU/mL,并用细胞破碎仪400 W 间歇 4 s,破碎 5 min,10 000×g离心10 min,收集上清液为细胞内容物[9]。
1.3.2 DPPH自由基清除能力
将新配制的2 mL 0.1 mmol/L DPPH试剂与1 mL待测样品混合,室温下静置30 min,5 000×g离心10 min,于517 nm处测定上清液的吸光值(A样品),以去离子水代替样品测定的吸光值(A对照),以无水乙醇代替DPPH测定的吸光值(A空白),以去离子水和无水乙醇调零[10]。按照公式(1)计算DPPH自由基清除能力:
DPPH自由基清除率![]()
(1)
式中:A对照,1 mL H2O+2 mL DPPH;A空白,1 mL无水乙醇+2 mL样品;A调零,1 mL H2O+2 mL无水乙醇。
1.3.3 ·OH清除率
将1 mL 0.75 mmol/L邻二氮菲试剂、2 mL PBS缓冲液、1 mL 0.75 mmol/L FeSO4充分混匀,加入1 mL 体积分数为10%的H2O2和1 mL待测样品溶液,在37 ℃环境下静置90 min, 在波长536 nm处测吸光值为As。用生理盐水替代样品得到的吸光值为Ac,用生理盐水代替H2O2和样品溶液得到的吸光值为Ab[11]。按照公式(2)计算·OH清除率:
·OH清除率![]()
(2)
1.3.4 总还原能力
在0.5 mL待测样品中加入0.5 mL PBS缓冲液、0.5 mL 10 g/L K3[Fe(CN)6],置于50 ℃水浴20 min,取出后迅速冷却,加入0.5 mL 100 g/L TCA,3 000×g离心5 min,取1 mL上清液,加入1 mL蒸馏水及1 mL 1 g/L FeCl3,混合均匀,在室温下静置10 min,在波长700 nm处测吸光值,蒸馏水做空白管。
配制0~400 μmol/L的L-半胱氨酸盐酸盐,按上述步骤测吸光值,做标准曲线,将样品吸光值带入标准曲线,计算半胱氨酸当量[12]。
1.3.5 亚油酸过氧化抑制率
将1 mL亚油酸的乳化液与0.5 mL PBS溶液混合,加入0.2 mL 0.1 g/L FeSO4溶液、0.02 mL 0.1 g/L 抗坏血酸盐和0.4 mL待测样品,混匀后置于37 ℃水浴反应12 h,向混合液中加入0.2 mL 40 g/L TCA、2 mL 8 g/L TBA和0.2 mL 4 g/L BHT,混匀后在100 ℃水浴中反应30 min,取出后迅速冷却,用2 mL丁醇提取,在532 nm处测定其上清液的吸光值为A样品,用PBS缓冲液代替样品的吸光值为(A空白)[5]。按照公式(3)计算亚油酸过氧化抑制率:
亚油酸过氧化抑制率![]()
(3)
1.3.6 抗氧化酶类物质活性
用试剂盒测定菌悬液、无细胞上清液、无细胞提取物中GSH-Px、总超氧化物歧化酶(total superoxide dismutase,T-SOD)和CAT的活性以及T-AOC。
1.4 全基因组测序以及抗氧化相关基因信息挖掘
将活化好的菌体交由美吉生物公司,结合2代Illumina Hiseq×10平台及3代PacBio测序平台,进行基因组序列测定,获取菌株基因组完成图[13]。将预测得到的编码基因通过与数据库(NR、Swiss-Prot、Pfam、EggNOG、GO和KEGG)进行比对进行功能注释。挖掘与抗氧化相关蛋白的编码基因,利用NCBI设计引物,与内参基因引物一同在生工生物工程(上海)股份有限公司合成。
1.5 总RNA的提取、cDNA的合成以及RT-qPCR
将2代的菌液以体积分数为2%的接种量分别接种到H2O2浓度为0、0.5、1.0、1.5、2和2.0 mmol/mL 的MRS液体培养基中,37 ℃培养12 h,取2 mL菌悬液,4 ℃环境下12 000×g离心5 min。采用玻璃珠-酚仿法提取菌体RNA,利用TAKARA Recombinant DNase Ⅰ试剂盒消化DNA,具体方法参考吴思琪等[14]研究。
cDNA合成:利用TAKARA公司的PrimeScriptTM 1 st Strand cDNA Synthesis Kit试剂盒进行反转录。
RT-qPCR体系:1 μL模板、1 μL上游引物、1 μL下游引物、0.4 μL ROX、0 μL TB GREEN 1和6.6 μL H2O。具体步骤为:95 ℃预变性3 min,扩增循环(95 ℃ 10 s,引物Tm 30 s),39个循环,对每种目的基因的扩增反应都进行了扩增产物的融解曲线分析。
将cDNA样品的连续稀释后进行实时荧光定量PCR,做标准曲线评估引物扩增效率,扩增效率在1.90~2.05的引物用于后续的mRNA水平检测,利用2-ΔΔCT计算基因表达水平,将内参基因的表达量设定为1[15]。
1.6 数据处理
采用SPSS 17.0对所得数据进行统计学分析,采用t检验分析样品的差异显著性,P<0.05时认为有显著性差异
2 结果与分析
2.1 菌株体外抗氧化能力评价
2.1.1 DPPH自由基清除能力
由图1可知,唾液乳杆菌M18-6的菌悬液、无细胞上清液以及细胞内容物中均有较强的清除DPPH自由基的能力,其中无细胞上清液DPPH自由基清除能力最强(26.9%),显著高于菌悬液和细胞内容物的清除能力,分别为13.9%和11.75%;无细胞上清液和细胞内容物的DPPH自由基清除能力均显著高于商业菌株LGG的无细胞上清液和细胞内容物,分别为20.2%和9.05% (P<0.05)。结果表明,菌株无细胞上清液中的活性物质能很好地清除DPPH自由基。有研究表明,菌体清除DPPH自由基的能力与菌体代谢产生的胞外多糖有关[16]。
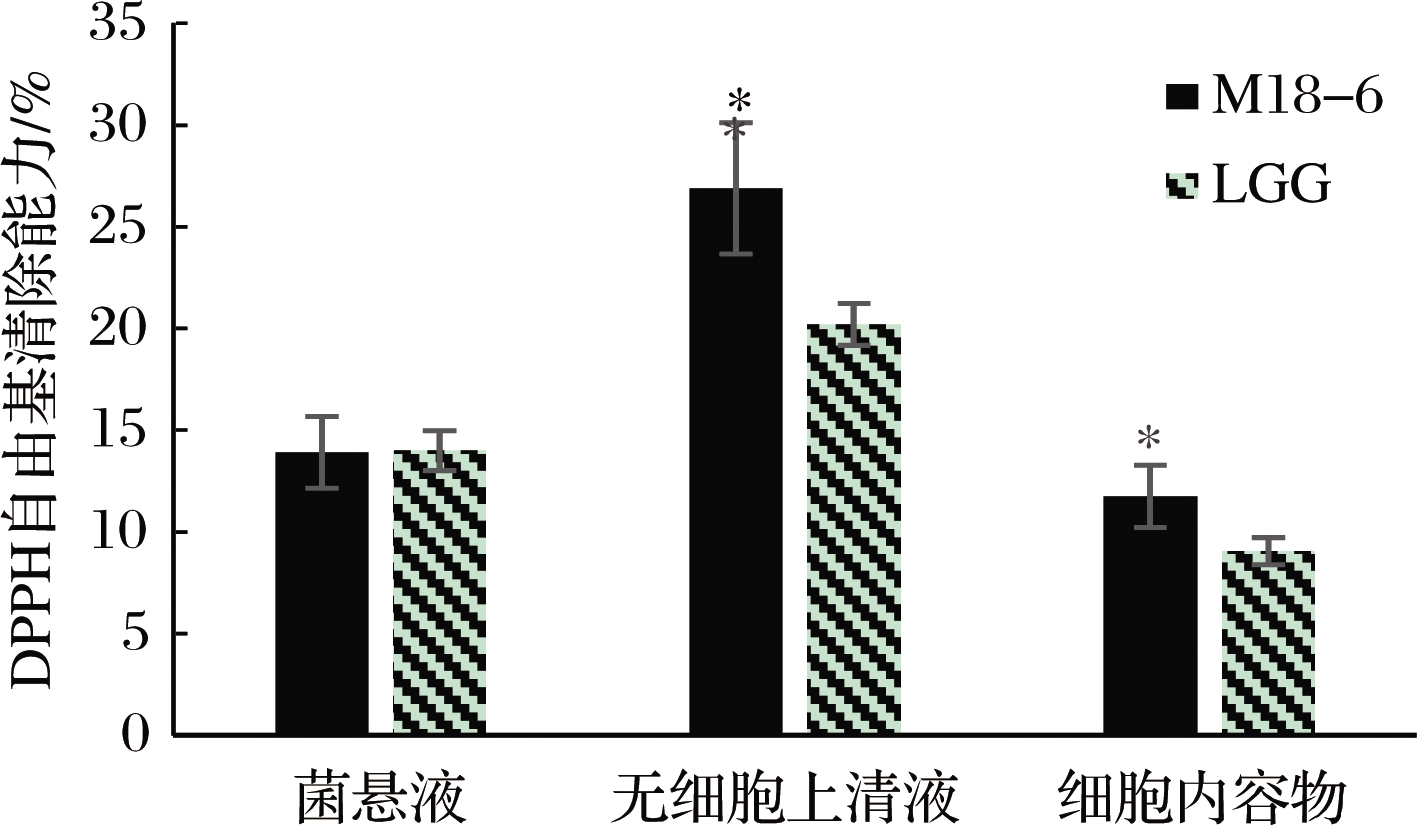
图1 唾液乳杆菌M18-6清除DPPH自由基能力
Fig.1 DPPH free radicals scavenging rate of L.salivarius M18-6 注:*表示与同处理组的LGG相比具有显著性差异(P<0.05)(下同)
2.1.2 ·OH清除能力
本实验体系中,·OH由Fenton反应产生,被清除后体系中Fe2+的质量浓度升高,吸光度也相应升高[17]。·OH清除率如图2所示,唾液乳杆菌M18-6的无细胞上清液以及细胞内容物的·OH清除能力分别为61.95%和18.76%,其中无细胞上清液的清除·OH的能力显著高于商业菌株LGG(49.21%) (P<0.05)。与类似研究结果相比较发现,唾液乳杆菌M18-6无细胞上清液的·OH清除能力高于其他乳杆菌。刘少敏[1]研究发现,植物乳杆菌NDC 75017、嗜酸乳杆菌ATCC 14917和植物乳杆菌NCFM的无细胞上清液·OH清除率分别为32.13%、23.65%和17.28%,均低于本实验的唾液乳杆菌M18-6。无细胞上清液中的·OH清除率高,说明菌株在发酵过程中产生了可清除·OH的活性物质。
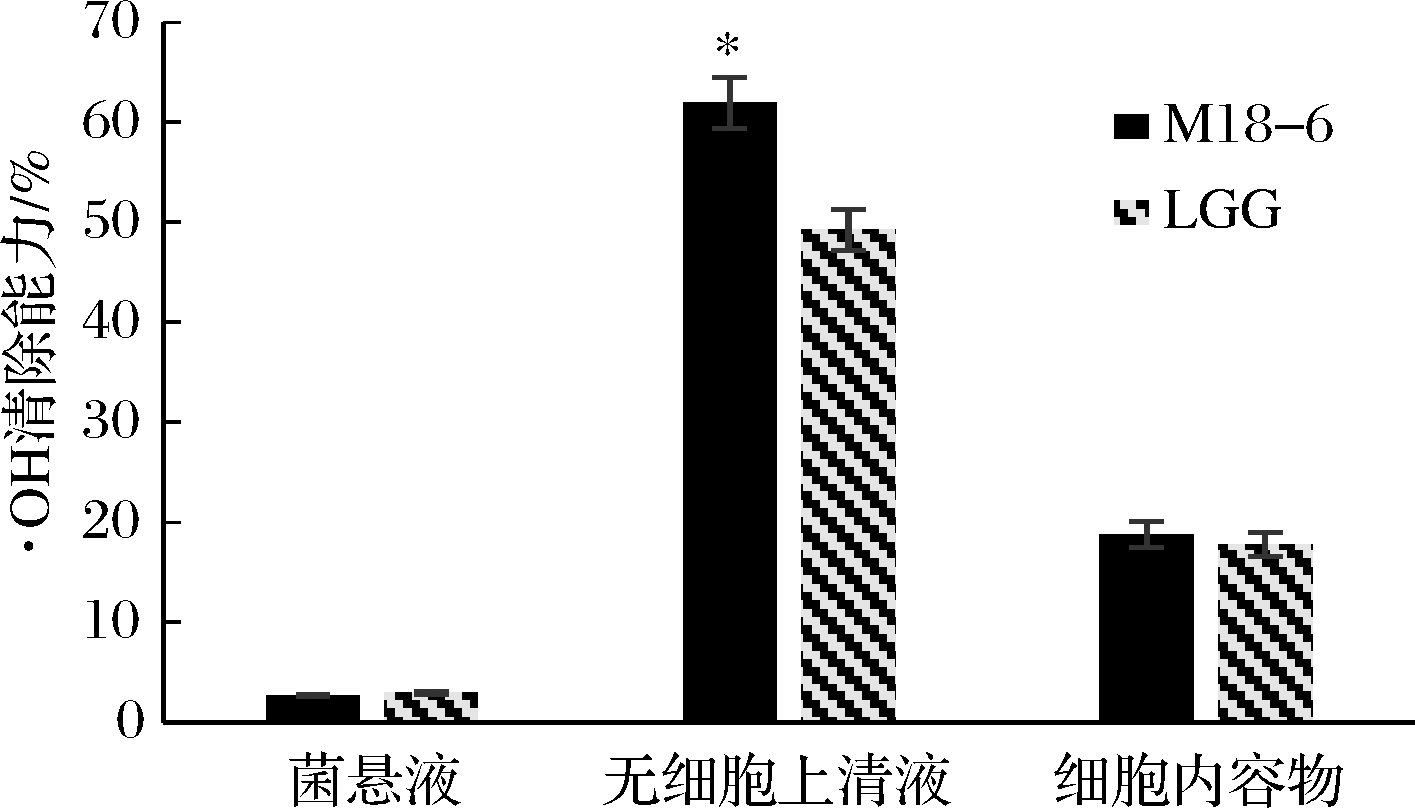
图2 唾液乳杆菌M18-6的·OH清除率
Fig.2 The hydroxyl radical scavenging rate of L.salivarius M18-6
2.1.3 总还原能力
具有抗氧化性的物质可将K3[Fe(CN)6]还原成K4[Fe(CN)6],再与Fe3+作用生成普鲁士蓝,在700 nm波长具有最大的光度值,以检测普鲁士蓝的生成量作为试样的还原能力[18]。如图3所示,唾液乳杆菌M18-6的菌悬液、无细胞上清液以及细胞内容物中均有较强的总还原能力,与对照菌株LGG持平,分别为371.125、1 448.625和155.29 μmol/L半胱氨酸当量,其中无细胞上清液显著高于菌悬液与细胞内容物(P<0.05)。由结果可知,菌株在发酵过程中产生了还原力强的活性物质,还原能力优于菌体与细胞内容物。
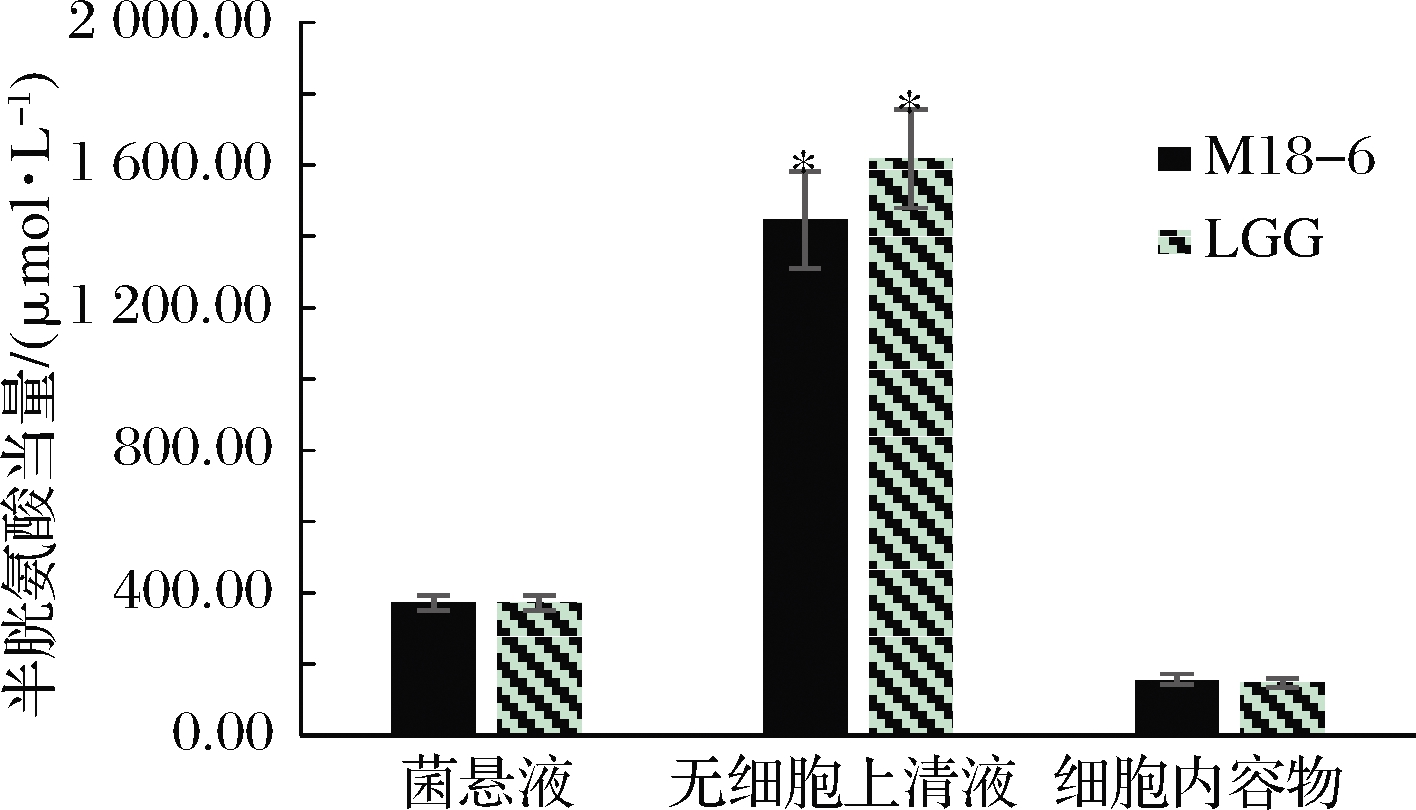
图3 唾液乳杆菌M18-6总还原能力
Fig.3 The total reducing capacity of L.salivarius M18-6
2.1.4 亚油酸过氧化抑制能力
亚油酸易发生氧化而形成过氧化物,进而氧化Fe2+为Fe3+,与邻菲罗啉中的SCN-生成络合物,在500 nm处有最大吸光值,吸光值与亚油酸自氧化程度成正比[19]。由图4可知,唾液乳杆菌M18-6具有良好的抑制亚油酸过氧化能力,其中无细胞上清液的抑制亚油酸过氧化能力为71.3%,显著高于商业菌株LGG(54.08%),也高于同菌株的菌悬液和细胞内容物的抑制亚油酸过氧化能力,分别为31.79%和17.93%。结果表明,菌株无细胞上清液中的活性物质是抑制亚油酸过氧化率的主要因素,部分完整细胞的非酶物质也能够起到一定的作用。
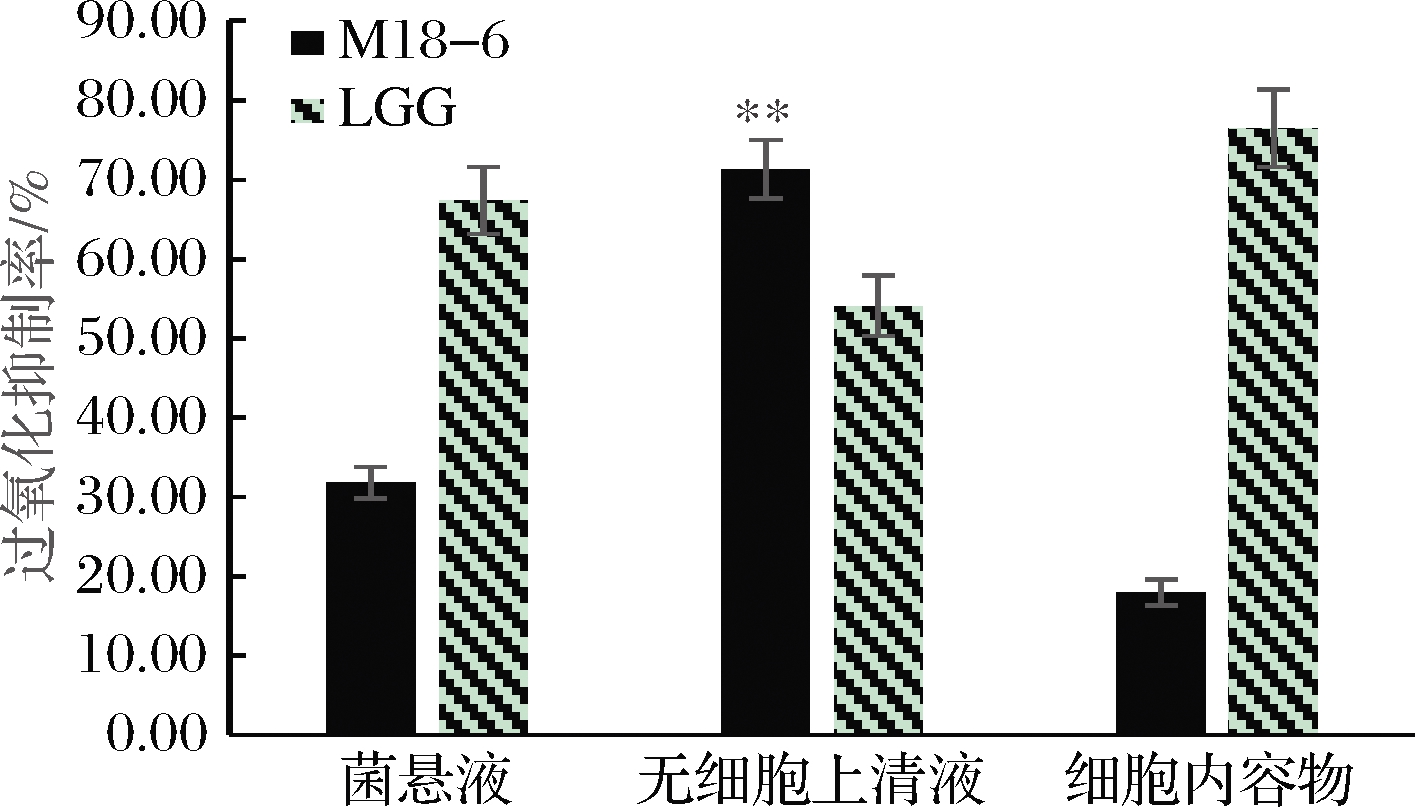
图4 唾液乳杆菌 M18-6抑制亚油酸过氧化率
Fig.4 Inhibition rate of linoleic acid peroxidation in L.salivarius M18-6 注:**表示与同处理组的LGG和菌株其他处理组相比 具有显著性差异(P<0.05)
2.1.5 抗氧化酶类物质活性
抗氧化酶类在机体防御活性氧的损伤中扮演着极为关键的角色[19]。如表1所示,唾液乳杆菌M18-6的菌悬液及无细胞上清液中具有GSH-Px活性,且活性显著高于商业菌株LGG(P<0.05);无细胞上清液中T-SOD活性显著高于商业菌株LGG(P<0.05);菌悬液中具有CAT活性;无细胞上清液以及细胞内容物中检测出较强的T-AOC。结果表明,SOD与GSH-Px活性主要展现在无细胞上清液中,证明其主要来源于菌体代谢产物;CAT活性主要是由于菌体表面的活性物;菌体无细胞上清液的T-AOC很强,与上文总还原能力结果一致。与类似研究结果相比较发现[20],对于乳杆菌抗氧化酶类物质的检测,鲜有将这4种酶类同时检测的报道,并且与同类菌株相比较,唾液乳杆菌M18-6的无细胞上清液的SOD、GSH-Px活性也有较强的优势。
表1 M18-6及LGG抗氧化酶类物质活性单位:U/mg
Table 1 The activity of antioxidant enzymes in L.salivarius M18-6 and L.rhamnosus GG
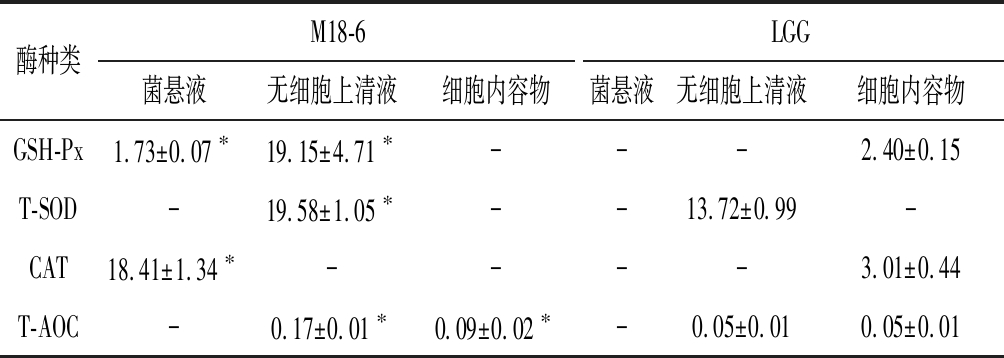
酶种类M18-6LGG菌悬液无细胞上清液细胞内容物菌悬液无细胞上清液细胞内容物GSH-Px1.73±0.07∗19.15±4.71∗---2.40±0.15T-SOD-19.58±1.05∗--13.72±0.99-CAT18.41±1.34∗----3.01±0.44T-AOC-0.17±0.01∗0.09±0.02∗-0.05±0.010.05±0.01
注:-,未检出
2.2 基因水平分析菌株抗氧化功能机制
2.2.1 抗氧化相关基因的引物设计
硫氧还蛋白系统、谷胱甘肽系统和是乳酸菌细胞内最主要的氧化还原调控系统[1]。硫氧还蛋白系统由硫氧还蛋白(thioredoxin,Trx)、硫氧还蛋白还原酶(thioredoxin reductase, TrxR)和还原型辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate,NADPH)组成[21]。谷胱甘肽系统主要是由还原型谷胱甘肽(glutathione,GSH)、GSH-Px、谷胱甘肽还原酶(glutathione reductase,GR)以及谷胱甘肽转硫酶(glutathione-S-transferase,GST)组成[22]。
同时,sod、cat等抗氧化酶基因表达出的SOD和CAT能够与过氧化物作用,发生还原反应,实现抗氧化的功能。根据以上抗氧化机理,选择基因注释中与抗氧化功能相关酶的基因,并设计相应引物(表2)。
2.2.2 H2O2胁迫下抗氧化相关基因的转录水平分析
为了探讨唾液乳杆菌M18-6的抗氧化机理,本研究检测了菌株在不同浓度的H2O2胁迫环境下,基因组中11个抗氧化性相关基因(表2所示)在mRNA上表达水平变化(图5)。研究结果显示,各基因均在0.5 mmol/L H2O2胁迫后出现显著表达上调,其中,NADH氧化酶(gene1634)和超氧化物歧化酶基因(sod)在2.5 mmol/L H2O2胁迫下,mRNA表达水平上调最多,分别上调了6.2和4.5倍。硫氧还蛋白系列(trxA1、trxA2、trxA3、trx)4个基因分别在2.5 mmol/L H2O2胁迫下表达上调了3.2、3.8、2.5和3.7倍,3个过氧化氢酶基因(cat 1、cat 2、cat 3)分别上调了2.3、3.3和1.2倍,gene0157基因表达水平在H2O2胁迫下未发生显著变化。推测在分子水平上,M18-6主要通过NADH氧化酶与硫氧还蛋白系统发挥抗氧化作用[23],并且sod、cat编码的抗氧化。
表2 唾液乳杆菌M18-6基因组中抗氧化功能相关编码基因及其引物设计
Table 2 Genome and primer design of L.salivarius M18-6 about antioxidant function-encoding gene

分类参考序列编号基因名称基因功能设计引物序列上游/下游 (5’-3’)Tm/℃PCR片段长度/bpWP_003861174.1trxA1硫醇还原酶硫氧还蛋白CAGCTGGTTGGTGTCCTGAT56116ACGATCTACTTCTTTTC-CATCTTCA硫氧还蛋白系统WP_003860964.1trxA2硫醇还原酶硫氧还蛋白AGCTGCTGTTTCTTGATTTG-CAT57130CATGGTGTGGTCCTTGTCGTWP_003678631.1trxA3硫醇还原酶硫氧还蛋白AAGATCATCGCTGGAATACT-CA56182TTTTTGGGCAGAATGGTGCGWP_003855300.1trx硫氧还蛋白CCACTGATATTGCTGGCTGC56125TACCTGTTGACGCGTCTGTC谷胱甘肽系统WP_003861417.1gene0157谷胱甘肽S-转移酶家族蛋白TGCTTAGGTGTGGTAAAGTCG55182GATGCCGATAGAGGTGAGGCWP_003862932.1 gene1634NADH氧化酶GCGCCAAGAAGCTAACCTTG57193ACGCCTCCTAGGCCTAAACTWP_003862560.1sod超氧化物歧化酶TGAAACAGTGCGTGTTCTCG54162CACCTGCAGTAGGAGCAAAGA抗氧化酶WP_003855300.1fnr铁氧还蛋白-NADP(+)还原酶AGCTGAATCACCACCACCTG57108ATAGCGAATGCCGAAGCACTWP_003855734.1cat 1过氧化氢酶ACTGCTAGTTACCGACCACA57129GCATGCAACCAAGCACTACCWP_011667631.1cat 2过氧化氢酶TTACTAGCTTCCAAACATGCT-TAAT56182CAACATGCGATGGATGCGTTWP_011102230.1cat 3过氧化氢酶ATAACGCTGTTGTTGGGGCA54160

图5 唾液乳杆菌M18-6基因组中抗氧化相关基因在 H2O2胁迫环境下的mRNA表达水平
Fig.5 The mRNA expression levels of antioxidant-related genes in the L.salivarius M18-6 genome under H2O2 stress
3 结论
M18-6无细胞上清液的DPPH自由基清除能力、·OH清除能力、亚油酸过氧化抑制能力均显著高于商业菌株LGG,另外,菌株的无细胞上清液中的GSH-PX与SOD活性也显著高于LGG上清液,表明菌株M18-6的无细胞上清液同时具有酶类和非酶类的抗氧化活性物质。
针对唾液乳杆菌M18-6的抗氧化机制探讨结果显示,唾液乳杆菌M18-6可能通过上调NADH氧化酶基因与硫氧还蛋白系统相关基因(gene1634、trxA1、trxA2、trxA3、trx)表达,及激活硫氧还蛋白系统呈现抗氧化作用效果,同时sod和cat基因表达上调,提高SOD、CAT酶量,提高酶活力,发挥抗氧化作用。
[1] 刘少敏.不同乳酸菌抗氧化能力比较及其机制的研究[D].哈尔滨:东北农业大学, 2015.
LIU S M.Research on the antioxidant ability and mechanism of different lactic acid bacteria[D].Harbin:Northeast Agricultural University, 2015.
[2] KULLISAAR T,ZILMER M,MIKELSAAR M,et al.Two antioxidative lactobacilli strains as promising probiotics[J].International journal of food microbiology,2002,72(3):215-24.
[3] ZHAI Q X,YIN R J,YU L L,et al.Screening of lactic acid bacteria with potential protective effects against cadmium toxicity[J].Food Control,2015,54:23-30.
[4] ATHINA A,MARJON B,LEON G,et al.Superoxide dismutase plays an important role in the survival of Lactobacillus sake upon exposure to elevated oxygen[J].Archives of microbiology,2001,176(2):79-88.
[5] 刘洋, 郭宇星,潘道东,等.4种乳酸菌体外抗氧化能力的比较研究[J].食品科学,2012,33(11):25-29.
LIU Y,GUO Y X,PAN D D,et al.Comparative antioxidant activity of four species of lactic acid bacteria in vitro[J].Food Science,2012,33(11):25-29.
[6] 赵吉春.植物乳杆菌抗氧化评价及抗氧化机制研究[D].无锡:江南大学,2018.
ZHAO J C.Evaluation of antioxidative activities of lactobacillus plantarum and the antioxidative mechanisms[D].Wuxi:Jiangnan University,2018.
[7] MASAKI S,TOHRU I,EMI Y,et al.Roles of thioredoxin and thioredoxin reductase in the resistance to oxidative stress in Lactobacillus casei[J].Microbiology,2012,158(4):953-962.
[8] KUMSAAR T,SONGISEPP E,AIMAPUU M,et al.Complete glutathione system in probiotic Lactobacillus fermentum ME-3[J].Applied biochemistry and microbiology,2010,46(5):481-486.
[9] PIOTR D,PAULINE H,PATRIK K,et al.Potato fiber protects the small intestinal wall against the toxic influence of acrylamide[J].Nutrition,2012,28(4):428-435.
[10] RUBIO R,JOFRE A,MARTIN B,et al.Characterization of lactic acid bacteria isolated from infant faeces as potential probiotic starter cultures for fermented sausages[J].Food Microbiology,2014,38:303-311.
[11] PAULRAJ K,PATTUKUMAR V,YUVARAJ N,et al.Production and purification of a novel exopolysaccharid from lactic acid bacterium Streptococcus phocae PI80 and its functional characteristics activity in vitro[J].Bioresource Technology:Biomass,Bioenergy,Biowastes,Conversion Technologies,Biotransformations,Production Technologies,2011,102(7):4 827-4 833.
[12] ZHANG L,LIU C H,LI D,et al.Antioxidant activity of an exopolysaccharide isolated from Lactobacillus plantarum C88[J].International Journal of Biological Macromolecules:Structure,Function and Interactions,2013,54:270-275.
[13] 陈臣. 植物乳杆菌ST-Ⅲ全基因组序列分析及其对低聚果糖代谢通路的解析[D].无锡:江南大学,2014.
CHEN C.Characterization of the complete genome sequence of Lactobacillus plantarum ST-Ⅲ and its pathways for fructooligosarccharides metabolism[D].Wuxi:Jiangnan University,2014.
[14] 吴思琪, 宋静颐,秦 倩,等.一种高效稳定的微生物总RNA提取方法[J].江苏农业学报,2017,33(3):517-523.
WU S Q,SONG J Y,QIN Q,et al.A high-efficiency and stable method for extracting total RNA from micro-organisms[J].Jiangsu Journal of Agricultural Science,2017,33(3):517-523.
[15] TANG W,ZHU Q X,LI C,et al.Molecular mechanisms and in vitro antioxidant effects of Lactobacillus plantarum MA2[J].Food Chemistry,2017,221(15):1 642-1 649.
[16] 李卫娜, 赵波,柳陈坚,等.副干酪乳杆菌胞外多糖抗氧化活性分析[J].食品工业科技,2019,40(24):34-39.
LI W N,ZHAO B,LIU C J,et al.Antioxidant activity analysis of exopolysaccharide from Lactobacillus paracasei strains[J].Science and Technology of Food Industry,2019,40(24):34-39.
[17] 王曦, 罗霞,许晓燕,等.不同乳酸菌菌株抗氧化能力的比较研究[J].食品科学,2010,31(9):197-201.
WANG X,LUO X,XU X Y,et al.Comparative studies on antioxidant activities of different lactic acid bacteria strains[J].Food Science,2010,31(9):197-201.
[18] 吴祖芳, 洪松虎,沈锡权,等.乳酸菌高抗氧化活性菌株的筛选及鉴定[J].中国食品学报,2010,10(1):73-78.
WU Z F,HONG S H,SHEN X Q,et al.Screening and identification of lactic acid bacteria stains with high antioxidant activity[J].Journal of Chinese Institute of Food Science and Technology,2010,10(1):73-78.
[19] ATHINA A,EDDY J,MARJON H,et al.Antioxidative properties of Lactobacillus sake upon exposure to elevated oxygen concentrations[J].FEMS Microbiology Letters,2001,203(1):87-94.
[20] 乔娜. 副干酪乳杆菌(Lactobacillus paracasei)HD1.7抗氧化活性的研究[D].哈尔滨:黑龙江大学,2014.
QIAO N.Study on antioxidant activity of Lactobacillus paracasei HD1.7[D].Harbin:Heilongjiang University,2014.
[21] DU Y T,ZHANG H H,ZHANG X,et al.Thioredoxin 1 is inactivated due to oxidation induced by peroxiredoxin under oxidative stress and reactivated by the glutaredoxin system[J].The Journal of biological chemistry,2013,288(45):32 241-32 247.
[22] 段希宇, 叶陵,刘成国,等.乳酸菌的抗氧化作用机制[J].微生物学杂志,2017,37(3):111-115.
DUAN Y X,YE L,LIU C G,et al.The antioxidative mechanism of lactic acid bacteria[J].Journal of Microbiology,2017,37(3):111-115.
[23] 左芳雷. 长双歧杆菌BBMN68氧胁迫应答机制的转录组学研究及差异表达基因的功能分析[D].北京:中国农业大学,2014.
ZUO F L.Transcriptomic characterization of the oxidative stress response in Bifiddobacterium longum subsp.longum BBMN68 and functional analysis of differentially expressed genes[D].Beijing:China Agricultural University,2014.