随着工业的发展,重金属污染日趋严重。由于环境中的重金属可以通过生物富集作用进入农产品中,危害人体健康,所以解决食品中重金属污染问题十分重要。铅(Pb)、镉(Cd)作为被联合国粮农组织(Food and Agriculture Organization,FAO)和世界卫生组织(World Health Organization,WHO)确认的对人体毒性最强的2种重金属,广泛分布于自然界中,其污染可通过食物链传播[1]。如何有效去除食品中的Pb、Cd污染已经引起广泛关注。对比传统的物理化学方法,用微生物去除食品中的重金属更加经济高效,且前景广阔[2]。
在各类食品中,尤以谷物类和蔬菜类食品中Pb、Cd的健康风险值最高[3]。杀虫剂等农药的使用及土壤中该类重金属含量超标都会提高蔬菜、水果中的Pb含量,对人体产生潜在危害。酵素是以新鲜蔬果、植物等为原料,经乳酸菌、酵母菌等有益菌发酵而成的功能性产品,富含酶、维生素、矿物质等营养成分[4]。酵素中的微生物是酵素发挥一系列功能的主要原因,能够抑制有害菌、改良土壤结构、增加作物产量,从而生产对环境无害的产品[5]。韦文芳等[6]通过将自制酵素喷洒在农作物上明显提高了氧化乐果、毒死蜱等5种农药的降解作用。部分乳酸菌可以吸附积累食品中的重金属[7-8],而酵素中含有大量的乳酸菌,因此酵素在去除食品重金属污染方面也有很大应用潜力。傅亚平等[7]利用植物乳杆菌(Lactobacilius plantarum)和戊糖片球菌(Pediococcus pentosaceus)复合发酵有效去除了大米中85.73%的Cd。从中国传统泡菜中分离出的L.plantarum 70810 EPS具有较好的铅吸附效果[8]。利用酵素中存在的乳酸菌等复合微生物不但可以去除果蔬、土壤中的重金属,这些有益菌也可以避免微生物修复后的残留污染,对人体无害,安全性高。水果酵素是由较常见的、价格低廉且原材料容易获取的水果发酵而成,农户可以自行制作,直接将酵素喷洒到种植蔬菜、农作物的土壤中达到去除部分重金属污染的目的。但是,目前对于水果酵素发酵过程中细菌群落结构,尤其是乳酸菌群动态变化的研究较少。为此,本文将水果、蔬菜及植物进行搭配发酵,以2种自制酵素为研究对象,利用高通量测序技术对不同发酵时段酵素样品中微生物群落结构动态进行分析和比较;对酵素样品中优势乳酸菌进行分离,并测定代表性菌株的Pb2+和Cd2+耐受性以及吸附和积累量。以期实现利用酵素中微生物去除食品中的重金属污染。
1 材料与方法
1.1 自制酵素样品制备
自制酵素样品AA以m(苹果)∶m(橘子)∶m(米糠)=4∶4∶1为原料,按m(水)∶m(糖)∶m(原料)=10∶1∶3配制;AB以m(苹果)∶m(橘子)∶m(圆葱)∶m(艾草)∶m(米糠)=3∶3∶1∶1∶1为原料,按m(水)∶m(糖)∶m(原料)=10∶1∶3配制。原料捣碎与糖、水混合均匀,室温自然发酵,每天搅拌1次。在发酵4个时段(10、20、40和120 d)取样进行测序。
1.2 自制酵素样品细菌群落高通量测序
利用细菌基因组DNA提取试剂盒(TIANamp Bacteria DNA Kit)提取各时段酵素样品中菌体DNA,通过高通量测序Hiseq-PE250平台进行细菌16S rRNA V3-V4区域扩增子测序分析。基于Illumina HiSeq测序平台,利用双末端测序(Paired-End)方法,构建小片段文库进行测序。通过对Reads拼接过滤,操作分类单位(operational taxonomic unit,OTU)聚类,进行物种注释及丰度分析。
1.3 自制酵素中乳酸菌的分离及系统发育分析鉴定
用于分离乳酸菌的乳酸菌培养基(MRS,g/L):蛋白胨10,牛肉膏10,酵母膏5,柠檬酸氢二胺2,葡萄糖20,吐温80 1 mL,乙酸钠5,K2HPO4 2,MgSO4 0.58,MnSO4 0.25,琼脂18,定容至1 L,pH 6.2~6.6。121 ℃灭菌20 min。
用TIANamp Bacteria DNA Kit提取纯菌株总DNA。用引物27F和1492R[9]扩增16S rRNA基因,扩增体系:25 μL体系,DNTP Mix(2.5 mmol/L)2 μL,10×Taq Buffer 2.5 μL,ddH2O 17.3 μL,引物27F和1492R各1 μL,Taq(5 U/μL,TaKaRa ExTaqTM) 0.2 μL,模板DNA 1 μL;扩增反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,26~30个循环;72 ℃后延伸10 min,扩增片段约1 500 bp。PCR产物用10 g/L琼脂糖凝胶电泳检测后送至美吉桑格生物医药科技有限公司测序,测序结果与GenBank上已知序列进行比对,利用MEGA7软件中的邻接法(neighbor-joining analysis)构建系统发育树。
1.4 分离菌株的重金属耐性研究
在重金属Pb2+、Cd2+胁迫条件下测定分离菌株的生长曲线及最小抑菌浓度(minimal inhibitory concentration,MIC)[10],判断菌株对Pb2+、Cd2+耐受性。
(1)重金属原液配制:将CdCl2·2/3H2O、Pb(NO3)2分别溶于超纯水中配制成Pb2+、Cd2+金属原液。121 ℃灭菌20 min,4 ℃保存。
(2)设置Pb2+和Cd2+金属培养液梯度为50、100、200和300 mg/L,同时设置一组不加重金属的空白对照。每个质量浓度设3个平行。将MRS液体培养基分装到试管中,121 ℃灭菌20 min。冷却至室温后加入相应浓度重金属原液。
(3)分别移取3种菌株原液加入到液体培养基中,接种量1%(体积分数),30 ℃摇床恒温培养。
(4)培养一定时间后分别取样,测定菌液样品OD600值。
1.5 分离菌株的重金属吸附与积累测定
通过用EDTA洗脱细菌细胞表面吸附的重金属,初步分析重金属吸附率[11];洗脱后用HNO3溶液消解分析菌体内重金属积累量。
(1)配制100 mg/L Pb2+金属培养液,设3个平行,测定初始质量浓度ρ0。加入体积分数1%菌体原液,30 ℃培养。
(2)将培养后的菌液混匀离心,取上清液到新离心管中,测定其质量浓度(ρ)。
(3)向菌体沉淀样品中加入5 mL EDTA洗脱液(0.5 mol/L,pH 8),混匀使充分洗脱后离心,移取洗脱液至新离心管中待测。重复此步骤4~5次,直至菌株表面金属离子彻底洗脱。
(4)将洗脱后菌体沉淀放于80 ℃烘箱烘干至恒定质量,称量菌体干质量m干。向干燥菌体中加入4 mL 体积分数60% HNO3溶液进行消解,80 ℃水浴3 h;冷却至室温后加入500 μL H2O2,90 ℃水浴1 h。将消解液转移到新离心管中,用1% HNO3溶液补足至5 mL[6]。测定其质量浓度(ρ2)。
(5)将所有待测样品用0.22 μm滤膜过滤后用原子吸收光谱仪(iCETM 3300 AAS,美国Thermo Fisher)测定金属离子质量浓度。
(1)
(2)
式中:β,金属离子去除率,%;ρ0,溶液初始金属离子质量浓度,mg/L;ρ,加菌培养后金属离子质量浓度,mg/L;ω,菌体内金属离子积累量,mg/g;ρ2,消解样品金属离子质量浓度,mg/L;V,待测消解液体积,L;m干,菌体干质量,g。
试验数据采用SPSS 24.0软件进行单因素方差分析(ANOVA),对各菌株间去除率或积累量进行差异显著性检验(P<0.05)。
2 结果与分析
2.1 自制酵素中细菌群落结构动态分析
2.1.1 Alpha多样性分析
高通量测序共获得230 940条有效序列,其中10、20 d有效序列共87 374条,共划分923个OTU;40 d为67 517条,共划分624个OTU;120 d为76 049条,共划分2 775个OTU。8个样品Coverage都在0.995以上,说明本次测序结果能较真实地反映微生物群落情况(表1)。2个发酵样品120 d时Observed species、Shannon、Simpson和Chao1指数最高,而20 d时最低。表现出发酵时间越长细菌群落多样性越高的趋势,但是2种发酵样品同一时段多样性指数有所差异,说明酵素样品原料配比差异性会诱导细菌群落多样性的不同。
2.1.2 酵素样品细菌群落多样性相对丰度分析
门水平细菌群落相对丰度分析结果如图1-a。以厚壁菌门(Firmicutes)为主(丰度>57%),其次是变形菌门(Proteobacteria)(丰度<16.8%)。与其他时段相比,发酵20 d时厚壁菌门相对丰度最大为97.7%。发酵120 d时厚壁菌门相对丰度降至4个时段最低,为58.1%;此时变形菌门(16.6%~16.8%)、放线菌门(Actinobacteria)(4.9%~5.7%)等其他菌门相对丰度最大,细菌群落多样性最高(表1)。
表1 酵素中细菌群落Alpha多样性指数
Table 1 The bacterial community Alpha diversity index of the Jiaosu samples
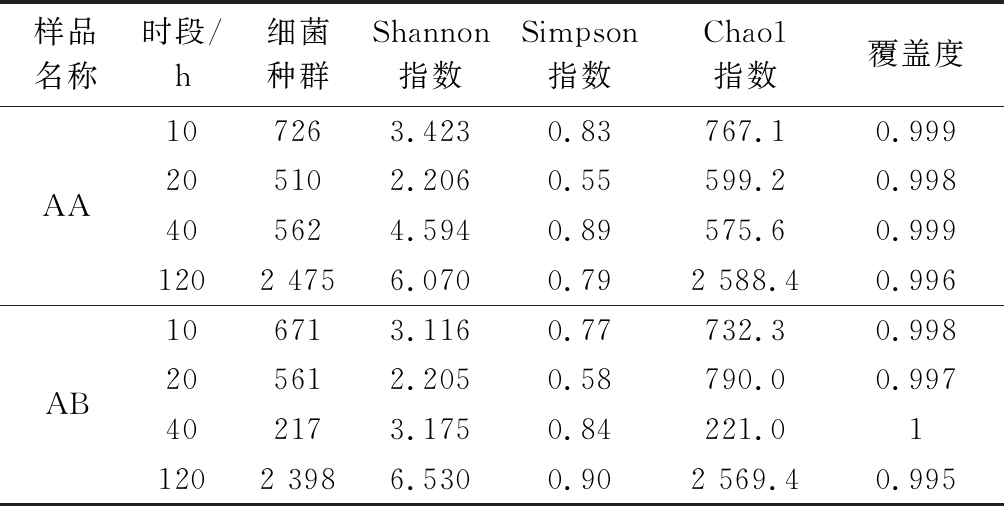
样品名称时段/h细菌种群Shannon指数Simpson指数Chao1指数覆盖度AA107263.4230.83767.10.999205102.2060.55599.20.998405624.5940.89575.60.9991202 4756.0700.792 588.40.996AB106713.1160.77732.30.998205612.2050.58790.00.997402173.1750.84221.011202 3986.5300.902 569.40.995
属水平细菌群落相对丰度分析结果如图1-b。2个样品中菌群变化大致相同,其中乳酸杆菌属(Lactocacillus)在4个发酵阶段相对丰度均占优势(25.8%~70.9%),发酵20 d时丰度最高达70.9%。此外,发酵10~40 d时相对丰度较高的有魏斯氏菌属(Weissella)(4%~36.2%)、片球菌属(Pediococcus)(8.4%~25.4%)和明串珠菌属(Leuconostoc)(1%~23.2%),120 d后3种菌属相对丰度明显下降。
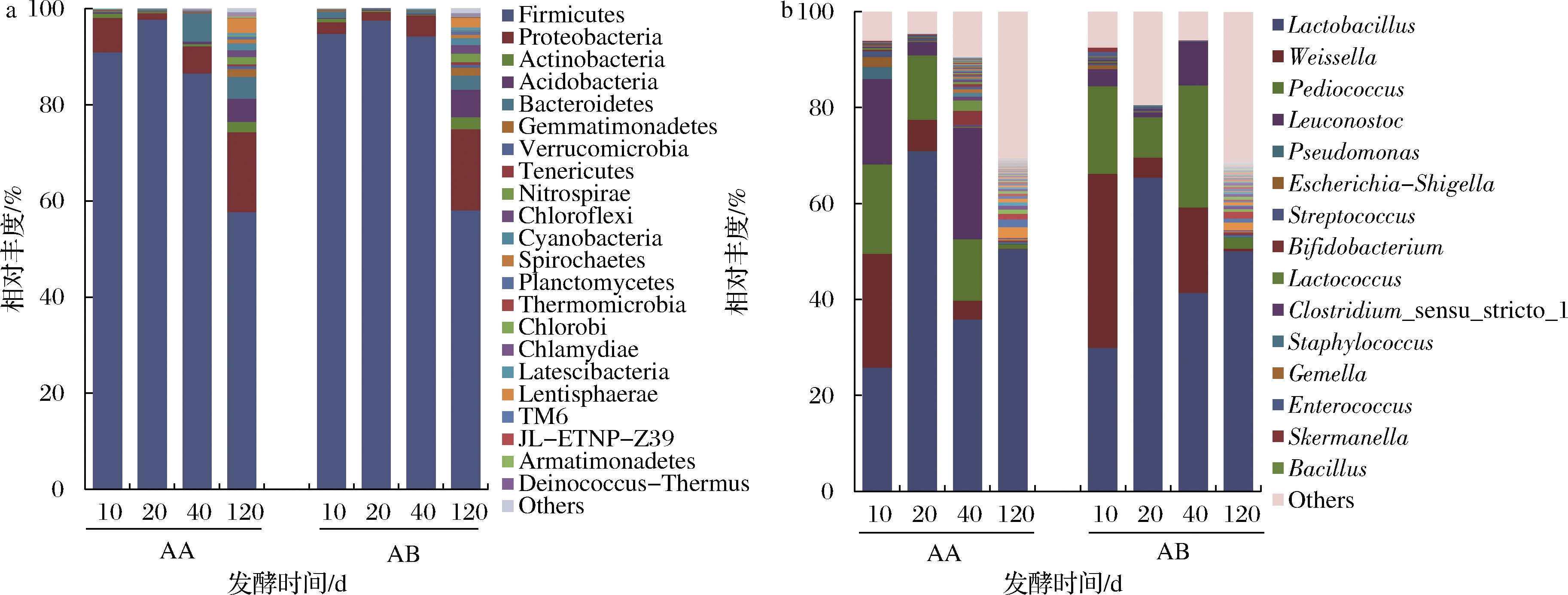
a-门水平;b-属水平
图1 细菌群落相对丰度分析
Fig.1 Analysis of relative abundance of bacterial community
2.1.3 酵素样品部分乳酸菌及致病菌不同时段相对丰度分析
为了解不同发酵时段种水平乳酸菌和大肠杆菌等的变化,进行了进一步详细分析。酵素中部分乳酸菌和致病菌菌群相对丰度变化如图2所示。2组样品在发酵10 d时戊糖乳杆菌(Lactobacillus pentosus)和戊糖片球菌(P.pentosaceus)相对丰度分别为23%和18%,是优势乳酸菌。发酵20 d时戊糖乳杆菌丰度急剧上升至65.5%,而大肠杆菌(Escherichia coli)丰度较初期(2.1%)急剧下降至0.14%。发酵40 d时戊糖乳杆菌和戊糖片球菌丰度急剧下降,而假肠膜明串珠菌(Leuconostoc pseudomesenteroides)、棒状乳杆菌(Lactobacillus coryniformis)、干酪乳杆菌(Lactobacillus casei)成为优势乳酸菌,3者共同丰度最高可达42.9%。随着发酵时间延长假肠膜明串珠菌丰度下降,到120 d时2种样品中只剩棒状乳杆菌和干酪乳杆菌。同时,金黄色葡萄球菌数量逐渐增多。可见不同发酵时期种水平乳酸菌和致病菌相对丰度有明显变化。
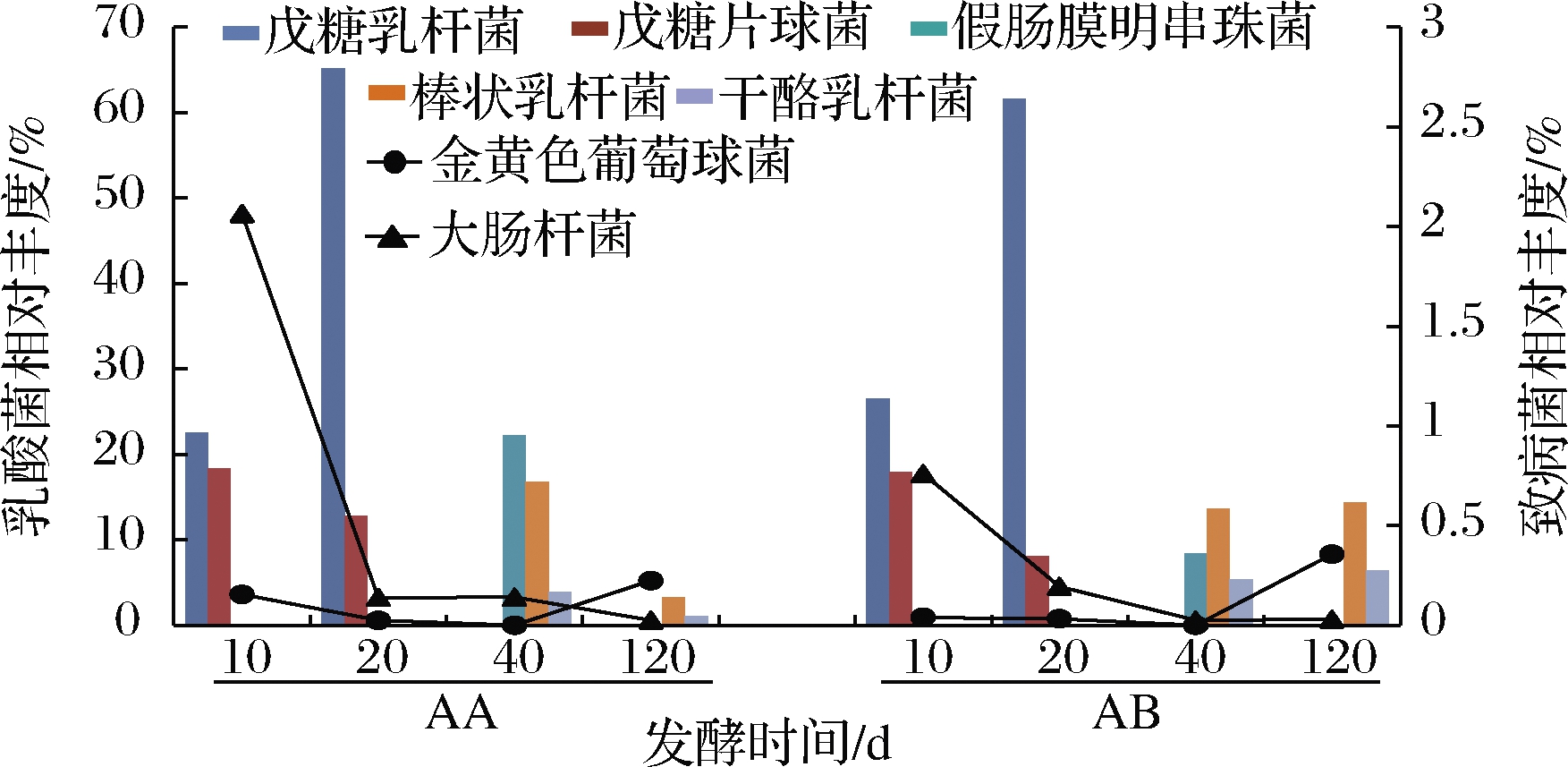
图2 酵素中部分乳酸菌、致病菌菌群相对丰度变化
Fig.2 Relative abundance of some lactic acid bacteria and pathogenic bacteria in Jiaosu
如图3所示,2组酵素样品在发酵120 d内pH一直保持在酸性条件(pH<4.5)。且随着发酵时间延长pH缓慢增加。当发酵10~20 d时pH值在3以下,而40~120 d时pH达3.5~4.05,同时乳酸菌和致病菌丰度也发生明显变化(图2)。发酵前20 d(pH 3.3)时乳酸菌丰度最高,致病菌丰度最低;发酵120 d(pH 4左右)时乳酸菌丰度减少且种群发生变化,致病菌有增长趋势。
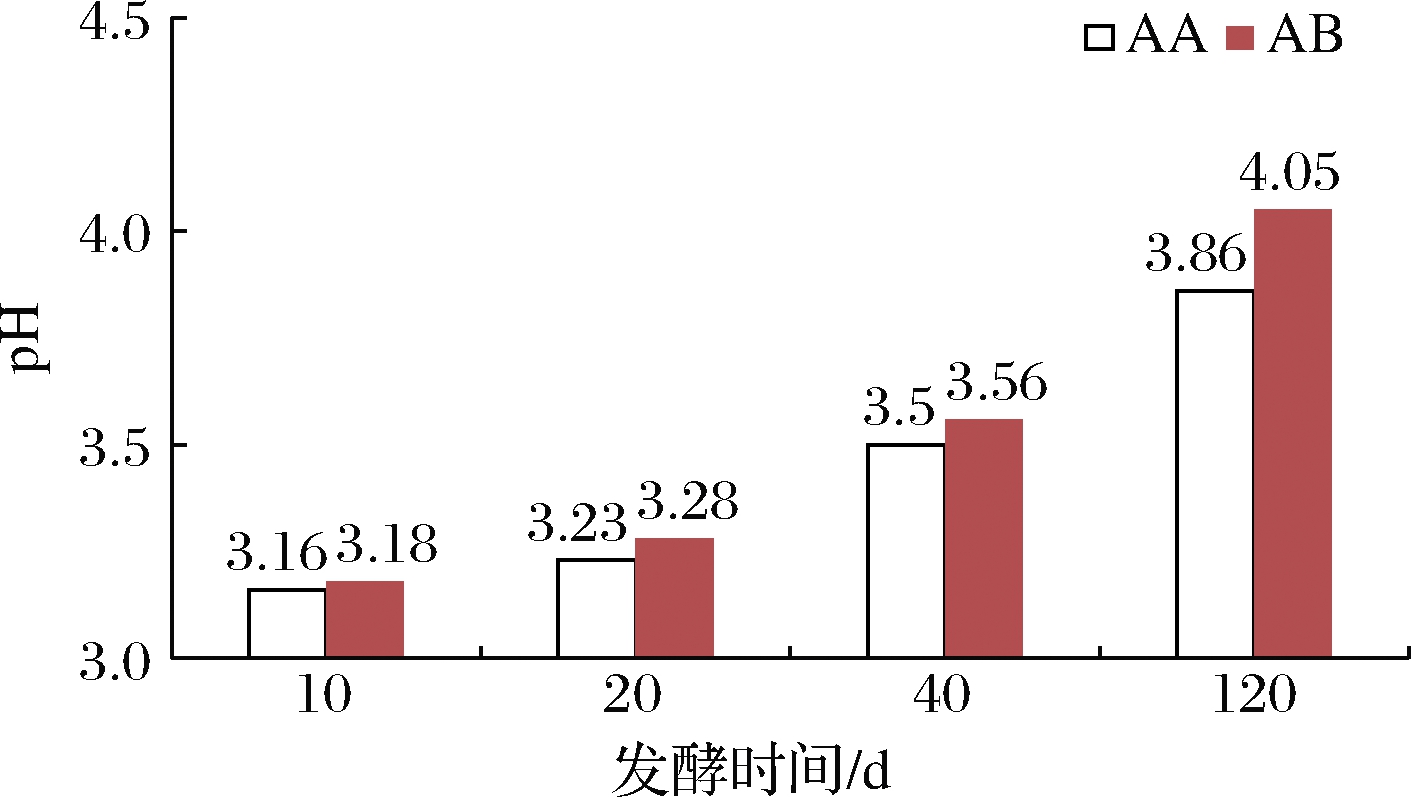
图3 酵素样品AA、AB不同时段pH测定
Fig.3 pH measurement of Jiaosu samples AA and AB in different periods
2.2 自制酵素中分离乳酸菌菌株的系统发育分析
通过分离纯化共得到39株菌种,包括32株乳酸杆菌(Lactobacillus)和7株片球菌(Pedicoccus)。将菌株16S rRNA序列与NCBI数据库比对,构建系统发育树如图4。39株菌共聚类分成6簇。类群Ⅰ(17株)、Ⅱ(2株)、Ⅲ(8株)、Ⅳ(AB13)、Ⅴ(7株)和Ⅵ(4株)分别近缘于短乳杆菌(Lactobacillus brevis)、布氏乳杆菌(L.buchneri)、戊糖乳杆菌(L.pentosus)、牛痘乳杆菌(L.vaccinostercus)、酒窖片球菌(Pediococus cellicola)和棒状乳杆菌(L.coryniformis)。所有分离菌株与亲缘菌的16S rRNA基因相似度均达99%以上。基本成功分离了不同发酵时段的关键乳酸菌。
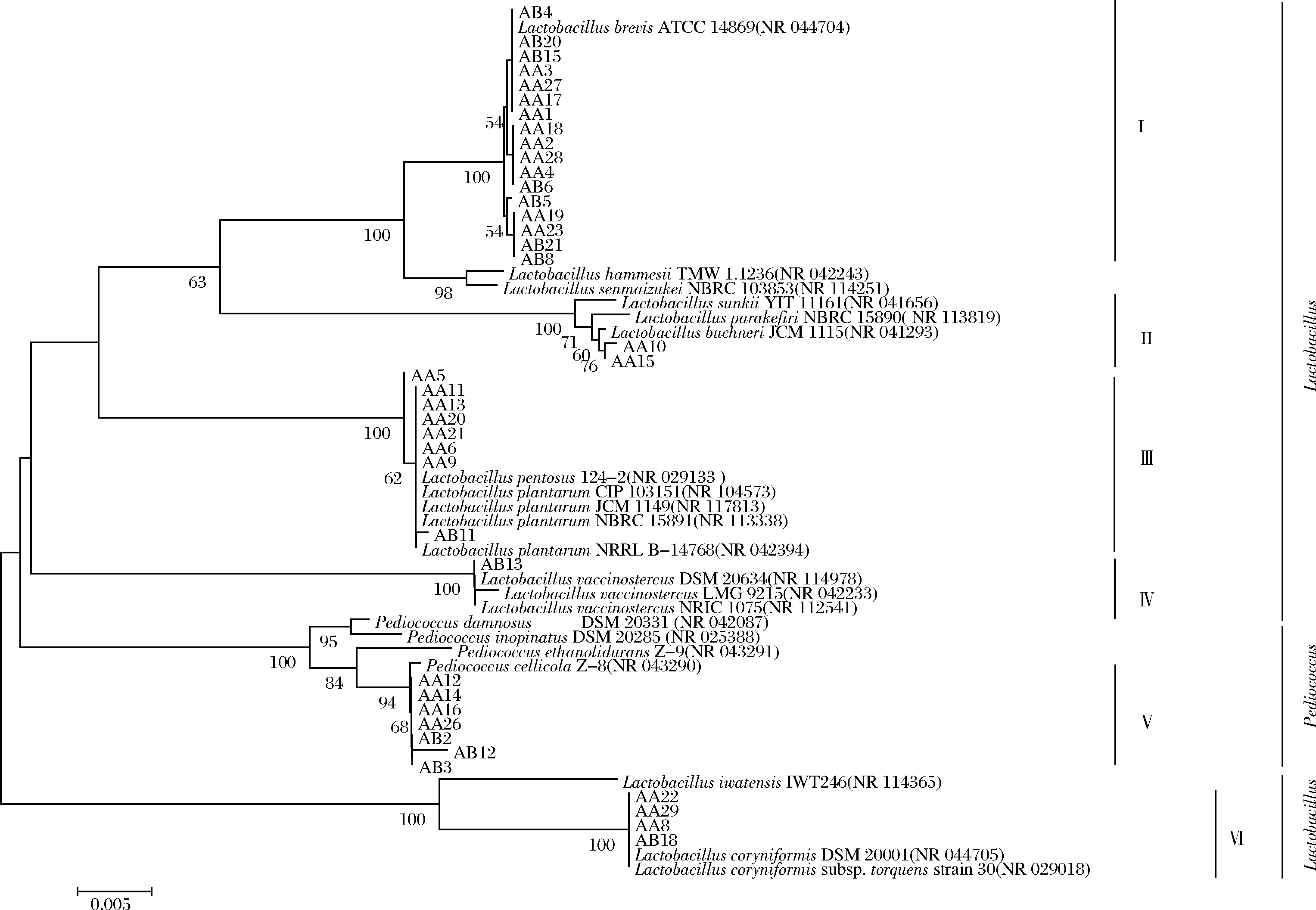
图4 基于菌株16S rRNA序列构建的系统发育树
Fig.4 Phylogenetic tree based on strain 16S rRNA sequence
2.3 分离菌株重金属耐性分析
选取发酵过程中主要菌群的3株代表菌:短乳杆菌AA1、戊糖乳杆菌AA11和酒窖片球菌AA12,测定其在MRS液体培养基(pH 6.5),重金属Pb2+、Cd2+胁迫条件下的生长曲线得出:3株菌在Pb2+胁迫条件下(图5-a)表现出较强耐受性,在300 mg/L Pb2+条件下均生长良好;而在50 mg/L Cd2+胁迫条件下(图5-b)其生长明显受到抑制。将多次测定OD值没有增长变化的重金属离子浓度作为MIC,可知:菌株AA1、AA11和AA12对Pb2+的MIC>300 mg/L;对Cd2+的MIC<100 mg/L。
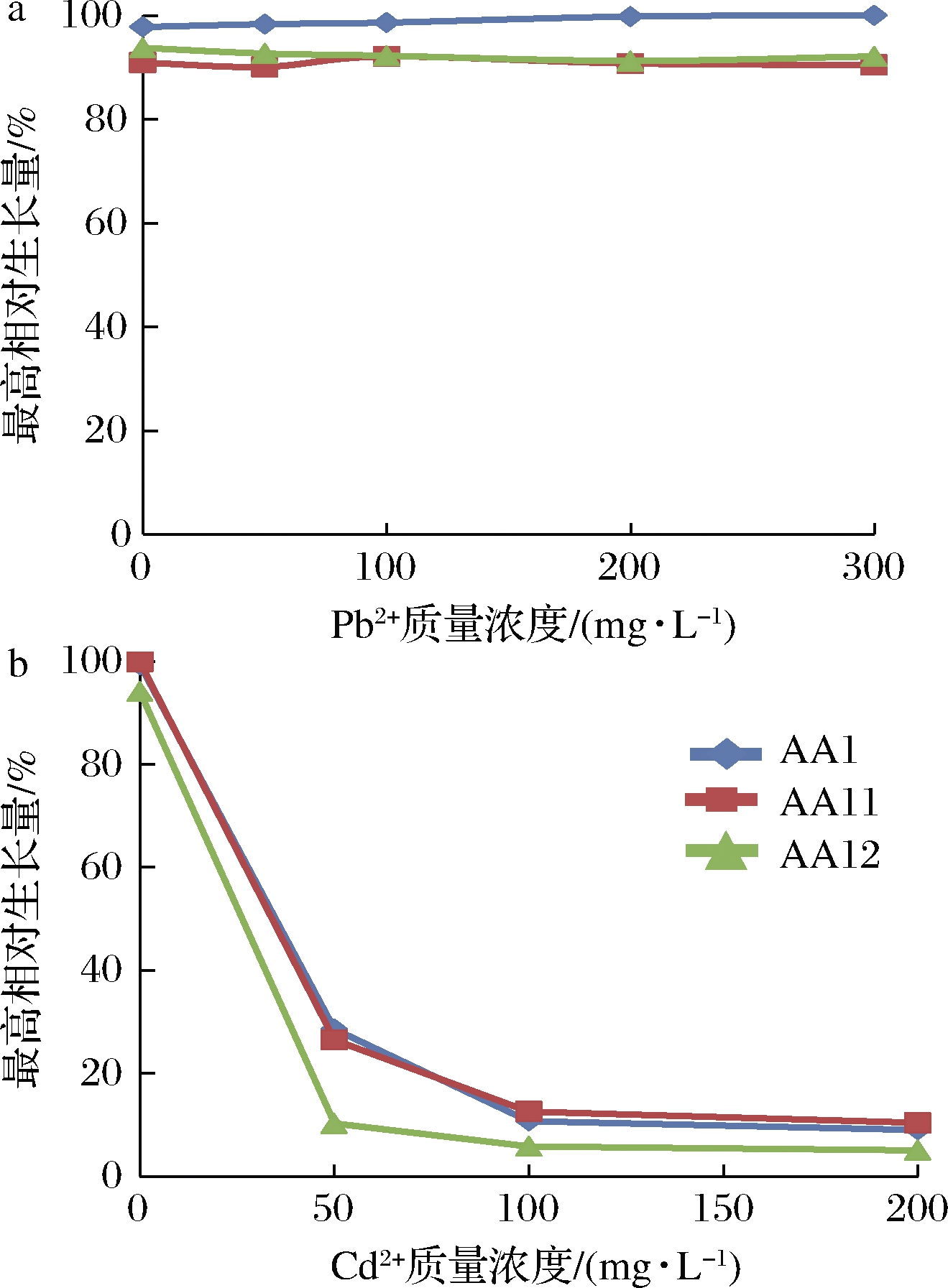
a-Pb2+;b-Cd2+
图5 Pb2+、Cd2+胁迫条件下3株菌最高相对生长量
Fig.5 The maximum relative growth of 3 strains under Pb2+,Cd2+ stress
2.4 分离菌株对Pb2+的吸附与积累测定
为进一步了解分离菌株对重金属Pb2+的吸附和积累特性,选择发酵20 d时3株代表菌株AA1、AA11和AA12进行Pb2+生物吸附及体内积累量测定。根据最终浓度绘制3株菌对Pb2+的去除率和体内积累量(图6)。样品初始Pb2+质量浓度为98.73 mg/L,将菌株AA1、AA11和AA12对数生长期菌液离心得上清液质量浓度分别为39.65、21.25和43.80 mg/L,得出对Pb2+去除率分别为59.84%、78.47%和55.63%。为分析细菌细胞内Pb2+积累量,洗脱菌体5次至Pb2+浓度在检测线以下(≤1%)。洗脱细胞外重金属后用HNO3溶液消解干菌体,最终得出3株菌体内Pb2+积累量分别为1.59、2.13和1.36 mg/g(DW)。其中,菌株AA11对Pb2+的去除率和积累量明显高于菌株AA1和AA12(P<0.05)。
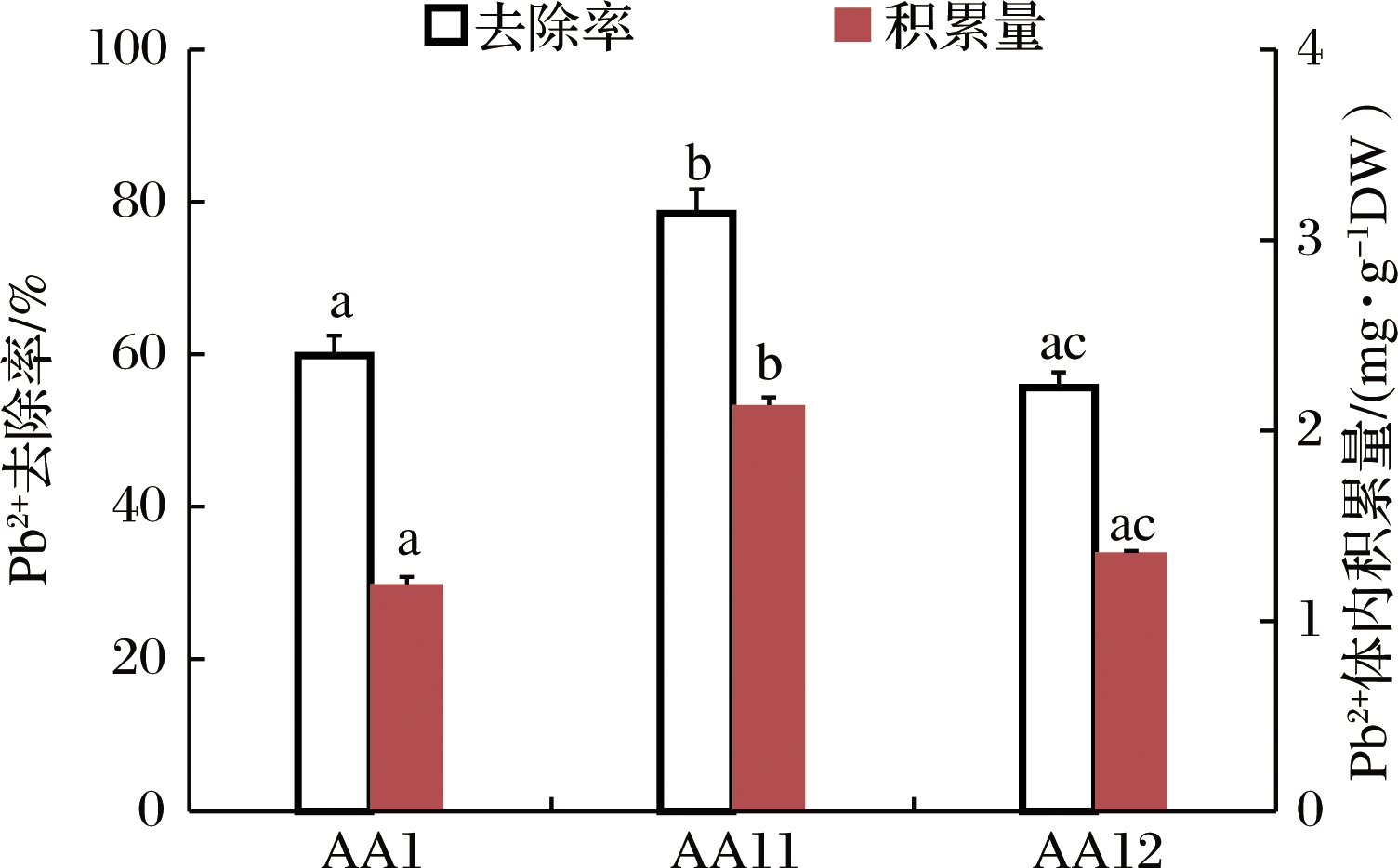
图6 三株代表菌对Pb2+的去除率和体内积累量
Fig.6 Removal rate and accumulation of Pb2+ by three representative strains 注:不同字母表示菌株间去除率或积累量差异显著(P<0.05)
3 结论与讨论
发酵成分有所差异的发酵液在发酵过程中总体细菌群落变化基本一致,说明发酵成分对乳酸菌富集过程影响不大。但不同时段菌种发生明显变化,当发酵20 d时乳酸菌属占绝对优势(图1),这与高庆超等[12]在黑果枸杞酵素发酵过程中的结果一致。此时戊糖乳杆菌(61.6%~65.2%)成为优势菌群,且群落结构多样性相较于其他3个时段最低,这可能是由于乳酸杆菌等乳酸菌产生的乳酸在抑制杂菌生长的同时,较强酸性生境条件(pH 3.2,图3)富集了乳酸菌[13]。且该时段致病菌等杂菌明显受到抑制(图2),故为发酵最优时段。戊糖乳杆菌生存环境pH 3左右时对大肠杆菌、金黄色葡萄球菌等有害菌的抑制效果最好[14];其他乳酸菌,如戊糖片球菌、短乳杆菌(L.brevis ATCC 14869)、布氏乳杆菌、植物乳杆菌等均能抑制致病菌和菌毒素[15-21]。上述结果支持了本研究中关于发酵20 d是乳酸菌相对丰度占比最大时段且大肠杆菌等明显受到抑制的现象。在发酵40~120 d时微生物多样性明显上升(图1),其他菌群丰度增加,而戊糖乳杆菌和片球菌也被假肠膜明串珠菌、棒状乳杆菌和干酪乳杆菌所取代且总体丰度降低(图2)。这可能是由于发酵液pH上升(图3),其他菌群开始生长并竞争营养物的能力比乳酸菌强且逐渐抑制其生长所致。此阶段大肠杆菌生长持续被抑制,但金黄色葡萄球菌在发酵120 d时表现出生长趋势(图2),说明戊糖乳杆菌对致病菌的抑制作用比其他乳酸菌强。在重金属耐性实验中,3株代表菌AA1、AA11、AA12在高浓度Pb2+胁迫条件下表现出较强耐受性。这与张利[22]分离的乳酸菌在Pb2+胁迫条件下MIC >400 mg/L结果相对应。相比于Pb2+,3株菌对Cd2+耐受性表现较差(图5),可能是由于Cd2+浓度过高导致细胞的微观结构受到破坏[23]。在吸附积累实验中,3株优势乳酸菌代表菌株均具有较好的Pb2+去除能力(>55.63%),其中戊糖乳杆菌AA11对Pb2+去除能力明显强于短乳杆菌AA1和酒窖片球菌AA12(P<0.05)(图6),表明乳酸菌菌种间有差异,且暗示了自制酵素具有较好的去除Pb2+的潜力。同时有研究表明乳酸杆菌主要通过其细胞壁表面的表层蛋白或官能团吸附重金属离子[24-26],稳定性好[27]且对肠道Pb2+毒性有缓解作用[28]。
本文不仅研究了乳酸菌等有益菌群的动态变化,还对大肠杆菌等致病菌群进行了相对丰度分析;同时得出在发酵20 d时乳酸菌相对丰度最高且能抑制大肠杆菌等有害菌,是最适合的发酵期;戊糖乳杆菌作为优势乳酸菌对Pb2+具有较强的耐性和去除作用,在食品重金属去除领域有潜在应用价值。对于酵素在铅污染环境中的实用性需进一步探索。
[1] 付鹏钰,李杉,杨丽,等.2015年河南省常见食品中重金属污染调查分析[J].华南预防医学,2018,44(4):101-103.
FU P Y,LI S,YANG L,et al.Heavy metal pollution in common food in Henan Province,2015[J].South China Journal of Preventive Medicine,2018,44(4):101-103.
[2] 李畅, 贾原博,赵晓峰,等.乳酸菌对重金属吸附作用的研究进展[J].微生物学通报,2018,45(10):2 254-2 262.
LI C,JIA Y B,ZHAO X F,et al.Research progress in the adsorption of heavy metals by lactic acid bacteria[J].Microbiology China,2018,45(10):2 254-2 262.
[3] 杨洋, 操基玉,陈栋,等.安徽省六安市2 013-2016年各类食品中重金属铅镉暴露量及风险评估[J].中国热带医学,2019,19(7):671-674.
YANG Y,CAO J Y,CHEN D,et al.The exposure and risk assessment of heavy metals lead and cadmium in all kinds of food,Lu’an,Anhui,2 013-2016[J].Chinese Tropical Medicine,2019,19(7):671-674.
[4] 冯彦君, 张慜,韩宇斌.麦苗酵素发酵工艺的优化及其抗氧化功能[J].食品与生物技术学报,2018,37(2):165-170.
FENG Y J,ZHANG M,HAN Y B.Optimization of the fermentation process of barley ferment and study on its antioxidant properties[J].Journal of Food Science and Biotechnology,2018,37(2):165-170.
[5] 冯蕾, 赵运林,彭姣,等.酵素菌微生物在农业生产中的应用进展[J].现代农业科技,2016(1):220-223.
FENG L,ZHAO Y L,PENG J,et al.Advance on application of development of microbial fertilizer enzyme[J].Modern Agricultural Science and Technology,2016(1):220-223.
[6] 韦文芳, 梁春红,唐千淄,等.环保酵素对田间种植蔬菜残留农药的降解作用[J].广西农学报,2016,31(3):24-26,30.
WEI W F,LIANG C H,TANG Q Z,et al.Study on degradation of the pesticide residues in vegetables by spraying garbage enzyme[J].Journal of Guangxi Agriculture,2016,31(3):24-26,30.
[7] 傅亚平, 廖卢艳,刘阳,等.乳酸菌发酵技术脱除大米粉中镉的工艺优化[J].农业工程学报,2015,31(6):319-326.
FU Y P,LIAO L Y,LIU Y,et al.Optimization of fermentation process of removal of cadmium in rice powder using lactic acid bacteria[J].Transactions of the Chinese Society of Agricultural Engineering,2015,31(6):319-326.
[8] FENG M Q,CHEN X H,LI C C,et al.Isolation and identification of an exopolysaccharide-producing lactic acid bacterium strain from Chinese Paocai and biosorption of Pb(II) by its exopolysaccharide[J].Journal of Food Science,2012,77(6):T111-T117.
[9] FRANK J A,REICH C I,SHARMA S,et al.Critical evaluation of two primers commonly used for amplification of bacterial 16S rRNA genes[J].Applied and Environmental Microbiology,2008,74(8):2 461-2 470.
[10] WIEGAND I,HILPERT K,HANCOCK R E W.Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances[J].Nature Protocols,2008,3(2):163-175.
[11] 袁浩, 卢梦涵,刘宏伟,等.矿区复合污染土壤真菌多样性及其对稀土-重金属离子的吸附特征[J].微生物学报,2019,59(12):2 334-2 345.
YUAN H,LU M H,LIU H W,et al.Fungal community structure in mining soil and its adsorption kinetics of rare earth-heavy metal ions[J].Acta Microbiologica Sinica,2019,59(12):2 334-2 345.
[12] 高庆超, 常应九,马蓉,等.黑果枸杞酵素自然发酵过程中微生物群落的动态变化[J].食品与发酵工业,2019,45(13):126-133.
GAO Q C,CHANG Y J,MA R,et al.Dynamic changes in microbial community during natural fermentation of Lycium ruthenicum Murr.enzyme[J].Food and Fermentation Industries,2019,45(13):126-133.
[13] SAHADEVA R P K,LEONG S F,CHUA K H,et al.Survival of commercial probiotic strains to pH and bile[J].International Food Research Journal,2011,18(4):1515-1522.
[14] 朱英莲. 戊糖乳杆菌细菌素的抑菌特性研究[J].食品科技,2015,40(5):295-298.
ZHU Y L.The antibacterial properties of the bacteriocin of Lactobacillus pentoeus[J].Food Science and Technology,2015,40(5):295-298.
[15] VIDHYASAGAR V,JEEVARATNAM K.Evaluation of Pediococcus pentosaceus strains isolated from Idly batter for probiotic properties in vitro[J].Journal of Functional Foods,2013,5(1):235-243.
[16] ALBANO H,OLIVEIRA M,AROSO R,et al.Antilisterial activity of lactic acid bacteria isolated from "Alheiras" (traditional Portuguese fermented sausages):In situ assays[J].Meat Science,2007,76(4):796-800.
[17] 曹振辉, 潘洪彬,张鲜焰,等.戊糖片球菌的益生功能及其在食品科学领域中的应用[J].安徽农业科学,2016,44(9):106-108.
CAO Z H,PAN H B,ZHANG X Y,et al.Application of the beneficial function of Pediococcus pentosaceus in the field of food science[J].Journal of Anhui Agricultural Sciences,2016,44(9):106-108.
[18] JAKAVA-VILJANEN M,AVALL-JAASKELAINEN S,MESSNER P,et al.Isolation of three new surface layer protein genes (slp) from Lactobacillus brevis ATCC 14869 and characterization of the change in their expression under aerated and anaerobic conditions[J].Journal of Bacteriology,2002,184(24):6 786-6 795.
[19] KHALEGHI M,KERMANSHAHI R K,YAGHOOBI M M,et al.Assessment of bile salt effects on S-layer production,slp gene expression and some physicochemical properties of Lactobacillus acidophilus ATCC 4356[J].Journal of Microbiology and Biotechnology,2010,20(4):749-756.
[20] LI P C,YIN Y Y,YU Q H,et al.Lactobacillus acidophilus S-layer protein-mediated inhibition of Salmonella-induced apoptosis in Caco-2 cells[J].Biochemical and Biophysical Research Communications,2011,409(1):142-147.
[21] LI P C,YU Q H,YE X L,et al.Lactobacillus S-layer protein inhibition of Salmonella-induced reorganization of the cytoskeleton and activation of MAPK signalling pathways in Caco-2 cells[J].Microbiology,2011,157(9):2 639-2 646.
[22] 张利. 降铜、铅离子乳酸菌的筛选及机制初探[D].咸阳:西北农林科技大学,2017.
ZHANG L.Screening of lactic acid bacteria lowering copper and lead and exploring of their mechanism[D].Xianyang:Northwest A & F University,2017.
[23] 邵鑫, 孙凯,熊婧,等.耐镉乳酸菌对重金属镉的吸附机制[J].食品与发酵工业,2017,43(3):48-53,60.
SHAO X,SUN K,XIONG J,et al.The cadmium removal mechanism of Lactobacillus strains[J].Food and Fermentation Industries,2017,43(3):48-53,60.
[24] GERBINO E,MOBILI P,TYMCZYSZYN E,et al.FTIR spectroscopy structural analysis of the interaction between Lactobacillus kefir S-layers and metal ions[J].Journal of Molecular Structure,2011,987(1-3):186-192.
[25] TONG Y J,ZHAI Q X,WANG G,et al.System-wide analysis of manganese starvation-ind uced metabolism in key elements of Lactobacillus plantarum[J].RSC Advances,2017,7(21):12 959-12 968.
[26] SOLIOZ M,MERMOD M,ABICHT H K,et al.Stress Responses of Lactic Acid Bacteria[M].New York:Springer US,2011:163-195.
[27] HALTTUNEN T,COLLADO M C,EL-NEZAMI H,et al.Combining strains of lactic acid bacteria may reduce their toxin and heavy metal removal efficiency from aqueous solution[J].Letters in Applied Microbiology,2008,46(2):160-165.
[28] 殷瑞杰. 植物乳杆菌CCFM8661吸附铅离子及缓解肠细胞铅毒性的机制解析[D].无锡:江南大学,2016.
YIN R J.Mechanism of Pb2+ removal and cytotoxicity alleviation by L.plantarum CCFM8661[D].Wuxi:Jiangnan University,2016.