玉米须(Stigma maydis)是禾本科植物玉蜀黍Zea mays L.的花柱和柱头,是一种药食两用材料[1]。玉米须因具有丰富的生理功能,如降血糖、抗氧化、提高免疫力和利尿排毒[2-4]等,而受到广泛关注。玉米须多糖是玉米须最重要的活性成分之一,具有含量高、功效广泛等优点,但目前开发利用非常有限,这使得有关玉米须多糖的研究成为热点。目前玉米须多糖的研究主要集中在粗多糖的制备方法,脱蛋白、脱色素[5-6]等领域,而关于玉米须多糖的体内功效研究相对比较薄弱。郑鸿雁等[7]报道醇沉制备多糖可以提高小鼠抗体生成脾细胞数并一定程度上调节小鼠巨噬细胞的吞噬功能,但纯化对玉米须多糖体内活性的影响尚未见报道。本研究分析了多糖纯化中常采用的乙醇沉淀分离对玉米须多糖体内免疫活性的影响,为玉米须多糖的开发利用提供理论依据。
1 材料和方法
1.1 实验材料
1.1.1 实验原料
玉米须,安徽亳州中药材批发市场,经清洗、烘干、粉碎备用。
1.1.2 主要试剂
胶原蛋白维生素C维生素E粉,汤臣倍健公司;小牛血清,分析纯,北京博尔西科技有限公司;Giemsa染液、Hank’s液、阿氏液,分析纯,北京博奥拓达科技有限公司;其他试剂均为国产分析纯。
1.1.3 主要仪器
XSZ-G显微镜,上海仪圆显微镜公司;UF-20中空纤维超滤装置,大城县华泰净化技术有限公司;722 N可见分光光度计,上海箐华科技仪器有限公司;PYX-DHS-500BS隔水电热培养箱,北京市永光明医疗仪器厂。
1.1.4 实验动物
昆明小鼠,长春市亿斯实验动物技术有限责任公司。
1.2 实验方法
1.2.1 玉米须多糖制备
玉米须粉热水煮沸2 h,3 000 r/min离心分离上清液,玉米须残渣同法再提取一次,合并2次上清液,使用超滤膜分离小分子物质(分子质量<10 kDa),收集超滤浓缩液,进一步浓缩后烘干至恒重,获得玉米须超滤多糖(corn silk polysaccharide,CSP),保存于干燥器中备用。
1.2.2 玉米须多糖乙醇沉淀分离
40%乙醇沉淀多糖(CSP-1):将CSP研磨后制备成质量分数1.5%多糖溶液,向多糖液中加入无水乙醇至乙醇体积分数达到40%,4 ℃沉淀24 h,10 000 r/min离心20 min,分离上清液和沉淀,测量上清液体积用于后续实验,沉淀烘干至恒重,即为CSP-1。
80%乙醇沉淀多糖(CSP-2):向CSP-1分离得到的上清液中继续加入无水乙醇至溶液乙醇体积分数达到80%,4 ℃沉淀24 h,4 000 r/min离心15 min,分离上清液和沉淀,将沉淀烘干至恒重,即为CSP-2。
上清多糖(CSP-3):将从CSP-2分离得到上清液经旋转蒸发浓缩后,烘干至恒重,即为CSP-3。各多糖得率按公式(1)计算:
多糖得率![]()
(1)
1.2.3 玉米须多糖成分分析
多糖测定采用苯酚-硫酸法[8];蛋白质测定采用凯氏定氮法[9];总黄酮测定采用三氯化铝分光光度法[10]。
1.2.4 体内免疫调节作用研究[11]
1.2.4.1 实验动物
昆明小鼠体质量,18~22 g,雌雄各半,每组10只。
1.2.4.2 实验多糖配制
设计14个实验组:阴性对照组(蒸馏水)、阳性对照组(汤臣倍健胶原蛋白维生素C维生素E粉,500 mg/kg)、CSP、CSP-1、CSP-2和CSP-3的低、中、高剂量组(100、200、300 mg/kg)。玉米须多糖溶液经巴氏杀菌,冷却至室温后,用于灌胃,每只小鼠每天灌胃0.4 mL,实验时间为30 d。
1.2.4.3 血清溶血素的测定
免疫动物及血清分离:用生理盐水配成体积分数2%的绵羊红细胞(sheep red blood cell,SRBC)悬液,每只鼠腹腔注射0.2 mL进行免疫,4~5 d后摘除眼球取血于离心管中,放置5 h,使血清充分析出,3 000 r/min离心15 min,分离血清,用于凝集实验。
凝集反应:用生理盐水将血清倍比稀释,将不同稀释度的血清分别置于微量血凝实验板内,每孔100 μL,再加入100 μL体积分数0.5%的SRBC悬液,混匀,放入带有湿润纱布的平盘内,加盖,于37 ℃温箱孵育3 h,观察血球凝集程度。
1.2.4.4 小鼠腹腔巨噬细胞吞噬鸡红细胞实验(滴片法)
实验前4~5 d给每只小鼠腹腔注射体积分数2%压积SRBC 0.2 mL进行免疫,颈椎脱臼处死小鼠,每只小鼠腹腔注射含有体积分数5%小牛血清的Hank’s液4 mL,轻轻按揉腹部20次,以充分洗出腹腔巨噬细胞,然后用注射器吸取腹腔洗液,取0.5 mL洗液加入盛有0.5 mL体积分数1%鸡红细胞悬液的离心管中,混匀。吸取0.5 mL混合液加入事先做好的载玻片琼脂圈内。将载玻片放入带有湿润纱布的平盘中,放置于温箱内37 ℃孵育15~20 min,孵育结束后迅速用生理盐水将未贴壁细胞冲掉,加入甲醇固定10 min,再用Giemsa液染色15 min,用蒸馏水冲洗干净,晾干。在10×40倍显微镜下观察巨噬细胞吞噬鸡红细胞情况,计数。
吞噬率为每100个巨噬细胞中,吞噬鸡红细胞的巨噬细胞所占的百分率按公式(2)计算;吞噬指数为平均每个巨噬细胞吞噬鸡红细胞的个数按公式(3)计算:
吞噬率![]()
(2)
吞噬指数![]()
(3)
1.2.4.5 免疫器官指数的测定
剖解小鼠,取脾脏、胸腺、脑、肝、肾、心脏和肺并称取质量,按公式(4)计算脏器指数。
脏器指数=脏器质量(mg)/体质量(g)
(4)
1.2.5 数据统计分析
使用 Excel 2010 软件对数据进行处理,SPSS 17.0软件进行统计分析。Duncan法进行多组样本间差异显著性分析,LSD法进行多重比较。
2 结果与分析
2.1 玉米须多糖组成分析
超滤法制备的玉米须多糖CSP(复溶率为95.2%)经不同体积分数乙醇沉淀分离后,获得3个多糖组分CSP-1、CSP-2和CSP-3,得率分别为23.01%、41.41%和28.02%,其中CSP-2得率远高于其他2个多糖。它们的多糖含量基本相当,其中CSP-2和CSP-3略高。3个组分的多糖绝对含量(指各组分多糖的得率与其多糖含量之积)之和为32.03%,和初始母多糖CSP相近(35.43%),其中CSP-2绝对多糖含量最高为14.68%,占到CSP的41.43%,其次是CSP-3为10.05%,占28.37%,CSP-1最少为7.29%,占20.58%。综上分析,可见玉米须超滤多糖主要为不溶于体积分数80%乙醇的高分子量多糖,占多糖总量的近一半。同时CSP-2中蛋白质含量是3个组分中最低的,可见高浓度乙醇沉淀可以有效降低玉米须多糖中蛋白质含量,可能有利于后续纯化。体积分数80%乙醇沉淀多糖时沉淀物成絮状,4 000 r/min 离心即可,且离心后沉淀结实,容易与上清液分离;而体积分数40%乙醇沉淀多糖时,沉淀物颗粒较小,需10 000 r/min离心,离心后沉淀不结实,但可以与上清液较好地分离,沉淀成泥状。
表1 不同玉米须多糖组成成分![]()
Table 1 Component analysis different corn silk polysaccharides

组成成分CSPCSP-1CSP-2CSP-3多糖含量/%35.43±0.0831.69±0.0635.45±0.0635.88±0.04蛋白含量/%34.51±0.0436.95±0.0530.80±0.0833.54±0.07总黄酮含量/%1.43±0.0050.93±0.0042.15±0.0043.71±0.008
2.2 玉米须多糖对小鼠血清溶血素的影响
溶血素是一种体液免疫物质。由表2可知,4种玉米须多糖的3个实验剂量组小鼠产生的抗体都明显高于阴性对照组,说明实验效果显著,4种玉米须多糖都可以提高小鼠血清中抗体的产生量,具有激活体液免疫能力[11]。通过组内比较发现,CSP低、中、高剂量组之间抗体水平无显著差异,表明CSP对小鼠体液免疫的激活作用没有剂量依赖性,只需100 mg/kg玉米须多糖,即可达到激活体液免疫作用。但在另一个同类型实验中,发现CSP低剂量时表现出剂量依赖性,与本实验结果有一定出入,但也仅限于低浓度是否有剂量依赖性上,不影响对其提高体液免疫能力的判断。CSP-1中和高剂量明显优于低剂量,可见其低浓度时呈现剂量依赖性,但继续升高浓度到300 mg/kg对活性没有明显提升作用。CSP-2 低剂量活性优于中和高剂量,说明其只需较低浓度即可发挥激活体液免疫的作用,但浓度过高反而会使活性降低,可能是由于其含有一定的起负面效应的物质,当浓度升高时,其对多糖的综合效果影响增大,导致整体活性下降。随着浓度的升高,CSP-3的活性先升高后降低,最佳的浓度是200 mg/kg。在组间活性表现上,CSP和CSP-1的所有实验剂量组都优于阳性对照组,CSP-2的低剂量和CSP-3的中剂量组优于阳性对照组,其他剂量与阳性对照组活性相当,表明CSP和CSP-1对小鼠体液免疫的激活作用优于市售具有提高免疫功能保健食品的效果,CSP-2和CSP-3不逊于市售阳性保健食品的效果;相同剂量比较,CSP-1至少有2个剂量抗体水平高于CSP-2和CSP-3,表明CSP纯化后的3个组分中活性最好的是CSP-1,其活性与CSP相当。
表2 小鼠血清溶血素生成量
Table 2 Yields of serum emolysin with different polysaccharides

组别剂量/(mg·kg-1)抗体水平阴性073.00±8.04e阳性50084.16±5.98dCSP100112.00±8.90a200104.75±10.62ab300109.50±4.04abCSP-110098.71±4.42bc200113.57±9.45a300110.280±8.24aCSP-2100105.50±6.72ab20089.60±5.86cd30089.00±5.83cdCSP-310080.50±13.00de200103.60±9.18ab30088.75±11.59cd
注:同列不同小写字母表示在P<0.05下差异显著(下同)
2.3 玉米须多糖对小鼠腹腔巨噬细胞吞噬作用影响
巨噬细胞在细胞免疫中发挥重要作用。由表3可知,经灌胃后,CSP 三个剂量、CSP-1中、高剂量和CSP-2 三个实验剂量的巨噬细胞吞噬指数明显高于阴性对照组,表明CSP、CSP-1和CSP-2可提高小鼠巨噬细胞的吞噬指数(P<0.05),依据“保健食品检验与评价技术规范(2003版)”[11]结果判定原则(实验组中任意2个剂量阳性,可判定该功能测定实验阳性),具有提高细胞免疫功能活性。CSP-3没有提高细胞免疫功能活性。组内比较中,发现CSP高剂量组活性优于低、中剂量组,表明对小鼠巨噬细胞的激活作用,在浓度达到200 mg/kg以上时具有剂量依赖性。但在另一个同类型实验中,发现CSP低剂量时(200 mg/kg以下)表现出剂量依赖性,与本实验结果有一定出入,但2次实验都证实CSP有提高细胞免疫功能活性,仅在不同浓度间活性表现不一致,后续实验将进一步验证。CSP-1的活性呈现剂量依赖性,随着浓度升高,活性提高。CSP-2 低和中剂量活性优于高剂量,表明其只需较低浓度即可发挥激活体液免疫的作用,但浓度过高(达到300 mg/kg时)反而会使活性降低。在组间活性表现上,CSP的所有实验剂量都与阳性对照组相当,CSP-1的高剂量组优于阳性,中和低剂量与阳性相当,而CSP-2的低和中剂量组优于阳性,高剂量组和阳性相当,说明CSP-2对小鼠细胞免疫功能的激活作用优于市售宣称具有提高免疫功能的保健食品和前体多糖CSP,而CSP-1与阳性对照相当。可见经乙醇沉淀纯化后CSP-2的调节细胞免疫功能得到强化和提升。
表3 小鼠腹腔巨噬细胞吞噬鸡红细胞实验结果
Table 3 Results of phagocytosis of chicken red blood cells by mouse peritoneal macrophages.
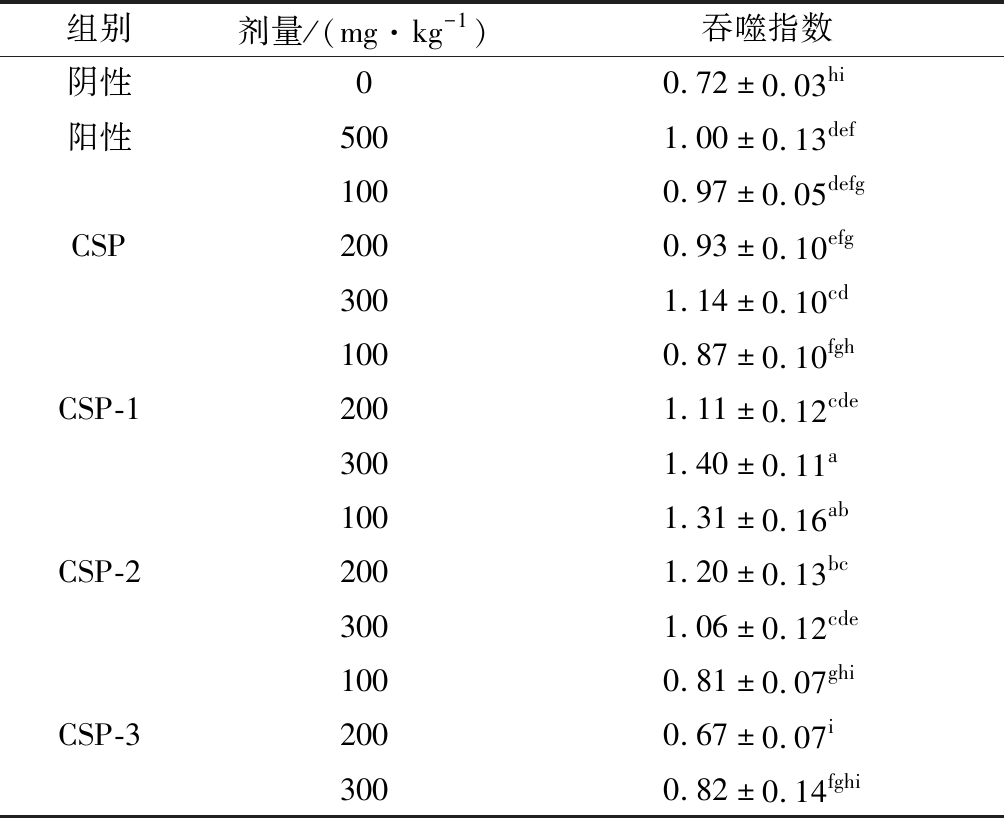
组别剂量/(mg·kg-1)吞噬指数阴性00.72±0.03hi阳性5001.00±0.13def1000.97±0.05defgCSP2000.93±0.10efg3001.14±0.10cd1000.87±0.10fghCSP-12001.11±0.12cde3001.40±0.11a1001.31±0.16abCSP-22001.20±0.13bc3001.06±0.12cde1000.81±0.07ghiCSP-32000.67±0.07i3000.82±0.14fghi
2.4 玉米须多糖对小鼠免疫器官的影响
胸腺和脾脏作为重要的免疫器官,其器官质量及脏器指数可一定程度上反映机体免疫功能的强弱。由表4可见,体内灌胃30 d后,4种玉米须多糖和阳性对照可明显提升脾脏指数,表明它们可以促进小鼠脾脏生长。组内和组间比较发现,除CSP中剂量组和CSP-3低剂量组的脾指数明显升高外,其他实验组间没有差异,因此初步认为4种多糖和阳性保健食品对小鼠脾脏的生长促进作用无显著差异。对于胸腺指数,除CSP-2中和高剂量组没有明显升高外,其他多糖至少有2个剂量组有明显升高,表明CSP、CSP-1、CSP-3和市售保健食品对小鼠胸腺的生长有明显促进作用,但CSP-2没有促进作用。CSP、CSP-1、CSP-3和阳性对照比较,分别都有2个剂量组没表现出差异。表明CSP、CSP-1、CSP-3和阳性保健食品对小鼠胸腺的生长促进作用没有明显差异。
2.5 玉米须多糖对小鼠其他主要器官的影响
CSP、CSP-1、CSP-2和CSP-3对小鼠其他主要器官生长的影响研究发现,它们和阳性保健食品对心脏、肾、肺、肝和脑的生长没有显著影响(相关数据略)。
表4 玉米须多糖对小鼠胸腺和脾脏的影响
Table 4 Effects of polysaccharide from Stigma maydis on thymus and spleen in mice
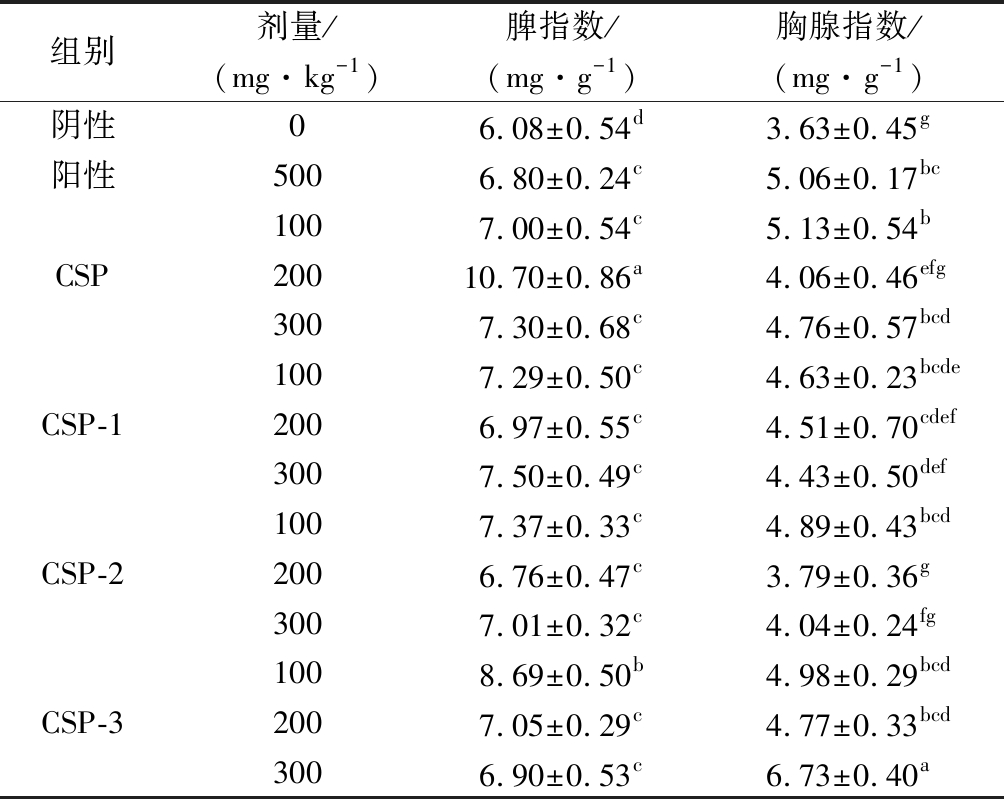
组别剂量/(mg·kg-1)脾指数/(mg·g-1)胸腺指数/(mg·g-1)阴性06.08±0.54d3.63±0.45g阳性5006.80±0.24c5.06±0.17bc1007.00±0.54c5.13±0.54bCSP20010.70±0.86a4.06±0.46efg3007.30±0.68c4.76±0.57bcd1007.29±0.50c4.63±0.23bcdeCSP-12006.97±0.55c4.51±0.70cdef3007.50±0.49c4.43±0.50def1007.37±0.33c4.89±0.43bcdCSP-22006.76±0.47c3.79±0.36g3007.01±0.32c4.04±0.24fg1008.69±0.50b4.98±0.29bcdCSP-32007.05±0.29c4.77±0.33bcd3006.90±0.53c6.73±0.40a
3 结论
研究发现采用超滤法制备的玉米须多糖(CSP)主要为不溶于体积分数80%乙醇的高分子量多糖(CSP-2),占多糖总量的近一半。小鼠体内免疫活性实验结果显示,多糖CSP、CSP-1和CSP-2在细胞免疫功能和体液免疫功能实验中均为阳性,可判定3种多糖具有调节免疫功能作用[11],其中CSP-1表现出剂量依赖性,CSP-2在低浓度时活性更佳,且3种多糖对体液免疫功能调节作用优于阳性对照市售保健食品;几种多糖间比较发现CSP-1调节体液免疫功能优于CSP-2和CSP-3,与CSP相当,而CSP-2对细胞免疫功能的调剂作用明显优于CSP和市售保健品(阳性对照),可见经纯化后80%乙醇沉淀级分的调节细胞免疫功能得到强化和提升。同时发现,CSP、CSP-1和CSP-3可促进脾脏和胸腺生长,3种多糖作用效果没有明显差异和市售保健食品相当,而CSP-2只对小鼠脾脏的生长具有促进作用,几种实验多糖对小鼠心脏、肾、肺、肝和脑的生长没有显著影响。
[1] 中华人民共和国卫生部药材标准委员会.中华人民共和国卫生部药材标准(1985版)[M].北京:人民卫生出版社,1986.
Chinese medicine standards committee,Ministry of Health of PRC.Medicinal Material Standard of Ministry of Health of PRC (1985)[M].Beijing:People’s Hygiene Press,1986.
[2] 温宪春,周丽,赵健飞,等.玉米须水提物对2 型糖尿病大鼠胰高血糖素的影响[J].医学研究杂志,2010,39(4):52-54;128.
WEN X C,ZHOU L,ZHAO J F,et al.Effect of stigma maydis aqueous extract on glucolipid metabolism and oxidative stress in type 2 diabetic rats[J].Journal of Medical Res,2010,39(4):52-54;128.
[3] 窦传斌,杜娟,许启泰.玉米须多糖的利尿作用[J].河南大学学报(医学版),2007,26(3):35-37.
DOU C B,DU J,XU Q T,et al.Study on diuretic effect of stigma maydis polysaccharide[J].J Henan University (Medical Science),2007,26(3):35-37.
[4] 王英平,李向高.玉米须化学成分和药理作用研究进展[J].特产研究,2004(2):42-46.
WANG Y P,LI X G.Progress in study on chemical constituent and pharmacological activity of corn silk[J].Special Wild Economic Animal and Plant Research,2004(2):42-46.
[5] 宫春宇,郑喜群,韩翔宇.玉米须多糖吸附法脱色工艺条件研究[J].食品科技,2015,40(8):200-204.
GONG C Y,ZHENG X Q,HAN X Y,et al.Decolorization of polysaccharide from stigma maydis by absorption method[J].Food Science and Technology,2015,40(8):200-204.
[6] 宫春宇,余世锋,郑喜群.响应面法优化玉米须多糖氧化脱色工艺条件[J].粮食与油脂,2015,28(8):31-34.
GONG C Y,YU S F,ZHENG X Q.Optimization of decolorization process of oxidation method of polysaccharide from stigma maydis by response surface methodology[J].Cereals & Oils,2015,28(8):31-34.
[7] 郑鸿雁,闵伟红,昌友权,等.玉米须多糖调节免疫功能研究[J].食品科学,2004,25(10):291-293.
ZHENG H Y,MIN W H,CHANG Y Q,et al.The experimental study of SMPS in the regulation of immune function[J].Food Science,2004,25(10):291-293.
[8] 张惟杰.糖复合物生化研究技术(第二版)[M].杭州:浙江大学出版社,1997.
ZHANG W J.Biochemical research technique of carbohydrate complex (Second Edition)[M].Hangzhou:Zhejiang University Press,1997.
[9] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.5—2016食品安全国家标准-食品中蛋白质的测定[S].2016.
National Health and Family Planning Commission of PRC,National Medical Products Administration.GB 5009.5—2016 National food safety standard,Determination of protein in food[S].2016.
[10] 中华人民共和国农业部.NY/T 1295-2007 中华人民共和国农业行业标准-荞麦及其制品中总黄酮的测定[S].北京:中国农业出版社,2007.
Ministry of Agriculture of the PRC.NY/T 1295—2007 Agricultural industry standard of the PRC, Determination of flavones in buckwheat and its products[S].Beijing:China Agriculture Press,2007.
[11] 中华人民共和国卫生部.保健食品检验与评价技术规范(2003版)[M].2003.
Ministry of Health of the PRC.Technical specification for dietary supplement (2003)[M].2003.