虎杖为多年生草本植物,是一种常用的中药,主要活性成分是虎杖苷、白藜芦醇和蒽醌类化合物[1]。白藜芦醇是虎杖的次生代谢产物,具有抑制肿瘤、抗癌、保护心血管、抗氧化、抗炎症、调节自身免疫力、保护肝脏等作用[2-6]。目前白藜芦醇的制备方法主要有溶剂提取法、化学合成、生物合成以及微生物转化法[7-9]。从植物中采用溶剂法直接提取分离白藜芦醇,是目前天然白藜芦醇最主要的生产方法,但植物中的白藜芦醇含量低,限制了应用;化学合成方法步骤复杂、经济损耗高且存在污染等问题[10-11];生物合成法环境污染小,资源破坏少,具有较大的应用价值,但是如何实现产业化生产还是一个急需解决的问题[12]。相对而言,微生物转化法具有操作简单、反应条件温和、成本低廉等优点,可以克服其他方法的弊端。虎杖中白藜芦醇含量较低,但虎杖苷含量较高,质量分数可达2.55%。因而利用微生物转化虎杖苷是制备白藜芦醇的可行途径之一。目前关于微生物转化虎杖苷合成白藜芦醇的研究报道已有不少[13-20],但总体而言,高活性的菌株数量不够多,寻找新的高效转化微生物菌源仍是重点研究方向。植物内生菌是一类生活在健康植物组织内部的,不引起宿主植物出现明显病害症状的一类微生物,近年来在生物转化领域的应用受到重视[21-22]。例如,刘华金等[23]从虎杖根、茎中分离出6株内生真菌,其中的草酸青霉具有转化虎杖苷为白藜芦醇的能力,最高转化率为25.6%。本文拟从广西产的新鲜虎杖中分离筛选高效转化虎杖苷生成白藜芦醇的内生真菌,为微生物转化制备白藜芦醇的产业化提供潜在的微生物资源及技术参考。
1 材料与方法
1.1 材料与试剂
植物材料:2年生新鲜虎杖,2018年10月采摘于南宁药用植物园。
初筛培养基(g/L):NaNO3 2,K2HPO4 1,KCl 0.5,MgSO4 0.5,FeSO4 0.01,虎杖苷10,琼脂20,pH自然。
复筛培养基:马铃薯葡萄糖液体培养基(potato dextrose broth,PDB)。
虎杖苷,上海阿拉丁生化科技股份有限公司;白藜芦醇,上海阿拉丁生化科技股份有限公司;引物ITS1(TCCGTAGGTGAACCTGCGG),引物ITS2(TCCTCCGCTTATTGATATGC),真菌DNA提取试剂盒,上海生工生物工程有限公司。所用试剂均为分析纯或生化试剂,所用水均为二次蒸馏水。
1.2 仪器与设备
振荡培养箱(LRH-150-Z),珠江韶关市泰宏医疗器械有限公司;立式压力蒸汽灭菌器(BXM-30R),上海博讯实业有限公司医疗设备厂;超净工作台(CJ-1SFS),天津市泰斯特仪器有限公司;高效液相色谱仪(Aglient1260LC),安捷伦科技有限公司;PCR扩增仪(2720-Thermal-Cycler),美国应用生物系统公司;电泳仪(JY5000),北京君意东方电泳器有限公司;全自动数码凝胶成像系统(Tanon-1600),上海天能科技有限公司。
1.3 实验方法
1.3.1 菌株的初筛
将采摘回来的新鲜虎杖,用自来水清洗干净后,从中选取表面健康无病害的新鲜虎杖,用体积分数为75%的酒精浸泡1 min,再用25 g/L次氯酸钠溶液浸泡20 min,最后用无菌水冲洗6次,以清洗去除附着在虎杖表面的消毒液。经表面消毒的虎杖采用漂洗液检验法[24]和组织印迹法[25]进行表面灭菌效果的检验。在无菌条件下将经表面消毒的虎杖进行粉碎后,置于培养皿中,加适量无菌水使其润湿,然后置于30 ℃的恒温培养箱中,自然固态发酵7 d。取固态发酵粉末适量,用无菌水[1∶10(g∶mL)]制成悬浮液并静置30 min后,取200 μL上清液涂布于以虎杖苷为唯一碳源的初筛培养基平板上,30 ℃恒温培养4 d,挑取长势良好的霉菌顶端菌丝,转接至马铃薯葡萄糖琼脂(potato dextrose agar,PDA)固体培养基上,30 ℃恒温培养,待菌落长成后,不断重复先前的步骤直至获得纯培养物。纯化后的菌株编号后分别接种至PDA斜面培养基中,置于30 ℃的恒温培养箱中培养4 d后,置于4 ℃冰箱中保存备用。
1.3.2 菌株的复筛
1.3.2.1 摇瓶培养
用接种针从保存斜面中挑取少量菌丝点种于PDA培养基上,置于30 ℃恒温培养箱中培养至菌落长直径达4~5 cm后,无菌条件下用φ= 6 mm打孔器在菌落边缘打取菌饼4块,接至含100 mL PDB培养基的250 mL三角瓶中,30 ℃、150 r/min摇床培养4 d,用4层纱布过滤,分别收集菌体细胞和发酵液,4 ℃冰箱中贮存备用。
1.3.2.2 菌体细胞转化虎杖苷实验
取10 mg/mL虎杖苷甲醇溶液0.2 mL、菌体细胞2 g(湿重)依次加入到含有19.8 mL 0.2 mol/L磷酸盐缓冲液(pH 7.0)的100 mL三角瓶中,在30 ℃,180 r/min的条件下,转化48 h后,取样进行HPLC检测。每个菌株进行3次平行试验。
上述体系中,不加菌体细胞同法操作作为底物对照,用0.2 mL甲醇代替虎杖苷溶液同法操作作为菌体对照。
1.3.2.3 发酵液转化虎杖实验
取10 mg/mL虎杖苷甲醇溶液0.2 mL、发酵液1 mL依次加入到含有19 mL 0.2 mol/L磷酸盐缓冲液(pH 7.0)的100 mL三角瓶中,在30 ℃,180 r/min的条件下,转化48 h后,取样进行HPLC检测。每个菌株进行3次平行试验。
上述体系中,用1 mL液体培养基代替发酵液同法操作作为底物对照,用0.2 mL甲醇代替虎杖苷溶液同法操作作为菌体对照。
1.3.3 菌株鉴定
菌株总DNA的提取参照WEILAND[26]所述方法进行。
DNA的PCR扩增使用PCR扩增试剂盒进行。按照试剂盒说明书加样,其中,引物分别为ITS1和ITS4。PCR扩增程序为:95 ℃预变性2 min,95 ℃变性45 s,56 ℃退火45 s,72 ℃延伸1 min,40个循环;最后72 ℃延伸7 min[27]。
用10 g/L的琼脂糖凝胶、0.5×TBE为电泳缓冲液、80 V电压进行PCR产物的琼脂糖凝胶电泳。将电泳合格的PCR扩增产物,委托上海生工生物工程有限公司进行序列分析,测序分析数据在美国NCBI网站上进行DNABlast比对分析,获取比对指标靠前的相似序列,在MEGA5.1软件构建系统发育树,确定菌株的归属。
1.3.4 HPLC分析
1.3.4.1 色谱条件
采用HPLC方法测定转化液中的虎杖苷和白藜芦醇[28]。测定在安捷伦Agilent 1260色谱仪上进行,色谱柱为Phenomenex Luna C18柱(250 mm×4.6 mm,5 μm),检测器为DAD二极阵列管,检测波长305 nm,柱温为30 ℃,流动相流速1 mL/min,进样量10 μL,流动相的组成为乙腈和甲酸水溶液(体积比35∶65)。在该色谱条件下,虎杖苷和白藜芦醇的保留时间分别为3.22、6.06 min。
1.3.4.2 标准曲线绘制
分别称取虎杖苷和白藜芦醇标准品各 0.5 g,用甲醇溶解定容,配制成 1 mg/mL虎杖苷、白藜芦醇储备液,备用。并将其稀释成0.02、0.04、0.06、0.08、0.1 mg/mL。以样品质量浓度作为x轴,峰面积作为y轴绘制标准曲线。其中虎杖苷标准曲线方程为y=22 965x-13.224(相关系数r=0.999 6),白藜芦醇的标准曲线方程y=74 886x-0.998 3(相关系数r=0.998 1)。
1.3.4.3 虎杖内生真菌转化虎杖苷的HPLC分析
将样品稀释适当倍数后,用0.22 μm的微孔滤膜过滤,按上述方法进行HPLC分析,按公式(1)计算产物白藜芦醇的摩尔转化产率:
摩尔转化率![]()
(1)
2 结果与分析
2.1 菌株初筛结果
按1.3.1小节的方法,以虎杖苷为唯一碳源进行选择性培养,共分离纯化获得4株长势良好的虎杖内生真菌,将其分别编号为HZ001、HZ002、HZ003和HZ004。
在马铃薯葡萄糖平板培养基上,HZ001菌落疏松、干燥、不透明,呈绒毛状,为红褐色。HZ002菌落生长快,表面成黑色粉末状。HZ003最初为黄色,后变为黄绿色至颜色变暗、平坦、反面无色。HZ004为灰色隆起,边缘整齐,表面光滑、突起。显微镜检结果表明,HZ001菌株基部没有假根,也没有足细胞,顶部形成了球状的顶囊,菌丝有无隔膜,孢子连着一条分枝形成类似蝌蚪状的形态,孢子的形状呈球状。HZ002分生孢子有横隔,光滑,顶端不形成膨大的顶囊,菌丝有横隔,基部无足细胞。HZ003有球形或近球形的分生孢子,黄绿色,孢子直径大,分生孢子梗上再生长出膨大的顶囊,近球形。HZ004菌丝呈分隔状,分生孢子头呈连珠状,且可见孢子梗上有孢子囊,梗上有分生孢子,分生孢子梗粗糙无色,顶囊呈球形。
2.2 菌株复筛结果
按照1.3.2小节的方法对初筛的4株虎杖内生真菌转化虎杖苷生成白藜芦醇的性能进行复筛,菌体细胞转化体系和发酵液转化体系的HPLC分析结果分别见图1和图2。
由图1可知,与标准对照(虎杖苷和白藜芦醇质量浓度均为1 mg/mL甲醇溶液)相比较,HZ001(图1,C)和HZ004(图1,I)的菌体细胞转化中底物虎杖苷的色谱峰消失,在6.06 min处出现产物白藜芦醇色谱峰,表明HZ001和HZ004菌体细胞具有较好的转化虎杖苷生成白藜芦醇的活性。HZ002(图1,E)和HZ003(图1,G)的菌体细胞转化体系中底物虎杖苷的色谱峰消失,但未出现新色谱峰,表明HZ002和HZ003能够利用或吸附虎杖苷,但未转化生成胞外新产物。

图1 虎杖内生真菌菌体细胞转化虎杖苷的HPLC图
Fig.1 HPLC diagrams of transformation of polydatin by the cells of endophytic fungi from Polygonum cuspidatum
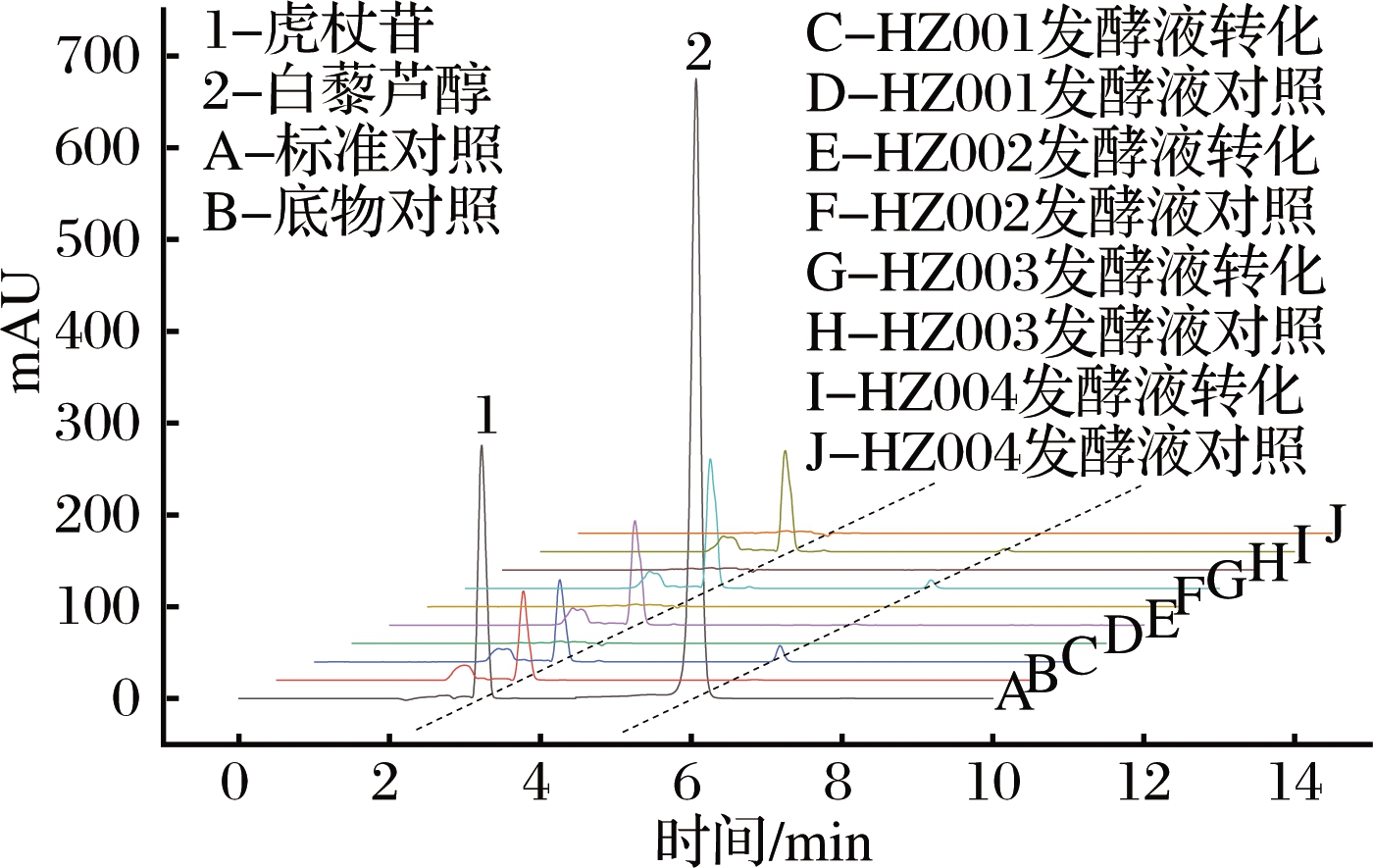
图2 虎杖内生真菌发酵液转化虎杖苷的HPLC图
Fig.2 HPLC diagrams of transformation of polydatin by the fermentation broths of endophytic fungi from P.cuspidatum
由图2可知,HZ001(图2,C)、HZ003(图2,G)和HZ004(图2,I)的发酵液转化体系中均出现了白藜芦醇色谱峰,表明该3菌株发酵液中均有一定的胞外酶活性。
按1.3.4.3小节的方法分别计算各菌株菌体细胞和发酵液转化虎杖苷生成白藜芦醇的摩尔转化产率,结果如表1所示。
表1 虎杖内生真菌转化虎杖苷生成白藜芦醇的转化产率
Table 1 Conversion yields of polydatin to resveratrol by endophytic fungi from P.cuspidatum

菌株转化产率/%HZ001菌体100HZ002菌体—HZ003菌体—HZ004菌体100HZ001发酵液51HZ002发酵液—HZ003发酵液40HZ004发酵液38
注:“-”表示无产物生成
由表1可知,HZ001和HZ004菌株细胞转化虎杖苷生成白藜芦醇的转化产率均可达100%。3菌株HZ001、HZ003、HZ004的发酵液转化虎杖苷生成白藜芦醇的转化产率分别为51%、40%和38%。综上可知,从虎杖中分离获得的4株内生真菌中,HZ001和HZ004转化虎杖苷生成白藜芦醇的活性最好,其主要靠胞内酶发挥作用,而HZ003具有一定的转化效果,其以胞外酶起作用。
2.3 菌株鉴定结果
按1.3.3小节的方法对菌株的DNA进行提取和PCR扩增后,进行琼脂糖凝胶电泳,结果如图3所示。结果表明,4株虎杖内生真菌DNA的分子量均为650 bp左右。对菌株序列进行分析,将分析结果在NCBI网站上进行Blast比对,然后挑选同源性较高的菌株序列,采用MEGA5.1软件构建系统发育树,如图4所示。结果表明,HZ001和HZ002分别归属为Aspergillus aculeatus和Penicillium georgiense,HZ003和HZ004则均归属为Aspergillus flavus。
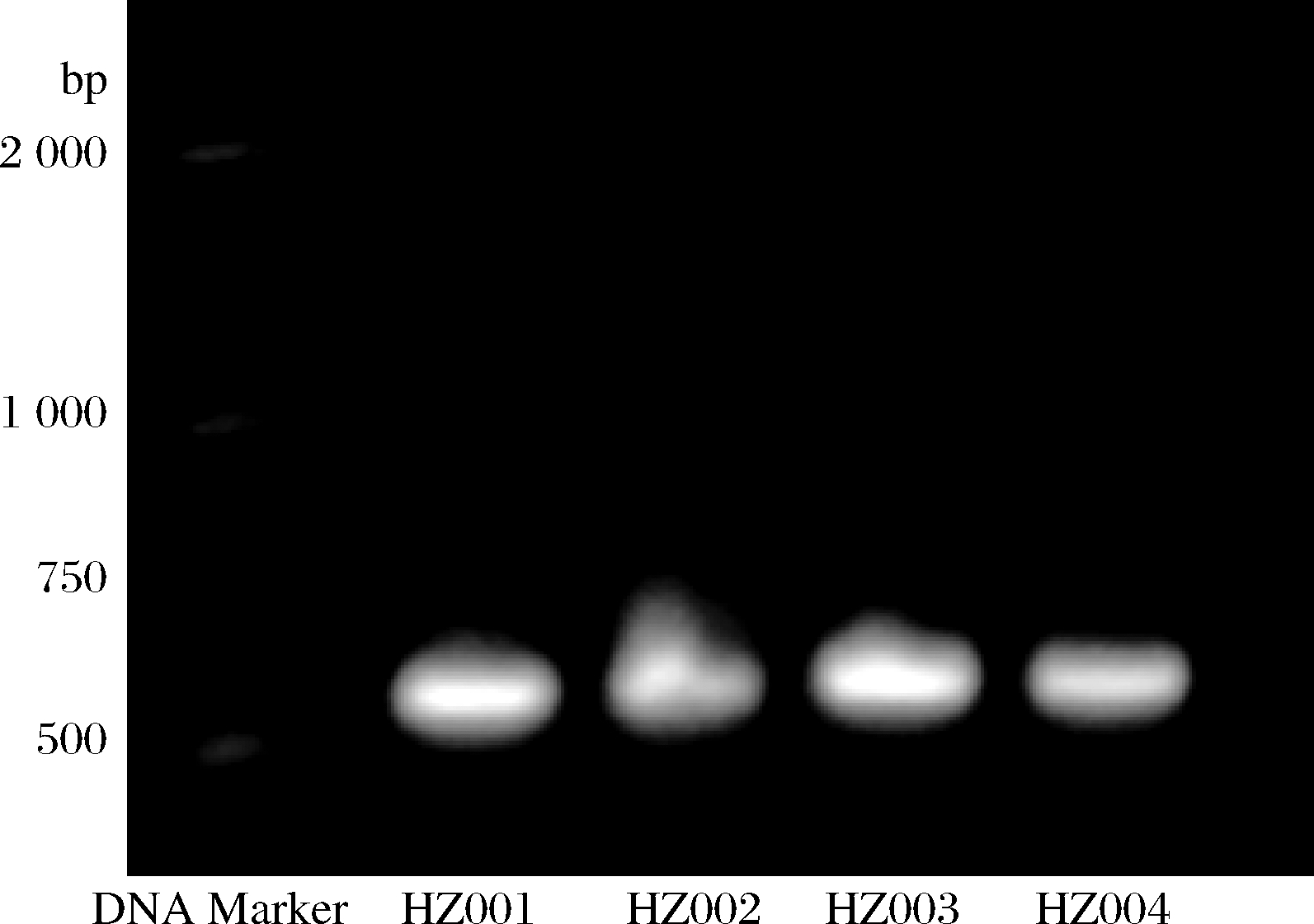
图3 虎杖内生真菌DNA提取物PCR扩增产物 琼脂糖凝胶电泳谱图
Fig.3 Agarose gel electrophoresis photograph of PCR products from DNA extracts of the endophytic fungi from P.cuspidatum
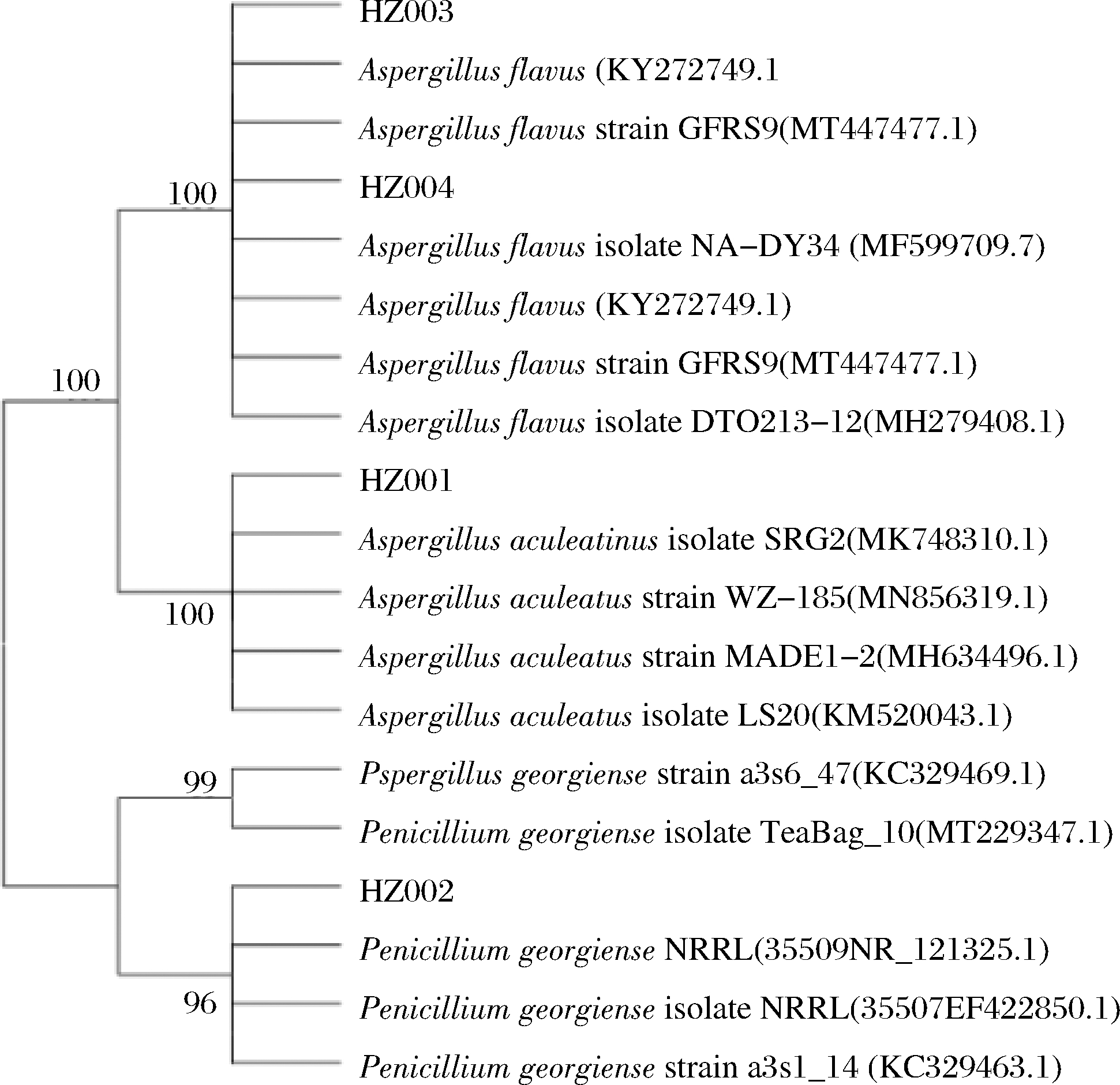
图4 虎杖内生真菌的系统发育树
Fig.4 Phylogenetic tree of the endophytic fungi from P.cuspidatum
3 结论
虎杖作为我国常用中药,临床用途非常广泛,其有效成分白藜芦醇在医药、食品、化妆品中的应用也越来越广泛。本文以虎杖苷为唯一碳源的选择性培养基从广西产新鲜虎杖中分离出4株内生真菌HZ001、HZ002、HZ003和HZ004。菌体细胞生物转化和发酵液生物转化试验结果表明, HZ001和HZ004转化虎杖苷生成白藜芦醇的性能最强,在本实验的条件下白藜芦醇的转化产率可达100%,其主要靠胞内酶发挥作用。而HZ003具有一定的转化效果,其以胞外酶起作用,白藜芦醇的转化产率约为40%。菌株鉴定结果表明,HZ001和HZ002分别归属为Aspergillus aculeatus和Penicillium georgiense,HZ003和HZ004则均归属为Aspergillus flavus。
[1] 梁明辉.中药虎杖的研究进展[J].中国医药指南, 2019,17(10):47-47.
LIANG M H.Research progress of Polygonum cuspidatum[J].Guide of China Medicine,2019,17(10):47-47.
[2] 孙治刚, 李志娜,李敏.白藜芦醇的药理作用研究进展[J].淮海工学院学报:自然科学版,2017,26(2):40-43.
SUN Z G,LI Z N,LI M.Research progress on pharmacological effects of resveratrol[J].Journal of Huaihai Institute of Technology(Natural Science Edition), 2017,26(2):40-43.
[3] 郭瑞. 白藜芦醇抗疲劳作用及其机理研究[J].食品研究与开发,2018,39(24):181-186.
GUO R.Effect and mechanism of resveratrol for anti-fatigue[J].Food Research And Development,2018,39(24):181-186.
[4] 陈旭, 李风录,邢晓艺,等.白藜芦醇的药理活性研究进展[J].药学研究,2020(5):284-288.
CHEN X,LI F L,XING X Y,et al.Research progress on pharmacological activity of resveratrol[J].Journal of Pharmaceutical Research,2020(5):284-288.
[5] PARK E J,PEZZUTO J M.The pharmacology of resveratrol in animals and humans[J].Biochimica Et Biophysica Acta,2015,1 852(6):1 071-1 113.
[6] MOHAMED E,CHEN Y,WANG X J,et al.Resveratrol:An overview of its anti-cancer mechanisms[J].Life Sciences,2018,207:340-349.
[7] 赵荣国, 姜涛.白藜芦醇的制备方法研究进展[J].国际药学研究杂志,2009,36(5):362-365.
ZHAO R G,JIANG T.Preparation methods of resveratrol research progress[J].Journal of International Pharmaceutical Research,2009,36(5):362-365.
[8] 闻永举, 梁爱军,申秀丽.白藜芦醇制备技术进展[J].中成药,2010,32(9):1 569-1 573.
WEN Y J,LIANG A J,SHEN X L.Development of resveratrol preparation technology[J].Chinese Traditional Patent Medicine,2010,32(9):1 569-1 573.
[9] 冯瑞, 陈继承,薛丽华,等.白藜芦醇制备方法及其生物活性的研究进展[J].热带作物学报,2012,33(6):1 148-1 152.
FENG R,CHEN J C,XUE L H,et al.Advances in resveratrol preparations and the bioactivities[J].Chinese Journal of Tropical Crops, 2012,33(6):1 148-1 152.
[10] 夏曦, 徐嘉琪,胡越高,等.白藜芦醇的合成研究进展[J].化学试剂,2019,41(9):873-881.
XIA X,XU J Q,HU Y G,et al.Research progress in the synthesis of resveratrol[J].Chemical Reagents, 2019,41(9):873-881.
[11] 高冬梅, 靳淼.白藜芦醇合成方法综述[J].化学与粘合,2019,41(3):220-223.
DAO D M,JIN M.A Review of the synthesis methods for resveratrol[J].Chemistry and Adhesion,2019,41(3):220-223.
[12] 王长松,赵莹,赵广荣.微生物合成白藜芦醇的研究进展[J].微生物学通报,2014,41(2):352-357.
WANG C S,ZHAO Y,ZHAO G R.Advances on resveratrol production of engineered microorganisms[J].Microbiology China,2014,41(2):352-357.
[13] 张文婷, 黄琴伟,向智敏,等.大鼠肠道菌对虎杖苷的生物转化研究[J].中国药学杂志,2012,47(8):631-633.
ZHANG W T,HUANG Q W,XIANG Z M,et al.Biotransformation of polydatin by rat intestinal bacteria[J].Chinese Pharmaceutical Journal,2012,47(8):631-633.
[14] 袁润蕾, 徐萌萌,孙艳娟,等.微生物转化虎杖苷粗提物生成白藜芦醇的研究[J].时珍国医国药,2008,19(3):712-714.
YUAN R L,XU M M,SUN Y J,et al.The studies on the transformation from the crude extractin of polydatin to resveratrol by the microbial transformation[J].Lishizhen Medicine and Materia Medica Research,2008,19(3):712-714.
[15] 杨晓英. 微生物转化虎杖苷粗提物制备白藜芦醇的工艺研究[D].北京:北京化工大学,2011.
YANG X Y.Studies on processing conditions for biotransformation from crude polydatin to resveratrol[D].Beijing:Beijing University of Chemical Technology,2011.
[16] 田天丽, 王嫱,王永宏,等.虎杖的微生物发酵转化及其发酵产物提取分离的研究[J].天然产物分离,2006,4(4):1-4.
TIAN T L,WANG Q,WANG Y H,et al.Microbial transformation of Polygonum cuspidatum Sieb.et Zucc by Rhizopus sp.[J].Natural product,2006,4(4):1-4.
[17] 田天丽, 沈竞,徐萌萌,等.虎杖中虎杖苷的微生物发酵转化研究[J].四川大学学报(自然科学版),2008,45(2):437-440.
TIAN T L,SHEN J,XU M M,et al.Biotransformation of polydatin from Polygonum cuspidatum by Rhizopus sp.T-34[J].Journal of Sichuan University (Natural Science Edition),2008,45(2):437-440.
[18] 汤华钊, 陈良.微生物转化虎杖苷制备白藜芦醇的方法:CN201510747647.5[P].2 016-2-3.
TANG H Z,CHEN L.Method for preparing resveratrol by microbial transformation of polydatin:CN201510747647.5[P].2016-2-3.
[19] 韩萍萍, 祝旭君,陈虹.微生物转化虎杖苷生成白藜芦醇的研究[J].浙江树人大学学报(自然科学版),2012,12(1):25-28.
HAN P P,ZHU X J,XHEN H.Study on the biotransformation from polydatin to resveratrol[J].Journal of Zhejiang Shuren University(Acta Scientiarum Naturalium), 2012,12(1):25-28.
[20] 冯薇, 胡小妍,马明娜,等.产β-葡萄糖苷酶细菌的筛选及转化白藜芦醇的研究[J].生物技术通报,2017,33(11):130-135.
FENG W,HU X Y,MA M N,et al.The screening of β-glycosidase-producing strain and the transforming of resveratrol[J].Biotechnology Bulletin,2017,33(11):130-135.
[21] 郑江松, 李继扬.植物内生菌在药物研究中的应用[J].复旦学报(医学版),2013,40(5):610-618.
ZHENG J S,LI J Y.The application of endophyte in drug research[J].Fudan University Journal of Medical Sciences,2013,40(5):610-618.
[22] 王宇, 戴传超.内生真菌对生物活性物质代谢转化作用的研究进展[J].中草药,2009,40(9):1 496-1 499.
WANG Y,DAI C C.Advances in studies on metabolic transformation of bioactive substances by endophytic fungi[J].Chinese Traditional and Herbal Drugs,2009,40(9):1 496-1 499.
[23] 刘华金. 虎杖内生菌高效转化白藜芦醇苷的研究[D].长沙:湖南农业大学,2012.
LIU H J.Study on efficiently microbial transformation of polydatin by endophyte in Polygonum cuspidatum[D].Changsha:Changcha Hunan Agricultural University,2012.
[24] MCINROY J A,KLOEPPER J W.Survey of indigenous bacterial endophytes from cotton and sweet corn[J].Plant and Soil,1995,173(2):337-342.
[25] STURZ A V,CHRISTIE B R,MATHESON B G,et al.Biodiversity of endophytic bacteria which colonize red clover nodules,roots,stems and foliage and their influence on host growth[J].Biology and Fertility of Soils,1997,25(1):13-19.
[26] WEILAND J J.Rapid procedure for the extraction of DNA from fungal spores and mycelia[J].Fungal Genet Newsl,1997,44(1):60-63.
[27] 柴海云, 张磊,袁牧歌,等.一种简便、快速、高效适合 PCR 的真菌 DNA 提取方法[J].中国真菌学杂志,2017,12(6):359-361,367.
CHAI H Y,ZHANG L,YUAN M G,et al.A rapid and efficient extraction method of fungus DNA for PCR[J].Chinese Journal of Mycology,2017,12(6):359-361;367.
[28] 吴青, 罗先钦,胡荣.高效液相色谱法测定虎杖提取物中白藜芦醇的含量[J].重庆医科大学学报,2013,38(7):773-775.
WU Q,LUO X Q,HU R.Determination of erbascoside and resveratrol in root of polygonum cuspidatum by high performance liquid chromatography[J].Journal of Chongqing Medical University,2013,38(7):773-775.