莼菜(Brasenia schreberi)为莼菜科(Cabombaceae)多年生水生蔬菜,野生种已濒危[1-2]。原广泛分布于北半球,现主要分布在亚热带等地区[3]。莼菜具有较高的经济价值与保健功能,在我国逐渐形成重庆石柱、湖北利川、四川雷波和杭州西湖四大产区[4]。莼菜以被覆透明胶质且带嫩茎的叶为其产品部分,富含多糖、多酚、蛋白质等多种活性成分,具有抗菌消炎、抗肿瘤、降血糖等功效,被誉为“水中人参”“植物胎盘”,为中国传统药食兼用植物[5-7]。
黄酮类化合物是以C6-C3-C6为基本骨架的植物次生代谢产物,依据化学结构可分为黄酮类、花青素类、异黄酮类、黄烷-3-醇类、黄酮醇类、二氢黄酮类等[8],因其在抗氧化、降低血管脆性、降血脂等方面功效显著,研究前景广阔,现已成为药用、食用等植物研究上不可忽视的研究内容[9]。近年来,国内外学者对莼菜的研究主要集中在栽培管理[10-12]、食用等方面[5-6,13],对莼菜黄酮类物质的研究甚少,国外研究者对莼菜研究发现其含有抗氧化性很强的槲皮素等黄酮类物质[14-16],但目前尚未有关于莼菜黄酮类物质组成及活性研究方面较为系统的文献报道,对我国莼菜黄酮类物质的基础研究则更少。
本研究首先对莼菜体外胶质、脱胶莼菜叶和未脱胶莼菜叶3个处理部分的总黄酮含量进行了测定,因当前主要的碱液脱胶方法对莼菜活性物质具有一定的破坏作用,本研究选取中国四大产区莼菜未脱胶叶为试验材料,甲醇为提取剂,系统研究各产区莼菜总黄酮、黄酮类物质的组成及含量、体外抗氧化活性及抑菌活性,最后利用相关性分析探究黄酮类物质组成及含量在抗氧化、抑菌过程中的作用,旨在为莼菜黄酮类物质的进一步研究及开发利用提供基础数据。
1 材料与方法
1.1 材料与试剂
试验材料为采自湖北利川(LC)、四川雷波(LB)、重庆石柱(SZ)和浙江西湖(XH)四大产区的莼菜(2018年7月末)。选取大小适中、被覆透明胶质、无病害带嫩茎的莼菜叶,清水冲洗3遍后,手工分离体外胶质与莼菜叶,各部分经冷冻干燥后粉碎过40目筛,粉末保存至-20 ℃备用。
Trolox(纯度97%)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(纯度99%)、2,4,6-三(2-吡啶基)-1,3,5-三嗪(2,4,6-Tri(2-pyridyl)-1,3,5-triazine,TPTZ)(纯度99%)、2,2’-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azinobis-(3-etylbenzthiazoline-6-sulphonate),ABTS)(纯度99%);12种黄酮类物质标准品:芦丁(纯度98%)、牡荆素(纯度99%)、红草苷(纯度98%)、二氢杨梅素(纯度98%)、杨梅素(99%)、圣草酚(纯度98%)、槲皮素(纯度98%)、木犀草素(纯度98%)、山奈酚(纯度98%)、芹菜素(纯度98%)、香橙素(纯度98%)、异鼠李素(纯度98%),美国Sigma公司。
1.2 仪器与设备
DHG-9070A型电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;800Y型多功能粉碎机,永康市铂欧五金制品有限公司;WT2003CH型电子天平,常州万泰天平仪器有限公司;UV1700型紫外可见光分光光度计,上海重逢科学仪器有限公司;LC-20A型高效液相色谱仪(配有2998PDA 二极管阵列检测器),日本岛津公司。
1.3 试验方法
1.3.1 莼菜提取物制备
称取各产区莼菜粉末1.0 g,置于100 mL三角瓶内,体积分数80%的甲醇为提取剂,参考许瑞波等[17]对同为水生植物睡莲叶黄酮的提取方法,滤液经真空减压浓缩至膏状,用体积分数50%的二甲基亚砜溶液溶解并定容至25 mL进行测定,剩余部分保存于-20 ℃下。
1.3.2 总黄酮含量测定
以芦丁为标准品,参照GOMEZ等[18]的方法制作标准曲线测定。取莼菜提取液0.1 mL,加入纯水和质量分数为5%的NaNO2分别为2和0.1 mL,混匀静置6 min后,加入0.2 mL质量分数为 10%的AlCl3溶液反应5 min,再加入纯水0.6 mL于波长420 nm处测其吸光度,结合标准曲线计算总黄酮含量。
1.3.3 莼菜黄酮类物质的HPLC测定
参照左龙亚[19]的方法略加修改。色谱条件:色谱柱Inertsil ODS-3 C18(4.6 mm×250 mm,5 μm);柱温25 ℃,进样量10 μL,流速1.0 mL/min,波长320 nm下检测圣草酚、木犀草素、山奈酚、芹菜素、槲皮素5种黄酮类物质的含量,350 nm下检测红草苷含量,360 nm下检测异鼠李素含量;体积分数0.1%的甲酸水溶液为流动相A,甲醇为流动相B。
1.3.4 抗氧化活性测定
DPPH自由基清除率测定参照GORINSTEIN等[20]的方法略加修改。取莼菜提取液50 μL,加入3.0 mL DPPH反应液避光反应30 min,于波长 510 nm处测其吸光度值,DPPH自由基清除率按公式(1)计算:
DPPH自由基清除率![]()
(1)
式中:A0,空白对照吸光度值;A1,样品溶液吸光度。
ABTS自由基清除率的测定参照ALMEIDA等[21]的方法略加修改。取莼菜提取液25 μL,加入ABTS反应液5.0 mL,混匀室温反应10 min,于波长400 nm处测吸光度值,ABTS自由基清除率按公式(2)计算:
ABTS自由基清除率![]()
(2)
式中:A0,空白对照吸光度值;A1,样品溶液吸光度。
铁还原/抗氧化能力(ferric reducing/ antioxidant power,FRAP)值的测定参照BENZIE等[22]的方法,取莼菜提取液50 μL,加入FRAP反应液5.0 mL混匀,室温反应10 min,于波长593 nm处测吸光度值,以Trolox做标曲线计算FRAP值。
抗氧化能力指数(APC)按公式(3)计算:
抗氧化能力指数APC/%=(测定值/最大值)×100
(3)
1.3.5 抑菌活性测定
参照吕爽等[23]的滤纸片法测定莼菜黄酮对变形杆菌(Proteus vulgaris)、大肠杆菌(Escherichia coli)、铜绿假单胞菌(Pseudomonas aeruginosa)的抑菌活性。在无菌操作台取0.1 mL菌悬液于已倒好的平板上,涂布均匀,将6 mm滤纸片贴在固体培养基上,取10 μL莼菜提取液于滤纸片上,将其置于37 ℃下培养24 h,测抑菌圈直径,体积分数50%的二甲基亚砜为阴性对照。抑菌能力指数计算方法同抗氧化能力指数。
1.3.6 统计学处理
试验均为3次生物学重复,结果以均值±标准差表示,Excel 2016及Origin 9.0作图。采用SPSS 20.0进行单因素差异显著性分析和皮尔森相关性分析,P<0.05为差异显著,P<0.01为差异是极显著。
2 结果与分析
2.1 莼菜不同处理及各产区总黄酮含量比较
2.1.1 莼菜不同处理总黄酮含量比较
芦丁标准曲线y=0.857 7x-0.033 1,(R2=0.999 6),在0~2 mg/mL的范围内具有良好的线性关系,利用该标准曲线对莼菜总黄酮含量进行定量分析。
由图1可知,莼菜3个处理总黄酮含量差异显著(P<0.05),其大小顺序为:脱胶莼菜[(47.975±3.481) mg/g]>未脱胶莼菜[(42.213±1.383) mg/g]>体外胶质[(6.189±0.603) mg/g],体外胶质总黄酮含量与孙雨欣等[24]对莼菜体外胶质总黄酮(5.1 mg/g)的测定结果相差甚小,其差异可能主要由脱胶方式不同所致。同时本试验结果也说明莼菜所含黄酮类物质不像多糖一样主要存在于体外胶质[4],而是主要存在于莼菜叶中。
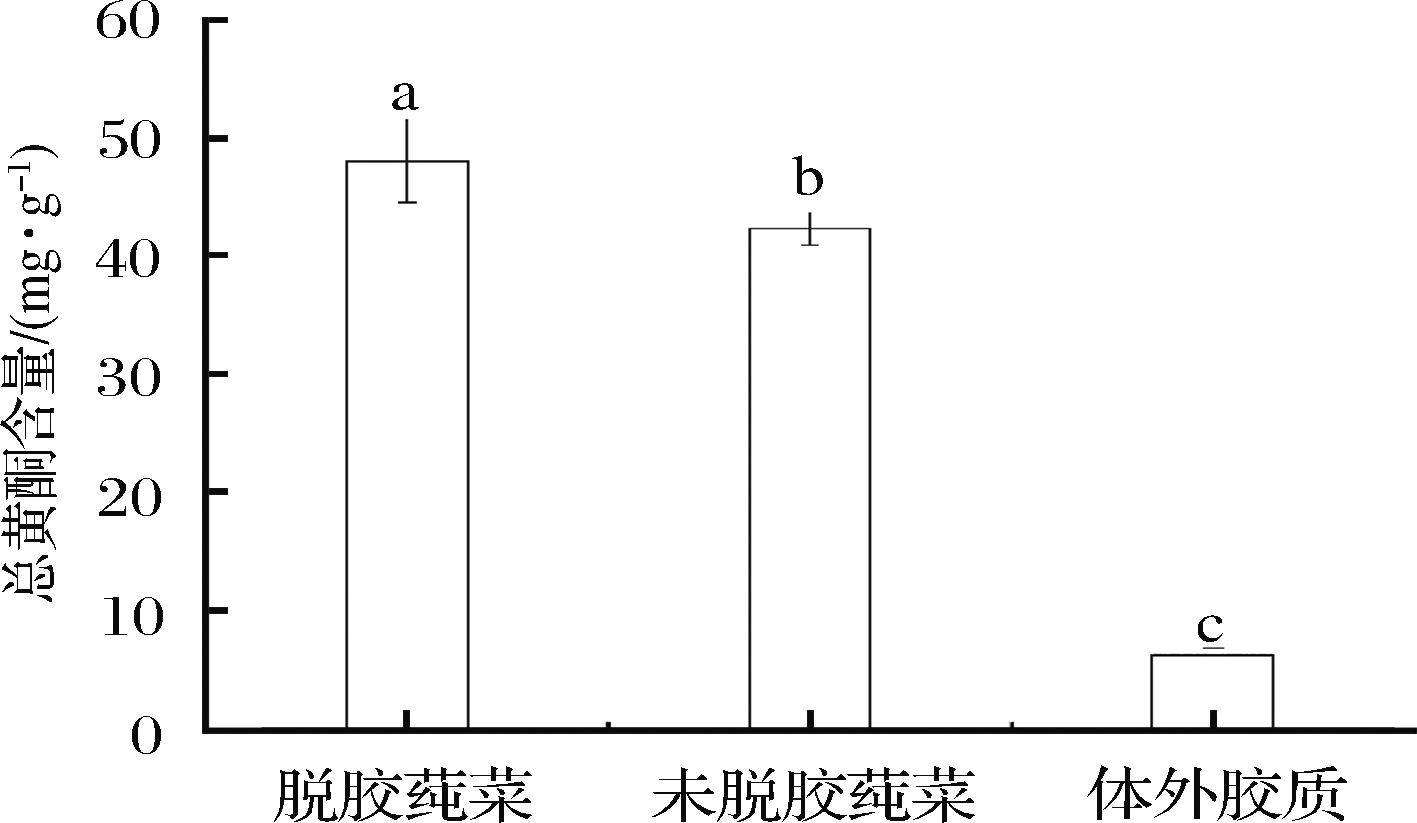
图1 莼菜不同处理总黄酮含量
Fig.1 Total flavonoids content in different treatment parts of water shield 注:组间不同小写字母表示差异显著(P<0.05)(下同)
2.1.2 不同产区莼菜总黄酮含量比较
由图2可知,四大产区莼菜甲醇提取物中总黄酮含量差异显著(P<0.05),其含量为(15.845±0.119)~(42.505±0.458) mg/g,其中,石柱莼菜总黄酮含量最高,利川[(39.325±0.681) mg/g]和雷波[(24.243±0.700) mg/g]次之,西湖最低。
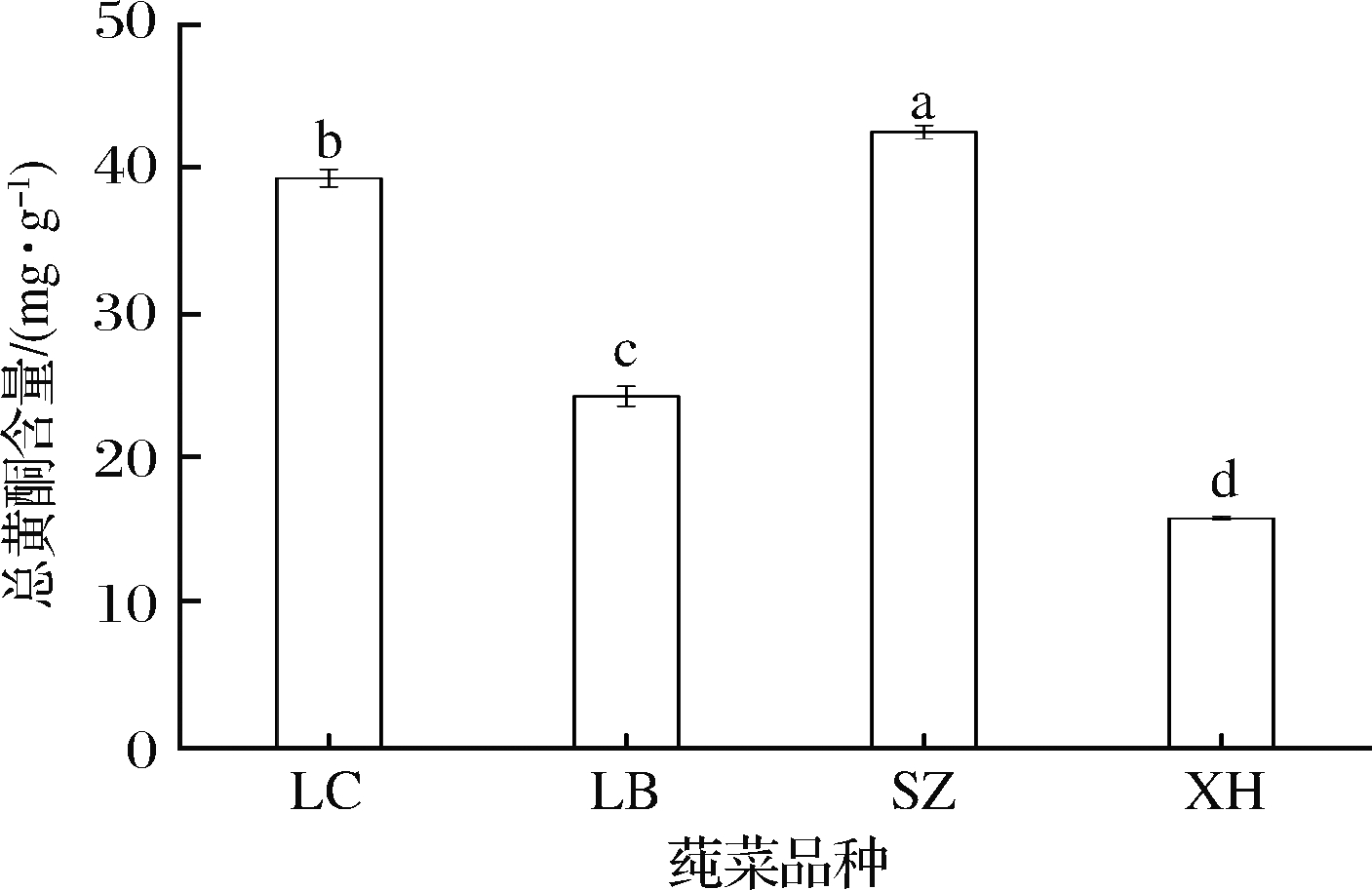
图2 不同产区莼菜总黄酮含量
Fig.2 Total flavonoids content of water shield in different production areas
2.2 不同产区莼菜甲醇提取物黄酮类物质组成
黄酮类物质泛指拥有15个碳原子的酚类化合物,主要存在于植物的叶、果皮和果实等部位[25],其种类和含量因植物种类、生长环境及成熟度等而异。研究表明,莼菜耐储性较差,其活性物质会随贮存时间的延长而散失,且随存储条件的不同散失程度也不同[26]。LEGAULT等[14]、LEE等[15]研究,发现莼菜中含有抗氧化作用较强的槲皮素。SHIMODA等[16]以6月份采自日本的莼菜叶为材料,利用质谱检测确定酚类物质种类及结构,共鉴定出5种黄酮类化合物(槲皮素、山奈酚、棉花素、hypolaetin 7-O-glucoside、junsainoside A)和多种酚酸类物质。本试验利用12种黄酮类物质标准品(图3),通过高效液相色谱法从莼菜甲醇提取物中共检测到7种黄酮类物质(图4、图5),木犀草素、异鼠李素、红草苷、槲皮素、芹菜素、山奈酚和圣草酚,且黄酮类物质种类及含量在不同产区莼菜提取物中存在显著差异(P<0.05)。本研究结果与前人的研究结果存在较大差异,可能主要与所选材料生长环境及莼菜成熟度不同有关,也有可能与所采用的检测方法等不同有关。
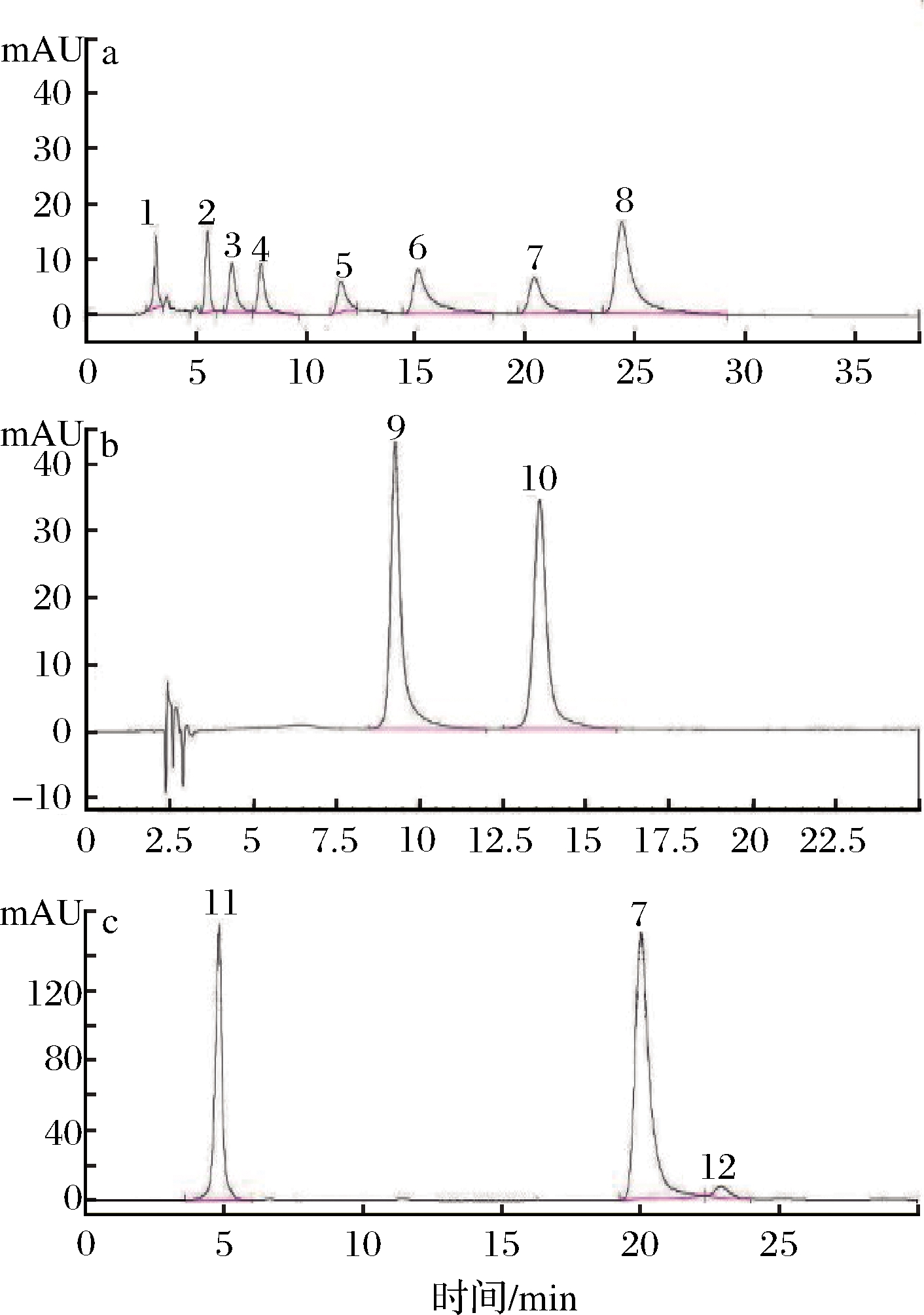
1-二氢杨梅素;2-香橙素;3-杨梅素;4-圣草酚;5-槲皮素;6-木犀草素; 7-山奈酚;8-芹菜素;9-红草苷;10-牡荆素;11-芦丁;12-异鼠李素 a-320 nm 标准品色谱图;b-350 nm标准品色谱图; c-360 nm标准品色谱图
图3 标准品色谱图
Fig.3 Chromatogram of the standard
试验测得黄酮类物质主要由异鼠李素、槲皮素和山奈酚组成, 含量分别为(37.630±0.797)~(367.534±3.822) mg/kg、(8.931±0.029)~(240.596±1.263) mg/kg和(4.089±0.021)~(48.291±0.687) mg/kg。同为水生植物的荷叶黄酮主要为异鼠李素、槲皮素[27],王莲叶主要黄酮类物质为槲皮素、山奈酚[28],与本研究结果类似。木犀草素的含量为(0.840±0.077)~(4.670±0.045) mg/kg,在西湖莼菜提取物中含量最低,石柱莼菜含量最高。红草苷仅少量存在于利川、雷波和石柱莼菜提取物中,西湖莼菜提取物未检测到该物质。圣草酚仅少量存在于雷波和石柱莼菜提取物中,含量分别为(7.543±0.225)和(17.311±0.589) mg/kg。总体来看,石柱莼菜在黄酮类物质组成及含量上均高于其他3个产区,西湖莼菜黄酮组成及含量在4个产区中最低。
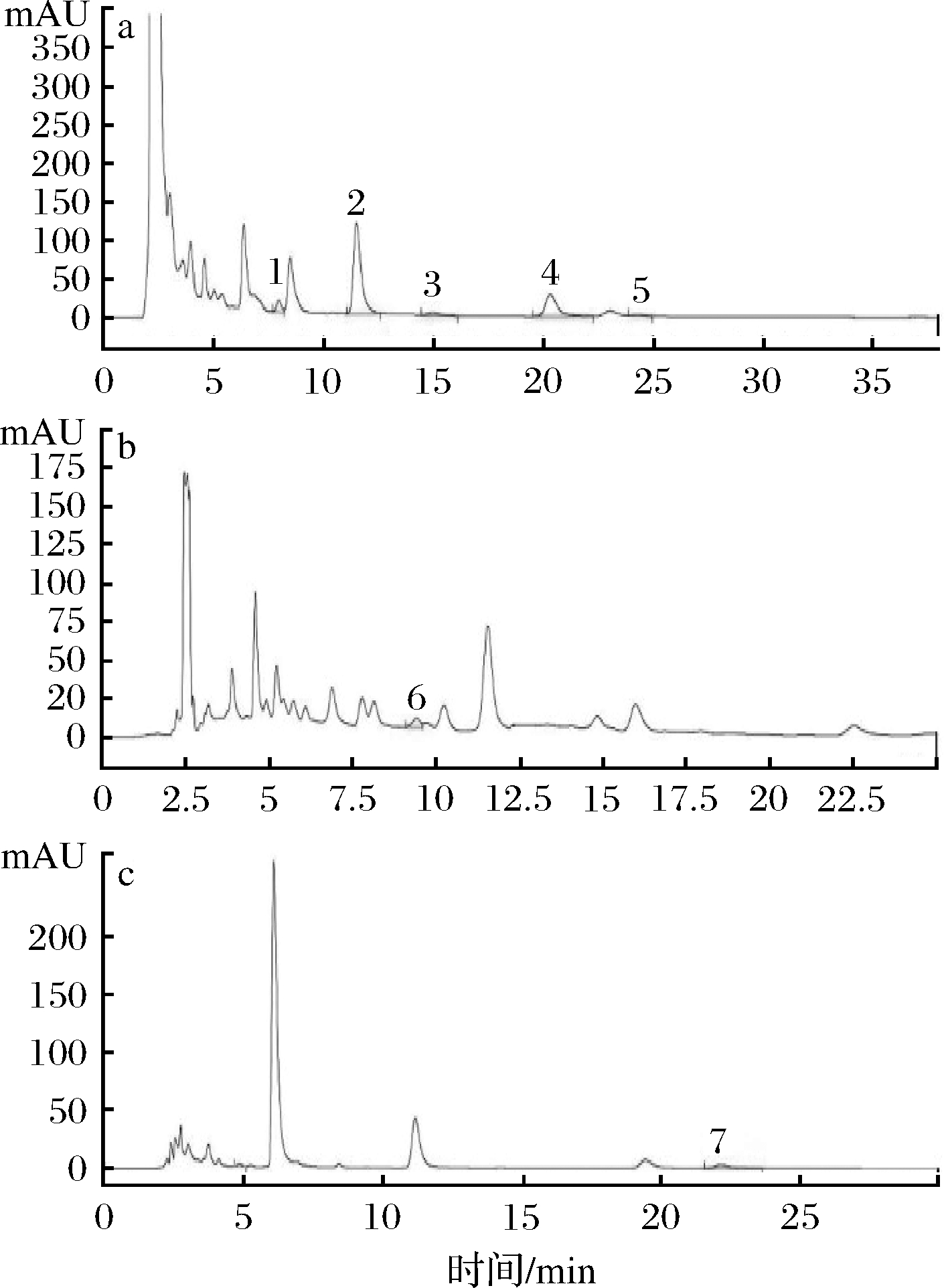
a-320 nm部分样品色谱图;b-350 nm部分样品色谱图; c-360 nm部分样品色谱图 1-圣草酚;2-槲皮素;3-木犀草素;4-山奈酚; 5-芹菜素;6-红草苷;7-异鼠李素
图4 部分黄酮类物质色谱图
Fig.4 Chromatogram of flavonoids
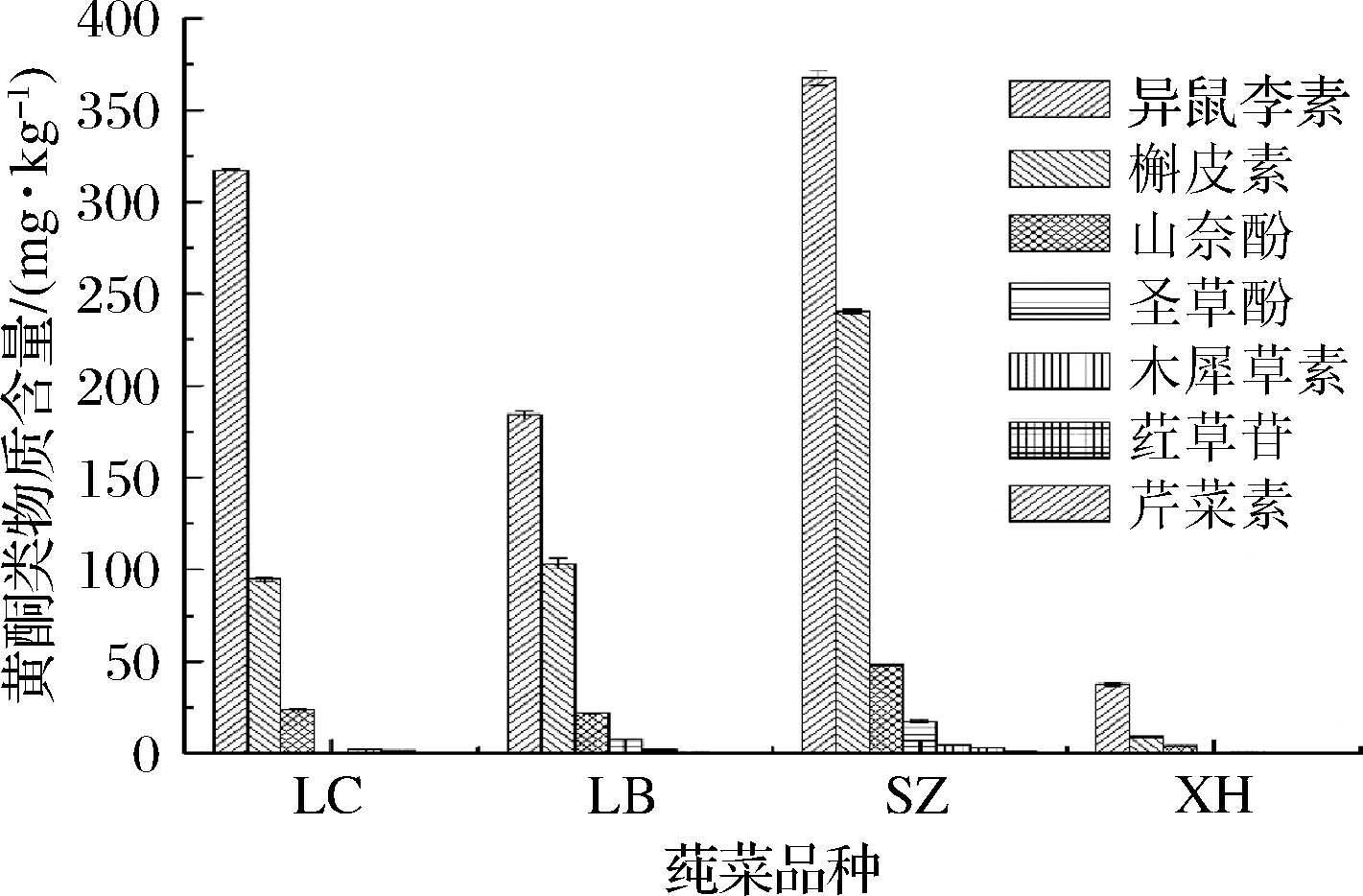
图5 各产区莼菜黄酮物质种类及含量
Fig.5 Types and contents of flavonoids in water shield from different producing areas
2.3 抗氧化结果
2.3.1 不同产区莼菜甲醇提取物抗氧化活性比较
由图6可知,各产区莼菜甲醇提取物对两类自由基清除率及还原值均具有显著性差异(P<0.05)。DPPH自由基清除率为(21.188±0.953)%~(88.409±0.810)%,除西湖莼菜外,清除率均显著高于抗坏血酸阳性对照组(55.227±0.821)%。ABTS自由基清除率为(25.461±1.123)%~(96.245±1.141)%,除西湖莼菜外,其他产区莼菜提取物ABTS自由基清除率也显著高于抗坏血酸阳性对照组(51.794±0.575)%。FRAP还原值为(26.455±2.554)~(151.968±1.885)μmol/g,除西湖莼菜外,其他各产区FRAP还原值与自由基清除率类似,均显著高于抗坏血酸阳性对照组(53.795±0.419)μmol/g。
整体来看,ABTS自由基清除率高于DPPH自由基清除率,但3种抗氧化法对不同产区莼菜总黄酮抗氧化能力的评价大小变化顺序一致,均为:石柱莼菜﹥利川莼菜﹥雷波莼菜﹥西湖莼菜。

a-自由基清除率;b-铁离子还原值
图6 不同产区莼菜抗氧化活性
Fig.6 Antioxidant activity of water shield from different producing areas
2.3.2 四大产区莼菜甲醇提取物抗氧化活性综合评价
由抗氧化结果所得的APC指数均值(%)及排序(表1)表明,各产区莼菜均具有抗氧化活性,但各产地莼菜抗氧化指数均值变化幅度较大,在21.73%~100%。其中,石柱莼菜甲醇提取物的抗氧化指数均值最大,为100%,利川(83.57%)和雷波(78.46%)次之,西湖莼菜最小,为21.73%,与各产区莼菜总黄酮含量大小顺序一致。
表1 各产区莼菜甲醇提取物抗氧化活性APC指数及排序
Table 1 APC index and ranking of antioxidant activities of methanol extracts from water shield indifferent producing areas
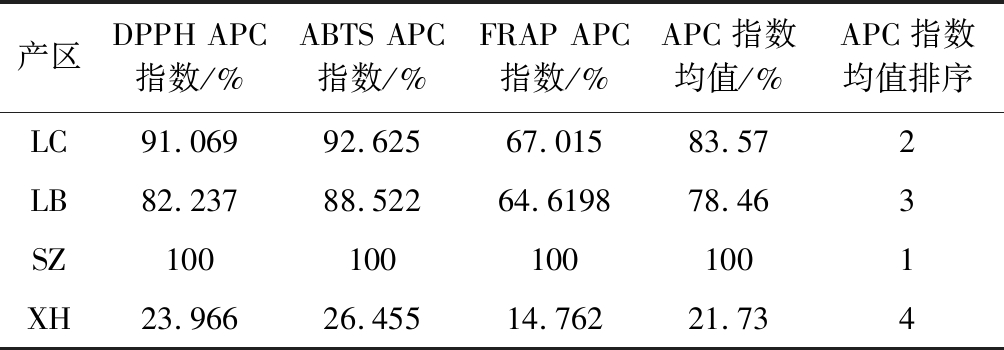
产区DPPH APC指数/%ABTS APC指数/%FRAP APC指数/%APC指数均值/%APC指数均值排序LC91.06992.62567.01583.572LB82.23788.52264.619878.463SZ1001001001001XH23.96626.45514.76221.734
2.4 抑菌结果
2.4.1 不同产区莼菜甲醇提取物抑菌活性比较
本研究发现各产区莼菜提取物对3种人体致病菌均具有显著抑制作用(图7、表2),抑菌圈直径在(8.527±0.564)~(15.660±0.803) mm,这一结果与袁丽萍等[29]对荷叶黄酮的抑菌报道类似。但莼菜黄酮对3种细菌的抑制程度不同,总体来看对变形杆菌和大肠杆菌的抑菌效果要强于铜绿假单胞菌。依据董兰芳等[30]的抑菌圈试验判定标准,3种细菌对各产区莼菜提取物均表现为中度敏感。

图7 各产区莼菜甲醇提取物对细菌生长的影响
Fig.7 Effect of methanol extract of water shield from different producing areas on bacterial growth
表2 各产区莼菜甲醇提取物抑菌活性
Table 2 Antibacterial activity of methanol extract from water shield in different producing areas
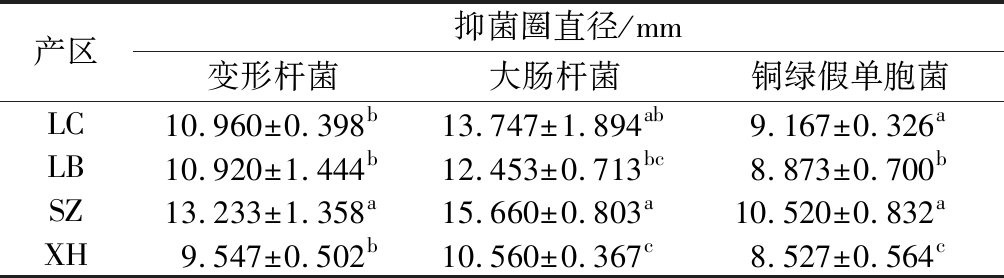
产区抑菌圈直径/mm变形杆菌大肠杆菌铜绿假单胞菌LC10.960±0.398b13.747±1.894ab9.167±0.326aLB10.920±1.444b12.453±0.713bc8.873±0.700bSZ13.233±1.358a15.660±0.803a10.520±0.832aXH9.547±0.502b10.560±0.367c8.527±0.564c
注:同一列不同小写字母表示差异显著(P<0.05)
2.4.2 不同产区莼菜甲醇提取物综合抑菌活性比较
由表3可知,各产区莼菜均具有抑菌活性,且各产地莼菜抑菌活性APC指数均值变化幅度较小(73.55%~100%)。其中,石柱莼菜甲醇提取物的抑菌活性APC指数均值最大,为100%,利川(85.92%)和雷波(82.13%)次之,西湖莼菜最小(73.55%)。通过APC指数均值排序发现,各产地莼菜抑菌能力大小顺序为:石柱﹥利川﹥雷波﹥西湖,与各产地莼菜总黄酮含量及抗氧化顺序一致。
表3 各产区莼菜甲醇提取物抑菌活性APC指数及排序
Table 3 APC index and ranking of antibacterial activity of methanol extract from water shield in different producing areas
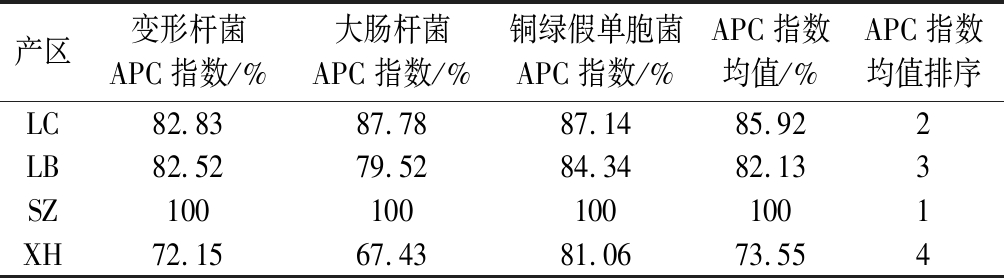
产区变形杆菌APC指数/%大肠杆菌APC指数/%铜绿假单胞菌APC指数/%APC指数均值/%APC指数均值排序LC82.8387.7887.1485.922LB82.5279.5284.3482.133SZ1001001001001XH72.1567.4381.0673.554
2.5 莼菜黄酮类物质与抗氧化、抑菌活性的相关性分析
相关性分析表明(表4),莼菜总黄酮及测定的7
表4 黄酮类物质与抗氧化、抑菌活性的相关性
Table 4 Correlation between flavonoids and antioxidant and bacteriostatic activities
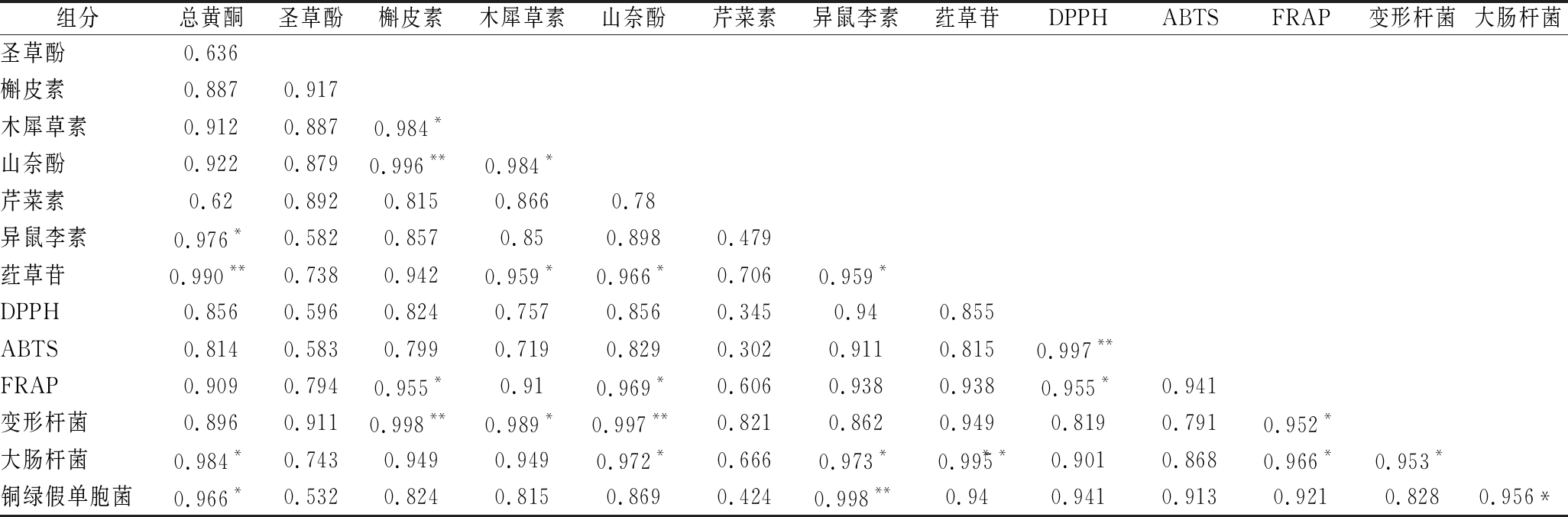
组分总黄酮圣草酚槲皮素木犀草素山奈酚芹菜素异鼠李素荭草苷DPPHABTSFRAP变形杆菌大肠杆菌圣草酚0.636槲皮素0.8870.917木犀草素0.9120.8870.984*山奈酚0.9220.8790.996**0.984*芹菜素0.620.8920.8150.8660.78异鼠李素0.976*0.5820.8570.850.8980.479荭草苷0.990**0.7380.9420.959*0.966*0.7060.959*DPPH0.8560.5960.8240.7570.8560.3450.940.855ABTS0.8140.5830.7990.7190.8290.3020.9110.8150.997**FRAP0.9090.7940.955*0.910.969*0.6060.9380.9380.955*0.941变形杆菌0.8960.9110.998**0.989*0.997**0.8210.8620.9490.8190.7910.952*大肠杆菌0.984*0.7430.9490.9490.972*0.6660.973*0.995**0.9010.8680.966*0.953*铜绿假单胞菌0.966*0.5320.8240.8150.8690.4240.998**0.940.9410.9130.9210.8280.956*
注:**代表在0.01水平上显著性相关(双尾);*代表在0.05水平上显著性相关(双尾)
种黄酮类物质单体均具有不同程度的抗氧化、抑菌作用,且总黄酮含量与红草苷及异鼠李素分别存在极显著和显著正相关性,对应系数分别为0.990和0.976。抗氧化相关性分析显示,总黄酮物质含量与DPPH、ABTS和FRAP三种体外抗氧化评价法的结果相关系数为0.814~0.919,表明总黄酮物质含量在抗氧化过程中起重要作用。抑菌相关性分析显示,槲皮素、木犀草素和山奈酚对变形杆菌具有极显著或显著抑制作用,相关系数为0.989~0.998,总黄酮和异鼠李素对大肠杆菌和铜绿假单胞菌具有显著或极显著抑制作用,相关系数在0.966~0.998之间,表明这5类物质在抑菌过程中有重要贡献。
3 结论
莼菜中黄酮类物质主要存在于莼菜叶中,且四大产区莼菜总黄酮含量存在显著的地区差异,其大小顺序为:石柱莼菜﹥利川莼菜﹥雷波莼菜﹥西湖莼菜。本试验在莼菜中共测定了7种黄酮类物质,分别为异鼠李素、槲皮素、山奈酚、木犀草素、荭草苷、芹菜素和圣草酚,其中异鼠李素、槲皮素和山奈酚为本试验所测主要黄酮成分,且含量及组成均存在地区差异。抗氧化及抑菌试验结果显示,莼菜抗氧化能力很强,抑菌能力较弱,3种细菌对各产区莼菜提取物均表现为中度敏感。相关性分析结果表明,莼菜总黄酮含量及检测到的7种黄酮类物质单体均具有抗氧化、抑菌作用。
[1] 吴征镒,RAVEN P H.中国植物志[M].北京:科学出版社,2001.
WU Z Y,RAVEN P H.Flora of China[M].Beijing:Science Press,2001.
[2] LI Z Z,GICHIRA A W,WANG Q F,et al.Genetic diversity and population structure of the endangered basal angiosperm Brasenia schreberi (Cabombaceae) in China[J].PeerJ,2018,6(5):1-14.
[3] KIM H,WANG Q,SHOEMAKER C F,et al.Polysaccharide gel coating of the leaves of Brasenia schreberi lowers plasma cholesterol in hamsters[J].Journal of Traditional and Complementary Medicine,2015,5(1):56-61.
[4] 吴洪梅, 吕泽芳,张昭,等.四大莼菜产区商品成分种类和质量分数测定及比较研究[J].西南大学学报(自然科学版),2017,39(5):76-82.
WU H M,LV Z F,ZHANG Z,et al.A comparative study of the commercially valuable components of water shield (Brasenia schreberi) from 4 cultivation areas in China[J].Journal of Southwest University (Natural Science Edition),2017,39(5):76-82.
[5] LIU H,HUANG W,HUANG L,et al.Research progress on resources and nutritional components of Brasenia schreberi[J].Botanical Research,2019,8(1):7-14.
[6] 王慧芳, 谈如蓝.莼菜的药用价值与综合开发应用[J].现代食品科技,2016,7(13):45-46.
WANF H F,TAN R L.Water shield medicinal values and comprehensive development and application[J].Modern Food,2016,7(13):45-46.
[7] 李燕, 柯剑鸿,焦大春,等.莼菜的营养价值及其应用研究进展[J].长江蔬菜,2018,18(14):36-39.
LI Y,KE J H,JIAO D C,et al.The nutritional value of Brasenia schreberi and its application research progress[J].Journal of Changjiang Vegetables,2018,18(14):36-39.
[8] ALEKSANDRA K,DOROTA S W.Flavonoids-food sources and health benefits[J].Roczniki Państwowego Zak adu Higieny,2014,68(2):79-85.
adu Higieny,2014,68(2):79-85.
[9] HUGHES S D,KETHEESAN N,HALEAGRAHARA N.The therapeutic potential of plant flavonoids on rheumatoid arthritis[J].Critical Reviews in Food Science and Nutrition,2017,57(17):3 601-3 613.
[10] KIM C,NA H R,CHOI H K.Conservation genetics of endangered Brasenia schreberi based on RAPD and AFLP markers[J].Journal of Plant Biology,2008,51(4):260-268.
[11] OH M J,NA H R,CHOI H K,et al.High frequency plant regeneration from zygotic-embryo-derived embryogenic cell suspension cultures of water shield (Brasenia schreberi)[J].Plant Biotechnology Reports,2008,2(1):87-92.
[12] XIE C,LI J,PAN F,et al.Environmental factors influencing mucilage accumulation of the endangered Brasenia schreberi in China[J].Scientific Reports,2018,8(1):583-597.
[13] XIAO H,CAI X,FAN Y,et al.Antioxidant activity of water-soluble polysaccharides from Brasenia schreberi[J].Pharmacognosy Magazine,2016,12(47):193-197.
[14] LEGAULT J,PERRON T,MSHVILDADZE V,et al.Antioxidant and anti-inflammatory activities of quercetin 7-O-β-D-glucopyranoside from the leaves of Brasenia schreberi[J].Journal of Medicinal Food,2011,14(10):1 127-1 134.
[15] LEE M K,PARK H J,KWON S H,et al.Tellimoside,a flavonol glycoside from Brasenia schreberi, inhibits the growth of cyanobacterium (Microcystis aeruginosa LB 2385)[J].Journal of the Korean Society for Applied Biological Chemistry,2013,56(1):117-121.
[16] SHIMODA H,NAKAMURA S,HITOE S,et al.Anti-Adipogenic polyphenols of water shield suppress TNF-α-Induced cell damage and enhance expression of HAS2 and HAPB2 in Adiponectin-Treated dermal fibroblasts[J].Natural Products Chemistry & Research,2014,2(5):146-153.
[17] 许瑞波, 曹晓英,王明艳,等.睡莲叶黄酮的提取及其抑菌活性研究[J].食品科技,2009,34(4):190-192;197.
XU R B,CAO X Y,WANG M Y,et al.Studies on the extracting technology of flavones from pygmy waterlily leaves and their antibacterial activity[J].Food Science and Technology,2009,34(4):190-192;197.
[18] GOMEZ J D,VATTUONE M A,ISLA M I,et al.Antioxidant activities of Sechium edule(Jacq.) Swartz extracts[J].Food Chemistry,2006,97(3):452-458
[19] 左龙亚. 柑橘亚属植物果皮多酚类物质提取及其抗氧化、抑菌活性检测[D].重庆:西南大学,2018.
ZUO L Y.Polyphenols extraction and antioxidant,antifungal activities test of subgenus Citrus[D].Chongqing:Southwest University,2018.
[20] GORINSTEIN S,HARUENKIT R,PARK Y S,et al.Bioactive compounds and antioxidant potential in fresh and dried Jaffa® sweeties,a new kind of Citrus fruit[J].Journal of the Science of Food and Agriculture,2004,84(12):1 459-1 463.
[21] ALMEIDA M M B,SOUSA P H M D,ARRIAGA A M C,et al.Bioactive compounds and antioxidant activity of fresh exotic fruits from northeastern Brazil[J].Food Research International,2011,44(7):2 155-2 159.
[22] BENZIE I F F,STRAIN J J.The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”:The FRAP assay[J].Analytical Biochemistry,1996,239(1):70-76.
[23] 吕爽, 田呈瑞,韩莎莎.薄荷属植物精油和多酚类的抑菌性及抗氧化性研究[J].食品与生物技术学报,2011,30(6):827-831.
LV S,TIAN C R,HAN S S.Study on antibacterial and antioxidant activity of essential oils and polyphenol in mentha plants[J].Journal of Food and Biotechnology,2011,30(6):827-831.
[24] 孙雨欣, 毛水芳,陈银宁,等.莼菜体外胶的分离及其体外功能活性研究[J].食品与发酵工业,2020,46(2):55-60.
SUN Y X,MAO S F,CHEN Y N,et al.Effect of ultrasonic treatment on the separation,physical properties of mucilage from Brasenia schreberi[J].Food and Fermentation Industries,2020,46(2):55-60.
[25] 唐莹, 黄先智,丁晓雯.食源性黄酮类化合物对肝脏功能的影响与作用机制研究进展[J].食品与发酵工业,2018,44(2):284-289.
TANG Y,HUANG X Z,DING X W.Research progress of the effects of dietary flavonoids on liver function and its mechanisms[J].Food and Fermentation Industries,2018,44(2):284-289.
[26] 刘馨, 郭婷,肖洁,等.莼菜贮藏保鲜的研究进展[J].农业机械,2012,10(30):111-113.
LIU X,GUO T,XIAO J,et al.Research progress on storage and fresh-keeping of Brasenia schreberi[J].Farm Machinery,2012,10(30):111-113.
[27] 蔡敏, 李长春,毕宏光,等.荷叶黄酮的提取和纯化工艺研究[J].湖北农业科学,2015,54(22):5 691-5 693;5 697.
CAI M,LI C C,BI H G,et al.Study on extraction and purification process of flavonoids from lotus leaf[J].Hubei Agricultural Sciences,2015,54(22):5 691-5 693;5 697.
[28] 李鹏程. 王莲类黄酮成分分析[D].南京:南京农业大学,2017.
LI P C.The flavonoid composition in Victoria[D].Nanjing:Nanjing Agricultural University,2017.
[29] 袁丽萍, 王卫,吉莉莉,等.荷叶中黄酮抑菌作用的研究进展[J].山东化工,2018,47(22):46-47.
YUAN L P,WANG W,JI L L,et al.Research progress on the bacteriostatic effect of flavonoids in lotus leaves[J].Shandong Chemical Industry,2018,47(22):46-47.
[30] 董兰芳, 张琴,童潼,等.方格星虫多糖抗菌和抗氧化活性研究[J].广西科学,2013,20(4):289-293.
DONG L F,ZHANG Q,TONG T,et al.Study on the antibacterial and antioxidant activities of polysaccharide from Sipunculus nudus[J].Guangxi Science,2013,20(4):289-293.