真菌毒素的污染是每年造成全球谷物巨大经济损失的主要原因之一,其中黄曲霉毒素(aflatoxins, AFs)造成的危害最为严重。黄曲霉毒素是一类主要由黄曲霉(Aspergillus flavus)和寄生曲霉(Aspergillus parasiticus)产生的次级代谢产物,其基本结构中均含有二呋喃和氧杂萘邻酮(香豆素),主要包括AFB1、AFB2、AFG1、AFG2、AFM1和AFM2,化学结构式如图1所示。在已知的AFs中,AFB1的毒性最强,并被国际癌症研究机构列为I类致癌物[1]。在合适的自然条件下,黄曲霉可以在多种粮食、饲料和食品中生长并产生AFs,并且可以污染整个食物生产线的加工、运输和储藏过程[2]。
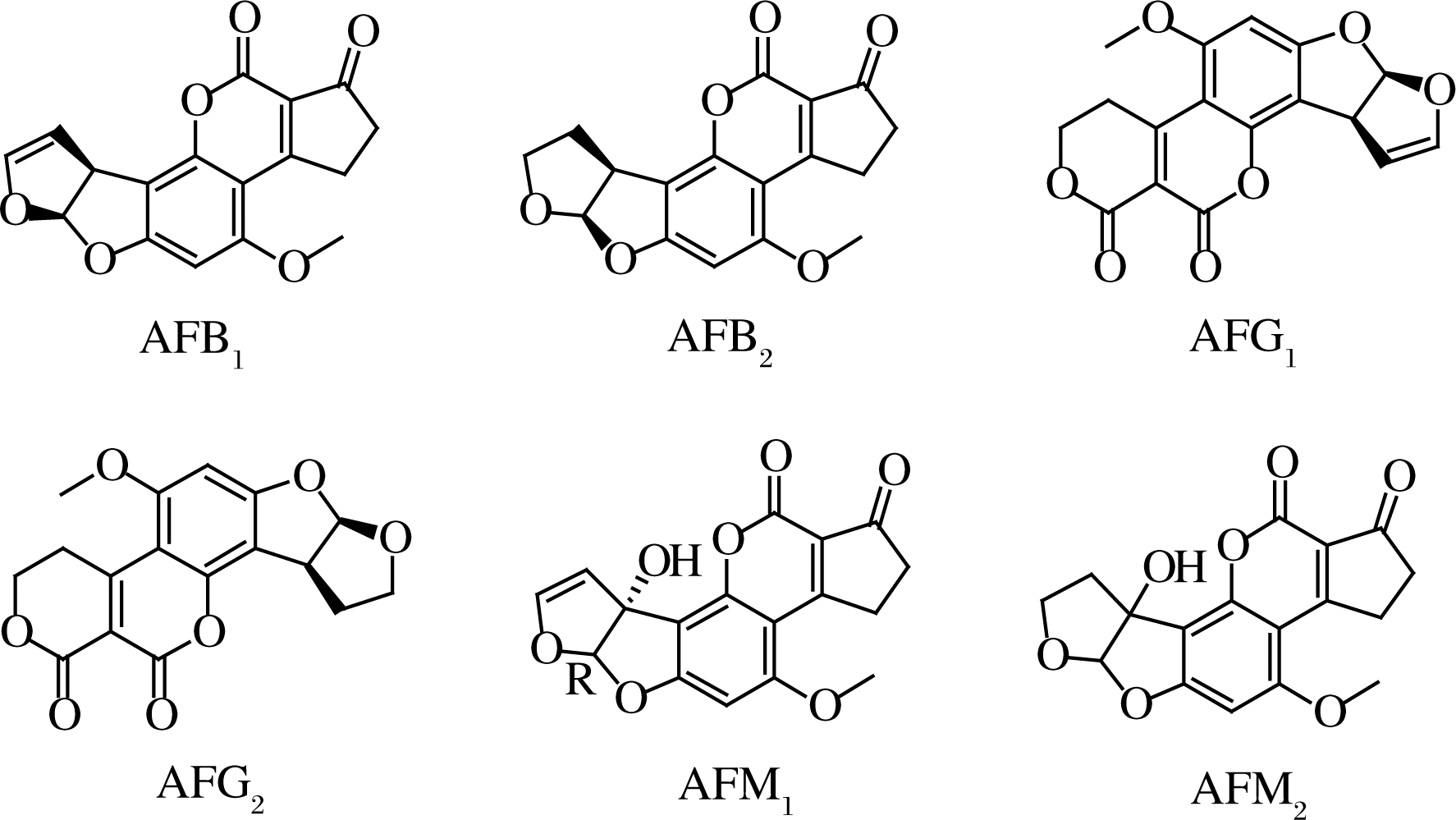
图1 黄曲霉毒素的化学结构式
Fig.1 Chemical structure of aflatoxins 注:化学结构式均来源于ChemBlink网站(https://www.chemblink.com)
AFB1经肠道被吸收,主要在肝脏中进行代谢[3],对人和动物造成毒性危害,可引起肝脏损伤、致突变和致畸。在肝脏中,AFB1通过细胞色素P450酶系统(cytochrome P450,CYP450)生物转化形成致癌的活性中间体AFB1-8,9-环氧化物(AFB1-8,9-epoxide, AFBO), 而AFBO的2种异构体中的AFB1-外-8,9-环氧化物是介导AFB1诱发肝癌形成的主要亲电子化合物,可与DNA、RNA和蛋白质反应形成加合物,尤其容易和p53肿瘤抑制基因反应,消除其抑制肿瘤的功能并促成致癌作用[4]。同时,AFB1还通过CYP450酶系的CYP3A4和CYP1A2代谢生成许多羟基化产物,包括AFM1、AFQ1和AFP1;黄曲霉素醇(aflatoxicol,AFL)是通过还原型辅酶形成的,具有恢复为AFB1能力的独特性质,可作为AFB1的储存库;黄曲霉毒素B2a(AFB2a)发现于肝脏中并可以在酸性环境中自发的形成,而关于AFH1的产生知之甚少,但很可能是由AFL或AFQ1形成的。此外,参与AFB1代谢的CYP450酶系还包括CYP2A13、CYP2A3和CYP321A1,由P450介导的AFB1代谢途径如图2所示[5]。
AFB1在体外和体内都具有遗传毒性,可抑制细胞活性并诱导不同培养细胞系中的自噬,甚至突变p53基因以诱导癌症[6]。AFB1已被充分证明是肝细胞性肝癌(hepatocellular carcinoma, HCC)的诱发因子[7]。此外,AFB1还表现出其他的毒性,已经证明AFB1在人和动物模型中都会导致营养不良、生长迟缓和免疫抑制[8]。尽管AFB1的主要毒性目标是肝脏,但摄入AFB1对其他器官也有不良反应,如心脏、肾脏、附睾、睾丸、大脑和卵巢[9]。
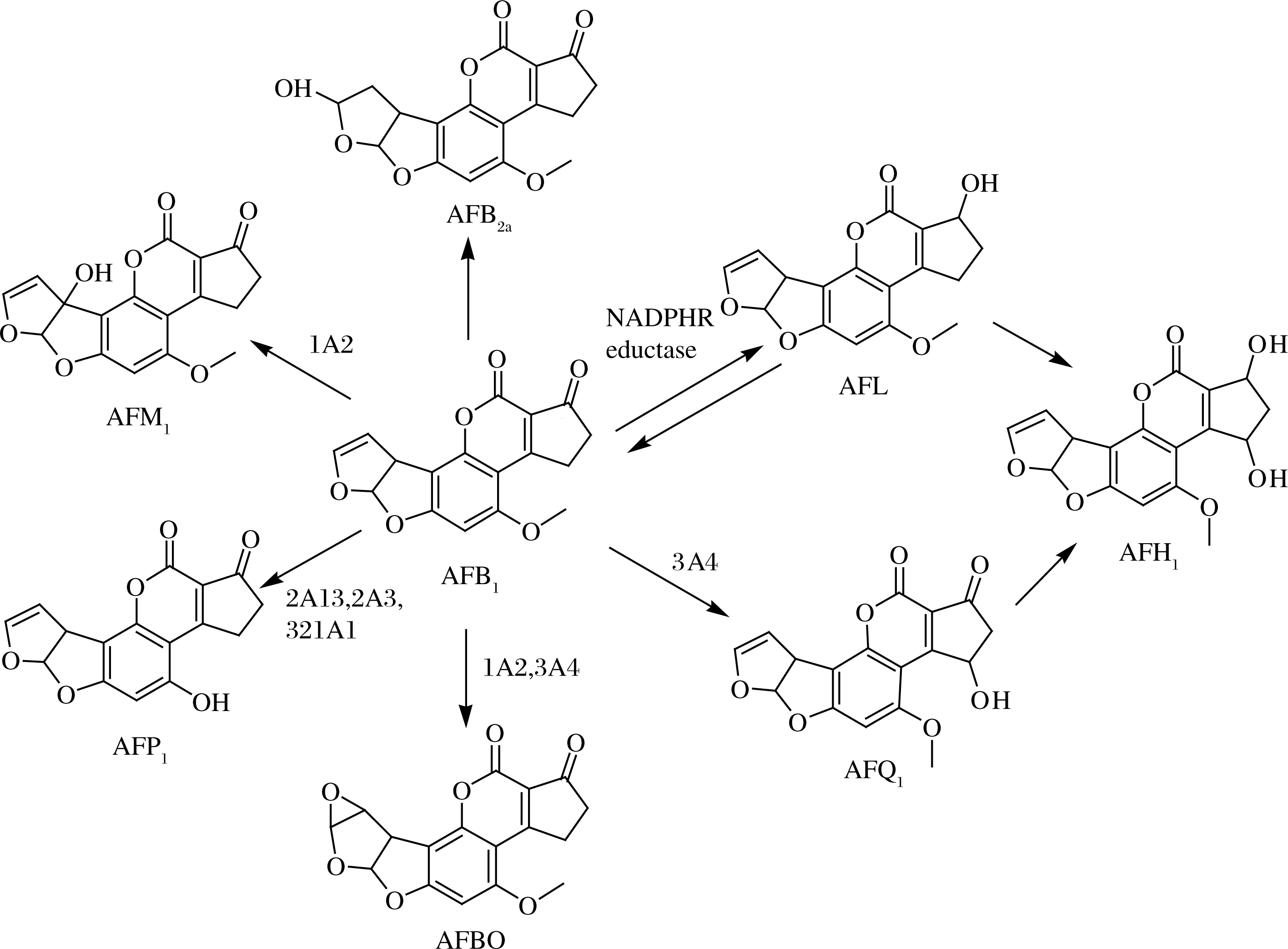
图2 P450介导的AFB1的代谢途径
Fig.2 P450 mediated metabolic pathway of AFB1
近年来,植物源天然产物因其显著的生物活性,对环境和人类健康的低影响等优势而备受关注。多种天然产物已被开发为功能食品或食品添加剂,用于预防慢性疾病和辅助药物治疗疾病,如香菇多糖和水飞蓟素等。研究发现,多种植物源天然产物显示出对黄曲霉的生长和产毒的抑制,且可以抑制AFB1对动物体内和体外细胞的毒性损伤作用[10],其主要生物活性成分为酚类、黄酮类、萜类、多糖类、挥发油类、维生素类和生物碱等。因此,本文主要综述了植物源天然产物对黄曲霉生长的抑制,以及对AFB1诱导动物和体外细胞毒性损伤的抑制作用的研究进展,以期为进一步开展AFB1毒性损伤的防护研究工作以及开发能降低AFB1对人和动物的毒性损伤的新型保健药物和功能食品提供参考。
1 植物源天然产物对黄曲霉的抑制
1.1 植物提取液
植物提取液中含有多种活性成分,多种植物的提取液对黄曲霉生长和产毒有抑制作用。WANG等[11]研究发现,用正丁醇再次萃取山茶籽饼80%甲醇萃取液,其滤液能够有效抑制AFB1的产生、引起菌丝体畸形和减少分生孢子的产生。SANCHEZ等[12]用2种龙舌兰的乙醇、甲醇和水提取物分别作用于2种培养基和储存玉米中黄曲霉,对比其最小抑制浓度(minimum inhibitory concentration,MIC),结果显示龙舌兰花提取物的MIC更高(30 mg/g),而低于MIC的浓度极大地抑制了培养基或玉米中AFB1的产生。
SOMAI等[13]研究发现,质量浓度为10 mg/mL的紫娇花水提取物可导致黄曲霉和寄生虫的持续生长抑制超过50%,在光学显微镜下能观察到紫娇花水提取物以剂量依赖性方式抑制黄曲霉分生孢子的萌发。MO等[14]研究发现几种中国传统茶的水提取物都能抑制AFB1的产生,但不抑制黄曲霉菌丝体的生长,而且大多数茶通过下调aflR和aflS的转录来抑制AFB1的产生。SCARPARI等[15]发现,药用植物云芝的培养滤液可以通过诱导Afyap1转录因子感知和调节氧化爆发(过氧化物和超氧阴离子形成),从而刺激曲霉菌丝体的抗氧化系统,通过调节真菌抗氧化系统起作用,最终导致AFs的生物合成被抑制。
可以发现,植物提取液抑制黄曲霉的生长主要通过抑制其菌丝体的生长以及减少其分生孢子的产生,而且其抑制黄曲霉产生AFB1主要通过调控与表达AFB1生物合成中关键基因、酶和调控因子。此外,植物提取液显示出的抑菌作用,也为进一步分离、分析和鉴定其产生抑制作用的具体活性产物提供了理论基础。
1.2 植物精油
植物精油是一类植物次生代谢产物,分子质量小,易挥发,易溶于有机溶剂,并具有特殊芳香气味的油性物质的总称。植物精油是一类含有多种不同浓度组分的复杂天然混合物,其中萜类化合物是最为常见且含量最多的成分,而萜类化合物中的单萜和倍半萜化合物往往有很强的抗菌作用。
UPADHYAY等[16]探讨了岩玫瑰精油(Cistus ladaniferus essential oil, CLEO)作为植物性防腐剂对储存油籽中真菌和AFB1的抑制潜力,CLEO的抗真菌作用的位点为真菌质膜,同时发现CLEO降低AFB1生物合成的一种新型作用方式是通过引起AFs诱导底物甲基乙二醛的减少。HU等[17]发现天然姜黄精油对黄曲霉的抗菌活性存在剂量依赖性,可通过破坏真菌细胞内膜系统(如质膜和线粒体膜),抑制麦角甾醇合成及线粒体ATP酶、苹果酸脱氢酶和琥珀酸脱氢酶活性,同时通过下调控制AFB1生物合成的相关基因来抑制AFB1。
用纳米技术对精油进行包封处理可以改善精油的水溶性和稳定性,纳米包封处理后精油也显示出比未处理的效果更好。DAS等[18]首次报道了一种基于壳聚糖的绿色纳米包封技术,被纳米包封的芫荽精油(Coriandrum sativum essential oil, CSEO)作用于被黄曲霉侵染的储存水稻,用未包封的CSEO相比其表现出更高的抑制真菌生长和AFB1产生的生物活性,可导致重要的真菌膜生物分子麦角甾醇和细胞离子泄漏,并抑制AFs诱导物甲基乙二醛的生物合成。此外,DWIVEDY等[19]首次报道了八角茴香精油(Illicium verum essential oil, IvEO)纳米胶囊的抗真菌和抗AFB1能力,麦角甾醇含量的降低和Ca2+、K+和Mg2+泄漏的增强表明真菌细胞膜为IvEO的作用部位,IvEO在小鼠体内具有清除自由基活性,并且显示出较高的LD50,凝胶和冻干形式的IvEO纳米胶囊可增强其抗真菌和抗AFB1活性。
植物精油的抗菌靶点主要位于真菌质膜,可导致真菌质膜上重要的生物分子如麦角甾醇和细胞离子泄漏,并抑制AFs生物合成诱导物的产生。
1.3 植物活性物质
植物源天然产物有许多生物活性物质,同时许多可食用植物中也含有这样的活性物质,可食用植物中的这些组成成分也被称为食源性天然产物,常见的主要有多糖类、黄酮类、多酚类、萜类化合物和生物碱等。
槲皮素(quercetin, QUE)是最具代表性的黄酮类化合物之一,天然存在于蔬菜、水果、红酒和草药中,其具有抗炎、抗氧化、抗病毒、抗肿瘤等生物活性。TIWARI等[20]分别用玉米粉(corn flour, CF)和加有QUE的玉米粉(CFQ)培养黄曲霉,并对2组实验进行蛋白质组分析、基因本体修饰分类和AFB1含量测定,结果在CFQ组中观察到cAMP/PKA信号传导途径,而在CF组中观察到MAPK途径;CFQ组中培养48 h时AFB1生物合成降低51%。为深入研究QUE抑制AFs生物合成分子机制,TIWARI等[21]又研究了其与黄曲霉的聚酮化合物合成酶A(polyketidesynthase A,PksA)的相互作用,对PksA的7个域的3D结构进行建模,并且将配体(QUE和己酸)的对接能量与PksA酶的每个结构域进行比较。定量RT-PCR分析结果显示,与QUE处理的黄曲霉7 h相比,在24 h时下调了pksA、aflD、aflR、aflP和aflS基因;QUE相比己酸与PksA结构域具有更高水平的结合潜力,因此,QUE可能通过竞争性结合聚酮合酶的结构域来抑制AFB1的生物合成。
胡椒碱(piperine, PIP)作为一种生物碱,是胡椒中活性及含量最高的化学成分,具有降血脂、抗氧化及抗肿瘤等生物活性。CACERES等[22]发现PIP可抑制黄曲霉的生长和AFB1的产生,且存在剂量依赖性,PIP可下调几乎所有参与AFB1生物合成途径的基因,同时过量表达如atfA、atfB和ap-1以及属于超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase,CAT)族的基因。暴露于PIP下还会导致仅在真菌中存在的全局性调节因子veA转录水平的降低,而veA可参与真菌细胞的多个过程调控,包括发育分化、次生代谢、氧化胁迫应答、侵染宿主致毒致病等[23]。
肉桂醛(cinnamaldehyde, CIN)是樟科植物肉桂中的活性成分,具有抗菌、降糖和降脂等生物活性,在肉桂挥发油中90%左右都是肉桂醛,也是一种安全且很有前途的天然防腐剂。SUN等[24]研究结果表明CIN以剂量依赖的方式抑制了黄曲霉的径向生长、孢子产生、菌丝体形成和AFB1的生物合成;在104 mg/L 的质量浓度下,CIN暴露能够完全抑制真菌生长以及AFB1的产生。此外,CIN显著降低脂质过氧化水平和还原型谷胱甘肽(glutathione,GSH)水平,并显著抑制总SOD的活性。
柠檬醛是一种存在于枫茅油和山苍子油中的萜类化合物,常被用作食品添加剂和食用香料。属于酚类化合物的丁香酚是植物丁香的主要活性成分,具有良好的抗菌活性,通常作为天然香料而被使用。LIANG等[25]为了揭示肉桂醛、柠檬醛和丁香酚对AFs生物合成的抑制作用,通过RT-PCR评估了5种关键的AFs生物合成基因的表达水平。结果显示,0.80 mmol/L的肉桂醛和2.80 mmol/L的柠檬醛能够完全抑制黄曲霉的生长和AFB1的产生。在较低浓度下,肉桂醛(0.40 mmol/L)、丁香酚(0.80 mmol/L)和柠檬醛(0.56 mmol/L)能显著降低AFB1的产量,抑制率分别为68.9%、95.4%和41.8%。RT-PCR结果显示,肉桂醛(0.40 mmol/L)、丁香酚(0.80 mmol/L)和柠檬醛(0.56 mmol/L)均可不同程度的下调aflR、aflT、aflD、aflM和aflP的表达。
没食子酸(gallic acid, GA)是自然界存在的一种多酚类化合物,具有很高的抗氧化活性。ZHAO等[26]发现GA通过显著抑制farB的表达和下调碳抑制调节因子编码基因creA两种途径来抑制AFs,其中farB是编码参与过氧化物酶体脂肪酸β-氧化的转录因子,CreA蛋白参与AFs的合成且AFs生物合成基因在ΔcreA突变体中显著下调。
从研究发现可以看出,植物中的生物活性物质对黄曲霉产生毒素的抑制机制通常与AFB1生物合成中关键基因、酶和调控因子的表达与调控有关。各植物活性物质的化学结构式如图3所示,其对黄曲霉生长及其产毒的抑制情况和其抑制作用的相关机制如表1所示。
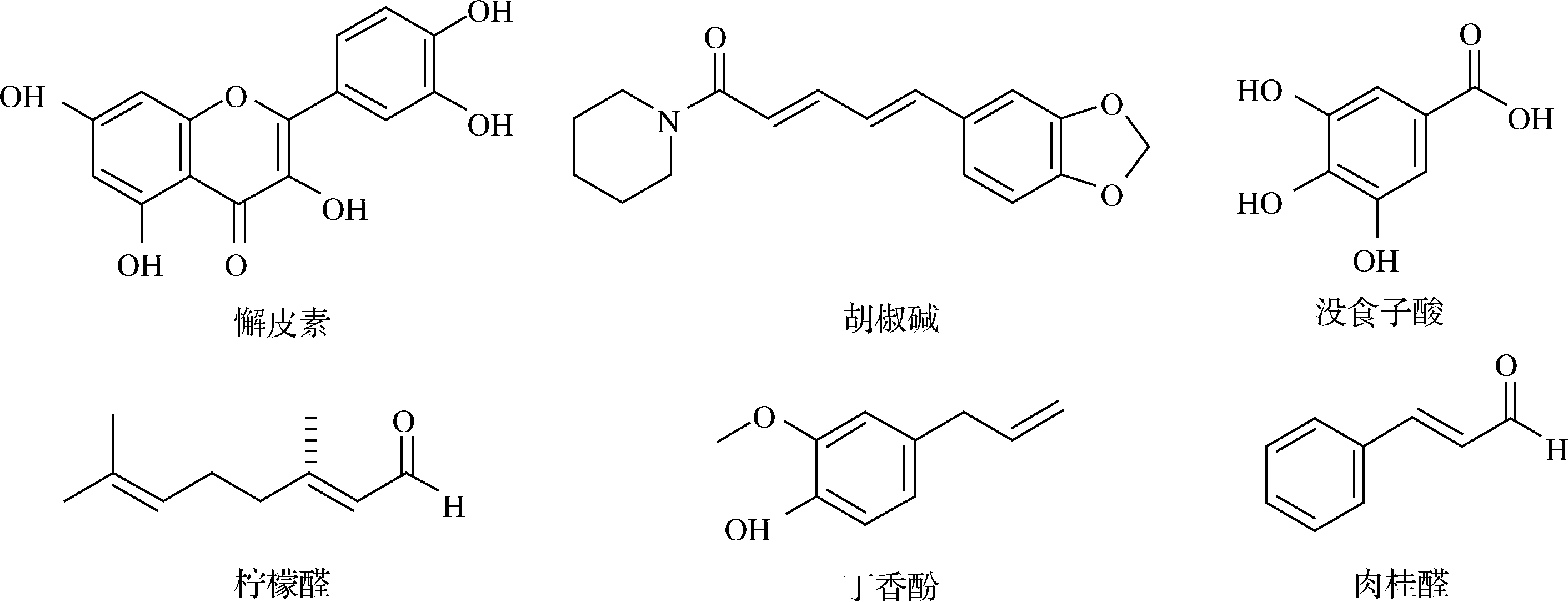
图3 天然产物的化学结构式
Fig.3 Chemical structure of natural products
表1 天然产物对黄曲霉的抑制作用及相关机制
Table 1 The inhibition and mechanism of Aspergillus flavus induced by natural products

天然产物抑制黄曲霉抑制AFB1的产生抑制机制参考文献槲皮素++激活cAMP / PKA信号传导途径;下调pksA、aflD、aflR、aflP和aflS基因;竞争性结合聚酮合酶[20-21]胡椒碱++下调参与AFB1合成途径的基因;降低调节因子veA的转录水平;过量表达编码atfA、atfB和ap-1以及属于SOD和CAT的基因[22]肉桂醛++高度下调aflM,其次是aflP、aflR、aflD和aflT基因的表达;降低脂质过氧化和GSH水平,抑制总SOD的活性[24-25]柠檬醛++完全抑制aflT,其次是aflM、aflP、aflR和aflD[25]丁香酚++高度下调aflP的表达,其次是aflM、aflR、aflD和aflT基因[25]没食子酸++显著抑制farB的表达;显著下调碳抑制调节因子编码基因creA[26]
注:“+”表示有抑制效果,“-” 表示没有抑制效果
2 植物源天然产物对AFB1毒性的抑制作用
2.1 药用植物提取物
草本植物穿心莲(Andrographia paniculata)因具有多种药用活性,已经用于多种临床应用。AHMAD等[27]设计了体内和体外实验对穿心莲提取物进行了抗AFB1诱导的毒性的抗原性、抗突变和抗癌特性的测试,结果显示,穿心莲提取物在体内各浓度和暴露时间均能显著降低畸变细胞数和细胞畸变频率;在体外可显著降低染色体畸变和姐妹染色单体交换,提高复制指数。
叶下珠(Phyllanthus urinaria)是一种全草可入药且具有巨大药用潜力的草本植物,其具有多种药用活性,常用的治疗肝肾疾病。AHMAD等[28]又评估了叶下珠提取物对AFB1诱导体外人淋巴细胞和体内Albino 小鼠骨髓细胞的抗原性、抗原毒性和抗诱变潜力,结果显示,叶下珠提取物显著减低了体内畸变细胞数和细胞畸变频率以及体外染色体畸变和姐妹染色单体交换,并提高了复制指数。因此,叶下珠提取物能显著降低体内和体外AFB1诱导的致突变性和遗传毒性。
长松萝(Usnea longissima)是一种隶属松萝科松萝属的地衣类附生植物,其提取物和代谢产物具有多种生物活性,如抗炎、抗病毒、抗氧化、抗肿瘤等,其抗菌作用尤为突出。AGAR等[29]研究了松萝甲醇提取物对AFB1导致人血细胞的遗传毒性和氧化应激的影响,发现松萝提取物通过提高抗氧化酶活性水平消除了AFB1的遗传毒性和脂质过氧化,结果表明松萝提取物具有很强的抗氧化和抗原毒性作用。
有名的中药材红参在许多疾病中发挥调节作用,如心血管疾病、癌症和高血压等。ABDEL-WAHHAB等[30]的研究发现,红参提取物可预防AFB1和伏马菌素诱导引起的大鼠肝癌前的病变。
以上研究发现药用植物提取物显示出对AFB1诱导引起的基因突变、DNA损伤和遗传毒性有较好的干预作用。
2.2 植物活性物质
2.2.1 番茄红素
番茄红素属于类胡萝卜素,是一种亲脂、不饱和、具有生物活性的天然色素,广泛存在于红色的水果和蔬菜中,特别是西红柿,番茄红素含有共轭双键的长链结构,具有很强的抗氧化活性,其清除活性氧自由基的能力远远超过维生素E和其他类胡萝卜素,可以保护脂质、蛋白质和DNA免受氧化损。YILMAZ等[31]研究发现,服用了AFB1的Wistar-Albino大鼠肾脏和心脏组织中的丙二醛(malondialdehyde, MDA)水平显著增加;而GSH、谷胱甘肽-S-转移酶(glutathione-S-transferase GST)、CAT、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、SOD和葡萄糖-6-磷酸脱氢酶(glucose-6-phosphatedehydrogenase,G6PD)活性降低,且番茄红素能够改善以上抗氧化防御系统和脂质过氧化的指标,显示出番茄红素对AFB1诱导的肾毒性和心脏毒性的保护作用。
此外,已经有研究证明番茄红素在诸多重要的生物学过程中发挥作用,如抗肿瘤、刺激细胞生长、改善细胞代谢、加强细胞间的结合、加强某些激素、细胞因子和生长因子的信号传递等,加强其对氧化应激、胰岛素分泌、内皮功能和脂质代谢的影响比较显著。我国已经批准其作为食用色素和营养补充剂,可用于食品和医疗领域。
2.2.2 白藜芦醇
白藜芦醇作为一种天然多酚类化合物,存在于葡萄、葡萄酒、桑椹、蓝莓等。白藜芦醇具有多种生物活性作用,如免疫调节、抗癌、降血压、降血糖、抗休克、抗血小板聚集和心脏保护作用,也因此用于不同疾病的预防和治疗,如癌症、老年痴呆症、糖尿病等。ZHOU等[32]使用白藜芦醇作用于AFB1诱导的牛乳腺上皮细胞,发现白藜芦醇可以减轻AFB1诱导的细胞毒性,缓解活性氧自由基的增加、牛乳腺上皮细胞线粒体膜电位(mitochondrial membrane potential,MMP)的减少和细胞凋亡,同时调节Nrf2信号传导途径的组分的mRNA转录物(包括Nrf2、Keap1、NQO1、HO-1、SOD2和HSP70)的表达,说明白藜芦醇对AFB1诱导牛乳腺上皮细胞的毒性具有改善作用。
因白藜芦醇有多种生物活性,使其具有极大的研究价值和利用价值,但其较低的体内生物利用度也增加了研究、开发和利用的难度。同时,虽然白藜芦醇反式和顺式2种几何异构体具有不同的生物活性,但这2种异构体对光照、pH和温度的敏感性也会限制其在体内外的应用,这也将是开发研究所要攻克的重难点。
2.2.3 维生素E
维生素E也被称为生育酚,是一类化学结构相似的酚类化合物的总称,具有抗氧化、抗炎和免疫调节等多种生物活性。维生素E的抗氧化活性与其化学结构上的羟基有关,能够通过捕获自由基来阻断自由基的链式反应,从而阻止脂质过氧化反应,保护组织结构。
YILMAZ等[33]发现AFB1的给药可引起大鼠的肝毒性、心脏毒性和肾毒性,而维生素E组显著降低大鼠血浆中天冬氨酸转氨酶、丙氨酸转氨酶、碱性磷酸酶和乳酸脱氢酶的活性和尿素浓度,并改善AFB1对氧化应激标志物和病理变化的有害影响。此外,ABDEL-HAMID等[34]观察用AFB1处理后的大鼠肾皮质组织,观察到管状细胞质空泡形成、线粒体破坏、大量溶酶体、胶原沉积等现象,而在AFB1 + 维生素E组中,对于肾皮质的组织学结构影响最小,且抗氧化参数变化不大。维生素E显示出的对AFB1诱导靶器官或细胞的毒性作用的干预作用为以后研究通过日常膳食抵抗AFB1对人体和动物的毒性作用提供了可能性。
2.2.4 β-葡聚糖
β-葡聚糖是由D-葡萄糖单体通过β-糖苷键连接而成的大分子多糖,存在于燕麦、大麦纤维、酵母以及医药用蘑菇菌的细胞壁中,具有多种生物活性,如免疫调节、抗肿瘤、降低血清胆固醇和血糖、预防肥胖等,在健康食品和医药产品中发挥着重要作用。不同来源的β-葡聚糖有着不同的化学结构和物理性质,聚合度直接决定其溶解性,聚合度>100的β-葡聚糖通常完全不溶于水;β-葡聚糖还因其保湿、抗衰老和伤口愈合作用而被应用于化妆品中。
ZIMMERMANN等[35]研究发现了β-葡聚糖对暴露于AFB1中肉鸡淋巴细胞显示出体外剂量依赖性的细胞保护和基因保护作用,β-葡聚糖能够完全恢复AFB1诱导的淋巴细胞DNA损伤,并保持DNA完整性。MADRIGAL-BUJAIDAR等[36]探讨了β-D-葡聚糖在小鼠肝细胞中减少AFB1诱导的DNA损伤的能力,高剂量组的β-D-葡聚糖和AFB1间形成了超分子复合物,从而减少了AFB1对DNA损伤。BAKHEET等[37]研究了β-1,3-葡聚糖(β-1,3-glucan,BG)对暴露于AFB1的小鼠表型标志物和细胞因子分泌表达的作用,单独使用BG和结合暴露于AFB1的BG显著增加了血液中淋巴细胞亚群(CD4+、GITR+、CD8+、TCRβ+、CD3+、Foxp3+、CD4+ Foxp3+和CD127+)的百分比和细胞因子(IL-2、TNF-α、IL-17和IFN-γ)的水平,结果表明BG通过调节细胞因子的产生来实现其免疫调节活性。
2.2.5 QUE
QUE作为一种有效的自由基清除剂,相比于维生素C和维生素E这类传统抗氧化剂,具有更强的抗氧化活性。EL-NEKEETY等[38]的研究发现饲喂AFs污染饮食大鼠的血清生化指标、氧化应激标记和DNA片段化显著增加,而加入QUE能够成功地使生化参数趋于正常,并改善肝组织中核酸的含量、基因表达、肝脏的组织病理学和组织化学图像,可以得出QUE具有潜在的抗氧化活性保护作用并且调节由AFs诱导的基因表达。
AFB1与人血清白蛋白(human serum albumin, HSA)具有较高的亲和力,TAN等[39]通过荧光光谱、同步光谱、超滤研究等方法研究了QUE与AFB1结合HSA的竞争能力,发现AFB1和QUE均在结合位点Sudlow site Ⅰ的亚结构域IIA (subdomain IIA)与HSA结合,且QUE-HSA复合物的结合率明显高于AFB1-HSA复合物,研究结果表明QUE能竞争性的与HSA结合来去除HSA中的AFB1。这项研究中的QUE显示出竞争性物质对人类的潜在保护作用,为研究降解AFB1的体内毒性提供了新的思路。
此外,EFTEKHARI等[40]还通过体外和体内实验评价了槲皮素纳米粒子(quercetin nanoparticles,QNPs)抵抗由AFB1诱导的毒性的保肝作用和抗氧化活性,与游离QUE相比,QNPs能更有效地增强其抗氧化水平,并通过降低谷草转氨酶、谷丙转氨酶和碱性磷酸酶水平显示出显著的保肝作用,这表明QNPs有成为药物递送物的潜力,可增强QUE对AFB1致肝细胞毒性的保肝作用。
尽管QUE具有广谱的药理特性,但其在水中的溶解度低、生物半衰期短且口服生物利用度低,极大限制了QUE作为治疗剂的使用。纳米技术生产设计的纳米颗粒(粒径<100 nm)有望为药物输送、电化学传感、诊断和治疗各类疾病提供新的解决方案。由于纳米颗粒的尺寸较小,提供了更大的比表面积,因此可以提高药物的有效性和生物利用度。以纳米技术为基础的方法在增加吸收不良水溶性活性物质方面显示出有益的影响,并且在天然产物的开发研究中,可使用较少剂量达到实验预期效果。
2.2.6 姜黄素
姜黄素(curcumin,CUR)是从姜科植物中提取的一种天然多酚化合物,具有抗氧化、抗炎、抗肿瘤、抗菌和促进伤口愈合的潜在功能。ZHANG等[41]研究发现食用含有AFB1饲料组的雄性肉鸡肝脏中的血清白蛋白、总蛋白、GSH-Px、CAT和GSH水平显著降低,谷草转氨酶和谷丙转氨酶的活性显著升高,MDA、8-羟基脱氧乌苷(8-OHdG)和AFBO-DNA加合物的浓度水平增加。补充CUR能缓解AFB1引起的肝脏损伤,同时增加抗氧化能力,抑制AFBO的产生。
LI等[42]研究发现,CUR可抑制肉鸡肝脏中活性氧自由基、8-OHdG和AFB1加合物的产生,抑制活化的Nrf2信号传导途径,从而减轻AFB1诱导的毒性和氧化应激。CUR可以被认为是预防AFB1诱导的毒性和氧化应激的潜在药物,AFB1加合物可能是合适的治疗靶点。WANG等[43]的研究发现,CUR可通过增强Ⅱ相酶的活性和表达来改善AFB1诱导的肝损伤,此外,CUR在肝细胞质中体外增加GSH和AFB1的结合率,同时可以提高Nrf2及其下游基因的mRNA、蛋白质的表达水平。
ABDEL-WAHHAB等[44]就评估了姜黄素纳米粒负载水凝胶(CUR-NPs-Hgs)对AFB1诱导的大鼠肝脏遗传毒性的保护作用,添加CUR-Nps-Hgs缓解了AFB1单独处理大鼠导致的体重降低、生化及遗传毒性和组织学紊乱,结果表明了CUR-NPs-Hgs具有防止AFB1诱导肝损伤的潜力。以上研究结果显示出植物活性物质可从多个方面抵抗AFB1的毒性损伤,如抗氧化应激、改善脂质氧化代谢、防止DNA损伤、抗遗传毒性、抗突变、调节酶活性、改善关键细胞因子和蛋白质的分泌与表达、免疫调节、恢复血清和脏器指标、竞争AFB1的作用靶点以防止AFB1加合物的形成等。以上植物活性物质化学结构式如图4所示,其对AFB1的毒性抑制作用及机制如表2所示。
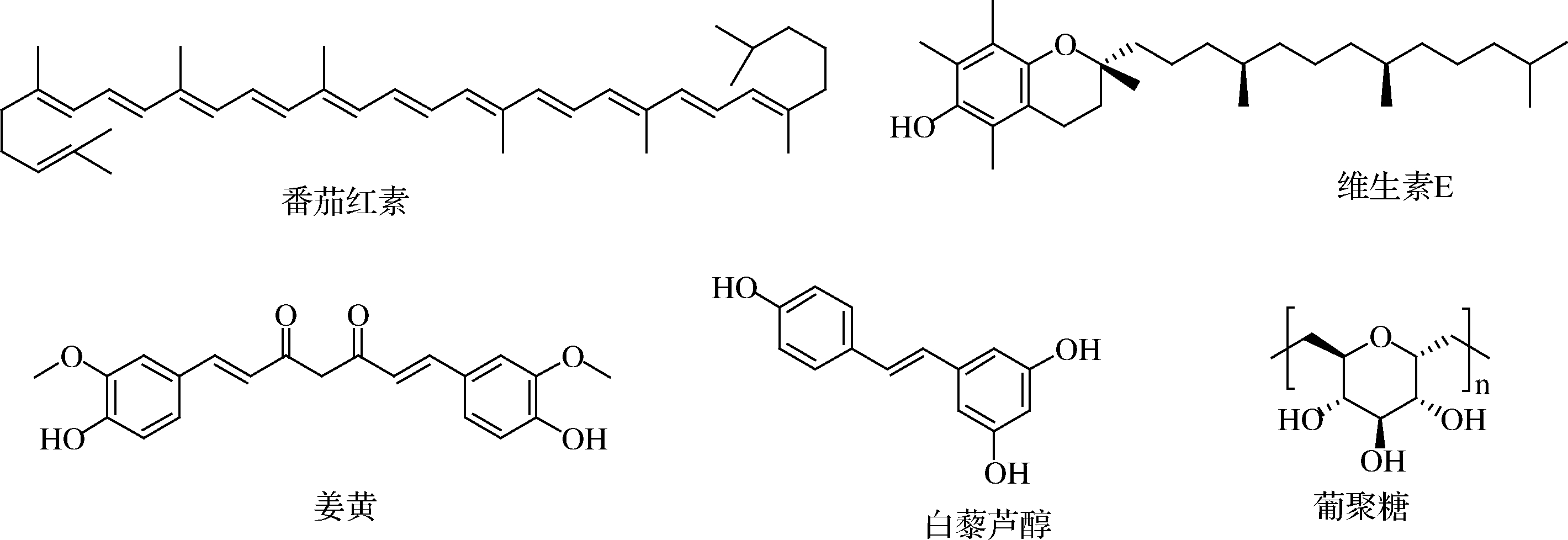
图4 天然产物的化学结构式
Fig.4 Chemical structure of natural products
表2 几种天然产物对AFB1毒性的抑制作用及相关机制
Table 2 The inhibition of AFB1 toxicity by several natural products and related mechanisms

天然产物实验对象抑制效果或相关机制参考文献番茄红素Wistar-Albino大鼠改善AFB1引起的MDA水平显著增加,GSH、GST、CAT、GSH-Px、SOD和G6PD活性的降低[31]白藜芦醇牛乳腺上皮细胞缓解AFB1引起的活性氧自由基的增加、MMP和细胞凋亡的减少,同时调节Nrf2信号传导途径相关基因的表达[32]维生素EWistar-Albino大鼠降低AFB1引起肝脏和肾脏损伤指标水平,改善AFB1对氧化应激标志物和病理变化的有害影响[33-34]β-葡聚糖肉鸡淋巴细胞完全恢复AFB1诱导的淋巴细胞DNA损伤,并保持DNA完整性[35]小鼠β-D-葡聚糖和AFB1之间形成了超分子复合物[36]小鼠增加了血液中淋巴细胞亚群的百分比和细胞因子的水平[37]槲皮素HepG2细胞促进抗氧化防御系统和抑制脂质过氧化[38]人血清白蛋白QUE能竞争性的与HSA结合,从而去除HSA中的AFB1,并降低其结合率[39]大鼠和大鼠肝细胞可以使AFB1引起与肝损伤有关的肝脏功能指标的升高趋于正常水平[40]姜黄素雄性肉鸡缓解AFB1引起的肝脏损伤,同时增加抗氧化能力和抑制AFBO的产生[41]Arbor Acres肉鸡抑制肉鸡肝脏中活性氧自由基、8-OHdG和AFB1加合物的产生以及活化的Nrf2信号传导途径[42]Arbor Acres肉鸡增强Ⅱ相酶的表达和活性,增加GSH和AFB1的结合,提高Nrf2及其下游基因的mRNA、蛋白质的表达水平[43]
2.2.7 其他活性物质
LU等[45]研究了氧化茶多酚(oxidised tea polyphenols, OTP)对AFB1在大鼠体内吸收和毒性的影响,结果显示OTP可与AFB1复合,并且抑制AFB1加合物在大鼠体内的吸收,从而缓解了AFB1对肝脏的损伤;与AFB1组相比,AFB1+OTP组的大鼠在进食4 h后AFB1-白蛋白的含量明显降低。此外,OTP能显著促进粪便中AFB1的含量。研究结果表明,食用发酵普洱茶等含OTP的产品,可有效地缓解AFB1对肝脏的危害;OTP可作为食品添加剂加入食品中。
WANG等[46]研究了一种大白菜水溶性提取物粉末(在出口温度为130 ℃条件下喷雾干燥制得)对AFB1诱导肝癌的潜在抗癌能力。动物实验结果表明,饮用水中加质量分数为10%的大白菜粉可以改善血浆微量营养素水平,抑制肝细胞中AFB1-DNA加合物的形成,并且有效地使AFB1诱发肝癌的发生率从6.67%降低到0。
结合纳米包封技术对多种活性物质纳米包封用于研究其抑制AFB1的毒性作用是一种研究新趋势。KUMAR等[47]制备了基于百里香酚、肉桂酸甲酯和芳樟醇组合的新型协同配方的纳米包封制剂(Ne-TML),评估了Ne-TML在体外和食品系统中的抗真菌和抗AFB1潜力,结果发现0.3 μL/mL的Ne-TML可抑制黄曲霉的生长并完全抑制AFB1的产生,结果推测Ne-TML的抗真菌作用模式与麦角甾醇含量降低、膜离子泄漏、碳源利用受损、线粒体功能、抗氧化防御系统(SOD,CAT和GR)和AFB1生物合成基因ver-1有关。KUMAR等[48]制备了丁香酚、薄荷醇和t-茴香脑组合的新型协同制剂(EMT)和其纳米包封制剂(Ne-EMT),Ne-EMT 抑制AFB1的毒性机制与麦角甾醇减少、离子泄漏、碳源利用以及抗氧化防御系统和GSH的比例降低有关,并与AFB1调控基因ver-1和omt-A相互作用。此外,Ne-EMT有效地保留了模型食物系统的感官特性,增强了其作为植物类抗菌剂的功效。
3 总结与展望
常用的物理、化学和生物黄曲霉毒素脱毒法要大规模的应用于实际生活中比较困难,同时也存在实际操作较为繁琐、成本高、耗时长、污染环境、易影响食品和饲料的感官和营养价值等缺陷。再加上AFB1与其他危险因素如乙型肝炎病毒和丙型肝炎病毒有协同作用,通过遗传和表观遗传修饰促进HCC的发展[49],以及黄曲霉可在适当的自然条件下生长并且产生毒素的特性,所以人和动物不可避免的会摄入AFB1进而造成肝脏损伤甚至致癌。因此,通过其他途径和方式来减轻AFB1对肝脏的损伤尤其重要,例如,筛选具有生物活性且合适的天然产物作为食品添加剂加入粮食、加工食品和饲料中以抑制黄曲霉等真菌的生长和产毒,以及研究开发天然活性产物用于制备新型保肝药物和功能食品。因而,副作用小、生物活性显著、多靶点、多途径的植物源天然产物就显示出了巨大的开发潜力和研究价值。本文总结了近年来植物源天然产物对黄曲霉生长、产毒以及AFB1毒性的抑制作用和相关抑制机制,这些植物源天然产物抑制黄曲霉生长和产毒途径和方式主要是通过导致真菌质膜的麦角甾醇和细胞离子泄露,抑制菌丝体生长、分生孢子的产生、诱导AFs生物合成诱导物的产生,以及调控与表达AFB1生物合成中关键基因、酶和调控因子。同时,植物源天然产物抵抗AFB1毒性损伤的机制也包括多个方面,如抗氧化应激、改善脂质氧化代谢、防止DNA损伤、抗遗传毒性、抗突变、调节酶活性、免疫调节、恢复血清和脏器指标、竞争AFB1的作用靶点以防止AFB1加合物的形成等。
研究发现的部分有效植物源天然产物也属于食源性天然产物,可以通过膳食获得,这是降低AFB1对人和动物毒性损伤比较健康且安全的一种方式。此外,也有一些农产品的副产物对AFB1致动物的毒性损伤有抑制作用,如葡萄籽[50],这显示出其作为动物饲料来源的潜力,同时也是一种资源最大化利用的环保途径。
目前的研究显示,植物源天然产物对黄曲霉和AFB1的抑制作用的研究方面取得了一定的进展,但尚有一些方面需要思考和研究:(1)虽然植物提取物和植物精油对黄曲霉和AFB1均显示出较好的抑制,但对该混合物的组成成分及相对含量缺乏研究和探讨。(2)目前研究主要围绕单一天然产物对黄曲霉生长、产毒或AFB1毒性损伤的防护作用,复配天然产物的研究报道相对较少。(3)部分研究仅以生化指标、脏器指数及组织切片作为植物源天然产物对AFB1毒性有干预作用的依据,缺乏关键酶、相关调控信号通路和基因水平的检测研究,对认识天然产物的干预作用的具体机制欠缺。建议引入代谢组学、蛋白组学和基因组学。(4)植物源天然产物对AFB1毒性的干预作用的途径和靶点可能不是单一的,通常是结合多靶点作用,因此应研究关键作用靶点以及不同靶点间的协同作用。(5)虽然越来越多的研究发现植物源天然产物可以抑制黄曲霉生长、产毒以及AFB1毒性,为天然产物作为天然防毒剂和食品添加剂以保障食品安全提供了更多的可能性,后续的研究应主要从食品或饲料的实际情况来分析这些植物源天然产物的适用范围、使用方式及实际效果。
[1] AONE. IARC Monographs on the Evaluation of Carcinogenic Risk to Humans,Vol.56,Some Naturally Occurring Substances:Food Items and Constituents,Heterocyclic Aromatic Amines and Mycotoxins:IARC,Lyon,1993 (ISBN 92-832-1256-8).599 pp.Price SF 95.00[J].Analytica Chimica Acta,1994,294(3):341.
[2] XU L,ZHANG Z W,ZHANG Q,et al.Mycotoxin determination in foods using advanced sensors based on antibodies or aptamers[J].Toxins,2016,8(8):239.
[3] YAMASAKI C,OGAWA Y,KAGEYAMA Y,et al.Detection of aflatoxin B1 hepatotoxicity using PXB-cells[J].Drug Metabolism and Pharmacokinetics,2017,32(1):S63-S63.
[4] QI L N,BAI T,CHEN Z S,et al.The p53 mutation spectrum in hepatocellular carcinoma from Guangxi,China:Role of chronic hepatitis B virus infection and aflatoxin B1 exposure[J].Liver International,2015,35(3):999-1 009.
[5] RUSHING B R,SELIM M I.Aflatoxin B1:A review on metabolism,toxicity,occurrence in food,occupational exposure,and detoxification methods[J].Food and Chemical Toxicology,2019,124:81-100.
[6] CHEN B L,LI D Y,LI M,et al.Induction of mitochondria-mediated apoptosis and PI3K/Akt/ mTOR-mediated autophagy by aflatoxin B2 in hepatocytes of broilers[J].Oncotarget,2016,7(51):84 989-84 998.
[7] FERREIRA R G,CARDOSO M V,DE SOUZA F K M,et al.Epigenetic alterations caused by aflatoxin B1:A public health risk in the induction of hepatocellular carcinoma[J].Translational Research,2019,204:51-71.
[8] CORCUERA L A,ARBILLAGA L,VETTORAZZI A,et al.Ochratoxin A reduces aflatoxin B1 induced DNA damage detected by the comet assay in HepG2 cells[J].Food and Chemical Toxicology,2011,49(11):2 883-2 889.
[9] CHENG L H,QIN Y S,HU X,et al.Melatonin protects in vitro matured porcine oocytes from toxicity of aflatoxin B1[J].Journal of Pineal Research,2019,66(4):e12543.
[10] VIPIN A V,RAKSHA R K,NAWNEET K K,et al.Protective effects of phenolics rich extract of ginger against aflatoxin B1-induced oxidative stress and hepatotoxicity[J].Biomedicine & pharmacotherapy,2017,91:415-424.
[11] WANG Y P,YANG L,FEI X Q,et al.Antifungal effect of camellia seed cake extract on Aspergillus flavus[J].Journal of Food Protection,2019,82(3):463-469.
[12] SANCHEZ E,HEREDIA N,GARCIA S.Inhibition of growth and mycotoxin production of Aspergillus flavus and Aspergillus parasiticus by extracts of agave species[J].International Journal of Food Microbiology,2005,98(3):271-279.
[13] SOMAI B M,BELEWA V.Aqueous extracts of tulbaghia violacea inhibit germination of Aspergillus flavus and Aspergillus parasiticus conidia[J].Journal of Food Protection,2011,74(6):1 007-1 011.
[14] MO H Z,ZHANG H,WU Q H,et al.Inhibitory effects of tea extract on aflatoxin production by Aspergillus flavus[J].Letters in Applied Microbiology,2013,56(6):462-466.
[15] SCARPARI M,PARRONI A,ZACCARIA M,et al.Trametes versicolor bioactive compounds stimulate Aspergillus flavus antioxidant system and inhibit aflatoxin synthesis[J].Plant Biosystems-An International Journal Dealing with all Aspects of Plant Biology,2016,150(4):653-659.
[16] UPADHYAY N,SINGH V K,DWIVEDY A K,et al.Cistus ladanifer L.essential oil as a plant based preservative against molds infesting oil seeds,aflatoxin B1 secretion,oxidative deterioration and methylglyoxal biosynthesis[J].LWT-Food Science & Technology,2018,92:395-403.
[17] HU Y C,ZHANG J M,KONG W J,et al.Mechanisms of antifungal and anti-aflatoxigenic properties of essential oil derived from turmeric (Curcuma longa L.) on Aspergillus flavus[J].Food Chemistry,2017,220:1-8.
[18] DAS S,SINGH V K,DWIVEDY A K,et al.Encapsulation in chitosan-based nanomatrix as an efficient green technology to boost the antimicrobial,antioxidant and in situ efficacy of Coriandrum sativum essential oil[J].International Journal of Biological Macromolecules,2019,133:294-305.
[19] DWIVEDY A K,SINGH V K,PRAKASH B,et al.Nanoencapsulated Illicium verum Hook.f.essential oil as an effective novel plant-based preservative against aflatoxin B1 production and free radical generation[J].Food and Chemical Toxicology,2018,111:102-113.
[20] TIWARI S,SHANKAR J.Integrated proteome and HPLC analysis revealed quercetin-mediated inhibition of aflatoxin B1 biosynthesis in Aspergillus flavus[J].3 Biotech,2018,8(1).DOI:10.1007/s13 205-017-1067-0.
[21] TIWARI S,SHISHODIA S K,SHANKAR J.Docking analysis of hexanoic acid and quercetin with seven domains of polyketide synthase A provided insight into quercetin-mediated aflatoxin biosynthesis inhibition in Aspergillus flavus[J].3 Biotech,2019,9(4).DOI:10.1007/s13 205-019-1675-y.
[22] CACERES I,ELKHOURY R,BAILLY S,et al.Piperine inhibits Aflatoxin B1 production in,Aspergillus flavus,by modulating fungal oxidative stress response[J].Fungal Genetics and Biology,2017,107:77-85.
[23] WANG D Y,TONG S M,GUAN Y,et al.The velvet protein VeA functions in asexual cycle,stress tolerance and transcriptional regulation of Beauveria bassiana[J].Fungal Genetics and Biology,2019,127:1-11.
[24] SUN Q,SHANG B,WANG L,et al.Cinnamaldehyde inhibits fungal growth and aflatoxin B1 biosynthesis by modulating the oxidative stress response of Aspergillus flavus[J].Applied Microbiology and Biotechnology,2016,100(3):1 355-1 364.
[25] LIANG D D,XING F G,SELVARAJ J N,et al.Inhibitory effect of cinnamaldehyde,citral,and eugenol on aflatoxin biosynthetic gene expression and aflatoxin B1 biosynthesis in Aspergillus flavus[J].Journal of Food Science,2015,80(12):M2917-M2924.
[26] ZHAO X X,ZHI Q Q,LI J Y,et al.The antioxidant gallic acid inhibits aflatoxin formation in Aspergillus flavus by modulating Transcription Factors FarB and CreA[J].Toxins,2018,10(7):270.
[27] AHMAD M S,AHMAD S,ARSHAD M,et al.Andrographia paniculata a Miracle Herbs for cancer treatment:In vivo and in vitro studies against aflatoxin B1 toxicity[J].Egyptian Journal of Medical Human Genetics,2014,15(2):163-171.
[28] AHMAD M S,BANO S,ANWAR S.Cancer ameliorating potential of Phyllanthus amarus:In vivo and in vitro studies against aflatoxin B1 toxicity[J].Egyptian Journal of Medical Human Genetics,2015,16(4):343-353.
[29] AGAR G,ASLAN A,SARIOGLU E K,et al.Protective activity of the methanol extract of Usnea longissima against oxidative damage and genotoxicity caused by aflatoxin B1 in vitro[J].Turkish Journal of Medical Sciences,2014,41(6):1 043-1 049.
[30] ABDEL-WAHHAB M A,HASSAN N S,EL-KADY A A,et al.Red ginseng extract protects against aflatoxin B1 and fumonisins-induced hepatic pre-cancerous lesions in rats[J].Food and Chemical Toxicology,2010,48(2):733-742.
[31] YILMAZ S,KAYA E,KARACA A,et al.Aflatoxin B1 induced renal and cardiac damage in rats:Protective effect of lycopene[J].Research in Veterinary Science,2018,119:268-275.
[32] ZHOU Y F,JIN Y C,YU H,et al.Resveratrol inhibits aflatoxin B1-induced oxidative stress and apoptosis in bovine mammary epithelial cells and is involved the Nrf2 signaling pathway[J].Toxicon,2019,164:10-15.
[33] YILMAZ S,KAYA E,COMAKLI S.Vitamin E (α tocopherol) attenuates toxicity and oxidative stress induced by aflatoxin in rats[J].Advances in Clinical & Experimental Medicine,2017,26(6):907-917.
[34] ABDEL-HAMID A A M,FIRGANY E D L.Vitamin E supplementation ameliorates aflatoxin B1-induced nephrotoxicity in rats[J].Acta Histochemica,2015,117(8):767-779.
[35] ZIMMERMANN C E P,CRUZ I B M,CADONA F C,et al.Cytoprotective and genoprotective effects of β-glucans against aflatoxin B1-induced DNA damage in broiler chicken lymphocytes[J].Toxicology in Vitro,2015,29(3):538-543.
[36] MADRIGAL-BUJAIDAR E,MORALES-GONZLEZ J,SNCHEZ-GUTIRREZ M,et al.Prevention of aflatoxin B1-induced DNA breaks by β-D-Glucan[J].Toxins,2015,7(6):2 145-2 158.
[37] BAKHEET S A,ATTIA S M,ALWETAID M Y,et al.β-1,3-Glucan reverses aflatoxin B1-mediated suppression of immune responses in mice[J].Life Sciences,2016,152:1-13.
[38] EL-NEKEETY A A,ABDEL-AZEIM S H,HASSAN AM,et al.Quercetin inhibits the cytotoxicity and oxidative stress in liver of rats fed aflatoxin-contaminated diet[J].Toxicology Reports,2014,1:319-329.
[39] TAN H X,CHEN L,MA L,et al.Fluorescence spectroscopic investigation of competitive interactions between quercetin and aflatoxin b1 for binding to human serum albumin[J].Toxins,2019,11(4).DOI:10.3390/toxins11040214
[40] EFTEKHARI A,AHMADIAN E,PANAHI-AZAR V,et al.Hepatoprotective and free radical scavenging actions of quercetin nanoparticles on aflatoxin B1-induced liver damage:In vitro/in vivo studies[J].Artificial Cells,Nanomedicine,and Biotechnology,2018,46(2):411-420.
[41] ZHANG N Y,QI M,ZHAO L,et al.Curcumin prevents aflatoxin B1 hepatoxicity by inhibition of cytochrome P450 isozymes in chick liver[J].Toxins,2016,8(11):327.
[42] LI S H,MUHAMMAD I,YU H X.Detection of Aflatoxin adducts as potential markers and the role of curcumin in alleviating AFB1-induced liver damage in chickens[J].Ecotoxicology and Environmental Safety,2019,176:137-145.
[43] WANG H,MUHAMMAD I,LI W,et al.Sensitivity of Arbor Acres broilers and chemoprevention of aflatoxin B1-induced liver injury by curcumin,a natural potent inducer of phase-II enzymes and Nrf2[J].Environmental Toxicology and Pharmacology,2018,59:94-104.
[44] ABDEL-WAHHAB M A,SALMAN A S,IBRAHIM MIM,et al.Curcumin nanoparticles loaded hydrogels protects against aflatoxin B1-induced genotoxicity in rat liver[J].Food and Chemical Toxicology,2016,94:159-171.
[45] LU H,LIU F F,ZHU Q Q,et al.Aflatoxin B1 can be complexed with oxidised tea polyphenols and the absorption of the complexed aflatoxin B1 is inhibited in rats[J].Journal of the Science of Food & Agriculture,2017,97(6):1 910-1 915.
[46] WANG T Y,LI C Y,LIU Y,et al.Inhibition effects of Chinese cabbage powder on aflatoxin B1-induced liver cancer[J].Food Chemistry,2015,186:13-19.
[47] KUMAR A,KUJUR A,SINGH P P,et al.Nanoencapsulated plant-based bioactive formulation against food-borne molds and aflatoxin B1 contamination:Preparation,characterization and stability evaluation in the food system[J].Food Chemistry,2019,287:139-150.
[48] KUMAR A,KUJUR A,YADAV A,et al.Optimization and mechanistic investigations on antifungal and aflatoxin B1 inhibitory potential of nanoencapsulated plant-based bioactive compounds[J].Industrial Crops and Products,2019,131:213-223.
[49] JEANNOT E,BOORMAN G A,KOSYK O,et al.Increased incidence of aflatoxin B1-induced liver tumors in hepatitis virus C transgenic mice[J].International Journal of Cancer,2012,130(6):1 347-1 356.
[50] TARANU I,MARIN D E,PALADE M,et al.Assessment of the efficacy of a grape seed waste in counteracting the changes induced by aflatoxin B1 contaminated diet on performance,plasma,liver and intestinal tissues of pigs after weaning[J].Toxicon,2019,162:24-31.