伏马毒素(fumonisins)主要是由串珠镰刀菌(Fusarium moniliforme)产生的一种次级代谢产物[1-2],在自然界中是一种分布比较普遍的真菌毒素。目前共发现28种伏马毒素[3],其中伏马毒素B1(fumonisin B1,FB1)的占比最高、毒性最强、分布最广,主要污染玉米及玉米制品[4-5]。伏马毒素随着食物链传递会严重危害人畜的健康,人类食用被伏马毒素污染的食品可能会诱发食道癌、结肠癌等多种疾病[6-7];猪、马、牛等动物取食被伏马毒素污染的饲料,会对其器官产生致命毒性,从而引起多种疾病[8]。粮油食品被伏马毒素等真菌毒素污染后将会造成巨大的经济损失,产生严重的环境污染问题。
伏马毒素非常稳定,250 ℃热处理也不能脱除玉米中的伏马毒素[9]。目前有物理法和化学法等脱毒方法[2],但这些方法还存在破坏食品营养价值、安全性低、稳定性差等问题。除此以外,生物法利用微生物或酶的作用可将伏马毒素转化为低毒或无毒产物,脱毒效果稳定且无污染,是一种非常有前景的方法[10]。其中微生物法在很多食品加工等领域并不能广泛适用,相比之下酶法具有操作简单、专一性强、催化效率高等优点而广受青睐。FB1生物降解的本质是在酶的催化下完成的,HEINL等[11]在Sphingopyxis sp.MTA144的同一个基因簇上找到了降解FB1的2个关键基因,FB1经2步酶促反应降解:在羧酸酯酶的作用下,FB1被降解为HFB1,毒性显著降低[12];在转氨酶的作用下HFB1发生转氨反应,最终转化成2-酮基-HFB1。
优化发酵条件和培养基成分,创造适合菌体生长和代谢的最佳条件以充分发挥菌种的潜力,是提高FB1羧酸酯酶产量的首要步骤。由于微生物发酵系统十分复杂且高度非线性,因此需要建立一个准确适合的发酵模型。人工神经网络技术是对人类大脑的一种物理结构上的模拟,其中误差反向传播神经网络即BP神经网络在拟合复杂的非线性关系方面具有显著优势,已广泛应用于培养基优化[13]、发酵过程控制[14]等发酵工业领域。
目前已鉴定的FB1降解酶数量十分有限,关于FB1羧酸酯酶等降解酶的发酵优化也少有报道。本研究以实验室前期构建的毕赤酵母工程菌(ASAG156)为FB1羧酸酯酶的生产菌株,通过单因素试验对发酵条件进行优化,通过Plackett-Burman试验、正交试验和BP神经网络模型对发酵培养基进行优化,以充分发挥菌株的生产性能,进一步提高FB1羧酸酯酶的产量。
1 材料与方法
1.1 实验材料
1.1.1 菌株
FB1羧酸酯酶产生菌:毕赤酵母工程菌ASAG156,由本实验室构建并保藏。
1.1.2 试剂
甲醇、乙腈(色谱级),美国Thermo Fisher公司;FB1标准品,PriboLab公司;酵母粉,英国Oxoid公司;蛋白胨,北京奥博星生物技术有限责任公司;其他常用生化试剂均为进口或国产分析纯。
1.1.3 培养基及溶液
酵母膏胨葡萄糖(yeast extract peptone dextrose,YPD)培养基(g/L):葡萄糖 20,酵母粉 10,蛋白胨 20;固体YPD培养基另外加入20 g/L的琼脂粉。
BMGY培养基(g/L):酵母粉 10,蛋白胨 20,无氨基酵母氮源(yeast nitrogen base, YNB)13.4,生物素 4×10-4,甘油 10,磷酸钾缓冲液(pH 6.0)0.1 mol/L。
BMMY培养基(g/L):酵母粉 10,蛋白胨 20,YNB 13.4,生物素 4×10-4,甲醇 10,磷酸钾缓冲液(pH6.0)0.1 mol/L。
FM22生长培养基(g/L):KH2PO4 43,(NH4)2SO4 5,CaSO4·2H2O 1.27,K2SO4 14.3,MgSO4·7H2O 11.7,PTM4 2(mL/L),甘油 40,KOH溶液调节PH至6。
FM22诱导培养基(g/L):KH2PO4 43,(NH4)2SO4 5,CaSO4·2H2O 1.27,K2SO4 14.3,MgSO4·7H2O 11.7,PTM4 2(mL/L),甲醇 10,KOH溶液调节PH至6。
PTM4(Pichia trace minerals 4)微量元素溶液(g/L):CuSO4·5H2O 2,KI 0.089,MnSO4·H2O 3,Na2MoO4·2H2O 0.2,H3BO3 0.02,CaSO4·2H2O 0.5,CoCl2 0.5,ZnCl2 7,FeSO4·7H2O 22,生物素 0.2,浓硫酸 1 mL/L。
1.1.4 仪器与设备
ECOTRON型恒温摇床,瑞士Infors公司;Centrifuge 5810R型高速冷冻离心机,德国Eppendorf公司;EVOLUTION 300紫外可见分光光度计,美国Thermo Fisher公司;Waters e2695高效液相色谱仪、2475荧光检测器、Waters XBridge C18色谱柱(250 mm×4.6 mm,5 μm),美国Waters公司;PP60型pH计,德国Sartorius公司。
1.2 实验方法
1.2.1 培养条件
种子活化:取适量保存在冷冻甘油管中的菌液划线接种于YPD固体平板上,30 ℃培养48~72 h。
种子培养:挑取单菌落接种于YPD液体培养基中,30 ℃、200 r/min条件下,培养24 h。
1.2.2 发酵条件优化
将经YPD培养后的种子液以体积分数为5%的接种量接入BMGY培养基中,30 ℃、200 r/min条件下培养16~24 h,OD600达到5~6,将全部细胞转接到BMMY培养基中进行诱导;摇瓶发酵初始条件:初始pH 6.0,在30 ℃下进行诱导,每24 h补加体积分数为1%的甲醇,诱导72 h取样并测定发酵上清中FB1羧酸酯酶酶活力。在下列条件下依次进行单因子摇瓶发酵优化实验。
(1)诱导时间:诱导温度30 ℃,初始pH 6.0,每24 h补加体积分数为1%的甲醇。分别在24、48、72、96和120 h取样并测定酶活力,确定最佳诱导时间。
(2)甲醇体积分数:诱导温度30 ℃,初始pH 6.0,每24 h分别补加体积分数为0.5%、1%、2%和3%的甲醇,96 h取样并测定酶活力,确定最佳甲醇添加量。
(3)培养基初始pH:诱导温度30 ℃,配制初始pH值分别为4.0、5.0、6.0、7.0和8.0的培养基,每24 h补加体积分数为1%的甲醇,96 h取样并测定酶活力,确定最佳培养基初始pH。
(4)诱导温度:诱导温度分别为25、28、30和35 ℃,初始pH 6.0,每24 h补加体积分数为1%的甲醇,96 h取样并测定酶活力,确定最佳诱导温度。
1.2.3 发酵培养基优化
1.2.3.1 Plackett-Burman 试验设计
在FM22诱导培养基的基础上,添加10 g/L酵母粉,20 g/L蛋白胨组成新的发酵培养基,使用Minitab软件进行Plackett-Burman 试验设计和结果分析,研究发酵培养基中的8种成分。每个因素取高(+1)、低(-1)2个水平,以酶活力为响应值。各组分及其水平设置见表1。
表1 Plackett-Burman试验设计确定的因素及水平
Table 1 Factors and levels of Plackett-Burman experimental design
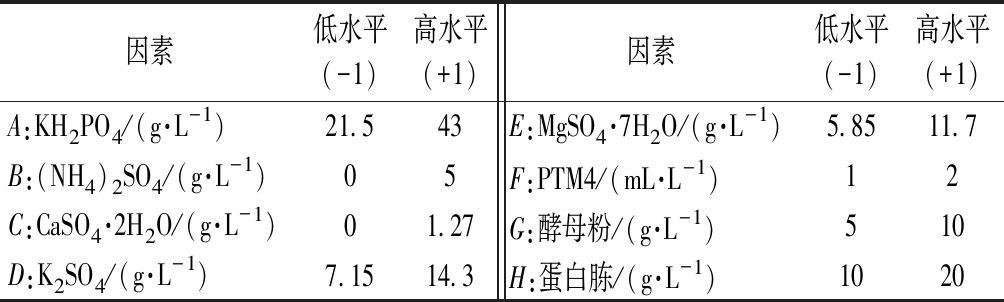
因素低水平(-1)高水平(+1)因素低水平(-1)高水平(+1)A:KH2PO4/(g·L-1)21.543E:MgSO4·7H2O/(g·L-1)5.8511.7B:(NH4)2SO4/(g·L-1)05F:PTM4/(mL·L-1)12C:CaSO4·2H2O/(g·L-1)01.27G:酵母粉/(g·L-1)510D:K2SO4/(g·L-1)7.1514.3H:蛋白胨/(g·L-1)1020
1.2.3.2 正交试验
根据Plackett-Burman 试验设计结果,以蛋白胨、KH2PO4、PTM4为变量,各因素设计3水平,正交试验因素与水平如表2所示。
表2 正交试验因素水平
Table 2 Factors and levels of orthogonal experiment

水平因素蛋白胨/(g·L-1)KH2PO4/(g·L-1)PTM4/(mL·L-1)115321.5220432325542.5
1.2.3.3 BP人工神经网络模型
使用Matlab R2018a软件,以正交试验结果作为训练和测试数据样本,根据培养基影响因子和优化目标确定神经网络的输入输出。
1.2.4 分析方法
1.2.4.1 FB1的HPLC检测
FB1前处理及仪器的检测条件参考GB 5009.240―2016《食品安全国家标准 食品中伏马毒素的测定》。
1.2.4.2 粗酶液制备
取一定量的发酵液置于离心机中,12 000 r/min离心10 min,上清液即为粗酶液。
1.2.4.3 酶活力测定
测定方法参照文献[15]。酶活力定义:在37 ℃和pH 7.4条件下,每分钟降解1 μg FB1 所需的酶量定义为1个酶活单位(U)。
2 结果与分析
2.1 单因素摇瓶发酵条件优化
由图1-a可知,随着甲醇诱导时间的延长,发酵上清液中酶活力逐渐增大,在96 h酶活力达到最大,诱导时间继续延长而酶活力没有明显增大,因此选择诱导96 h进行后续实验。培养基中甲醇是重组菌的碳源和诱导剂,体积分数合适的甲醇可以满足酵母生长和产酶。由图1-b可知,随着甲醇体积分数的增大,酶活力逐渐增大,当甲醇体积分数为1%时酶活达到最大,继续增大甲醇体积分数,酶活力迅速降低,过多的甲醇会对菌体产生毒害作用[16],使产酶量降低,因此选择体积分数为1%的甲醇进行后续实验。培养基初始pH会影响细胞膜所带电荷和培养基内的物质解离,从而影响菌体的代谢能力和产酶,同时pH会影响酶的稳定性。由图1-c可知,中性和碱性条件下酶活力较低,而当培养基初始pH为6.0时酶活力达到最大,因此选择pH 6.0为发酵培养基初始pH进行后续研究。每种菌的发酵产酶都有一个适宜的温度范围来使其产酶达到最优水平,由图1-d可知,重组菌产酶随着诱导温度的降低而升高,这表明低温诱导有利于胞外产酶,但诱导温度过低加大了能耗提高了发酵成本,因此选择28 ℃为诱导温度。
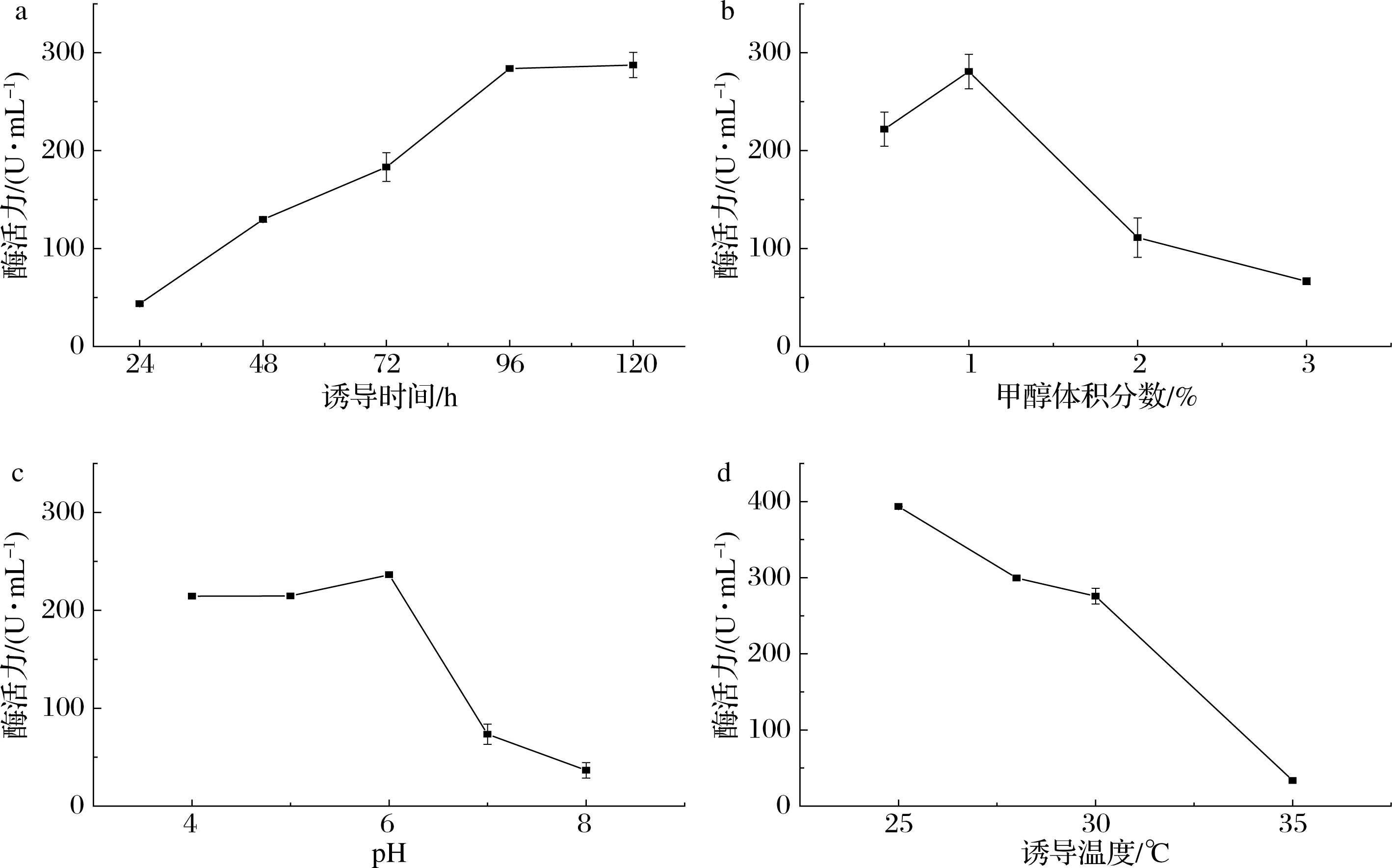
a-诱导时间;b-甲醇体积分数;c-pH;d-诱导温度
图1 摇瓶发酵条件优化
Fig.1 Shaking flask optimization of fermentation conditions
经发酵条件优化,FB1羧酸酯酶酶活力有了显著提高,即摇瓶最适发酵条件为培养基初始pH 6.0,每24 h补加体积分数为1%的甲醇,在28 ℃下诱导96 h,发酵上清液中酶活力为300 U/mL,较优化前提高了63%。
2.2 发酵培养基优化
FB1羧酸酯酶已在毕赤酵母工程菌中实现了表达,但BMMY这种复合培养基中包含价格高且需单独过滤除菌的YNB和生物素等成分,操作不便;同时与发酵罐常用的BSM基础盐培养基成分差别较大。FM22培养基是在BSM培养基基础上改进后的另一种合成培养基,具有较强的适应性[17]、缩短发酵延迟期和发酵时间、提高比生长速率等优点[18]。这些基础盐培养基在灭菌后均会出现大量乳白色沉淀,限制细胞的生长同时增大了蛋白下游分离提取纯化等环节的难度。所以对FM22培养基成分的优化将有助于目的蛋白的表达和分离纯化。前期实验发现,菌体在FM22生长培养基中能利用其丰富的盐离子正常生长,但FM22诱导培养基中需添加有机氮源,FB1羧酸酯酶才能正常表达。因此参考BMMY培养基配方,将酵母粉和蛋白胨添加到FM22诱导培养基中,在摇瓶最优发酵条件下,对新的发酵培养基进行优化。
2.2.1 Plackett-Burman 试验结果分析
在最优发酵条件下进行培养基优化实验,按照表1对发酵培养基中8种成分进行考察,以筛选出对酶活有显著影响的因素进一步优化。按照Plackett-Burman试验设计表设计,8个因素12次实验,每个试验号酶活取平均值。Plackett-Burman试验设计结果及显著性分析见表3和表4。
表3 Plackett-Burman试验设计结果
Table 3 Results of Plackett-Burman experimental design

编号ABCDEFGH酶活力/(U·mL-1)1-1-1-1-1-1-1-1-1188.7921-1-1-1111-1388.3031-11-1-1-111376.814-1111-111-1307.545-11-1-1-1111368.3561-111-11-1-1366.647-1-1-1111-11401.12811-111-11-1362.319111-111-11384.9910-1-1111-111401.431111-11-1-1-11360.9312-111-11-1-1-1263.36
因素H的P值<0.05,对酶活力影响显著;因素A的P=0.05,处于边缘状态,在处理时和H一并确认为本试验的显著影响因素,即蛋白胨和KH2PO4为酶活力的显著影响因素。对酶活力影响排第3的因素是PTM4,由于PTM4中包含Cu2+、Mn2+、Na+、Ca2+、Zn2+、Fe2+和Co2+等金属离子及生物素等,可以提供毕赤酵母用于生长和外源蛋白表达所需的微量元素[19],因此将PTM4和蛋白胨、KH2PO4这3个因素作为接下来优化试验的研究对象。其他对酶活力影响不显著的因素:(NH4)2SO4、CaSO4·2H2O、K2SO4、MgSO4·7H2O和酵母粉,采取Plackett-Burman试验低水平浓度,减少盐离子质量浓度和沉淀的产生,同时节约成本,即K2SO4 7.15 g/L、MgSO4·7H2O 5.85 g/L和酵母粉 5 g/L。
表4 Plackett-Burman试验各因素的影响
Table 4 Effects of factors in the Plackett-Burman experiment
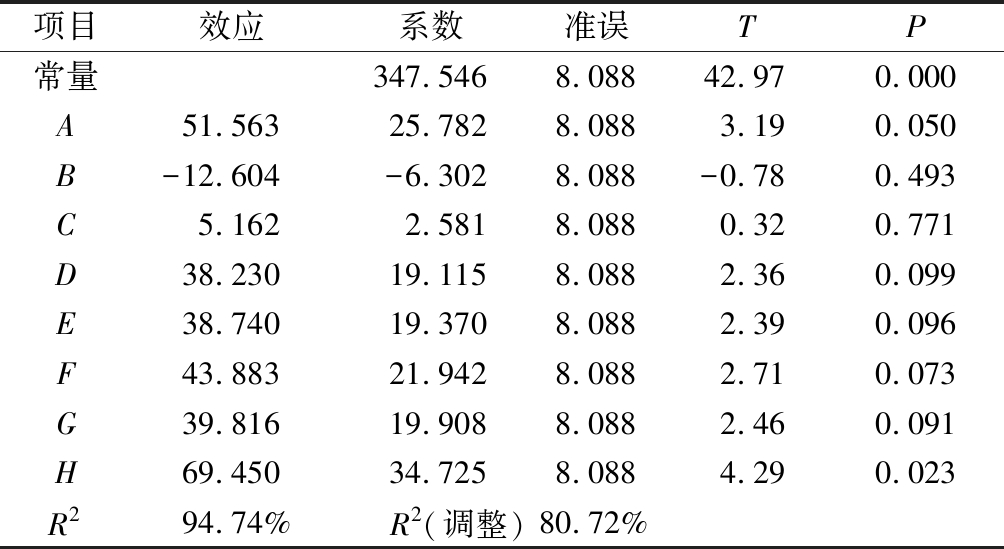
项目效应系数准误TP常量347.5468.08842.970.000A51.56325.7828.0883.190.050B-12.604-6.3028.088-0.780.493C5.1622.5818.0880.320.771D38.23019.1158.0882.360.099E38.74019.3708.0882.390.096F43.88321.9428.0882.710.073G39.81619.9088.0882.460.091H69.45034.7258.0884.290.023R294.74%R2(调整)80.72%
2.2.2 正交试验结果分析
利用Minitab软件进行正交设计和结果分析。采用L9(34)正交表设计并安排试验,因素水平见表2,以酶活力为考察指标,对影响酶活力的3个因素蛋白胨、KH2PO4、PTM4进行正交试验,每个试验号重复3次,酶活力取平均值。试验设计及结果见表5,方差分析见表6。
表5 正交试验结果
Table 5 Results of orthogonal experiment
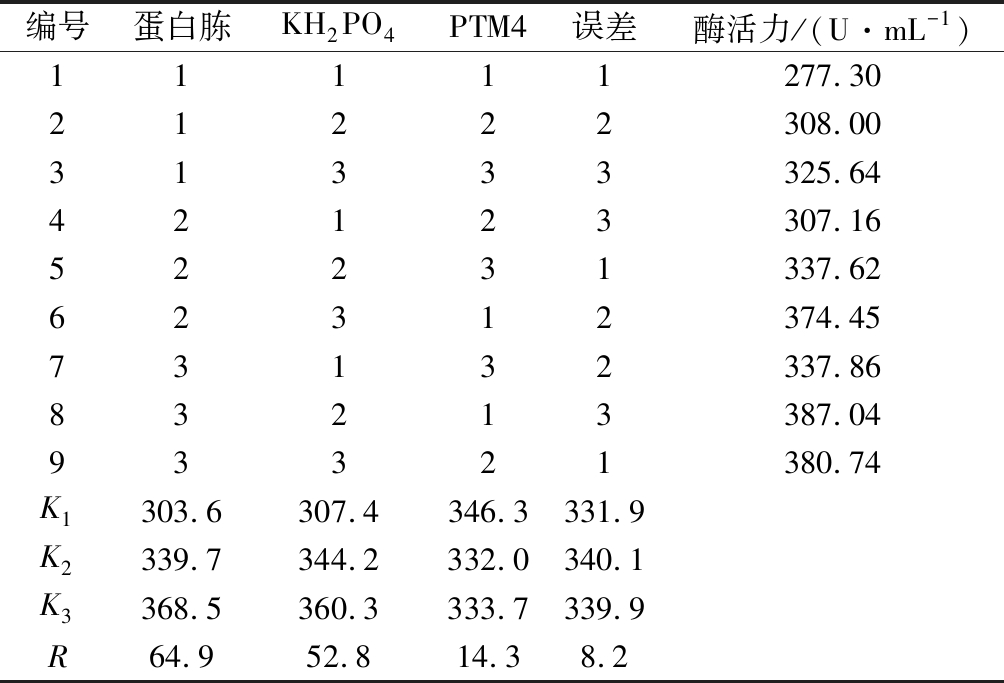
编号蛋白胨KH2PO4PTM4误差酶活力/(U·mL-1)11111277.3021222308.0031333325.6442123307.1652231337.6262312374.4573132337.8683213387.0493321380.74K1303.6307.4346.3331.9K2339.7344.2332.0340.1K3368.5360.3333.7339.9R64.952.814.38.2
表6 方差分析
Table 6 Analysis of variance
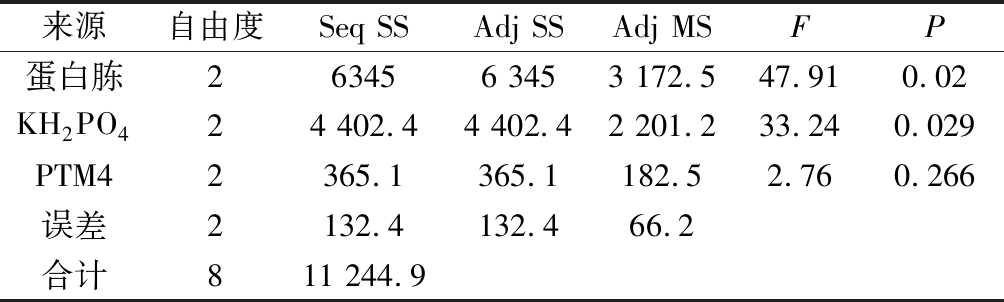
来源自由度Seq SSAdj SSAdj MSFP蛋白胨263456 3453 172.547.910.02KH2PO424 402.44 402.42 201.233.240.029PTM42365.1365.1182.52.760.266误差2132.4132.466.2合计811 244.9
由表5正交试验结果可知,各因素对酶活力的影响程度依次为蛋白胨>KH2PO4>PTM4。由表6方差分析结果可知,蛋白胨和KH2PO4这2个因素对酶活力有显著影响(P<0.05),为主要因素;PTM4这个因素对酶活力的影响不显著(P>0.05),为次要因素;显著性分析结果与Plackett-Burman试验一致。结合直观分析,正交试验确定的最优培养基配方为蛋白胨 25 g/L、KH2PO4 54 g/L和PTM4 1.5 mL/L。
2.2.3 神经网络模型的建立和应用
2.2.3.1 建立人工神经网络模型
经证实对于含一个隐含层的3层结构的BP神经网络,能以任意精度逼近有界区域上的任意连续函数[20]。因此本文以蛋白胨、KH2PO4、PTM4这3个影响因素为输入神经元,以酶活为输出神经元,构建N为隐含层的3-N-1型BP神经网络,结构图见图2。
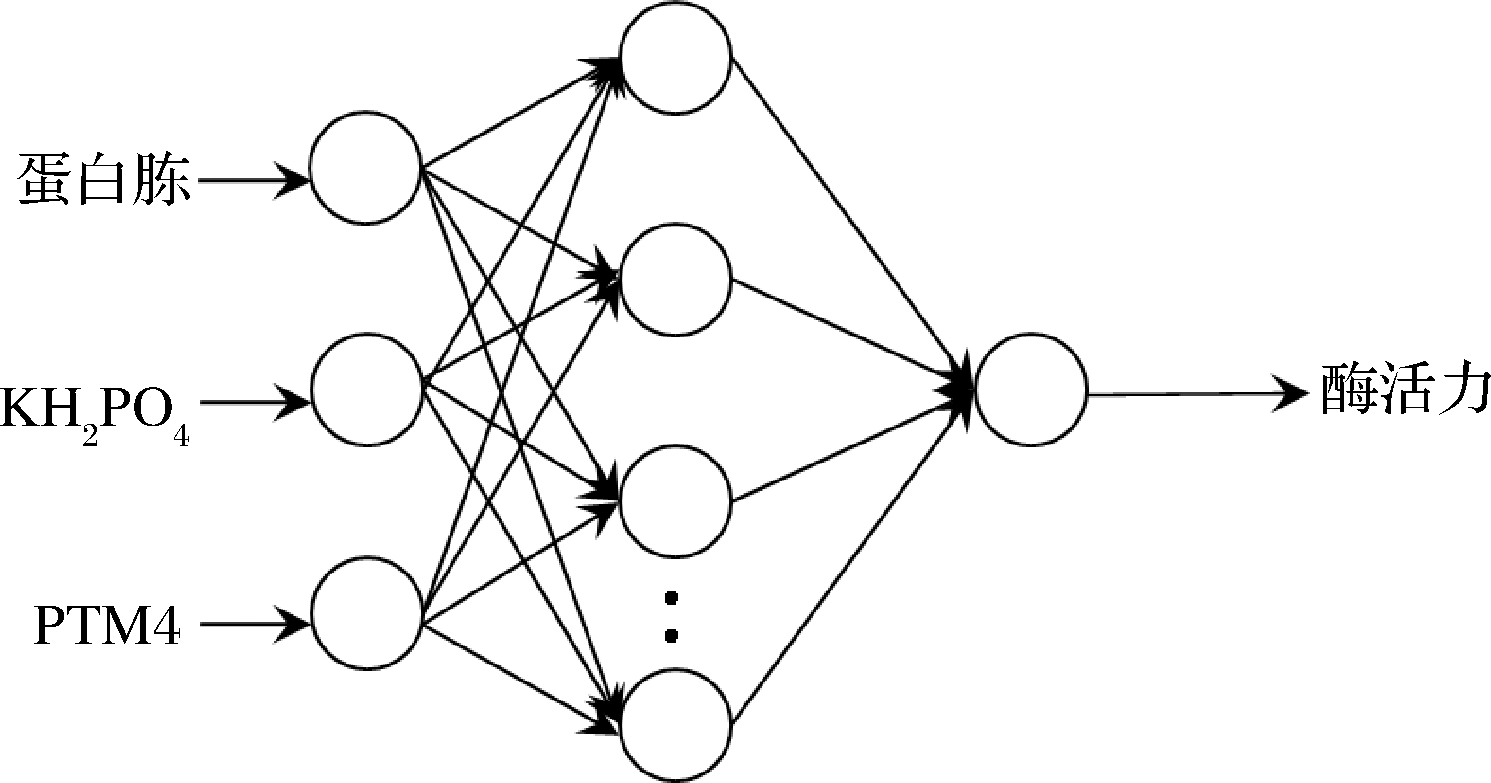
图2 神经网络结构图
Fig.2 Structure of artificial neural network
表5正交试验的9组数据中,其中8组数据作为网络训练数据,剩余1组数据作为测试数据。为了提高网络训练效率,加快训练网络的收敛性,同时防止计算过程中出现“过拟合”等问题,在训练前对样本数据进行归一化处理,使数据全部归于[0,1]之间,训练结束后再将输出还原。本试验调用Matlab R2018a工具箱中的相应函数进行编程建立BP神经网络模型并训练。隐含层节点数选为10,在此条件下该网络具有足够的泛化能力和输出精度,训练函数为trainlm,隐含层神经元的传递函数为tansig,输出层神经元的传递函数为pureline,最大训练迭代次数为50,其他各项参数选择默认值。训练后的网络收敛于目标误差0.000 1,满足精度要求。由此建立了反映发酵培养基中蛋白胨、KH2PO4、PTM4这3个因子与酶活之间非线性关系的BP神经网络模型。
以网络预测值和实测值的相对误差来评价网络模型,结果见图3。实测值和预测值的相对误差绝对值为2%,这表明预测值与实测值有较好的吻合度,训练后的网络预测性能好、仿真度高,能够很好地拟合酶活力与3个影响因素之间的关系。因此该网络模型可用于对酶活力结果的预测。
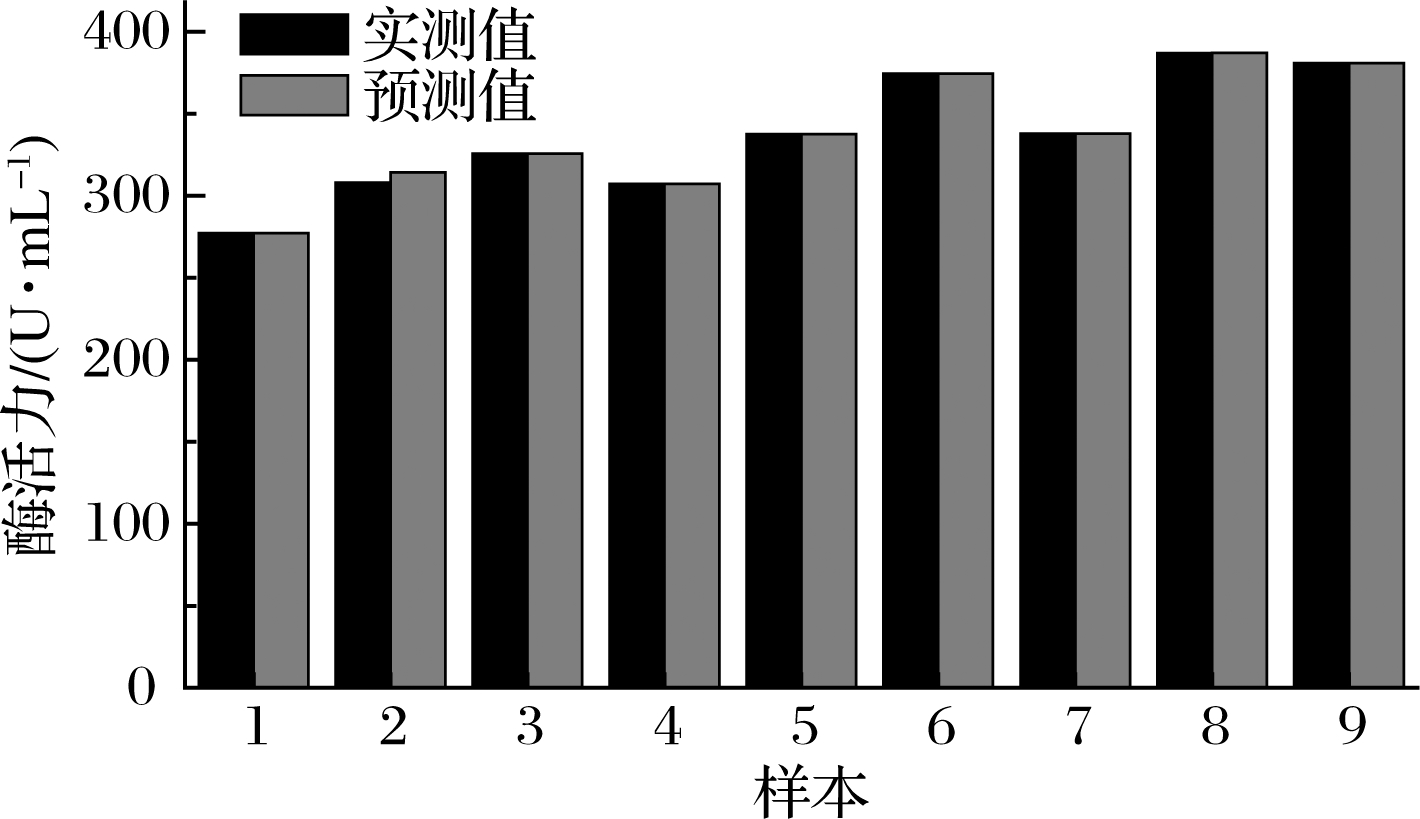
图3 实测值与预测值的比较
Fig.3 Comparison of experimental values and predicted values
2.2.3.2 利用BP神经网络筛选最佳培养基配方
基于所建立的BP神经网络模型,分别为蛋白胨、KH2PO4、PTM4这3个输入因素选择合适的步长,利用Matlab相关函数对每个因素定义域值进行编程,通过sim函数对网络优化结果进行仿真输出并找到输出值最大的组合。结果结果,利用BP人工神经网络模型进行仿真模拟,在2 783种可能组合中筛选到的最优诱导培养基配方为蛋白胨 23 g/L、KH2PO4 44 g/L和PTM4 1.5 mL/L。
正交试验是一种利用部分试验来代替全面试验的方法,通过挑选有代表性的试验点来减少试验次数[21-22],但分析得到的结果受限于因素水平的设定;人工神经网络能够快速准确地仿真模拟所有试验条件,避免大量试验的同时能得出比正交试验更为精确的结果[23]。
2.2.3.3 验证试验
分别按照正交试验及BP神经网络优化得到的培养基配方进行3次独立试验,测定实际酶活力。正交试验得到的酶活力为402.64 U/mL,BP神经网络优化得到的酶活力为402.96 U/mL,与预测值的相对误差小于2%,说明该BP神经网络模型可以很好的模拟发酵培养基中蛋白胨等3种组分添加量与酶活力的关系;另一方面BP神经网络优化得到的培养基配方具有蛋白胨和KH2PO4添加量少的优点,节约发酵成本的同时减少了无机盐沉淀的产生。人工神经网络与正交试验等多种优化方法相结合,能够反映多因素多水平间复杂的变化规律,在发酵培养基优化方面的应用较广泛[24-26]。
3 结论
FB1羧酸酯酶在毕赤酵母中的摇瓶水平表达量偏低,本研究首先通过单因素试验对诱导时间、甲醇体积分数、培养基初始pH、诱导温度这4个发酵条件进行了优化,综合考虑发酵成本等实际情况,确定了最适发酵条件即培养基初始pH 6.0,在28 ℃下进行诱导,每24 h补加体积分数为1%的甲醇,诱导96 h。对发酵培养基进行优化,首先采用Plackett-Burman试验设计快速筛选出蛋白胨、KH2PO4和PTM4这3个因素作为进一步优化试验的研究对象;采用正交试验建立数据样本;利用Matlab R2018a软件构建3-10-1型BP人工神经网络模型。得到的最优发酵培养基组成为:蛋白胨 23 g/L、KH2PO4 44 g/L、PTM4 1.5 mL/L、K2SO4 7.15 g/L、MgSO4·7H2O 5.85 g/L和酵母粉 5 g/L。通过发酵条件和培养基的优化,酶活力提高了1.19倍,达到402 U/mL以上,同时培养基中无机盐沉淀大量减少,便于蛋白分离纯化等下游环节的进行。本研究为实现毕赤酵母重组菌摇瓶发酵高效生产FB1羧酸酯酶提供了数据参考,下一步将通过高密度发酵优化工艺进一步提高FB1羧酸酯酶的产量,为伏马毒素酶法脱毒的工业化应用奠定技术基础。
[1] YAMAZOE Y,KOYAMA N,KUMAGAI S.Possible role of phosphatidylcholine and sphingomyelin on fumonisin B1-mediated toxicity[J].Food Safety,2017,5(3):75-97.
[2] ZHU Y,HASSAN Y I,WATTS C,et al.Innovative technologies for the mitigation of mycotoxins in animal feed and ingredients-A review of recent patents[J].Animal Feed Science and Technology,2016,216:19-29.
[3] OMURTAG G Z.Fumonisins,trichothecenes and zearalenone in cereals[J].International Journal of Molecular Sciences,2008,9(11):2 062-2 090.
[4] CAO C,ZHU X,LI X,et al.Assessment of ionic homeostasis imbalance and cytochrome P450 system disturbance in mice during fumonisin B1 (FB1) exposure[J].Chemosphere,2020.DOI:10.1016/j.chemosphere.2020.126393.
[5] WEI T,ZHU W,PANG M,et al.Natural occurrence of fumonisins B1 and B2 in corn in four provinces of China[J].Food Additives & Contaminants:Part B,2013,6(4):270-274.
[6] FALLAH B,ZAINI F,GHAZVINI R D,et al.The antagonistic effects of Candida parapsilosis on the growth of Fusarium species and fumonisin production[J].Current Medical Mycology,2016,2(1):1-6.
[7] MINERVINI F,GARBETTA A,D’ANTUONO I,et al.Toxic mechanisms induced by fumonisin B1 mycotoxin on human intestinal cell line[J].Archives of Environmental Contamination and Toxicology,2014,67(1):115-123.
[8] 杨李梅, 苏建明,雷红宇,等.伏马毒素研究进展[J].动物医学进展,2014,35(3):97-100.
YANG L M,SU J M,LEI H Y,et al.Progress on fumonisins[J].Progress in Veterinary Medicine, 2014,35(3):97-100.
[9] BRY A
A ![]() A,SZYMCZYK K,et al.Effects of pH and temperature on the stability of fumonisins in maize products[J].Toxins,2017,9(3):88-103.
A,SZYMCZYK K,et al.Effects of pH and temperature on the stability of fumonisins in maize products[J].Toxins,2017,9(3):88-103.
[10] ZHU Y,HASSAN Y I,LEPP D,et al.Strategies and methodologies for developing microbial detoxification systems to mitigate mycotoxins[J].Toxins,2017,9(4):130-155.
[11] HEINL S,HARTINGER D,THAMHESL M,et al.Degradation of fumonisin B1 by the consecutive action of two bacterial enzymes[J].Journal of Biotechnology,2010,145(2):120-129.
[12] ADDITIVES E P O,FEED P O S U I A.Scientific opinion on the safety and efficacy of fumonisin esterase (FUMzyme®) as a technological feed additive for pigs[J].EFSA Journal,2014,12(5):3 667-3 685.
[13] YANG Y,GAO M,YU X,et al.Optimization of medium composition for two-step fermentation of vitamin C based on artificial neural network-genetic algorithm techniques[J].Biotechnology & Biotechnological Equipment,2015,29(6):1 128-1 134.
[14] SHI Y,GAI G,ZHAO X,et al.Back propagation neural network (BPNN) simulation model and influence of operational parameters on hydrogen bio-production through integrative biological reactor (IBR) treating wastewater[C].2010 4th International Conference on Bioinformatics and Biomedical Engineering,2010:1-4.
[15] 坚乃丹. 伏马毒素B1降解酶YD的异源表达及其酶学性质研究 [D].天津:天津科技大学,2018.
JIAN N D.Heterologous expression and characterization of fumonisin B1 degradation enzyme YD [D].Tianjin:Tianjin University of Science and Technology,2018.
[16] 李飞, 喻晓蔚,沙冲,等.基因拷贝数和甲醇浓度对重组毕赤酵母产华根霉脂肪酶的影响[J].微生物学通报,2011,38(3):301-309.
LI F,YU X W,SHA C,et al.Impact of gene dosage and methanol concentration on Rhizopus chinensis recombinant lipase production in Pichia pastoris[J].Microbiology China,2011,38(3):301-309.
[17] 陈明祥, 谢万勇,廖锡豪,等.表面展示南极假丝酵母脂肪酶B的毕赤酵母FM22发酵培养基响应面优化[J].中国酿造,2012,31(10):52-56.
CHEN M X,XIE W Y,LIAO X H,et al.The response surface optimization on FM22 induction medium of CALB displayed on Pichia pastoris cell surface production[J].China Brewing,2012,31(10):52-56.
[18] CHAROENRAT T,KHUMRUAENGSRI N,PROMDONKOY P,et al.Improvement of recombinant endoglucanase produced in Pichia pastoris KM71 through the use of synthetic medium for inoculum and pH control of proteolysis[J].Journal of Bioscience and Bioengineering,2013,116(2):193-198.
[19] WANDERLEY M S,OLIVEIRA C,BRUNESKA D,et al.Influence of trace elements supplementation on the production of recombinant frutalin by Pichia pastoris KM71H in fed-batch process[J].Chemical Papers,2013,67(7):682-687.
[20] 陈柳, 马广大.大气中SO2浓度的小波分析及神经网络预测[J].环境科学学报,2006,26(9):1 553-1 558.
CHEN L,MA G D.Study on wavelet analysis and neural network prediction of SO2 concentration in air[J].Acta Scientiae Circumstantiae, 2006,26(9):1 553-1 558.
[21] 刘瑞江, 张业旺,闻崇炜,等.正交试验设计和分析方法研究[J].实验技术与管理,2010,27(9):52-55.
LIU R J,ZHANG Y W,WEN C W,et al.Study on the design and analysis methods of orthogonal experiment[J].Experimental Technology and Management,2010,27(9):52-55.
[22] MA H,LI H,GANG J,et al.Optimization of ethanol fermentation from fruit and vegetable waste by plackett-burman and orthogonal experimental design[J].BioResources,2019,14(1):1 210-1 218.
[23] 吴娜, 赵重博,胡美变,等.BP-ANN 结合正交试验法优化白附子多糖提取工艺[J].中成药,2016,38(6):1 248-1 253.
WU N,ZHAO C B,HU M B,et al.Optimizing the extraction of polysaccharides from Typhonii rhizoma by BP-ANN combined with orthogonal test[J].Chinese Traditional Patent Medicine,2016,38(6):1 248-1 253.
[24] 王云龙, 刘松,堵国成,等.基于人工神经网络的L-天冬酰胺酶发酵培养基优化[J].食品与发酵工业,2018,44(8):27-33.
WANG Y L,LIU S,DU G C,et al.Optimization of L-asparaginase fermentation medium based on artificial neural network[J].Food and Fermentation Industries,2018,44(8):27-33.
[25] PENG W,ZHONG J,YANG J,et al.The artificial neural network approach based on uniform design to optimize the fed-batch fermentation condition:Application to the production of iturin A[J].Microbial Cell Factories,2014,13(1).DOI:10.1186/1475-2859-13-54.
[26] DASARI V R R K,DONTHIREDDY S R R,NIKKU M Y,et al.Optimization of medium constituents for Cephalosporin C production using response surface methodology and artificial neural networks[J].Journal of Biochemical Technology,2009,1(3):69-74.