冰葡萄酒属于高档甜型葡萄酒,因原料稀缺,酒体醇厚甘甜、香味浓郁而成为葡萄酒中的珍品[1]。近年来,由于全球气候变暖,使酿酒葡萄果实出现成熟速度加快,糖分含量逐渐升高,酸度逐渐下降,风味物质含量降低等趋势[2],原料也不可避免的出现酸度缺乏、香气复杂性欠缺等问题。酵母菌在葡萄酒酿造过程中的代谢活动会伴随着甘油、酸类、醇类、酯类等物质的生成而对葡萄酒质量风格产生重要影响[3]。近年来,随着对葡萄酒相关酵母菌种的深入研究发现,一些具有潜在应用价值的非酿酒酵母具有独特的代谢通路和较强的酶活力,可以产生较低的酒精、增加甘油、调节酸度、释放甘露糖蛋白或多糖,改善葡萄酒口感、增强颜色稳定性以及香气复杂性,且不同种属的非酿酒酵母的贡献也各不相同[4]。耐热克鲁维酵母(Lachancea thermotolerans)属于Lachancea属[5],在酒精发酵过程中主要产生乳酸以增加温带葡萄种植区葡萄酒的酸度,有“生物酸化剂”之称[6]。此外,L.thermotolerans亦能够改善葡萄酒的一些质量参数[7-12]。戴尔有孢圆酵母(Torulaspora delbrueckii)在非酿酒酵母中具有较强的酒精发酵能力[13],与酿酒酵母(Saccharomyces cerevisiae)相比能够耐受葡萄汁中较高的渗透压[14],产生低浓度的乙酸和高级醇类,较高浓度的萜烯类物质[15]。在工业化水平上,T.delbrueckii也是最早进入商业化应用的非酿酒酵母菌株[16]。目前关于L.thermotolerans和T.delbrueckii在干型葡萄酒上的研究报道较多,而在冰葡萄酒中应用研究报道较少,尤其冰葡萄汁的发酵条件与其他类型的葡萄酒差异较大,其酒精发酵是在高渗透压和高浓度SO2以及低温条件下进行,因此,针对非酿酒酵母菌株在冰葡萄酒生境下酿造特性的研究对于酵母资源的进一步开发利用具有积极意义。
本试验对实验室保存的L.thermotolerans和T.delbrueckii菌株的嗜杀性、生长动态、耐受性、在冰葡萄酒生境下的发酵特性以及主要挥发性香气化合物种类、含量等进行分析,旨在评价两菌株在冰葡萄酒酿造中的应用潜力。
1 材料与方法
1.1 试验材料
‘贵人香’冰葡萄汁:2018年11月购于甘肃祁连葡萄酒业有限责任公司,含糖量为34.45 °Brix、可滴定酸(以酒石酸计)6.75 g/L;当天运抵实验室,加入60 mg/L SO2于4 ℃冰箱贮藏备用。
供试菌株Lachancea thermotolerans:LT1保藏于中国工业微生物菌种保藏管理中心(CICC,保藏编号33099);菌株LT2由甘肃省葡萄与葡萄酒工程学重点实验室筛选于自然发酵的葡萄醪中,根据其在WLN(wallerstein laboratory nutrient)鉴别培养基上的菌落形态,经26S rDNA D1/D2区测序,其序列在NCBI上blast比对与Lachancea thermotolerans的序列100%匹配(登录号MH472648.1);菌株LT3保藏于CICC(保藏编号2.4066)。Torulaspora delbrueckii:TD1菌株来源于上海工业试验所(保藏编号1004);菌株TD2来源于山东扳倒井股份有限公司(保藏编号33295);菌株TD3来源于甘肃省科学院生物研究所(保藏编号32851)。酿酒酵母活性干粉:CECA(编号SC),安琪酵母公司提供;敏感菌株S.cerevisiae 1 296:西北农林科技大学葡萄酒学院赠送。
1.2 仪器与试剂
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基(g/L):酵母浸粉10.0、葡萄糖20.0、蛋白胨20.0、琼脂20.0;YEPD-MB培养基:在YEPD培养基的基础上,用0.1 mol/L的柠檬酸磷酸盐缓冲液调节pH至4.6后,加入20.0 g/L琼脂和0.3 g/L亚甲基蓝指示剂。以上培养基均现用现配,并于121 ℃高压灭菌20 min备用。
主要试剂:2-辛醇(色谱纯),SIGMA-ALDRICH(上海)贸易有限公司;L-苹果酸和L-乳酸(色谱纯),上海源叶生物科技有限公司;NaOH、NaCl、Na2CO3、盐酸、醋酸钠、醋酸、无水葡萄糖等试剂(分析纯),天津市科密欧化学试剂有限公司。
主要仪器:SW-CJ-2FD超净工作台,苏净集团苏州安泰空气技术有限公司;500051S立式高压灭菌锅,上海申安医疗器械厂;SPX-150-II生化培养箱,上海跃进医疗器械有限公司;Genesis 10 s紫外-可见分光光度计、Ultimate 3 000高效液相色谱仪、TRA-CE1310-ISQ气相色谱质谱联用仪,美国Thermo Scientific公司。
1.3 实验方法
1.3.1 菌株活化和种子液制备
挑取供试菌株单菌落于YEPD液体培养基中,在28 ℃培养箱中培养48 h,以2%的接种量分别接种于YEPD液体培养基中,培养48 h后进行酵母菌接种试验(细胞生物量均达到108 CFU/mL)。
1.3.2 菌株嗜杀性测定
参照ULLIVARRI等[17]的牛津杯抑菌法。将敏感菌株S.cerevisiae 1296 以2%的接种量接种于YEPD液体培养基中,28 ℃培养48 h后,稀释菌悬液至107 CFU/mL,取100 μL涂布于YEPD-MB培养基,再取200 μL供试菌株的菌悬液分别加入牛津杯中,28 ℃培养48 h后,观察并测定酵母菌株周围蓝色的死菌带,测定抑菌圈直径与菌落直径,其差值表示抑菌圈大小。
1.3.3 菌株生长曲线测定
参照杨婕等[18]的方法并略作修改。分别挑取各供试菌株的单菌落于YEPD液体培养基,28 ℃条件下培养48 h,再以2%的接种量分别接种于YEPD液体培养基中,16 ℃条件下培养,每隔2 h取250 μL菌液于离心管中,以未接种的YEPD培养基作为空白对照,使用紫外分光光度计测定OD630 nm的吸光值,绘制生长曲线。
1.3.4 菌株耐受性测定
参照杨婕等[18]和刘灿珍等[19] 的方法并略作修改。以酿酒酵母SC为对照,分别测定3株L.thermotolerans(LT1、LT2、LT3)和3株T.delbrueckii(TD1、TD2、TD3)菌株的耐高糖、耐高酒精、耐高浓度SO2及耐低温性能。将各菌株种子液以2%的接种量分别接种于葡萄糖质量浓度分别为250、300、350、400、450、500 g/L,乙醇体积分数分别为6%、9%、12%、15%;SO2质量浓度分别为100、200、300、400 mg/L,温度为10、13、16、19 ℃的YEPD液体培养基中,于28 ℃条件下培养24 h,使用紫外分光光度计测定不同处理下的供试酵母菌株的OD630 nm的吸光值。
1.3.5 菌株发酵特性试验
将各菌株种子液以2%接种量分别接种于水浴杀菌处理的冰葡萄汁中进行纯种发酵(初始菌体数量均为107 CFU/mL),每个样品设3个平行。其中,水浴灭菌处理是将冰葡萄汁分装于无菌棕色罐中,装液量为70%,60 ℃水浴10 min[2],水浴处理后取样进行平板计数,其灭菌后菌落总数小于10 CFU/mL,具有可行性。
1.3.5.1 乳酸测定
参照BUGLASS等[20]和PEREZ等[21]方法,并略作修改,采用高效液相色谱仪进行测定。色谱条件:色谱柱BDS HYPERSILC18(250 mm × 4.6 mm, 5 μm);检测器为二极管阵列检测器;流动相为0.005 mol/L的硫酸水溶液;流速0.5 mL/min;柱温为30 ℃;进样量20 μL;检测波长210 nm。
定性定量:将不同浓度的乳酸标准液分别进样,根据保留时间、出峰时间进行定性;以不同标准液的浓度,出峰面积进行定量,并绘制标准曲线,得到乳酸含量的标准曲线方程(y=10.768x+0.035 5,R2=0.999 7)。
1.3.5.2 酒样理化指标测定
参照GB/T 15 038—2006《葡萄酒、果酒通用分析方法》[22]对残糖、乙醇体积分数、挥发酸、总酸等基本理化指标进行测定。
1.3.6 小容器发酵试验
1.3.6.1 ‘贵人香’冰葡萄酒酿造工艺
冰葡萄酒酿造工艺参照李景明等[1]的方法;巴杀处理参照BENITO等[2]方法并略作修改:
冰葡萄汁→加SO2(60 mg/L)、果胶酶(20 mg/L)处理→巴氏杀菌处理(65 ℃,10 min)→接种试验→16 ℃(低温发酵)→终止发酵→倒罐→陈酿→指标测定
1.3.6.2 菌株单独接种试验
将各菌株种子液分别以2%接种量接种于水浴杀菌处理的冰葡萄汁中进行纯种发酵(初始菌体数量均为107 CFU/mL),将接种酒样置于恒温培养箱中发酵,当乙醇体积分数达到10%~11%时降温至0 ℃左右,并添加SO2至120 mg/L,终止发酵,密封陈酿3个月后测定主要理化指标及挥发性香气化合物。
1.3.7 挥发性化合物测定
参照王玉华等[8]的方法,采用顶空固相微萃取-色谱质谱联用仪(headspace solid phase microextraction-gas chromatography-mass spectrum, HS-SPME-GC-MS)进行测定。
HS-SPME处理:取8 mL酒样于萃取瓶中,加入2.40 g NaCl及10 μL 8.82 mg/L 2-辛醇(内标物),放入磁力搅拌转子密封后,置于磁力搅拌器上摇匀,于40 ℃下水浴平衡30 min,插入萃取头磁力搅拌吸附富集30 min。
GC-MS条件:DB-WAX(60 m×2.5 mm,0.25 μm)色谱柱;柱升温程序:40 ℃保持7 min,以4 ℃/min升至200 ℃,保持8 min;载气:He,纯度99.99%;流速:1.0 mL/min;进样口温度:240 ℃;不分流进样。电子轰击离子源(EI);离子源能量70 eV;传输线温度:220 ℃;离子源温度:240 ℃;质谱扫描范围50~350 m/z。
定性分析:采用质谱全离子扫描图谱,根据本实验室在相同检测条件下建立的各化合物的保留时间、保留指数和质谱信息以及标准质谱库检索比对进行定性分析。
定量分析:采用内标法进行半定量分析,按公式(1)进行计算:
(1)
式中:ρ,香气物质的质量浓度;ρ内,内标物的质量浓度;A1,测得香气物质的峰面积;A,测得内标物的峰面积;f,内标物的校正因子,f=1。
气味活性值(odor activity value, OAV):香气物质的含量与嗅觉阈值的比值。
1.3.8 感官分析
参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》[22]。按表1的评分标准给酒样打分[23-24]。
表1 冰葡萄酒感官评分标准
Table 1 Criteria for sensory evaluation of ice wine

项目指标评分标准(分)外观色泽浅绿色(0~3);浅黄色(4~6);金黄色(7~9)澄清度酒体浑浊不透明,有明显悬浮物(0~3);酒体少许浑浊,略带悬浮物(4~6);澄清透明,无明显悬浮物,悦目协调(7~9)香气花香花香弱(0~3);花香中等(4~6);花香强(7~9)果香果香(菠萝、水蜜桃等热带水果味)非常弱(0~3);果香味中等(4~6);果香味强(7~9)异味异味弱(0~3);异味中等(4~6);异味明显(7~9)香气强度气味浓度弱,无浓郁的花果香和酒香(0~3);气味浓度中等,有少许浓郁的花果香和酒香(4~6);气味浓度强,具有纯正愉悦、浓郁和谐的花果香和酒香(7~9)口感酸度无酸味(0~3);酸度较低,酒样品尝起来平淡无奇(4~6);酸度适中,口腔中酸度刺激感(7~9)酸甜平衡感甜酸平衡感差(0~3);甜酸平衡感欠佳(4~6);甜酸平衡感好,酒体协调(7~9)整体评分香气单一,余味短,平衡感差(0~3);香气清新且较复杂,余味较长,甜酸平衡感较好(4~6);香气清新、复杂,余味长,甜酸平衡感好(7~9)
1.4 数据分析
所有试验均设3次重复。采用Excel 2010进行数据处理,SPSS 23.0对数据进行单因素方差分析,利用Duncan’s多重比较在置信区间P<0.05下对数据进行差异显著性分析,对不同处理酒样的香气化合物进行主成分分析。
2 结果与分析
2.1 菌株嗜杀性测定
嗜杀性是酿酒酵母生理特性的重要指标之一,嗜杀性强的菌株能更好的保障葡萄酒正常的发酵过程,拮抗其他微生物的干扰。图1为6株供试菌株对于敏感菌株S.cerevisiae 1296的嗜杀性。由图1可知,3株L.thermotolerans具有嗜杀性,抑菌圈的直径分别为2.32、2.8和2.25 mm,其中LT2的嗜杀性最强。3株T.delbrueckii中只有TD2具有嗜杀性,抑菌圈的大小约为2.3 mm。

图1 供试菌株嗜杀性结果
Fig.1 Homicidal results of the tested strains
2.2 L.thermotolerans和T.delbrueckii供试菌株的生长曲线
由图2可知,在16 ℃低温条件下,3株L.thermotolerans菌株的生长趋势大致相同(图2-a),均经过了4~6 h的延滞期,然后需8~10 h的指数生长期,在第18 小时以后菌体数量达到稳定期。在指数生长期,L.thermotolerans的生长速率略低于对照SC,但达到稳定期后菌体数量基本一致。3株T.delbrueckii在经过6 h的延滞期后需10~14 h的指数生长期,并于第20~22小时达到稳定期(图2-b)。3株T.delbrueckii菌株在指数生长期的生长速率明显低于SC,达到稳定期后菌体数量也均较低于SC。
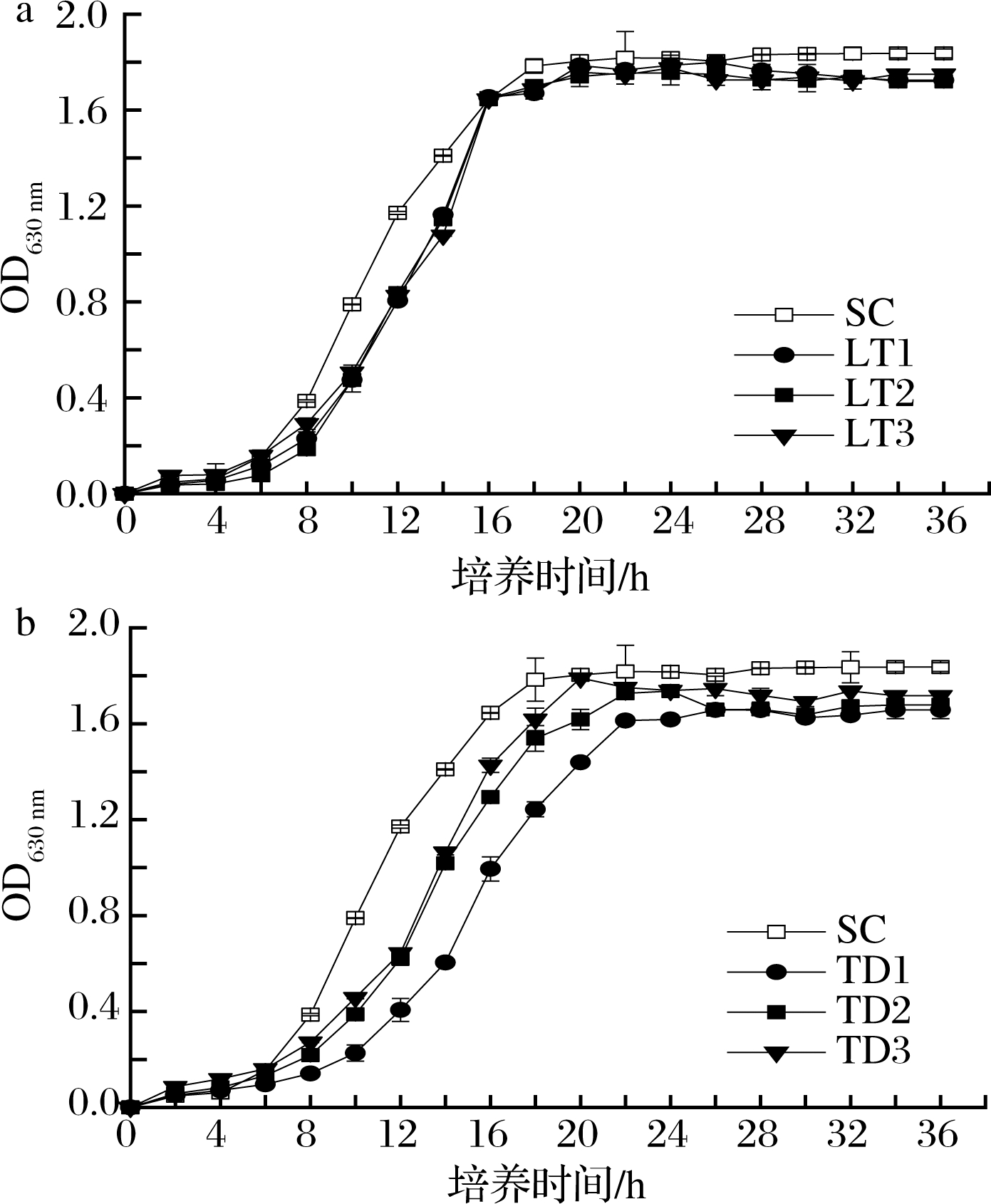
a-L.thermotolerans菌株;b-T.delbrueckii菌株
图2 供试菌株在YEPD培养基中的生长曲线
Fig.2 Growth curve of tested strains in YEPD medium
2.3 菌株耐受性分析
2.3.1 高糖耐受性
冰葡萄酒是在低温下高糖发酵的一种甜型葡萄酒,冰葡萄汁中的糖度通常大于350 g/L,是发酵液中高渗透压的主要因素,对酵母的生长繁殖具有一定胁迫抑制作用[25]。由图3-a可知,随着葡萄糖质量浓度的增加,酿酒酵母SC及供试的6株非酿酒酵母菌株的OD值均呈下降趋势,但各菌株表现出的耐受性差异较大。当葡萄糖质量浓度在250~400 g/L时,所有菌株的OD值均大于1.2,但 LT1、LT3和TD1菌株的OD值显著低于其他菌株;当葡萄糖质量浓度达到500 g/L时,供试的6株非酿酒酵母菌株的OD值显著低于SC,其中,TD1菌株的OD值最低(约为0.6),只能进行微弱生长,LT2菌株显著高于其他几株非酿酒酵母菌株。因此,本试验中3株L.thermotolerans菌株和TD2、TD3菌株对高糖环境的适应性较强。
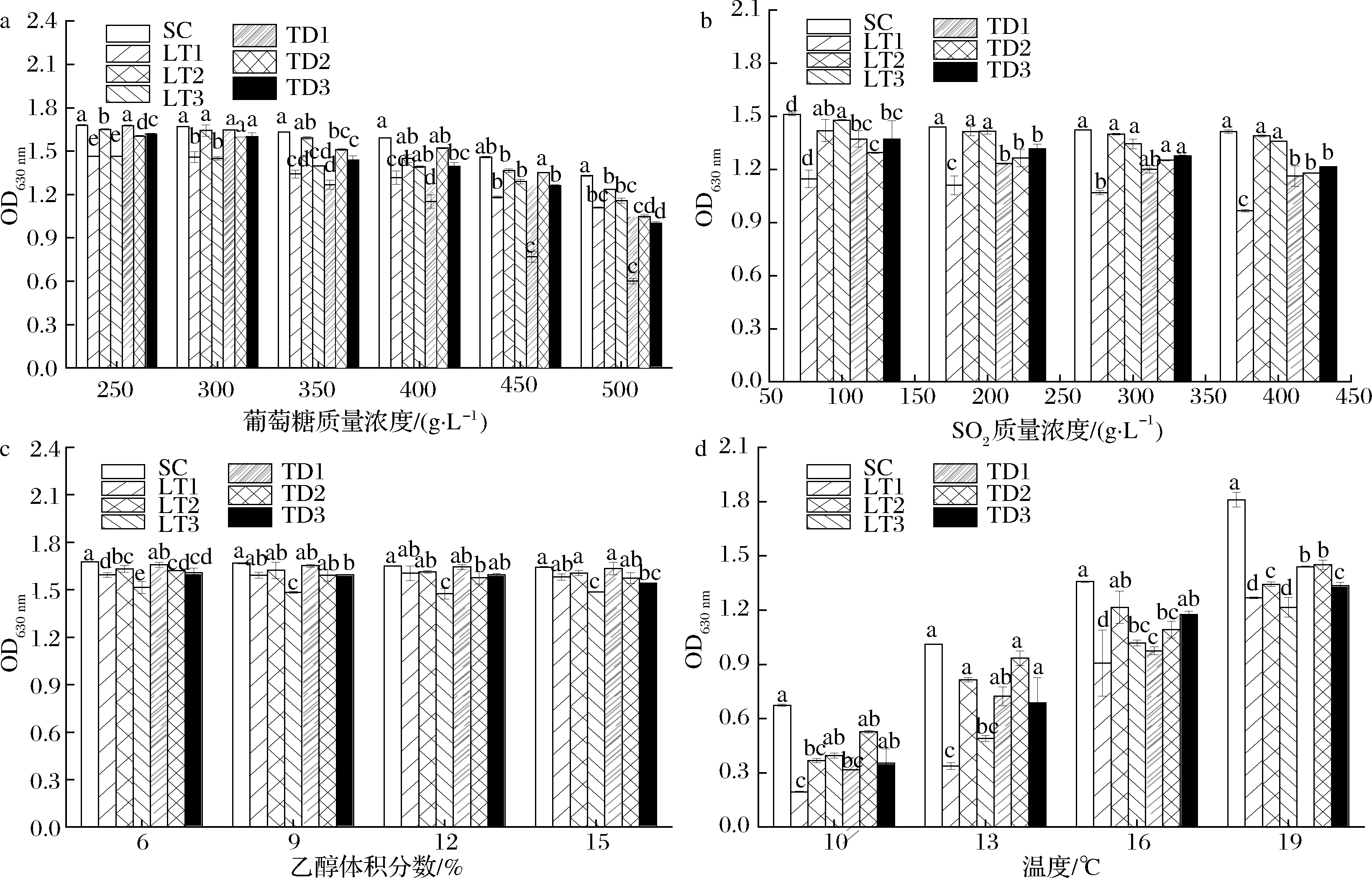
a-葡萄糖;b-SO2;c-乙醇;d-温度
图3 供试菌株在不同条件下的生长情况
Fig.3 Growth of tested strains under different conditions 注:不同字母代表差异显著(P<0.05)(下同)
2.3.2 高SO2的耐受性
在冰酒酿造中,当达到所需酒度时需要终止发酵,通常采取的措施是添加高浓度SO2及降低温度。如图3-b所示,以酿酒酵母SC为对照,6株供试菌株的OD值均随着SO2质量浓度的增加而呈现下降的趋势,但LT1菌株与其他菌株相比对SO2的敏感性较强,当SO2质量浓度为100 mg/L时其生长受到明显抑制;菌株LT2、LT3在SO2质量浓度达到400 mg/L其耐受性与SC差异不显著,但显著高于3株T.delbrueckii菌株,由此可知,菌株LT2、LT3具有非常强的SO2耐受性,而3株T.delbrueckii菌株之间对SO2耐受性无显著差异。
2.3.3 乙醇耐受性
大多数非酿酒酵母由于酒精耐受性不高而只能存在于葡萄酒酒精发酵的前期和中期。而本研究中6株非酿酒酵母均具有较强的乙醇耐受性,由图3-c可知,当乙醇体积分数达到15%时,耐受性最低的LT3菌株的OD值也达到了1.5,其次,除了LT3和TD3菌株,其他4株供试非酿酒酵母菌株的OD值与酿酒酵母SC的差异不大,表明供试的几株非酿酒酵母均具有良好的乙醇耐受性,这一结果与已有报道结果基本一致[19,26]。
2.3.4 低温耐受性
冰葡萄汁通常于初冬季节才能获取,通常将冰酒酿造温度控制在10~19 ℃的低温条件下进行。由图3-d可知,当温度在10 ℃时,供试菌株中只有酿酒酵母SC和TD2菌株的OD值大于0.5,表现出微弱的生长。随着温度升高,供试菌株的OD值均呈上升趋势。当温度上升到16 ℃时,除LT1菌株外其他菌株的OD值均大于1.0,当温度达到19 ℃时,供试菌株的OD值均大于1.2,然而6株非酿酒酵母的OD值均显著低于SC(OD值1.8),其中TD1、TD2菌株的OD值均大于1.4,对低温的适应性较优于TD3和LT2菌株,LT1和LT3菌株的低温适应性弱于其他菌株。
2.4 L.thermotolerans菌株乳酸生成量
对于冰葡萄酒来说,适量的有机酸类物质可提高葡萄酒的风味和口感,其甜酸协调的口感是冰葡萄酒的一个重要感官标准[8],L.thermotolerans主要代谢特点是能够产生乳酸。由图4可知,在发酵温度为16 ℃的条件下,3株L.thermotolerans菌株对冰葡萄汁发酵过程中能够代谢产生L-乳酸,LT1、LT2和LT3均在第6天时达到最大值,分别为1.970、2.195和1.705 g/L,可以看出,在冰葡萄汁低温发酵的条件下,LT2菌株的L-乳酸含量显著高于其他2株L.thermotolerans。
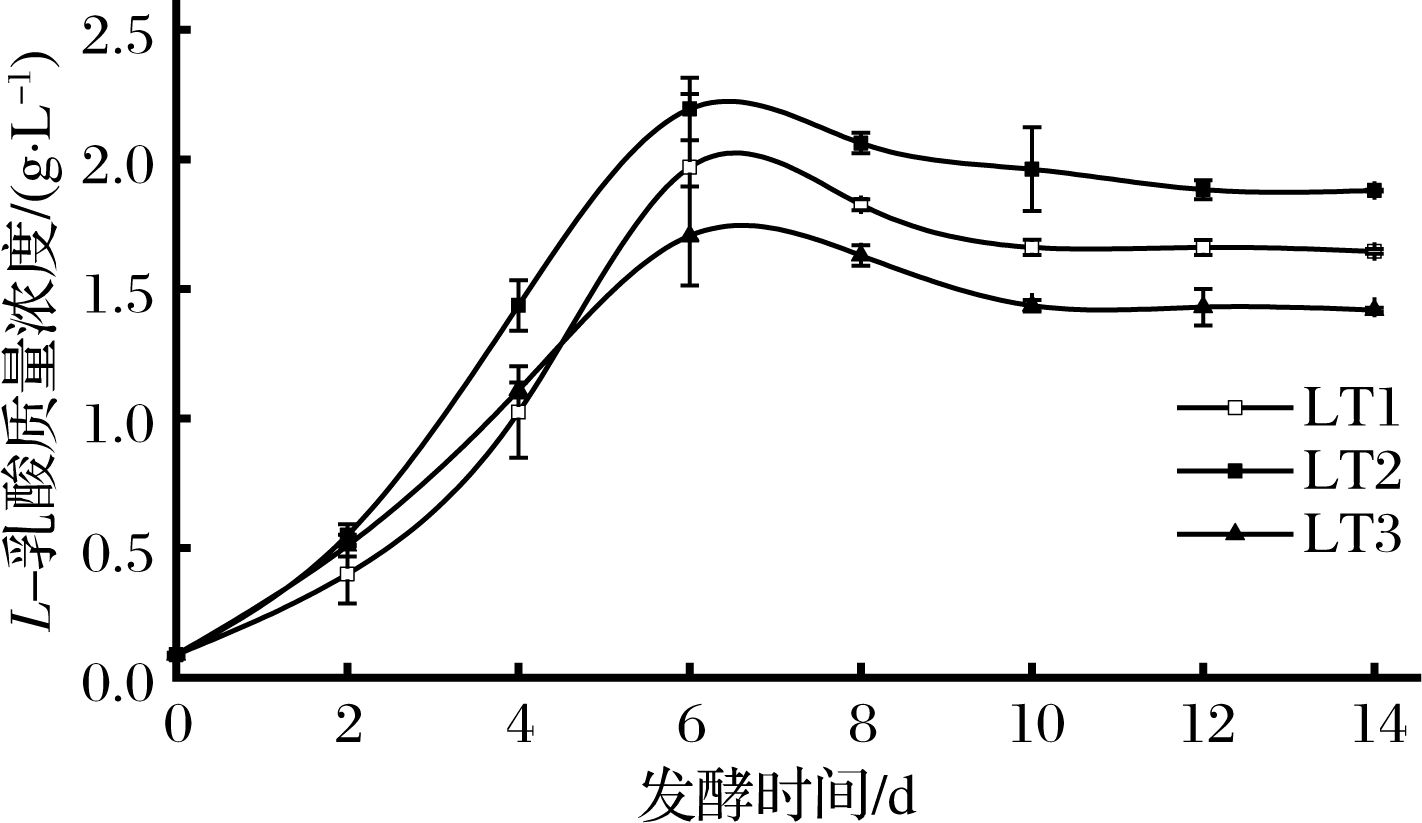
图4 三株L.thermotolerans菌株的乳酸生成量
Fig.4 Production of lactic acid of three L.thermomotolerans strains
2.5 酒样理化指标分析
由表2可知,供试菌株酿制的冰葡萄酒主要理化指标均符合GB/T 25504—2010《冰葡萄酒》[27]国家标准的要求。酿酒酵母SC酿制的冰酒乙醇体积分数为14.0%,显著高于其他6个非酿酒酵母处理组,其中3株L.thermotolerans处理组酒样能够达到的乙醇体积分为11.00%~11.43%,显著低于3株T.delbrueckii酒样(12.07%~12.83%);从完成酒精发酵所需的时间来看,6株非酿酒酵母比酿酒酵母酒精发酵时间延长了10~25 d;3株L.thermotolerans酒样中挥发酸含量显著低于其他试验组,其中LT2酒样挥发酸含量低于对照70.74%,减少了约1.38 g/L;3株T.delbrueckii菌株发酵的酒样中,挥发酸含量比对照SC显著降低了50%~55.31%,减少了约0.94~1.05 g/L。BELY等[14]研究也指出,与酿酒酵母相比,T.delbrueckii可使挥发酸减少0.5~0.8 g/L,减少的程度主要取决于不同的T.delbrueckii菌株。
表2 酒样基本理化指标
Table 2 Basic physico-chemical indices of wine samples

酒样 总发酵时间/d乙醇体积分数/% 总糖/(g·L-1) 挥发酸/(g·L-1)SC2014.00±0.05a101.00±0.23g1.88±0.03aLT13011.00±0.13f151.00±0.31a0.55±0.24dLT23011.65±0.03e141.00±0.43c0.50±0.14eLT33511.43±0.14e148.00±0.05b0.58±0.41dTD14512.40±0.07c130.83±0.68e0.91±0.09bTD24012.83±0.11b126.83±0.45f0.84±0.09cTD34012.07±0.22d134.00±0.31d0.94±0.19b
综上所述,通过对3株L.thermotolerans和3株T.delbrueckii的生长曲线、耐受性及发酵性能分析,表明了L.thermotolerans和T.delbrueckii在高质量浓度葡萄糖、高乙醇体积分数、高SO2和低温等条件下均具有较好的定殖能力,其中LT2和LT3、TD2和TD3等4株菌株耐受性良好。通过对供试的3株L.thermotolerans菌株的乳酸产生量及6株非酿酒酵母酒精发酵性能分析,最终以LT2和TD2菌株为优选菌株,进行单独接种发酵以分析其在冰酒酿造中的应用潜力。
2.6 LT2和TD2菌株单独接种发酵的冰葡萄酒品质分析
2.6.1 基本理化指标分析
酒精发酵结束后,各试验酒样中残糖、乙醇、挥发酸、总酸的含量如表3所示,根据国标GB/T 25504—2010《冰葡萄酒》中总糖 ≥ 125 g/L,乙醇体积分数为9.0%~14.0%及挥发酸 ≤ 2.1 g/L的要求,本次试验所得酒样均达到国标要求,其中处理组TD2和LT2酒样中挥发酸含量比对照SC酒样分别降低55.3%和73.4%,总酸含量分别高出SC酒样的9.2%和23.0%;pH值比SC酒样降低4.0%和7.4%。
表3 ‘贵人香’冰酒基本理化指标
Table 3 Physico-chemical indices of ‘Italian Riesling’ ice wines

理化指标纯种接种SCLT2TD2残糖/(g·L-1)159.67±0.21a163.67±1.86a153.33±1.73a乙醇体积分数/%10.33±0.15a10.07±0.15a10.53±0.45a挥发酸/(g·L-1)1.88±0.03a0.50±0.14c0.84±0.09b总酸/(g·L-1)6.57±0.16c8.08±0.41bc7.18±0.66bpH值4.03±0.02a3.73±0.04c3.87±0.12b
注:SC,酿酒酵母纯种发酵;LT2,L.thermotolerans纯种发酵;TD2,T.delbrueckii纯种发酵(下同)
2.6.2 主要挥发性香气化合物的分析
采用SPME-GC-MS技术对各酒样中香气物质进行分析,共检测出50~63种香气成分,包括16~19种高级醇类、15~18种酯类、8~9种脂肪酸类、6~10种萜烯类和5~7种其他类化合物。由图5可知,各酒样中香气物质的种类和含量差异较大。3个酒样中高级醇含量最多,但2个处理酒样与对照之间均无显著差异(P < 0.05);各酒样中酯类物质含量差异较大(955.25~2 999.68 μg/L),TD2和LT2的总酯含量比SC酒样(2 999.68 μg/L)分别下降了40.99%和68.15%,说明这2种非酿酒酵母在冰酒酿造中合成酯类物质的能力远低于酿酒酵母,但TD2和LT2酒样中萜烯类物质含量显著增加,高于SC酒样的84.6%和89.70%;葡萄酒中大部分挥发性有机酸主要是发酵的副产物,低级饱和脂肪酸通常带有不愉快的嗅感[28],本试验中TD2和LT2菌株发酵的酒样中有机酸含量显著低于对照SC酒样的83.69%和93.69%;其他类化合物主要以醛酮类为主,由于含量较低未进行分析。
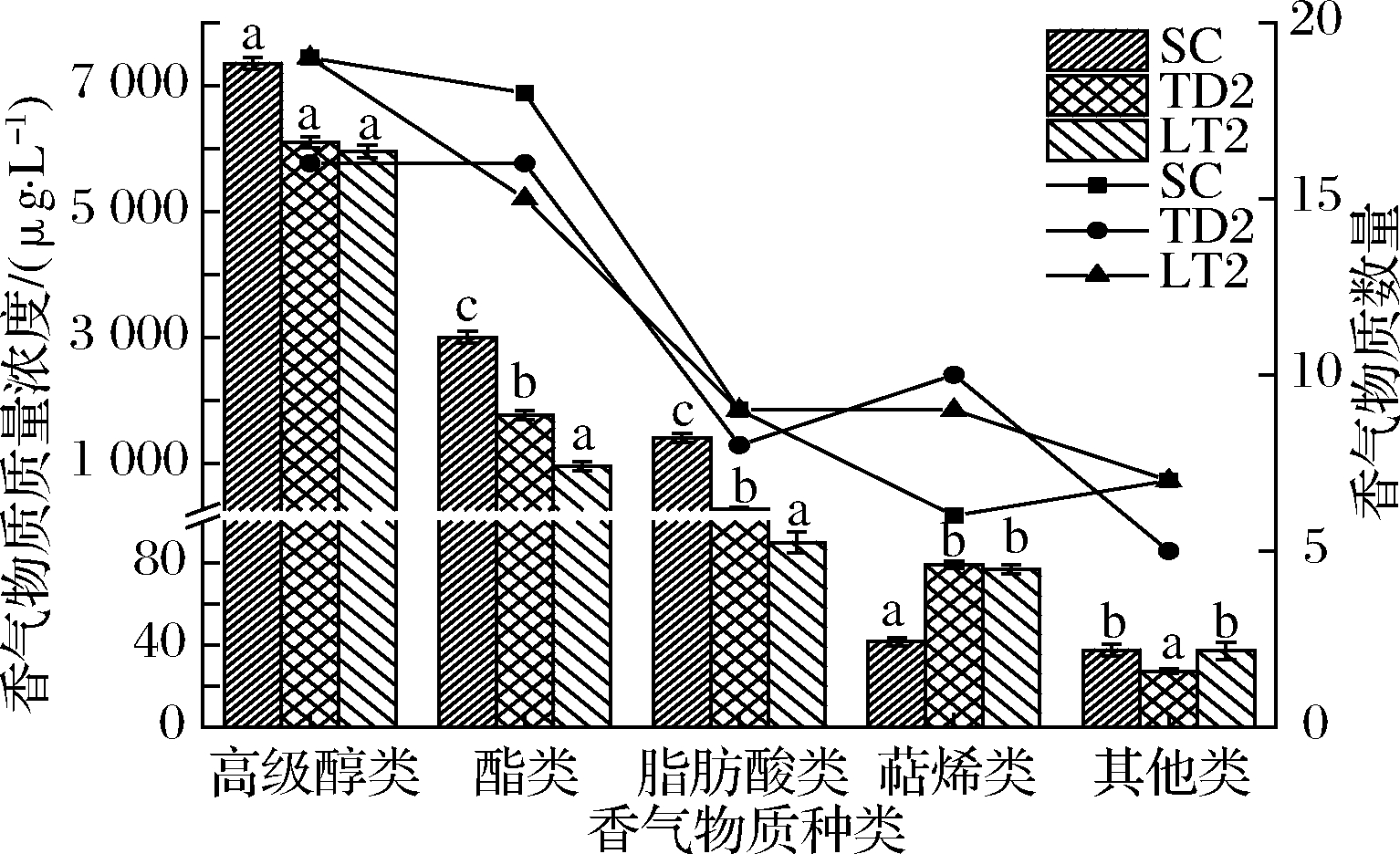
图5 不同酒样产香特性比较
Fig.5 Comparison of aroma production characteristics of different wine samples 注:图中柱形图代表香气物质含量,折线图代表香气物质数量
OAV是评价单一香气化合物对葡萄酒整体香气贡献程度的指标,为了直观分析酿酒酵母SC与2种非酿酒酵母LT2和TD2纯种发酵的冰葡萄酒样的香气特点,对表4中的数据进行了主成分分析(principal component analysis,PCA),由图6和图7可知,PC1和PC2的贡献率分别为70.33%和29.67%。其中,SC位于PC1和PC2的正向端,与正己酸乙酯、乙酸己酯、辛酸乙酯、癸酸乙酯、丁酸乙酯、棕榈酸乙酯、癸酸和9-癸烯酸相关性强,对SC酒样的花香、果香和脂肪味等贡献较大;TD2位于PC1的负向端和PC2的正向端,与苯乙醇和乙酸苯乙酯有较大的关联,对TD2酒样的花香味贡献较大;LT2位于PC1和PC2的负向端,与正己醇、1-戊醇和芳樟醇等香气物质关联紧密,对LT2酒样的醇香、花香等贡献较大。通过PCA发现,3个不同供试酒样之间有较大的香气差异,SC主要体现了酯类物质的香气,TD2主要体现了醇类物质的香气,这与BELDA等[15]研究一致,LT2主要增加了萜烯类香气物质带来的花果香气,BENITO等[6]研究也表明了这一点。
表4 供试酒样中OAV>1的主要挥发性香气成分及含量
Table 5 Main volatile aroma components (OAV>1) in ice wine samples
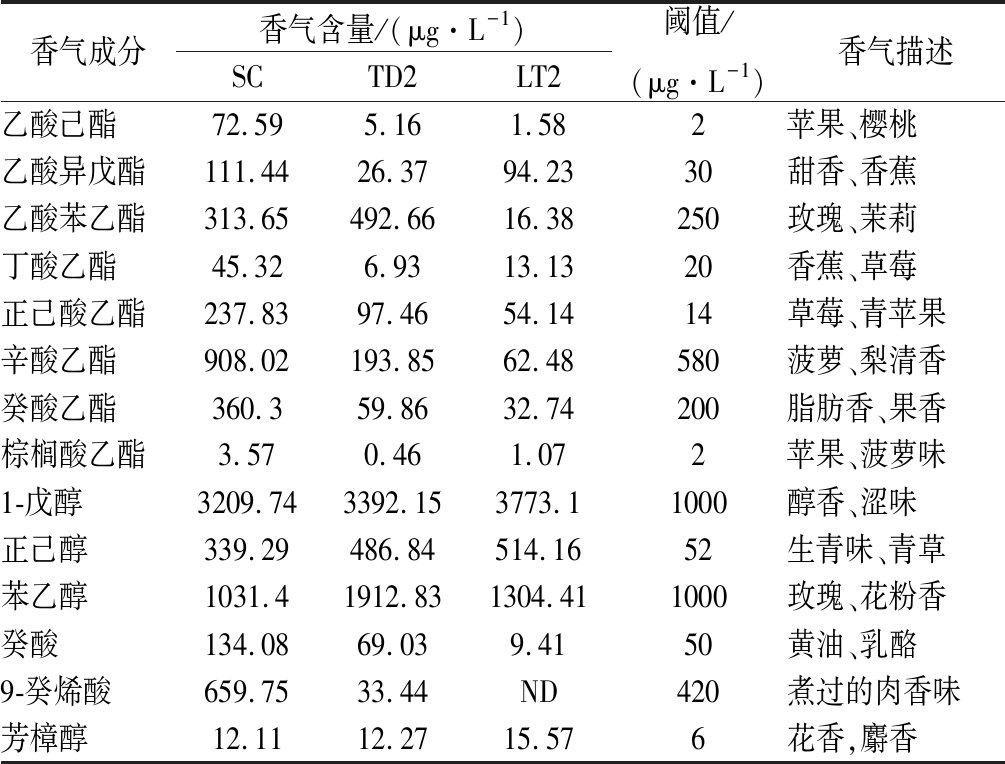
香气成分香气含量/(μg·L-1)SCTD2LT2阈值/(μg·L-1)香气描述乙酸己酯72.595.161.582苹果、樱桃乙酸异戊酯111.4426.3794.2330甜香、香蕉乙酸苯乙酯313.65492.6616.38250玫瑰、茉莉丁酸乙酯45.326.9313.1320香蕉、草莓正己酸乙酯237.8397.4654.1414草莓、青苹果辛酸乙酯908.02193.8562.48580菠萝、梨清香癸酸乙酯360.359.8632.74200脂肪香、果香棕榈酸乙酯3.570.461.072苹果、菠萝味1-戊醇3209.743392.153773.11000醇香、涩味正己醇339.29486.84514.1652生青味、青草苯乙醇1031.41912.831304.411000玫瑰、花粉香癸酸134.0869.039.4150黄油、乳酪9-癸烯酸659.7533.44ND420煮过的肉香味芳樟醇12.1112.2715.576花香,麝香

图6 香气化合物(OAV>1)主成分分析的因子载荷图
Fig.6 Loadings plot from PCA of volatile aroma compounds (OAV>1)
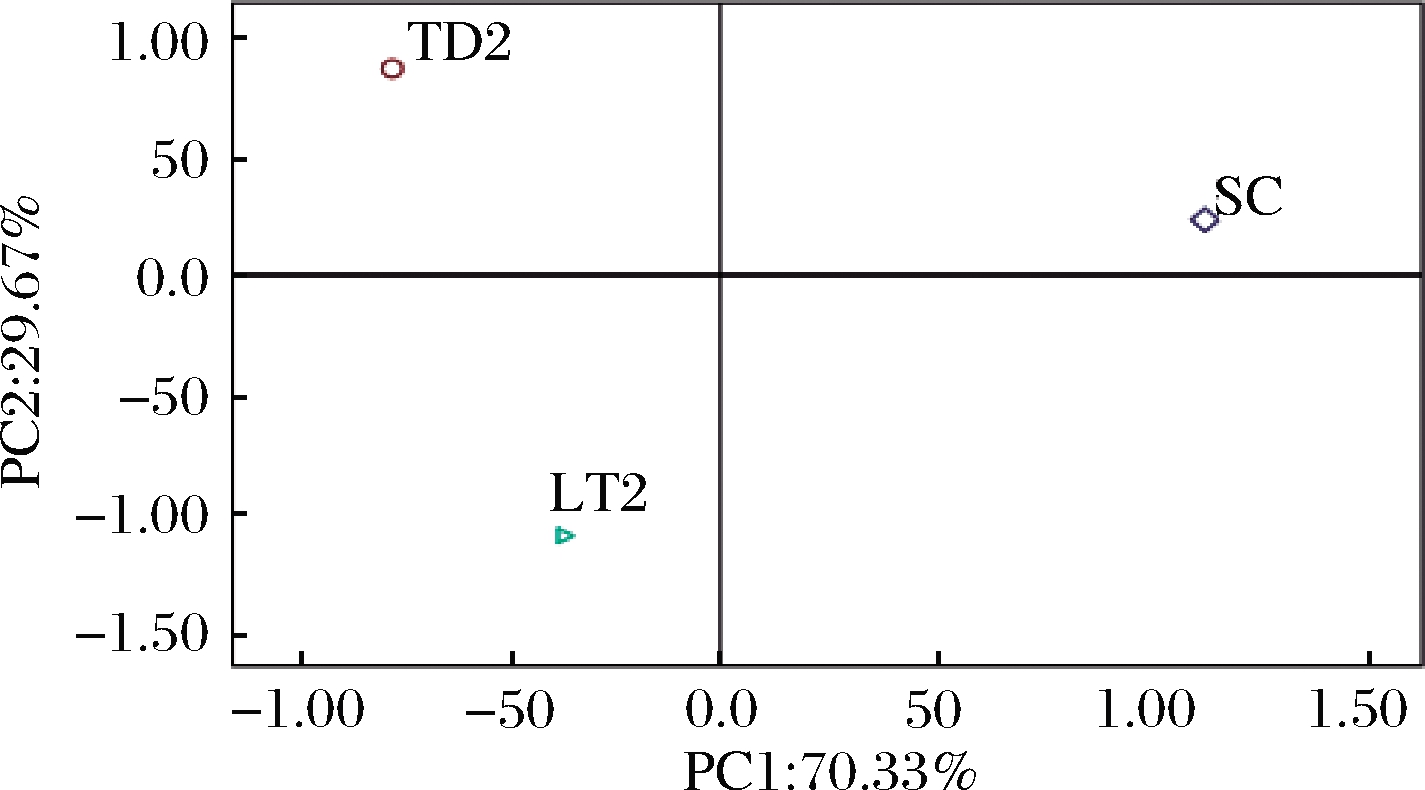
图7 香气化合物主成分分析的供试酒样的分布图
Fig.7 Score plot from PCA of the volatile aroma compounds
2.7 感官评价分析
试验得到的3种贵人香冰葡萄酒均为澄清的金黄色酒体,由图8中可知,在色泽和澄清度方面各酒样的分值无明显差异;从香气评分来看,处理组TD2酒样的花香、果香以及香气强度方面的得分较高于LT2和SC酒样,这一特点与TD2酒样中苯乙醇和乙酸苯乙酯检出量最高的结果相符;各处理酒样在异味方面的得分无明显差异;就口感方面而言,LT2处理酒样的酸味和甜酸平衡感明显高于TD2和SC酒样,说明LT2酒样中乳酸的产生对冰酒的酸甜协调性具有积极影响;从整体评分来看,2组处理酒样的得分均明显高于对照组。总的来看,TD2菌株纯种发酵的贵人香冰葡萄酒在一定程度上增加了花果香气,而LT2菌株发酵的酒样增强了酸度,有助于平衡冰酒的甜腻感,使口感协调。
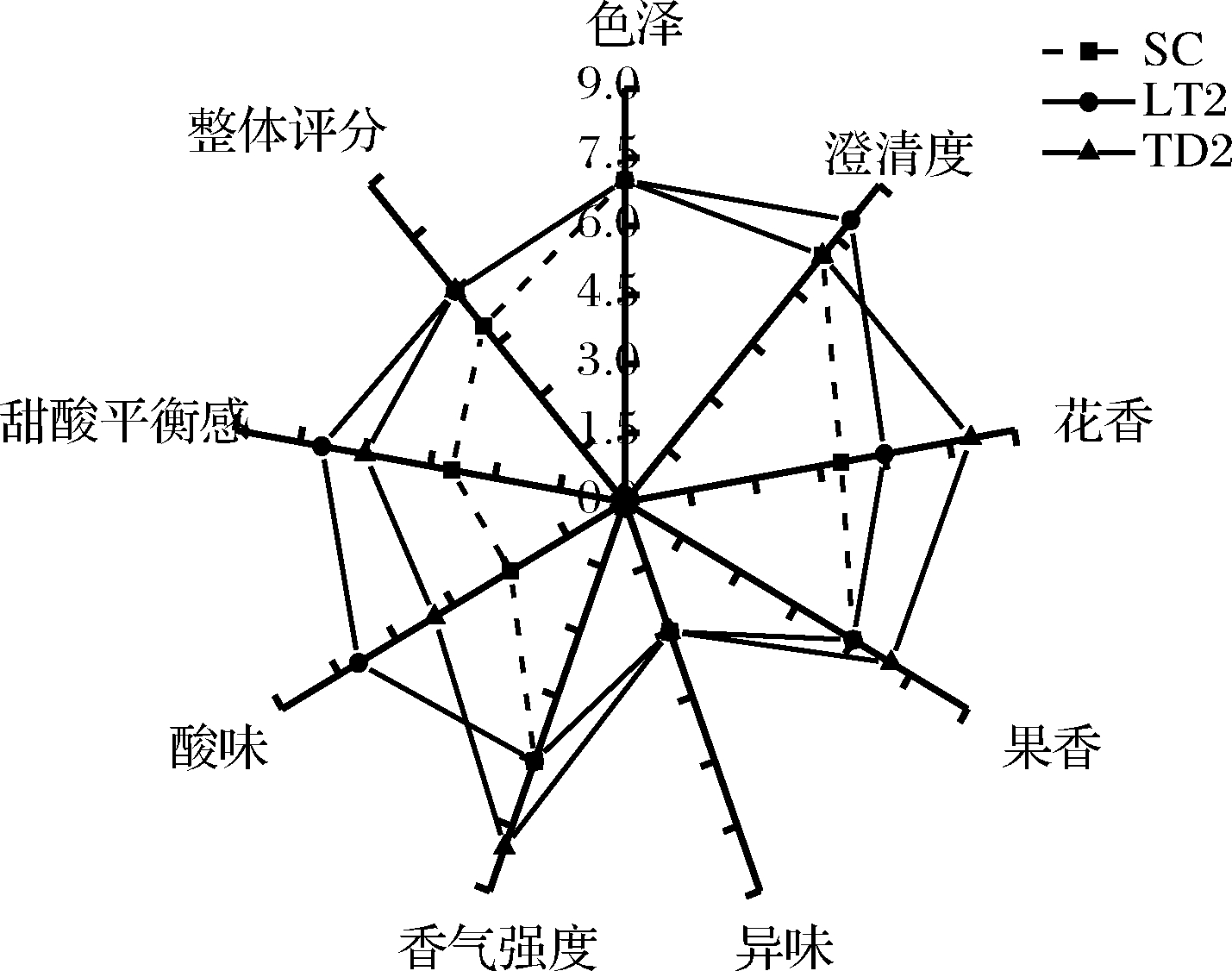
图8 感官分析雷达图
Fig.8 Radar map of sensory analysis
3 结论
通过对不同来源的3株L.thermotolerans和3株T.delbrueckii菌株的嗜杀性、生长特性和发酵性能的分析,结果表明:3株L.thermotolerans和TD2菌株均具有较强的嗜杀性;6株供试的非酿酒酵母菌株在16 ℃的低温条件下均经历4~6 h的延滞期后很快进入对数生长期,稳定期细胞数量高,生长良好;LT2、TD2菌株在葡萄糖质量浓度为400~500 g/L、乙醇体积分数为15%、SO2质量分数为400 mg/L、温度为13~19 ℃等条件下耐受性良好。3株L.thermotolerans菌株中LT2菌株的乳酸产量最高(2.195 g/L)。LT2和TD2菌株纯种发酵能够使冰葡萄酒的乙醇体积分数达到11%~12%,并且与酿酒酵母纯种发酵的酒样相比,萜烯类物质总含量显著增加,酯类、有机酸类物质总含量显著降低;其中TD2菌株纯种发酵能够增加乙酸苯乙酯、丙酸苯乙酯、反式-4-癸烯酸乙酯等乙醇酯以及萜烯类物质的含量;LT2菌株能够增加芳樟醇含量,赋予葡萄酒花香。感官分析表明,TD2菌株纯种发酵的冰葡萄酒有较明显的花、果香气;LT2菌株能够增强冰葡萄酒的酸度,有助于平衡冰酒的甜腻感,使口感协调。综上所述,L.thermotolerans和T.delbrueckii菌株纯种发酵在一定程度对冰葡萄酒的感官品质有一定的积极影响。在后续研究中,将进一步考察L.thermotolerans和T.delbrueckii分别与酿酒酵母混菌发酵的接种方式对冰葡萄酒品质的影响,以期为利用非酿酒酵母提升冰葡萄酒的品质提供理论参考。
[1] 李景明,马丽艳,杨丽丽.冰葡萄酒及生产工艺[J].中外食品,2005(11):39-41.
LI J M,MA L Y,YANG L L.Ice wine and its production process[J].Global Food Industry,2005(11):39-41.
[2] BENITO  ,CALDERON F,PALOMERO F,et al.Quality and composition of Airén wines fermented by sequential inoculation of Lachancea thermotolerans and Saccharomyces cerevisiae[J].Food Technology and Biotechnology,2015,54(2):135-144.
,CALDERON F,PALOMERO F,et al.Quality and composition of Airén wines fermented by sequential inoculation of Lachancea thermotolerans and Saccharomyces cerevisiae[J].Food Technology and Biotechnology,2015,54(2):135-144.
[3] PETRUZZI L,CAPOZZI V,BERBEGAL C,et al.Microbial resources and enological significance:Opportunities and benefits[J].Frontier in Microbiology,2017,8:995.
[4] 谭凤玲,王宝石,胡培霞,等.非酿酒酵母在葡萄酒混菌发酵中的应用及其挑战[J/OL].食品与发酵工业,2020.DOI:10.13995/j.cnki.11-1802/ts.024520.
TAN F L,WANG B S,HU P X,et al.Application and challenge of non-Saccharomyces cerevisiae yeast in the mixed fermentation of wine[J/OL].Food and Fermentation Industries,2020.DOI:10.13995/j.cnki.11-1802/ts.024520.
[5] KURTZMAN C P,ROBNETT C J.Phylogenetic relationships among yeasts of the ‘Saccharomyces complex’ determined from multigene sequence analyses[J].FEMS Yeast Res,2003,3:417-432.
[6] BENITO S.The impacts of Lachancea thermotolerans yeast on winemaking[J].Applied Microbiology and Biotechnology,2018,102:6 775-6 790.
[7] TRISTAN J P,BENOIT D,MATHABATHA E S.Lachancea yeast species:Origin,biochemical characteristics and oenological significance[J].Food Research International,2019,119:378-389.
[8] 王玉华,盛文军,李敏,等.耐热克鲁维酵母和粟酒裂殖酵母顺序接种发酵对美乐干红葡萄酒品质的影响[J].食品科学,2019,40(8):102-111.
WANG Y H,SHENG W J,LI M,et al.Effect of sequential fermentation with Lachancea thermotolerans and Schizosaccharomyces pombe on the quality of Merlot dry red wine[J].Food Science,2019,40(8):102-111.
[9] SHEKHAWAT K,PORTER T J,Bauer F F,et al.Employing oxygen pulses to modulate Lachancea thermotolerans-Saccharomyces cerevisiae Chardonnay fermentations[J].Annals of Microbiology,2018,68(2):93-102.
[10] PONSONE M L,NALLY,et al.Evaluation of the effectiveness of potential biocontrol yeasts against black sur rot and ochratoxin A occurring under greenhouse and field grape production conditions[J].Biological Control,2016,103:78-85.
[11] BENITO  ,CALDERON F,BENITO S.Combined use of S.pombe and L.thermotolerans in winemaking.beneficial effects determined through the study of wines’ analytical characteristics[J].Molecules,2016,21(12):1 744
,CALDERON F,BENITO S.Combined use of S.pombe and L.thermotolerans in winemaking.beneficial effects determined through the study of wines’ analytical characteristics[J].Molecules,2016,21(12):1 744
[12] BENITO  ,CALDERON F,PALOMERO F,et al.Combine use of selected Schizosaccharomyces pombe and Lachancea thermotolerans yeast strains as an alternative to the traditional nalolactic fermentation in red wine production[J].Molecules (Basel,Switzerland),2015,20(6):9 510-9 523.
,CALDERON F,PALOMERO F,et al.Combine use of selected Schizosaccharomyces pombe and Lachancea thermotolerans yeast strains as an alternative to the traditional nalolactic fermentation in red wine production[J].Molecules (Basel,Switzerland),2015,20(6):9 510-9 523.
[13] COMITINI F,GOBBI M,DOMIZIO P,et al.Selected non-Saccharomyces wine yeasts in controlled multistarter fermentations with Saccharomyces cerevisiae[J].Food Microbiology,2011,28(5):873-882.
[14] BELY M,STOECKLE P,MASNEUF P L,et al.Impact of mixed Torulaspora delbrueckii-Saccharomyces cerevisiae culture on high-sugar fermentation[J].International Journal of Food Microbiology,2008,122(1):312-320.
[15] BELDA I,RUIZ J,BEISERT B,et al.Influence of Torulaspora delbrueckii in varietal thiol (3-SH and 4-MSP) release in wine sequential fermentations[J].International Journal of Food Microbiol,2017,257:183-191.
[16] BENITO S.The impacts of Torulaspora delbrueckii yeast on winemaking[J].Applied Microbiology and Biotechnology,2018,102(7):3 081-3 094.
[17] ULLIVARRI M,MENDOZA L M,RAYA R R.Killer activity of Saccharomyces cerevisiae strains:Partial characterization and strategies to improve the biocontrol efficacy in winemaking[J].Antonie Van Leeuwenhoek,2014,106(5):865-878.
[18] 杨婕,王玉华,米兰,等.耐热克鲁维酵母与酿酒酵母顺序接种发酵对霞多丽干白葡萄酒感官品质的影响[J].食品与发酵工业,2019,45(18):144-154.
YANG J,WANG Y H,MI L,et al.Effects of sequential fermentation of Lachancea thermotolerans and Saccharomyces cerevisiae on the quality of Chardonnay dry white wine[J].Food and Fermentation Industries,2019,45(18):144-154.
[19] 刘灿珍,董书甲,姜凯凯,等.5株非酿酒酵母的耐受性及发酵特性研究[J].中国酿造,2017,36(10):42-46.
LIU C Z,DONG S J,JIANG K K, et al.Tolerance and fermentation characteristics of five non-Saccharomyces[J].China Brewing,2017,36(10):42-46.
[20] BUGLASS A J,LEE S H.SEQUENTIAL.Analysis of malic acid and both enantiomers of lactic acid in wine using a high-performance liquid chromatographic column-switching procedure[J].Journal of Chromatographic Science,2001,39(11):453-458.
[21] PEREZ-RUIZ T,MART N C,TOMAS V,et al.High-performance liquid chromatographic separation and quantification of citric,lactic,malic,oxalic and tartaric acids using a post-column photochemical reaction and chemiluminescence detection[J].Journal of Chromatography A,2004,1026(1-2):57-64.
[22] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
State Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China,China National Standardization Administration.GB/T 15038—2006 Analytical methods of wine and fruit wine[S].Beijing:China Standards Press,2006.
[23] 曲昆生,曲天波,曲林,等.苹果酸-乳酸发酵对威代尔冰酒香气的影响[J].中国酿造,2019,38(9):36-42.
QU K S,QU T B,QU L,et al.Effect of malolactic fermentation on volatile compounds of Vidal ice wine[J].China Brewing,2019,38(9):36-42.
[24] PEREZ-MAGARINO S,ORTEGA-HERAS M,CANO-MOZO E,et al.The influence of oak wood chips,micro-oxygenation treatment,and grape variety on colour,and anthocyanin and phenolic composition of red wines[J].Journal of Food Composition & Analysis,2009,22(3):204-211.
[25] 苑伟,王学锋,刘延琳.优选酿酒酵母菌株发酵性能研究[J].中国酿造,2010,29(9):48-52.
YUAN W,WANG X F,LIU Y L,Study of the vinification characteristics of superior wine yeast[J].China Brewing,2010,29(9):48-52.
[26] 杨诗妮,叶冬青,贾红帅,等.本土戴尔有孢圆酵母在葡萄酒酿造中的应用潜力[J].食品科学,2019,40(18):108-115.
YANG S N,YE D Q,JIA H S,et al.Oenological potential of indigenous Torulaspora delbrueckii for winemaking[J].Food Science,2019,40(18):108-115.
[27] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T25 504—2010 冰葡萄酒[S].北京:中国标准出版社,2010.
State Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China,China National Standardization Administration.GB/T25 504—2010 Ice Wines[S].Beijing:China Standards Press,2010.
[28] 李华,王华,袁春龙,等.葡萄酒化学[M].北京:科学出版社,2006.
LI H,WANG H,YUAN C L,et al.Wine Chemistry[M].Beijing:Science Press,2006.