面包工业中常常使用含糖面团来制作甜面包,但高浓度的糖分会引发高渗胁迫,导致胞内水分外迁,扰乱并破坏细胞质膜上的离子梯度和细胞抵御能力,并最终使细胞破裂死亡[1]。为应对此种情况,酵母细胞通常会富集甘油、海藻糖、氨基酸等物质来抵御高渗胁迫引起的细胞损伤,提高菌株抗性[2]。
酵母菌能够利用麦芽糖与MAL基因座(MAL1~4和MAL6)有关,每个MAL基因座均包含编码麦芽糖运输蛋白的MALx1(又名MALxT),x代表基因座位置,编码麦芽糖酶的MALx2(又名MALxS),以及编码正调节蛋白的MALx3(又名MALxR),其中麦芽糖酶是麦芽糖水解的关键酶[3]。在之前的试验中发现,工业酵母BY14a中高表达麦芽糖酶编码基因MAL62,会提高突变株B+MAL62的胞内海藻糖含量,增强突变株耐冷冻能力[4]。海藻糖是一种非还原性的葡二聚糖,随着外界生存压力的增强,其在胞内的含量会随之上升[5]。BELL等[6]发现,酵母在面临渗透压胁迫时,野生菌株比无法合成海藻糖的突变株(TPS1Δ、TPS2Δ)生存率更高。STAMBUK等[7]和JULES等[8]等研究发现,酵母从胞外向胞内转运海藻糖时,菌株自身的麦芽糖代谢状态会对这个过程有所影响,只有组成型表达的MAL基因座才能够开启Agt1p的海藻糖转运功能。
目前有关菌体耐胁迫受麦芽糖代谢调控的相关研究仅集中在完整的MAL基因座上,针对单独的麦芽糖酶与胞内海藻糖含量以及酵母耐高渗能力之间的联系并无报道。由于海藻糖具有保护胞内可溶性酶和细胞膜稳定性的功能[9],因此,猜测MAL62基因的高表达可能会使突变株在耐冷冻以外获得一定程度的耐高渗能力。鉴于此,本课题计划探究麦芽糖酶编码基因MAL62高表达对菌株的生长特性、形态特征、胞内应激物质积累及产气在不同糖浓度环境下所带来的影响,并与市售高糖酵母进行对比,初步探索相关现象出现的可能原因,为挖掘面包酵母麦芽糖酶多抗性奠定良好基础。
1 材料与方法
1.1 菌种及培养基
酿酒酵母(Saccharomyces cerevisiae)BY14a,天津科技大学张翠英教授惠赠;突变株B+MAL62及市售高糖活性干酵母GSJ与GML,保存于天津农学院发酵与酿造食品实验室。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:葡萄糖2%,蛋白胨2%,酵母浸粉1%,固体YEPD添加琼脂2%。LSMLD培养基:液体模拟面团培养基,其配方参考文献[10]。高糖培养基:在LSMLD培养基基础上,将葡萄糖质量分数替换为40%、50%与60%。培养基均需121 ℃灭菌20 min。
1.2 主要试剂与设备
葡萄糖、酵母浸粉和琼脂粉,北京奥博星生物技术有限公司;蛋白胨,天津市英博生化试剂有限公司;海藻糖标准品(分析纯99%),Sigma公司;丙三醇(分析纯),天津试剂厂;甘油检测试剂盒,Megazyme公司;高筋小麦粉,五得利金富强;其他未注明试剂均为分析纯,国药化学试剂公司。
恒温培养箱(DHP-420BS),天津市中环电炉有限公司;立式摇床(HNY-2102C),天津欧诺仪器股份有限公司;移液器(Research plus),Effendorf公司;高速冷冻离心机(gL20A),中科院生物物理所技术服务公司;离子溅射仪(SD-3000),北京博远微纳科技有限公司;台式扫描电子显微镜(Phenom pro),荷兰飞纳公司。
1.3 实验方法
1.3.1 菌种培养条件
挑取1环菌泥接入5 mL YEPD培养基中,28 ℃、180 r/min振荡24 h,以1%接种量转入高糖LSMLD培养基中,30 ℃,180 r/min振荡培养相应时间。
1.3.2 海藻糖与甘油检测方法
取适量菌体,双蒸水洗涤2次。胞内海藻糖测定采用硫酸蒽酮法[11],甘油含量的测定采用Megazyme甘油检测试剂盒[12],实验重复3次取平均值。
1.3.3 生长性能测定
菌体在高糖培养基中30 ℃,180 r/min振荡培养64 h,每隔2 h取样,双蒸水洗涤2次后测定OD600,以空白培养基作为对照,绘制生长曲线,实验重复3次取平均值。
1.3.4 细胞形态观察
菌体在高糖培养基中培养至对数期,双蒸水洗涤菌体2次,立即涂布于导电胶,真空喷金,台式扫描电镜观察。
1.3.5 产气性能测定
杜氏产气:每5 mL高糖培养基中接入1 mL种子液,30 ℃,间隔12 h观察杜氏小管中产气量。分为0~5等级:0级,管内无气体;1级至5级分别为管内1/8、1/4、1/2、3/4及满气。结果取3次实验平均值。
实际产气实验:采用量筒法进行实际产气实验[13],含糖面团[14]于30 ℃条件下间隔30 min记录体积,结果取3次实验平均值。
1.3.6 数据统计方法
采用ANOVA法统计菌株间差异,t-检验法统计突变株与出发菌株的差异,P<0.05为显著,P<0.01为极显著。
2 结果与分析
2.1 胞内物质含量
各菌株胞内海藻糖含量如图1所示,40%糖胁迫环境下,B+MAL62胞内海藻糖含量为51.15 mg/g,比BY14a高出64.27%(P<0.05);当糖质量分数由50%升至60%时,B+MAL62的胞内海藻糖则可分别比BY14a提高55.03%与59.06%(P<0.05)。但与市售高糖菌株相比,B+MAL62的优势则不明显,当胁迫糖的质量分数由40%提至60%时,B+MAL62的胞内海藻糖仅仅比市售高糖酵母的平均值高出12.26%、12.44%和12.74%。因此,尽管高表达MAL62基因能够明显提升出发菌株的胞内海藻糖含量,但仅能够达到与市售高糖酵母相近的水平。
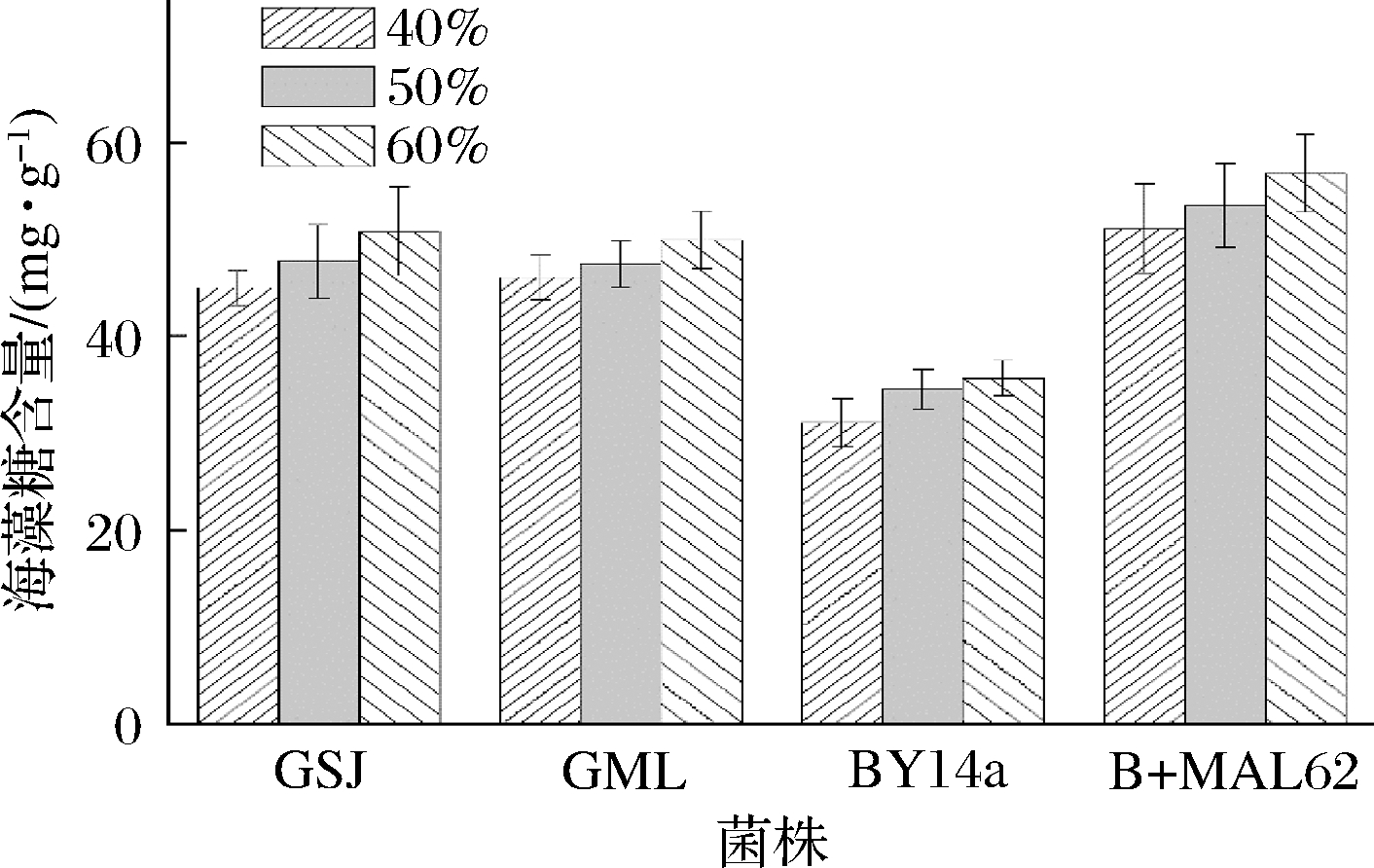
图1 高糖环境下各菌株的胞内海藻糖含量
Fig.1 Contents of intracellular trehalose of the four strains under high sugar stress
各菌株胞内甘油含量如图2所示,当胁迫糖的质量分数为40%时,B+MAL62的胞内甘油含量为17.41 μg/mg,为BY14a时的2.30倍;当糖的质量分数升至50%与60%时,则分别为2.20与2.24倍(P<0.01)。与市售高糖菌株相比,B+MAL62的胞内甘油水平亦具有优势。当糖的质量分数由40%升至60%时,B+MAL62的胞内甘油可以比市售高糖酵母的平均值高出27.10%、29.90%和28.45%(P<0.05)。因此,高表达MAL62基因能够明显提升出发菌株的胞内甘油含量,并使其高于市售高糖酵母的平均水平。
通过实验发现,随着糖浓度升高,各菌株胞内海藻糖及甘油的含量均呈现升高趋势。其中B+MAL62菌株随着渗透压升高,胞内甘油提升速率较大,达到26.04%,其胞内海藻糖含量的提升速率也可达到11.11%。有报道称,海藻糖合成基因TPS1、TPS2以及甘油合成关键基因GDP1的启动子上均带有STREs序列[15-16],在许多胁迫基因的启动子上,Msn2p、Msn4p与STREs绑定[17],且Msn2p、Msn4p是Hog1实现高渗透压胁迫下控制基因表达的重要转录激活因子[18]。因此,由实验结果进行推测,MAL62基因的高表达可能通过影响Hog1、Msn2、Msn4通路,激活了TPS1、TPS2以及GDP1共同的STRE压力响应元件;同时,MAL62基因高表达引发了麦芽糖酶水平提高[19],很可能导致胞内葡萄糖等底物水平提高,致使海藻糖和甘油合成前体水平提高[20],由此提升了菌株胞内海藻糖及甘油的含量。后期将进一步使用多组学方法分析并协通相关发酵实验验证上述内容,相关实验正在进行中。
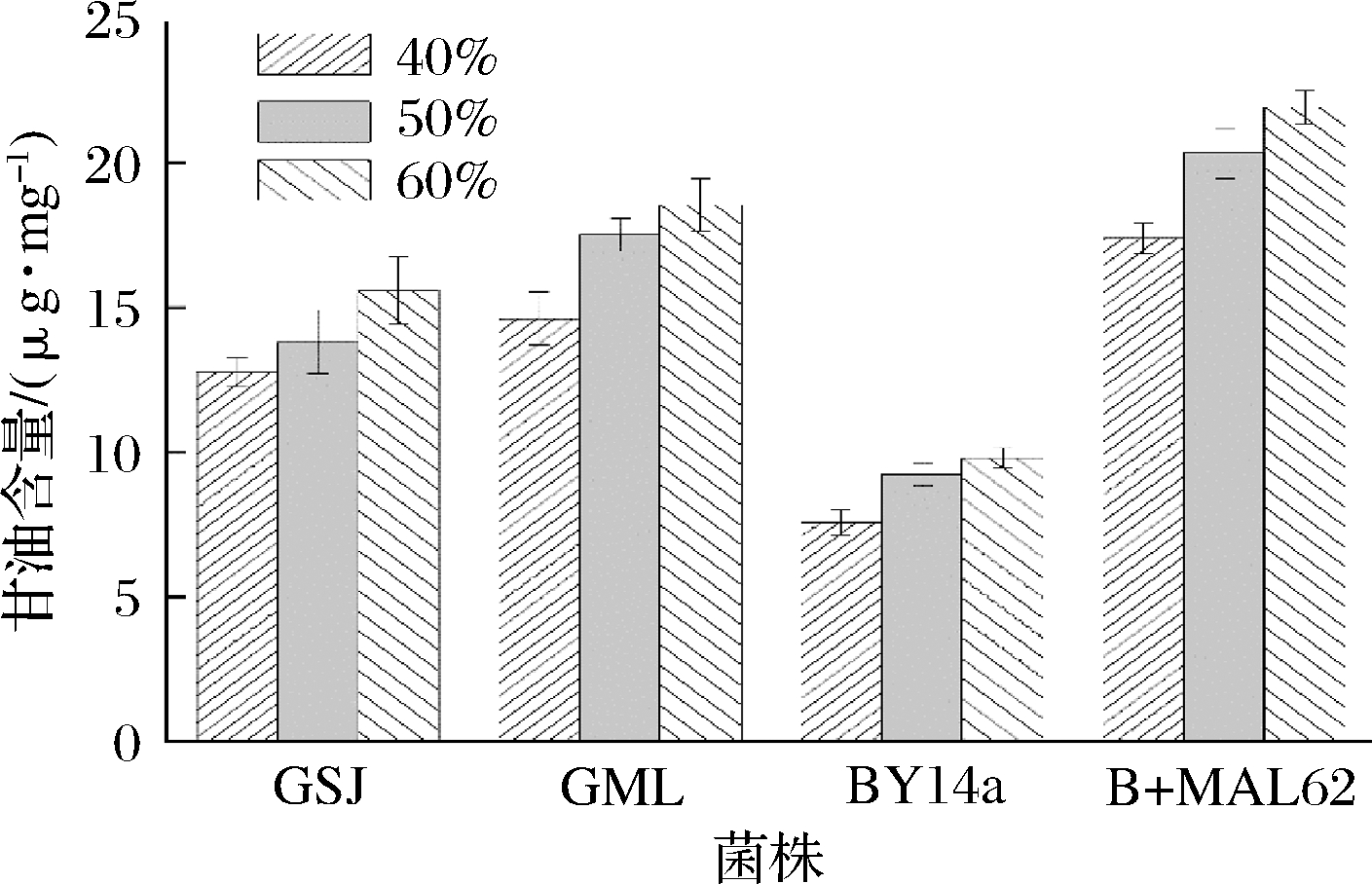
图2 高糖环境下各菌株的胞内甘油含量
Fig.2 Contents of intracellular glycerol of the four strains under high sugar stress
2.2 菌株生长性能的比较
由图3可知,当胁迫糖的质量分数为40%时,B+MAL62菌株的停滞期为6 h,是BY14a的一半,与市售高糖菌株GSJ及GML的平均停滞期相近。当胁迫糖的质量分数为50%时,B+MAL62比对照BY14a停滞期减少50%,与市售高糖GML相近。总的来看,随着糖浓度的增加,各菌株的延滞期也随之增长,发酵至55 h后,所有菌株的OD600值均无明显续增,甚至还会出现下降。这也许是因为高渗环境会造成细胞严重脱水进而使细胞失活[21],或者由于在高糖胁迫下, 酵母细胞内会产生过量的活性氧和活性氮等有害物质, 促使线粒体产生超氧化物并激活一氧化氮合酶, 形成过氧亚硝基, 致使机体进一步被氧化而受损伤,甚至凋亡[22]。在高渗环境下,酵母会通过合成甘油与海藻糖平衡胞内渗透压以防止细胞脱水[23-25]。实验发现B+MAL62的胞内甘油与海藻糖快速增加,说明B+MAL62菌株可以获得更多的胞内保护物质,这可以解释为何B+MAL62菌株能够在高糖环境下比对照菌更早进入对数期。
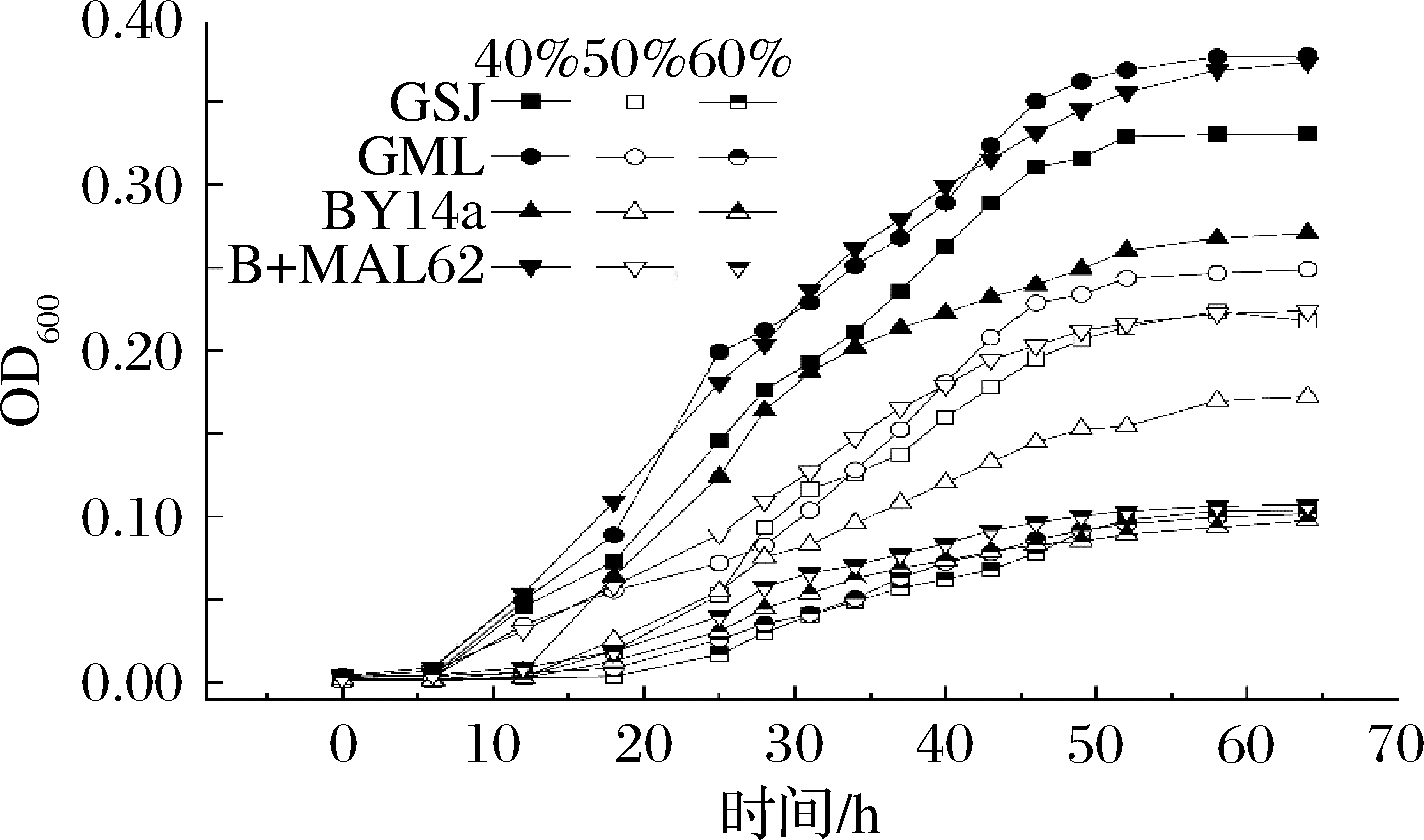
图3 高糖环境下各菌株的生长曲线
Fig.3 Growth curve of the four strains under high sugar stress
2.3 菌株细胞形态观察
由图4-a和图4-d可知, 质量分数为40%糖胁迫时,市售高糖酵母GSJ与GML的细胞均出现不同程度的凹陷(箭头处),BY14a菌株(图4-g)细胞表面出现部分褶皱,B+MAL62菌株(图4-j)细胞呈椭球形,表面光滑,均匀,个体独立。质量分数为50%糖胁迫时,GSJ和GML(图4-b和4-e)的细胞表面已经出现大量凹陷甚至部分塌陷(箭头处),BY14a(图4-h)也呈现出结构塌陷(箭头处),B+MAL62(图4-k)失去平滑的外观,出现凹凸不平(箭头处)。

a-GSJ 40%;b-GSJ 50%;c-GSJ 60%;d-GML 40%;e-GML 50%; f-GML 60%;g-BY14a 40%;h-BY14a 50%;i-BY14a 60%; j-B+MAL62 40%;k-B+MAL62 50%;l-B+MAL62 60%
图4 高糖环境下各菌株的细胞形貌
Fig.4 Cell morphology of the four strains under high sugar stress
随着胁迫糖的质量分数升高至60%, GSJ和GML(图4-c与4-f)的菌体严重坍塌,细胞壁破损,出现破碎组织;BY14a(图4-i)的菌体也呈现塌陷与空洞(箭头处),B+MAL62(图4-l)则皱缩严重,出现细胞黏连及部分塌陷(箭头处)。据报道,高渗环境会影响面包酵母的糖酵解,糖异生、脂肪酸合成、细胞膜内的酶活性,这些代谢反应变化与面包酵母形态的改变有关[26]。此外,高渗环境下HOG途径所涉及的压力响应途径与细胞壁完整性途径存在协作关系,细胞壁损伤会同时激活上述2个途径,使之一同调控酵母细胞壁有关葡聚糖形成的基因转录[27]。由于B+MAL62菌株胞内甘油含量提升,因此我们推测也许MAL62基因高表达会通过上述途径增强细胞壁的稳定性,进而减少高糖环境下B+MAL62菌株的破碎死亡率。
2.4 菌株产气性能比较
由图5可见, 质量分数为40%与50%糖胁迫时,GSJ与GML菌株直至发酵18 h时杜氏产气等级仍大多处于2级(50%糖的GML菌株除外);相比之下,B+MAL62菌株在糖质量分数为40%与50%时发酵12 h即可达到杜氏产气3级,说明40%~50%糖环境下B+MAL62菌株的起始产气能力大于GSJ、GML以及BY14a菌株。但是,当糖胁迫的质量分数升至60%时,B+MAL62菌株的快速产气能力受到抑制,各阶段产气量与GSJ与GML菌株近似,失去了产气速度的优势。
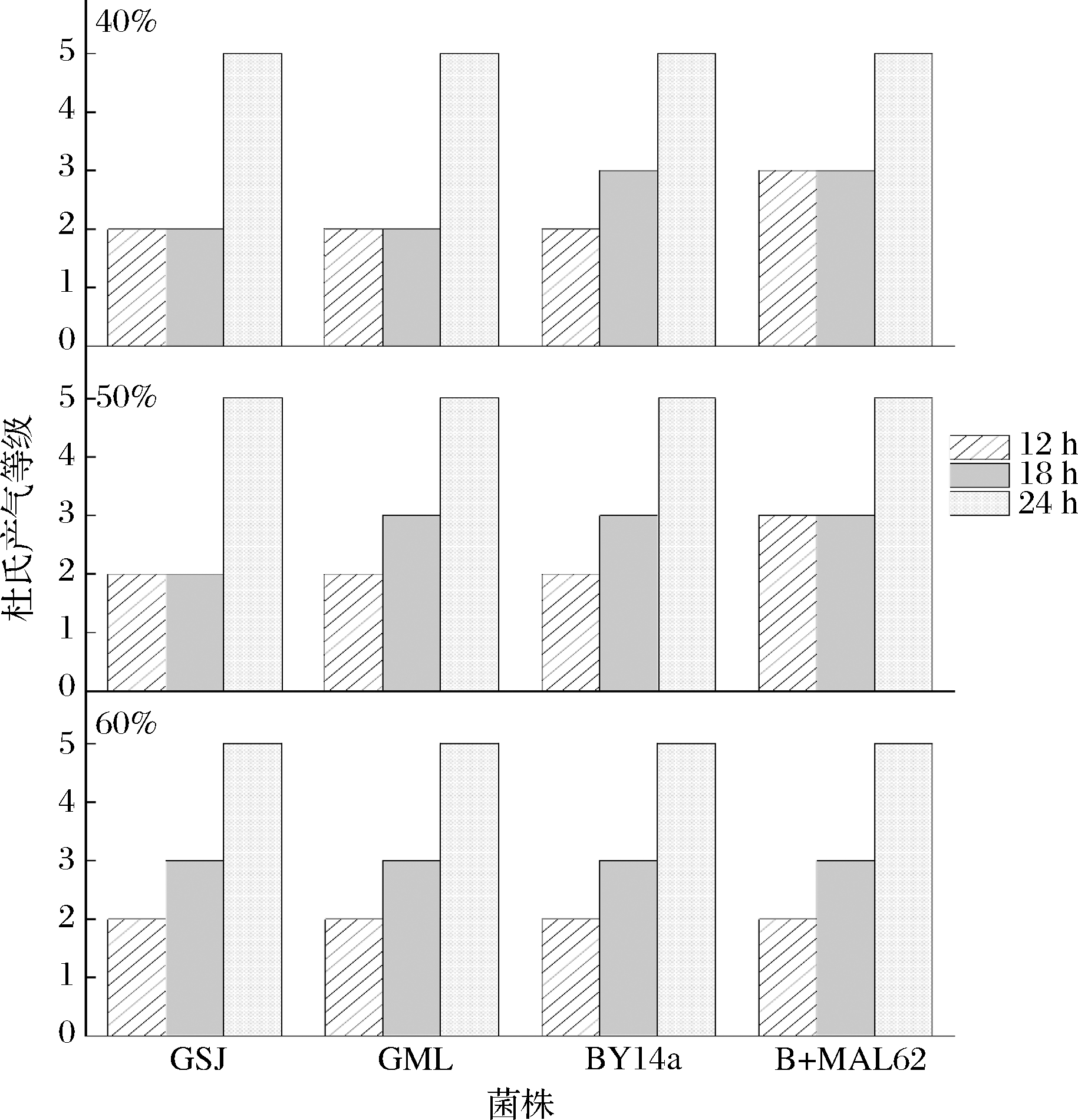
图5 高糖环境下各菌株的杜氏小管产气
Fig.5 Gas production of the four strains in Durham’s fermentation tube under high sugar stress
为了进一步对比各菌株的实际产气能力,采用量筒法检测了4种酵母在实际含糖面团中的发酵力,结果如图6所示。几个时间点内,B+MAL62菌株的产气量几乎均为最大,在发酵末期可达到84 mL,分别高出GSJ、GML与BY14a 35.48%、6.33%和21.74%。从产气速度来看,3 h内 B+MAL62菌株增长了66 mL,可分别高出其他菌株50.00%(GSJ),4.76%(GML)与34.69%(BY14a)。
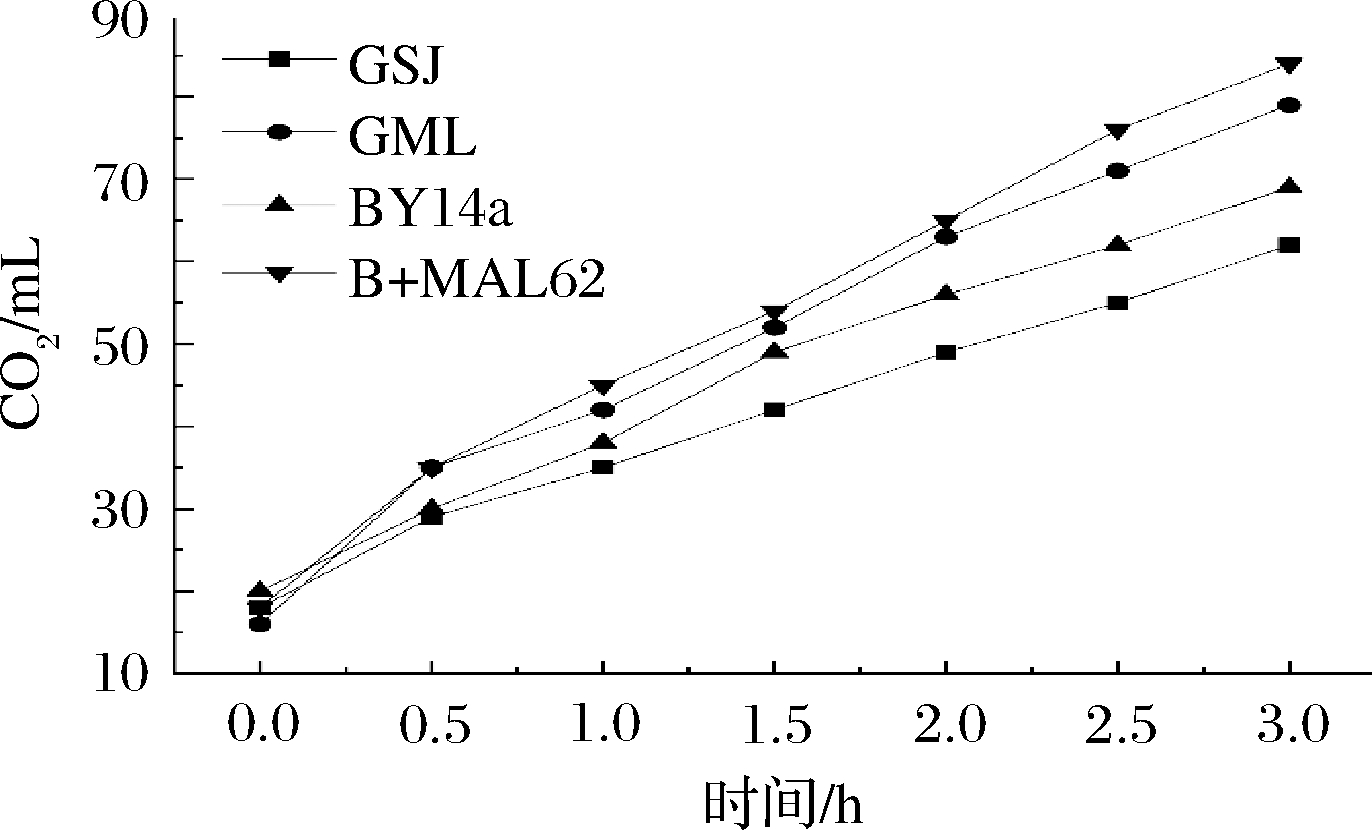
图6 高糖环境下各菌株的实际面团产气
Fig.6 Gas production of the four strains in high sugar dough
有报道认为,酵母菌自身的甘油合成能力以及胞内海藻糖含量与菌株发酵力具有明显的相关性[25, 28],此外,实际面团发酵初期,菌体的抗压反应机制会被迅速激活,HOG途径相关的基因表达会剧烈变化[29],由于HOG途径与甘油等相关保护性物质关系密切,这意味着较高的胞内甘油含量可以更好地抵御实际面团发酵初期的各种胁迫,此外,胞内甘油还能够明显促进面团的持气能力[24]。因此,具有较多胞内甘油和海藻糖的B+MAL62菌株可以更好地应对高糖面团发酵开始阶段的低水活压力,并最终在实际面团产气方面体现出优势。
3 结论
基于前期研究基础,本课题针对高表达麦芽糖酶基因MAL62的耐冷冻突变株B+MAL62进行了抗高糖方面的研究。发现质量分数为40%~60%的糖胁迫下,MAL62高表达能够将酵母胞内海藻糖与甘油的含量分别提升23.42%~30.78%与0.88~0.96倍;并可以在高糖环境下更好地保持细胞形态的稳定性。通过对B+MAL62菌株进行产气测试发现,高糖环境下其产气速度及最终产气量均优于出发菌株,甚至优于市售高糖酵母。本研究为进一步探究酵母的多抗性提供了重要技术参考。
[1] KO E,KIM M,PARK Y,et al.Heterologous expression of the carrot Hsp17.7 gene increased growth,cell viability,and protein solubility in transformed yeast (Saccharomyces cerevisiae) under heat,cold,acid,and osmotic stress conditions[J].Current Microbiology,2017,74(8):952-960.
[2] 时桂芹,任菲,谢冰宗,等.高糖胁迫对酿酒酵母抗氧化活性及代谢的影响[J].食品工业科技,2019,40(20):94-100.
SHI G Q,REN F,XIE B Z,et al.Effect of high-glucose condition on antioxidant activity and metabolism of Saccharomyces cerevisiae[J].Science and Technology of Food Industry,2019,40(20):94-100.
[3] 张翠英,林雪,孙溪,等.敲除MIG1同时过表达MAL62面包酵母的发酵性能[J].天津科技大学学报,2014,29(3):1-5.
ZHANG C Y,LIN X,SUN X,et al.Fermentation abilities of the recombined strain BPM-M and its overexpressing MAL62 along with deletion of MIG1[J].Journal of Tianjin University of Science & Technology, 2014,29(3):1-5.
[4] SUN X,ZHANG C Y,WU M Y,et al.MAL62 overexpression and NTH1 deletion enhance the freezing tolerance and fermentation capacity of the baker’s yeast in lean dough[J].Microbial Cell Factories,2016,15:54-61.
[5] CHENG H J,SUN Y H,CHANG H W,et al.Compatible solutes adaptive alterations in arthrobacter simplex during exposure to ethanol,and the effect of trehalose on the stress resistance and biotransformation performance[J].Bioprocess and Biosystems Engineering,2020,43(5):895-908.
[6] BELL W,SUN W N,HOHMANN S,et al.Composition and functional analysis of the Saccharomyces cerevisiae trehalose synthase complex[J].Journal of Biological Chemistry,1998,273(50):33 311-33 319.
[7] STAMBUK B U,PANEK A D,CROWE J H,et al.Expression of high-affinity trehalose-H+ symport in Saccharomyces cerevisiae[J].Biochimica Et Biophysica Acta-General Subjects,1998,1 379(1):118-128.
[8] JULES M,GUILLOU V,FRANCOIS J,et al.Two distinct pathways for trehalose assimilation in the yeast Saccharomyces cerevisiae[J].Appl Environ Microbiol,2004,70(5):2 771-2 778.
[9] KOSAR F,AKRAM NA,SADIQ M,et al.Trehalose:A key organic osmolyte effectively involved in plant abiotic stress tolerance[J].Journal of Plant Growth Regulation,2019,38(2):606-618.
[10] PANADERO J,RANDEZ-GIL F,PRIETO J A.Validation of a flour-free model dough system for throughput studies of baker’s yeast[J].Applied and Environmental Microbiology,2005,71(3):1 142-1 147.
[11] FERREIRA JC,PASCHOALIN VMF,PANEK AD,et al.Comparison of three different methods for trehalose determination in yeast extracts[J].Food Chemistry,1997,60(2):251-254.
[12] 刘青,刘朝霞,李志勇,等.国产葡萄酒中甘油含量的调查与分析[J].中国食品卫生杂志,2015,27(2):171-175.
LIU Q,LIU Z X,LI Z Y,et al.Investigation of glycerol content in domestic wines[J].Chinese Journal of Food Hygiene,2015,27(2):171-175.
[13] 张守文,张智武.国内市售面包酵母发酵特性及其适用性的研究[J].中国粮油学报,1999(6):12-18.
ZHANG S,ZHANG Z W.Fermentation characteristics and suitability of baker’s yeast on domestic market[J].Journal of the Chinese Cereals and Oils Association,1999(6):12-18.
[14] TOKASHIKI T,YAMAMOTO H,WATANABE H,et al.A functional compound contained in sugar cane molasses enhances the fermentation ability of baker's yeast in high-sugar dough[J].Journal of General and Applied Microbiology,2011,57(5):303-307.
[15] DE WINDERICKX,WINDE J H,CRAUWELS M,et al.Regulation of genes encoding subunits of the trehalose synthase complex in Saccharomyces cerevisiae:Novel variations of STRE-mediated transcription control?[J].Molecular & General Genetics,1996,252(4):470-482.
[16] MIZUSHIMA D,IWATA H,ISHIMAKI Y,et al.Two glycerol 3-phosphate dehydrogenase isogenes from Candida versatilis SN-18 play an important role in glycerol biosynthesis under osmotic stress[J].Journal of Bioscience and Bioengineering,2016,121(5):523-529.
[17] MARTINEZ-PASTOR MT,MARCHLER G,SCHULLER C,et al.The Saccharomyces cerevisiae zinc finger proteins Msn2p and Msn4p are required for transcriptional induction through the stress response element (STRE)[J].The EMBO Journal,1996,15(9):2 227-2 235.
[18] DE NADAL E,ALEPUZ PM,POSAS F.Dealing with osmostress through MAP kinase activation[J].Embo Reports,2002,3(8):735-740.
[19] SUN X,ZHANG J,FAN Z-H,et al.MAL62 Overexpression enhances freezing tolerance of baker’s yeast in lean dough by Enhancing Tps1 activity and maltose metabolism[J].Journal of Agricultural and Food Chemistry,2019,67(32):8 986-8 993.
[20] 李新,郑兆娟,岳泰稳,等.以纤维二糖为底物利用重组大肠杆菌合成海藻糖[J].食品科学,2019,40(6):180-186.
LI X,ZHENG Z J,YUE T W,et al. Biosynthesis of trehalose from cellobiose by recombinant Escherichia coli[J].Food Science,2019,40(6):180-186.
[21] 倪松,王聪,宋旭,等.高渗环境假丝酵母胞内甘油和海藻糖代谢研究[J].食品研究与开发,2016,37(5):134-136.
NI S,WANG C,SONG X,et al.Metabolism of glycerol and trehalose in the cells of Candida versatilis in hypertonic environment[J].Food Research and Development,2016,37(5):134-136.
[22] VAZQUEZ J,GRILLITSCH K,DAUM G,et al.The role of the membrane lipid composition in the oxidative stress tolerance of different wine yeasts[J].Food Microbiology,2019,78:143-154.
[23] 陆信曜,诸葛斌,宗红,等.产甘油假丝酵母HOG途径应答研究进展[J].中国科学:生命科学,2019,49(5):585-594.
LU X Y,ZHUGE B,ZONG H,et al.Advances in the HOG pathway of Candida glycerinogenes[J].Scientia Sinica (Vitae),2019,49(5):585-594.
[24] ASLANKOOHI E,REZAEI M N,VERVOORT Y,et al.Glycerol production by fermenting yeast cells is essential for optimal bread dough fermentation[J].PloS One,2015,10(3):e0 119 364.
[25] SHARMA SC.A possible role of trehalose in osmotolerance and ethanol tolerance in Saccharomyces cerevisiae[J].FEMS Microbiology Letters,1997,152(1):11-15.
[26] 赵美琳,诸葛斌,陆信曜,等.工业酵母抗逆机理研究进展[J].微生物学通报,2019,46(5):1 155-1 164.
ZHAO M L,ZHUGE B,LU X Y,et al.Research progress in stress tolerance of industrial yeasts[J].Microbiology China,2019,46(5):1 155-1 164.
[27] KAPTEYN JC,TER RIET B,VINK E,et al.Low external pH induces HOG1-dependent changes in the organization of the Saccharomyces cerevisiae cell wall[J].Mol Microbiol,2001,39(2):469-480.
[28] PANADERO J,PALLOTTI C,RODRIGUEZ-VARGAS S,et al.A downshift in temperature activates the high osmolarity glycerol (HOG) pathway,which determines freeze tolerance in Saccharomyces cerevisiae[J].Journal of Biological Chemistry,2006,281(8):4 638-4 645.
[29] HUANG L,WAN J,HUANG W,et al.Effects of glycerol on water properties and steaming performance of prefermented frozen dough[J].Journal of Cereal Science,2011,53(1):19-24.