近年来,随着消费者对健康食品的需求与日俱增,可食用聚合物在食品工业中用作乳化剂、增稠剂等相关研究也越来越多,尤其是蛋白质[1]。玉米醇溶蛋白(zein)作为玉米中重要的贮藏蛋白,由于其结构的两亲性特征[2-3],能够在溶剂极性变化下自组装形成近圆形纳米颗粒(zein nanoparticle,ZNP)[4]。但是,ZNP表面存在大量疏水性氨基酸,导致其在水溶液中容易絮凝沉淀,因此很多研究利用多糖如阿拉伯胶[5]、黄原胶[6]和果胶[7]等作为疏水性蛋白的保护层,通过静电、疏水等作用力相结合,提高亲水性从而形成稳定的乳液[4]。亚麻籽胶(flaxseed gum,FSG)是从亚麻籽壳中提取的一种亲水胶体,也是一种可溶性的膳食纤维,具有较强的营养价值[8]。不仅如此,FSG还具有多种功能性质,增稠性可以提高溶液体系稳定性,由于分子结构上结合了少量蛋白质,FSG也具有表面活性和乳化性,可稳定水包油型(oil in water,O/W)乳液[9-10]。将亚麻籽胶与醇溶蛋白结合,发挥亲水胶体优势,可显著提升乳液体系稳定性。
Pickering乳液的稳定性很大程度上决定于液滴表面固体颗粒的大小、分布、极性和微观形貌等因素,可以通过各种物理、化学和酶法等手段对其进行改性优化。已有研究表明,超声波可以通过改变乳清蛋白、牛血清蛋白和花生蛋白等动植物蛋白质的结构,进而影响蛋白质的粒径及功能性质[11-13]。然而,上述结论是建立在水溶性蛋白质的超声波处理上,鲜少有研究关于超声波对醇溶蛋白的作用,尤其是醇溶液中的玉米蛋白和小麦蛋白等。因此,拟研究超声波预处理对醇溶液中zein结构的影响,在此基础上,进一步探究不同超声波条件处理对zein与FSG复合物的稳定性的影响。
本文利用不同条件的超声波处理zein醇溶液,通过反溶剂沉淀法制备ZNP;然后,将不同处理所得的ZNP与FSG通过静电相互作用等形成蛋白-多糖复合颗粒,进一步观察超声波预处理对ZNP-FSG复合颗粒性质的影响;最后利用ZNP-FSG复合颗粒均质制备成Pickering乳液,利用显微镜观察、液滴粒径和高温实验探究超声波预处理对乳液特性的影响,为将超声波应用于Pickering乳液制备提供理论依据。
1 材料与方法
1.1 材料与试剂
玉米醇溶蛋白,上海麦克林生化科技股份有限公司;亚麻籽胶,上海源叶生物科技有限公司;金龙鱼食用植物调和油,益海嘉里食品有限公司;8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS),上海阿拉丁生化科技股份有限公司;NaOH、HCl等试剂均为分析纯。
1.2 仪器与设备
JY-IIN型超声细胞破碎仪,浙江宁波新芝仪器有限公司;Nano-ZS纳米粒度仪,英国Malvern公司;F97Pro型荧光光谱仪,上海棱光技术有限公司;CHIRASCAN型数字式圆二色光谱仪,英国Applied Photophysics公司;FJ200-SH型高速分散机,上海标本模型厂;Alpha 1-2 D Pius冷冻干燥机,德国Marin Christ公司;JSM-5610LV型高分辨扫描电子显微镜-X射线能谱仪,日本JEOL公司;IX73型倒置显微镜,日本Olympus公司。
1.3 实验方法
1.3.1 超声波预处理
称取1.0 g玉米醇溶蛋白溶于40 mL体积分数80%的乙醇溶液中,磁力搅拌器1000 r/min搅拌1 h,使其充分溶解,用离心管分装成4份,每份样品10 mL,空白组为N-zein。取样品进行超声波处理,超声仪最大功率680 W,参数设置条件分别为U1∶10%-20 min、U2∶10%-40 min、U3∶20%-20 min、U4∶30%-20 min、U5∶40%-20 min,超声探头直径6 mm,换算为功率强度分别约为U1∶230 W/cm2-20 min、U2∶230 W/cm2-40 min、U3∶460 W/cm2-20 min、U4∶690 W/cm2-20 min、U5∶920 W/cm2-20 min。超声波处理过程中,探头充分浸没于样品溶液中,并保持样品管置于冰浴中以控制样品温度低于5 ℃。超声波处理时采用工作5 s,暂停5 s的工作模式,处理完毕,放入4 ℃冰箱24 h过夜。
1.3.2 玉米醇溶蛋白纳米颗粒的制备
采用反溶剂沉淀法,按照JIANG等[14]的方法并稍作修改。将10 mL超声波处理的玉米醇溶蛋白乙醇溶液倒入碱式滴定管,将装有30 mL蒸馏水的烧杯置于超声波水浴中,开启超声波防止絮凝物出现,使滴定管中的样品逐滴滴入,直至结束。最后,进行旋转蒸发除去多余的乙醇,水浴温度为45 ℃,旋至蛋白质质量浓度为20 mg/mL,并调节溶液pH至4.0,放入4 ℃冰箱保存,备用。
1.3.3 内源荧光光谱测定
采用王中江等[15]的方法。用pH 4.0的去离子水将样品稀释至质量浓度1 mg/mL,测定条件为波长295 nm处激发,扫描范围为300~400 nm、狭缝宽度为5 nm和扫描速度为1 200 nm/min,记录发射光谱。
1.3.4 二级结构测定
参照ERICKSON等[16]的方法。采用远紫外区圆二色谱探究超声波处理对zein二级结构的影响。测定在室温(25 ℃)、持续通氮气的条件下进行,利用体积分数80%的乙醇溶液将样品稀释至质量浓度0.2 mg/mL,扫描速度为100 nm/min,扫描范围为190~260 nm,带宽1 nm,样品池光程为1 mm。使用Dicroprot软件对所收集的数据进行分析。
1.3.5 粒径和zeta电位测定
粒径测定采用JIANG等[7]的方法,采用纳米粒度仪测定ZNP和ZNP-FSG复合颗粒的粒径,测量前将所有样品用pH 4.0的去离子水稀释至质量浓度1 mg/mL。在室温(25 ℃)下测定粒径、分散性指数以及电位,。
1.3.6 ZNP-FSG复合颗粒的制备
配制质量浓度为10 mg/mL亚麻籽胶水溶液,水浴95 ℃、磁力搅拌1 h至完全溶解,调节pH至4.0,放置冰箱24 h过夜。将10 mL 质量浓度10 mg/mL的ZNP溶液与10 mL质量浓度10 mg/mL的FSG溶液等体积混合,使ZNP与FSG质量比为1∶1,15 000 r/min下高速均质2 min,混合,放入冰箱静置24 h过夜,备用。
1.3.7 表面疏水性测定
根据KATO等[17]采用ANS作为荧光探针对样品的表面疏水性进行测定。在5 mL ZNP中加入50 μL 8.0 mmol/L的ANS溶液(pH 4.0),用pH 4.0的去离子水将样品稀释成一定梯度(0.01~1 mg/mL),用荧光分光光度计在390 nm激发波长下测定样品的荧光强度,扫描范围为400~600 nm,狭缝宽度为5 nm。用线性回归分析法计算荧光强度对蛋白质质量浓度的初始斜率,作为蛋白质表面疏水性指数。
1.3.8 形貌特征观察
将样品溶液冻干成粉末,称取少量样品,冻干后的样品黏附到导电胶,然后粘到圆柱形的样品柱上。采用高分辨扫描电子显微镜对ZNP及ZNP-FSG复合颗粒微观结构进行观察。
1.3.9 Pickering乳液的制备
将ZNP-FSG复合胶体颗粒溶液与食用油按体积比1∶1混合,油水体系采用剪切分散机于18 000 r/min下剪切3 min,将形成的Pickering乳液放置于4 ℃冰箱储藏,备用。
1.3.10 液滴尺寸及形态观测
根据ZHU等[18]的方法,采用粒度分布仪测定乳液的粒径和电位。参数设置为:分散剂,水;颗粒折射率1.460;颗粒吸收率0.001;分散剂折射率1.330。采用面积平均直径d32来表征颗粒和乳液液滴粒度的大小。
显微镜观察:吸取中部位置乳液50 μL,缓慢滴入载玻片上,轻轻盖上盖玻片,防止液滴破裂,分别在4和40倍物镜下用倒置显微镜进行观察,连接显微成像系统DP80相机,使用图像采集软件CellSens standard观察液滴形态。
1.3.11 耐高温稳定性
将新鲜制备的乳液倒入统一规格的具塞玻璃管,置于80 ℃水浴30 min后,立即置于冰浴降温至室温并取出,观察乳液前后稳定性的差异,用显微镜放大4倍观察乳液液滴形态。
1.3.12 数据统计分析
实验数据采用平均值±标准偏差表示,采用统计软件SPSS 24.0对数据进行ANOVA差异显著性分析,以P<0.05为差异有统计学意义。采用Origin 2017软件进行图表处理。
2 结果与分析
2.1 超声波预处理对玉米醇溶蛋白结构的影响
2.1.1 内源荧光光谱分析
蛋白质内源荧光的特点是由蛋白质中芳香氨基酸(色氨酸和酪氨酸等)所在位置的差异决定的,有助于评价蛋白质结构的变化及特点。不同超声波预处理的玉米醇溶蛋白荧光光谱图如图1所示,醇溶液中玉米蛋白经295 nm激发后在385 nm附近出现荧光发射峰,含有高比例的乙醇溶液可能使色氨酸基团的最大吸收波长(λmax)从348 nm红移至385 nm。天然的玉米醇溶蛋白表面含有较多疏水性氨基酸,可能存在色氨酸基团,导致其荧光强度较高[19]。与未处理的N-zein组比较,超声波处理蛋白质的荧光强度均呈现一定程度地降低。研究表明,由于芳香族氨基酸特性,色氨酸残基通常被完全或部分地埋在蛋白质的疏水核心内,超声波引发的高剪切作用,使蛋白质结构变得松散,使紧紧相连的α-zein分子变得疏松,更多色氨酸开始暴露,接触极性环境导致荧光强度降低[20]。随着超声强度从U1增加至U5,处理时间延长至U2,荧光强度不断降低,说明蛋白质螺旋结构更加趋于开放。
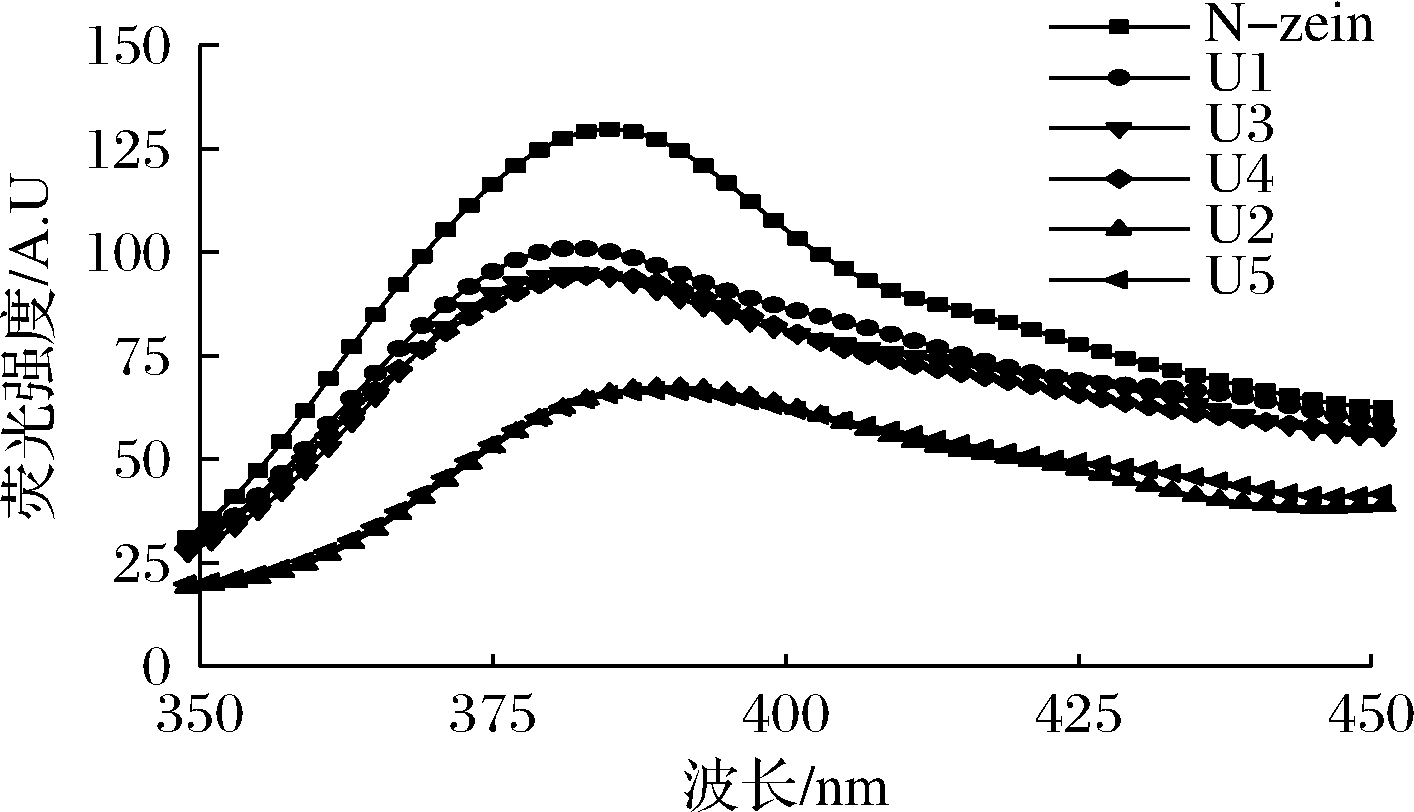
图1 不同超声条件下玉米醇溶蛋白荧光光谱
Fig.1 Fluorescence spectrum of zein under different ultrasonic conditions
由不同超声波预处理条件对玉米醇溶蛋白的最大发射峰位置的影响分析发现,U1、U3和U4处理组相较于N-zein蓝移至382 nm,适宜的超声强度和处理时间促使蛋白质结构中的色氨酸基团向内部疏水区域转移。相反,U2和U5处理组的最大发射波长红移至390 nm处,且荧光强度相近。对比超声功率与超声时间的影响发现,超声时间的延长(U2∶230 W/cm2-40 min)较功率增加(U3和U4)影响程度更大,可显著降低荧光强度,与超声条件为 U5∶920 W/cm2-20 min时相当,最大荧光强度达到最低水平(66.5)。发射峰红移的原因可能是由色氨酸周围的空间环境结构发生变化,长时间和高强度的超声波使芳香族氨基酸侧链暴露在蛋白质的表面,其周围的溶液极性升高,对结构产生了不利的影响。MATSUSHMIA等[21]发现,α-zein在体积分数70%的乙醇水溶液中呈带状,由10个左右相邻的螺旋柱体结构反向平行排列构成,两端通过谷氨酰胺与前后2个螺旋连接。而长时间和较高强度的超声波处理使两两相邻螺旋距离变大,空间结构变得更加开放。
2.1.2 圆二色光谱分析
圆二色光谱是用于评估蛋白质二级结构的常用技术手段之一,用于探究超声处理对乙醇溶液中的玉米醇溶蛋白二级结构的影响。图2显示了N-zein与超声处理组在190~260 nm的远紫外圆二色光谱。所有zein处理组的圆二光谱在193 nm附近具有正峰,在202 nm处与零线相交,同时2个负峰在209和224 nm处出现,这表明无论超声与否,zein都是典型的富含α-螺旋结构的蛋白质,此结果与之前的研究一致[22]。根据α-螺旋、β-折叠和无规则卷曲结构的光谱数据,计算N-zein和超声处理组的圆二色光谱的不同结构的占比,并进行蛋白质二级结构分析。表1展示了不同超声条件下蛋白质二级结构的含量,经数据分析,N-zein的二级结构组成分别为45.5% α-螺旋、12% β-折叠、9.5%β-转角和35.4%的无规则卷曲,这一结果与先前SELLING等[23]和ERICKSON等[16]研究结果一致,在体积分数80%的乙醇水溶液中,zein的α-螺旋含量在33.6%~60%,表明zein在醇水溶液中具有球状结构。

图2 不同超声处理对玉米醇溶蛋白二级结构含量的影响
Fig.2 Effect of different ultrasonic treatment on the secondary structure content of zein
表1 不同超声条件下玉米醇溶蛋白二级结构的相对含量 单位:%
Table 1 Relative content of zein secondary structure under different ultrasonic conditions
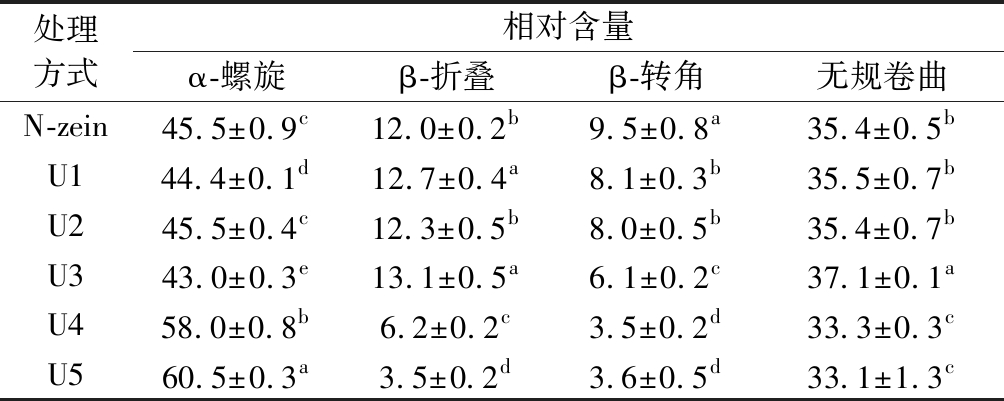
处理方式相对含量α-螺旋β-折叠β-转角无规卷曲N-zein45.5±0.9c12.0±0.2b9.5±0.8a35.4±0.5bU144.4±0.1d12.7±0.4a8.1±0.3b35.5±0.7bU245.5±0.4c12.3±0.5b8.0±0.5b35.4±0.7bU343.0±0.3e13.1±0.5a6.1±0.2c37.1±0.1aU458.0±0.8b6.2±0.2c3.5±0.2d33.3±0.3cU560.5±0.3a3.5±0.2d3.6±0.5d33.1±1.3c
注:上标不同字母表示不同样品具有差异显著性(P<0.05)(下同)
如图2和表1所示,当超声强度较低时(U1~U3),图中曲线与对照组相比变化并不明显,结构含量变化并不显著,表明低强度的超声波对zein的二级结构含量影响较小。值得注意的是,当超声强度达到U4时,208和224 nm处的2个负峰强度上升,表明α-螺旋结构含量增加,由45.0%分别增加至58.0%和60.5%;同时,216 nm处的负峰强度也上升,这些现象表明,高强度超声波导致β-折叠和β-转角结构含量显著降低,由数据分析可得,β-折叠从12.0%降低到3.5%,β-转角含量也降低至3.6%,β-折叠含量的减少会降低蛋白质的柔韧性和扩展性,使zein分子结构更加具有刚性[24-25];然而超声波预处理对于zein结构中的无规则结构含量,作用不大。这些现象与REN等[22]的结果有所不同,其超声波处理的zein三种结构含量均无明显变化,可能是因为其超声处理时的溶剂为水溶液,醇溶蛋白无法溶于水,导致超声波无法影响其二级结构含量。
玉米醇溶蛋白二级结构含量的变化将会影响其自组装的过程,由于自组装主要是由zein受到溶剂极性的变化影响,其中α-螺旋结构自发变成β-折叠进行排列,后续多个长带状的zein进行卷曲形成球形纳米颗粒[26]。因此,猜测当超声波引起α-螺旋结构含量增加、β-折叠含量减少时,其形成纳米颗粒的过程将会变慢,进而导致ZNP的粒径受到影响。
2.1.3 粒径及zeta电位
不同超声波预处理对反溶剂法制备的ZNP溶液(pH 4.0)粒径分布影响情况如图3所示。可以发现经不同超声波处理的ZNP粒径分布均向左偏移,而且粒径分布的宽度明显变窄,这说明超声波预处理使ZNP颗粒大小更为集中。其中经U1、U3超声波处理的ZNP平均粒径降低,但它的曲线宽度却没有变窄,分布甚至更加广泛。
不同超声条件下ZNP的平均粒径、峰值粒径、分散性指数和电位如表2所示。分散性指数(polydispersity index,PDI)通常用来反映颗粒的粒径分布程度。发现超声强度为U1时(230 W/cm2-20 min),PDI增加,且显著高于对照组,低强度超声波虽然可以降低平均粒径,但是对粒径分布的集中均匀性没有贡献,甚至会使分布更加分散。随着超声时间增加(U2),PDI降低,与对照组相比,颗粒变得更加均匀,说明相同超声密度,延长超声时间有利于PDI的降低,即有利于颗粒分布更加集中。而当超声强度增加至460 W/cm2-20 min时,与U1条件具有相似的结果。当超声强度进一步升高到达U4、U5时,PDI又继续降低,证明了一定强度的超声波可以促进玉米醇溶蛋白纳米颗粒大小的均匀性,由此可以说明超声波处理过程的超声密度、超声时间对颗粒均匀性有显著的影响。这与REN等[22]的研究结果一致。
胶体颗粒溶液的稳定性主要取决于颗粒的粒度和表面所带电荷量,粒径小和电量高的颗粒溶液体系相对稳定。当zeta电位绝对值大于30 mV,胶体粒子可以借助其排斥静电力来稳定乳液[29-30]。N-ZNP在溶液pH为4.0时,低于其等电点6.2,表面带有正电荷,电位值为+26.4 mV。N-ZNP的zeta电位小于30 mV,说明溶液体系是不够稳定的,容易产生沉淀。超声波预处理使ZNP的电位绝对值显著增加且均高于30 mV,也就是说对zein进行不同超声波处理均能够提高ZNP的溶液稳定性。相较于其他组,zein经U3预处理所形成的ZNP的zeta电位达到最高值(+40.9 mV),此时的溶液稳定性最好。然后进一步增加超声强度(U4、U5),ZNP的zeta电位逐渐降低,由此可以得出,并非超声波强度越大ZNP溶液越稳定。上述结果表明,超声波预处理可以使ZNP粒径降低并增加zeta电位绝对值,但其影响程度与影响规律受超声强度和超声时间影响。因此,为寻求最有利于ZNP在乳液稳定方面表现出更好性能的超声条件,需要进一步分析。
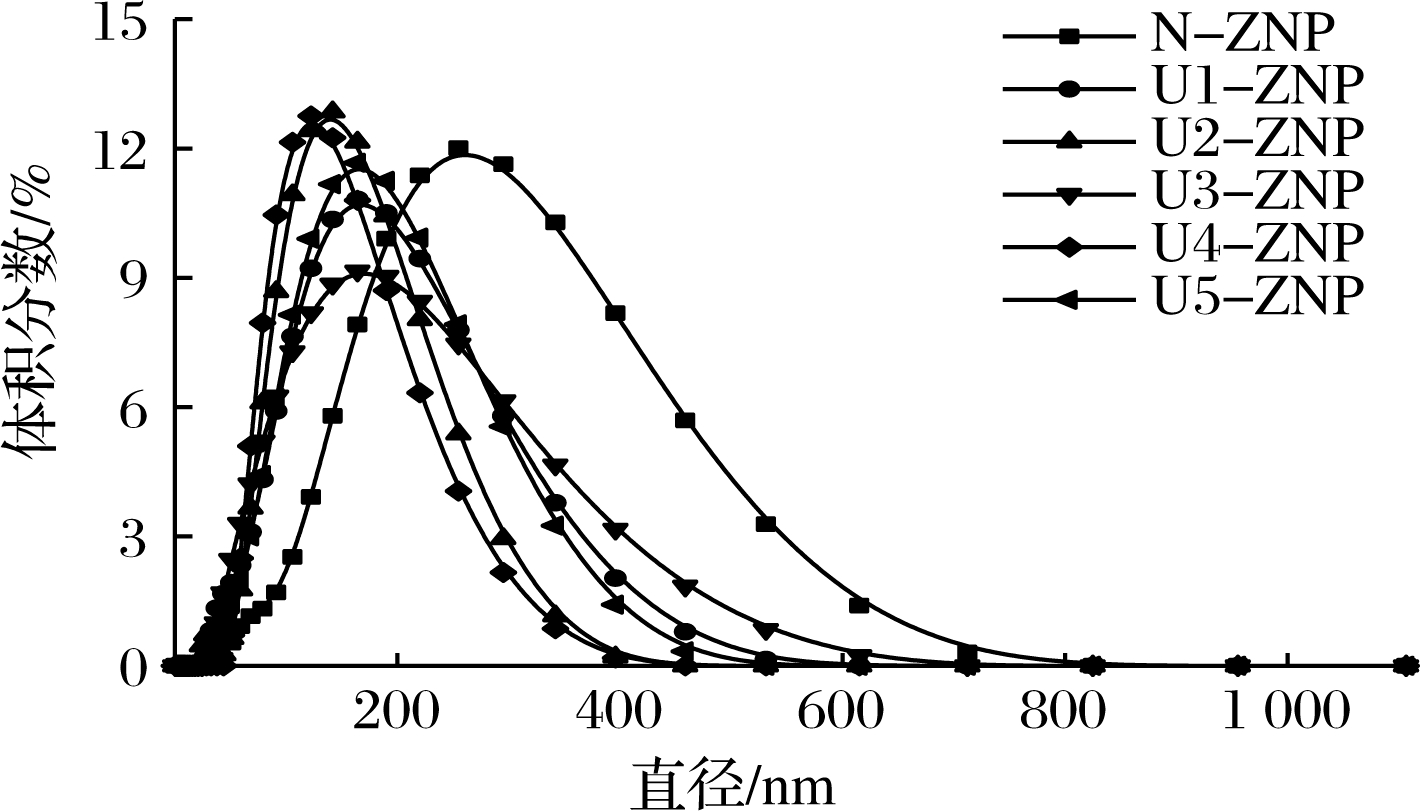
图3 不同超声条件下玉米醇溶蛋白粒径及分布
Fig.3 Size distribution of zein under different ultrasonic conditions
表2 不同超声条件下玉米醇溶蛋白粒径、分散性指数及电位
Table 2 Size PDI and potential of zein under different ultrasonic conditions
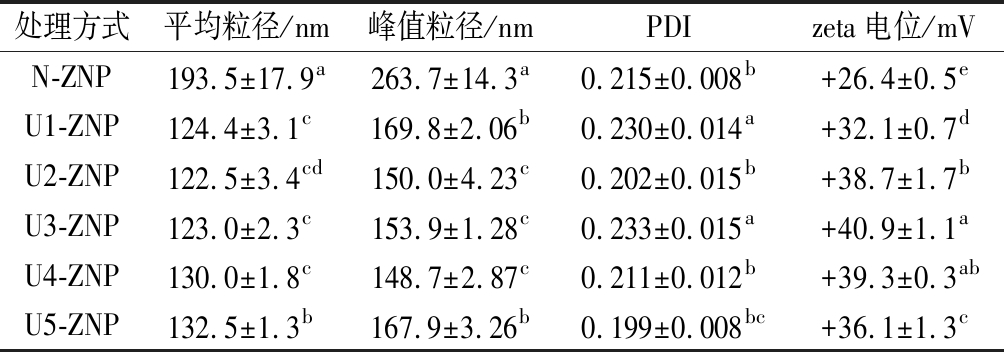
处理方式平均粒径/nm峰值粒径/nm PDIzeta电位/mVN-ZNP193.5±17.9a263.7±14.3a0.215±0.008b+26.4±0.5eU1-ZNP124.4±3.1c169.8±2.06b0.230±0.014a+32.1±0.7dU2-ZNP122.5±3.4cd150.0±4.23c0.202±0.015b+38.7±1.7bU3-ZNP123.0±2.3c153.9±1.28c0.233±0.015a+40.9±1.1aU4-ZNP130.0±1.8c148.7±2.87c0.211±0.012b+39.3±0.3ab U5-ZNP132.5±1.3b 167.9±3.26b0.199±0.008bc+36.1±1.3c
2.2 超声波预处理对ZNP-FSG复合颗粒微观形态和特性的影响
2.2.1 扫描电镜观察
ZNP与ZNP-FSG复合颗粒样品微观结构采用扫描电镜(scanning electron microscope,SEM)分别在放大倍数为1 000和8 000倍的条件下进行观察,结果如图4所示。ZNP在冻干后整体呈现片状,结构紧密(图4-a)。由于ZNP的粒径较小,且机器放大倍数有限,放大至8 000倍时无法清晰呈现ZNP的球状结构。随着FSG的加入,ZNP-FSG复合颗粒冻干后整体呈细纤维状,彼此交联形成网络结构(图4-b)。当放大至8 000倍时可观察到ZNP被包裹在FSG的内部显现出圆形颗粒,说明FSG附着在ZNP的表面使粒径变大,FSG的不平整性导致形成了粗糙的ZNP-FSG复合颗粒(图4-c)。
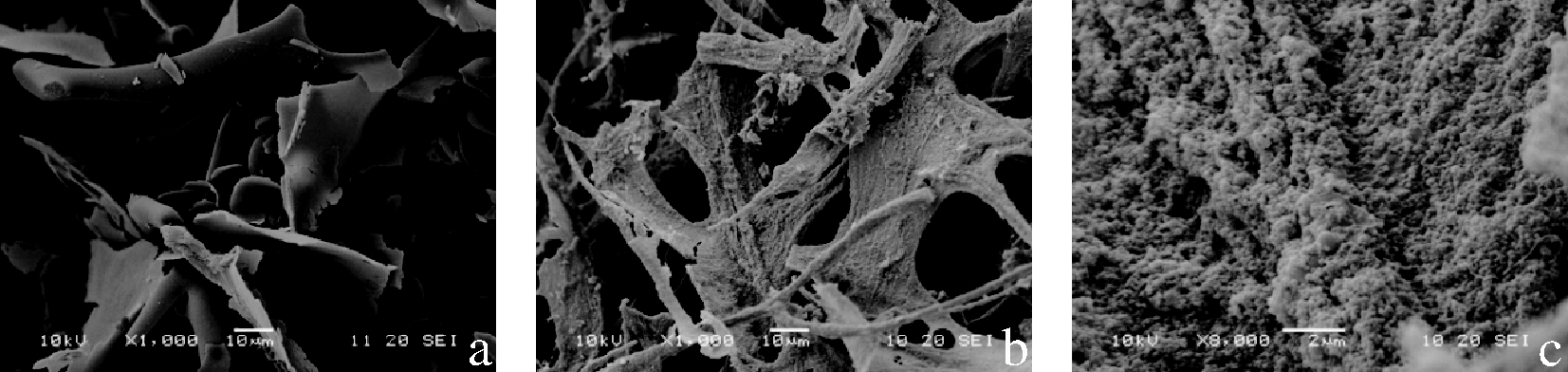
a-N-ZNP(×1 000);b-N-ZNP-FSG(×1 000);c-N-ZNP-FSG(×8 000)
图4 玉米醇溶蛋白纳米颗粒与玉米醇溶蛋白-亚麻胶 复合颗粒的SEM图
Fig.4 SEM of ZNP and ZNP-FSG composite particles
2.2.2 表面疏水性分析
当不同超声波预处理的质量浓度10 mg/mL的ZNP溶液加入等量的质量浓度10 mg/mL的FSG溶液后,与未添加FSG的N-ZNP相比,U1组的表面疏水性没有发生显著变化,推测其原因可能是FSG主要通过静电相互作用与ZNP结合,同时这2组ZNP电位值较低导致吸附的FSG数目较少,ZNP表面的疏水残基并未受到影响。进一步增加超声强度(U3∶460 W/cm2-20 min)和延长超声时间(U2∶230 W/cm2-40 min),ZNP的表面疏水性显著性增强,两者之间没有显著性差异。进一步对比发现,经更高强度的超声波处理后(U4、U5),ZNP的表面疏水性略低于处理条件为U2、U3时的表面疏水性。另外,对比发现,虽然超声波预处理可以增加ZNP的表面疏水性,但是添加FSG形成ZNP-FSG复合颗粒后,其表面疏水性显著下降,且不同超声波预处理对复合颗粒的表面疏水性没有显著性影响。ZOU等[31]发现随着亲水性单宁酸的加入,ZNP表面疏水性显著降低。推测ZNP表面疏水性显著降低是由于其表面结合的FSG增加,但是FSG的加入是否同时遮蔽了原本由于超声波预处理引起的ZNP的结构变化所带来的影响,还需测量尺寸和电位来进一步确定其组间差异。
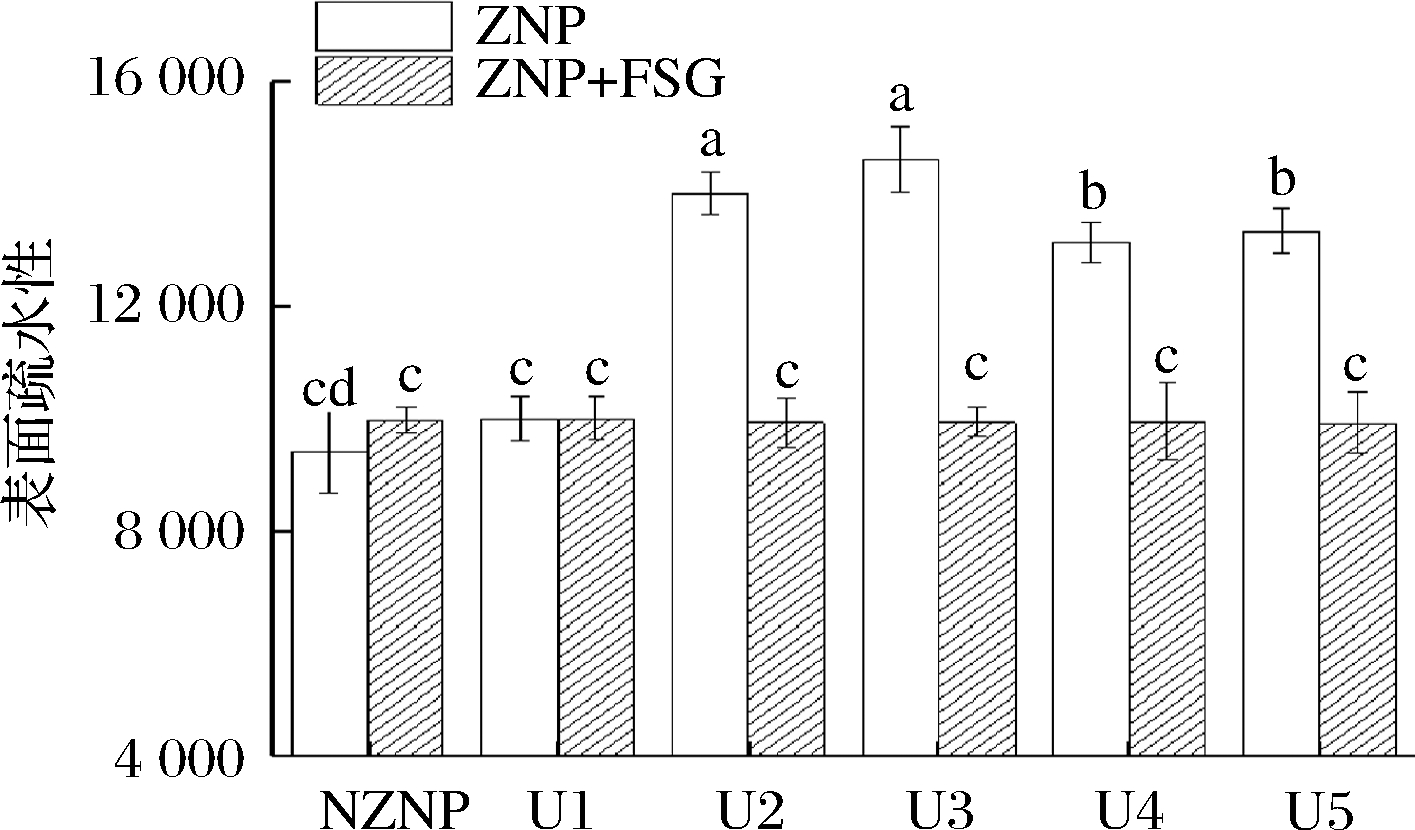
图5 不同超声条件下玉米醇溶蛋白纳米颗粒与玉米醇溶 蛋白-亚麻胶复合颗粒的表面疏水性
Fig.5 Surface hydrophobicity of ZNP and ZNP-FSG composite particles dispersion under different ultrasonic conditions
2.2.3 粒径及zeta电位
不同超声条件下ZNP-FSG复合颗粒的粒径及分布如图6所示,由于前处理过程中FSG溶液pH调节至4.0,可能导致FSG部分大分子裂解成较小的片断无法与ZNP结合,所有实验组都出现双峰,分散性较差[32]。多糖的加入使ZNP粒径增大,U4和U5粒径增加的程度较弱,紧接着是U1和U2,U3处理组的粒径最大且分布较广泛,这一趋势验证了表面疏水性的结果。已有研究证明,zein与亲水性多糖通过非共价相互作用:静电、疏水与氢键作用生成复合颗粒[33-34]。表3列出了不同超声条件预处理后的zein制备的ZNP-FSG复合颗粒的粒径和zeta电位。由于与FSG的络合,颗粒粒径从193.5 nm增加到672 nm。ZNP被包裹后颗粒尺寸的增加可能部分是由于玉米蛋白和亚麻籽胶形成复合物,也有可能是因为多糖之间相互聚集所导致的[35]。与对照组相比,超声处理组的复合颗粒粒径显著升高,从672 nm升至最高1 366 nm,证明更多的FSG成功附着在蛋白质表面;不同超声处理组之间的粒径存在明显差距,代表其表面的多糖数量存在显著差异。
由于ZNP与FSG在pH 4.0的水溶液里带有正负2种电荷,当它们均匀分布在溶液中时,正负相吸而结合。静电相互作用在蛋白质和阴离子多糖的形成复合物过程中及其稳定性程度起重要作用,决定其稳定性,并且,外部胶层决定着复合物颗粒的整体电荷特征[36]。无FSG包覆的天然ZNP的电位是+26.4 mV,经FSG包覆后电位变成负电荷,证明两者主要由静电相互作用形成具有较大粒径的复合物,此结论可以通过表3的粒径变化趋势得到验证。在超声波预处理条件为U1时,ZNP-FSG复合颗粒的电位显著降低至-36.9 mV,代表有部分多糖包裹在蛋白质表面,中和本身带有的正电荷。随着超声处理强度增加,电位绝对值不断升高。结合分析表2中超声预波处理后ZNP所带电荷数值,可以得出,ZNP所带正电荷越多,结合阴离子多糖的能力越强,更多的负电荷亚麻籽胶包裹在表面,导致ZNP-FSG复合粒子表面负电荷量越高。由表3可知,超声波预处理条件为U3时,ZNP在结合多糖后,其负电荷绝对值最高,达到40.6 mV。蛋白表面正电荷越高,结合FSG的能力就越强,同时也解释了前文中ZNP-FSG复合粒子粒径变化的可能原因。
综上所述,针对不同超声波条件下,ZNP-FSG复合颗粒的粒径和电位的变化趋势,发现超声波预处理对zein的结构影响可以直接影响到ZNP和ZNP-FSG复合颗粒的结构、构象与颗粒大小,且变化趋势与超声波的超声时间和超声密度相关。证明超声波预处理促进更多FSG附着在ZNP的表面,FSG作为亲水性多糖可以进一步增加疏水性蛋白的表面亲水性,使得ZNP-FSG复合颗粒同时拥有亲水性蛋白质和胶体稳定性的特征,复合颗粒的理化性质对Pickering乳液的液滴粒径分布及体系稳定性有着重要的意义。
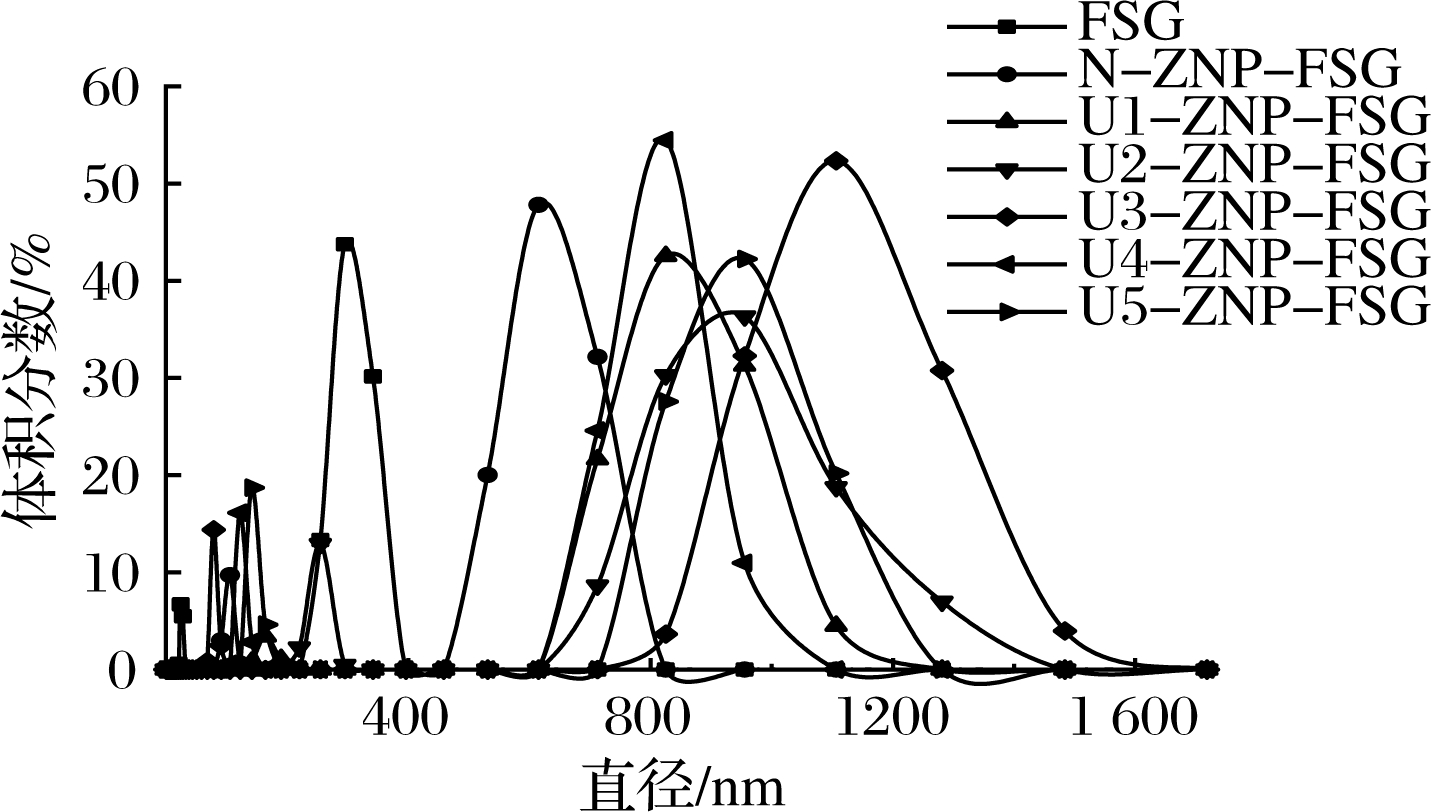
图6 不同超声条件下玉米醇溶蛋白-亚麻胶 复合颗粒的粒径及分布
Fig.6 Size and distribution of ZNP-FSG composite particles under different ultrasonic conditions
表3 不同超声条件下玉米醇溶蛋白-亚麻胶 复合颗粒粒径及电位
Table 3 Size and potential of ZNP-FSG composite particles under different ultrasonic conditions
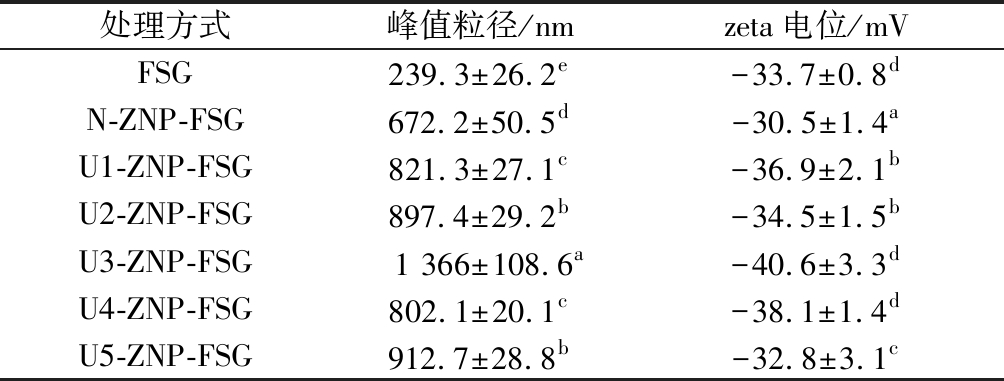
处理方式峰值粒径/nmzeta电位/mVFSG239.3±26.2e-33.7±0.8dN-ZNP-FSG672.2±50.5d-30.5±1.4aU1-ZNP-FSG821.3±27.1c-36.9±2.1bU2-ZNP-FSG897.4±29.2b-34.5±1.5bU3-ZNP-FSG1 366±108.6a-40.6±3.3dU4-ZNP-FSG802.1±20.1c-38.1±1.4dU5-ZNP-FSG912.7±28.8b-32.8±3.1c
2.3 乳液性质及稳定性
2.3.1 乳液外观及显微镜观察
图7-a展示了由水相与油相按体积比1∶1均质制备的乳液,可以观察到除了N-ZNP,其他组均未出现分层现象,说明FSG在稳定乳液方面较强,与文献报道一致[37]。质量浓度为5 mg/mL的N-ZNP稳定的乳液分层最严重,且底物出现絮凝物,由于玉米醇溶蛋白具有较强的疏水性,无法包裹油滴,只是单纯与食用油混合。从每组乳液中间吸取一滴至载玻片上如图7-b所示,液滴的外观进一步展示了乳液的微观特点,FSG组的液滴中间为乳液的形态,而周围一圈呈现接近于透明的状态;N-ZNP的液滴几乎由油状物构成,掺杂着些许蛋白质絮凝物;其他组的液滴都较为完整呈现乳白色,较为稳定。
乳液液滴放大4倍和40倍的光学显微镜图(图8)与液滴状态描述的相一致,虽然FSG可以包裹油滴,但仍然有大量流动液体存在于液滴周围,乳液状态处在不稳定的边缘;N-ZNP的显微镜图中看不见任何液滴形态,食用油中漂浮着少许蛋白絮凝物;未经超声复合颗粒组(N-ZNP-FSG)与超声波预处理组(U-ZNP-FSG)复合颗粒制备的乳液都呈现完整视野的液滴,液滴大小较为集中,状态良好,N-ZNP-FSG由于液滴尺寸较大,被盖玻片挤压轻微变形,且液滴分布较为松散。同时,与对照组相比,超声组波的液滴尺寸更小,尤其是U2和U3组,形状呈近圆形分布紧密,且尺寸大小较为集中。由倒置显微镜放大40倍后,发现不同超声波预处理组间ZNP-FSG液滴大小有所差异,对照组、U1和U5组存在肉眼可见较大的液滴,U2和U3的状态和尺寸相近,液滴比较密集,出现层次感。这说明经过一定条件的超声波预处理的zein形成的ZNP-FSG乳液拥有较小的颗粒、较强的稳定性,具体尺寸分布仍需进一步测量分析。

a-Pickering乳液;b-液滴
图7 ZNP-FSG复合颗粒制备的Pickering乳液及液滴
Fig.7 Visual observations of Pickering emulsion and droplets stabilized by ZNP-FSG composite particles

a-液滴放大4倍视野;b-液滴放大40倍视野
图8 ZNP-FSG复合颗粒制备的Pickering乳液照片 和光学显微镜图
Fig.8 Optical micrographs of Pickering emulsion stabilized by ZNP-FSG composite particles
2.3.2 液滴尺寸及分布
Pickering乳液的稳定性很大程度上决定于蛋白质颗粒的大小、分布、极性、微观形貌等。前期研究发现,不同超声波预处理形成的ZNP、ZNP-FSG复合颗粒的粒径和表面电位等存在巨大差异(表3),进而影响乳液的稳定性。不同超声条件处理的复合颗粒对乳液液滴尺寸如图9所示。随着超声处理的加入(U1),所制备乳液的粒径显著减小,液滴粒径从原来的76.8 μm降低至最35.8 μm左右,N-ZNP-FSG制备>的乳液液滴具有最大尺寸,其分布的峰较宽,与显微镜放大观察到的现象一致。超声波预处理组的ZNP-FSG粒径分布变化趋势与ZNP粒径相似,均在U3-ZNP-FSG时获得最小尺寸以及分布最集中。由此可以说明,在超声条件为U3∶460 W/cm2-20 min时,ZNP包裹的FSG亲水层较稳定,乳化性最强。WAN等[38]的研究表明,由SPI制备的乳液液滴越小其物理稳定性越强,因此可以推测出超声处理组拥有较强的稳定性,不易出现分层。
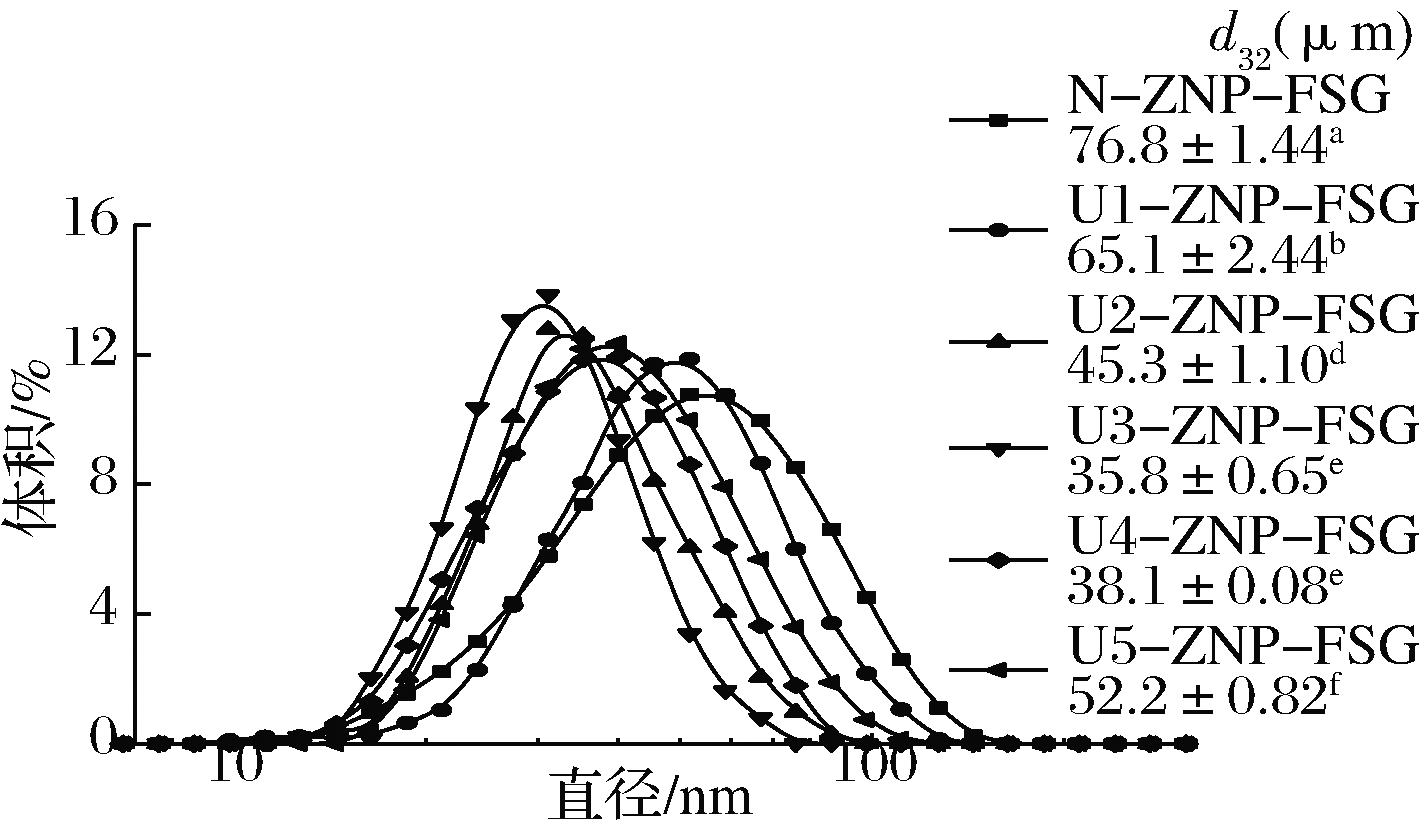
图9 不同超声波预处理下的ZNP-FSG复合颗粒 制备乳液液滴粒径分布
Fig.9 Droplets size distribution of the Pickering emulsion made by ZNP-FSG composite particles under various ultrasonic treatment
此外,由于单独FSG和ZNP稳定乳液中的油相已经大部分释放,极其不稳定,所以不适合测量尺寸。分析其原因可能是ZNP对照组蛋白颗粒上的亲水性多糖数量较低,亲水面积较少无法包裹小油滴,导致油滴易发生聚集,粒径较大。超声波预处理增加了zein表面电荷绝对值,尤其是适宜超声强度和时间下(U3),ZNP-FSG复合物亲水面积显著增大,乳液滴粒径减小,更加均一。与此同时,亚麻籽胶的黏稠性可以有效增加Pickering乳液连续相的黏度,有利于阻碍液滴间的碰撞和聚并,也阻止油滴的上浮或者水滴的沉降,延缓分层速度,增强了乳液的稳定性。
2.3.3 耐高温稳定性
高温环境可以加速乳液失稳,有利于短期内观察复合物以及乳液的稳定性。热处理可能会迫使蛋白质分子展开并暴露被埋藏的疏水基团,导致蛋白质与多糖之间发生反应并进一步形成复合物[18]。本文研究了在不添加任何物质的情况下,热处理(80 ℃ 30 min)对Pickering乳液稳定性的影响,如图10-a所示。在相对较高的温度处理之后,将所有样品倒置后仅FSG和N-ZNP组可以完全流动,其他组已经呈现凝胶状态,这说明了ZNP-FSG复合颗粒经高温处理后形成凝胶颗粒,使乳液流动性变差。

a-Pickering乳液正置与倒置;b-液滴放大4倍视野
图10 80 ℃水浴30 min之后乳液照片和光学显微图
Fig.10 Visual observations and optical micrographs of emulsion after 80 ℃ water bath for 30 min
如图10-b所示,对照组的乳液发生了显著的变化,尤其由N-ZNP制备的乳液,经加热后,油相与水相完全分离,蛋白质析出并漂浮在油相之中。同时,FSG的液滴直径变大,油相析出。这种现象证明了醇溶蛋白的疏水性对于乳液体系是极其不利的,而FSG属于大分子乳化剂,虽然同时具乳化能力和增稠性能,但是受到高温影响后,原先稳定在油滴表面的部分FSG大分子容易脱落,导致乳液失稳,与陈海华[9]的研究结果一致。观察ZNP-FSG复合颗粒制备的乳液,对比加热前后显微镜下液滴的大小及分布,发现高温处理后乳液液滴分布变得疏松,并且液滴尺寸有了一定增长,但大部分乳液,尤其是U3组,还保持着均一、较小的液滴,拥有较强稳定性,说明了一定强度超声波预处理后,ZNP-FSG复合颗粒制备的乳液拥有抵抗高温的物理稳定性。
3 结论
经过超声波预处理的zein结构发生了显著的变化,尤其是高强度超声增加了α-螺旋结构的含量,同时使更多疏水性氨基酸暴露。超声波预处理引起的zein的结构变化也使得反溶剂沉淀制备ZNP的过程受到影响,即适当的超声波预处理条件可以显著降低ZNP的平均粒径、峰值粒径,并增加电位绝对值,显著提升体系稳定性。超声波预处理进而影响了ZNP与FSG通过静电相互作用形成的复合颗粒。超声预处理促进了ZNP表面电位的升高,从而使得ZNP结合更多的FSG,导致复合颗粒的粒径增大、电位绝对值增加,复合颗粒的亲水性增加。最后经过热稳定性分析结果,发现利用ZNP-FSG复合颗粒制备的乳液无分层析水现象,尤其U3下的液滴形态几乎无变化,将其作为乳液稳定剂应用于需高温处理的食品加工过程中,能够有效地抵御液滴的聚集及破裂。总之,超声波处理提供了一种提高Pickering粒子亲水性以及稳定性,尤其是热稳定性的物理改性方法。
[1] REDDY N,YANG Y Q.Potential of plant proteins for medical applications[J].Trends in Biotechnology,2011,29(10):490-498.
[2] EVANS C D,MANLEY R H.Ternary solvents for zein[J].Industrial and Engineering Chemistry Research,1944,36(5):408-410.
[3] KASAAI M R.Zein and zein-based nano-materials for food and nutrition applications:A review[J].Trends in Food Science and Technology,2018,79:184-197.
[4] DE FOLTER J W J,VAN RUIJVEN M W M,VELIKOV K P.Oil-in-water pickering emulsions stabilized by colloidal particles from the water-insoluble protein zein[J].Soft Matter,2012,8(25):6 807-6 815.
[5] WU W,KONG X,ZHANG C,et al.Improving the stability of wheat gliadin nanoparticles-effect of gum arabic addition[J].Food Hydrocolloids,2018,80:78-87.
[6] FU D W,DENG S M,MCCLEMENTS D J,et al.Encapsulation of β-carotene in wheat gluten nanoparticle-xanthan gum-stabilized pickering emulsions:Enhancement of carotenoid stability and bioaccessibility[J].Food Hydrocolloids,2019,89:80-89.
[7] JIANG Y,WANG D,LI F,et al.Cinnamon essential oil pickering emulsion stabilized by zein-pectin composite nanoparticles:characterization,antimicrobial effect and advantages in storage application[J].International Journal of Biological Macromolecules,2020,148:1 280-1 289.
[8] LUO J M,LI Y T,MAI Y S,et al.Flaxseed gum reduces body weight by regulating gut microbiota[J].Journal of Functional Foods,2018,47:321-341.
[9] 陈海华. 亚麻籽胶的功能性质、结构及其应用[D].无锡:江南大学,2005.
CHEN H H.Functional properties,structure and application of flaxseed gum[D].Wuxi:Jiangnan University,2005.
[10] PHAM L B,WANG B,ZISU B,et al.Microencapsulation of flaxseed oil using polyphenol-adducted flaxseed protein isolate-flaxseed gum complex coacervates[J].Food Hydrocolloids,2020,107:105 944.
[11] O’SULLIVAN J,MURRAY B,FLYNN C,et al.The effect of ultrasound treatment on the structural,physical and emulsifying properties of animal and vegetable proteins[J].Food Hydrocolloids,2016,53:141-154.
[12] SUN Y J,CHEN J H,ZHANG S W,et al.Effect of power ultrasound pre-treatment on the physical and functional properties of reconstituted milk protein concentrate[J].Journal of Food Engineering,2014,124(4):11-18.
[13] GÜLSEREN  ,GÜZEY D,BRUCE B D,et al.Structural and functional changes in ultrasonicated bovine serum albumin solutions[J].Ultrasonics Sonochemistry,2007,14(2):173-183.
,GÜZEY D,BRUCE B D,et al.Structural and functional changes in ultrasonicated bovine serum albumin solutions[J].Ultrasonics Sonochemistry,2007,14(2):173-183.
[14] JIANG Y,ZHANG C,YUAN J H,et al.Effects of pectin polydispersity on zein/pectin composite nanoparticles (zaps) as high internal-phase pickering emulsion stabilizers[J].Carbohydrate Polymers,2019,219:77-86.
[15] 王中江, 江连洲,魏冬旭,等.pH值对大豆分离蛋白构象及表面疏水性的影响[J].食品科学,2012,33(11):47-51.
WANG Z J,JIANG L Z,WEI D X,et al.Effect of pH on conformation and surface hydrophobicity of soybean protein isolate[J].Food Science,2012,33(11):47-51.
[16] ERICKSON D P,OZTURK O K,SELLING G,et al.Corn zein undergoes conformational changes to higher beta-sheet content during its self-assembly in an increasingly hydrophilic solvent[J].International Journal of Biological Macromolecules,2020,157:232-239.
[17] KATO A,NAKAI S.Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J].Biochim Biophys Acta,1980,624(1):13-20.
[18] ZHU Y Q,MCCLEMENTS D J,ZHOU W,et al.Influence of ionic strength and thermal pretreatment on the freeze-thaw stability of pickering emulsion gels[J].Food Chemistry,2020,303:125 401.
[19] JIN J,MA H L,WANG K,et al.Effects of multi-frequency power ultrasound on the enzymolysis and structural characteristics of corn gluten meal[J].Ultrasonics Sonochemistry,2015,24:55-64.
[20] MOMANY F A,SESSA D J,LAWTON J W,et al.Structural characterization of α-zein[J].Journal of Agricultural and Food Chemistry,2006,54(2):543-547.
[21] MATSUSHIMA N,DANNO G I,TAKEZAWA H,et al.Three-dimensional structure of maize α-zein proteins studied by small-angle x-ray scattering[J].Biochim Biophys Acta,1997,1 339(1):14-22.
[22] REN X F,WEI X,MA H,et al..Effects of a dual-frequency frequency-sweeping ultrasound treatment on the properties and structure of the zein protein[J].Cereal Chemistry Journal,2015,92(2):193-197.
[23] SELLING G W,HAMAKER S A H,SESSA D J.Effect of solvent and temperature on secondary and tertiary structure of zein by circular dichroism[J].Cereal Chemistry,2007,84(3):265-270.
[24] 康雪帆, 李海明,陈丹洁,等.糖接枝玉米醇溶蛋白包埋虾青素[J].食品科学,2018,39(7):168-173.
KANG X F,LI H M,CHEN D J,et al.Encapsulation of astaxanthin in zein-saccharide graft reaction products[J].Food Science,2018,39(7):168-173.
[25] 李晨. 基于糖基化反应的花生蛋白成膜性及其风味缓释效应的研究[D].无锡:江南大学,2015.
LI C.Study of physiochemical properties and flavor controlled release of peanut protein isolate-polysaccharides films crosslinked by glycation reaction[D].Wuxi:Jiangnan University,2015.
[26] WANG Y,PADUA G W.Nanoscale characterization of zein self-assembly[J].Langmuir,2012,28(5):2 429-2 435.
[27] FABRA M J,LOPEZ-RUBIO A,LAGARON J M.High barrier polyhydroxyalcanoate food packaging film by means of nanostructured electrospun interlayers of zein[J].Food Hydrocolloids,2013,32(1):106-114.
[28] LIANG Q,REN X F,ZHANG X,et al.Effect of ultrasound on the preparation of resveratrol-loaded zein particles[J].Journal of Food Engineering,2018,221:88-94.
[29] WANG L,ZHANG Y.Eugenol nanoemulsion stabilized with zein and sodium caseinate by self-assembly[J].Journal of Agricultural and Food Chemistry,2017,65(14):2 990-2 998.
[30] FREITAS C,MÜLLER R H.Effect of light and temperature on zeta potential and physical stability in solid lipid nanoparticle (slntm) dispersions[J].International Journal of Pharmaceutics,1998,168(2):221-229.
[31] ZOU Y,VAN BAALEN C,YANG X,et al.Tuning hydrophobicity of zein nanoparticles to control rheological behavior of pickering emulsions[J].Food Hydrocolloids,2018,80:130-140.
[32] WANG M,FENG M Q,JIA K,et al.Effects of flaxseed gum concentrations and pH values on the stability of oil-in-water emulsions[J].Food Hydrocolloids,2017,67:54-62.
[33] WANG L J,HU Y Q,YIN S W,et al.Fabrication and characterization of antioxidant Pickering emulsions stabilized by zein/chitosan complex particles (ZCP)[J].Journal of Agricultural and Food Chemistry,2015,63(9):2 514-2 524.
[34] SOLTANI S,MADADLOU A.Two-step sequential cross-linking of sugar beet pectin for transforming zein nanoparticle-based Pickering emulsions to emulgels[J].Carbohydrate Polymers,2016,136:738-743.
[35] REN X F,HOU T,LIANG Q F,et al.Effects of frequency ultrasound on the properties of zein-chitosan complex coacervation for resveratrol encapsulation[J].Food Chemistry,2019,279:223-230.
[36] 孙翠霞. 基于玉米醇溶蛋白的复合胶体颗粒制备、表征及其应用[D].北京:中国农业大学,2018.
SUN C X.Fabrication,characterization and application of zein-based composite colloidal particles[D].Beijing:China Agricultural University,2018.
[37] KAUSHIK P,DOWLING K,ADHIKARI R,et al.Effect of extraction temperature on composition,structure and functional properties of flaxseed gum[J].Food Chemistry,2017,215:333-340.
[38] WAN Z L,WANG L Y,WANG J M, et al.Synergistic interfacial properties of soy protein-stevioside mixtures:relationship to emulsion stability[J].Food Hydrocolloids,2014,39:127-135.